水包油(oil-in-water,O/W)乳液具有封装、输送和释放生物活性成分并提高其生物可及度等功能,常用于食品和医药领域的生物活性物质的包埋递送。然而O/W乳液的热力学不稳定性限制了其在食品中的应用。研究表明蛋白质类乳化剂能迅速扩散到乳液界面,赋予界面膜较高的机械强度[1],从而提高O/W乳液的稳定性。因此,利用蛋白质类乳化剂提高乳液稳定性对于扩展O/W乳液在食品的应用具有重要意义。
麦醇溶蛋白(gliadin,Gli)是小麦蛋白的主要成分(约占40%~50%),因其具有独特的自组装特性、起泡性和生物相容性而被广泛用于啤酒、面包和药物输送等领域[2-3]。然而,单一Gli具有较高的疏水性[4],在油水界面的吸附能力较弱,限制了其作为乳化剂在食品中的应用。研究发现,酚类化合物可通过物理或化学相互作用与蛋白质结合,促进蛋白质分子构象改变,达到改善其乳化性和抗氧化性等性能的目的[5]。在众多酚类化合物中,姜黄素(curcumin,Cur)和γ-谷维素(gamma oryzanol,GO)近年来受到广泛关注。Cur是一种天然的低分子质量酚类化合物,具有抗氧化、抗炎和抗菌等作用[6]。NAYAK等[7]研究发现,Cur与乳清分离蛋白形成的复合物显著降低了乳液的粒径,提高了乳液稳定性;YI等[8]研究发现,紫外线照射8 h后,加入Cur后豌豆蛋白和高甲氧基果胶形成的复合物对胡萝卜素的保留量提高47.38%。GO是一种由环木菠萝醇类阿魏酸酯和甾醇类阿魏酸酯组成的天然混合物,因其具有降胆固醇、降血糖血脂、抗氧化等功效而被广泛用于医药、食品和化妆品等领域[9]。研究发现,加入GO后乳清分离蛋白的乳化活性和抗氧化性均显著提高[10]。然而,目前尚未有将Gli-Cur复合物和Gli-GO复合物作为乳化剂用于提高乳液稳定性的研究,并且缺乏Gli与Cur、Gli与GO在微观层面相互作用研究。分子动力学模拟可以深入阐述分子间的相互作用,有望在分子层面上为Gli-Cur复合物和Gli-GO复合物提高乳液稳定性提供理论支持[11]。
因此,本文通过测定Gli-Cur复合物和Gli-GO复合物的接触角及其对O/W乳液的粒径、流变学特性和氧化稳定性的影响,并进一步借助红外光谱、分子对接和分子动力学模拟分析Gli与Cur、Gli与GO之间的相互作用,为扩大Gli在乳液中的应用并改善O/W乳液性能提供理论依据。
1 材料与方法
1.1 材料与试剂
谷朊粉(蛋白质含量为75%),新乡良润全谷物食品有限公司;姜黄素,国药集团化学试剂有限公司;γ-谷维素,大连美伦生物技术有限公司;KBr(光谱级),天津光孚精细化工研究所;亚麻籽油,陕西关中油坊有限公司;其他试剂均为分析纯。
1.2 仪器与设备
Spectrun100红外光谱仪,美国Perkin-Elmer公司;T18 ULTRA-TURRAX型高速均质机,德国IKA公司;DF-101S型热式恒温磁力搅拌器,巩义市予华仪器有限责任公司;BX43型光学显微镜,日本OLYMPUS公司;Mastersizer 3000激光粒度分析仪,英国Malvern公司;DHR-1旋转流变仪,美国TA公司;SDC-200光学接触角测定仪,东莞市鼎晟精密仪器有限公司。
1.3 实验方法
1.3.1 复合物的制备
参考PENG等[12]的方法制备Gli,并稍做修改。将谷朊粉和二氯甲烷按1∶10(g∶mL)混合,磁力搅拌2 h后过滤除去二氯甲烷,重复上述步骤3次。将脱脂谷朊粉与70%乙醇溶液(体积分数,下同)按1∶10(g∶mL)混合,磁力搅拌2 h后离心(3 000×g)10 min,收集上清液于4 ℃过夜,将上清液离心(3 000×g)10 min后于40 ℃旋蒸除去乙醇,冷冻干燥后得到Gli。
参考LIU等[13]的方法利用反溶剂法制备Gli-Cur和Gli-GO复合物。将0.2 g Cur或GO与1 g Gli混合后溶解于100 mL的70%乙醇溶液中,磁力搅拌30 min后于4 ℃放置过夜。取10 mL Gli-Cur和Gli-GO混合物分别加入40 mL去离子水中,在1 000 r/min磁力搅拌使其完全混合,旋蒸除去体系中的乙醇,并用去离子水将复合物分散液定容至50 mL,得到蛋白质质量浓度为2 mg/mL的Gli-Cur和Gli-GO复合物分散液。不加Cur和GO,按照上述相同条件制备Gli样品作为对照。
1.3.2 接触角的测定
参考ZHU等[14]的方法测定样品的接触角(θow),并稍做修改。在室温下利用光学接触角测定仪中的静态滴定法测定样品的θow。将样品压制成薄片后浸泡在含有大豆油的培养皿中,用高精度注射器在薄片表面滴入一滴2.7 μL的超纯水,然后利用高速摄像机获取液滴从注射器落下的图像。
1.3.3 乳液粒径的测定和微观结构表征
乳液的制备:将1.3.1节制备的Gli、Gli-Cur复合物和Gli-GO复合物与亚麻籽油1∶1(体积比)混合后利用高速剪切机在14 000 r/min下高速剪切5 min,得到由Gli、Gli-Cur复合物和Gli-GO复合物稳定的乳液。
粒径测定:利用激光粒度仪测量室温(25 ℃)下乳液的液滴尺寸分布。去离子水水相和亚麻籽油油相折射率分别设置为1.33和1.48,根据尺寸分布的测量结果得到乳液液滴的体积平均直径(d4,3)和表面平均直径(d3,2)。
乳液的微观结构:使用光学显微镜对乳液样品进行微观结构观察。取10 μL乳液样品置于干净的载玻片中央,盖上盖玻片,使用40×物镜对乳液液滴进行微观形态观察。
1.3.4 乳液的流变特性
参考SRIPRABLOM等[15]的方法测定乳液的流变学特性,并稍作修改。采用旋转流变仪测定乳液的流变学特性,选用d=40 mm的夹具,设置间隙1 mm,测试温度25 ℃。黏弹性质测量:应力扫描范围0.01%~10%,频率1 Hz,确定乳液的线性黏弹性区域;频率扫描范围0.1~100 Hz,应变为0.1%,测定乳液的储能模量(G′)、损耗模量(G″)和损耗正切(tan δ=G″/G′)。在剪切速率0.1~100 s-1下测定乳液黏度。
1.3.5 乳液的氧化稳定性测定
通过测量乳液的过氧化值(peroxide value,PV)和硫代巴比妥酸反应物(thiobarbituric reactive substances,TBARS)分别确定脂质氧化的初级氧化产物和次级氧化产物的含量。取1.3.3节制备的乳液10 mL于螺旋透明小瓶中,并密封,室温(25 ℃)贮藏28 d。分别在1、7、14、21、28 d时取样测定乳液的PV和TBARS值。
参照王艇[16]的方法测定乳液的PV。吸取1 mL乳液样品,加入4 mL V(石油醚)∶V(异丙醇)=3∶1的混合溶液,充分混合后离心(3 000 r/min,2 min)。吸取1 mL上清液于10 mL试管中,加入50 μL KSCN和50 μL FeCl2溶液后用三氯甲烷-甲醇混合溶液(7∶3,体积比)定容至10 mL。混合均匀后在室温下避光放置5 min,用等体积石油醚和异丙醇混合溶液(3∶1,体积比)替代上清液,于510 nm波长处测定吸光度。按照公式(1)计算PV。
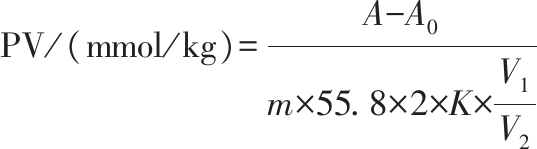
(1)
式中:A,样品吸光度;A0,等体积石油醚和异丙醇混合溶剂代替样品的吸光度;K,Fe3+标准曲线的斜率,0.034 7;m,样品质量,g;V1,样品体积,mL;V2,稀释后总体积,mL;55.8,Fe3+的摩尔质量,g/mol;2,换算因子。
参考CHEN等[17]的方法测定乳液的TBARS值,并稍做修改。吸取1 mL样品乳液与2 mL的硫代巴比妥酸试剂(15%三氯乙酸,0.25 mol/L HCl,0.375%的硫代巴比妥酸)混合。将混合物在沸水浴中加热15 min冷却10 min至室温,然后将混合物用微孔膜过滤后取滤液于532 nm处测定吸光度。根据1,1,3,3-四乙氧基丙烷的标准曲线计算TBARS浓度(μmol/L)
1.3.6 红外光谱分析
将干燥的待测样品与KBr按质量比1∶100混合研磨后压制成薄片,使用红外光谱仪在波数4 000~400 cm-1范围内采集图谱,分辨率为4 cm-1,总扫描次数为32次。
1.3.7 分子对接
参考杨婷婷等[18]同源建模的方法获取Gli三维结构。从Pubchem(https://pubchem.ncbi.nlm.nih.gov)数据库中获取Cur(ID:969516)和GO(ID:5282164)的初始分子结构。使用YASARA软件(版本:2020.12.26)[19]进行分子对接。以Gli三维结构作为蛋白质受体,Cur和GO三维结构模型作为配体进行分子对接。采用半柔性对接,对接格子设置为12 Å×12 Å×12 Å,对接次数为100次。使用PyMOL(2.4版)[20]和Ligplot(2.2版)[21]对结合能最低处的构象进行可视化分析,并用于后续分子动力学模拟。
1.3.8 分子动力学模拟
为阐明Gli-Cur和Gli-GO之间的结合差异,使用YASARA(版本:2020.12.26)[19]软件进行分子动力学模拟。模拟过程使用AMBER14力场[22],首先,将Gli-Cur和Gli-GO复合物分别封装在立体盒子中,复合物分子与盒子边缘距离为1 nm。然后加入TIP3P模型水,通过Na+或Cl-中和体系电荷,在0.8 nm处截断范德华力和短程静电作用。使用Particle-Mesh Ewald方法[23]计算长程静电作用。随后,整个系统进行能量最小化,设置模拟温度为298.15 K,时间步长为2 fs,模拟时间为20 ns。最后,使用YASARA软件自带工具计算Gli-Cur和Gli-GO复合物的均方根偏差(root mean square deviation, RMSD)和结合能。按照公式(2)和公式(3)计算系统的结合能、范德华势能、静电势能和内能。
ΔE=ΔEelec+ΔEvdw +ΔEinter
(2)
ΔEinter=ΔEbond+ΔEangle+ΔEdihedral+ΔEplanarity
(3)
式中:ΔE,结合能,kJ/mol;ΔEelec,静电能,kJ/mol;ΔEvdw,范德华势能,kJ/mol;ΔEinter,内能,kJ/mol;ΔEbond,键拉伸能量,kJ/mol;ΔEangle,角度弯曲能量,kJ/mol;ΔEdihedral,扭转能量,kJ/mol;ΔEplanarity,平面能量,kJ/mol。
1.4 数据处理
实验指标平行测定3次,样品平行测定2次,结果以平均值±标准偏差表示。用统计软件SPSS 18.0进行单因素ANOVA分析(P<0.05时为差异显著)。
2 结果与分析
2.1 Gli-Cur复合物和Gli-GO复合物的表面润湿性
接触角(θow)是衡量复合物表面润湿性的重要指标,是影响乳液的形成与稳定的关键因素之一[24]。当θow<90°时,复合物表现出亲水性,易形成O/W乳液;反之,当θow>90°时,复合物表现出亲油性,易形成W/O乳液;θow在90°左右时,复合物表现较好的表面润湿性,能较好地吸附在油水界面,进而形成性质较为稳定的乳液[25]。图1反映了Gli、Gli-GO复合物和Gli-Cur复合物接触角的变化情况。
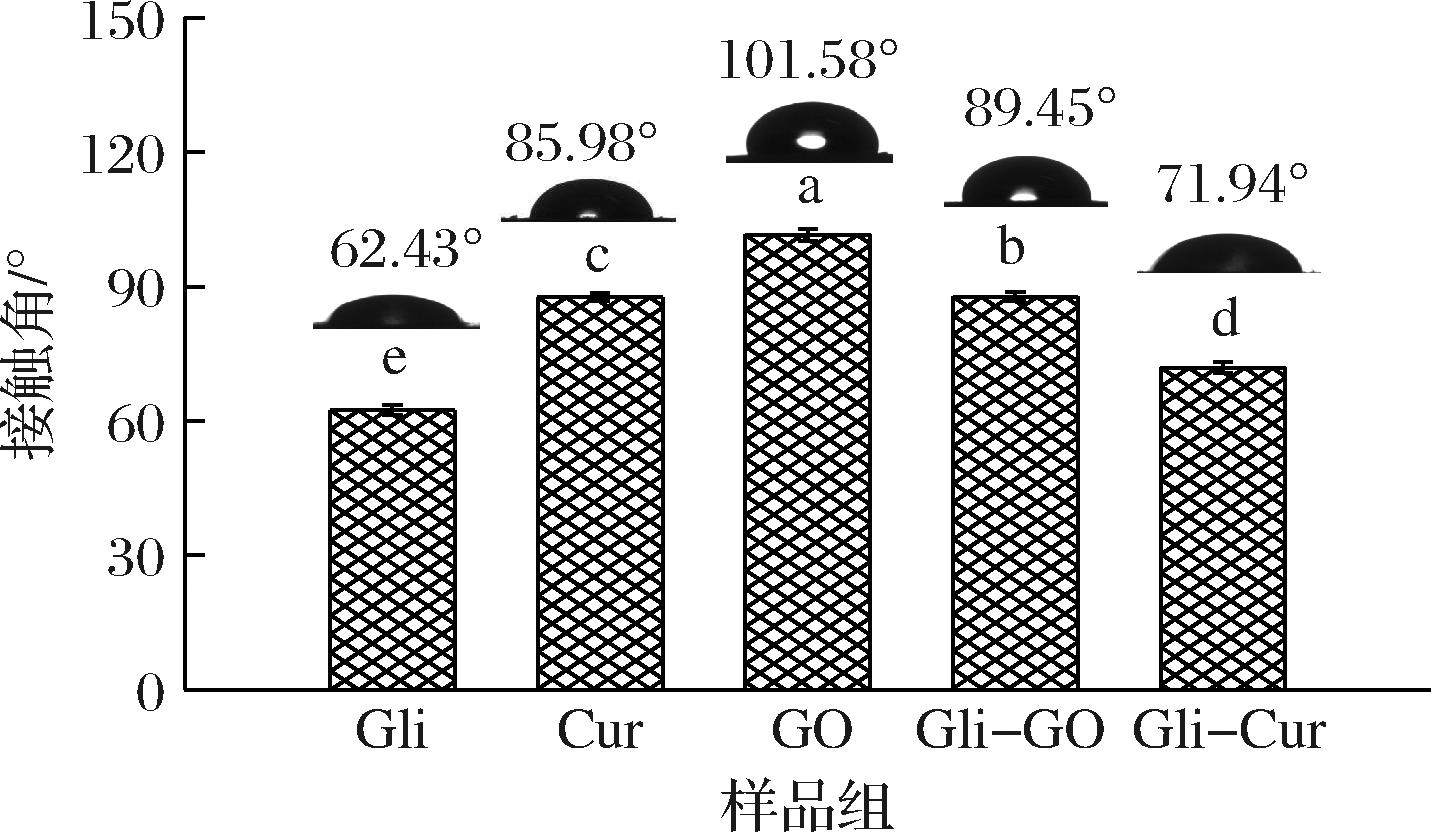
图1 Gli、Gli-GO复合物及Gli-Cur复合物的接触角
Fig.1 Contact angle of Gli, Gli-GO complex and Gli-Cur complex
注:同一指标组间不同字母表示差异显著(P<0.05)(下同)。
Gli、Gli-GO复合物和Gli-Cur复合物的θow<90°,表明Gli、Gli-GO和Gli-Cur复合物形成的乳液均为O/W型。同时,与单一Gli相比(θow为62.43°),Gli-GO和Gli-Cur复合物的θow分别增大至89.45°和71.94°,这可能是由于Cur与Gli、GO与Gli的结合使Gli结构更加松散,内部疏水基团暴露,从而增加Gli-Cur和Gli-GO复合物的疏水性;此外,由于GO和Cur均具有疏水性,附着在Gli表面也可能增加复合物的疏水性[26]。结果表明,Gli与疏水性的GO或Cur复合可以改善Gli的表面润湿性,更利于稳定乳液。
2.2 Gli-Cur复合物和Gli-GO复合物对O/W乳液理化性质的影响
2.2.1 乳液的粒径分析和微观结构表征
如图2-a所示,单一Gli稳定的乳液的粒径呈单峰分布,主峰分布在37~56 μm;加入GO或Cur后,Gli-GO和Gli-Cur的主峰均向低粒径方向移动(主峰分布在25~40 μm),表明Gli-GO和Gli-Cur稳定的乳液粒径较小。此外,与单一Gli稳定的乳液相比,Gli-GO和Gli-Cur稳定乳液的d4,3分别降低10.66%和10.42%,d3,2分别降低29.22%和16.46%(图2-b)。这表明GO或Cur的加入能降低乳液液滴尺寸,这可能是由于Gli与GO、Gli与Cur之间的非共价和共价相互作用促进Gli结构改变[27],使Gli-GO复合物和Gli-Cur复合物的接触角接近90°,更容易吸附在油水界面,从而降低乳液液滴尺寸,更利于乳液稳定(图1)。
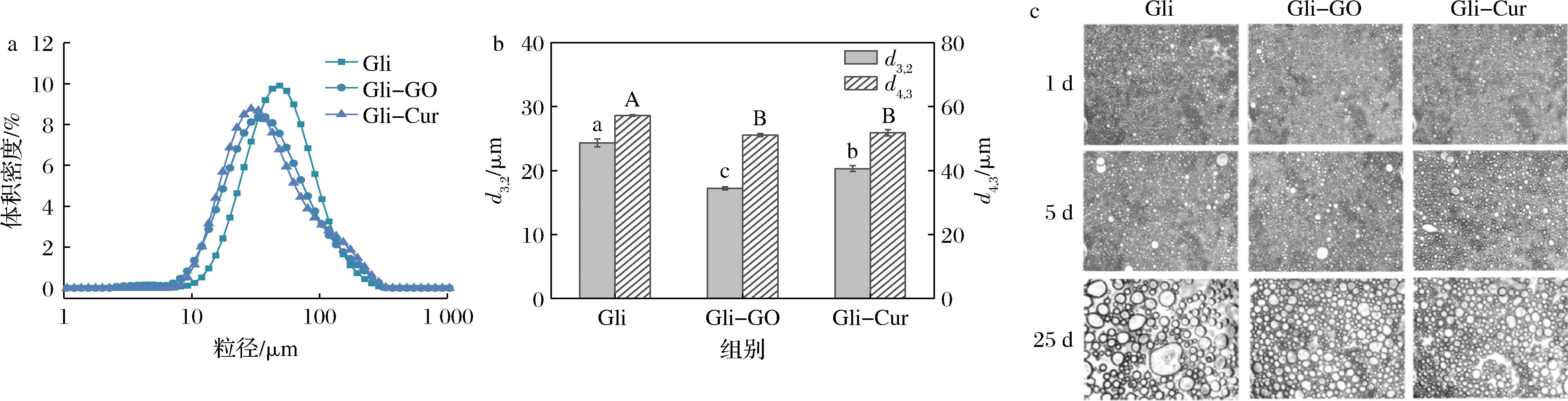
a-粒径分布;b-d3,2和d4,3;c-贮藏期间(1、5和25 d)的微观形貌
图2 Gli、Gli-GO复合物和Gli-Cur复合物稳定的乳液的粒径分布和贮藏期间(1、5和25 d)的微观形貌
Fig.2 Particle size distribution of emulsions stabilized by Gli, Gli-GO complex and Gli-Cur complex and microstructure of the emulsions stored for 1, 5 and 25 days
注:同种柱形图上方不同大写字母和小写字母表示组间差异显著(P<0.05)。
如图2-c所示,第1天时,所有乳液的液滴均相对较小且分散均匀。随着贮藏时间延长至25 d,Gli-GO和Gli-Cur乳液的大液滴数量小于单一Gli乳液,表明Gli-GO复合物和Gli-Cur复合物稳定的乳液具有更好的物理稳定性。综上所述,加入GO或Cur能显著降低Gli稳定的乳液粒径,提高乳液稳定性。
2.2.2 乳液的流变学特性
如图3-a所示,在0.1~10 Hz的频率扫描范围内,Gli、Gli-GO复合物和Gli-Cur复合物稳定的乳液的G′>G″,表现出明显的弹性流体特征,表明乳液形成了弹性凝胶状网络[28]。此外,所有乳液的G′和G″均随频率的增加而增加,表明非共价相互作用是乳液形成弹性凝胶状网络的主要原因[29]。tan δ表示黏性和弹性分量的相对大小,tan δ>1时,表现为乳液的黏性性质,tan δ<1时,表现为乳液的弹性性质[28]。
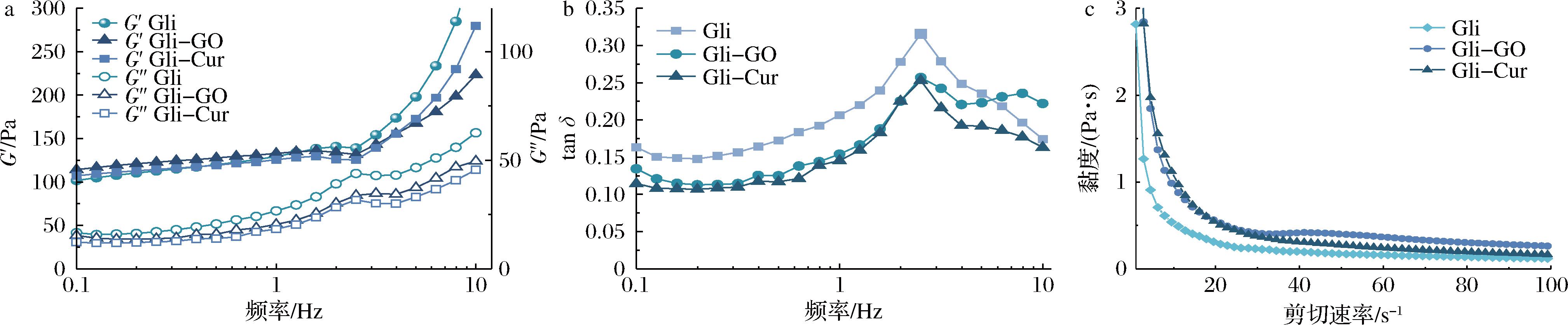
a-储能模量(G′)、损耗模量(G″);b-tan δ;c-黏度
图3 乳液的储能模量(G′)、损耗模量(G″)和tan δ随频率的变化曲线和黏度随剪切速率的变化曲线
Fig.3 Curves of storage modulus (G′) and loss modulus (G″) and tan δ of emulsion versus frequency, and viscosity versus shear rate
由图3-b可知,Gli、Gli-GO复合物和Gli-Cur复合物稳定的乳液的tan δ<1,并且与单一Gli相比,Gli-GO和Gli-Cur稳定的乳液的tan δ值均显著降低,表明GO或Cur的加入能提高Gli稳定的乳液弹性[30]。此外,与Gli-GO稳定的乳液的tan δ值相比,Gli-Cur复合物稳定的乳液的tan δ值更低,表明Gli-Cur复合物稳定的乳液弹性更大。
如图3-c所示,Gli、Gli-GO复合物和Gli-Cur复合物稳定的乳液黏度均随剪切速率的增加而降低,表现出明显的剪切变稀现象。这可能是因为随着剪切速率的增加,乳液的凝胶网络结构被破坏,油滴变形,使乳液黏度降低[31]。此外,在剪切速率为1~100 s-1的范围内,Gli-GO复合物和Gli-Cur复合物稳定的乳液黏度均高于单一Gli稳定的乳液,表明加入GO或Cur能提高Gli稳定的乳液黏度,是利于乳液稳定的因素之一(图2-c)[30]。
2.3 Gli-Cur复合物和Gli-GO复合物对O/W乳液氧化稳定性的影响
如图4所示,随着贮藏时间增加,不同体系中油脂的PV和TBARS值均显著升高。
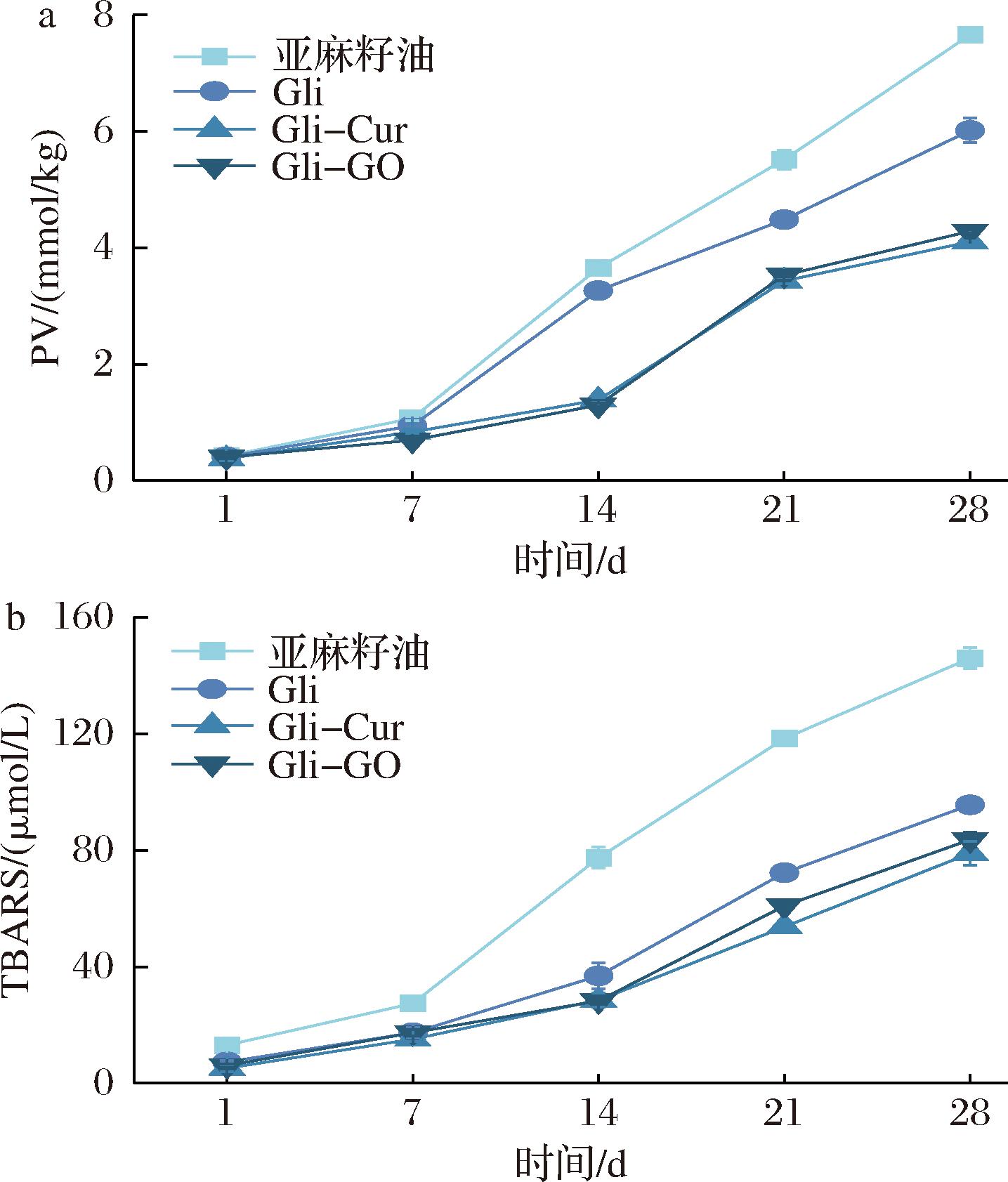
a-PV值;b-TBARS值
图4 Gli、Gli-Cur复合物和Gli-GO复合物制备的乳液的PV和TBARS值随贮藏时间的变化情况
Fig.4 Changes in PV and TBARS value of emulsions prepared by Gli, Gli-Cur complex and Gli-GO complex
贮藏28 d后,Gli、Gli-Cur复合物和Gli-GO复合物制备的乳液PV与亚麻籽油相比分别降低1.64、3.56、3.37 mmol/kg。这与Gli氨基酸侧链中具有抗氧化活性的半胱氨酸、蛋氨酸和色氨酸等有关[32]。此外,与单一Gli相比(PV和TBARS值分别为6.02 mmol/kg和95.57 μmol/L),贮藏28 d后,Gli-Cur复合物和Gli-GO复合物稳定的乳液PV分别降低31.8%和28.79%,TBARS值分别降低17.37%和12.51%。可能原因除Cur和GO本身具有较高的抗氧化性外,Gli-Cur复合物和Gli-GO复合物会在脂质表面形成一层致密的界面层,降低空气中氧和水相中促氧化剂与油脂接触的能力[33]。综上所述,Gli-Cur复合物和Gli-GO复合物能提高乳液的氧化稳定性。
2.4 Gli-Cur复合物和Gli-GO复合物的相互作用分析
由上述复合物稳定的乳液流变学特性的结果推测,Gli与GO、Gli与Cur之间存在非共价相互作用,且Gli与Cur之间的非共价相互作用较Gli与GO间的更强。因此,本环节采用红外光谱联合理论计算(分子对接和分子动力学模拟)分析复合物中Gli与GO、Gli与Cur之间的相互作用。
2.4.1 红外光谱分析
如图5所示,Gli在3 293、1 665 cm-1处的特征峰分别与O—H伸缩振动和C![]() O伸缩振动有关,1 536 cm-1处的特征峰与C—H伸缩振动和N—H弯曲振动有关[34]。在Gli中加入GO或Cur后,Gli在3 293 cm-1处的特征峰分别蓝移至3 300、3 313 cm-1,表明Gli与GO、Gli与Cur之间存在相互作用。同时,当GO或Cur加入到Gli中,1 665 cm-1处的特征峰分别红移至1 660和1 658 cm-1,1 536 cm-1处的特征峰分别蓝移至1 545、1 544 cm-1,这些结果表明Gli与GO、Gli与Cur之间存在静电相互作用[35]。
O伸缩振动有关,1 536 cm-1处的特征峰与C—H伸缩振动和N—H弯曲振动有关[34]。在Gli中加入GO或Cur后,Gli在3 293 cm-1处的特征峰分别蓝移至3 300、3 313 cm-1,表明Gli与GO、Gli与Cur之间存在相互作用。同时,当GO或Cur加入到Gli中,1 665 cm-1处的特征峰分别红移至1 660和1 658 cm-1,1 536 cm-1处的特征峰分别蓝移至1 545、1 544 cm-1,这些结果表明Gli与GO、Gli与Cur之间存在静电相互作用[35]。
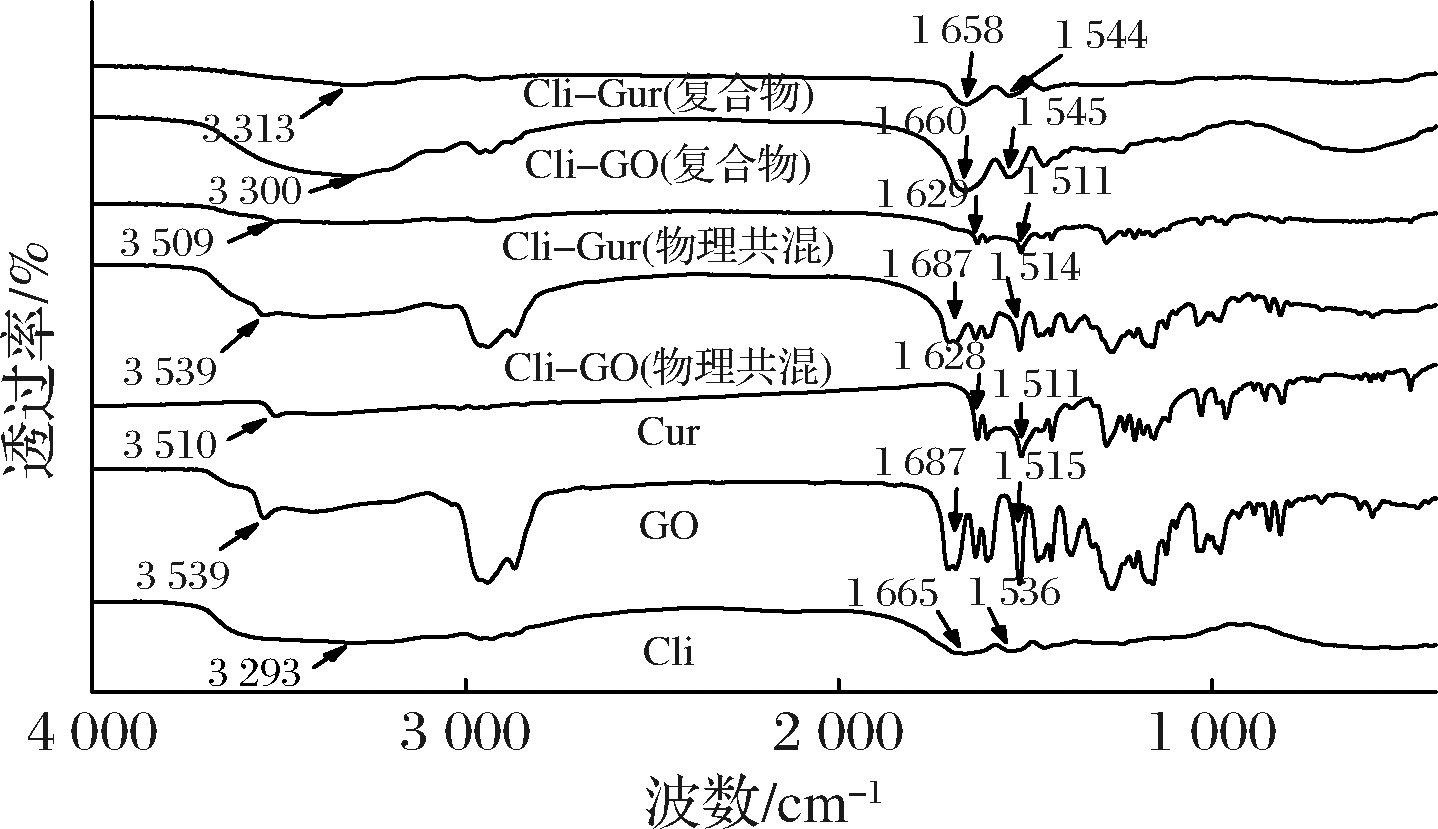
图5 Gli、Gli-GO复合物和Gli-Cur复合物的红外光谱
Fig.5 FIIR specta of Gli, Gli-GO complex and Gli-Cur complex
综上所述,Gli与GO、Gli与Cur之间的氢键和静电相互作用是形成Gli-GO和Gli-Cur复合物的其中两个驱动力。
2.4.2 分子对接
分子对接可探究Gli与GO、Gli与Cur之间的结合位点以及结合过程涉及的相互作用。由Gli-GO和Gli-Cur分子对接2D和3D示意图可知,GO与Gli的Thr 166和Gln 129形成氢键(图6-a和图6-c);Cur与Gli的Phe 219、Gln 160、Gln 223和Ser 218形成氢键(图6-b和图6-d)。此外,由Gli-GO、Gli-Cur分子对接2D示意图可知,GO与Gli的Pro 88、Gln 125、Gln 87、Pro 84、Tyr 76、Leu 81、Gln 85、Gln 121、Gln 126、Gln 124、和Gln 127形成了疏水相互作用;Cur与Gli的 Gln 164、Asn 192、His 195、His 191、Pro 227、Pro 222和Gln 216形成了疏水相互作用。这些结果表明,GO与Gli、Cur与Gli复合过程中主要的相互作用力是疏水相互作用和氢键。综上,结合红外光谱的结果可以看出(图5),Gli与GO、Gli与Cur之间的氢键、静电相互作用和疏水相互作用是形成Gli-GO和Gli-Cur复合物的主要驱动力。
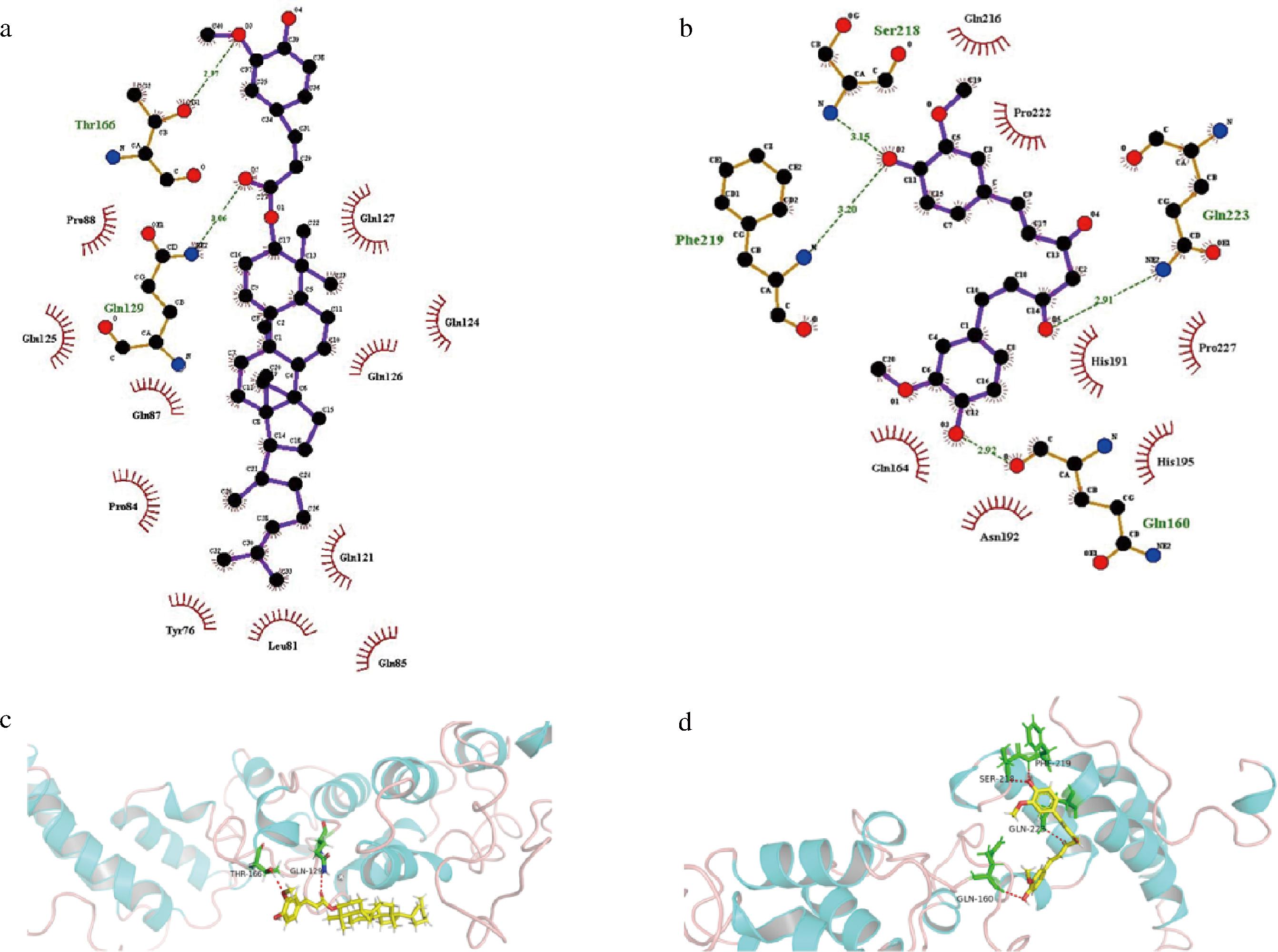
a-Gli-GO的分子对接2D;b-Gli-Cur的分子对接2D;c-Gli-GO的分子对接3D;d-Gli-Cur的分子对接3D
图6 Gli-GO和Gli-Cur的分子对接2D和3D示意图
Fig.6 Molecular docking of Gli-GO and Gli-Cur 2D and 3D diagrams
注:a,b图中氢键相互作用显示为绿色虚线,疏水相互作用显示为红色弧线。
2.4.3 分子动力学模拟
2.4.3.1 RMSD
通过分析Gli、Gli-Cur复合物和Gli-GO复合物的RMSD以反映复合物分子结构在特定时间内偏离其初始构象的程度;当RMSD值在0.2 nm范围内波动时,表明体系达到了平衡[11]。由图7可知,Gli、Gli-Cur和Gli-GO的RMSD在0~15 ns波动较大,但15 ns以后三者均逐渐趋于平稳,此时Gli、Gli-Cur和Gli-GO的RMSD分别维持在0.46、0.58、0.60 nm左右,且RMSD曲线波动范围都在0.2 nm以内。结果表明Gli、Gli-Cur和Gli-GO体系均处于稳定状态,可用于进一步分析结合能变化。

图7 Gli、Gli-GO复合物和Gli-Cur复合物在分子动力学模拟过程中的RMSD变化
Fig.7 Changes in RMSD of Gli, Gli-GO and Gli-Cur during molecular dynamics simulation
注:图中显示了三种体系在5和19 ns时的代表性分子动力学轨迹。
2.4.3.2 结合能分析
图8显示了Gli-Cur和Gli-GO复合物稳定后各项能量的贡献情况。Gli-Cur复合物和Gli-GO复合物的范德华势能和内能均为正值,且对结合能贡献较小;而静电势能呈现负值,且与结合能的变化保持一致,表明静电相互作用主导了Gli与Cur、Gli与GO之间的结合。此外,与Gli-GO的结合能(-1.89×105 kJ/mol)相比,Gli-Cur的结合能更低(-2.11×105 kJ/mol),表明Gli-Cur复合物由于结合强度更大而表现出更好的稳定性,这可能更利于增强Gli-Cur乳液凝胶网络结构的强度(图3)。
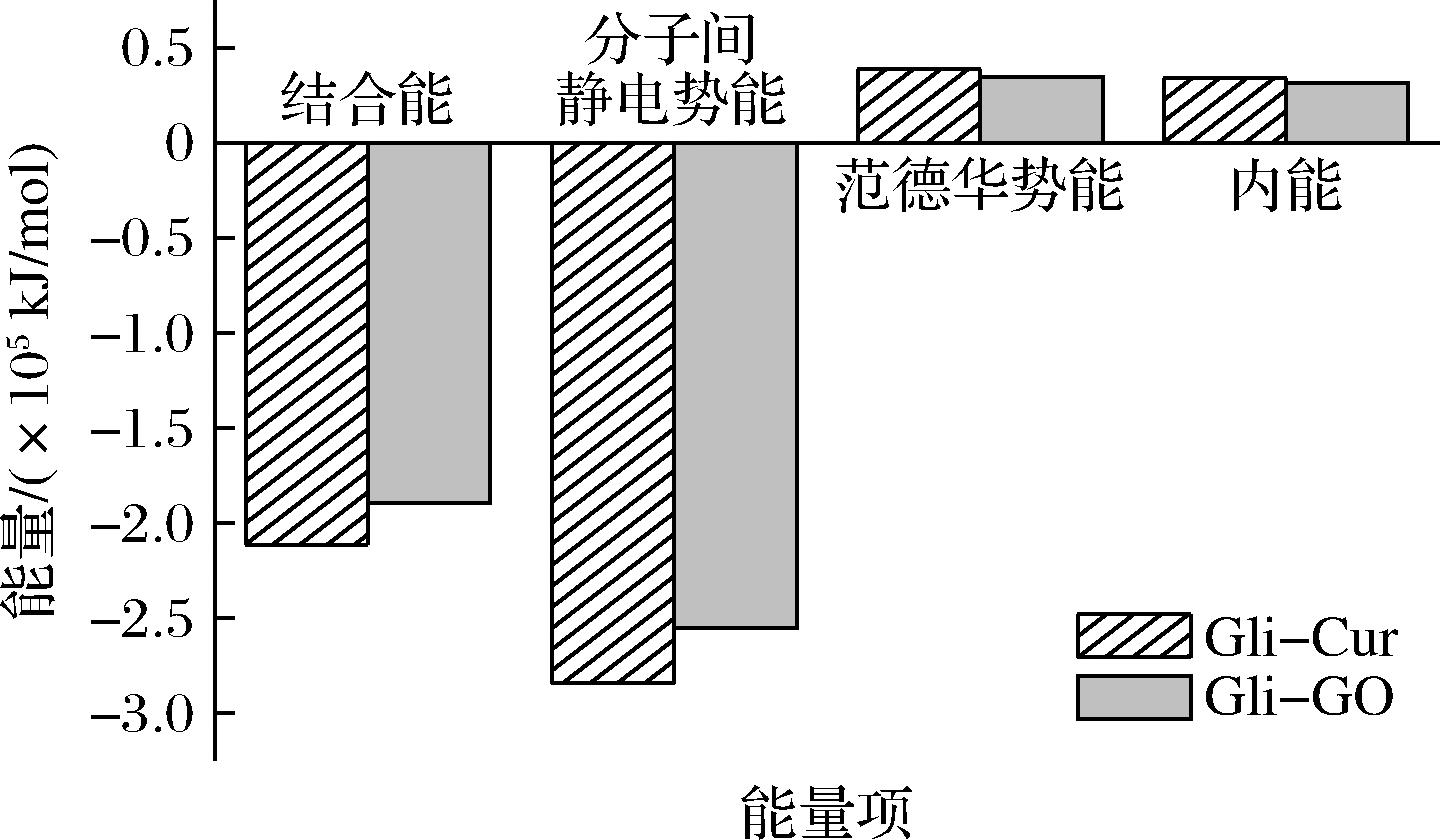
图8 Gli-Cur复合物和Gli-GO复合物的结合能和能量分解
Fig.8 Binding energy and energy decomposition of Gli-Cur complex and Gli-GO complex
3 结论
本文研究了Gli与Cur、Gli与GO形成复合物的相互作用及其对O/W乳液稳定性的影响。结果表明,与单一Gli相比,Gli-Cur和Gli-GO复合物能显著降低乳液的粒径(d3,2分别下降16.46%和29.22%)和过氧化值(分别降低31.8%和28.79%),提高乳液凝胶网络结构的强度,更利于提高乳液的理化稳定性。此外,分子动力学模拟结果显示,静电相互作用主导了Gli-Cur和Gli-GO之间的结合;Gli-Cur复合物的结合能低于Gli-GO复合物的结合能,表明Gli和Cur之间的结合强度更大,这可能更利于增强Gli-Cur乳液凝胶网络结构的强度。总之,本结果为研究酚类化合物改善Gli乳液的理化性质与扩大Gli乳液应用提供了一定参考。
[1] MCCLEMENTS D J, GUMUS C E.Natural emulsifiers - Biosurfactants, phospholipids, biopolymers, and colloidal particles:Molecular and physicochemical basis of functional performance[J].Advances in Colloid and Interface Science, 2016:3-26.
[2] 王启明, 唐瑜婉, 李春翼, 等.NaCl浓度对麦醇溶蛋白与槲皮素相互作用的影响[J].食品科学, 2021, 42(8):29-39.
WANG Q M, TANG Y W, LI C Y, et al.Spectroscopic analysis of interaction between gliadin and quercetin under different NaCl concentrations[J].Food Science, 2021, 42(8):29-39.
[3] XU W, SUN H M, KANG M Y, et al.Ethanol-tolerant Pickering emulsion stabilized by gliadin nanoparticles[J].LWT, 2022, 162:113440.
[4] RANI M, SIDDIQI R A, SHARMA R, et al.Functional and structural properties of gliadin as influenced by pH, extraction protocols, and wheat cultivars[J].International Journal of Biological Macromolecules, 2023, 234:123484.
[5] 陈晓玲, 管维良, 施佩影, 等.谷物醇溶蛋白与植物多酚的互作机理及应用研究进展[J].食品科学, 2022, 43(17):353-361.
CHEN X L, GUAN W L, SHI P Y, et al.Review on recent progress in the mechanism and application of interaction between prolamins and polyphenols[J].Food Science, 2022, 43(17):353-361.
[6] DU C X, XU J J, LUO S Z, et al.Low-oil-phase emulsion gel with antioxidant properties prepared by soybean protein isolate and curcumin composite nanoparticles[J].LWT-Food Science and Technology, 2022, 161:113346.
[7] NAYAK A, GENOT C, MEYNIER A, et al.Impact of process and physico-chemical conditions on the formation of curcumin-whey protein composite particles capable to stabilize food-compatible oil in water emulsions[J].LWT, 2022, 153:112421.
[8] YI J, HUANG H M, LIU Y X, et al.Fabrication of curcumin-loaded pea protein-pectin ternary complex for the stabilization and delivery of β-carotene emulsions[J].Food Chemistry, 2020, 313:126118.
[9] 杨贵妃, 刘昕, 黎重阳, 等.谷维素对纳米乳液理化稳定性的影响[J].食品与机械, 2018, 34(10):14-18;54.
YANG G F, LIU X, LI C Y, et al.Effect of oryzanol on the physicochemical stability of nanoemulsions[J].Food &Machinery, 2018, 34(10):14-18;54.
[10] LI M, LI J Z, HUANG Y X, et al.Insight into comparison of binding interactions and biological activities of whey protein isolate exposed prior to two structurally different sterols[J].Food Chemistry, 2023, 405(Pt A):134827.
[11] 刘瑞, 刘郁琪, 钟金锋, 等.pH对果胶-酪蛋白复合物包埋体系理化稳定性的影响[J].食品与发酵工业, 2023, 49(18):216-223;231.
LIU R, LIU Y Q, ZHONG J F, et al.Effect of pH on physicochemical stability of pectin-casein complex system[J].Food and Fermentation Industries, 2023, 49(18):216-223;231.
[12] PENG D F, JIN W P, LI J, et al.Adsorption and distribution of edible gliadin nanoparticles at the air/water interface[J].Journal of Agricultural and Food Chemistry, 2017, 65(11):2454-2460.
[13] LIU X, HUANG Y Q, CHEN X W, et al.Whole cereal protein-based Pickering emulsions prepared by zein-gliadin complex particles[J].Journal of Cereal Science, 2019, 87:46-51.
[14] ZHU X W, CHEN Y T, HU Y X, et al.Tuning the molecular interactions between gliadin and tannic acid to prepare Pickering stabilizers with improved emulsifying properties[J].Food Hydrocolloids, 2021, 111:106179.
[15] SRIPRABLOM J, SUPHANTHARIKA M.Influence of xanthan gum on properties and stability of oil-in-water Pickering emulsions stabilized by zein colloidal particles[J].Journal of Food Measurement and Characterization, 2022, 16(4):2772-2781.
[16] 王艇. 交流阻抗法评价O/W型乳液氧化稳定性[D].无锡:江南大学, 2015.
WANG T.Evaluation of the O/W emulsion oxidation stability with AC impedance spectroscopy[D].Wuxi:Jiangnan University, 2015.
[17] CHEN S, ZHANG N, TANG C H.Influence of nano complexation with curcumin on emulsifying properties and emulsion oxidative stability of soy protein isolate at pH 3.0 and 7.0[J].Food Hydrocolloids, 2016, 61:102-112.
[18] 杨婷婷, 罗国柳, 覃小丽, 等.低分子糖-麦醇溶蛋白复合物的结构与性能及其相互作用分析[J].食品研究与开发, 2023, 44(5):15-21.
YANG T T, LUO G L, QIN X L, et al.Analysis of structure and properties of low-molecular-weight saccharides-gliadin complexes and their interactions[J].Food Research and Development, 2023, 44(5):15-21.
[19] KRIEGER E, VRIEND G.New ways to boost molecular dynamics simulations[J].Journal of Computational Chemistry, 2015, 36(13):996-1007.
[20] SEELIGER D, DE GROOT B L.Ligand docking and binding site analysis with PyMOL and Autodock/Vina[J].Journal of Computer-Aided Molecular Design, 2010, 24(5):417-422.
[21] WALLACE A C, LASKOWSKI R A, THORNTON J M.LIGPLOT:A program to generate schematic diagrams of protein-ligand interactions[J].Protein Engineering, 1995, 8(2):127-134.
[22] MAIER J A, MARTINEZ C, KASAVAJHALA K, et al.ff14SB:Improving the accuracy of protein side chain and backbone parameters from ff99SB[J].Journal of Chemical Theory and Computation, 2015, 11(8):3696-3713.
[23] DARDEN T, YORK D, PEDERSEN L.Particle mesh Ewald:An N·glog(N) method for Ewald sums in large systems[J].The Journal of Chemical Physics, 1993, 98(12):10089-10092.
[24] CUI S, MCCLEMENTS D J, SHI J L, et al.Fabrication and characterization of low-fat Pickering emulsion gels stabilized by zein/phytic acid complex nanoparticles[J].Food Chemistry, 2023, 402:134179.
[25] ZHOU F Z, YU X H, LUO D H, et al.Pickering water in oil emulsions prepared from biocompatible gliadin/ethyl cellulose complex particles[J].Food Hydrocolloids, 2023, 134:108050.
[26] ZHOU S J, HAN L, LU K Y, et al.Whey protein isolate-phytosterols nanoparticles:Preparation, characterization, and stabilized food-grade Pickering emulsions[J].Food Chemistry, 2022, 384:132486.
[27] TIAN L, YANG K J, ZHANG S L, et al.Impact of tea polyphenols on the stability of oil-in-water emulsions coated by whey proteins[J].Food Chemistry, 2021, 343:128448.
[28] ALIZADEH L, ABDOLMALEKI K, NAYEBZADEH K, et al.Characterization of sodium caseinate/Hydroxypropyl methylcellulose concentrated emulsions:Effect of mixing ratio, concentration and wax addition[J].International Journal of Biological Macromolecules, 2019, 128:796-803.
[29] TANG C H, LIU F.Cold, gel-like soy protein emulsions by microfluidization:Emulsion characteristics, rheological and microstructural properties, and gelling mechanism[J].Food Hydrocolloids, 2013, 30(1):61-72.
[30] ZOU Y, VAN BAALEN C, YANG X Q, et al.Tuning hydrophobicity of zein nanoparticles to control rheological behavior of Pickering emulsions[J].Food Hydrocolloids, 2018, 80:130-140.
[31] ALIYARI M A, SALAMI M, HOSSEINI E, et al.Biophysical, rheological, and functional properties of complex of sodium caseinate and olive leaf aqueous polyphenolic extract obtained using ultrasound-assisted extraction[J].Food Biophysics, 2021, 16(3):325-336.
[32] XU N J, CHEN G Q, LIU H.Antioxidative categorization of twenty amino acids based on experimental evaluation[J].Molecules, 2017, 22(12):2066.
[33] LI R Y, DAI T T, TAN Y B, et al.Fabrication of pea protein-tannic acid complexes:Impact on formation, stability, and digestion of flaxseed oil emulsions[J].Food Chemistry, 2020, 310:125828.
[34] XU G R, LI L, BAO X Y, et al.Curcumin, casein and soy polysaccharide ternary complex nanoparticles for enhanced dispersibility, stability and oral bioavailability of curcumin[J].Food Bioscience, 2020, 35:100569.
[35] ESPINOSA-ANDREWS H, SANDOVAL-CASTILLA O, V ZQUEZ-TORRES H, et al.Determination of the gum Arabic-chitosan interactions by Fourier Transform Infrared Spectroscopy and characterization of the microstructure and rheological features of their coacervates[J].Carbohydrate Polymers, 2009, 79(3):541-546.
ZQUEZ-TORRES H, et al.Determination of the gum Arabic-chitosan interactions by Fourier Transform Infrared Spectroscopy and characterization of the microstructure and rheological features of their coacervates[J].Carbohydrate Polymers, 2009, 79(3):541-546.