近年来,全球人口老龄化趋势加剧,新冠后疫情时代背景下消费者对食品营养功能性的需求显著增加。特殊医学用途全营养配方食品可作为单一营养源满足需全面补充营养素的消化障碍人群对能量的摄入要求,而乳剂型产品无需复水操作,更有利于在临床上应用,具有广阔的市场发展前景[1]。
全营养乳液作为一个营养成分复杂的热力学不稳定体系,在贮藏期间易发生蛋白絮凝、斑点、脂肪上浮、矿物质沉淀和货架期凝胶化等物理不稳定现象以及维生素氧化降解的化学变化[2-3]。稳定动力学模型常用来预测乳液贮藏过程中感官阈值及货架期,WANG等[4]通过构建氧化动力学模型对不同贮存温度下大麻籽油在水包油乳液中的氧化程度进行分析和预测,RAKSHIT等[5]利用动力学稳定拟合模型解释了阿拉伯胶浓度对石榴多酚释放量的影响,BORTNOWSKA[6]通过释放动力学及热力学参数分析了乳液凝胶中影响芳香化合物稳定性的因素。采取单一指标进行动力学数学模型的建立并预测产品保质期品质变化的研究较为广泛,而综合多种指标进行稳定动力学分析的研究较少。
本研究对不同贮藏温度下全营养乳液的品质变化规律进行了探讨,并将其与理化参数的回归性分析和稳定动力学研究相结合,获得相关动力学与热力学参数,以数字化形式描述了全营养乳液贮藏过程中的品质劣变情况,为产品后续的保质保藏提供参考。
1 材料与方法
1.1 实验材料
酪蛋白(食品级),上海津颂实业有限公司;麦芽糊精(葡萄糖当量12),罗盖特营养食品有限公司;大豆油为市售;各类维生素均属食品级,厦门墨奕怀食品贸易有限公司;其余试剂均为分析纯,国药集团化学试剂有限公司。
1.2 实验设备
S3500激光粒度分析仪,美国Microtrac公司;多角度粒度与高灵敏度Zeta电位分析仪,美国布鲁克海文仪器公司;剪切分散机,德国IKA公司;AH-2010均质机,安拓思纳米技术(苏州)有限公司;YXQ-LS-30SII立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂。
1.3 实验方法
1.3.1 全营养乳液的制备
称取相应质量的酪蛋白与麦芽糊精干粉混合均匀,溶于已预热至60 ℃的去离子水中,磁力搅拌至充分溶解得酪蛋白和麦芽糊精质量分数分别为6%、15%的复合溶液,在4 ℃下储存过夜以完全水合。参照GB 29922—2013,向其中分别加入一定量的矿物质和水溶性维生素,并与含一定量油溶性维生素的大豆油以体积比96∶4混合后使以10 000 r/min转速高速剪切4 min,然后经80 MPa循环均质2次,121 ℃灭菌处理15 min得全营养乳液。全营养素乳液(g/L):酪蛋白 60, 麦芽糊精 150,大豆油 40, K2HPO4 3.07, MgSO4 1.12,CaCO3 0.17, NaCl 4.42, CuSO4 0.015 3, FeSO4 0.075 9, ZnSO4 0.063, MnSO4 0.020 4, KI 0.000 107, 亚硒酸钠 0.000 59, 维生素C 0.1, 维生素B1 0.002, 维生素B2 0.002, 维生素B6 0.002, 维生素B12 0.000 003,烟酸 0.005,叶酸 0.000 53,泛酸 0.007,生物素 0.000 05,维生素A 0.002 7,维生素E 0.01。
1.3.2 贮藏实验
将全营养乳液置于20、30、40 ℃恒温培养箱贮藏,每隔30 d取样测定粒径、电位、离心沉淀率、色差、pH、维生素C、维生素E和感官评分。
1.3.3 感官评分
邀请15名具有丰富经验的感官评定成员组成评价小组,对全营养乳液的组织状态、色泽、气味及口感4个指标进行感官评定,满分为100分,以平均值作为评定结果。参考标准见表1。
表1 全营养乳液感官评鉴参考标准
Table 1 Sensory evaluation standards of total nutrient emulsions

感官指标评分标准分值/分组织状态(30分)组织均匀,无脂肪上浮,无分层,无沉淀25~30少量脂肪上浮现象,无沉淀15~25有分层和少量沉淀5~15严重脂肪分层及明显沉淀0~5色泽(10分)呈均一的乳白色或微偏黄,光泽好8~10色泽均匀,淡黄色,略有光泽4~7色泽不均匀,黄褐色,无光泽0~3气味(30分)乳香味浓厚,无任何异味20~30乳香味稍淡,无明显异味10~20出现明显异味,无法接受0~10口感(30分)口感细腻爽滑,无涩味20~30无明显涩味,口感一般,略有粗糙10~20粗糙有涩味,口感单薄0~10
1.3.4 粒径电位测定
使用激光粒度分析仪测定全营养乳液平均粒径及分布情况,常温下取0.5 mL样品于测定池内并用去离子水进行分散,分散剂和颗粒的折射率分别为1.33和1.59。将样品溶液用去离子水稀释100倍,使用多角度粒度与高灵敏度Zeta电位分析仪在25 ℃下测其Zeta电位[7-8]。
1.3.5 离心沉淀率测定
准确称量10 mL全营养乳液倒入15 mL的干燥离心管内,将装有样品的离心管在4 000 r/min离心20 min,离心完成后小心取出离心管,将液体部分完全倒出。离心沉淀率的计算如公式(1)所示:
离心沉淀率![]()
(1)
式中:m1,单独离心管的质量,g;m2,装有样品乳液的离心管的质量,g;m3,离心后沉淀物和离心管质量总和,g[9]。
1.3.6 色泽测定
使用高精度分光测色仪分析不同贮藏温度对全营养乳液色泽的影响,记录L*、a*和b*值(平行测定5 次)。L*为亮度值,L*值越大色泽越亮;a*为绿色/红色值,正值方向表示红色增加;b*为蓝色/黄色值,正值方向表示黄色增加;样品色泽变化采用ΔE来表示,其值越小代表色泽变化越小,计算如公式(2)所示:
(2)
1.3.7 pH测定
利用pH计在25 ℃下测定全营养乳液的pH值,实验重复3次。
1.3.8 维生素含量的测定
采用GB 5009.86—2016《食品安全国家标准 食品中抗坏血酸的测定》中的2,6-二氯靛酚滴定法测定全营养乳液中维生素C含量;采用GB 5009.82—2016《食品安全国家标准 食品中维生素A、D、E的测定》中的第一法测定全营养乳液中维生素E含量。
1.3.9 全营养乳液贮藏期间反应动力学和热力学参数
相关研究证实,大多数营养物质发生降解反应的动力学模型基本上符合零级或一级动力学反应模型[10]。相关方程如下,其中公式(3)为零级动力学模型,公式(4)为一级动力学模型。
f(c)=f(c0)-kt
(3)
f(c)=f(c0)exp(-kt)
(4)
式中:f(c),t时刻1 mL溶液中所含反应物的质量,mg;f(c0),反应初始时刻1 mL溶液中反应物的质量,mg;t,反应进行时间,d;k,反应物在贮藏保质期外界环境温度下的对应降解速率常数。
反应物消耗一半时对应的质量(mg)可用f(c0)/2来表示,此时反应的半衰期为t1/2,即反应物被完全消耗所需时间的一半。根据公式(3)和公式(4),零阶和一阶反应的半衰期可分别用公式(5)和公式(6)表示:
t1/2=f(c0)/2k
(5)
t1/2=ln2/k
(6)
Arrhenius经验公式能反映不同温度下的反应速率常数k随温度的变化规律,如公式(7)所示:
K=A×exp(-Ea/RT)
(7)
式中:A和Ea分别为频率因子和活化能,均为不随反应物含量浓度与反应温度变化而改变的固定值;R,气体常数, 8.314 J/(mol·K);T,开氏温标,K。
为了对相关反应机理进一步研究,根据绝对反应速率理论计算全营养乳液贮藏期的相关热力学参数,计算如公式(8)~公式(10)所示:
ΔH=Ea-RT
(8)
ΔS=R[lnK-ln(Kb/h)-lnT-1]+Ea/T
(9)
ΔG=ΔH-TΔS
(10)
式中:Kb,Boltzmann常数, 1.38×10-23 J/K;h,Plank常数, 6.626×10-34J·s。
1.3.10 数据分析
所有实验均独立重复3次,数据以平均值±标准偏差表示。采用SPSS 25.0 Duncan法分析处理组之间的显著性差异(P<0.05)。所有图形处理均由Origin 2021软件完成。
2 结果与分析
2.1 全营养乳液贮藏期间感官评价得分的变化
由图1可知,全营养乳液的感官评价得分随着贮藏时间的增加而逐渐降低,且温度越高,评分下降速率越快。贮藏后期全营养乳液会出现轻微的乳析,可接受性分数减小。不同贮藏温度下全营养乳液的色泽具有差异,与高温促进褐变反应的发生有关。气味方面,随着贮藏温度的增加,油脂氧化反应和美拉德氧化产生的糠醛类物质使全营养乳液哈喇味较明显;口感方面,较高温度贮藏下的全营养乳液有明显的颗粒感和稠厚感,可能是由于高温导致液滴的布朗运动加快,颗粒间的碰撞机会增加,粒径增大所导致。
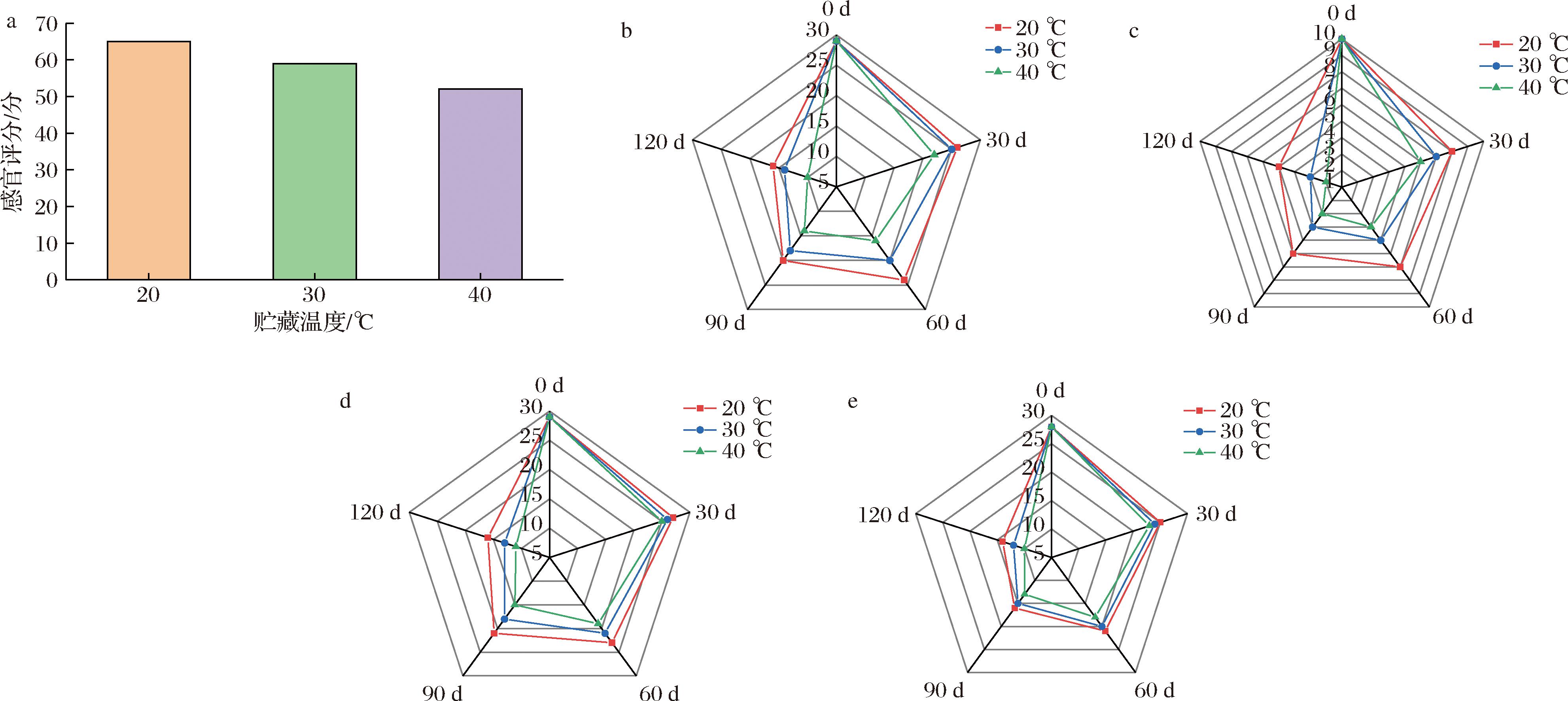
a-总感官评分;b-组织状态评分;c-色泽评分;d-气味评分;e-口感评分
图1 贮藏过程中全营养乳液感官品质变化情况
Fig.1 Sensory quality changes of total nutrient emulsions in storage process
2.2 全营养乳液贮藏期间色泽的变化
乳液的色度影响其感官特性,一般来说,颜色较浅的乳液更容易受消费者青睐。全营养乳液在贮藏过程中的颜色变化如图2所示,a*、b*值均为正数且随着贮藏时间的延长呈现增加趋势,说明全营养乳液整体颜色向黄红偏移。贮藏后期,结合L*与ΔE分析,全营养乳液的颜色亮度减弱。贮藏120 d后,20 ℃贮藏温度下的a*、b*较贮藏初期分别增加了40.33%和18.22%,L*、ΔE分别减小了8.91%和8.56%;30 ℃贮藏温度下的a*、b*分别增加了49.72%和29.31%,L*、ΔE分别减小了14.91%和9.77%;40 ℃贮藏温度下的a*、b*分别增加了70.17%和35.84%,L*、ΔE分别减小了23.55%和17.18%。a*值增幅明显,说明贮藏过程中非酶褐变引起的a*值变化是导致全营养乳液色泽下降的主要原因。

a-a*;b-b*;c-L*;d-ΔE*
图2 贮藏过程中全营养乳液色泽变化情况
Fig.2 Sensory quality changes of total nutrient emulsions in storage process
注:不同字母表示差异显著(P<0.05)。
2.3 全营养乳液贮藏期间粒径的变化
如表2所示,随着温度的升高和贮藏时间的延长,各粒径参数均有不同程度的增加,且贮藏温度越高,变化越大。其中,参数D10、D50和D90分别代表当被测试样的累积颗粒尺寸分布数目为10%,50%和90%时相应的颗粒尺寸。由表2可知,贮藏过程中全营养乳液的粒径参数D90相较于D10、D50增幅较大,D10和D50分别在9.19~16.24 μm和19.06~40.24 μm范围内波动,而D90的变化幅度大于70 μm。有研究报道,影响体积平均粒径(D[4,3])与面积平均粒径(D[3,2])的颗粒大小不同,D[4,3]受大颗粒的影响较大,D[3,2]受小颗粒的影响较大。全营养乳液在整个贮藏期D[4,3]均大于D[3,2],说明乳液粒径受大颗粒的影响较大,故而选取D[4,3]来反映全营养乳液平均粒径的大小。从整个贮藏过程来看,经20 ℃贮藏120 d后全营养乳液的平均粒径从18.24 μm增至32.32 μm,增加了77.19%,在30、40 ℃贮藏120 d后平均粒径分别增至39.11 μm和46.83 μm,分别增加了114.42%和156.74%。全营养乳液中的酪蛋白在贮藏过程中可能会与麦芽糊精发生碰撞并经共价交联或非共价结合形成较大颗粒的聚集物,导致体系粒径增大[11]。
表2 不同贮藏温度下全营养乳液粒度参数的变化
Table 2 Particle size parameter changes of total nutrient emulsions stored at different temperatures
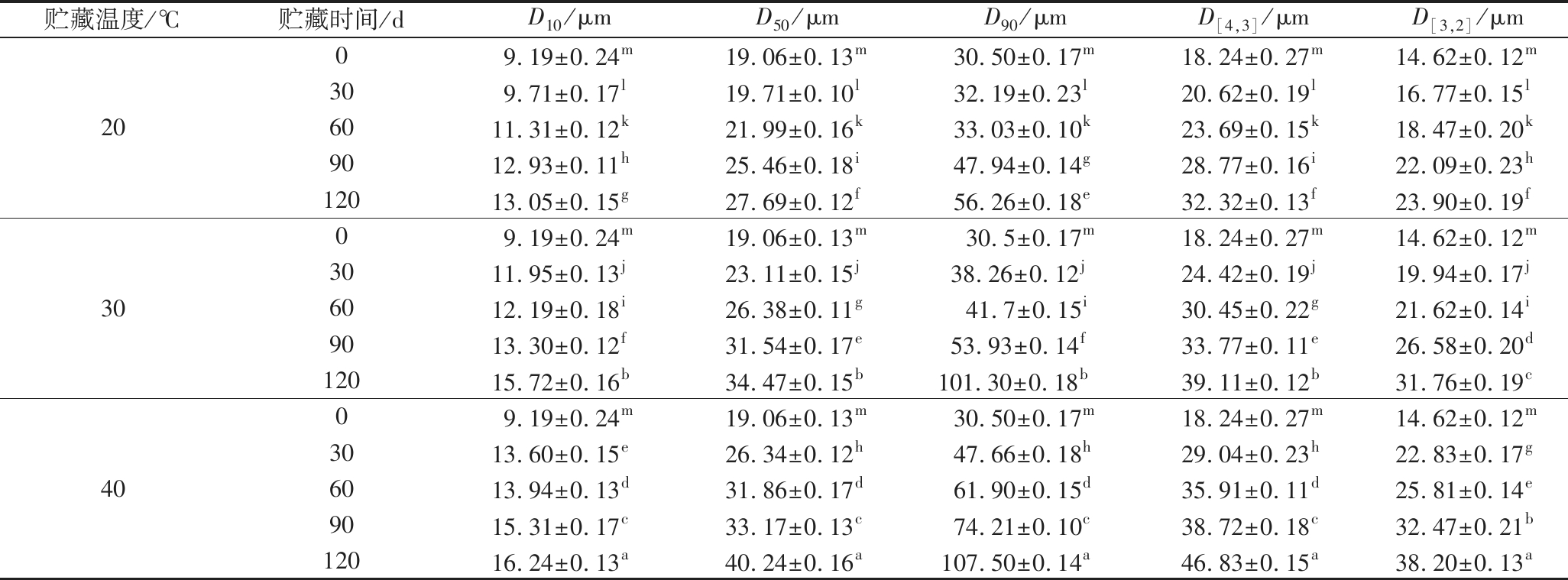
贮藏温度/℃贮藏时间/dD10/μmD50/μmD90/μmD[4,3]/μmD[3,2]/μm2009.19±0.24m19.06±0.13m30.50±0.17m18.24±0.27m14.62±0.12m309.71±0.17l19.71±0.10l32.19±0.23l20.62±0.19l16.77±0.15l6011.31±0.12k21.99±0.16k33.03±0.10k23.69±0.15k18.47±0.20k9012.93±0.11h25.46±0.18i47.94±0.14g28.77±0.16i22.09±0.23h12013.05±0.15g27.69±0.12f56.26±0.18e32.32±0.13f23.90±0.19f3009.19±0.24m19.06±0.13m30.5±0.17m18.24±0.27m14.62±0.12m3011.95±0.13j23.11±0.15j38.26±0.12j 24.42±0.19j19.94±0.17j6012.19±0.18i26.38±0.11g41.7±0.15i30.45±0.22g21.62±0.14i9013.30±0.12f31.54±0.17e53.93±0.14f 33.77±0.11e26.58±0.20d12015.72±0.16b34.47±0.15b101.30±0.18b 39.11±0.12b31.76±0.19c4009.19±0.24m19.06±0.13m30.50±0.17m18.24±0.27m14.62±0.12m3013.60±0.15e26.34±0.12h47.66±0.18h29.04±0.23h22.83±0.17g6013.94±0.13d31.86±0.17d61.90±0.15d35.91±0.11d25.81±0.14e9015.31±0.17c33.17±0.13c74.21±0.10c38.72±0.18c32.47±0.21b12016.24±0.13a40.24±0.16a107.50±0.14a46.83±0.15a38.20±0.13a
注:不同字母表示差异显著(P<0.05)。
由图3可知,全营养乳液在不同贮藏温度下的第0、30、60天粒径分布较均匀,均呈现单峰分布,随着贮藏时间的延长,第90天开始峰变为双峰,且最大体积峰向右迁移。20 ℃贮藏温度下,前期(0~60 d)全营养乳液颗粒粒度分布范围分别集中在1.64~44 μm、6.42~52.32 μm和6.54~124.4 μm。贮藏90 d时双峰分别出现在18.5 μm和37 μm处,最大体积峰由1.64~44 μm移至31.11~87.99 μm,120 d时粒度分布范围由7.78~87.99 μm变成7.78~148 μm,最大体积峰的占比由50.2%增加至89.96%,说明颗粒的粒度在向更大范围迁移;30 ℃贮藏温度下,前期(0~60 d)全营养乳液颗粒粒度分布范围分别集中在1.64~44 μm、6.54~73.99 μm和6.54~104.6 μm。贮藏90 d时双峰分别出现在3.27 μm和52.32 μm处,最大体积峰由1.64~44 μm移至13.08~176 μm,120 d时出现一个新的148~209.3 μm粒径分布,且体积分数达到11.44%;40 ℃贮藏温度下,前期(0~60 d)全营养乳液颗粒粒度分布范围分别集中在1.64~44 μm、6.54~104.6 μm和7.78~176 μm。贮藏90 d时,粒径分布出现三峰,且31.11~52.32 μm粒径区间分布颗粒增多,120 d时粒度分布范围由11~73.99 μm变成9.25~248.9 μm,峰的数量增至四峰,颗粒大小不均匀性进一步提高。
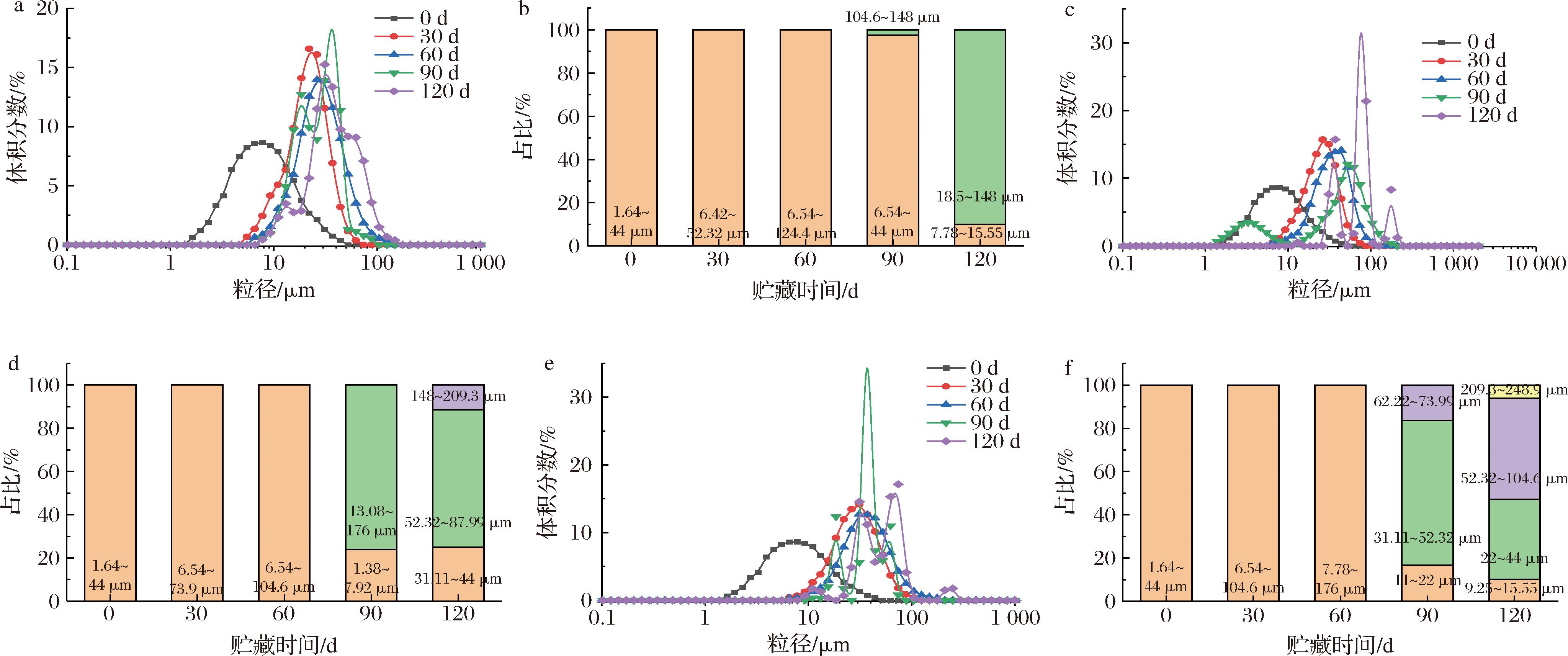
a-20 ℃粒径分布情况;b-20 ℃各粒径峰分布范围;c-30 ℃粒径分布情况;d-30 ℃各粒径峰分布范围;e-40 ℃粒径分布情况;f-40 ℃各粒径峰分布范围
图3 不同贮藏温度下全营养乳液粒径分布的变化
Fig.3 Particle size distribution changes of total nutrient emulsions stored at different temperatures
2.4 全营养乳液贮藏期间Zeta电位的变化
一般来说,表征液滴表面电荷性质的Zeta电位的绝对值越大,油滴间静电排斥作用越大,这样能够防止液滴之间的相互接近和聚集,保持乳液体系的稳定。如图4所示,随着贮藏时间和贮藏温度的增加,全营养乳液的Zeta电位绝对值均呈减小趋势。全营养乳液在20、30、40 ℃贮藏下Zeta电位的绝对值分别减小了27.36%、34.76%和48.31%,高温环境下油水界面蛋白等乳化分子的热流动性增加,它们更容易从液滴界面逃逸,分布在液滴界面上的同种电荷数量减小,削弱了静电斥力,促进了液滴之间的聚结,稳定性下降[12]。贮藏后期的电位绝对值仍大于30 mV,表明所制全营养乳液的贮藏稳定性相对较强。
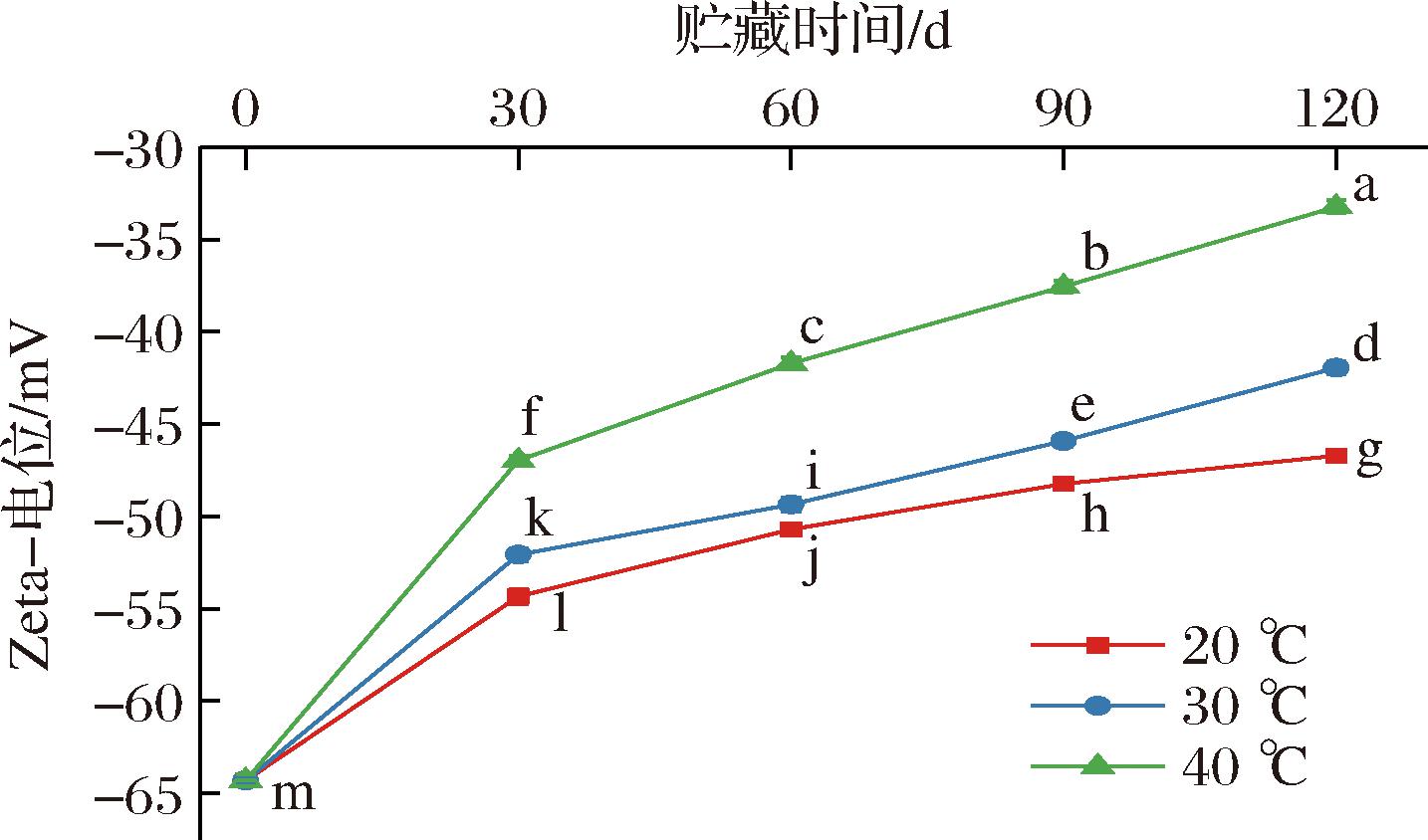
图4 不同贮藏温度下全营养乳液Zeta电位的变化
Fig.4 Zeta potential changes of total nutrient emulsions stored at different temperatures
2.5 全营养乳液贮藏期间离心沉淀率的变化
离心沉淀率与乳液稳定性成反比关系,数值越大,体系内大颗粒数目越多且发生聚集的可能性越大。如图5所示,随着贮藏期的延长,离心沉淀率在贮藏期前期(0~30 d)变化较为缓慢,贮存期第31~90天离心沉淀率剧烈变化且幅度较大,分别从3.23%(20 ℃)、4.12%(30 ℃)和4.89%(40 ℃)上升至8.72%、11.64%和14.55%,贮藏期后期(91~120 d)离心沉淀率变化曲线相对平稳。此时,全营养乳液有少量脂肪上浮和轻微沉淀现象。综上可知,不同贮藏条件下的全营养乳液离心沉淀率随着温度的升高而增大,高温加速了乳液中酪蛋白酸钠和麦芽糊精等大分子物质的运动速度,使得颗粒间碰撞几率大幅度增加,发生聚集并在重力的作用下产生沉淀。
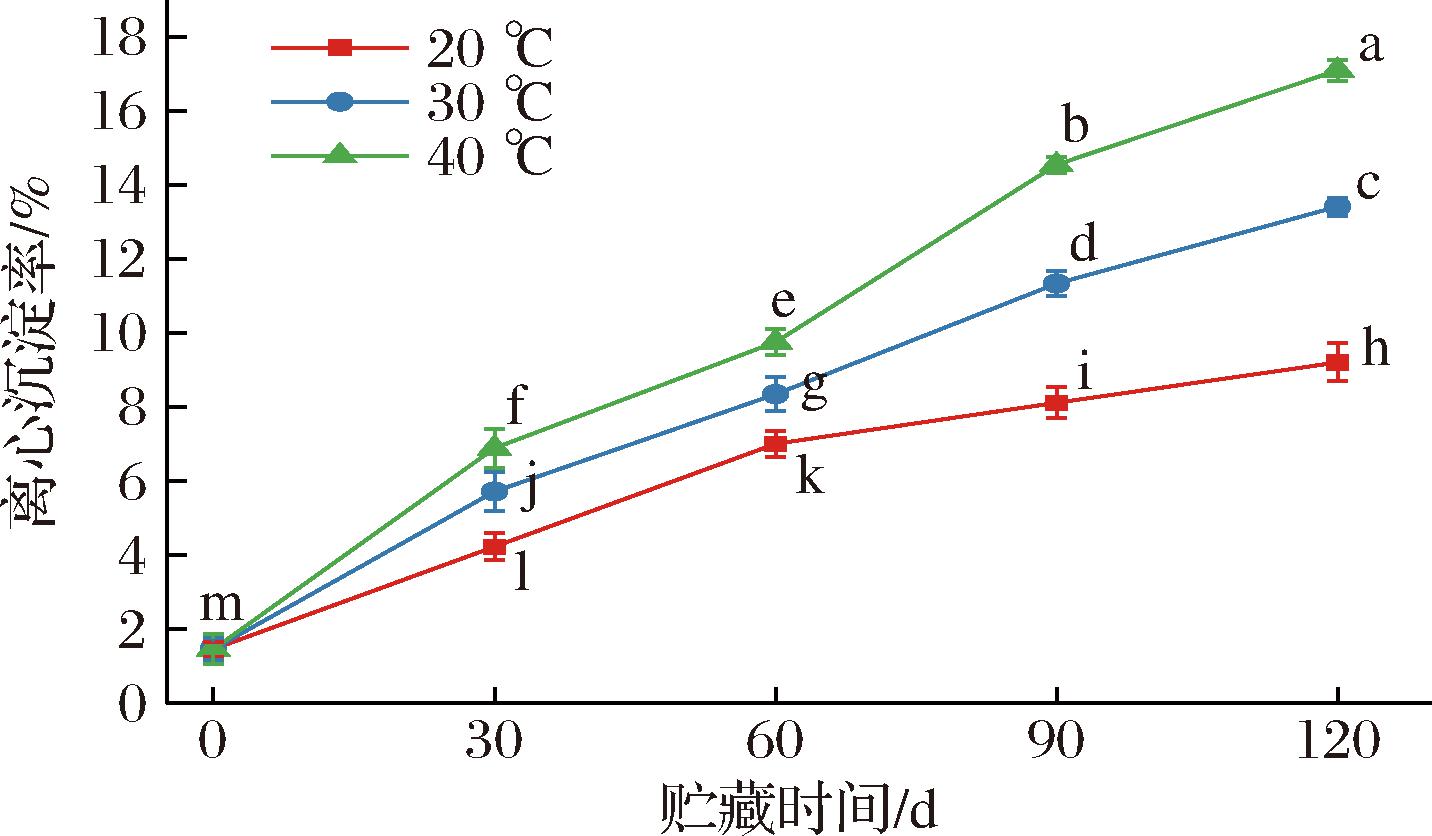
图5 不同贮藏温度下全营养乳液离心沉淀率的变化
Fig.5 Centrifugal sedimentation change of total nutrient emulsions stored at different temperatures
2.6 全营养乳液贮藏期间pH的变化
如图6所示,经高温灭菌后的新鲜全营养乳液的pH值为6.61,在20、30、40 ℃下贮藏120 d后,pH值分别下降至6.23、6.17、6.11,即全营养乳液的pH在不同贮藏温度下均呈下降趋势。造成全营养乳液在贮藏期间pH下降的原因与脂肪氧化水解导致的氧化酸败有关,除此之外,全营养乳液体系中的残余酶的存在促进蛋白和脂肪分别被分解为游离氨基酸和脂肪酸[13]。在相同的贮藏时间下,高温贮藏下的全营养乳液的pH较低。乳基中残留的脂肪酶和蛋白酶的酶解反应速率随着贮藏温度的升高而逐渐增加,游离脂肪酸含量增加。同时,高温会加快美拉德反应的发生,碱性氨基酸与还原糖的Maillard反应使乳液中的碱性氨基酸浓度下降,加剧了全营养乳液pH的下降。
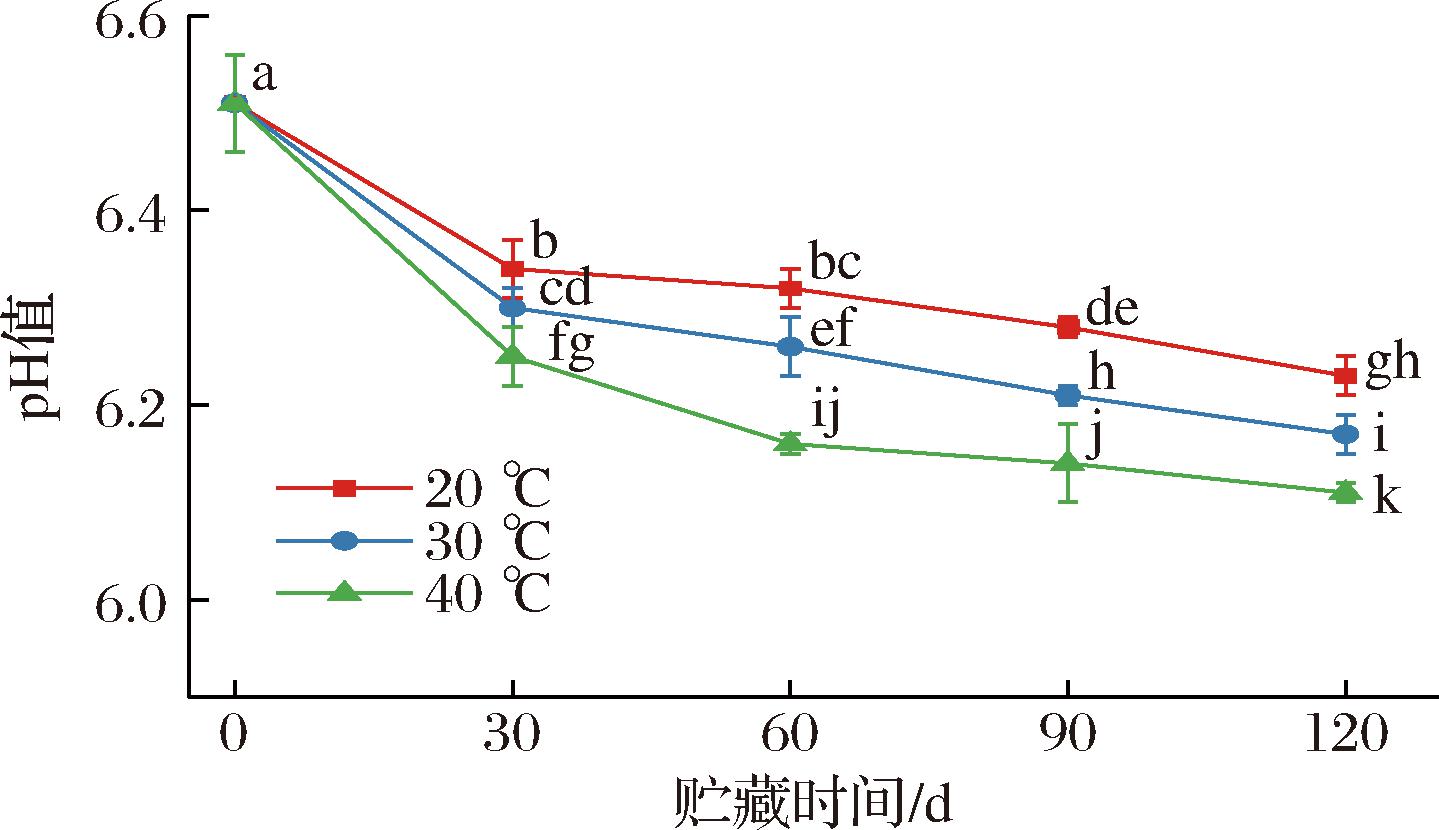
图6 不同贮藏温度下全营养乳液pH的变化
Fig.6 pH trend of total nutrient emulsions stored at different temperatures
2.7 全营养乳液贮藏期间维生素C含量的变化
维生素C作为人体必须的营养素之一,在抗氧化、解毒、提高机体免疫功能等方面具有重要意义[14]。因此,研究维生素C在贮藏期间的含量变化及其降解规律有利于评价全营养乳液的营养价值。在不同温度下对全营养乳液进行了维生素C含量测定,并对其含量变化规律进行了研究。由图7可知,在不同的贮藏时间下,所有全营养乳液中的维生素C含量都有下降的趋势,并且随着贮藏温度的增加,其降解速度也加快。表3显示了全营养乳液中维生素C保留率在不同贮藏温度下的变化情况,在20 ℃的贮藏条件下,贮藏期终点全营养乳液中的维生素C保留率为51.77%,分别是30 ℃和40 ℃的1.15倍和1.51倍,即维生素C的保留率随温度的升高而逐渐降低,这可能是因为温度升高使得维生素C与某些单糖间的网状缔合被破坏,反应活化能降低,维生素C脱氢水解并聚合形成其他无营养活性的产物[15]。
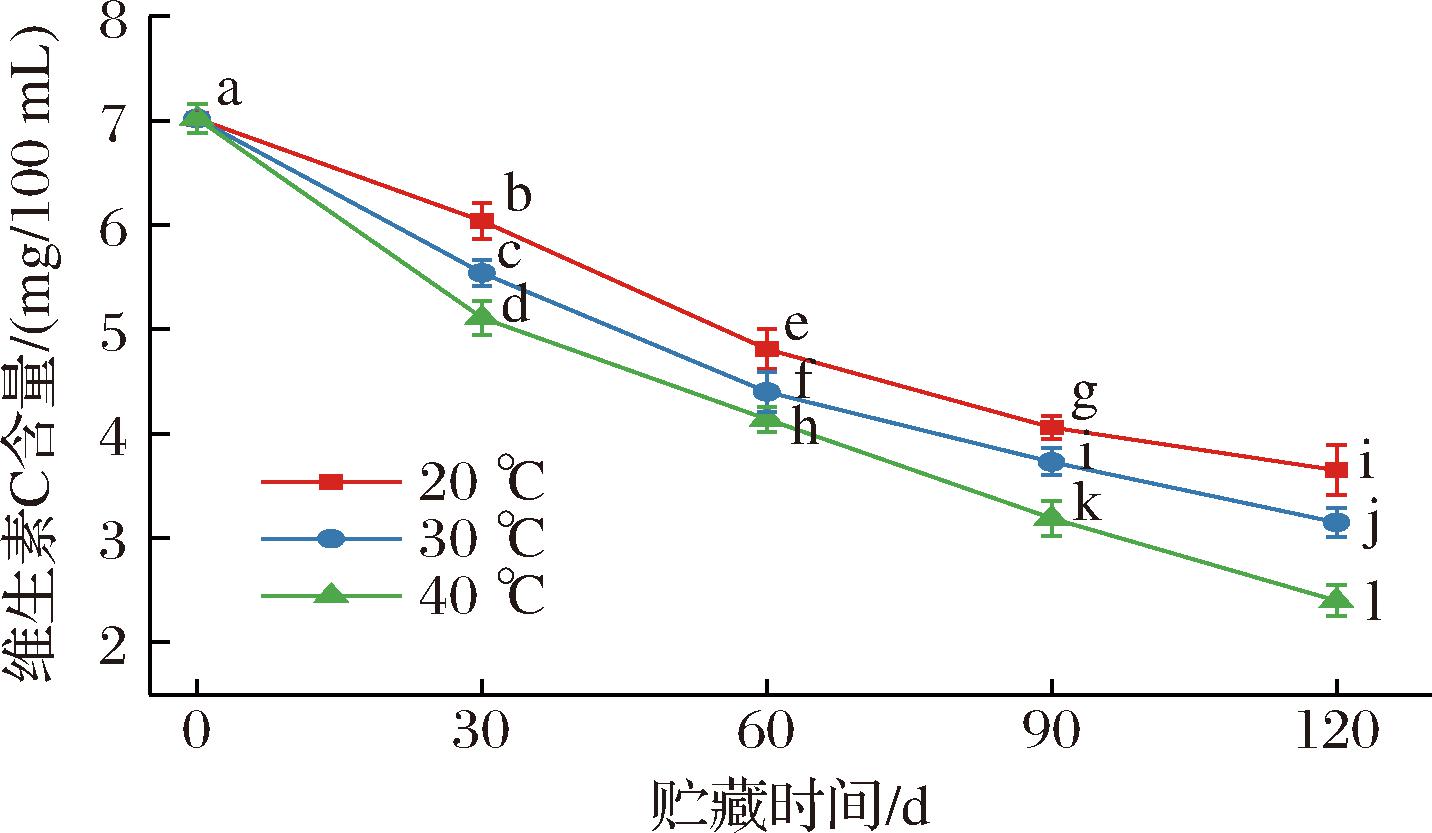
图7 不同贮藏温度下全营养乳液维生素C含量的变化
Fig.7 Vitamin C content changes of total nutrient emulsions stored at different temperatures
表3 不同贮藏温度下全营养乳液维生素C保留率的变化
Table 3 Changes of vitamin C preservation rate of total nutrient emulsions stored at different temperatures
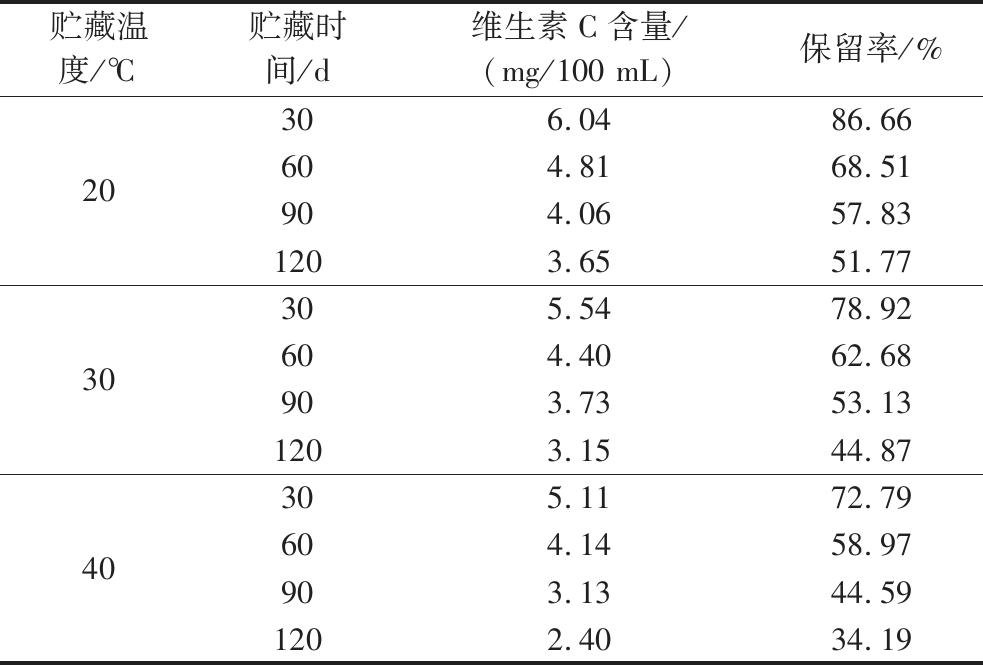
贮藏温度/℃贮藏时间/d维生素C含量/(mg/100 mL)保留率/%20306.0486.66604.8168.51904.0657.831203.6551.7730305.5478.92604.4062.68903.7353.131203.1544.8740305.1172.79604.1458.97903.1344.591202.4034.19
假定全营养乳液中维生素C降解过程分别满足零级和一级动力学,基于全营养乳液维生素C残留率随时间变化的规律计算了不同贮藏温度下维生素C降解速率对应级数,对数据作线性回归而求出相关系数,结果见表4。在某一温度范围内,一般采取反应降解速率常数来表征其降解速度,相关系数R2来推测反应级数,选取R2较大的反应级数来描述降解反应。由表4可知,随着贮藏温度的升高,全营养乳液中维生素C降解速率从0.023 3和0.004 8分别增加至0.030 5和0.008 5,呈上升趋势。根据各贮藏温度下的相关系数R2,不同贮藏温度下全营养乳液中维生素C的降解均符合一级反应。
表4 全营养乳液中维生素C在不同温度下的降解反应速率常数及相关系数
Table 4 Degradation rate constants and correlation coefficients of vitamin C in total nutrient emulsions at different storage temperatures
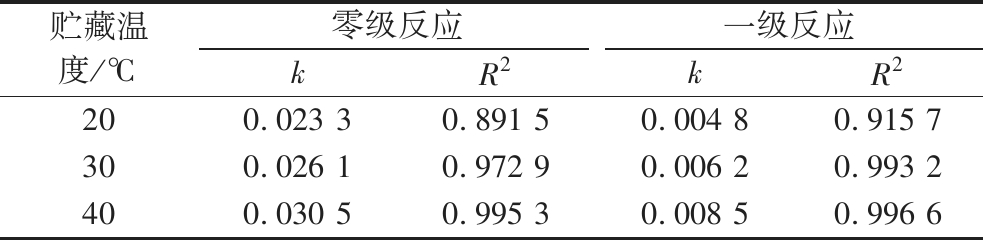
贮藏温度/℃零级反应一级反应kR2kR2200.023 30.891 50.004 80.915 7300.026 10.972 90.006 20.993 2400.030 50.995 30.008 50.996 6
根据一级反应动力学,根据计算分别得到不同贮藏温度下全营养乳液中维生素C的降解动力学方程及半衰期,如表5所示。随着贮藏温度的增加,全营养乳液中维生素C的半衰期从144 d降低至81 d,即温度越高,半衰期越短。
表5 全营养乳液中维生素C降解动力学方程及半衰期
Table 5 Kinetic equation of vitamin C in total nutrient emulsions and half-life period at different storage temperatures

贮藏温度/℃动力学方程半衰期/d20lnc=ln7.02-0.004 8t14430lnc=ln7.02-0.006 2t11240lnc=ln7.02-0.008 5t81
从表5中得到不同温度下一级反应的速率常数k,根据Arrhenius方程,将一级反应的速率常数对数ln k与储藏温度的倒数1/T作图并进行线性拟合,如图8所示。
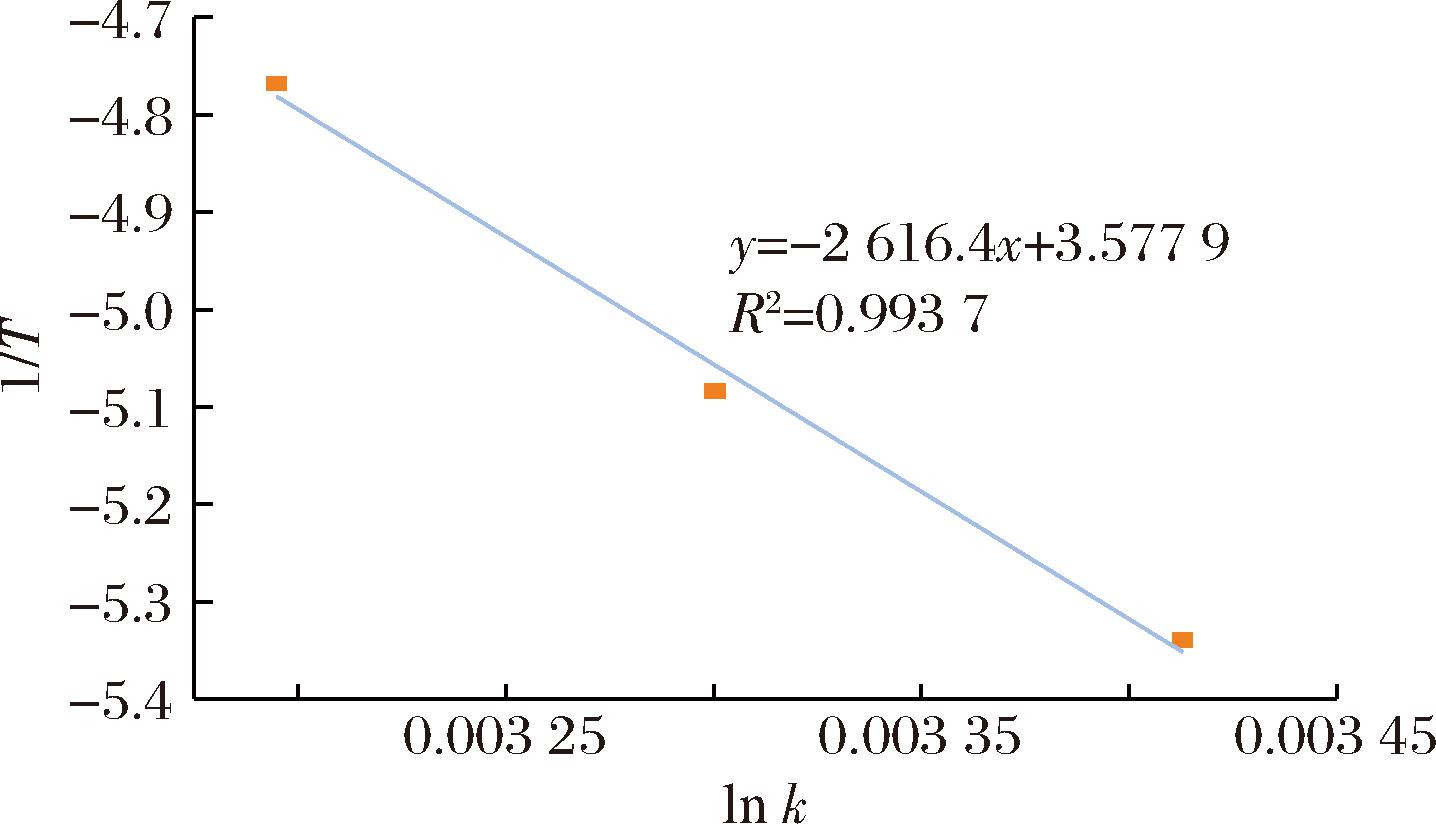
图8 全营养乳液中维生素C降解速率与温度的关系图
Fig.8 Relationship between degradation rate of vitamin C in total nutrient emulsions and temperature
全营养乳液中维生素C分解的回归方程为y=261 6.4x+3.577 9,R2=0.993 7。直线的斜率和截距分别为-Ea/R和ln A,求得储藏期间全营养乳液中维生素C反应的活化能Ea和频率系数A分别为21.75 kJ/mol和35.8 h-1。化学反应的活化能通常在40~400 kJ/mol。活化能Ea的大小与反应进行的难易程度有关,当Ea<40 kJ/mol时,降解反应速率很快;当Ea>400 kJ/mol时,降解反应速率非常慢。综上可知,全营养乳液在贮藏过程中维生素C发生降解反应的速率较快[16]。
2.8 全营养乳液贮藏期间维生素E含量的变化
由图9可知,全营养乳液中维生素E的含量随贮藏时间的延长缓慢下降,含量变化曲线较平缓,贮藏120 d后含量从25.11 μg/mL分别下降至16.37、15.26、14.49 μg/mL,损失率在40%以内。这可能是由于乳液中的维生素E在贮藏过程中与存在于乳基中的矿物质离子如Cu2+、Mg2+等发生氧化还原反应速率加快导致的[17]。表6显示了全营养乳液中维生素E保留率在不同贮藏温度下的变化情况,在20 ℃的贮藏条件下,贮藏期终点全营养乳液中的维生素E保留率为65.19%,分别是30 ℃和40 ℃的1.07倍和1.13倍,相比于维生素C,维生素E含量对贮藏温度和时间的敏感性较低。维生素E含量在较高温度贮藏下下降幅度增大,这可能与乳液中油脂氧化对维生素E的消耗速率增加有关[18]。综上可知,高温条件不利于维生素E的贮存。
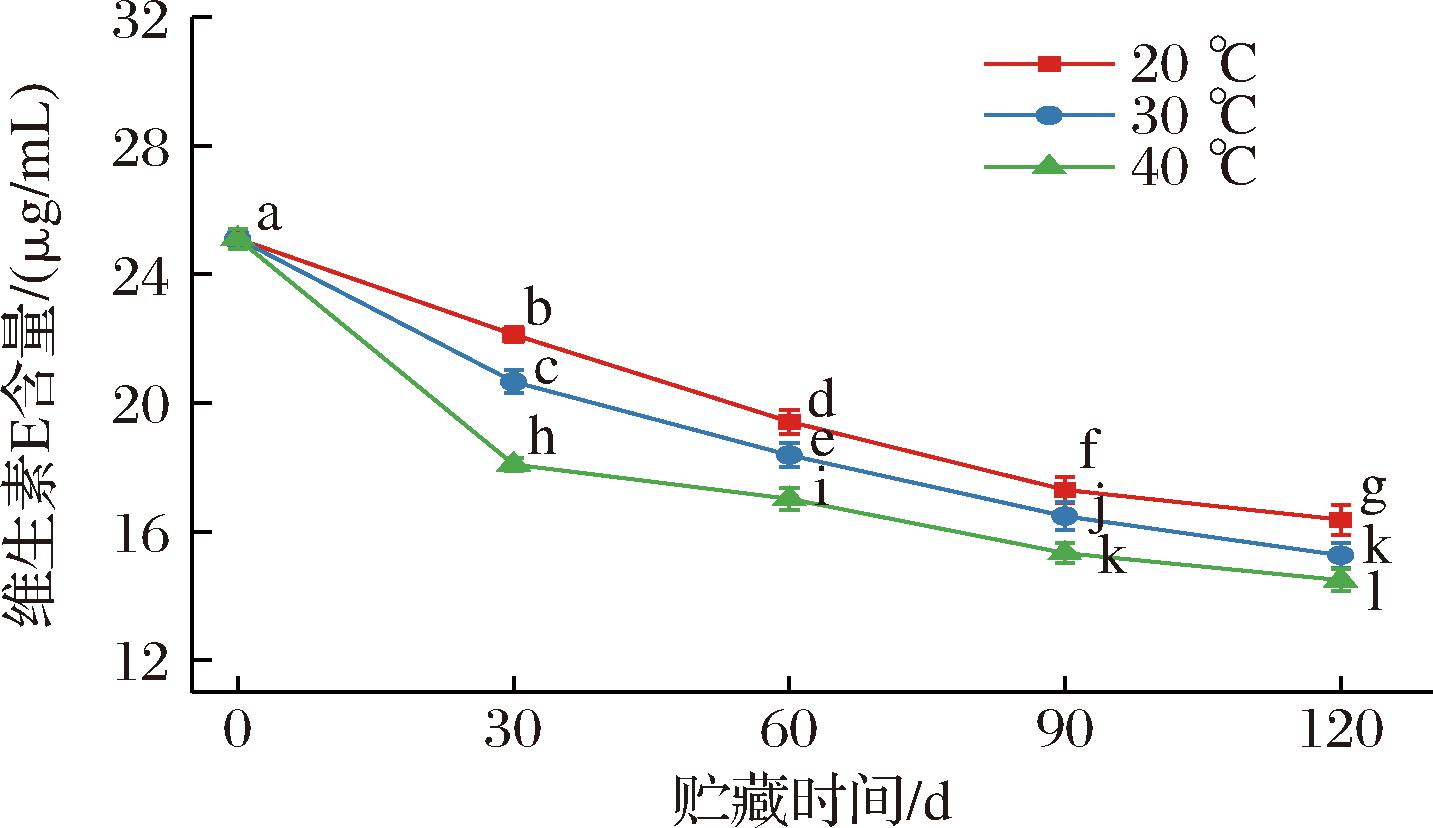
图9 不同贮藏温度下全营养乳液维生素E含量的变化
Fig.9 Vitamin E content changes of total nutrient emulsions stored at different temperatures
表6 不同贮藏温度下全营养乳液维生素E保留率的变化
Table 6 Changes of vitamin E preservation rate of total nutrient emulsions stored at different temperatures
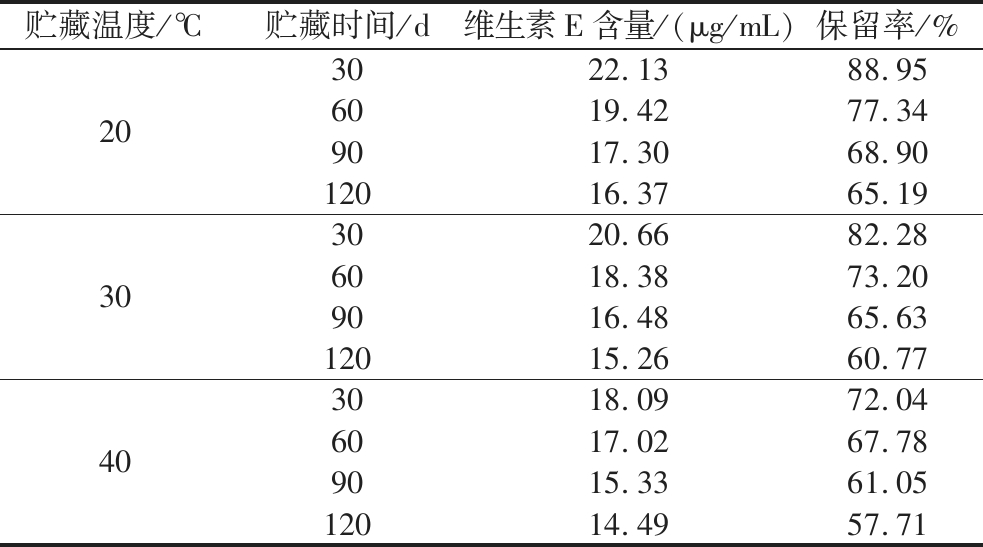
贮藏温度/℃贮藏时间/d维生素E含量/(μg/mL)保留率/%203022.1388.956019.4277.349017.3068.9012016.3765.19303020.6682.286018.3873.209016.4865.6312015.2660.77403018.0972.046017.0267.789015.3361.0512014.4957.71
2.9 全营养乳液贮藏期间理化参数回归分析
为进一步评价全营养乳液贮藏过程中理化参数的变化情况, 对理化指标随贮藏时间的变化情况进行回归分析, 确定其反应级数, 结果见表7。
表7 不同贮藏温度下全营养乳液品质变化与贮藏时间的回归分析
Table 7 Regression analysis of quality variation of total nutrient emulsions at different storage temperatures

检测指标贮藏温度/℃公式K值R2反应级数pH20y=-0.001 2x+6.385 0.001 20.967 5零级30y=-0.001 3x+6.3450.001 30.997 9零级40y=-0.001 4x+6.2750.001 40.884 2零级色差20y=-0.000 8x+0.003 9 0.000 80.958 3一级30y=-0.000 5x-0.040.000 50.979 3一级40y=-0.001 3x-0.045 90.001 30.971 3一级粒径20y=0.133 9x+6.385-0.133 90.991 6零级30y=0.158x+20.09-0.15 80.989 1零级40y=0.187 3x+23.58-0.187 30.971 9零级电位20y=-0.001 7x+0.127 5 0.001 70.973 8一级30y=-0.002 3x-0.135 40.002 30.988 7一级40y=-0.003 8x-0.200 60.003 80.999 2一级离心沉淀率20y=0.053 5x+3.13-0.053 50.938 1零级30y=0.087x+3.185-0.0870.995 4零级40y=0.118 1x+3.22-0.118 10.986零级维生素C20y=-0.004 8x-0.051 9 0.004 80.915 7一级30y=-0.006 2x-0.069 70.006 20.993 2一级40y=-0.008 5x-0.04 50.008 50.996 6一级维生素E20y=-0.003 4x-0.040 9 0.003 40.871 6一级30y=-0.003 4x-0.102 10.003 40.931 8一级40y=-0.003 6x-0.247 40.003 60.985 8一级
pH、粒径和离心沉淀率的下降遵循零级反应动力学,色差、电位、维生素C和维生素E含量的变化遵循一级反应动力学。各参数在40 ℃下的反应速率常数绝对值均高于20 ℃,如色差和维生素C在40 ℃时的K值分别比20 ℃时高了0.63和0.77倍,离心沉淀率和电位在40 ℃时K值分别为20 ℃时的2.21和2.24倍。这表明,在同一加速储藏实验中,不同物理化学参数对低温保质期的估测可能存在差异,造成各指标改变的加速因素也不尽相同,因此,不能笼统地对产品货架期进行预测。在所有进行回归分析的参数中,反映全营养乳液物理化学性质的色差、稳定性质的电位和营养品质的维生素C与贮藏时间的变化之间的联系较为紧密,色差在各温度下R2分别为0.958 3、0.979 3和0.971 3;电位在各温度下R2分别为0.973 8、0.988 7和0.999 2;维生素C在各温度下R2分别为0.915 7、0.993 2和0.996 6。因此,上述3个指标具备作为全营养乳液货架期预测指标的潜力。另外,离心沉淀率、粒径、维生素E在40 ℃时R2分别为0.986、0.971 9、0.985 8,可以更全面反映出全营养乳液在储存过程中因温度等变量因素影响下的稳定性状况。
2.10 全营养乳液稳定动力学分析
因色差、电位和维生素C含量的一级反应系数R2均高于零级反应且大于0.9,遵循一级反应动力学,故根据Arrhenius方程求出其反应活化能Ea,得到相关热力学参数ΔH、ΔS和ΔG。由表8可知,Zeta电位的活化能Ea大于色差和维生素C,色差的活化能最低。一般情况下,活化能被用来界定一个反应发生时所需跨越的能量障碍,它与反应发生的容易程度成反比,活化能越低,反应发生的概率越高[19-20]。色差发生改变所需要的能量最少,反应较易进行。ΔH的正负能够判断反应属于吸热反应还是放热反应,当ΔH>0时,物质从外界吸收热量温度升高,为吸热反应;ΔH<0时,为放热反应。全营养乳液的色差、电位和维生素C发生改变的ΔH均大于0,说明发生了吸热反应。全营养乳液色差、电位和维生素C的吉布斯自由能ΔG范围为84.77~94.12 kJ/mol,依赖于温度的变化,随着温度的增加呈上升趋势。吉布斯自由能可以判断反应发生的方向,因ΔH>0,ΔS<0,故所发生的反应在所有温度下均不能自发进行[21]。
表8 全营养乳液品质动力学和热力学参数
Table 8 Kinetic and thermodynamic parameters of total nutrient emulsions
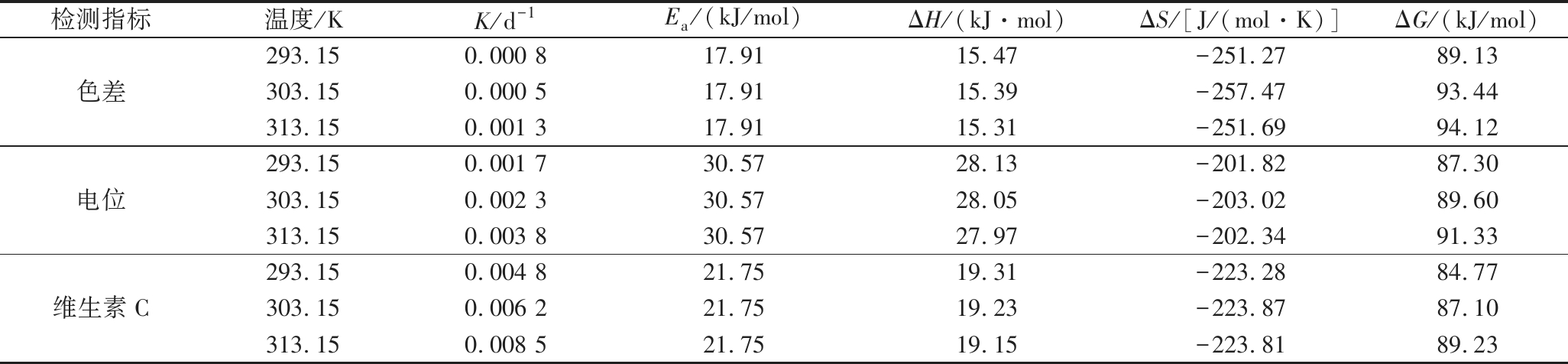
检测指标温度/KK/d-1Ea/(kJ/mol)ΔH/(kJ·mol)ΔS/[J/(mol·K)]ΔG/(kJ/mol)色差293.150.000 817.9115.47-251.2789.13303.150.000 517.9115.39-257.4793.44313.150.001 317.9115.31-251.6994.12电位293.150.001 730.5728.13-201.8287.30303.150.002 330.5728.05-203.0289.60313.150.003 830.5727.97-202.3491.33维生素C293.150.004 821.7519.31-223.2884.77303.150.006 221.7519.23-223.8787.10313.150.008 521.7519.15-223.8189.23
3 结论
本文研究了不同贮藏温度下全营养乳液品质变化情况,同时对贮藏过程中相关理化参数进行回归性分析并研究了稳定动力学。贮藏温度是影响全营养乳液品质变化的重要指标。随着贮藏时间的延长,平均粒径和离心沉淀率增加,电位绝对值和亮度减弱。维生素C对温度的敏感性高且降解符合一级反应,反应活化能为21.75 kJ/mol。色差、电位、维生素C含量的变化遵循一级反应动力学且R2均大于0.9,ΔH>0,ΔS<0,ΔG变化范围为84.77~94.12 kJ/mol,后续可作为全营养乳液货架期预测模型的参考指标。
[1] ESCURO A A, HUMMELL A C.Enteral formulas in nutrition support practice:Is there a better choice for your patient?[J].Nutrition in Clinical Practice:Official Publication of the American Society for Parenteral and Enteral Nutrition, 2016, 31(6):709-722.
[2] MCCLEMENTS D J.Food Emulsions:Principles, Practices, and Techniques[M].Third edition.Boca Raton:CRC Press, 2016
[3] ZHANG M, FAN L P, LIU Y F,et al.Effects of proteins on emulsion stability:The role of proteins at the oil-water interface[J].Food Chemistry,2022,397:133726.
[4] WANG T, WANG N, DAI Y J,et al.Interfacial adsorption properties, rheological properties and oxidation kinetics of oleogel-in-water emulsion stabilized by hemp seed protein[J].Food Hydrocolloids,2023,137:108402.
[5] RAKSHIT M,SRIVASTAV P P.Encapsulation of hydrolysable tannin from pomegranate peel in W/O/W double emulsion:In vitro digestion, release kinetics, storage and physical stabilities[J].Food Hydrocolloids for Health,2022,2:100067.
[6] BORTNOWSKA G.Effects of composition and storage time of biopolymers-based emulsion-filled gels on the retention and release of aroma compounds:Thermodynamic and kinetic studies [J].Food Chemistry,2022,382:132308.
[7] WANG S N, YANG J J, SHAO G Q, et al.pH-induced conformational changes and interfacial dilatational rheology of soy protein isolated/soy hull polysaccharide complex and its effects on emulsion stabilization[J].Food Hydrocolloids, 2020, 109:106075.
[8] MATSUMIYA K,HORIGUCHI S,KOSUGI T,et al.Effects of heat treatment and homogenization on milk fat globules and proteins in whipping creams[J].Food Structure,2017,12:94-102.
[9] MAO F J, TU M L, FAN F J,et al.Beneficial effects of high-pressure homogenization on the dispersion stability of aqueous hydrolysate from Mytilus edulis[J].Food Science and Human Wellness,2020,9(4):394-401.
[10] CORRADINI M G,PELEG M.Prediction of vitamins loss during non-isothermal heat processes and storage with non-linear kinetic models[J].Trends in Food Science &Technology,2006,17(1):24-34.
[11] BARRERAS-URBINA C G, RAM REZ-WONG B, L
REZ-WONG B, L PEZ-AHUMADA G A, et al.Nano- and micro-particles by nanoprecipitation:Possible application in the food and agricultural industries[J].International Journal of Food Properties,2016,19(9):1912-1923.
PEZ-AHUMADA G A, et al.Nano- and micro-particles by nanoprecipitation:Possible application in the food and agricultural industries[J].International Journal of Food Properties,2016,19(9):1912-1923.
[12] YUE M, HUANG M Y, ZHU Z S, et al.Effect of ultrasound assisted emulsification in the production of Pickering emulsion formulated with chitosan self-assembled particles:Stability, macro, and micro rheological properties[J].LWT,2022,154:112595.
[13] BAGLINI RE F,TANGUY G,JARDIN J,et al.Quantitative and qualitative variability of the caseinolytic potential of different strains of Pseudomonas fluorescens:Implications for the stability of casein micelles of UHT milks during their storage[J].Food Chemistry,2012,135(4):2593-2603.
RE F,TANGUY G,JARDIN J,et al.Quantitative and qualitative variability of the caseinolytic potential of different strains of Pseudomonas fluorescens:Implications for the stability of casein micelles of UHT milks during their storage[J].Food Chemistry,2012,135(4):2593-2603.
[14] GORDON D S,RUDINSKY A J,GUILLAUMIN J,et al.Vitamin C in health and disease:A companion animal focus[J].Topics in Companion Animal Medicine,2020,39:100432.
[15] AL-ZUBAIDY M M I,KHALIL R A.Kinetic and prediction studies of ascorbic acid degradation in normal and concentrate local lemon juice during storage[J].Food Chemistry,2007,101(1):254-259.
[16] WANG D L, WANG J J, SUN J C,et al.Degradation kinetics and isomerization of 5-O-caffeoylquinic acid under ultrasound:Influence of epigallocatechin gallate and vitamin C[J].Food Chemistry,2021,12:100147.
[17] JI J, ZHANG J P, CHEN J S,et al.Preparation and stabilization of emulsions stabilized by mixed sodium caseinate and soy protein isolate[J].Food Hydrocolloids,2015,51:156-165.
[18] KRICHENE D,ALLALOUT A,MANCEBO-CAMPOS V,et al.Stability of virgin olive oil and behaviour of its natural antioxidants under medium temperature accelerated storage conditions[J].Food Chemistry,2010,121(1):171-177.
[19] LALWANI S,GLANTZ M,PAULSSON M,et al.The effect of free convection on apparent vitamin degradation kinetics[J].Food and Bioproducts Processing,2021,130:182-194.
[20] 欧红艳,赵良忠,刘婷,等.豆清饮料发酵及贮藏过程中品质变化及动力学研究[J].大豆科学,2021,40(4):528-538.
OU H Y, ZHAO L Z, LIU T,et al.Study on quality change and kinetics of soybean whey beverage during fermentation and storage[J].Soybean Science,2021,40(4):528-538.
[21] RAIM NDEZ-RODR
NDEZ-RODR GUEZ E A, LOSADA-BARREIRO S, BRAVO-D
GUEZ E A, LOSADA-BARREIRO S, BRAVO-D AZ C.Enhancing the fraction of antioxidants at the interfaces of oil-in-water emulsions:A kinetic and thermodynamic analysis of their partitioning[J].Journal of Colloid and Interface Science,2019,555:224-233.
AZ C.Enhancing the fraction of antioxidants at the interfaces of oil-in-water emulsions:A kinetic and thermodynamic analysis of their partitioning[J].Journal of Colloid and Interface Science,2019,555:224-233.