乳脂肪球膜(milk fat globule membrane, MFGM)是包裹在乳脂肪球(milk fat globule, MFG)外的复杂三层膜结构,由磷脂、鞘脂及多种蛋白质组成[1]。MFGM具有很强的乳化能力,能够稳定乳中的MFG,防止其发生絮凝和聚结[2]。此外,MFGM还具有促进婴儿对母乳和婴配乳中脂肪的消化吸收作用,对婴儿的生长发育具有重要的作用[3]。
目前,市面上大部分的婴配粉中添加的都是从牛乳中提取的天然MFGM,其生产成本高、提取工艺复杂且产量低,因而制约了其在婴配粉中的使用。有研究利用植物磷脂与乳蛋白成功制备人工MFGM,其结构和组成与牛乳MFGM非常相似,且乳化性能好,在体外模拟消化试验中能有效抵抗胃蛋白酶酶解,保护MFG在肠道内的生物活性[4]。与牛乳MFGM相比,人工MFGM具有价格低、制备工艺简单、产率高等优点[5],作为婴配粉的乳化剂和营养强化剂具有广阔的市场发展前景。
本研究拟采用前期研究制得的单层人工脂肪球膜(monolayer artificial milk fat globule membrane, MAMFGM)与双层人工脂肪球膜(bilayer artificial milk fat globule membrane, BAMFGM),将其作为乳化剂和营养强化剂加入到婴配乳预混物中,以富含天然MFGM成分的MFGM-10作对照,通过体外模拟婴儿胃肠道消化模型比较乳脂的界面组成和结构变化,以及对乳脂肪消化特性的影响,探究不同结构的人工MFGM替代牛乳MFGM的可能性。
1 材料与方法
1.1 材料与试剂
脱脂牛乳,扬州市扬大康源乳业有限公司;MFGM-10,丹麦阿拉食品原料有限公司;乳清蛋白粉(蛋白含量为80%),上海昊岳生物科技有限公司;乳糖,上海麦克林生化科技有限公司;椰子油、玉米油、菜籽油,益海嘉里金龙鱼粮油食品股份有限公司;DHA藻油、花生四烯酸(arachidonic acid,ARA)粉剂,河南赞运食品有限公司;大豆磷脂(≥95%),河南万邦实业有限公司;淡黄油,新西兰威士兰(西部)乳品合作有限公司;胆固醇(≥99%),河南华商食品添加剂有限公司。
RGE25兔胃脂酶提取物,上海益同生物科技有限公司;猪胰酶、NaCl、NaOH、无水乙醇、乙酸,国药集团化学试剂有限公司;胰蛋白酶、胃蛋白酶、十二烷基硫酸钠(sodium dodecyl sulfate,SDS),生工生物工程(上海)股份有限公司;牛胆盐、游离脂肪酸(free fatty acids, FFA)含量检测试剂盒,北京索莱宝科技有限公司;脂肪酶、18∶1 Liss Rhod PE,西格玛奥德里奇(上海)贸易有限公司;尼罗红染剂、固绿FCF染剂,上海麦克林生化科技有限公司;12.5% ExpressCast PAGE彩色凝胶快速试剂盒,新赛美生物科技有限公司。
1.2 仪器与设备
马尔文激光粒度仪,英国Malvern仪器有限公司;SPX高压均质机,上海艾研生物科技有限公司;BXP-16恒温培养箱,上海力辰邦仪器科技有限公司;Zeiss LSM 880 NLO双光子荧光共聚焦显微镜,德国蔡司公司;1510酶标仪,美国赛默飞世尔科技有限公司。
1.3 实验方法
1.3.1 人工MFGM的制备
单层人工MFGM:将大豆卵磷脂和胆固醇溶于脱脂牛乳中,制得大豆磷脂脱脂乳液。滴入融化黄油,磁力搅拌乳化得到乳状液。恒温对乳状液进行2次均质(压力分别15 MPa和10 MPa),得到的乳液中含单层膜包被的脂滴。
双层人工MFGM:将大豆卵磷脂和胆固醇溶于无水乙醇中,滴入融化黄油,旋蒸后加入0.01 mol/L pH 7.4的PBS进行水合乳化,恒温对乳状液进行2次均质(压力分别15 MPa和10 MPa),后与同体积脱脂乳混合搅拌2 h,得到的乳液中含双层膜包被的脂滴。
膜的分离提取:将原乳液离心分离出乳脂,在室温条件下用洗涤液洗涤乳脂,得到洁净乳脂肪球。对得到的乳脂肪球进行搅打破坏至油水分离,释放MFGM成分,收集酪乳。向黄油颗粒中加入同体积洗涤液反复搅打,离心回收黄油乳清。将乳清与酪乳混合,添加质量分数为0.03%的凝乳酶和0.10%的CaCl2,搅匀后4 ℃静置过夜;调节pH值至6.8,50 ℃水浴1 h后通过离心法从酪乳中除去酪蛋白,冷冻干燥即得到MFGM干物质。
1.3.2 人工MFGM成分含量测定
1.3.2.1 蛋白质含量测定[6]
采用蛋白定量测定试剂盒测定人工MFGM蛋白质含量,方法为BCA微板法。
1.3.2.2 磷脂含量测定
结合硫氰亚铁铵比色法[7]和GB 5009.87—2016《食品安全国家标准 食品中磷的测定》测定人工MFGM磷脂含量。
1.3.2.3 蛋白组成成分分析[8]
以MFGM-10作为对照,采用SDS-PAGE分析人工MFGM蛋白组成。使用12.5% ExpressCast PAGE彩色凝胶快速试剂盒对MFGM蛋白进行分离。用Tris-甘氨酸-SDS作为电泳缓冲液,上样量为5 μL,120 V恒压电泳90 min。结束后用考马斯亮蓝R-250染色1 h,后脱色至胶片背景清晰,使用凝胶成像系统成像。
1.3.3 婴配乳的制备
各组婴配乳中MFGM的添加量按1.6 g/L[9]计算。先用去离子水将MFGM充分溶解,再定容至1 L。在20 MPa 75 ℃条件下均质2次,制备婴配乳。空白组为不添加MFGM的婴配乳,对照组为添加牛乳MFGM-10的婴配乳,单层组为添加单层人工MFGM的婴配乳,双层组为添加双层人工MFGM的婴配乳。
表1 婴配乳配方(以1 L奶液计)
Table 1 Formula milk formula (1 L milk)
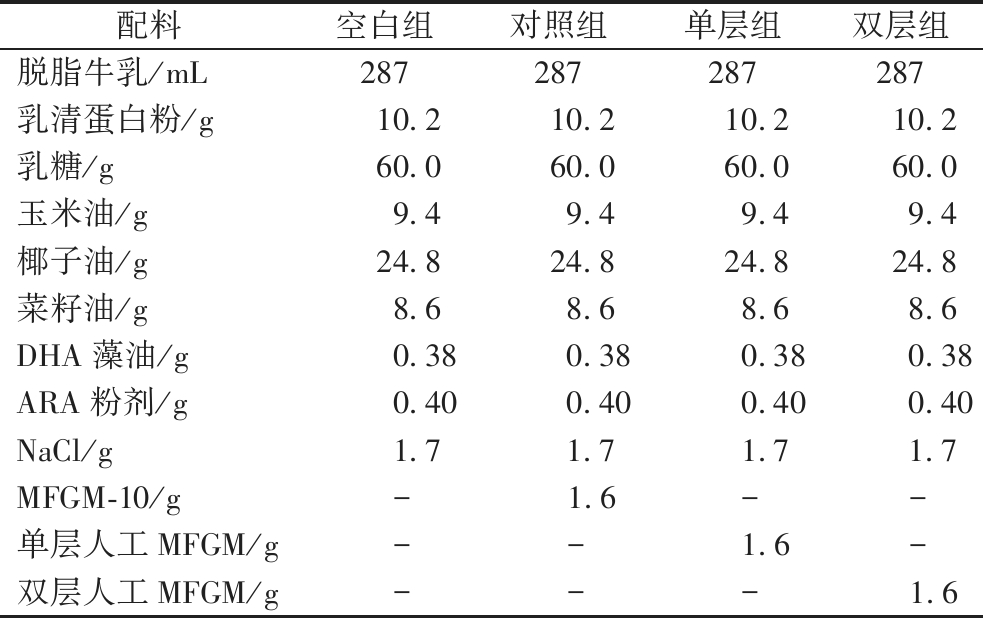
配料空白组对照组单层组双层组脱脂牛乳/mL287287287287乳清蛋白粉/g10.210.210.210.2乳糖/g60.060.060.060.0玉米油/g9.49.49.49.4椰子油/g24.824.824.824.8菜籽油/g8.68.68.68.6DHA藻油/g0.380.380.380.38ARA粉剂/g0.400.400.400.40NaCl/g1.71.71.71.7MFGM-10/g - 1.6 - -单层人工MFGM/g - - 1.6 -双层人工MFGM/g - - - 1.6
注:-为无添加。
1.3.4 模拟婴幼儿体外胃肠道消化特性的测定[9]
采用体外模拟婴幼儿胃肠道消化模型,与成人胃肠道模型的区别在于胃蛋白酶、胃脂酶、胰脂酶和胆盐的浓度以及pH值均不同。
模拟胃部消化:模拟胃液(simulated gastric fluid, SGF):由94 mmol/L NaCl溶液和13 mmol/L KCl溶液组成,胃蛋白酶的酶活性设定为268 U/mL胃内容物,脂肪酶的酶活性设定为19 U/mL。调节pH值至5.3,在37 ℃ 100 r/min摇床中保温10 min。选择市售兔胃脂酶提取物代替人胃脂酶,兔胃脂酶提取物的添加量覆盖了所需的100%的胃蛋白酶活性和110%的脂肪酶活性(21 U/mL)。
精确量取31.5 mL婴配乳,加入7.25 mL SGF,2.00 mL的猪胃脂酶储存液(95 U/mL),125 μL 30 mmol/L CaCl2溶液,加入1.125 mL去离子水定容至总体积为50 mL,空白样品(G0)用SGF代替酶储存液。之后将样品迅速放置于37 ℃ 100 r/mim摇床振荡消化60 min,分别在0 min(G0),15 min(G15),30 min(G30)和60 min(G60)各取3 mL样品进行理化性质测定。剩余38 mL样品继续用模拟肠液进行消化,通过添加1 mol/L NaOH溶液将pH值调节至7,以便在进一步肠消化前停止胃酶活性。采样后将样品置于沸水浴加热5 min,将酶灭活,并迅速将样品冷却至-80 ℃储存备用。平行样品为一式3份的独立样品。
模拟肠道消化:模拟肠液(simulated intestinal fluid, SIF):由164 mmol/L NaCl、10 mmol/L KCl和85 mmol/L NaCO3溶液组成,pH值调整为7.0。
经模拟胃液消化60 min后,每组取出12 mL样品调节pH值至6.6,与18 mL SIF以2∶3(体积分数)比例混合,先加入0.4 mL 3 mmol/L的CaCl2水溶液,再依次加入1.0 mL 3.3 mmol/L的牛胆盐储存液,10 mL猪胰酶储存液(脂肪酶活性为90 U/mL,胰蛋白酶活性为16 U/mL),最后用去离子水定容至总体积为50 mL。之后将样品迅速放置于37 ℃摇床,100 r/min振荡消化30 min,分别在5 min(I5),15 min(I15)和30 min(I30)取样。采样后将样品置于沸水浴中加热5 min,将酶灭活,并迅速将样品冷却至-80 ℃储存备用。平行样品为一式3份的独立样品。
1.3.5 婴配乳与消化液的理化性质测定
1.3.5.1 粒度分布与平均粒径[9]
在室温条件下,分别取100 μL的婴配乳、胃和肠消化不同时间的样品,加入10 mL 0.1% SDS溶液(质量分数,下同)稀释婴配乳,pH=5.3的超纯水稀释3组胃消化样品,pH=6.6的PBS稀释3组肠消化样品,在测定前加入1 mL 35 mmol/L EDTA/NaOH(pH=7.0)溶液混合1 min以沉降酪蛋白胶束。在比色皿中倒入4 mL稀释液,采用马尔文激光粒度仪分别测定婴配乳和消化液的粒度分布与平均粒径大小。
1.3.5.2 ζ-电位[9]
在室温条件下,取100 μL的婴配乳、胃和肠消化不同时间的样品,加入10 mL去离子水稀释婴配乳,pH=5.3的超纯水稀释3组胃消化样品,pH=6.6的PBS稀释3组肠消化样品,在电位池中分别加入1 mL稀释后的样品,采用马尔文激光粒度仪测定ζ-电位。
1.3.5.3 乳化稳定性
参考韩天翔等[10]实验方法,采用比浊法测定上述样品的乳化稳定性,并做适当修改。在离烧杯底部0.5 cm处取50 μL上述不同样品,加入5 mL 0.1%的SDS溶液,混匀后采用酶标仪测定500 nm处样品吸光度,以0.1%的SDS溶液作为空白对照,乳化活性指数(EAI)和乳化稳定性指数(ESI)的计算如公式(1)和公式(2)所示:
(1)
(2)
式中:EAI,乳化活性指数,m2/g;ESI,乳化稳定性指数,min;A0和A60,0 min和60 min时的吸光度;ρ,空白组婴配乳体系中的蛋白质量浓度,1.27 g/100 mL;l,光程,取0.01 m;θ,油相所占分数,取3.5%。
1.3.5.4 激光共聚焦显微镜观测(confocal laser scanning microscopy, CLSM)
各阶段消化产物的微观结构采用激光扫描共聚焦显微镜观测,He-Ar离子激光器,用10×目镜和100×油镜观测样品。样品中的脂质部分采用1 mg/mL尼罗红乙醇溶液进行染色,蛋白质部分采用1 mg/mL固绿水溶液染色30 min。尼罗红和固绿颜色设定为红色与绿色,激发波长分别为543 nm和633 nm,发射波长分别为605 nm和643 nm。拍摄单独及重叠图像,使用缩放因子将像素刻度值转换为10 μm,观察各乳状液中脂滴分散情况与絮凝现象。
1.3.5.5 游离脂肪酸含量测定
取各阶段消化液1 mL,于4 ℃,3 500 r/min离心15 min,收集尽量多的上清液并记录上清液总体积,保存至4 ℃环境待测。使用游离脂肪酸含量检测试剂盒测定,取200 μL上清液,在550 nm下测定吸光度。绘制标准曲线,得到计算公式Y=0.641 32X+0.0472 6,R2=0.999 5,计算样品FFA含量。
1.3.6 数据处理与分析
每个样品至少测量3次,结果用平均值±标准差表示,采用SPSS对数据进行统计学分析。用单因素ANOVA检验进行显著性分析。P<0.05定义为显著性差异阈值。
2 结果与分析
2.1 人工MFGM的蛋白含量与磷脂含量结果
由表2可得,2种结构人工MFGM的蛋白质含量分别为(157.40±0.15) mg/g与(39.40±2.91) mg/g;磷脂含量分别为(493.30±24.8) mg/g与(586.65±10.77) mg/g。膜结构不同因而测得的成分含量也有所差距。相较于单层膜的蛋白与磷脂穿插结构[11],双层膜呈现出乳蛋白与MFGM蛋白松散附着在磷脂双分子层上的状态,结合紧密程度低,因此在分离提取时,双层人工MFGM蛋白会出现较大程度流失;且由于双层膜主体结构为磷脂双分子层,因此磷脂含量较高。
表2 不同结构人工MFGM的蛋白质与磷脂含量
Table 2 Protein and phospholipid content of artificial MFGM with different structures

含量/(mg/g)单层人工MFGM双层人工MFGM蛋白质157.40±0.1539.40±2.91磷脂493.30±24.8586.65±10.77
2.2 人工MFGM的聚丙烯酰胺凝胶电泳分析结果
图1为不同结构人工MFGM蛋白电泳图,由图可知,相较于天然MFGM-10,人工MFGM蛋白种类较少,但更多地保留了黄嘌呤氧化酶/脱氢酶(xanthineoxidase/dehydrogenase, XO/XDH)、分化簇36(cluster of differentiation 36, CD36)、嗜乳脂蛋白(butyrophilin, BNT)、高碘酸席夫Ⅵ/Ⅶ(periodic acid Schiff Ⅵ/Ⅶ, PAS Ⅵ/Ⅶ)等能够与膜结构紧密连接的MFGM蛋白,使得成分尽可能接近MFGM-10。
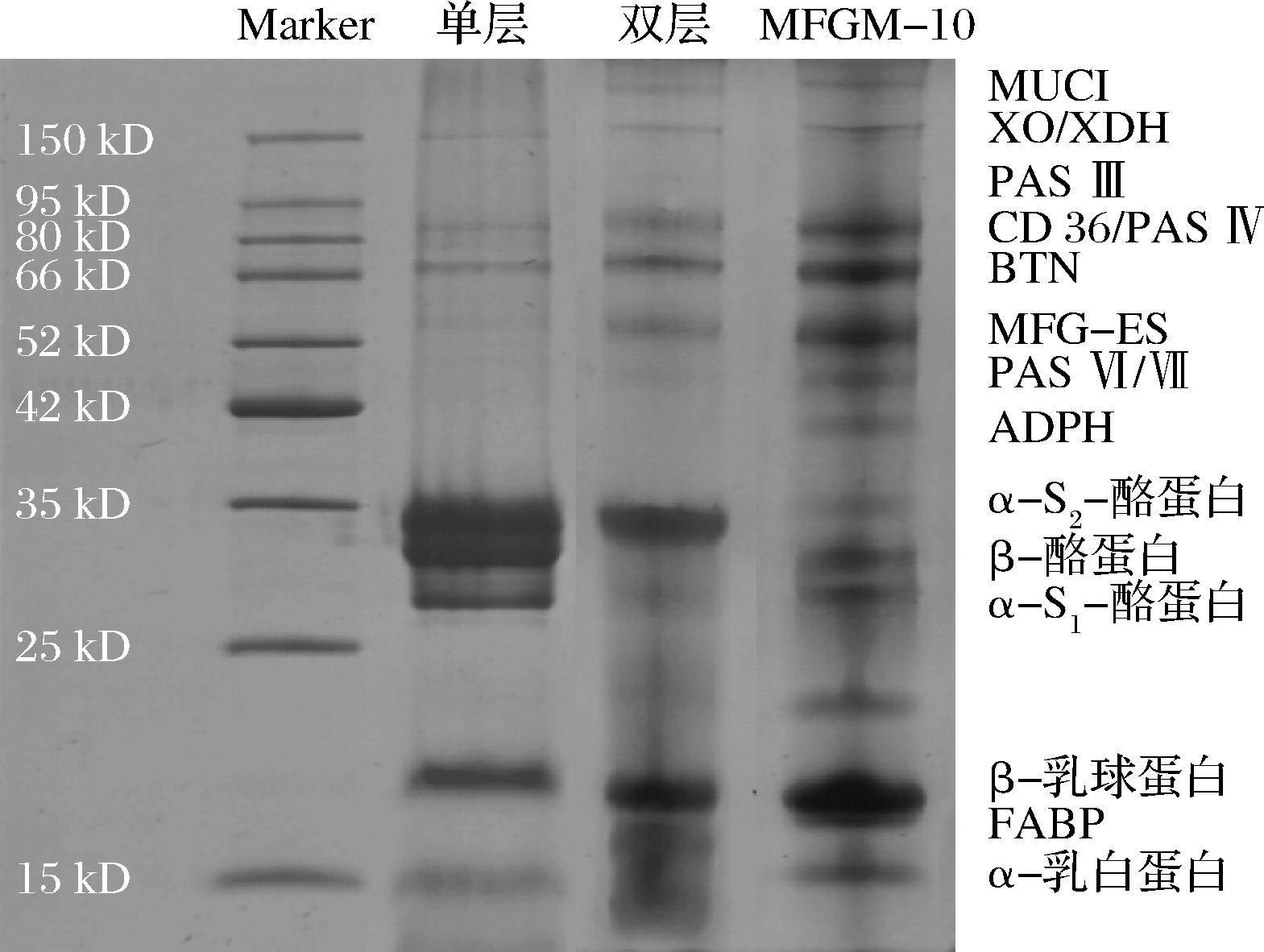
图1 不同结构MFGM蛋白的SDS-PAGE图
Fig.1 SDS-PAGE plots of MFGM proteins with different structures
2.3 粒度分布与平均粒径
乳化体系形成后,MFGM能够吸附在油水界面,稳定液滴使其不发生聚集,通过峰的位置及峰值大小能够得知乳液中MFG大小分布情况[12]。由图2-a可知,4组乳液样品的粒径分布均呈单峰正态分布,其中空白组的粒径范围为106~295 nm,对照组与实验组粒径分布整体向左偏移,范围在78.8~220 nm之间,说明添加MFGM能够有效减小MFG粒径大小,提高乳液稳定性。由图2-b可知,经模拟胃液消化60 min后,4组乳液的粒径分布范围均向大粒径方向迁移,呈单峰分布,说明此时4组乳液中具有一部分脂滴发生了聚集,并且有少部分甘油三酯被胃酯酶分解。由图2-c可知,经模拟肠液继续消化30 min后,4组乳液的粒径分布均向左大幅偏移,说明模拟肠液中的各类酶发挥作用,发生脂解反应。
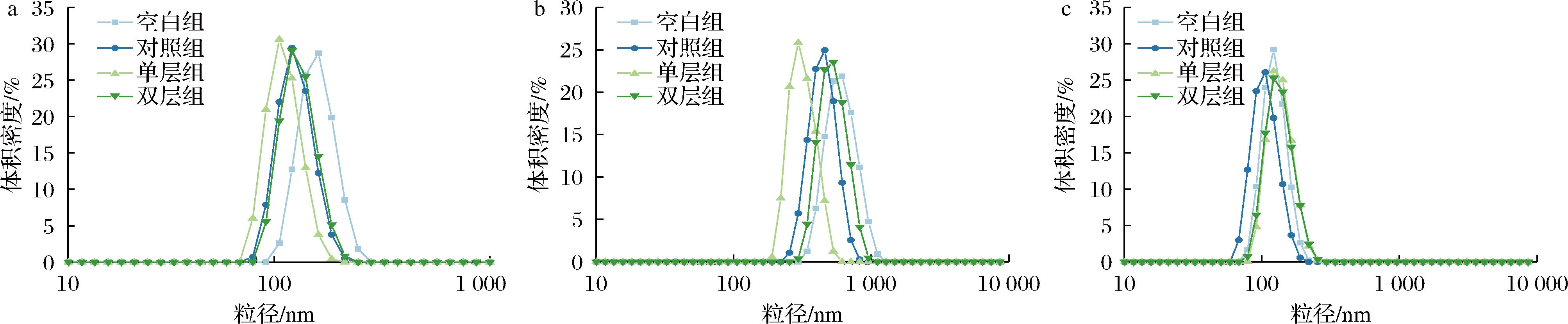
a-婴配乳原液;b-胃消化60 min;c-肠消化30 min
图2 四组婴配乳与在体外模拟消化过程中的粒径分布图
Fig.2 Particle size distribution during milk preparation and digestion in four groups
图3为4组乳液在体外模拟消化过程中的平均粒径,可以看出4组婴配乳中的MFG初始平均粒径分别为空白组163 nm>双层组141 nm>对照组139 nm>单层组127 nm,表明单层人工MFGM的加入对于减小MFG的粒径效果最佳。在模拟消化过程中,4组乳液的平均粒径均呈先增大后降低的趋势;在胃消化30 min时均达到最高值;胃消化结束阶段,4组乳液的平均粒径分别为空白组617 nm>双层组536 nm>对照组451 nm>单层组321 nm。粒径大小存在较大差异,可能是由于乳液的破坏程度存在差别。胃脂酶吸附在脂滴表面,与MFG表面的蛋白质竞争位置或将其水解,破坏了MFG的结构,MFG大量聚结以及MFG表面聚集了大量物质,导致乳液平均粒径变大[13]。经过肠消化后,所有样品的平均液滴尺寸明显下降(P<0.05),经过胃消化形成的许多大颗粒在小肠阶段被解离。这可能是因为酪蛋白胶束被分解,胆盐进一步乳化脂滴,从而迅速减小了被乳蛋白包裹的脂滴大小,最终随着脂肪酶被消耗,脂滴与其表面物质不再发生变化,平均粒径趋于稳定[14]。由图2、图3可知,消化过程中MFG颗粒大小的变化并不完全取决于其初始大小,与MFG的界面组成也有较大关系,单层组在胃消化期间的稳定性最好,能够更有效地将包裹物质递送到小肠得以利用。
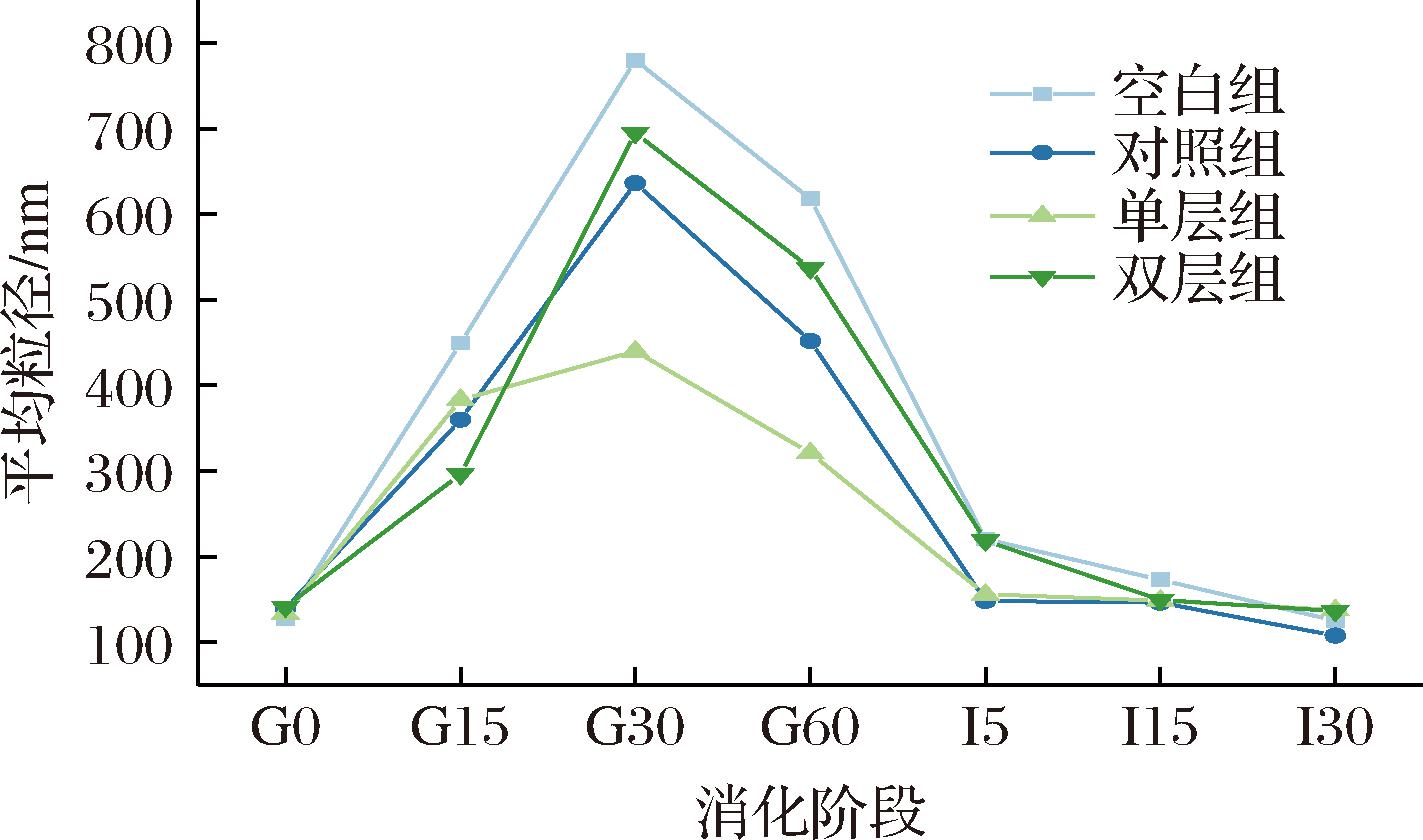
图3 四组婴配乳经各消化阶段后的平均粒径图
Fig.3 Average particle size diagram of four different formula milk groups after each digestion stage
2.4 ζ-电位
ζ-电位指数既能表征乳液物理稳定性,又能间接反映MFG界面成分的变化。乳液体系在均质处理后,MFG油水界面形成了一层由MFGM、乳蛋白、其他表面活性物质等所组成的新膜,而MFG表面带电性和带电量会影响到MFG稳定性以及与其他成分的相互作用。因此,在模拟消化前后测量了4组乳液各阶段的ζ-电位。根据ζ-电位绝对值的大小可以判断体系的稳定性[15]。如图4所示,初始阶段各组乳液MFG表面均带负电荷,实验组和对照组比空白组具有更大的电负性,其ζ-电位值分别为空白组(-41.50±0.78) mV,对照组(-42.20±0.72) mV,单层组(-44.13±1.78) mV和双层组(-42.53±0.72) mV。通常由蛋白质包被的脂滴应带有大量正电荷[11],且因为空白组缺少MFGM作为乳化剂吸附到新形成的MFG表面,所以与实验组存在油水界面组成的差异,进而造成电位的显著性差异(P<0.05)。
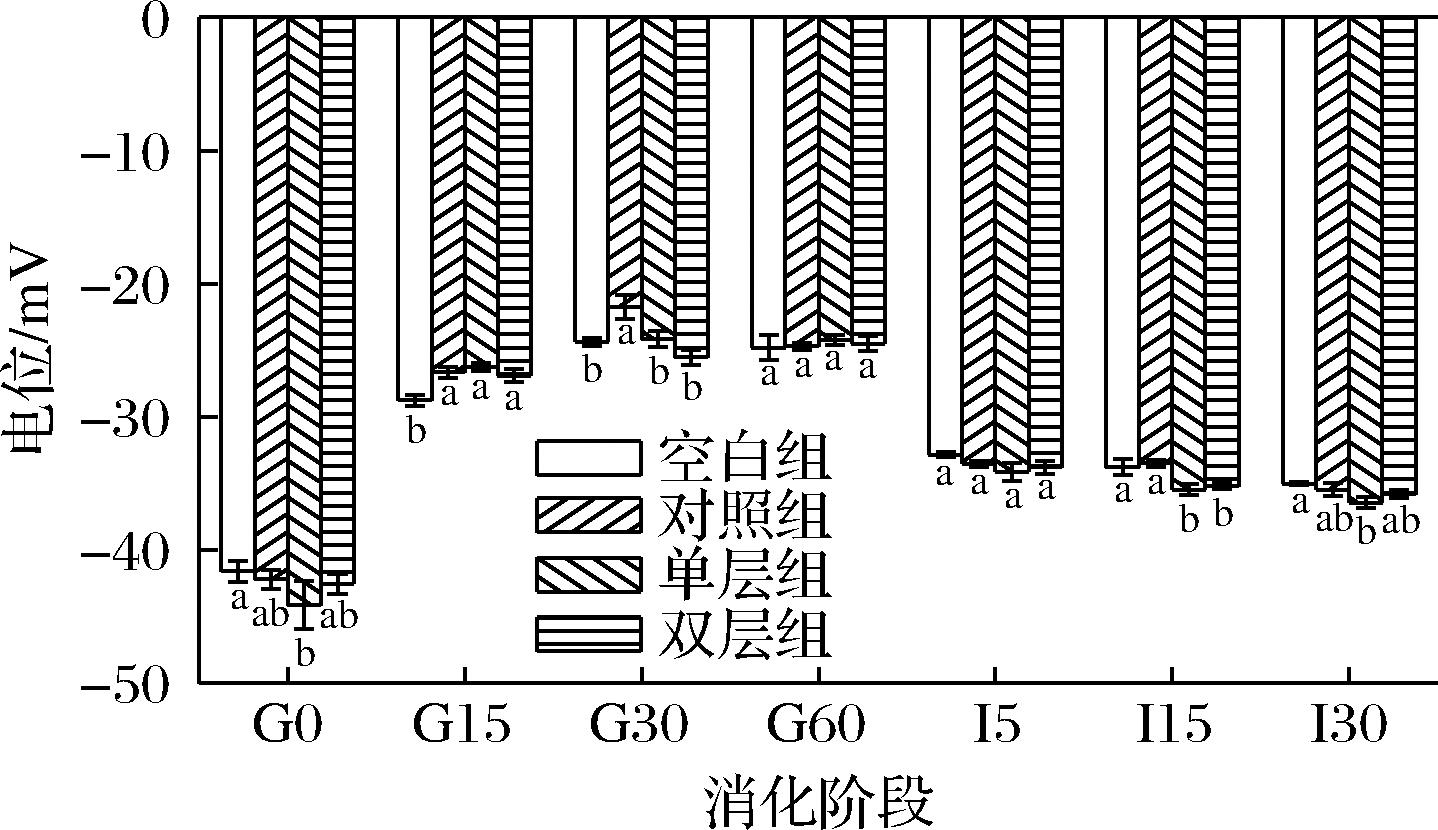
图4 四组婴配乳消化过程中的ζ-电位变化
Fig.4 Four groups of infant formula ζ- Potential change
ζ-电位指数也是脂肪分解酶的接触和脂肪分解效率的重要指标。4组乳液在消化过程中ζ-电位均呈先上升后下降最后平稳的趋势。在胃消化阶段4组乳液的ζ-电位均有不同程度的升高,当胃消化60 min时,此时4组乳液的ζ-电位值在-24.2~-24.8 mV之间(P>0.05),体系状态较不稳定。胃脂肪酶与胃蛋白酶的水解作用使MFG表面膜发生破坏,MFG产生聚结,平均粒径增大,从而导致脂滴表面的电荷量减少,与平均粒径的变化趋势相吻合。在肠消化阶段,4组乳液的电位均呈下降后平稳趋势,所有实验组均具有相对高的负电性表面电势(-35.03~-36.43 mV)。这是因为在肠消化阶段4组乳液经过胆盐的乳化和胰脂肪酶的水解作用后,消化液平均粒径减小;体系中存在各种类型的阴离子物质,如游离脂肪酸、多肽、磷脂等,致使颗粒间静电斥力增大,脂滴表面物质带电荷量增大;随着消化中间产物不断地吸附在脂滴表面,阻碍了脂滴进一步水解,电位趋于稳定[16]。
2.5 乳化稳定性
乳化活性指数(EAI)和乳化稳定性指数(ESI)是衡量乳化性能常用的2种指标,乳化活性指数是蛋白质吸附到界面能力的量度,而乳化稳定性是指乳液保持稳定,在一定时间内没有出现乳液分层、絮凝的能力[17]。由图5可知,4组乳液的乳化活性指数和乳化稳定性指数的大小顺序存在一致性,均为单层组>对照组>双层组>空白组,说明添加不同的MFGM均能改善婴配乳的乳化活性,其中单层人工MFGM的乳化效果最佳。这是因为天然MFGM与人工MFGM均含有磷脂和膜蛋白,均具有较强的表面活性,它们的协同作用提高了乳液的界面张力,从而加强了乳液体系的稳定性[18];另一方面MFGM可以提高乳液的黏度,使其网络结构更加稳定[19]。
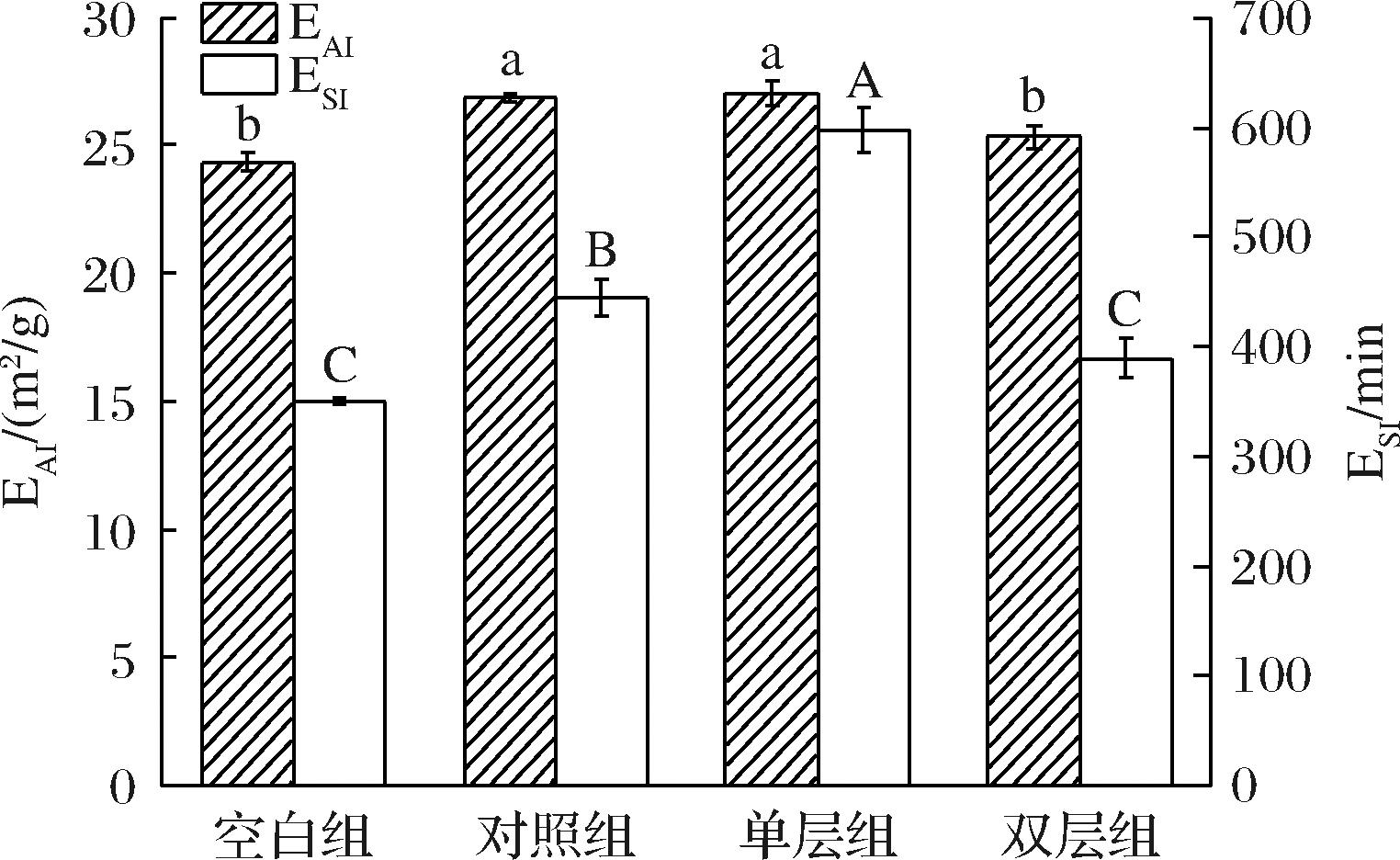
图5 四组婴配乳的乳化活性指数和乳化稳定性指数
Fig.5 Emulsification activity index and emulsion stability index of four different formula milk groups
注:不同小写字母表示乳化活性指数差异显著,不同大写字母表示乳化稳定性指数差异显著。
2.6 激光共聚焦显微镜观测测定
由图6可知,4组婴配乳中的MFG分别以不同粒径均匀分散在乳液体系中,经胃液消化后,4组乳液的平均粒径均有不同程度的增加,其中空白组最明显,出现大量脂滴聚集的现象。这可能是因为经过胃脂酶消化后,释放的游离脂肪酸和甘油二脂等脂解产物附着在脂滴表面,使得其静电屏蔽作用减弱和空间位阻减小,导致脂滴易聚集;也可能是由于被蛋白稳定的MFG本身在胃中就易聚集[19]。与空白组相比,对照组和实验组的聚集程度较弱,GALLIER等[20]也报道过MFG外围的MFGM结构能够保护它们在胃液中减轻絮凝程度,保护MFG的稳定性,从而延迟胰脂肪酶对甘油三酯的水解。该结果与平均粒径和ζ-电位的结果相一致。

图6 四组不同婴配乳组别经各消化阶段后的CLSM图
Fig.6 CLSM diagram of four different formula milk groups after each digestion stage
经过肠消化后,能够明显看到4组乳液的聚集现象减弱,原本聚集的大脂滴变为均匀分散的小脂滴,且部分MFG的形状被破坏,不再是规则的圆球状,这表明乳液中的MFG和蛋白质都被完全或部分水解,且伴随着胆盐的乳化作用,聚集的大脂滴分散开来,但仍有小部分出现聚集现象,可能是脂解产物附着造成的结果[13]。空白组相较于其他3组的存留脂滴数量较多,这些未被酶解脂滴的存在表明空白组的脂质水解程度低于其他组。由于空白组脂滴在胃部大量聚集,减少了酶接位点,也限制了脂肪酶分子穿过絮凝体接触内部脂肪,因而降低了其在肠道的消化速率。对照组与实验组在CLSM观测上并未显示出较大差异,说明添加MFGM可以在一定程度上起到稳定MFG的作用,保护MFG在胃消化期间被脂肪酶水解的程度[21],进而递送MFG至肠消化阶段得以被充分消化吸收利用。
2.7 游离脂肪酸含量
图7为4组乳液在模拟婴儿体外消化90 min过程中不同时间段的FFA释放量,4组乳液的游离脂肪酸释放率均呈先慢后快的趋势。在胃消化阶段,4组乳液的FFA释放量随时间的增加呈升高趋势,其中空白组相较于其他3组具有更高的FFA释放量,这是因为MFGM的存在能够减少胃脂肪酶与MFG内甘油三酯的接触,而空白组的MFG主要被乳清蛋白与酪蛋白包裹,胃蛋白酶首先水解乳蛋白,裂解的蛋白会促使MFG的释放,进而与胃酯酶作用释放FFA;实验组由于有MFGM的保护,FFA释放速率较慢[22]。模拟肠消化的30 min内,4组乳液的FFA释放量均迅速升高,其中空白组在15 min后的FFA释放量趋于稳定,而其他3组在15 min后仍继续上升,其中对照组在30 min时的FFA释放量最高,为1 560 μmol/mL,其次为双层组,为1 415 μmol/mL,单层组为1 361 m2/g。在肠消化阶段中,胆盐的乳化作用使脂滴乳化成细小的微粒,增加了胰脂肪酶与脂滴的接触面积;胰脂肪酶具有相对高的活性,对于对照组和实验组来说,MFG界面膜经胃消化后遭到破坏,脂解反应在肠消化阶段迅速进行,此时FFA脱离脂滴的速率要大于附着的速率,FFA释放速率增强,这与LUO等[23]得到的结论相似;而空白组随着消化时间的增加,消化产物富集在甘油三酯表面,减少了酶与甘油三酯的接触面积,导致消化速率减慢,FFA释放量减少,直至FFA释放率趋于平缓。实验结果表明添加了MFGM作为乳化剂制备的乳液在消化后期能够表现出明显较高的游离脂肪酸释放量,比空白组乳液的消化程度更高,其中单层组对脂肪消化更具有滞后性。
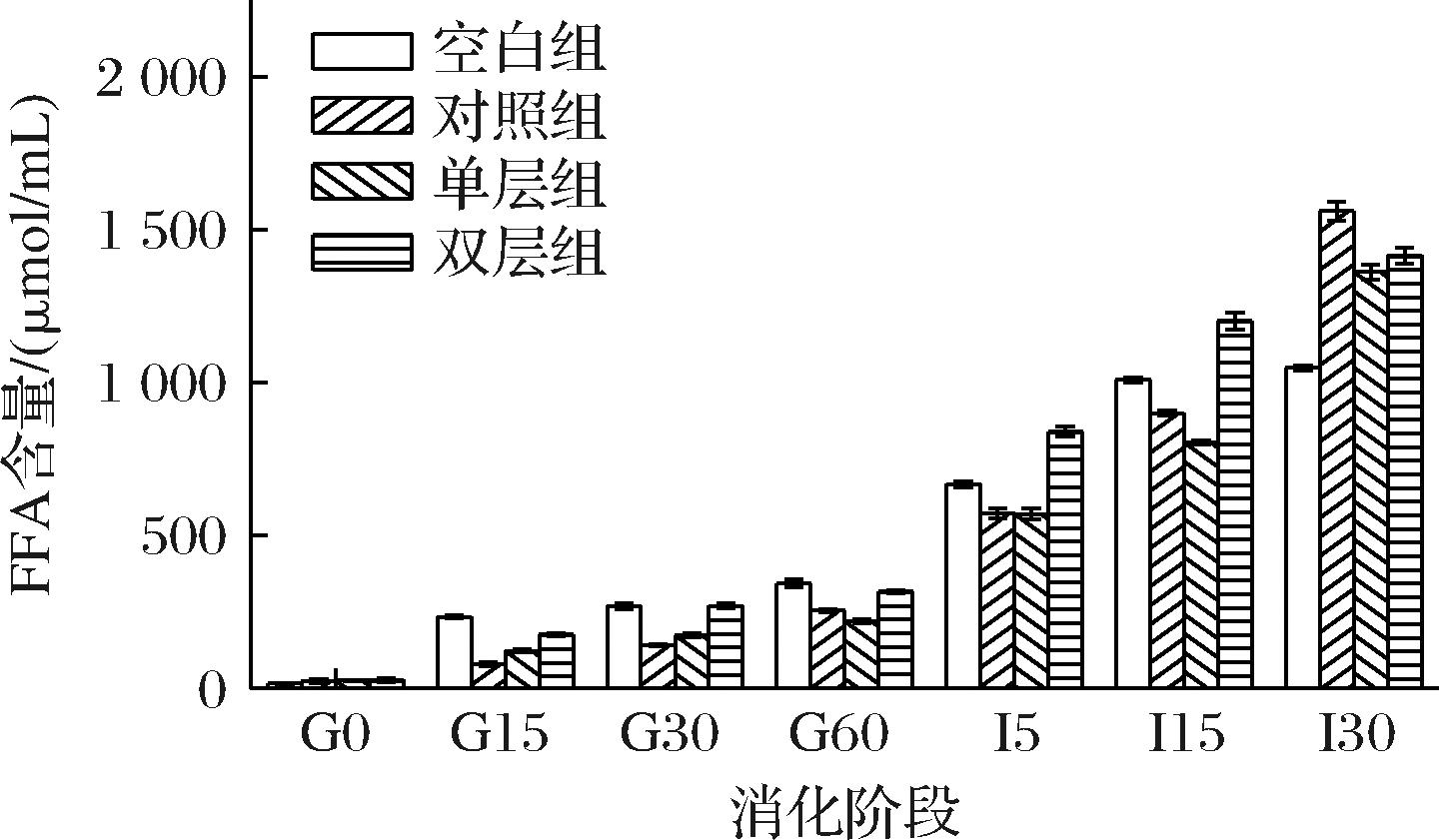
图7 四组不同婴配乳组别经各消化阶段后产生的游离脂肪酸累计含量图
Fig.7 Cumulative content of free fatty acids produced by four different formula milk groups after each digestion stage
3 结论
本研究通过对人工MFGM对婴配乳理化性质的影响以及对脂质消化的影响进行探究,得出结论:单层人工MFGM能够在婴配乳中代替天然MFGM对促进脂肪消化方面发挥一定作用。
研究证明,在婴配乳预混物中添加人工MFGM能有效降低MFG的粒径大小,并提高MFG的物理稳定性和乳液乳化稳定性,获得与添加天然MFGM的乳液相似的体系状态和理化性质,其中单层人工MFGM的效果最佳。通过体外模拟婴儿胃肠道消化模型,进一步证实人工MFGM能较好地保护MFG在胃消化道内的结构完整。单层组和双层组都可以使MFG在肠消化道中获得较高的脂解程度,提高脂肪消化率,其中单层组在整个消化过程中的MFG稳定性和甘油三酯水解程度更高。本研究有助于补充和完善体外婴幼儿MFG消化机理,为婴幼儿乳制品生产提供一定实验依据。
[1] EL-LOLY M.Composition, properties and nutritional aspects of milk fat globule membrane:A review[J].Polish Journal of Food and Nutrition Sciences, 2011, 61(1):7-32.
[2] LIPKIE T E, BANAVARA D, SHAH B, et al.Caco-2 accumulation of lutein is greater from human milk than from infant formula despite similar bioaccessibility[J].Molecular Nutrition &Food Research, 2014, 58(10):2014-2022.
[3] VORS C, DRAI J, PINEAU G, et al.Emulsifying dietary fat modulates postprandial endotoxemia associated with chylomicronemia in obese men:A pilot randomized crossover study[J].Lipids in Health and Disease, 2017, 16(1):97.
[4] CHEN Y, GE H, ZHENG Y, et al.Phospholipid-protein structured membrane for microencapsulation of DHA oil and evaluation of its in vitro digestibility:Inspired by milk fat globule membrane[J].Journal of Agricultural and Food Chemistry, 2020, 68(22):6190-6201.
[5] HOLZMÜLLER W, KULOZIK U.Technical difficulties and future challenges in isolating membrane material from milk fat globules in industrial settings-A critical review[J].International Dairy Journal, 2016, 61:51-66.
[6] 曹春杰. 乳脂肪球膜蛋白的富集分离及定量分析研究[D].天津:天津科技大学, 2020.
CAO C J.Enrichment and quantitative analysis of milk fat globule membrane[D].Tianjin:Tianjin University of Science &Technology, 2020.
[7] 龚金炎, 靳羽晓, 王静静, 等.硫氰亚铁铵比色法测定蛋黄卵磷脂中总磷脂含量[J].食品工业, 2018, 39(8):319-322.
GONG J Y, JIN Y X, WANG J J, et al.Determination of total phospholipids in egg yolk lecithin by thiocyanuric ammonium spectrophotometry[J].The Food Industry, 2018, 39(8):319-322.
[8] 姬晓曦. 乳源乳脂肪球膜蛋白组学分析及其对细胞凋亡的作用机制[D].哈尔滨:哈尔滨工业大学, 2017.
JI X X.The proteome analysis of mfgm original from different milk and the apoptosis mechanism of mfgm proteins on tumor cells[D].Harbin:Harbin Institute of Technology, 2017.
[9] MÉNARD O, BOURLIEU C, DE OLIVEIRA S C, et al.A first step towards a consensus static in vitro model for simulating full-term infant digestion[J].Food Chemistry, 2018, 240:338-345.
[10] 韩天翔, 李杨, 毕爽, 等.磷脂对大豆乳清蛋白乳化特性的影响[J].食品与发酵工业, 2017, 43(2):13-20.
HAN T X, LI Y, BI S, et al.Effect of phospholipids on the emulsifying properties of soy whey protein[J].Food and Fermentation Industries, 2017, 43(2):13-20.
[11] 梁丽. 乳脂肪球的体外消化特性及其影响因素研究[D].无锡:江南大学, 2019.
LIANG L.Study on milk fat globules digestion characteristics in vitro and its influence factors[D].Wuxi:Jiangnan University, 2019.
[12] 李杨, 王妍, 张雅娜, 等.大豆磷脂对大豆蛋白乳化体系的影响[J].食品工业科技, 2013, 34(19):74-76;79.
LI Y, WANG Y, ZHANG Y N, et al.Influence of soybean lecithin on soy protein emulsifying system[J].Science and Technology of Food Industry, 2013, 34(19):74-76;79.
[13] 张浩. 富含OPL结构酯的人乳替代脂的制备及其体外消化研究[D].郑州:河南工业大学, 2021.
ZHANG H.Preparation and in vitro digestion of human milk substitute fat containing OPL structural lipid[D].Zhengzhou:Henan University of Technology, 2021.
[14] LUEAMSAISUK C, LENTLE R G, MACGIBBON A K H, et al.Factors influencing the dynamics of emulsion structure during neonatal gastric digestion in an in vitro model[J].Food Hydrocolloids, 2014, 36:162-172.
[15] MICHALSKI M C, MICHEL F, SAINMONT D, et al.Apparent ζ-potential as a tool to assess mechanical damages to the milk fat globule membrane[J].Colloids and Surfaces B:Biointerfaces, 2002, 23(1):23-30.
[16] ZHANG R J, ZHANG Z P, ZHANG H, et al.Influence of emulsifier type on gastrointestinal fate of oil-in-water emulsions containing anionic dietary fiber (pectin)[J].Food Hydrocolloids, 2015, 45:175-185.
[17] DIFTIS N, KIOSSEOGLOU V.Stability against heat-induced aggregation of emulsions prepared with a dry-heated soy protein isolate-dextran mixture[J].Food Hydrocolloids, 2006, 20(6):787-792.
[18] BOUZID H, RABILLER-BAUDRY M, PAUGAM L, et al.Impact of zeta potential and size of caseins as precursors of fouling deposit on limiting and critical fluxes in spiral ultrafiltration of modified skim milks[J].Journal of Membrane Science, 2008, 314(1-2):67-75.
[19] SARKAR A, GOH K K T, SINGH H.Colloidal stability and interactions of milk-protein-stabilized emulsions in an artificial saliva[J].Food Hydrocolloids, 2009, 23(5):1270-1278.
[20] GALLIER S, YE A, SINGH H.Structural changes of bovine milk fat globules during in vitro digestion[J].Journal of Dairy Science, 2012, 95(7):3579-3592.
[21] SINGH H, GALLIER S.Nature’s complex emulsion:The fat globules of milk[J].Food Hydrocolloids, 2017, 68:81-89.
[22] LIU L, LIN S, MA S Y, et al.A comparative analysis of lipid digestion in human milk and infant formulas based on simulated in vitro infant gastrointestinal digestion[J].Foods, 2022, 11(2):200.
[23] LUO J, WANG Z W, LI Y R, et al.The simulated in vitro infant gastrointestinal digestion of droplets covered with milk fat globule membrane polar lipids concentrate[J].Journal of Dairy Science, 2019, 102(4):2879-2889.