凡纳滨对虾(Litopenaeus vannamei)是我国主要的养殖对虾品种之一,因其营养丰富和肉质鲜美而深受消费者的青睐。凡纳滨对虾具有高水分、高蛋白与头部酶活性强等特性,在常温下放置极易腐败变质[1]。为了避免水产品的品质劣变,冷冻是鲜虾初级加工的主要方式之一,而去头虾是加工厂最主要的贮藏方式。解冻方式对解冻冷冻制品的品质具有决定性的影响,进而影响其后续的深加工。目前,自然解冻、流水解冻和冷藏解冻等传统解冻方法,极易导致冷冻制品的蛋白质变性和脂质氧化,使解冻后冷冻制品的品质下降。非热解冻技术具有解冻速率快、损失小、能耗低、减少重结晶损伤和保持冻品品质的优点[2]。
新型非热解冻方式主要包括高压解冻、微波解冻和高压静电场解冻(high voltage electrostatic field thawing,HVEFT)[3-4]。然而,高压解冻耗费巨大,微波解冻极易导致局部过热,不利于这些新型解冻技术的发展应用[5]。HVEFT通过电晕放电来产生电晕风,使用空气离子来增加热量从而达到解冻的目的,不仅使用成本低、解冻速率快,而且冷冻制品品质能有效得到保持[4-6]。研究表明,HVEFT冷冻猪肉的时间仅为自然解冻(nature thawing,NT)时间的1/4~2/3,同时与NT相比,HVEFT猪里脊肉、兔肉和鲤鱼更有效地抑制微生物在解冻过程中的繁殖[6-8]。
肌原纤维蛋白是肌肉蛋白中最丰富的蛋白质(40%~60%),而肌球蛋白占肌原纤维蛋白含量的55%~60%,约占肌肉蛋白含量的30%,是肌肉中的主要蛋白质,对肌肉的组织结构与功能特性具有重要的作用[9]。冷冻虾制品解冻过程中,肌球蛋白结构的稳定性对虾制品在解冻后的营养成分、弹性、硬度与持水性等品质的保持具有重要的影响。肌肉蛋白在解冻过程中会发生氧化,直接影响到肌球蛋白的结构稳定性[10]。研究表明,冷冻制品在解冻过程中质量的变化与高压静电场的场强、温度和电极板间隙等条件有关[11]。肌球蛋白对肌肉组织的凝胶化、保水性和乳化起着重要的作用,但目前尚不清楚HVEFT对凡纳滨对虾肌球蛋白结构特征的影响。因此,本研究目的是通过选择NT作为参考对照,研究不同HVEFT条件(场强和温度)对凡纳滨对虾肌球蛋白结构特征的影响,为高压静电场技术的工业应用与冷冻制品的深加工发展提供科学的理论依据。
1 材料与方法
1.1 材料与试剂
鲜活的凡纳滨对虾(Litopenaeus vannamei)[规格为(12.00±2.00) g],购买于广东省湛江市霞山区水产品批发市场,加冰保鲜于泡沫箱中,于2 h内运输至实验室。
腺-5三磷酸二钠盐水合物(ATP,色谱纯),其他试剂均为国产试剂纯。
1.2 仪器与设备
NF-2型多功能静电冷冻试验机,台湾迪弗斯科股份有限公司;NanoBrook Omni型激光粒度分布仪,美国布鲁克海文仪器公司;Hettich Universal320R型高速冷冻离心机,德国Hettich公司;BRUKER TENSOR27型傅里叶红外光谱仪,美国BRUKER公司;Cintra1010型紫外分光光度计,澳大利亚GBC科学仪器公司。
1.3 实验方法
1.3.1 原材料预处理
鲜活的凡纳滨对虾运输至实验室后立即加入碎冰猝死,剪去虾头,获得去头虾。去头虾随机分组后装入铝箔袋并封口,放入-80 ℃冰箱中速冻12 h后转到-30 ℃冰箱中冷冻10 d。每组设3个平行,冷冻样品以不同的方式进行解冻。当样品中心温度到达(0±1) ℃时视为解冻完成。具体解冻方法设计如下:
固定场强为3.8 kV:(1)3.8 kV,5 ℃;(2)3.8 kV,15 ℃;(3)3.8 kV,25 ℃;
筛选出最佳温度T后:(4)T,1.8 kV;(5)T,3.8 kV;(6)T,4.3 kV;
筛选出最佳的场强(7)NT:在自然环境(25.00±1.00) ℃下进行解冻。
1.3.2 试验试剂的配制
试剂A:0.1 mol/L KCl溶液,20 mmol/L Tris溶液,盐酸溶液调节试剂pH值至7.5;
试剂B:0.45 mol/L KCl溶液,20 mmol/L Tris溶液,0.2 mol/L乙酸镁溶液,1 mmol/L EGTA溶液,5 mmol/L β-疏基乙醇溶液,马来酸溶液调节溶液pH值至6.8;
试剂C:0.5 mol/L KCl溶液,20 mmol/L Tris溶液,5 mmol/L β-疏基乙醇溶液,盐酸溶液调节试剂pH值至7.5;
试剂D:0.5 mol/L NaCl溶液,20 mmol/L Tris溶液,盐酸溶液调节试剂pH值至7.0。
1.3.3 肌球蛋白的提取
参考倪雪[12]的方法,稍作修改。将解冻的去头虾搅碎并与试剂A以料液比=1∶8(g∶mL)的比例混合,高速均质(11 000 r/min,3 min)后置于4 ℃反应15 min,离心取沉淀(3 000×g,5 min,4 ℃),并与试剂B以料液比=1∶3(g∶mL)的比例混匀,在混合液中加入腺-5三磷酸二钠盐水合物,使最终浓度为10 mmol/L,均质30 s后在4 ℃反应90 min,再次离心(9 000×g,15 min,4 ℃)取上清液。将上清液与1 mmol/L KHCO3溶液以1∶3(体积比)混匀后,于4 ℃反应40 min 后离心取沉淀(9 000×g,20 min,4 ℃)。将沉淀与试剂C以料液比=1∶2.5(g∶mL)的比例混合均质30 s后于4 ℃反应10 min,并将混合液与1 mmol/L KHCO3溶液以1∶3(体积比)的比例充分混匀后加入MgCl2溶液,使混合物中氯化镁的最终浓度为10 mmol/L,在4 ℃反应过夜。过夜后将混合液离心(9 000×g,25 min,4 ℃),沉淀即为肌球蛋白。用试剂D将肌球蛋白溶解后离心(5 000×g,10 min,4 ℃)取上清液备用。整个试验过程控制温度在4 ℃左右,提取的肌球蛋白4 ℃贮存并于72 h内完成试验。
1.3.4 肌球蛋白氧化程度的测定
1.3.4.1 总巯基含量的测定
参考JIA等[13]的方法,稍作修改。将0.5 mL肌球蛋白溶液(1 mg/mL)与4.5 mL 0.2 mol/L Tris-HCl缓冲液[8 mol/L尿素,2%(质量分数)十二烷基硫酸钠(sodium dodecyl sulfate,SDS),10 mmol/L EDTA,pH 8.0]混合后,将4 mL混合物加入到1 mL 0.1%(质量分数)5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithiobis-(2-nitrobenzoic acid),DTNB](0.2 mol/L Tris-HCl缓冲液溶解,pH 8.0)中并在40 ℃下保温25 min,在412 nm处测量吸光度。总巯基含量根据吸光度计算得来,摩尔消光度为13 600 L/(mol·cm)。
1.3.4.2 羰基含量的测定
参考HUANG等[14]的方法,稍作修改。分别取0.5 mL肌球蛋白溶液(1 mg/mL)于2个离心管中,其中一份加入2 mL 2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)溶液(10 mmol/L,用2 mol/L HCl溶液溶解),另一份加入2 mL 2 mol/L HCl溶液作为对照组。室温条件下避光静置1 h(每10 min涡漩混匀),随后加入2.5 mL 0.2 g/L的三氯乙酸沉淀蛋白,9 000×g离心3 min,取沉淀用2 mL乙酸乙酯/乙醇(1∶1,体积比)洗涤3次,留沉淀。加入6 mL 6 mol/L的盐酸胍溶解沉淀,室温放置10 min后9 000×g离心3 min,在370 nm波长下测定上清液的吸光度。蛋白质中的羰基含量(nmol/mg)使用分子吸光系数22 000 L/(mol·cm)计算,具体见公式(1):
(1)
式中:X,羰基化合物摩尔浓度,nmol/mg;ρ,肌球蛋白质量浓度,mg/mL;A,370 nm处的吸光值;ε,摩尔消光系数,22 000 L/(mol·cm)。
1.3.4.3 表面疏水性的测定
参考QIAN等[15]的方法,稍作修改。在1 mL肌球蛋白溶液(1 mg/mL)中,加入200 μL的1 mg/mL 溴酚蓝(bromophenol blue,BPB)溶液,充分混合并在室温下振荡10 min。随后,将混合溶液在6 000×g、4 ℃下离心15 min。然后取上清液并稀释10倍,在595 nm波长下测量吸光度。肌球蛋白表面疏水性表示为BPB结合的量(μg),使用公式(2)计算:
BPB结合的量![]()
(2)
式中:A0,空白组的吸光度;A1,样品溶液的吸光度;200,添加到肌球蛋白溶液中的BPB的总质量,μg。
1.3.5 粒径的测定
参考倪雪[12]的方法,稍作修改。将蛋白质溶液稀释到0.2 mg/mL,室温下静置20 min后,转移到一次性塑料比色皿中进行肌球蛋白粒径的测量。测定温度25 ℃,平衡时间2 min,每个样品进行5个平行的测定。
1.3.6 肌球蛋白结构分析
1.3.6.1 傅里叶变换红外光谱
参考HUANG等[14]的方法,稍作修改。将样品置于在-30 ℃冰箱中冻结4 h以上,然后立即置于真空冷冻干燥机中干燥至肌球蛋白样品完全干燥为止,即得到肌球蛋白冻干样品。随后将肌球蛋白冻干样品与经过干燥的无水KBr以1∶200(质量比)充分研磨混匀后压片。测定条件为分辨率4 cm-1,室温下重复扫描32次,扫描范围4 000~400 cm-1。扫描结果用Peak fit 4.12软件进行去卷积与高斯拟合,分析蛋白质不同二级结构的相对含量。
1.3.6.2 荧光强度的测定
参考汪少芸等[16]的方法,稍作修改。将肌球蛋白溶液稀释至0.2 mg/mL,使用RF-5301PC荧光光谱仪测量荧光强度,激发波长为283 nm,使用1 000 nm/min的扫描速度获得300~400 nm的发射光谱,激发狭缝宽度和发射狭缝宽度均设置为10 nm。
1.3.6.3 SDS-PAGE
将蛋白质量浓度调整至5 mg/mL,采用12%(质量分数)分离胶和4%(质量分数)浓缩胶,胶液的配制按说明书步骤,将样品与上样缓冲液(2×)1∶1混匀后于沸水中煮3 min,冷却后进行SDS-PAGE试验。电泳开始时先采用恒定电压80 V,待样品进入到分离胶后,调整电压至120 V直至试验结束。利用考马斯亮蓝摇床染色2 h,置于纯水中用摇床进行脱色,每隔15 min换1次水,直至电泳条带清晰为止。脱色后扫描成像观察对比不同HVEFT条件对去头虾肌球蛋白的区别。
1.4 数据处理
使用SPSS Statistics 26软件和Origin 2021软件对数据进行统计分析和作图,显著性差异检验使用Tukey多重检验(P<0.05,差异显著),结果以平均值±标准差的形式表示。
2 结果与分析
2.1 肌球蛋白氧化程度的变化分析
2.1.1 总巯基含量的分析
肌球蛋白的分子中含有约42个巯基,其中包含的硫氨基酸、半胱氨酸和甲硫氨酸具有较高的氧化敏感性,在蛋白氧化过程中,其巯基(SH—)极易被氧化生成二硫键,造成蛋白质交联。因而巯基对维持肌肉蛋白质结构的稳定具有重要的作用,其含量越低,表明蛋白被氧化的程度越严重[17]。如图1-a所示,场强固定为3.8 kV时,总巯基的含量随着温度的升高却呈现出先上升后下降的趋势。15 ℃解冻肌球蛋白的总巯基含量为3.35 mol/104 g。其中总巯基含量越高,说明氧化程度越小,由此得到15 ℃解冻对总巯基影响最小。15 ℃与5 ℃解冻时,总巯基的含量并无显著性差异(P>0.05),较低的温度需要花费较长时间解冻。如图1-b所示,当解冻温度为15 ℃时,总巯基的含量随着场强的增大呈先上升后下降的趋势,在3.8 kV解冻时得到最高的总巯基含量(3.35 mol/104 g)。增加场强会使总巯基的含量增加,而随着场强的进一步增加,则会导致空气发生电离和产生臭氧,使蛋白质结构发生改变。HVEFT肌球蛋白的总巯基含量均显著(P<0.05)高于NT(2.91 mol/104 g)。可能是HVEFT处理能有效抑制肌球蛋白分子中部分巯基的化学反应,延缓肌球蛋白的变性,促进去头虾品质的保持。而NT会使肌球蛋白的空间构像发生改变,埋藏在分子内部的巯基被暴露出来,巯基氧化形成二硫键,致使总巯基含量的下降。JIA等[13]的研究结果也表明,不同的HVEFT能降低了蛋白氧化程度并增加总巯基含量。
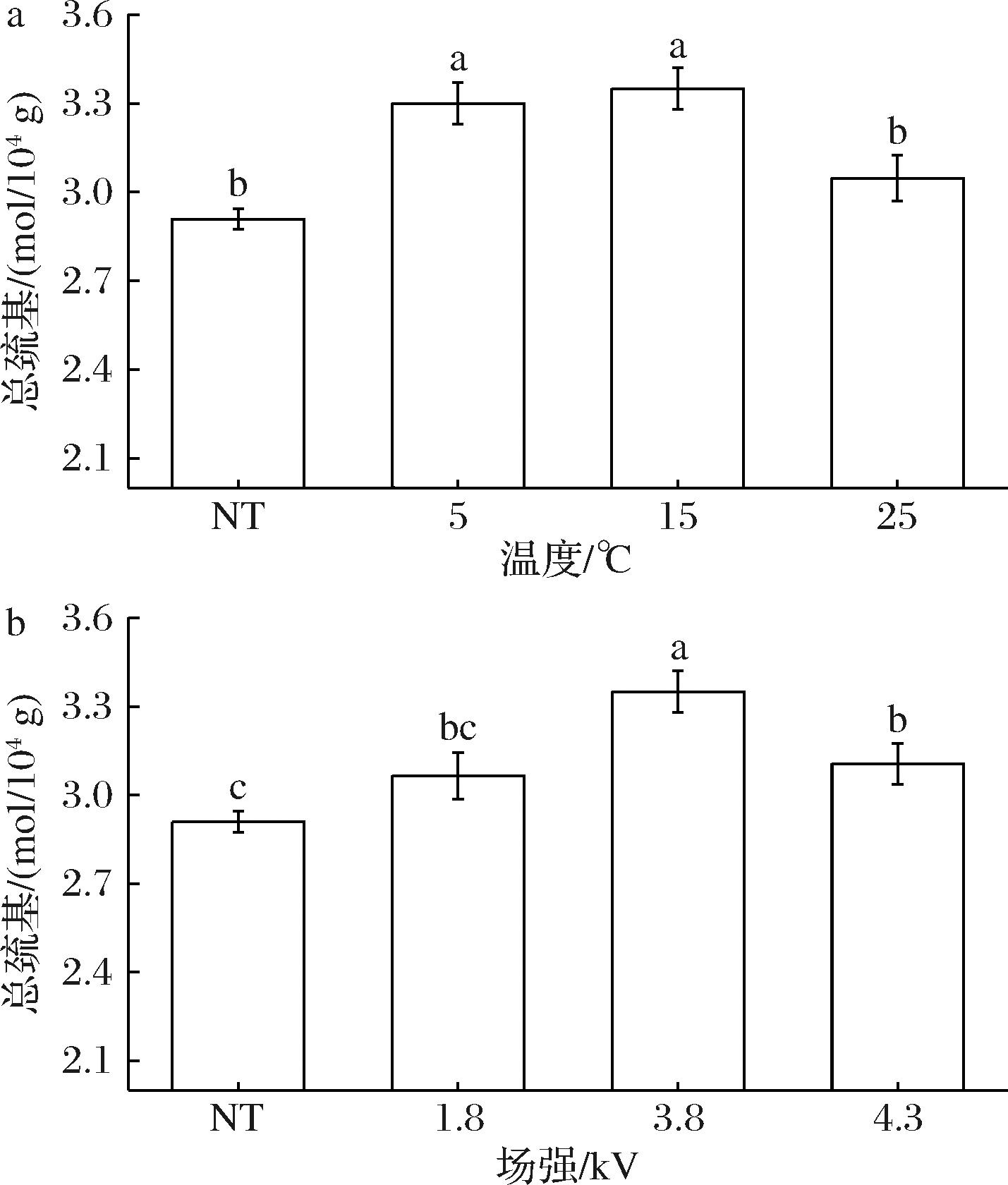
a-温度;b-场强
图1 HVEFT条件对去头虾肌球蛋白总巯基的影响
Fig.1 Effect of HVEFT conditions on the total sulfhydryl groups of myosin in decapitated shrimp
注:不同小写字母表示有差异性显著,P>0.05(下同)。
2.1.2 羰基含量的分析
羰基是自由基氧化氨基酸侧链生成的产物之一,蛋白氧化产生的羰基会通过交联的方式来加速蛋白功能性的丧失。分子内和分子间也会因为蛋白质的氧化发生交联从而导致结构变化,进而使功能性丧失。如图2-a所示,场强固定为3.8 kV时,随着解冻温度的上升,肌球蛋白的羰基含量不断增加。羰基含量越高,肌球蛋白被氧化的程度越严重。15 ℃和5 ℃解冻的羰基之间并无显著性差异(P>0.05),但都显著(P<0.05)低于25 ℃。较低的温度在解冻的过程中会耗费更多的时间,而较高的温度使氨基酸侧链受到攻击并释放出活性氧,产生了羰基化合物,因此筛出最佳温度为15 ℃。当解冻温度为15 ℃时,随着场强的增加,羰基含量也呈上升趋势(如图2-b),得到最佳解冻场强为1.8 kV。师希雄等[18]的研究也表明羰基含量随着压强的增加而上升。NT(0.23 nmol/mg)处理肌球蛋白的羰基含量显著(P<0.05)高于HVEFT,说明HVEFT可以抑制自由基介导所诱导的蛋白质羰基化。梁诗惠等[19]的研究也表明,在室温下解冻得到的羰基含量最高。
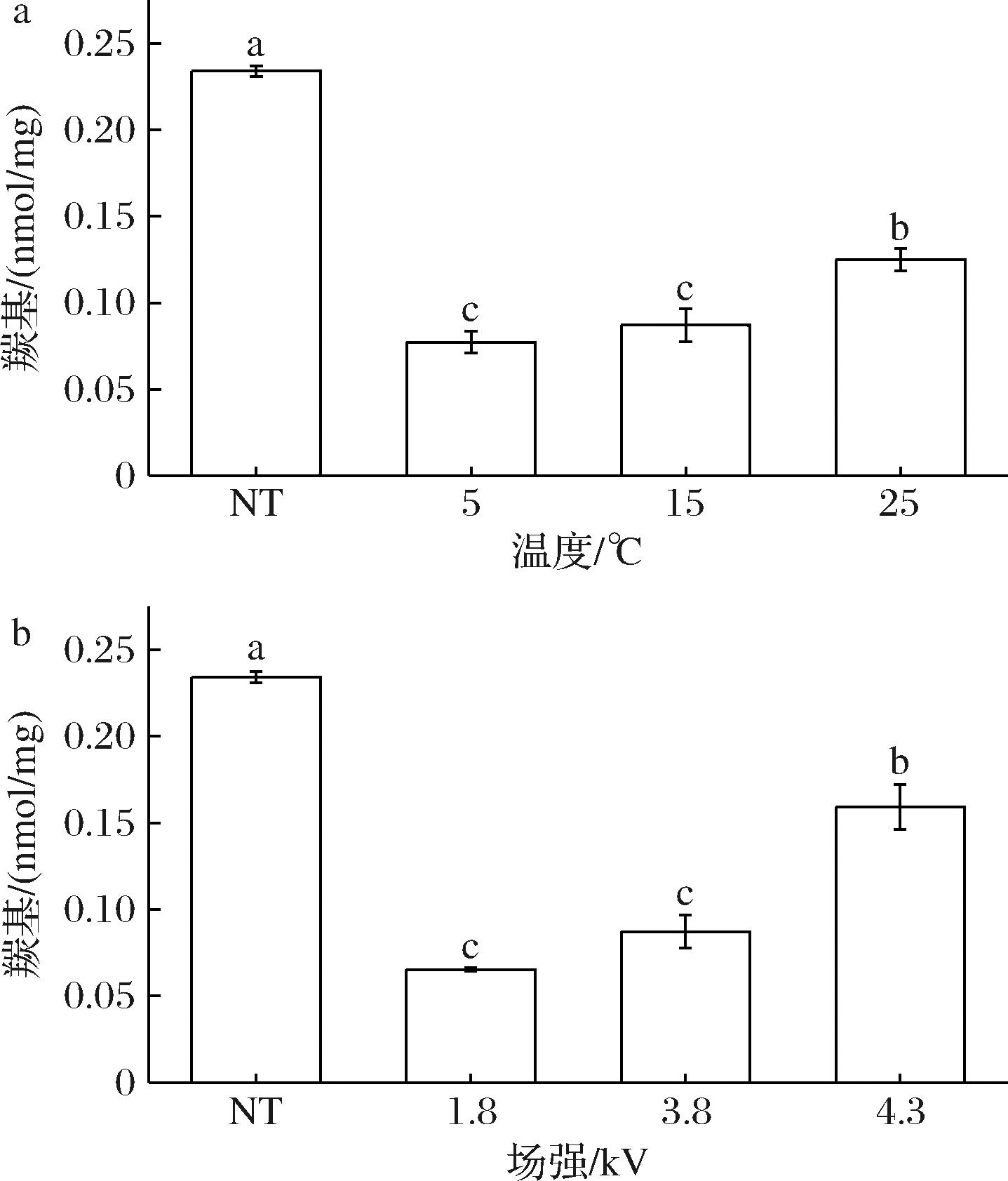
a-温度;b-场强
图2 HVEFT条件对去头虾肌球蛋白羰基的影响
Fig.2 Effect of HVEFT conditions on myosin carbonyl group of decapitated shrimp
2.1.3 表面疏水性分析
蛋白质中的非极性氨基酸和疏水基团与表面疏水性具有一定的相关性,表面疏水性能反映蛋白质结构的变化情况[19]。蛋白氧化所引起的二、三级结构的变化会导致蛋白结构展开、表面疏水性增加,并形成聚集体,最终导致不可逆的蛋白变性。表面疏水性越高,表明蛋白质被氧化得越严重。当场强固定为3.8 kV时,随着温度的升高,表面疏水性的含量呈先下降后上升的趋势(如图3-a)。得到最优的HVEFT温度为15 ℃。当解冻温度为15 ℃时,表面疏水性的含量随场强的增加呈下降后上升的趋势(如图3-b)。结果表明,温度和场强都对肌球蛋白表面疏水性的含量都具有显著影响(P<0.05)。得到最佳场强为3.8 kV,15 ℃下表面疏水性含量为9.45 μg/mL,比NT(22.54 μg/mL)的表面疏水性含量低了2.39倍。NT与HVEFT的表面疏水性之间均具有显著性差异(P<0.05),且HVEFT的表面疏水性都低于NT。这与QIAN等[20]的研究结果一致。可能是NT会使蛋白质氧化变性加剧,致使蛋白质短链展开,分子内部的疏水性氨基酸被暴露出来,导致了疏水性含量的增加。HVEFT处理样品的表面疏水性含量都显著低于NT(P<0.05),可能是高压静电场可以抑制疏水残基的暴露,从而减少肌球蛋白的表面疏水性,促进了肌球蛋白的复性。
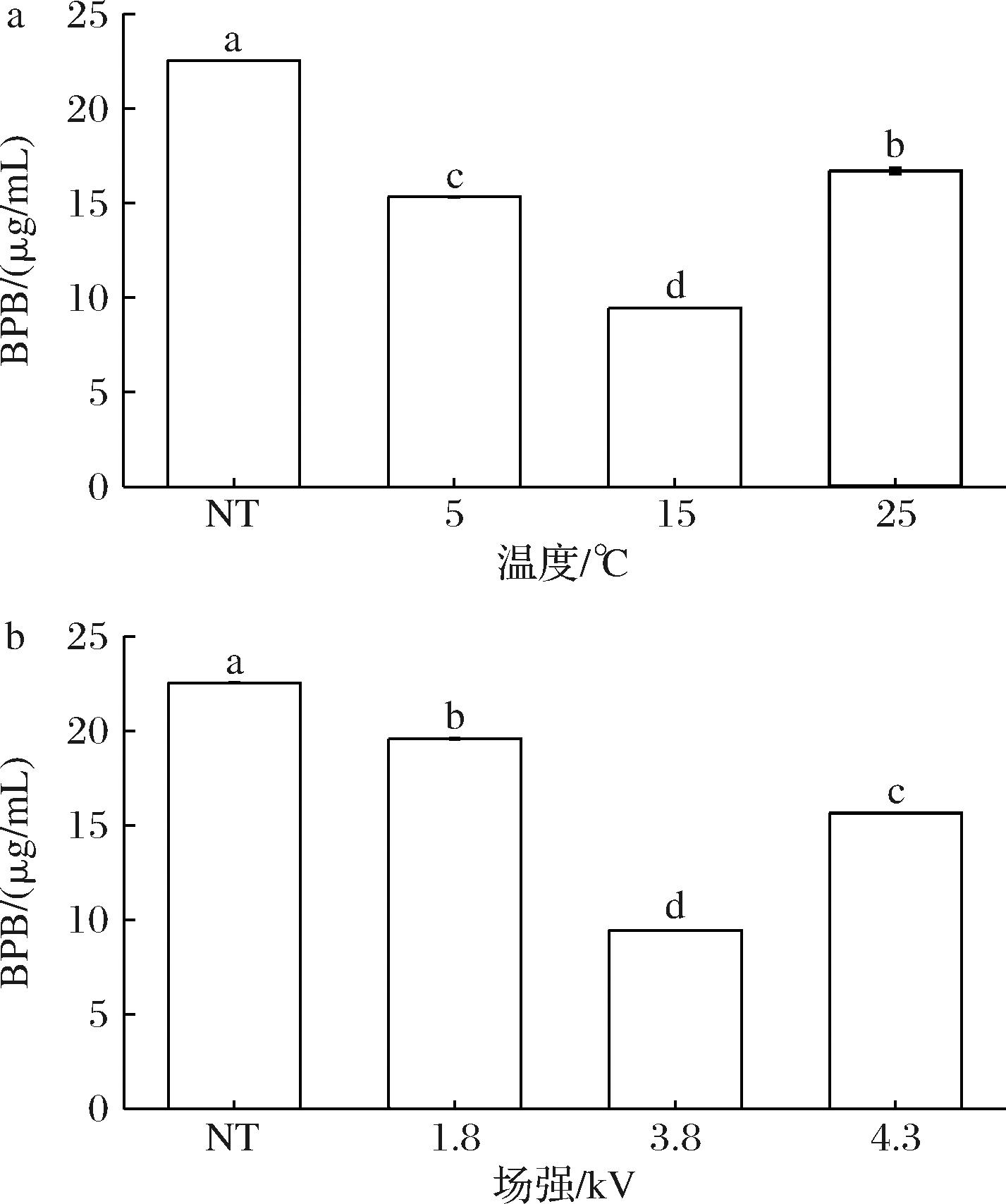
a-温度;b-场强
图3 HVEFT条件对去头虾肌球蛋白表面疏水性的影响
Fig.3 Effect of HVEFT conditions on hydrophobicity of the surface of myosin in decapitated shrimp
2.2 粒径分析
如图4-a所示,在场强固定为3.8 kV时,随着温度的增加,肌球蛋白的粒径呈现出先增后减的趋势。粒径越小,说明氧化程度越低,得到对肌球蛋白粒径的最好解冻温度为5 ℃。可能是低温下,蛋白的氧化程度减小,减少了聚集体的产生。当解冻温度为5 ℃时,随着场强的增加,粒径的大小是呈现出先下降后上升的趋势(如图4-b),得到最佳场强为3.8 kV。随着场强的增加,在电晕放电和带电离子流的影响下,肌球蛋白中的非共价键在互相作用下导致蛋白质结构展开,粒径减小。然而,随着场强的进一步增加,促进分子间二硫键和疏水力的相互作用产生聚集体,导致粒径的增加[21]。这与JIA等[22]的研究结果一致。NT处理肌球蛋白的粒径要显著(P<0.05)高于HVEFT,而肌球蛋白粒径的增加不利于肌肉品质的保持。
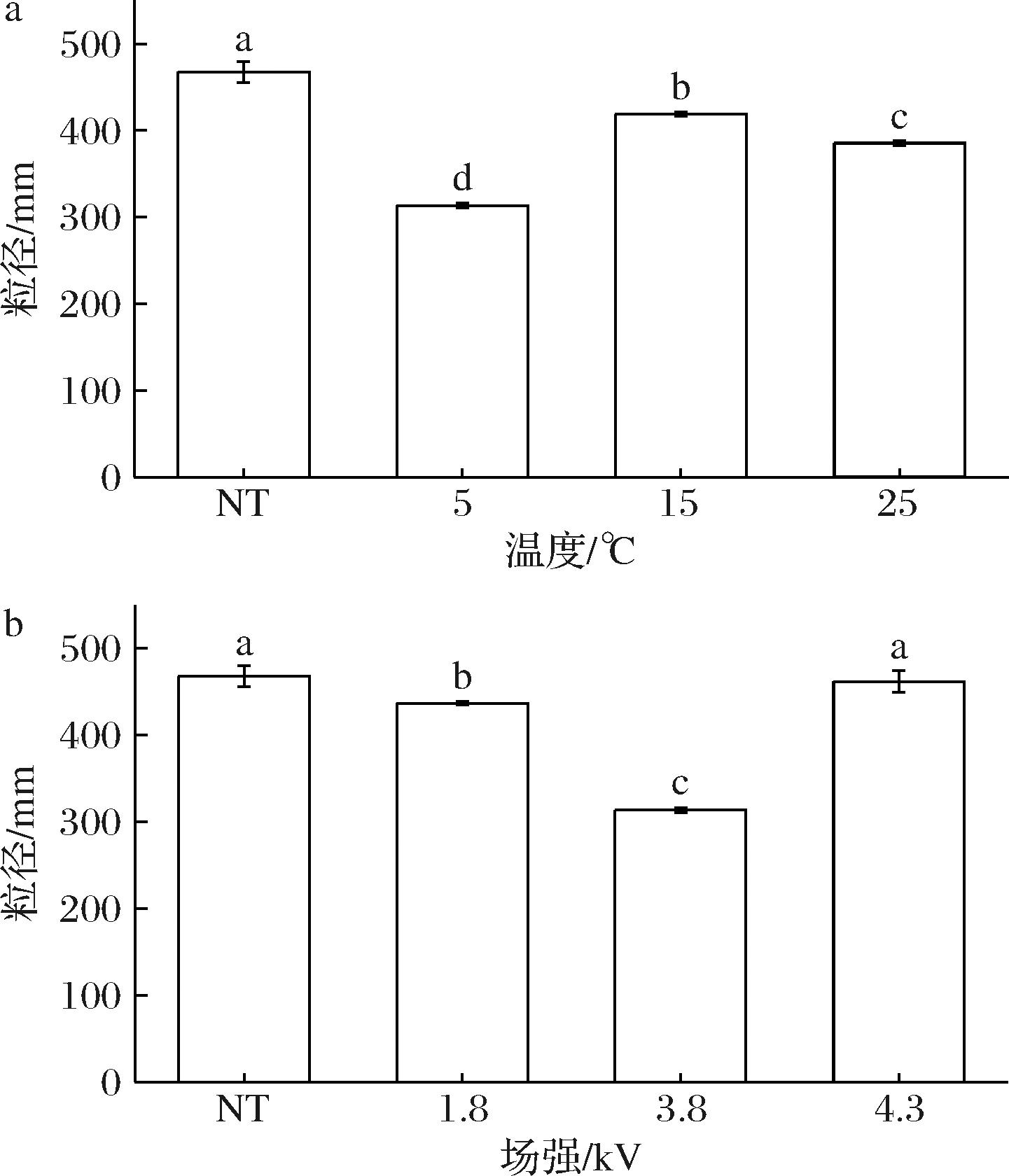
a-温度对粒径的影响;b-场强对粒径的影响
图4 HVEFT条件对去头虾肌球蛋白粒径的影响
Fig.4 Effect of HVEFT conditions on myosin particle size in decapitated shrimp
2.3 肌球蛋白结构分析
2.3.1 傅里叶红外光谱分析
酰胺Ⅰ带(1 600~1 700 cm-1)由于形成肽键的C![]() O伸缩振动和部分N—H弯曲而出现特定的吸收峰,其可用于分析蛋白质二级结构的变化[23]。蛋白质二级结构包括β折叠(1 611~1 640 cm-1)、无规则卷曲(1 642~1 650 cm-1)、α-螺旋(1 654~1 662 cm-1)与β转角(1 665~1 693 cm-1)。在场强固定为3.8 kV时,随着温度的增加,α-螺旋含量的比例呈先上升后下降的趋势(如图5-a),得到最优的解冻温度为15 ℃。这种现象可能是由于α-螺旋被肽链内的氢键稳定,β-折叠依赖于肽链之间的氢键。由于温度过高或过低,蛋白质展开,氢键减弱,导致α螺旋破坏以及无规则卷曲和β转角的形成。当解冻温度为15 ℃时,随着场强的升高,α-螺旋含量的比例呈先增加后减少的趋势(如图5-b)。电场强度过高或过低时,由于蛋白质空间结构的改变,未折叠的蛋白质分子链将重新弯曲,使α-螺旋的比例减少。如图5所示,NT样品的肌球蛋白α-螺旋仅占18%,低于HVEFT样品的α-螺旋含量。稳定蛋白质结构的氢键被破坏后会导致有序结构的减少[19]。而蛋白质的氧化促使肌球蛋白α-螺旋结构的展开,提高其他3种二级结构的占比。同时α-螺旋主要由C
O伸缩振动和部分N—H弯曲而出现特定的吸收峰,其可用于分析蛋白质二级结构的变化[23]。蛋白质二级结构包括β折叠(1 611~1 640 cm-1)、无规则卷曲(1 642~1 650 cm-1)、α-螺旋(1 654~1 662 cm-1)与β转角(1 665~1 693 cm-1)。在场强固定为3.8 kV时,随着温度的增加,α-螺旋含量的比例呈先上升后下降的趋势(如图5-a),得到最优的解冻温度为15 ℃。这种现象可能是由于α-螺旋被肽链内的氢键稳定,β-折叠依赖于肽链之间的氢键。由于温度过高或过低,蛋白质展开,氢键减弱,导致α螺旋破坏以及无规则卷曲和β转角的形成。当解冻温度为15 ℃时,随着场强的升高,α-螺旋含量的比例呈先增加后减少的趋势(如图5-b)。电场强度过高或过低时,由于蛋白质空间结构的改变,未折叠的蛋白质分子链将重新弯曲,使α-螺旋的比例减少。如图5所示,NT样品的肌球蛋白α-螺旋仅占18%,低于HVEFT样品的α-螺旋含量。稳定蛋白质结构的氢键被破坏后会导致有序结构的减少[19]。而蛋白质的氧化促使肌球蛋白α-螺旋结构的展开,提高其他3种二级结构的占比。同时α-螺旋主要由C![]() O和N—H之间的分子间氢键维持,高压静电场的存在使这些氢键不易被破坏[16],因而HVEFT能有效地稳固α-螺旋构像,降低解冻过程中的蛋白质变性程度。
O和N—H之间的分子间氢键维持,高压静电场的存在使这些氢键不易被破坏[16],因而HVEFT能有效地稳固α-螺旋构像,降低解冻过程中的蛋白质变性程度。

a-温度;b-场强
图5 HVEFT条件对去头虾肌球蛋白二级结构组成的影响
Fig.5 Effect of under different HVEFT conditions on the secondary structure composition of myosin in decapitated shrimp
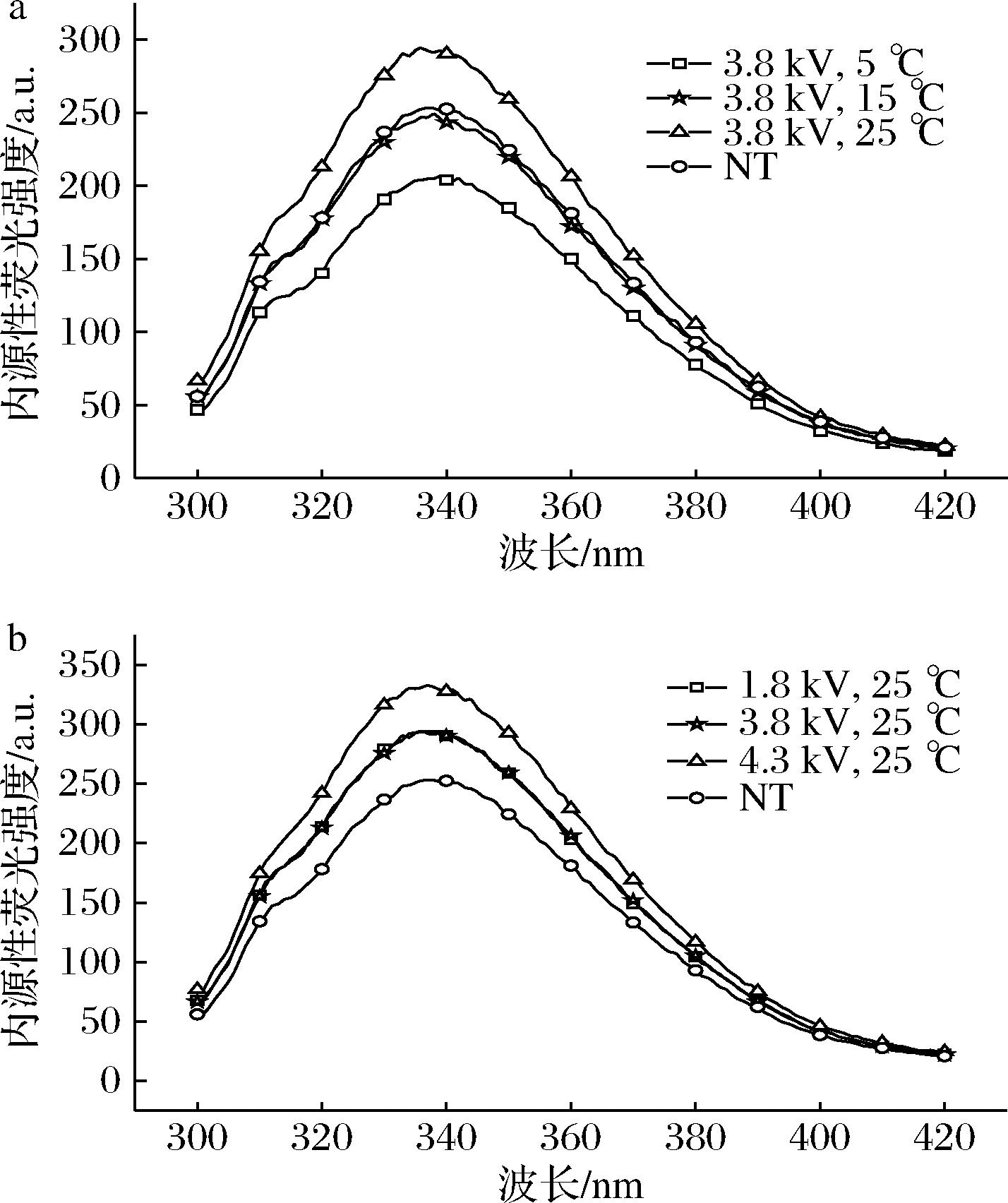
a-温度;b-场强
图6 HVEFT条件对去头虾肌球蛋白内源荧光强度的影响
Fig.6 Effect of under different HVEFT conditions on the endogenous fluorescence intensity of myosin in decapitated shrimp
2.3.2 内源性色氨酸荧光光谱分析
当肌球蛋白处于折叠状态时,包裹在蛋白质内部疏水结构中的色氨酸残基被激发后表现出较高的荧光强度;肌球蛋白部分或完全展开后,色氨酸因为暴露在蛋白质分子表面而导致荧光强度降低,因而根据色氨酸的荧光强度来判断对虾解冻后肌球蛋白结构的变化程度[24]。如图6所示,经不同条件解冻得到肌球蛋白的内源荧光强度有所不同。
当场强固定为3.8 kV时,随着温度的增加,内源荧光强度增加(如图6-a),得到最佳温度25 ℃。其原因是在较低的温度中的解冻时间较长,导致色氨酸残基暴露,从而降低内源性荧光强度。当解冻温度为25 ℃时,场强与内源荧光强度呈正比,且在4.3 kV时荧光强度最强,说明在该条件下受到自由基的攻击最弱。与HVEFT相比,NT的内源荧光强度最弱,说明解冻过程蛋白结构发生了变化,而HVEFT能提高肌球蛋白的内源性荧光强度,对肌球蛋白的氧化有一定的延缓作用。该结果与JIA等[13]的研究一致,空气解冻样品的内源荧光强度最低。
2.3.3 SDS-PAGE分析
蛋白质凝胶电泳条带常用于表征蛋白质的聚集或裂解变性情况。肌球蛋白主要由肌球蛋白重链(myosin heavy chain,MHC,200 kDa)、肌球蛋白螺旋尾(light meromyosin,LMM,70 kDa)和肌球蛋白轻链(myosin light chain,MLC,20 kDa)组成[25]。图7显示不同条件的HVEFT处理后肌球蛋白样品的电泳模式,其中由于解冻条件的不同,条带出现轻微变浅或加深的现象。如图7-a所示,在场强固定为3.8 kV时,随着温度的升高,蛋白条带逐渐变浅。
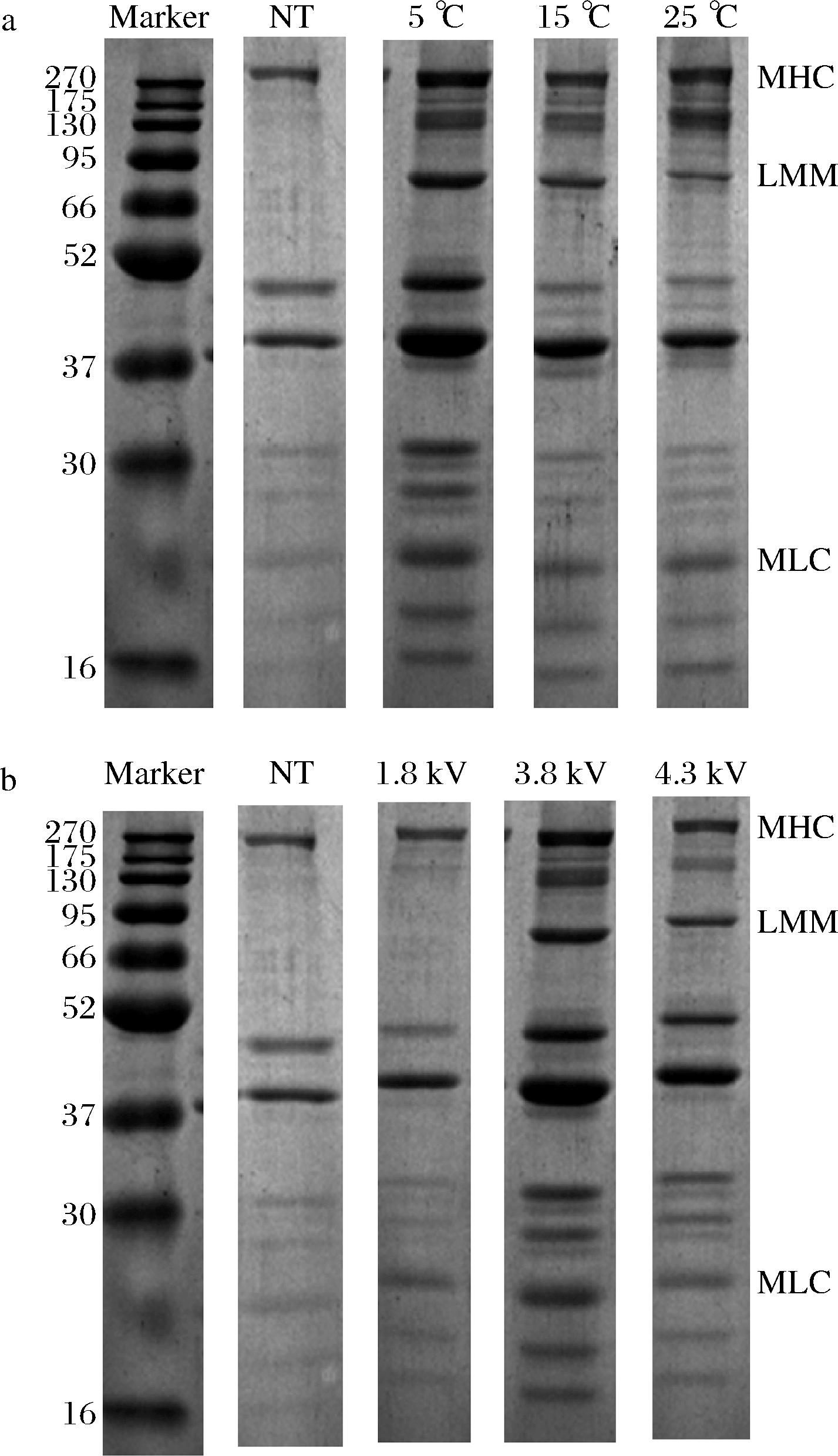
a-温度;b-场强
图7 HVEFT条件对去头虾肌球蛋白的SDS-PAGE分析
Fig.7 SDS-PAGE analysis of myosin from decapitated shrimp under different HVEFT conditions
表明样品在低温的环境中解冻更能保持样品的品质,得到较优的解冻温度为5 ℃。当解冻温度为5 ℃时,随着场强的增加,各条带的亮度和宽度呈现出先增强再减弱的现象,得到较优的解冻场强为3.8 kV。可能是因为相对较高的场强能有效地减少肌球蛋白各条带宽度和亮度的降低,但场强过高也会造成蛋白质的氧化变性。HVEFT在3.8 kV,5 ℃时,条带宽度和亮度最强,蛋白质被氧化降解的程度最小。相比于HVEFT处理的肌球蛋白的条带,NT处理的肌球蛋白条带在200 kDa处出现变浅的现象,而条带在70 kDa时基本消失。蛋白质的条带颜色变浅,表明蛋白质发生一定程度的降解和交联。HVEFT在某些条件下能加深或保持条带的颜色,说明HVEFT能在一定程度上维持肌球蛋白结构的稳定。
3 结论与讨论
水产品中的蛋白质含量丰富,加工过程中蛋白质的氧化降解对水产品品质的变化具有重要影响。其原因是蛋白质氧化形成的羰基化合物及其他聚合物会导致蛋白质的进一步降解,从而造成水产品品质的劣变。大量研究表明蛋白质氧化会对总巯基、羰基、表面疏水性和α-螺旋产生影响。结果表明,场强固定为3.8 kV时,随着温度的升高,总巯基、粒径、α-螺旋的含量呈先增后减的趋势,在15 ℃时达到最大值;表面疏水性呈先下降后上升的趋势,在15 ℃时达到最小值;羰基和内源荧光强度逐渐增加,在25 ℃时达到最大值。分别筛选出最佳的解冻温度。温度固定时,随着场强的增加,总巯基、α-螺旋和电泳条带亮度表现为先增后减的趋势,在3.8 kV时为最优值;羰基和内源荧光强度逐渐增加,4.3 kV时达到最大值;表面疏水性则呈现出先下降后上升的趋势,在3.8 kV时为最低值。分别得到最优的解冻场强。与NT对比,HVEFT能有效地抑制羰基和表面疏水性的增加与总巯基含量的下降,有利于降低解冻去头虾的蛋白质氧化程度,表明HVEFT能有效地阻碍由自由基介导肌球蛋白的氧化。同时,HVEFT有效防止肌球蛋白的α-螺旋结构向β折叠、无规则卷曲和β转角的转变,防止肌球蛋白发生聚集与抑制肌球蛋白各组成部分含量的降低,有利于维持肌球蛋白结构的稳定性。HVEFT是非热解冻且解冻均匀,能减少细胞的损伤,减少蛋白变性,提高解冻产品的品质;解冻装置成本低且能节约能源,现已有部分企业将其应用于生产加工过程中,随着科技的进步和发展,其应用领域也将会更加广泛。综合以上指标以及经济效益,得到场强3.8 kV,温度15 ℃为HVEFT最能保持肌球蛋白结构稳定的条件。该研究结果将为高压静电场技术在冷冻水产制品解冻工业中提供科学的数据支撑。
[1] QIU L Q, ZHANG M, BHANDARI B, et al.Shelf life extension of aquatic products by applying nanotechnology:A review[J].Critical Reviews in Food Science and Nutrition, 2022, 62(6):1521-1535.
[2] MOUSAKHANI-GANJEH A, HAMDAMI N, SOLTANIZADEH N.Impact of high voltage electric field thawing on the quality of frozen tuna fish (Thunnus albacares)[J].Journal of Food Engineering, 2015, 156:39-44.
[3] MOUSAKHANI-GANJEH A, HAMDAMI N, SOLTANIZADEH N.Thawing of frozen tuna fish (Thunnus albacares) using still air method combined with a high voltage electrostatic field[J].Journal of Food Engineering, 2016, 169:149-154.
[4] HE X L, LIU R, NIRASAWA S, et al.Effect of high voltage electrostatic field treatment on thawing characteristics and post-thawing quality of frozen pork tenderloin meat[J].Journal of Food Engineering, 2013, 115(2):245-250.
[5] CAI L Y, CAO M J, REGENSTEIN J, et al.Recent advances in food thawing technologies[J].Comprehensive Reviews in Food Science and Food Safety, 2019, 18(4):953-970.
[6] HSIEH C W, LAI C H, HO W J, et al.Effect of thawing and cold storage on frozen chicken thigh meat quality by high-voltage electrostatic field[J].Journal of Food Science, 2010, 75(4):M193-M197.
[7] JIA G L, LIU H J, NIRASAWA S, et al.Effects of high-voltage electrostatic field treatment on the thawing rate and post-thawing quality of frozen rabbit meat[J].Innovative Food Science &Emerging Technologies, 2017, 41:348-356.
[8] LI D P, JIA S L, ZHANG LT, et al.Post-thawing quality changes of common carp (Cyprinus carpio) cubes treated by high voltage electrostatic field (HVEF) during chilled storage[J].Innovative Food Science &Emerging Technologies, 2017, 42:25-32.
[9] XUE S W, WANG H H, YANG H J, et al.Effects of high-pressure treatments on water characteristics and juiciness of rabbit meat sausages:Role of microstructure and chemical interactions[J].Innovative Food Science &Emerging Technologies, 2017, 41:150-159.
[10] LUND M N, HEINONEN M, BARON C P, et al.Protein oxidation in muscle foods:A review[J].Molecular Nutrition &Food Research, 2011, 55(1):83-95.
[11] MOUSAKHANI-GANJEH A, HAMDAMI N, SOLTANIZADEH N.Effect of high voltage electrostatic field thawing on the lipid oxidation of frozen tuna fish (Thunnus albacares)[J].Innovative Food Science &Emerging Technologies, 2016, 36:42-47.
[12] 倪雪. 海水鱼和淡水鱼肌原纤维蛋白及肌球蛋白理化特性的研究[D].锦州:渤海大学, 2020.
NI X.Physicochemical properties of myofibrillar protein and myosin in marine fish and freshwater fish[D].Jinzhou:Bohai University, 2020.
[13] JIA G L, NIRASAWA S, JI X H, et al.Physicochemical changes in myofibrillar proteins extracted from pork tenderloin thawed by a high-voltage electrostatic field[J].Food Chemistry, 2018, 240:910-916.
[14] HUANG X, SUN L, LIU L, et al.Study on the mechanism of mulberry polyphenols inhibiting oxidation of beef myofibrillar protein[J].Food Chemistry, 2022, 372:131241.
[15] QIAN S Y, HU F F, LI X, et al.On the emerging of thawing drip:Role of myofibrillar protein renaturation[J].Food Chemistry, 2022, 393:133398.
[16] 汪少芸, 李晓贞, 陈旭, 等.鱼源抗冻多肽对鱼糜肌原纤维蛋白的冻融保护作用[J].广东海洋大学学报, 2023, 43(1):78-86.
WANG S Y, LI X Z, CHEN X, et al.Cryoprotective effect of fish-derived antifreeze peptides on surimi myofibril protein during freeze-thaw cycles[J].Journal of Guangdong Ocean University, 2023, 43(1):78-86.
[17] 刘岩, 李敏, 金枝, 等.生物保鲜剂真空浸渍对冰温贮藏罗非鱼蛋白特性的影响[J].广东海洋大学学报, 2022, 42(2):88-94.
LIU Y, LI M, JIN Z, et al.Effect of vacuum impregnation assisted biological preservatives on the protein properties of tilapia fillets during ice-temperature storage[J].Journal of Guangdong Ocean University, 2022, 42(2):88-94.
[18] 师希雄, 王建忠, 陈敬敬, 等.超高压处理对藏羊肉肌原纤维蛋白特性的影响[J].食品与发酵工业, 2022, 48(16):169-174;181.
SHI X X, WANG J Z, CHEN J J, et al.Influences of ultra-high pressure on the properties of myofibrillar proteins from Tibetan sheep meat [J].Food and Fermentation Industries, 2022, 48(16):169-174;181.
[19] 梁诗惠, 冯钰敏, 邓华荣, 等.解冻方式对鸡腿肉蛋白氧化特性的影响[J].食品与发酵工业, 2023, 49(5):223-229.
LIANG S H, FENG Y M, DENG H R, et al.Effects of thawing methods on protein oxidation characteristics of chicken thigh meat[J].Food and Fermentation Industries, 2023, 49(5):223-229.
[20] QIAN S Y, LI X, WANG H, et al.Effects of low voltage electrostatic field thawing on the changes in physicochemical properties of myofibrillar proteins of bovine Longissimus dorsi muscle[J].Journal of Food Engineering, 2019, 261:140-149.
[21] ZHANG Z Y, YANG Y L, ZHOU P, et al.Effects of high pressure modification on conformation and gelation properties of myofibrillar protein[J].Food Chemistry, 2017, 217:678-686.
[22] JIA G L, HE X L, NIRASAWA S, et al.Effects of high-voltage electrostatic field on the freezing behavior and quality of pork tenderloin[J].Journal of Food Engineering, 2017, 204:18-26.
[23] 俞军华. 鱼肉纤维的评价方法及白鲢鱼肉挤压重组研究[D].无锡:江南大学, 2022.
YU J H.Study on evaluation method of fish fiber and silver carp meat extrusion recombination[D].Wuxi:Jiangnan University, 2022.
[24] JIANG W X, HE Y F, XIONG S B, et al.Effect of mild ozone oxidation on structural changes of silver carp (Hypophthalmichthys molitrix) myosin[J].Food and Bioprocess Technology, 2017, 10(2):370-378.
[25] CONG H H, LYU H, LIANG W W, et al.Changes in myosin from silver carp (Hypophthalmichthys molitrix) under microwave-assisted water bath heating on a multiscale[J].Foods, 2022, 11(8):1071.