大鲵(Andrias davidianus)为有尾目,隐鳃鲵科,大鲵属两栖水生动物,体长可达2 m,是我国人工繁育和养殖实现产业化的重点水生保护动物品种之一[1]。大鲵作为珍稀补品具有极高的食用和药用价值[2],其肌肉[3]、血液[4]、黏液[5]、皮肤[6]和骨骼中含有许多不同的生物活性物质,具有抗氧化、抗菌、降血糖等诸多促进健康的功效[3, 7]。生物活性肽由可食用动植物蛋白酶解或发酵后产生,并具有抗氧化、降血糖和免疫调节等多种生物活性的蛋白质片段,且分子质量多小于6 000 Da[8]。随着大鲵人工养殖技术的成熟以及深加工利用的不断推进,大鲵源生物活性肽开发日益受到了关注,如抗菌肽[9]、降血糖肽[10]、抗氧化肽[11]、免疫调节肽[3]等。
硒是人体生长代谢必不可少的微量元素之一,具有抗氧化、抗肿瘤、免疫调节等生理功能[12]。近年来,随着多肽-矿物质螯合物产品的研究与开发增加,有关多肽-硒螯合物或复合物相关研究也受到了关注。已有来源于鱼头的肽[13]、大豆肽[14]、豌豆肽[15]、鳕鱼皮明胶肽[16]等为主体,分别与Na2SeO3进行螯合得到多肽-硒螯合物。YE等[17]制备出的大豆多肽-硒螯合物较大豆肽有着更强的羟自由基清除活性和还原能力。QIN等[15]利用豌豆低聚肽与Na2SeO3螯合制备出豌豆寡肽-硒螯合物,经分析表明,肽侧链自由基被折叠,螯合位点在N和O附近。赵丽娜等[18]利用响应面法优化菌草灵芝多肽与Na2SeO3的螯合工艺,发现影响螯合的主要因素分别为pH值、反应温度、体积比和反应时间。包怡红等[14]制备出了大豆多肽硒螯合物,螯合率为42.82%,其对DPPH自由基、羟自由基的清除能力以及还原能力均高于大豆多肽。QIN等[15,19]将玉米低聚肽和豌豆低聚肽与Na2SeO3进行螯合反应,并探究了肽和螯合物之间在抗氧化活性与结构表征方面的不同。
课题组前期已对大鲵肽制备、抗菌活性、抗氧化活性以及免疫调节活性进行了初步探究[3-4,6,9]。为了进一步开发大鲵高附加值产品以及丰富种类,本研究以大鲵肽为原料制备肽-硒螯合物,通过单因素和响应面试验对其制备工艺进行优化,考察其结构特征和抗氧化活性,为大鲵精深加工以及高值化产品开发提供参考。
1 仪器与材料
1.1 材料与试剂
健康鲜活大鲵5尾[体重(2.96±0.22) kg],汉中市龙头山水产养殖开发有限公司养殖基地。
Na2SeO3,天津市大茂化学试剂厂;乙二胺四乙酸二钠、L-抗坏血酸,天津市天力化学试剂有限公司;NaOH,天津市盛奥化学试剂有限公司;浓HCl、高氯酸、浓H2SO4,杭州汇普化工仪器有限公司;钼酸钠、3, 3-二氨基联苯胺(3,3′-diaminobenzidine, DAB),麦克林公司;无水乙醇,天津市富宇精细化工有限公司;碱性蛋白酶、木瓜蛋白酶、风味蛋白酶、胃蛋白酶,广西南宁庞博生物工程有限公司;胰蛋白酶,上海生工无股份有限公司;超滤膜(截留分子质量3 000 Da),南京艾宇琦膜科技有限公司。
1.2 仪器与设备
AIYUIQI膜过滤设备,南京艾宇琦膜科技有限公司;Allegra X-30R型离心机,Beckman coulter有限公司;pH 计、EL3002型电子天平,梅特勒-托利多仪器(上海)有限公司;JASCO日本分光J-1500圆二色光谱仪,日本分光株式会社;VERTEX70傅里叶红外光谱仪,德国Bruker公司;Evolution 201紫外-可见分光光度计,赛默飞世尔科技公司。
1.3 实验方法
1.3.1 大鲵肽制备
参考贺屹潮[3]的方法,稍作修改。大鲵经宰杀去皮、去除油脂,分割获得大鲵肉,并将大鲵肉匀浆成肉糜。以m(大鲵肉)∶m(水)=1∶3的比例加入蒸馏水,调整pH值至木瓜蛋白酶的最适条件,然后以3 000 U/g 的加酶量加入蛋白酶反应3 h,酶解过程中不断搅拌并滴入稀NaOH溶液使pH值保持恒定,酶解结束后采用沸水浴10 min灭酶,冷却至室温后10 000 r/min离心10 min,收集上清液,将上清液通过3 000 Da超滤膜分离,取小于3 000 Da组分进行真空冷冻干燥得到对应的大鲵肽(giant salamander peptide, GSP)。
1.3.2 大鲵肽-硒螯合物制备
参考包怡红等[14]的方法并稍作修改,将0.5 mol/L Na2SeO3溶液和大鲵肽溶液以体积比1∶2的比例充分混匀,调节pH值至9.0,在80 ℃水浴中振摇反应1 h后冷却,4 500 r/min、10 min离心取上清液,将上清液旋转蒸发至20 mL左右,利用肽硒螯合物不溶于有机溶剂特性,加入5倍体积的无水乙醇,4 ℃条件下静置12 h,4 500 r/min离心10 min后取沉淀,冷冻干燥沉淀得到大鲵肽-硒螯合物(giant salamander peptide-selenium chelate, Se-GSP)。
1.3.2.1 硒含量测定
硒含量测定采用3, 3-二氨基联苯胺比色法[20]。按公式(1)计算样品硒含量。
硒含量![]()
(1)
式中:ρ,从标准曲线中查得的相当于硒的标准质量浓度,μg/mL;V,甲苯萃取所得的样品体积,mL;m,样品的质量,g;φ,用于测定的样品体积的体积分数。
1.3.2.2 得率计算
参考秦修远等[21]的方法,按公式(2)计算大鲵肽-硒螯合物样品的得率。
得率![]()
(2)
式中:m2,反应体系总质量,g;m1,螯合物质量,g。
1.3.3 单因素试验
将大鲵肽溶于去离子水中,配制成一定质量分数多肽溶液,与0.5 mol/L Na2SeO3溶液恒温水浴一定时间。分别以体积比(1∶6、2∶6、3∶6、4∶6、5∶6、1∶1),肽浓度(1%、2%、3%、4%、5%、6%、7%、8%、9%、10%,质量分数,下同),螯合温度(50、60、70、80、90 ℃),螯合时间(30、40、50、60、70、80 min),pH值(4.0、5.0、6.0、7.0、8.0、9.0、10.0)进行单因素试验。
1.3.4 Plackett-Burman试验设计
Plackett-Burman试验设计可在较少的试验次数下,从众多因素中筛选出较显著的影响因素[22]。在单因素的试验结果的水平上,利用Design-Expert 8.0.6软件设计Plackett-Burman试验,每个因素分别取两个水平,-1和1分别代表低水平和高水平。其中肽浓度、体积比、螯合温度、pH值以及螯合时间的高低水平分别为9%、6%;5∶6、3∶6;90、60 ℃;9.0、7.0;70、50 min。响应值为硒含量和得率。分析各因素的效应值、方差以及贡献率,筛选出最重要的3个因素进行下一步探究。
1.3.5 最陡爬坡试验
根据Plackett-Burman试验结果得到显著因素和效应值,设计最陡爬坡试验的方向和步长,进而获取最佳工艺区域[23]。
1.3.6 Box-Behnken试验
通过分析Plackett-Burman试验和最陡爬坡试验所得出的各影响因素的范围,选取pH值、反应温度和体积比这3个对硒含量影响较大的因素水平,采用了三因素三水平进行响应面分析试验。试验的“-1”、“0”、“1”分别代表体积比1∶6、2∶6、3∶6,pH值8.5、9.0、9.5,螯合温度75、80、85 ℃。在此基础上对零点试验重复5次,以期提高该试验设计的灵敏度及准确度。
1.3.7 大鲵肽-硒螯合物的结构表征
1.3.7.1 紫外-可见吸收光谱测定
分别将大鲵肽和大鲵肽-硒螯合物冻干粉用超纯水配制成1 mg/mL的溶液,利用紫外-可见分光光度计进行紫外吸收光谱扫描,扫描范围200~800 nm,扫描速度60 nm/min,带宽1.0 nm[15]。
1.3.7.2 傅里叶红外光谱测定
分别将质量为2 mg的大鲵肽和大鲵肽-硒螯合物冻干粉混入200 mg干燥后的KBr粉末,于玛瑙研钵中充分研磨,压片后进行红外光谱扫描,扫描范围4 000~400 cm-1[19]。扫描图谱通过Omnic 7.3软件进行分析。
1.3.7.3 圆二色光谱测定
参考KELLY等[24]的方法,稍作修改。分别配制0.1 mg/mL 的GSP和Se-GSP溶液,扫描范围190~260 nm;1 cm的路径。使用CD Pro软件计算蛋白二级结构含量。
1.3.8 大鲵肽-硒螯合物的体外抗氧化活性
1.3.8.1 羟基自由基(·OH)清除率测定
参考QIN等[15]的方法,并稍作改动。将不同质量浓度的试样溶液与试剂按比例进行混合,其比例为试样溶液∶5 mmol/L水杨酸-无水乙醇溶液∶5 mmol/L亚硫酸铁溶液=1∶2∶2,混合后加入1倍体积的H2O2溶液启动反应,于37 ℃恒温水浴1 h,取出最终溶液在510 nm处测定吸光度,以维生素C作为阳性对照。平行测定3次,取平均值。根据公式(3)计算不同质量浓度的试样对·OH清除率:
·OH清除率![]()
(3)
式中:A1,不加试样溶液,但加入水杨酸-乙醇显色剂溶液的吸光度;A2,加入试样溶液,且加入水杨酸-乙醇显色剂溶液的吸光度;A3,加入试样溶液,加入水杨酸-乙醇显色剂溶液的吸光度。
1.3.8.2 超氧阴离子自由基(·O2-)清除率测定
参考黄玲玲等[25]的方法并稍作修改。分别取1 mL不同质量浓度的试样溶液,加入4.5 mL的0.05 mol/L三羟甲基氨基甲烷溶液(pH 8.2),于25 ℃恒温水浴10 min,随后加入0.2 mL的3 mmol/L邻苯三酚溶液并将其混合均匀,混合均匀之后在25 ℃恒温水浴5 min,最后加入8 mmol/L盐酸溶液终止反应,取出溶液在299 nm波长处测定最终溶液的吸光度。以维生素C为阳性对照,平行测定3次,取平均值。按公式(4)计算不同质量浓度的试样对·O2-清除率。
·O2-清除率![]()
(4)
式中:A1,不加试样溶液,且加入邻苯三酚溶液的吸光度;A2,加入试样溶液并且加入了邻苯三酚溶液的吸光度;A3,加入试样溶液,但不加邻苯三酚溶液的吸光度。
1.3.8.3 还原力测定
参考QIN等[15]的方法并稍作修改,将样品与0.2 mol/L磷酸盐缓冲液(pH 6.6)、质量分数为1%的铁氰化钾溶液以体积比1∶1∶1的比例混合均匀,于50 ℃水浴10 min,取出并迅速冷却。加入1倍体积的质量分数为10%的三氯乙酸溶液,混匀充分后迅速避光,随后取出1倍体积的反应混合物,并加入1倍体积的去离子水和0.2倍体积的质量分数为0.1%的FeCl3溶液,充分避光摇匀,静置10 min,于波长700 nm 处测量吸光度,将吸光度值作为表示样品还原能力的参数。以维生素C作为阳性对照,每组试验重复3次,取平均值。
1.3.9 数据分析
通过Design-Expert 8.0.6软件进行试验设计,每个试验重复3次,数据以平均值±标准偏差表示。利用SPSS 26.0对试验数据进行单因素方差分析和邓肯多重比较,以P<0.05表示差异显著,使用Origin 2021、Design-Expert 8.0.6软件进行绘图。
2 结果与分析
2.1 单因素试验结果
由图1-a可知,当肽浓度为1%时,Se-GSP的硒含量、得率最低。硒含量及得率随着肽浓度的增加而呈现出先增加后降低的趋势,当肽浓度升至7%时,硒含量达到最大值(3 827.22±108.07) μg/g,得率为(31.04±0.93)%,随着肽浓度的增加,硒含量和得率均趋于平缓,故在后续试验中,选择7%的肽浓度作为反应条件,且不再将肽浓度作为后续工艺优化的考察因素。由图1-b可知,随着肽溶液与Na2SeO3溶液体积比的增加,硒含量和得率逐渐增加,且随着体积比呈现先增加后降低的趋势。当肽溶液与Na2SeO3溶液体积比为4∶6时,Se-GSP的硒含量达到最高(3 847.24±96.63) μg/g;体积比为3∶6时,得率达到最高(32.23±0.95)%,综合考虑2个指标,螯合反应的体积比选择4∶6。由图1-c可知,随着温度的增加,Se-GSP的硒含量和得率也呈上升趋势,并在80 ℃达到最大,硒含量和得率分别为(4 249.55±146.19) μg/g、(28.24±0.46)%。当温度超过80 ℃后,得率稍有下降,硒含量逐渐下降,说明过高的温度会使肽链过度展开,影响配位构象,不利于形成螯合物[14]。从图1-d可以看出,随着反应体系pH值的增加,Se-GSP的硒含量及得率均呈先增加后下降的趋势,当pH值为8.0时,硒含量和得率分别为(3 589.82±85.52) μg/g、(21.93±0.51)%。当pH值>8.0之后,硒含量和得率均呈下降趋势并趋于平缓,此结果与秦修远等[21]研究结果一致;且pH值为8.0与pH值分别为4.0、5.0、6.0、7.0、9.0、10.0的6个条件下的Se-GSP的硒含量和得率有显著差异(P<0.05)。由图1-e可知,随着螯合时间的增加,硒含量和得率均呈现先增加后减小的趋势,当螯合时间为60 min时,硒含量和得率分别为(3 526.51±54.15) μg/g、(30.07±0.01)%。但当螯合时间超过60 min时,硒含量与得率均开始降低,螯合时间过长反而不利于螯合反应的进行。综合多方面因素考虑,通过单因素试验得到的最适螯合条件为肽浓度7%,体积为比4∶6,螯合温度80 ℃,pH值为8.0,螯合时间60 min。
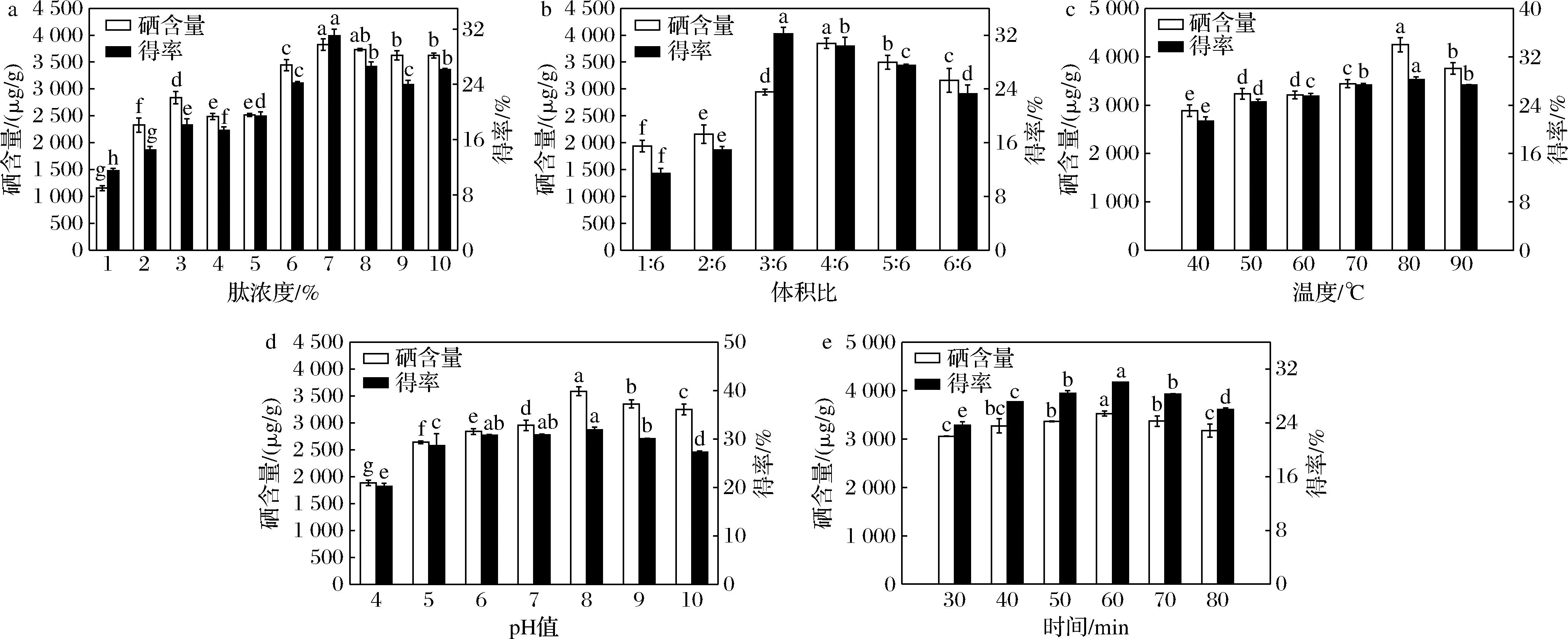
a-肽浓度;b-体积比;c-螯合温度;d-pH;e-螯合时间
图1 不同因素对Se-GSP硒含量和得率的影响
Fig.1 The influence of same factors on the selenium content and yield of Se-GSP
注:同一指标上标注的不同小写字母不同表示差异显著(P<0.05),下同。
2.2 Plackett-Burman试验结果
本试验对肽浓度(A)、体积比(B)、螯合温度(C)、pH值(D)、螯合时间(E)5个因素分析,考察各因素对制备Se-GSP硒含量及得率的影响,用Design Expert 8.0.6软件设计N=12的Plackett-Burman试验,结果如表1所示。
表1 Plackett-Burman试验设计及结果
Table 1 Design and results of the Plackett-Burman test
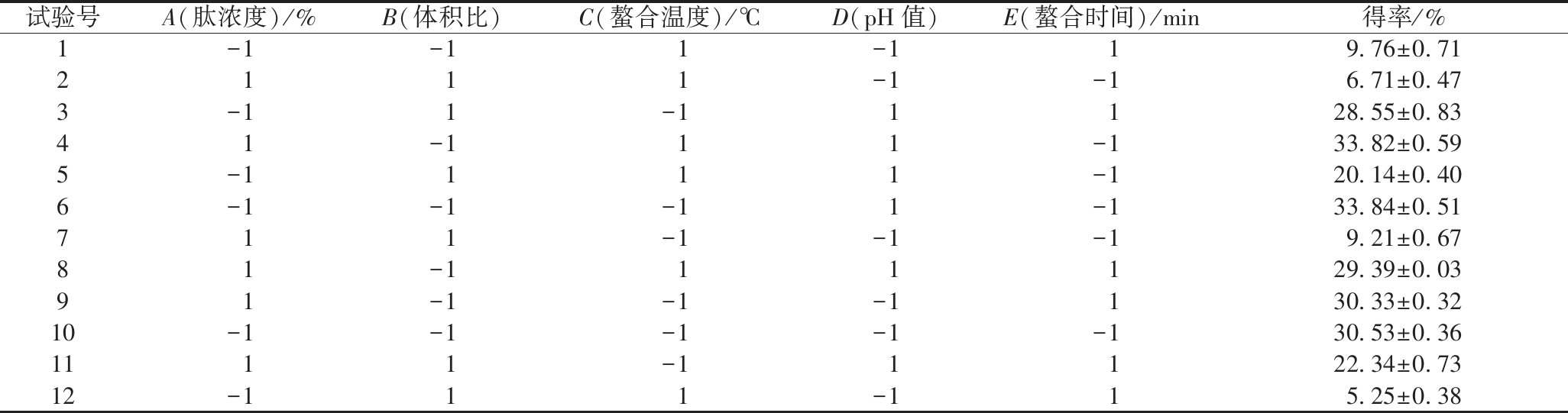
试验号A(肽浓度)/%B(体积比)C(螯合温度)/℃D(pH值)E(螯合时间)/min得率/%1-1-1 1-1 19.76±0.712111-1-16.71±0.473-11-11128.55±0.8341-111-133.82±0.595-1111-120.14±0.406-1-1-11-133.84±0.51711-1-1-19.21±0.6781-111129.39±0.0391-1-1-1130.33±0.3210-1-1-1-1-130.53±0.361111-11122.34±0.7312-111-115.25±0.38
由表2可知,以得率为响应值时,其肽浓度和pH值对Se-GSP的得率均显示正效应,体积比、螯合温度和螯合时间显示为负效应。各因素效应值的大小和贡献率反映出该因素对螯合反应的影响程度,效应值绝对值越大表示该因素的贡献率越高,对试验结果的影响越大[22]。
表2 Plackett-Burman试验效应分析
Table 2 Effect analysis of the Plackett-Burman test
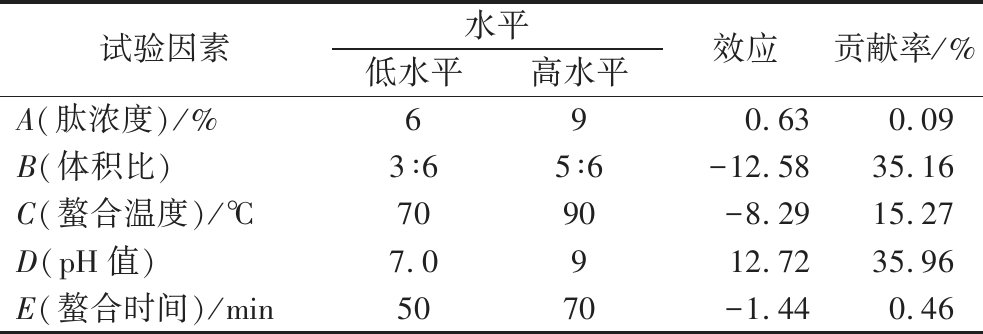
试验因素水平低水平高水平效应贡献率/%A(肽浓度)/%69 0.630.09B(体积比)3∶65∶6-12.5835.16C(螯合温度)/℃7090-8.2915.27D(pH值)7.0912.7235.96E(螯合时间)/min5070-1.440.46
通过对12组试验中Se-GSP的硒含量结果进行建模分析得到表3,其整体模型方差为0.012 5,表明模型整体对试验结果有显著性影响(P<0.05)。P值越小贡献率越高,其中体积比、螯合温度、pH值三因素对试验结果具有显著性影响,因此将以这3个因素建立模型对螯合条件进一步优化,螯合时间及肽浓度的水平由PB试验的正负效应与单因素试验结果共同确定,分别为7%和60 min。
表3 Plackett-Burman试验整体因素模型方差分析表
Table 3 Analysis of variance table for the overall factor model of the Plackett-Burman test
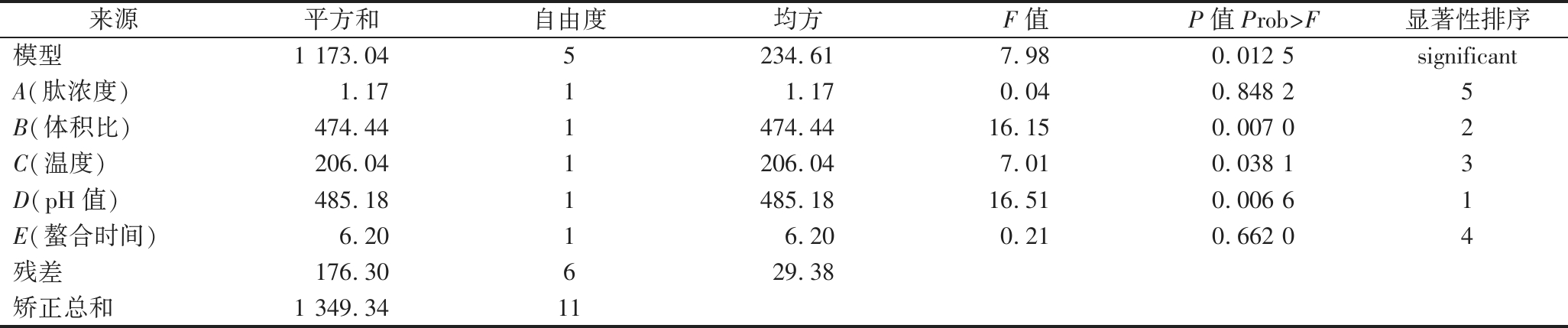
来源平方和自由度均方F值P值Prob>F显著性排序模型1 173.045234.617.980.012 5significantA(肽浓度)1.1711.170.040.848 25B(体积比)474.441474.4416.150.007 02C(温度)206.041206.047.010.038 13D(pH值)485.181485.1816.510.006 61E(螯合时间)6.2016.200.210.662 04残差176.30629.38矫正总和1 349.3411
2.3 最陡爬坡结果
根据Plackett-Burman试验结果设计因素的最陡爬坡路径,其中pH值为正效应,应增加,体积比以及温度为负效应,应减少。按照因素水平的变化及方向设计试验,结果如表4所示。最佳螯合条件可能在试验编号3和试验编号5之间,因此以试验编号4的条件为响应面试验的中心点。
表4 最陡爬坡试验设计及结果
Table 4 The design and results of the steepest climb test
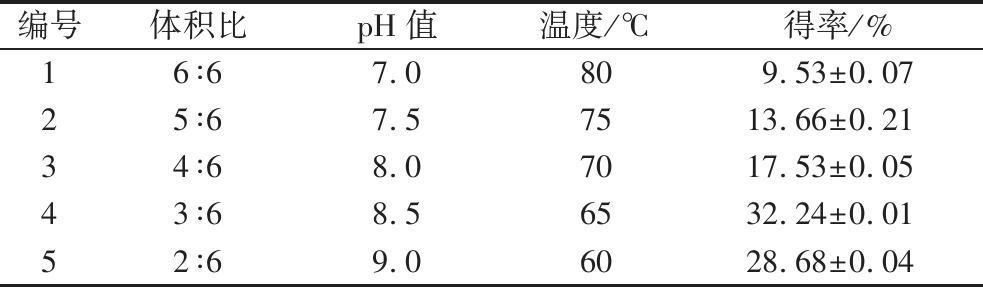
编号体积比pH值温度/℃得率/%16∶67.0809.53±0.0725∶67.57513.66±0.2134∶68.07017.53±0.0543∶68.56532.24±0.0152∶69.06028.68±0.04
2.4 Box-Behnken试验结果
综合考虑Plackett-Burman试验和最陡爬坡试验的结果,设计三因素三水平的Box-Behnken试验,以得率为响应值,试验设计及结果如表5所示。
表5 Box-Behnken试验设计及结果
Table 5 The design and results of Box-Behnken experiment
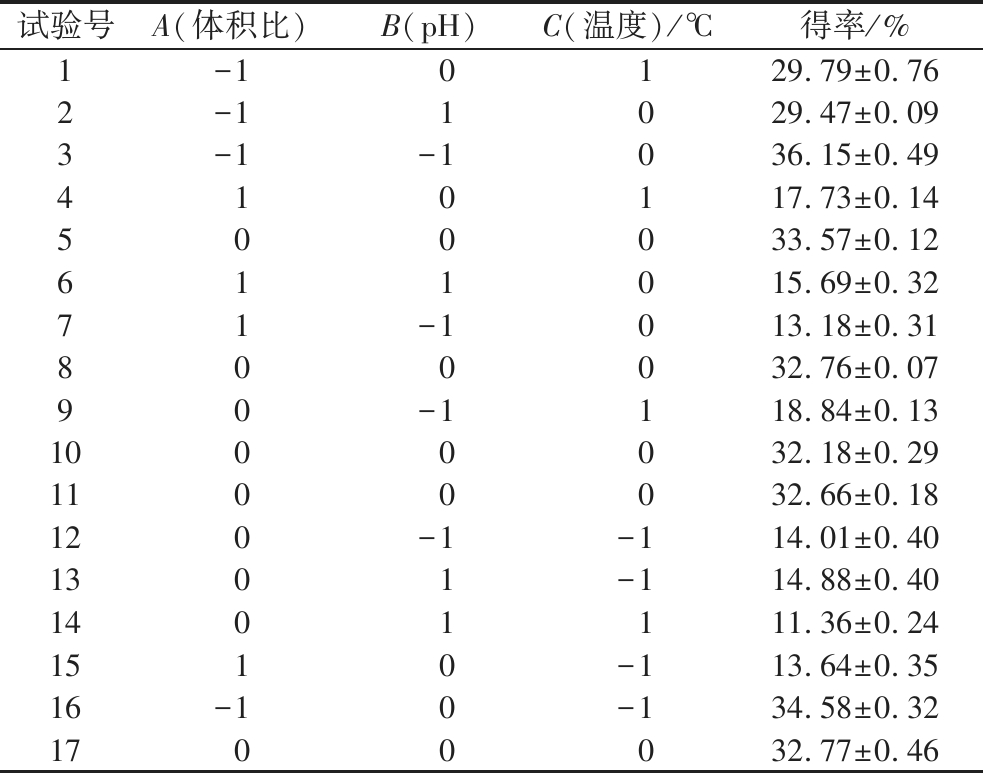
试验号A(体积比)B(pH)C(温度)/℃得率/%1-1 0 129.79±0.762-11029.47±0.093-1-1036.15±0.49410117.73±0.14500033.57±0.12611015.69±0.3271-1013.18±0.31800032.76±0.0790-1118.84±0.131000032.18±0.291100032.66±0.18120-1-114.01±0.401301-114.88±0.401401111.36±0.241510-113.64±0.3516-10-134.58±0.321700032.77±0.46
根据表5中Se-GSP得率的试验结果,利用Design-Expert 8.0.6 软件建立关于体积比(A)、pH值(B)、温度(C)3个影响因素与得率(Y)之间的多元二次回归模型,其方程如下:
Y=+32.79-8.72A-1.35B+0.077C+2.30AB+2.22AC-2.09BC-5.568E-003A2-9.16B2-8.85C2
对回归模型进行方差分析,结果如表6所示。其中试验模型F值为273.00,由噪声引起的可能性为0.01%,表明模型回归极显著(P<0.000 1)。模型失拟项P值为0.106 5>0.05,失拟项检验不显著。进一步对回归模型的可信度进行分析。结果表明模型的决定系数R2=0.997 2,矫正决定系数![]() 变异系数为3.11,信噪比为42.336>4,表明模型合理可用,拟合较好,未知因素对试验结果干扰较小。对Se-GSP的得率而言,A、B、AB、AC、BC、B2、C2项对得率均有显著影响(P<0.05),其影响大小的排序为:A、B2、C2>AB>AC>BC> B。从一次项方面可得体积比和pH值是影响大Se-GSP得率的主要因素,二次项结果表明了各试验因素与得率之间的影响是复杂的,可以利用该回归方程确定最佳螯合工艺。
变异系数为3.11,信噪比为42.336>4,表明模型合理可用,拟合较好,未知因素对试验结果干扰较小。对Se-GSP的得率而言,A、B、AB、AC、BC、B2、C2项对得率均有显著影响(P<0.05),其影响大小的排序为:A、B2、C2>AB>AC>BC> B。从一次项方面可得体积比和pH值是影响大Se-GSP得率的主要因素,二次项结果表明了各试验因素与得率之间的影响是复杂的,可以利用该回归方程确定最佳螯合工艺。
表6 Box-Behnken试验回归模型方差分析
Table 6 The AVOVA of Box-Behnken experiment
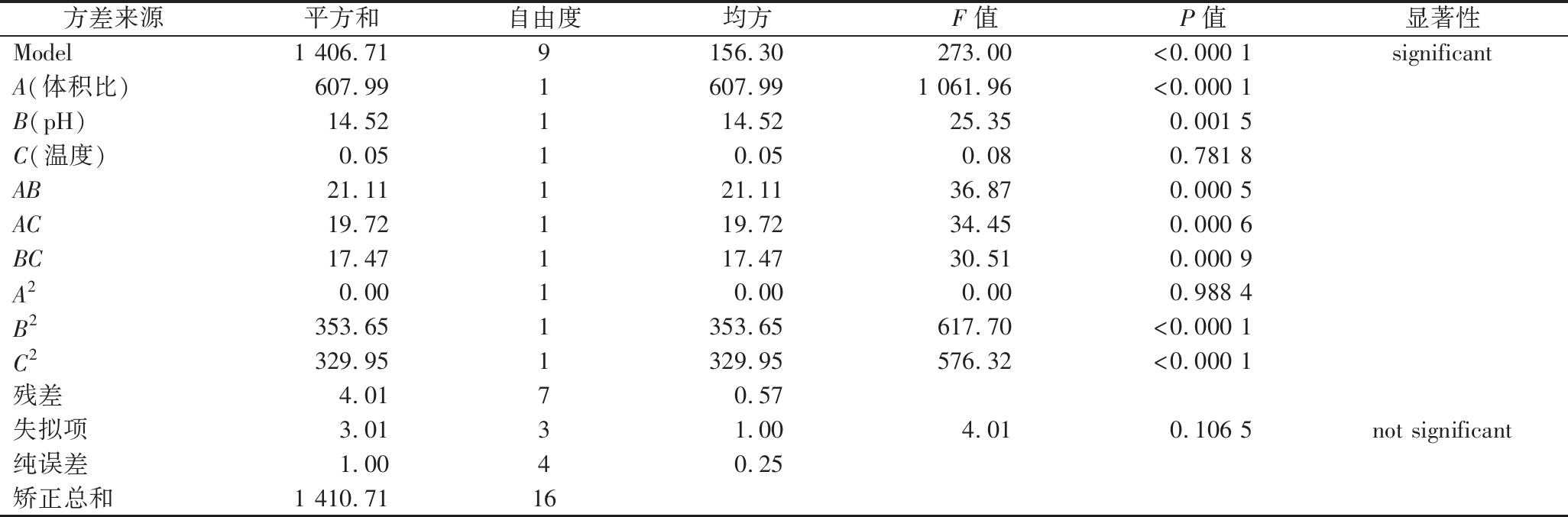
方差来源平方和自由度均方F值P值显著性Model1 406.719156.30273.00<0.000 1significantA(体积比)607.991607.991 061.96<0.000 1B(pH)14.52114.5225.350.001 5C(温度)0.0510.050.080.781 8AB21.11121.1136.870.000 5AC19.72119.7234.450.000 6BC17.47117.4730.510.000 9A20.0010.000.000.988 4B2353.651353.65617.70<0.000 1C2329.951329.95576.32<0.000 1残差4.0170.57失拟项3.0131.004.010.106 5not significant纯误差1.0040.25矫正总和1 410.7116
根据回归拟合方程及回归模型方差分析表可得二次回归方程等高线图和响应3D图。如图2所示,等高线图呈椭圆形,抛物线向下,说明模型存在最大值,模型建立良好[18]。在试验参数范围内,沿着体积比方向的等高线比pH和螯合温度方向的等高线更加密集和陡峭,表明体积比对硒含量的影响要大于pH和螯合温度对硒含量的影响。pH和螯合温度的等高线呈椭圆状,表明pH与螯合温度之间相互作用不明显。

图2 两因素交互作用的响应面图和等高线图
Fig.2 The response surfaces and the contour plots of two factors
最终通过回归模型优化计算得到硒含量的最佳工艺为体积比为46∶100,pH值为8.46,温度为65.00 ℃,此条件下的预测得率为34.54%,经过验证得到螯合物得率为36.18%,与模型预测值无显著差异(P>0.05)。
2.5 GSP和Se-GSP的结构表征分析
紫外-可见吸收光谱法可用于分析是否有新物质的产生。从图3-a可以看出,Se-GSP的吸收强度高于GSP的吸收强度。GSP的吸收峰值分别在224、205、257 nm处。GSP在257 nm处具有吸收峰,这是因为GSP中的芳香族氨基酸在250~280 nm下具有紫外吸收[26]。GSP与Na2SeO3螯合后,Se-GSP在257 nm处的吸收峰消失,这可能是与硒离子螯合过程中,苯丙氨酸、酪氨酸和色氨酸中的电荷发生了迁移[26]。Se-GSP的吸收峰值在201、207 nm处,说明GSP与硒元素发生螯合反应后,GSP的吸收峰具有整体蓝移的趋势。QIN等[15, 19]发现玉米低聚肽和豌豆低聚肽与硒螯合之后,吸光强度均增大。肽与元素离子发生螯合反应之后生色团和助色团的空间结构具有手型,导致螯合物的紫外吸收强度增加,发生红移。李洪艳[13]将真鲷鱼头肽与硒螯合之后,发现螯合物的最大吸收峰值由264.4 nm移至254.5 nm处,且吸收强度也增加,这是肽与硒结合后相应原子的价电子跃迁不同的反映。
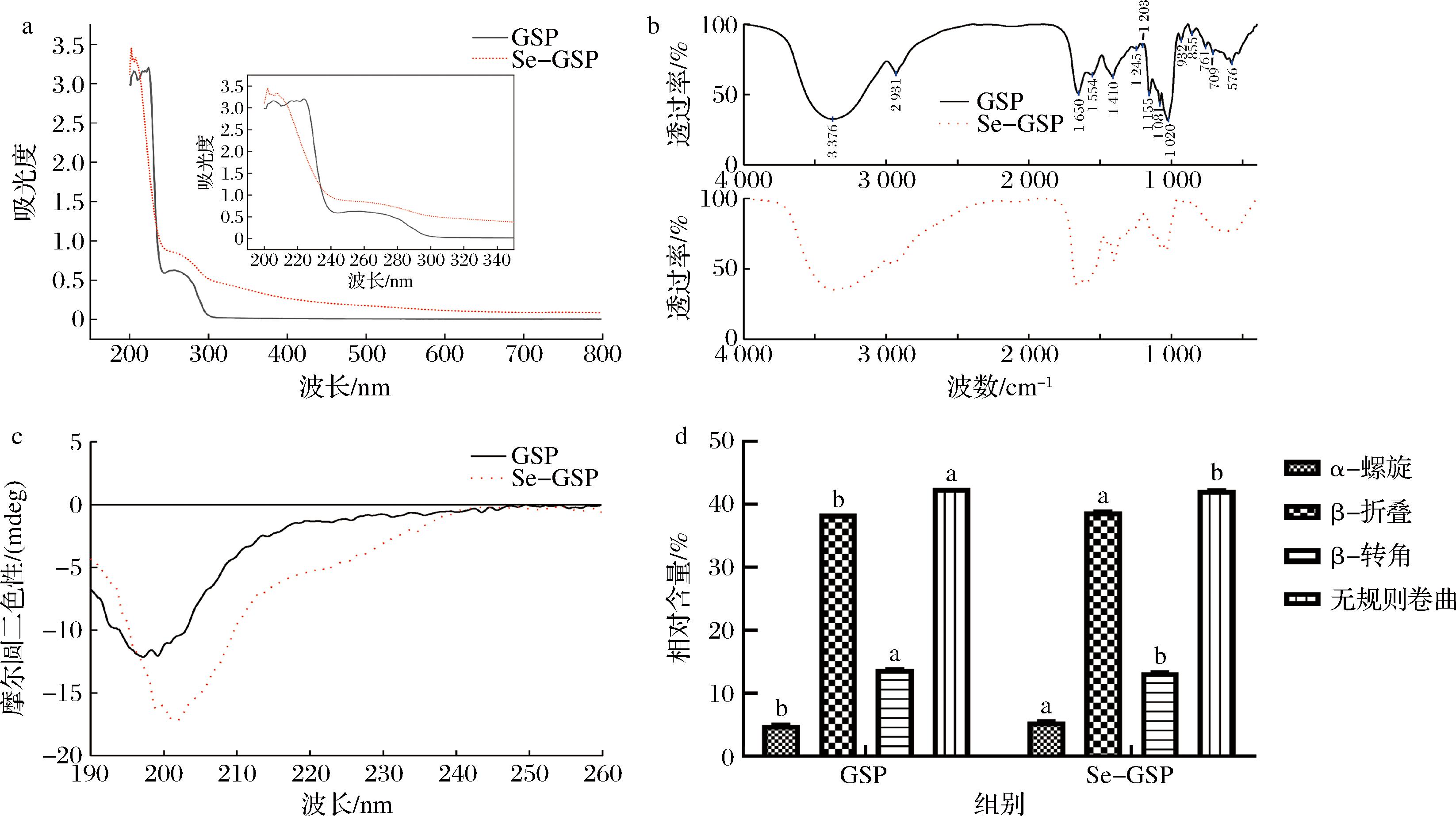
a-紫外可见光谱图;b-傅里变换叶红外光谱;c-圆二色光谱图;d-二级结构相对含量图
图3 GSP和Se-GSP的结构特征
Fig.3 Structure characterization of GSP and Se GSP
注:GSP为大鲵肽,Se-GSP为大鲵肽-硒螯合物,同一指标上标注字母不同表示差异显著(P<0.05)(下同)。
利用傅里叶变换红外光谱可以分析4 000~400 cm-1波数处的特征吸收峰变化,这种变化可反映出金属离子与多肽链上的有机配位基团的结合情况。红外光谱一般由2个区域构成,分别是官能团区域(4 000~1 300 cm-1)和指纹区域(1 300~600 cm-1)。GSP肽链中含有—NH2和—COOH,因此红外光谱图中的吸收峰会随着—NH2的伸缩振动、边角振动和—COOH的伸缩振动等的变化而发生改变[18]。由图3-b可看出Se-GSP的红外光谱曲线不同于GSP。综合分析GSP红外光谱图发现,在酰胺3 376 cm-1处N—H键的伸缩振动和酰胺1 650 cm-1处的C![]() 0伸缩振动处有明显的特征吸收峰,2 931 cm-1处的吸收C—H伸缩振动引起的特征吸收峰,1 409 cm-1属于羧基的对称振动,576 cm-1是由C
0伸缩振动处有明显的特征吸收峰,2 931 cm-1处的吸收C—H伸缩振动引起的特征吸收峰,1 409 cm-1属于羧基的对称振动,576 cm-1是由C![]() O的面外弯曲引起,900~650 cm-1范围出现吸收峰是C—H和N—H的面外弯曲振动导致。GSP与Na2SeO3螯合后,主要的吸收峰发生较明显的位移,相对强度也发生变化,与Na2SeO3螯合后,酰胺3 376 cm-1处转移到3 358 cm-1,发生蓝移;酰胺1 650 cm-1转移到1 657 cm-1处,出现红移;1 409 cm-1处是—COOH的伸缩振动的吸收峰,螯合后转到1 457 cm-1处,原位消失。该结果和赵立娜等[18]的研究结果相似,可能是GSP与Na2SeO3的螯合导致吸收峰的偏移和变化,因此推测GSP的—COOH和酰胺可能参与硒的螯合作用。
O的面外弯曲引起,900~650 cm-1范围出现吸收峰是C—H和N—H的面外弯曲振动导致。GSP与Na2SeO3螯合后,主要的吸收峰发生较明显的位移,相对强度也发生变化,与Na2SeO3螯合后,酰胺3 376 cm-1处转移到3 358 cm-1,发生蓝移;酰胺1 650 cm-1转移到1 657 cm-1处,出现红移;1 409 cm-1处是—COOH的伸缩振动的吸收峰,螯合后转到1 457 cm-1处,原位消失。该结果和赵立娜等[18]的研究结果相似,可能是GSP与Na2SeO3的螯合导致吸收峰的偏移和变化,因此推测GSP的—COOH和酰胺可能参与硒的螯合作用。
圆二色光谱可用于研究蛋白质或肽在水溶液中二级结构的光谱技术,能够反应蛋白质肽键的构象[27]。如图3-c所示,GSP在200 nm处有负峰,螯合后发生红移至202 nm处,这表明GSP与硒离子发生结合形成了新的物质。根据CD Pro软件分析,可以得到蛋白质二级结构构象的含量信息,见图3-d,GSP的二级结构主要以无规则卷曲为主,含量为42.60%,以无序的形式存在;Se-GSP二级结构α-螺旋和β-折叠含量较GSP上升(P<0.05),β-转角和无规则卷曲含量显著降低(P<0.05)。无规则卷曲的减少说明螯合反应改变了GSP原有的二级结构,由原来的无序结构向有序结构转变。ZHANG等[28]将太平洋鳕鱼骨胶原蛋白肽与钙离子进行螯合反应,螯合后发现α-螺旋含量和β-折叠的含量显著增加,与本文研究结果类似。
综合分析上述多种光谱学结果可知,GSP与硒离子螯合后,紫外光谱吸收峰强度增大且红移;表征—COOH和酰胺官能团的振动谱峰发生了强度和位置上的改变;Se-GSP中α-螺旋和β-折叠含量与GSP相比显著增加,β-转角和无规则卷曲含量明显降低,说明大鲵肽和Na2SeO3之间发生了螯合反应,本研究制备获得了大鲵肽-硒螯合物。但是本研究对制备的大鲵肽-硒螯合物未做进一步分离纯化,今后可尝试分离鉴定螯合硒能力的寡肽序列,以便精准理解其构效关系。
2.6 GSP和Se-GSP的体外抗氧化活性
·OH与衰老有着直接关系,在活性氧中危害性最大,可导致机体组织细胞发生病变[29]。由图4-a可知,GSP和Se-GSP均表现出较强的·OH清除能力,在一定质量浓度范围内,其清除能力随着样品质量浓度的增加而增强,由图4-b可知,当维生素C的质量浓度为2.0 mg/mL时,对·OH的清除率超过90%。GSP和Se-GSP对·OH的清除率都低于阳性对照(维生素C)。GSP对·OH的清除率变化曲线接近线性,斜率较小,GSP清除·OH的半抑制浓度(half maximal inhibitory concentration,IC50)为7.67 mg/mL。Se-GSP对·OH的IC50值为1.63 mg/mL。当Se-GSP的质量浓度>6 mg/mL时,其清除能力逐渐稳定;当质量浓度为10 mg/mL时,对·OH的清除能力最强,达到(95.87±0.02)%。这与YE等[17]对大豆肽硒螯合物清除·OH的结果相似。有研究表明,硒的抗氧化能力是通过调节氧自由基和抗氧化酶活性来实现的,具有·OH清除能力是实现抗氧化功能的途径之一[29]。本研究在测试质量浓度范围内,Na2SeO3具有较高的羟基自由清除能力,GSP清除·OH的能力最低,Se-GSP对·OH清除能力显著优于相同质量浓度的GSP(P<0.05),具有更好的抗氧化活性。

a-GSP和Se-GSP的·OH清除率;b-维生素C的·OH清除率;c-GSP和Se-GSP的·O2-清除率;d-维生素C的·O2-清除率;e-GSP和Se-GSP的还原力;f-维生素C的还原力
图4 GSP和Se-GSP的抗氧化活性
Fig.4 Antioxidant activities of GSP and Se GSP
·O2-有很强的活性,可以使核酸链断裂,促使细胞膜脂质过氧化,造成膜损伤等;可通过邻苯三酚法检测有色中间产物的含量,进一步评估样品的·O2-的清除能力[30]。如图4-c所示,GSP和Se-GSP对·O2-有一定的清除能力,Se-GSP对·O2-的清除能力强于GSP,随着浓度的增加,GSP和Se-GSP对·O2-的清除率呈增加趋势,在10 mg/mL时,Se-GSP对·O2-的清除率为(62.39±0.98)%,IC50值为7.83 mg/mL。这与QIN等[19]对玉米低聚肽硒螯合物清除·OH的结果相似。由图4-d可知,维生素C拥有很强的清除·O2-能力,在质量浓度为1.5 mg/mL时,清除率就已超过90%。Na2SeO3对·O2-的清除能力与质量浓度成正比,但远小于GSP和Se-GSP对·O2-的清除能力。
还原能力是评价抗氧化功能的一个重要指标,吸光度可用于间接表示还原能力,样品还原能力的大小与吸光度强弱成正比[14]。GSP和Se-GSP均具有较好的还原力,随着质量浓度的增加,还原能力逐渐增加(图4-e)。在相同的质量浓度下,Se-GSP的还原力强于GSP的还原能力。由图4-e、图4-f可知,GSP和Se-GSP的还原力弱于维生素C,Na2SeO3几乎没有还原能力,其变化曲线趋于极低水平。这与QIN等[15]对豌豆低聚肽硒螯合物的还原力结果相近。但是1 mg/mL大豆多肽-硒螯合物在700 nm波长下的吸光度为0.26[17],高于同浓度Se-GSP的吸光度(0.11±0.000 6)。
3 结论
利用酶解法获得GSP与Na2SeO3进行螯合反应,以得率为指标,通过单因素试验和响应面试验优化了Se-GSP的制备工艺。结果表明,当肽浓度7%、螯合时间60 min、体积比46∶100、pH值为8.46、螯合温度为65 ℃时,Se-GSP的得率为36.18%,与模型预测值34.54%无显著差异(P>0.05)。体积比对螯合反应的影响最大,其次是pH值和螯合温度。利用多种光谱学方法对Se-GSP进行结构表征与分析。GSP与Na2SeO3螯合后,紫外光谱吸收峰强度增大且红移。傅里叶变换红外光谱上表征—COOH和酰胺官能团的振动谱峰发生了强度和位置上的改变。圆二色光谱结果显示Se-GSP中α-螺旋和β-折叠含量较GSP显著上升(P<0.05),β-转角和无规则卷曲的含量显著减少(P<0.05)。抗氧化活性结果表明,GSP和Se-GSP具有较好的羟自由基、超氧阴离子自由基清除能力及还原能力,Se-GSP的抗氧化活性相对更强。今后将对肽硒螯合物进行分离纯化、鉴定螯合硒能力的寡肽序列,进一步探讨构效关系,以及开展体内抗氧化活性和安全性评价,本研究为大鲵肽硒螯合物相关产品研发提供技术支撑。
[1] JIN W G, CHEN X H, GENG J Z, et al.Quality characteristics and moisture mobility of giant salamander (Andrias davidianus) jerky during roasting process[J].Journal of Food Quality, 2021, 2021:9970797.
[2] HE D, ZHU W M, ZENG W, et al.Nutritional and medicinal characteristics of Chinese giant salamander (Andrias davidianus) for applications in healthcare industry by artificial cultivation:A review[J].Food Science and Human Wellness, 2018, 7(1):1-10.
[3] 贺屹潮. 大鲵肉酶解肽制备及抗氧化与免疫调节活性研究[D].汉中:陕西理工大学, 2020.
HE Y C.Preparation of enzymatic peptides from Chinese giant salamander(Andrias davidiauns) meat and its antioxidant and immunomodulatory activity[D].Hanzhong:Shaanxi University of Technology, 2020.
[4] PEI J, FENG Z, REN T, et al.Purification, characterization and application of a novel antimicrobial peptide from Andrias davidianus blood[J].Letters in Applied Microbiology, 2018, 66(1):38-43.
[5] CHEN X H, JIN W G, CHEN D J, et al.Collagens made from giant salamander (Andrias davidianus) skin and their odorants[J].Food Chemistry, 2021, 361:130061.
[6] JIN W G, PEI J J, DU Y N, et al.Characterization and functional properties of gelatin extracted from Chinese giant salamander (Andrias davidianus) skin[J].Journal of Aquatic Food Product Technology, 2019, 28(8):861-876.
[7] 关百婷, 李伟, 赵菲, 等.大鲵活性肽对D-半乳糖致小鼠机体氧化损伤的修复作用[J].食品工业科技, 2021, 42(16):344-352.
GUAN B T, LI W, ZHAO F, et al.Protective effects of giant salamander bioactive peptides on D-galactose induced oxidative damage in mice[J].Science and Technology of Food Industry, 2021, 42(16):344-352.
[8] S NCHEZ A, V
NCHEZ A, V ZQUEZ A.Bioactive peptides:A review[J].Food Quality and Safety, 2017, 1(1):29-46.
ZQUEZ A.Bioactive peptides:A review[J].Food Quality and Safety, 2017, 1(1):29-46.
[9] PEI J, CHEN D, JIN W, et al.Structure and mode of action of a novel antibacterial peptide from the blood of Andrias davidianus[J].Letters in Applied Microbiology, 2019, 69(5):312-317.
[10] ZHOU M, REN G Y, ZHANG B, et al.Screening and identification of a novel antidiabetic peptide from collagen hydrolysates of Chinese giant salamander skin:Network pharmacology, inhibition kinetics and protection of IR-HepG2 cells[J].Food &Function, 2022, 13(6):3329-3342.
[11] RAMADHAN A H, PEMBE W M, ALI OMAR K, et al.Characterization of antioxidant activity of peptide fractions from Chinese giant salamander (Andriaus davidianus) protein hydrolysate[J].Journal of Global Innovations in Agricultural Sciences, 2017, 5:14-19.
[12] 贾蕾, 向极钎, 殷红清, 等.生物活性硒肽的研究进展[J].食品科学, 2021, 42(15):346-355.
JIA L, XIANG J Q, YIN H Q, et al.Progress in bioactive selenium-containing peptides[J].Food Science, 2021, 42(15):346-355.
[13] 李洪艳. 真鲷鱼头制取鱼油及肽硒螯合物的研究[D].天津:天津科技大学, 2013.
LI H Y.Study on the preparation of fish oil and peptide-selenium chelates from fed sea bream head[D].Tianjin:Tianjin University of Science &Technology, 2013.
[14] 包怡红, 王芳, 王文琼.大豆多肽硒螯合物的制备及抗氧化活性分析[J].食品科学, 2013, 34(16):27-32.
BAO Y H, WANG F, WANG W Q.Preparation and antioxidant activity of selenium-chelating soybean peptides[J].Food Science, 2013, 34(16):27-32.
[15] QIN X Y, ZHANG J T, LI G M, et al.Structure and composition of a potential antioxidant obtained from the chelation of pea oligopeptide and sodium selenite[J].Journal of Functional Foods, 2020, 64:103619.
[16] 吴佳南, 孙娜, 林松毅, 等.鳕鱼皮明胶肽硒复合物的制备及结构表征[J].食品科学, 2021, 42(4):87-93.
WU J N, SUN N, LIN S Y, et al.Preparation and structural characterization of peptide-selenium complex from hoki(Macruronus novaezelandiae) skin gelatin[J].Food Science, 2021, 42(4):87-93.
[17] YE Q W, WU X P, ZHANG X Y, et al.Organic selenium derived from chelation of soybean peptide-selenium and its functional properties in vitro and in vivo[J].Food &Function, 2019, 10(8):4761-4770.
[18] 赵立娜, 陈紫红, 陈濠, 等.响应面法优化菌草灵芝多肽-硒螯合物的制备工艺[J].食品科学, 2017, 38(14):187-192.
ZHAO L N, CHEN Z H, CHEN H, et al.Optimization of chelation of Juncao Ganoderma lucidum peptides with selenium by response surface methodology[J].Food Science, 2017, 38(14):187-192.
[19] QIN X Y, ZHANG J T, LI G M, et al.Selenium-chelating corn oligopeptide as a potential antioxidant supplement:Investigation of the protein conformational changes and identification of the antioxidant fragment composition[J].International Journal of Food Engineering, 2020, 16(4):629-656.
[20] 王莲芳, 窦春霞, 张连富, 等.有机物中微量元素硒的测定[J].食品与机械, 2007, 23(1):115-117;147.
WANG L F, DOU C X, ZHANG L F, et al.Determination of trace selenium in organic samples[J].Food &Machinery, 2007, 23(1):115-117;147.
[21] 秦修远, 刘文颖, 陈立城, 等.豌豆低聚肽硒螯合物制备及结构特征研究[J].食品与发酵工业, 2019, 45(3):28-33.
QIN X Y, LIU W Y, CHEN L C, et al.Preparation and structure characterization of selenium-chelating pea oligopeptides[J].Food and Fermentation Industries, 2019, 45(3):28-33.
[22] JABEEN H, IQBAL S, ANWAR S, et al.Optimization of profenofos degradation by a novel bacterial consortium PBAC using response surface methodology[J].International Biodeterioration &Biodegradation, 2015, 100:89-97.
[23] ESMAEILI A, GHOLAMI M.Optimization and preparation of nanocapsules for food applications using two methodologies[J].Food Chemistry, 2015, 179:26-34.
[24] KELLY S M, JESS T J, PRICE N C.How to study proteins by circular dichroism[J].Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics, 2005, 1751(2):119-139.
[25] 黄玲玲, 苏彩霞, 张宗申, 等.硒、锌元素对羊肚菌多糖抗氧化性的影响[J].食品与发酵工业, 2015, 41(7):122-125.
HUANG L L, SU C X, ZHANG Z S, et al.Effects of selenium and zinc on the antioxidant activity of morel polysaccharides[J].Food and Fermentation Industries, 2015, 41(7):122-125.
[26] MACH H, MIDDAUGH C R.Simultaneous monitoring of the environment of tryptophan, tyrosine, and phenylalanine residues in proteins by near-ultraviolet second-derivative spectroscopy[J].Analytical Biochemistry, 1994, 222(2):323-331.
[27] YONG Y H, YAMAGUCHI S, MATSUMURA Y.Effects of enzymatic deamidation by protein-glutaminase on structure and functional properties of wheat gluten[J].Journal of Agricultural and Food Chemistry, 2006, 54(16):6034-6040.
[28] ZHANG K, LI J W, HOU H, et al.Purification and characterization of a novel calcium-biding decapeptide from Pacific cod (Gadus macrocephalus) bone:Molecular properties and calcium chelating modes[J].Journal of Functional Foods, 2019, 52:670-679.
[29] FENG R W, WEI C Y, TU S X.The roles of selenium in protecting plants against abiotic stresses[J].Environmental and Experimental Botany, 2013, 87:58-68.
[30] 贺燕, 黄先智, 韦峥, 等.桑叶生物碱对D-半乳糖诱导小鼠肠道菌群紊乱的调节作用[J].食品科学, 2022, 43(5):118-126.
HE Y, HUANG X Z, WEI Z, et al.Regulatory effect of mulberry leaf alkaloid on D-galactose-induced intestinal flora disturbance in mice[J].Food Science, 2022, 43(5):118-126.