鱼粉压榨液是鱼粉生产过程的副产物,含有脂肪、蛋白质等多种营养成分,其脂肪酸中的ω-3系多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)多为二十碳五烯酸(eicosapentaenoic acid EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)[1-3],富集后可以提高原料的综合利用价值。富集EPA和DHA的方法包括尿素包合、脂肪酶浓缩、低温结晶、分子蒸馏、色谱法等,其中分子蒸馏法是工业上最常见的方法[4-7]。鉴于EPA和DHA的特性,富集前一般需要对原料进行乙酯化处理以降低极性,而研究表明乙酯型EPA和DHA在人体中的吸收仅在20%左右,乙酯型脂肪酸在消化过程中还会产生乙醇,对乙醇耐受性差的人群产生不良反应[8-9]。游离脂肪酸型EPA和DHA容易被人体消化吸收,但是结构上的不饱和性使其极易氧化,不利于产品的流通,而且具有辛涩味。甘油酯型EPA和DHA在保持各种生理活性的同时,具有较好的氧化稳定性,既有利于人体的消化吸收,口感又得到了改善[10]。
传统化学法合成甘油酯存在反应温度高、设备损耗大、产品质量不高、环境污染等缺点,而酶法催化合成具有反应条件温和、环境污染小、产物选择性好、品质高等优点[11-13]。固定化酶是模仿酶附着在细胞膜上参与催化反应的天然模式,将酶和载体经物理或化学作用相结合的产物,使酶的结构和活性更加稳定,而且反应结束后,酶可多次重复使用,大大降低了生物催化剂的成本[14-16];还可以在真空条件下分离低沸点的副产物,提高转化率。但反应中的甘油限制了传质效率,使反应效率较低,一般通过添加有机溶剂或采用流加甘油的方式反应[17-20]。因此,本研究以鱼粉压榨液为原料富集EPA和DHA,得到乙酯型鱼油,进而采用两步合成方法,通过固定化酶CALB-A催化制备富含EPA和DHA的甘油酯型鱼油,以期为鱼粉加工副产物的高值化利用及相关健康产品的开发提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
鱼粉压榨液,宁波裕天海洋生物科技有限公司;37种脂肪酸甲酯混合标品、二十碳五烯酸乙酯,上海源叶生物科技公司;固定化酶CALB-A,尚科生物医药(上海)有限公司;甘油单油酸酯,阿拉丁;二十二碳六烯酸甘油三酯、二十碳五烯酸甘油三酯、二十二碳六烯酸乙酯,上海麦克林生化科技有限公司;甘油二油酸酯、甘油三油酸酯,Sigma-Aldrich。
HZ-88恒温水浴振荡器,上海维诚仪器有限公司;RE-2000旋转蒸发仪,上海亚荣仪器有限公司;VKL70-4分子蒸馏仪,德中瑞达工艺设备有限公司;SFE-2超临界萃取仪,Applied Separations;8890-5977B气相色谱质谱联用仪,美国Agilent公司;UPLC-ELSD超高效液相色谱仪,美国Waters公司。
1.2 实验方法
1.2.1 鱼油的提取与精制
参照李冲冲等[21]的方法,鱼粉压榨液静置4 h后吸取上层鱼油,按体积分数为1%添加量加入体积分数为60%磷酸,70 ℃下搅拌5 min后,4 500 r/min离心10 min,取上层油相;然后,按3%(体积分数)添加量加入3 mol/L NaOH,65 ℃下搅拌15 min后4 500 r/min离心10 min,上层油相添加150 g/L的活性炭进行脱色,60 ℃搅拌20 min后,真空抽滤,分离油相;最后在85 ℃下减压(真空度5 KPa)蒸馏10 min,制得精制鱼油。
1.2.2 精制鱼油的乙酯化
参照张蒙娜等[22]的方法,取一定量鱼油样品置于烧瓶,加入质量分数为1.2% NaOH和体积分数为60%无水乙醇,50 ℃反应75 min后,用质量分数为5% NaCl热溶液清洗,静置收集上层油相,旋转蒸发除去乙醇和水,即得乙酯化鱼油。
1.2.3 脂肪酸分析
脂肪酸组成采用气相色谱分析,并利用面积归一化法对鱼油中脂肪酸进行分析,参考GB 5009.168—2016。
样品处理:移取样品80 μL至25 mL比色管,加入0.125 mol/L KOH-甲醇溶液5 mL,85 ℃加热3~5 min至油滴消失,加入14%三氟化硼-甲醇溶液5 mL,加热3~5 min;然后加入正庚烷5 mL,加热2~3 min;最后加入无水硫酸钠4~5 g,取上清液稀释10倍进样。
色谱条件:色谱柱HP-5 ms(0.25 mm×30 m,0.25 μm);进样口温度230 ℃,分流比50∶1;进样量10 μL;载气为高纯N2;恒定柱压10 psi;程序升温:初温100 ℃,保持2 min,以5 ℃/min升至160 ℃,保持2 min,再以1 ℃/min升至175 ℃,保持10 min,然后以1 ℃/min升至185 ℃,保持10 min后以4 ℃/min升至240 ℃,保持15 min。
1.2.4 EPA和DHA的富集
取一定量乙酯化鱼油置于分子蒸馏仪60 ℃预热,以2 mL/min的进料速率,300 r/min的刮膜转速,117 ℃的蒸馏温度,15 Pa的蒸馏压力进行分子蒸馏,收集重相产物,即得乙酯型鱼油EE1。取一定量EE1采用超临界萃取进一步富集EPA和DHA,萃取温度50 ℃,萃取压力12、13、14、15 MPa梯度提高,产物为EE2。取一定量乙酯化鱼油进行多级分子蒸馏,进料速率为2 mL/min,蒸馏压力和温度第一级为5 Pa、80 ℃,第二级为10 Pa、90 ℃,第三级为5 Pa、90 ℃,第四级为2 Pa、95 ℃,所得产物为EE3。
EPA和DHA的含量测定采用气相色谱法,二者的回收率的计算方法如公式(1)所示:
EPA/DHA回收率![]()
(1)
式中:M1,回收鱼油质量,g;M2,上样鱼油质量,g;C1,回收鱼油中EPA/DHA含量,%;C2,上样鱼油中EPA/DHA含量,%。
1.2.5 叔丁醇溶剂中固定化酶CALB-A催化合成PUFA甘油酯
将EE1和甘油按不同的物质的量比置于具塞锥形瓶中,加入适量的叔丁醇溶解,按一定的比例添加固定化酶CALB-A,置于恒温振荡器中反应,酯化反应平衡后回收油相和固定化酶。
1.2.5.1 反应时间对溶剂中合成甘油酯的影响
甘油与乙酯的物质的量比1∶3,加酶量2%(以底物总质量计),反应温度50 ℃,底物质量分数20%,每隔1 h取样分析混合物组成,并计算乙酯型脂肪酸(fatty acid ethyl esters,FAEEs)的转化率。
1.2.5.2 反应温度对溶剂中合成甘油酯的影响
甘油与乙酯的物质的量比1∶3,加酶量2%,底物质量分数20%,反应温度分别选择40、50、60 ℃,反应6 h后取样分析混合物组成,并计算FAEEs转化率。
1.2.5.3 加酶量对溶剂中合成甘油酯的影响
甘油与乙酯的物质的量比为1∶3,反应温度50 ℃,底物质量分数为20%,加酶量分别为1%、2%、3%、4%、5%,反应6 h后取样分析混合物组成,并计算FAEEs转化率。
1.2.6 真空条件下固定化酶CALB-A催化合成PUFA甘油三酯
取上一步反应回收的油相,加入带真空阀的锥形瓶中,添加一定量的固定化酶CALB-A,用真空泵对反应体系抽真空,在恒温振荡器中反应,反应平衡后回收油相和固定化酶。
1.2.6.1 反应时间对真空中合成甘油三酯的影响
甘油与乙酯的物质的量比为1∶3,反应温度50 ℃,反应12 h后每隔2 h取样分析混合物组成,并计算FAEEs转化率和甘油三酯(triacylglycerol,TAG)的产率。
1.2.6.2 加酶量对真空中合成甘油三酯的影响
甘油与乙酯的物质的量比为1∶3,反应温度50 ℃,加酶量分别为2%、3%、4%、5%,反应24 h后取样分析混合物组成,并计算FAEEs转化率和TAG产率。
1.2.6.3 底物物质的量比对真空中合成甘油三酯的影响
加酶量为3%,反应温度50 ℃,甘油与乙酯的物质的量比分别为1∶1、1∶2、1∶3、1∶4、1∶5,反应24 h后取样分析混合物组成,并计算FAEEs转化率和TAG产率。
1.2.7 反应产物组成分析
反应产物的组成采用配备蒸发光散射检测器的超高效液相色谱进行检测分析。色谱柱为ACQUITY UPLC BEH C18(2.1×100 mm,1.7 μm);柱温35 ℃;流动相为V(异丙醇)∶V(95%乙腈)=1∶4,0.2 mL/min流速等梯度洗脱;进样量10 μL。各组分的出峰顺序为甘油单酯、乙酯、甘油二酯、甘油三酯,采用标准品进行定性和定量。
反应中以FAEEs(EPA+DHA)的转化率和TAG(EPA+DHA)的产率作为衡量酯化反应的指标,计算如公式(2)、公式(3)所示:
FAEEs转化率/%=
(2)
TAG产率![]()
(3)
1.2.8 TAG的分离
反应产物中TAG脂肪酸分析需先进行TAG的分离[23],分离方法如下:反应产物采用薄层色谱法分离,使用薄层层析硅胶板(100×200 mm),展开剂为V(石油醚)∶V(乙醚)∶V(乙酸)=80∶20∶1。样品分离后烘干,喷涂1 g/L的2,7-二氯荧光素后在紫外光下观察各组分条带分布。将TAG条带刮下参照1.2.3节进行后继处理。
1.2.9 数据处理
所有数据采用SPSS进行分析,采用ANOVA检验,P<0.05,差异显著;采用Origin进行作图;对样品进行3次平行测定,取平均值±标准差。
2 结果与分析
2.1 鱼粉压榨液中鱼油的富集
鱼粉压榨液中的鱼油经提取、精制后,比较一级分子蒸馏(EE1)、分子蒸馏-超临界萃取(EE2)、多级分子蒸馏(EE3)3种方法富集EPA和DHA的效果。从图1可知,EE1中EPA+DHA含量为43.2%,较EE2和EE3低,但其EPA+DHA回收率显著高于其余两者(P<0.01),达到87.04%。考虑到原料的利用率,以EE1为原料进行后续试验。
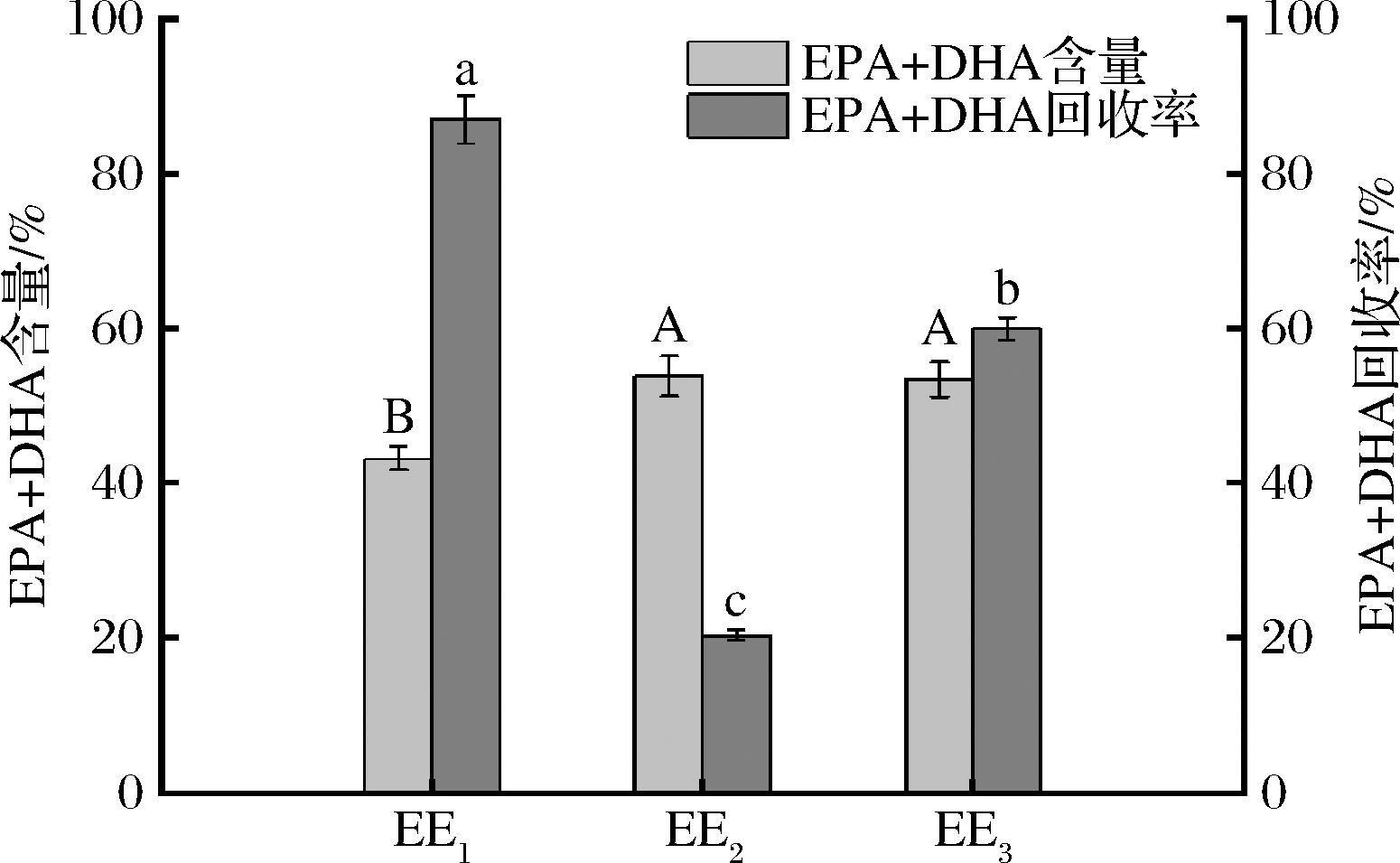
图1 鱼粉压榨液中的EPA和DHA的富集
Fig.1 Enrichment of EPA and DHA from pressed liquor of fish meal processing
注:大小写字母代表显著性差异分析(P<0.05),下同。
2.2 反应时间对溶剂中合成甘油酯的影响
反应需要一定时间达到平衡,时间过短会导致反应不完全,时间过长会增加副产物,影响反应效率。如图2所示,FAEEs转化率在6 h前快速上升,反应6 h时FAEEs转化率达到了49.86%,6 h后酯化反应基本达到平衡,FAEEs转化率趋于平缓。因此在叔丁醇溶剂体系的酯化反应中,反应时间以6 h为宜。刘向前等[24]以自制固定化脂肪酶CALB-L在叔丁醇溶剂中催化乙酯型脂肪酸合成甘油酯,转化率与本实验结果相似。
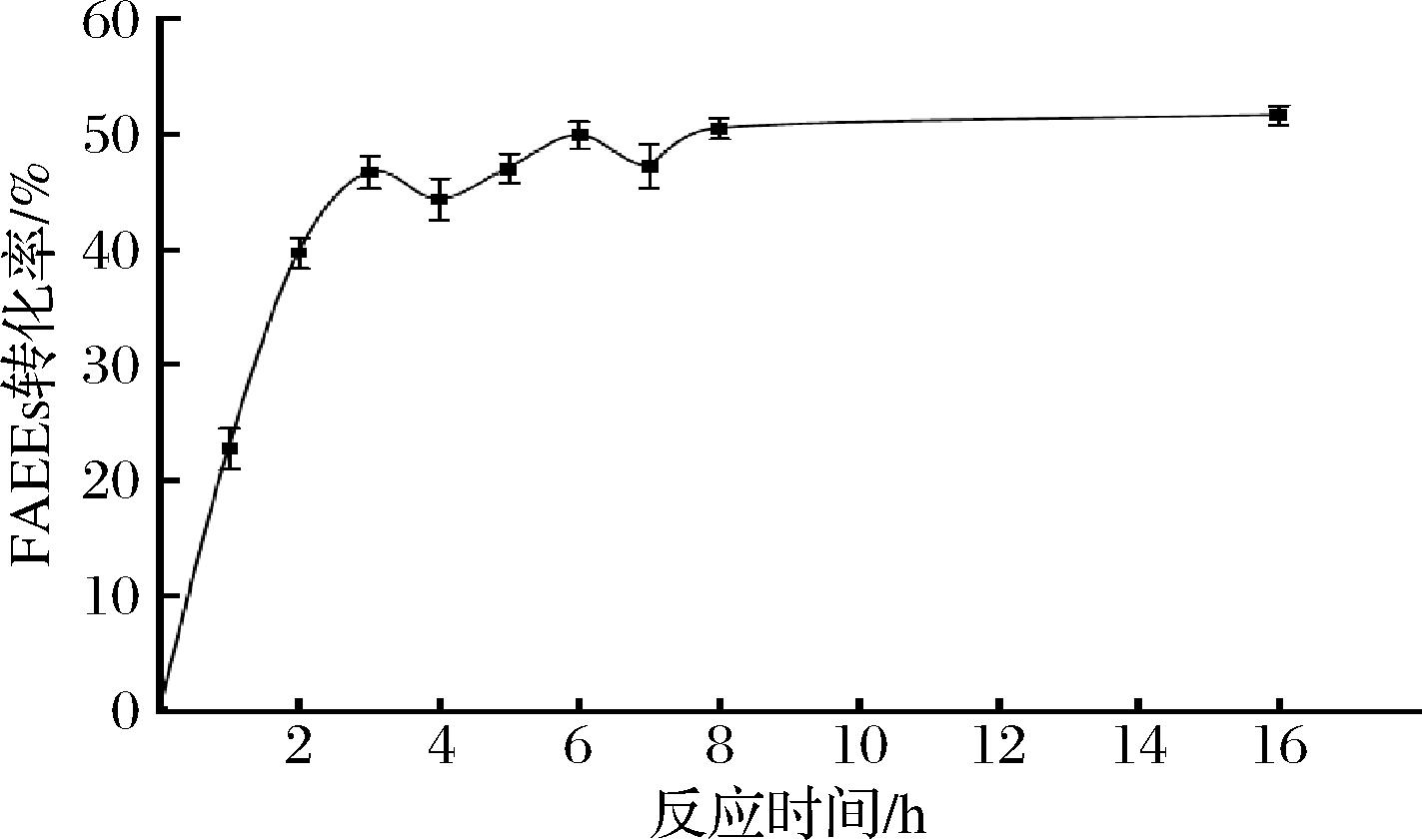
图2 反应时间对溶剂体系中酯化反应的影响
Fig.2 Effect of reaction time on esterification reaction in solvent system
2.3 反应温度对溶剂中合成甘油酯的影响
如图3所示,FAEEs转化率随反应温度的增加无显著性差异(P>0.05),50 ℃时FAEEs转化率略高于其他温度。温度的升高可以降低体系黏度,加快传质效率,但当温度过高时,部分固定化酶会发生变性,活性降低。此外鱼油多不饱和脂肪酸含量较高,温度的提升会加速其氧化降解,因此选择50 ℃进行后续试验。
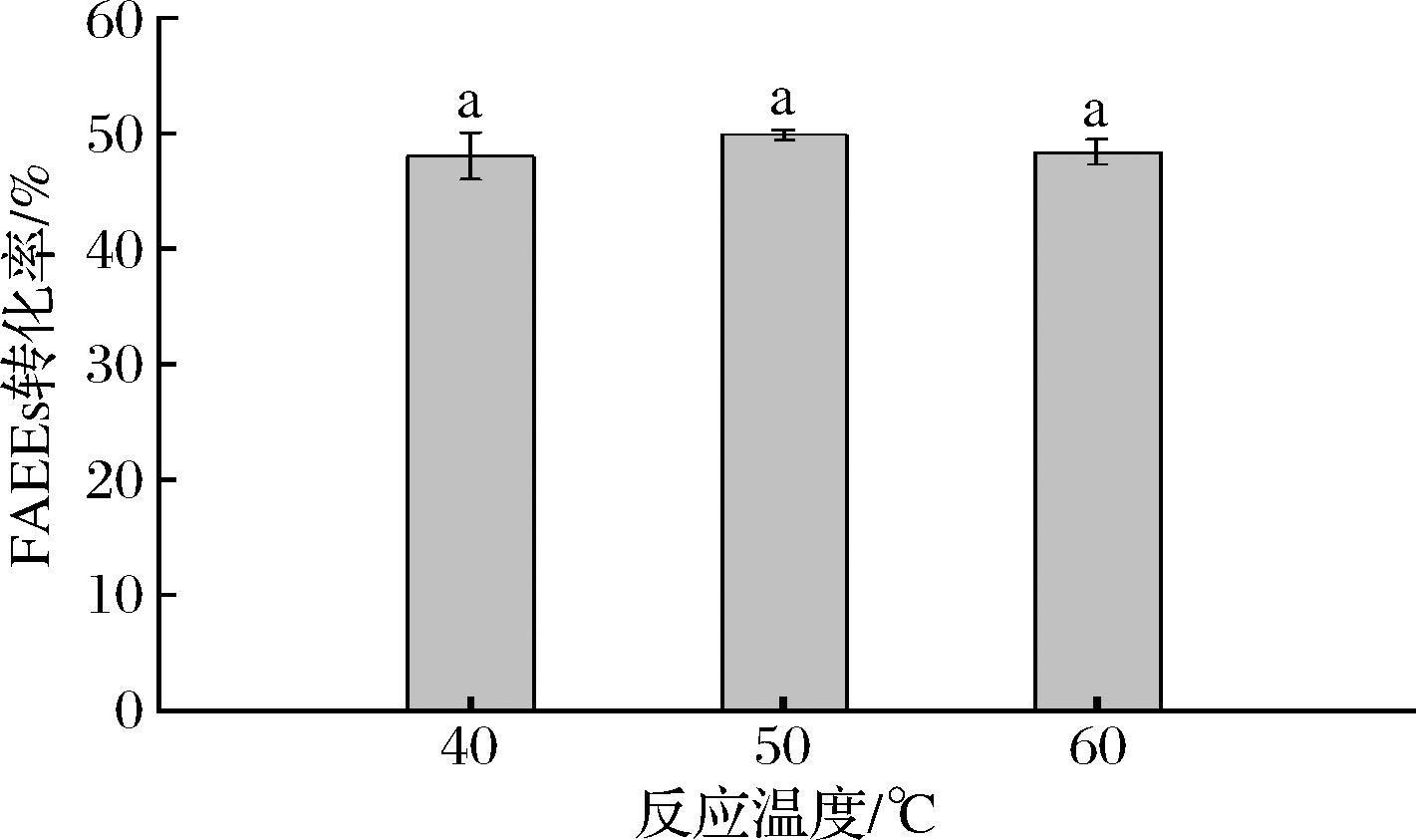
图3 反应温度对溶剂体系中酯化反应的影响
Fig.3 Effect of reaction temperature on esterification reaction in solvent system
2.4 加酶量对溶剂中合成甘油酯的影响
固定化酶相较于游离酶能回收重复利用,但仍会产生损耗,固定化酶的价格较高,是限制其应用的重要因素。本研究通过考察不同加酶量条件下FAEEs转化率,寻找最佳加酶量。加酶量对叔丁醇溶剂体系下酯化反应的影响如图4所示,当加酶量从1%增加到2%,FAEEs转化率显著增加(P<0.05),从35.93%增至44.72%;但当加酶量进一步增加时,FAEEs转化率反而降低。这可能是因为酶添加量过多时,振荡方式不能使固定化酶充分悬浮,使其传质受限。因此,2%加酶量较为适宜。
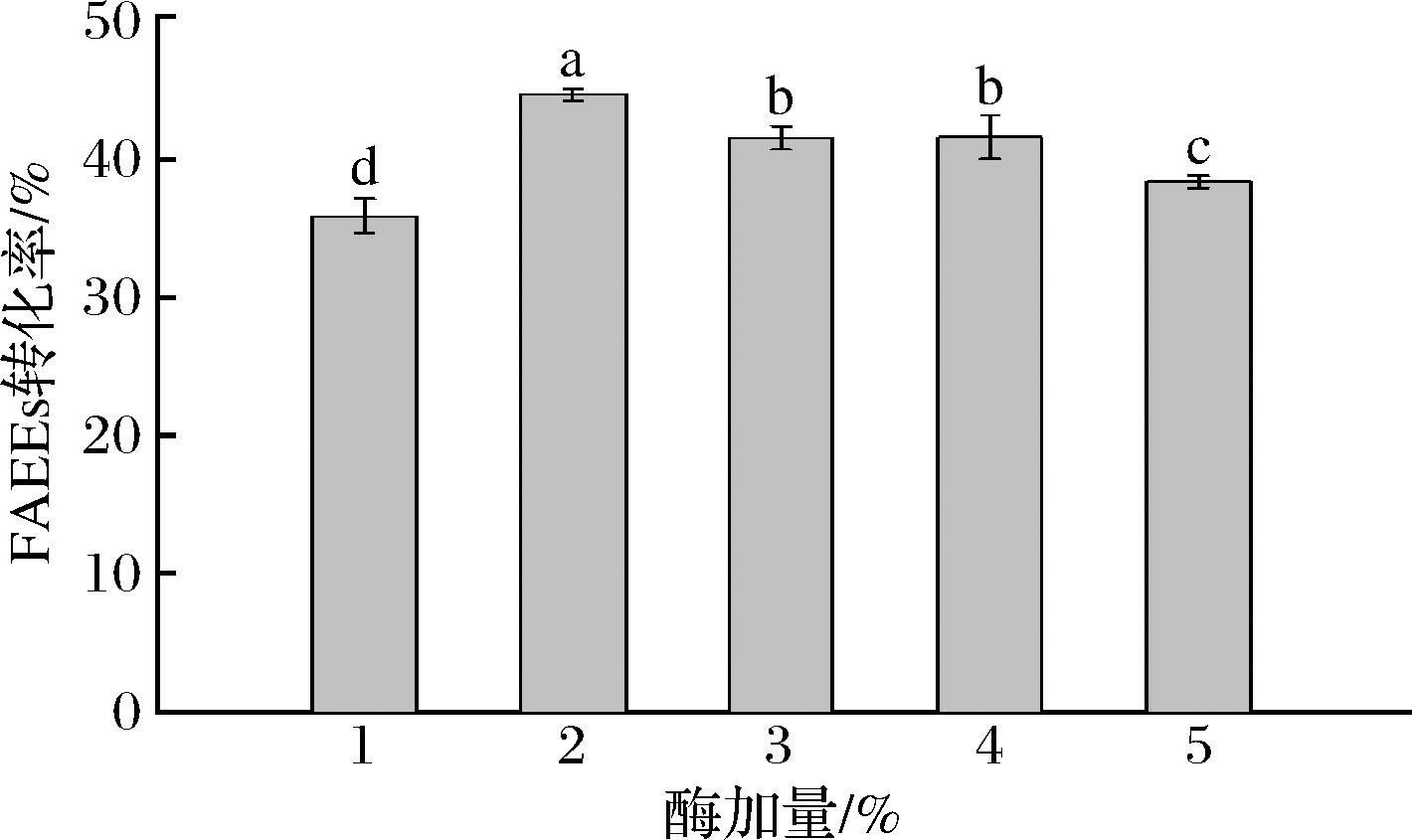
图4 加酶量对溶剂体系中酯化反应的影响
Fig.4 Effect of enzyme dosage on esterification reaction in solvent system
2.5 反应时间对真空中合成TAG的影响
乙酯型鱼油和甘油在酯化反应过程中会产生乙醇,在真空条件下将乙醇持续抽离,可以使平衡向生成TAG的方向移动,提高TAG的产率。如图5所示,随着反应时间的增加,FAEEs转化率和TAG产率均逐渐增加,21 h后TAG产率趋于平缓,FAEEs转化率缓慢增加。综合考虑反应效率和能耗,以TAG为主要目标产物时,反应时间定为24 h左右较为合适。
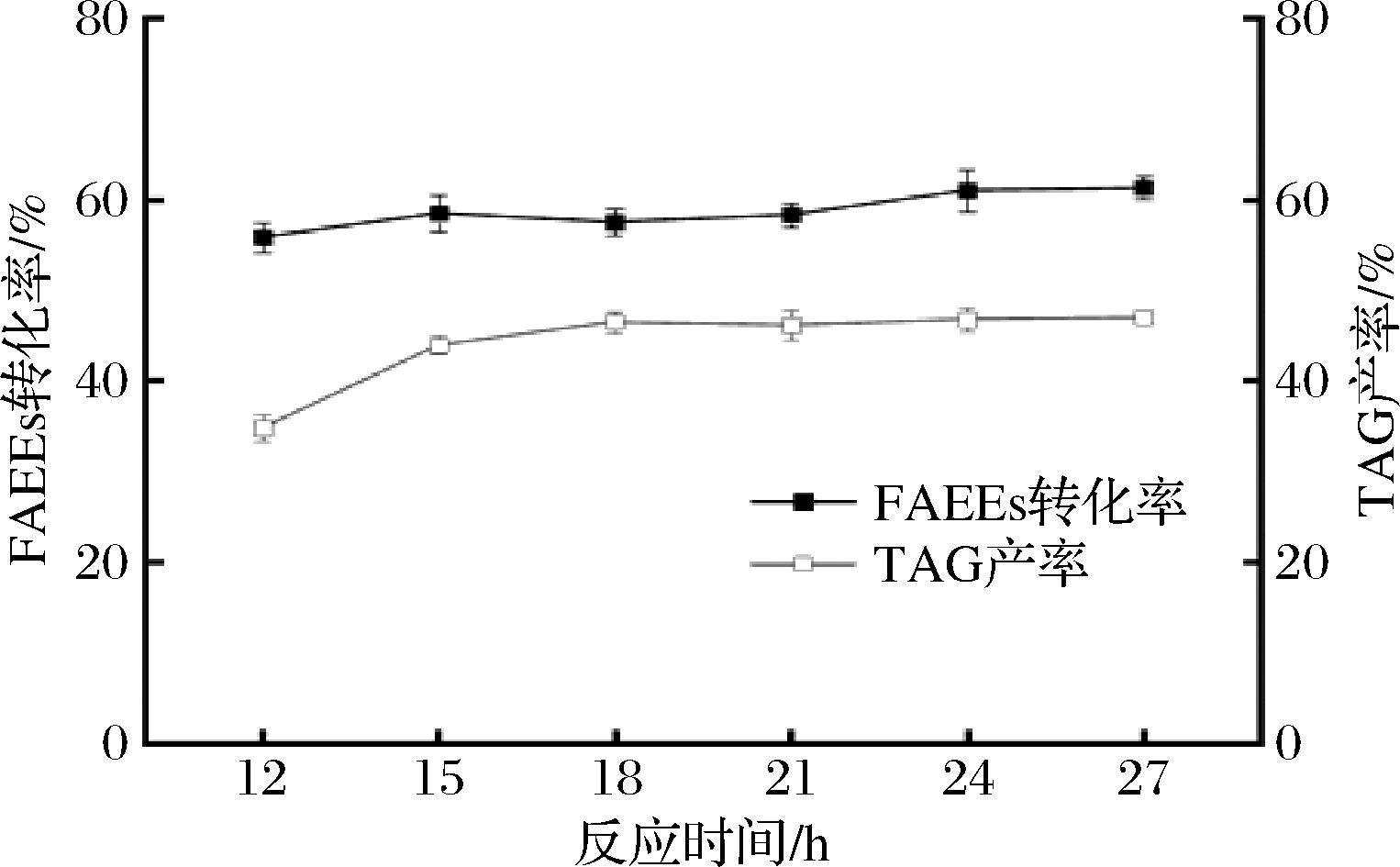
图5 反应时间对真空体系中酯化反应的影响
Fig.5 Effect of reaction time on esterification reaction in vacuum system
2.6 加酶量对真空中合成TAG的影响
不同加酶量对酯化反应的影响如图6所示,加酶量从2%到3%时,酯化反应的FAEEs转化率和TAG产率都显著性提高(P<0.05),当加酶量继续增加时FAEEs转化率显著下降(P<0.05),而TAG产率无显著变化(P>0.05)。这可能是由酶过量时传质受限所致。因此,在真空体系的酯化反应中,加酶量确定为底物总质量的3%。
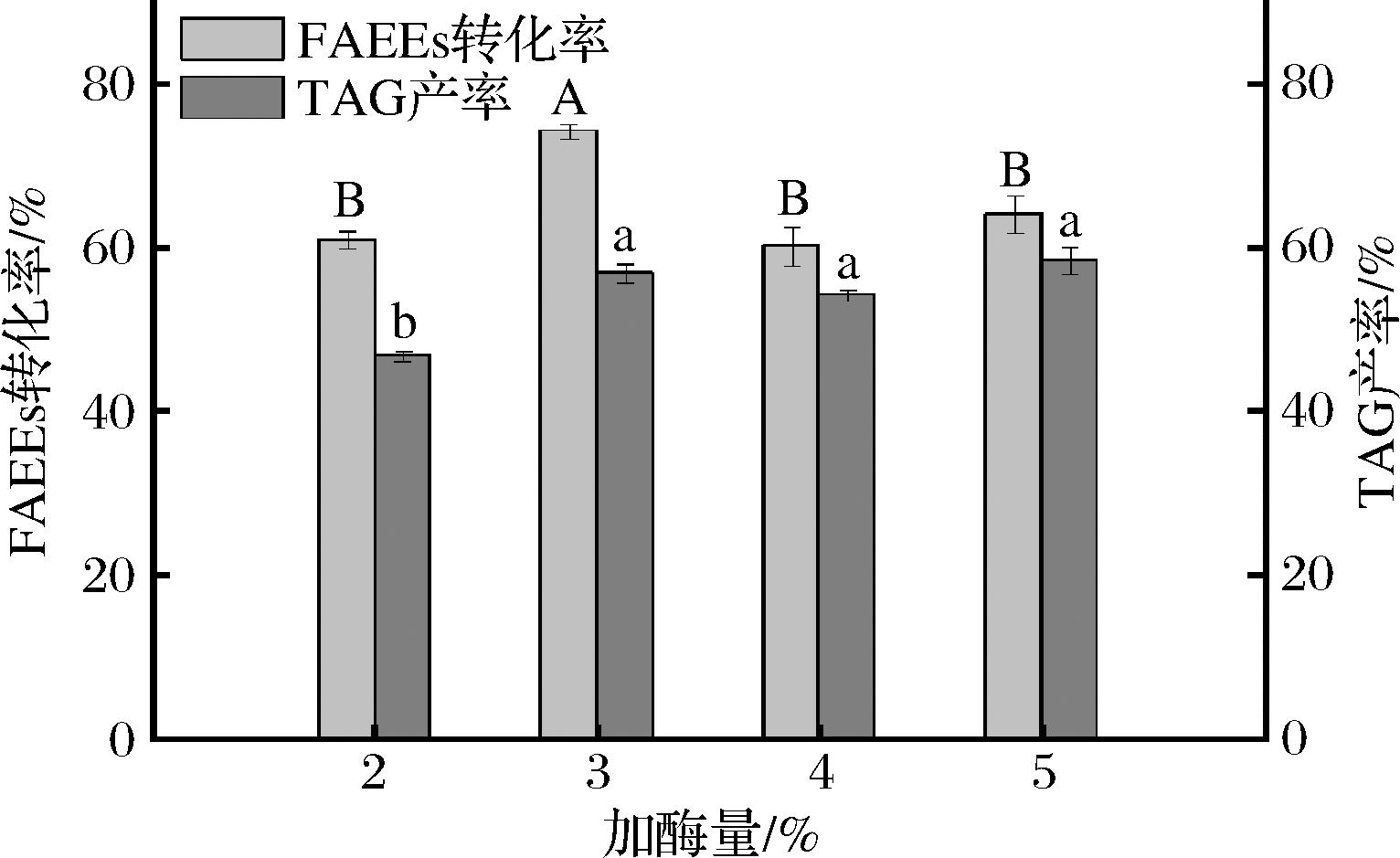
图6 加酶量对真空体系中酯化反应的影响
Fig.6 Effect of enzyme dosage on esterification reaction in vacuum system
2.7 底物物质的量比对真空中合成TAG的影响
在催化反应体系中,底物物质的量比会影响反应的平衡终点和反应产物的组成。根据催化合成反应的化学计量式可知,反应合成甘油三酯的理论甘油/乙酯物质的量比为1∶3,但体系不同会导致一定偏差,且甘油/乙酯物质的量比将直接影响产物的组成,因此需选择合适底物物质的量比。如图7所示,甘油/乙酯物质的量比对FAEEs转化率和TAG产量均有显著影响,当脂肪酸乙酯的比例低于1∶3时,FAEEs转化率无显著性差异(P>0.05),高于1∶3时则显著下降(P<0.05),而TAG产量随着脂肪酸乙酯比例的增加显著上升(P<0.05)。当乙酯的比例过高时,体系中会剩余大量的乙酯,因此造成转化率下降。底物物质的量比为1∶3时,FAEEs转化率最高,为81.22%,但TAG产率只有34.14%。当物质的量比为1∶4,FAEEs转化率虽然只有68.27%,TAG产率却提高到了62.51%。王卫飞等[25]曾通过两步法以脂肪酶Novozyme 435催化乙酯型鱼油反应36 h后,TAG占比67.1%,与本实验相当。综合考虑材料利用度和目标产物得率,底物物质的量比选取1∶4较为合适。
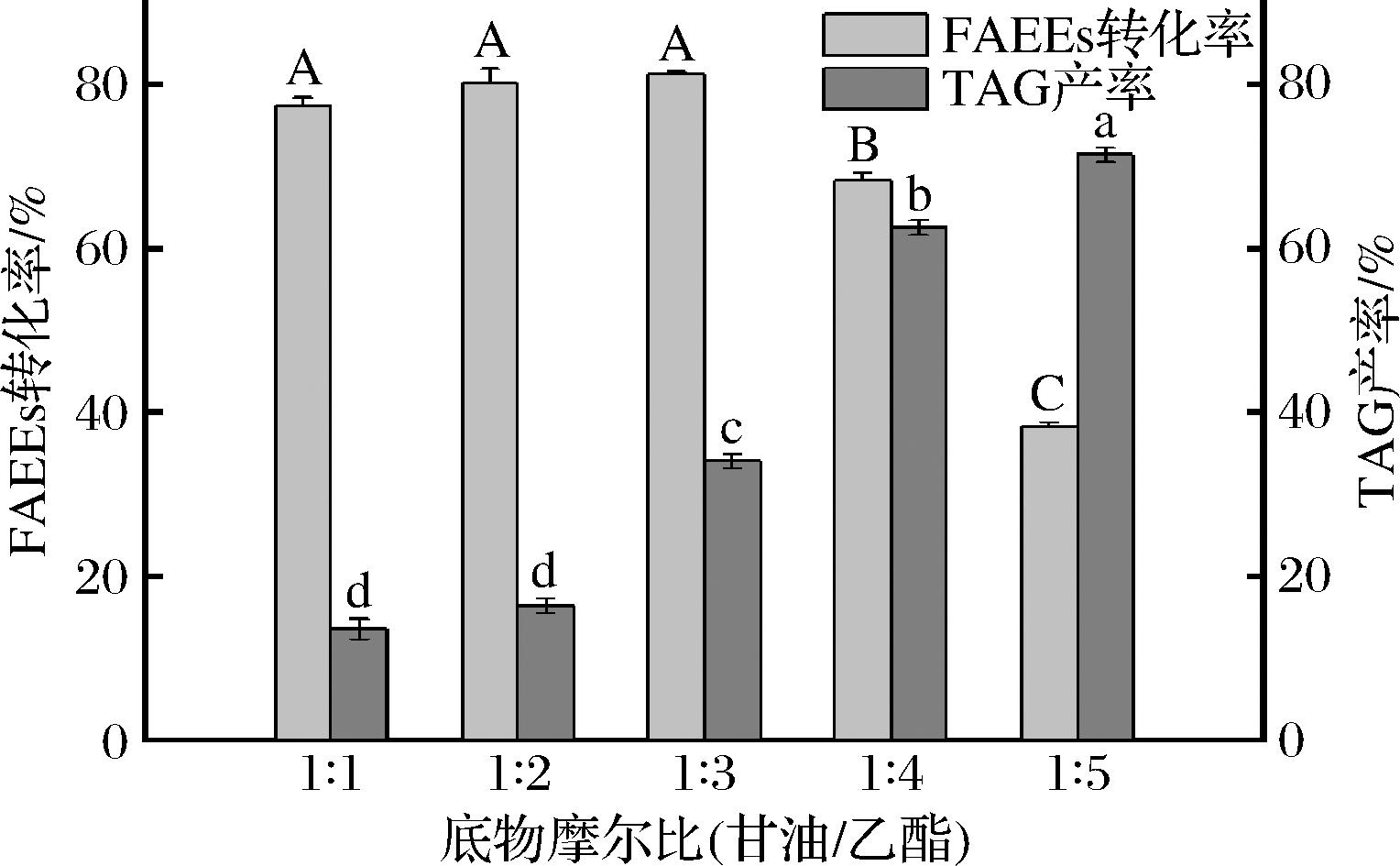
图7 底物摩尔比对真空体系中酯化反应的影响
Fig.7 Effect of substrate molar ratio on esterification reaction in vacuum system
2.8 脂肪酸分析
优化条件下反应产物用薄层色谱法分离(图8),反应产物为甘油一酯、甘油二酯、甘油三酯、乙酯混合物。
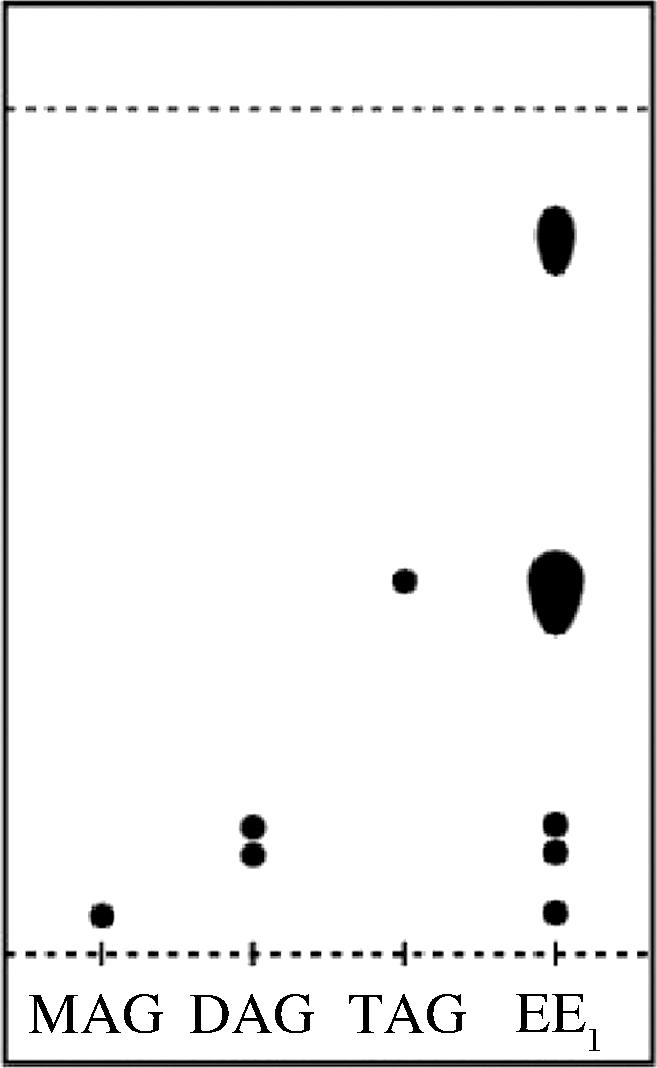
图8 甘油酯鱼油薄层色谱分离情况
Fig.8 Thin-layer chromatographic separation of glycerol ester fish oil
TAG组分和乙酯型鱼油EE1的脂肪酸分析见表1,可以看出二者主要脂肪酸均为C18以上的长链脂肪酸,乙酯型鱼油经固定化酶CALB-A催化后脂肪酸组成一致,且含量变化不大,催化反应前EPA、DHA的含量分别为12.15%和30.48%,酶催化后含量分别为11.67%和30.57%。
表1 EPA和DHA甘油三酯中脂肪酸含量的变化 单位:%
Table 1 Changes of fatty acid content in EPA and DHA triglycerides
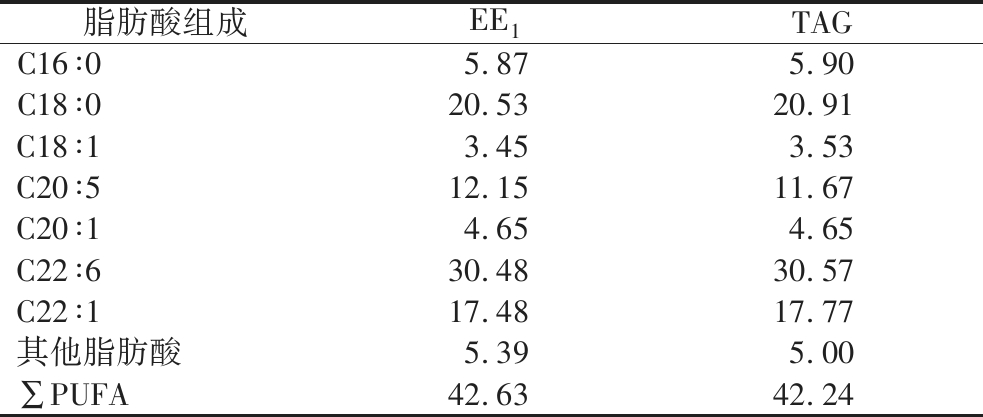
脂肪酸组成EE1TAGC16∶05.875.90C18∶020.5320.91C18∶13.453.53C20∶512.1511.67C20∶14.654.65C22∶630.4830.57C22∶117.4817.77其他脂肪酸5.395.00∑PUFA42.6342.24
3 结论
由于分子天然鱼油的高沸点和热敏性,分子蒸馏所富集的高EPA和DHA含量鱼油多为乙酯型,通过酯交换可获得甘油酯型鱼油以提高鱼油营养价值。因此,本文以鱼油压榨液为原料提取精制鱼油,采用分子蒸馏法富集EPA和DHA,继而利用固定化酶CALB-A两步催化合成甘油酯型鱼油,优化的工艺参数为:以甘油/乙酯摩尔比1∶4、加酶量2%(以底物总质量计)、底物浓度20%、反应温度50 ℃的条件在叔丁醇溶剂中反应6 h,回收的油相以加酶量3%(以底物总质量计)、反应温度50 ℃、在真空条件下反应24 h,得到甘油酯型产品,FAEEs转化率为68.27%,TAG产率为62.51%。脂肪酸分析表明,TAG组分和酶催化前乙酯型鱼油的脂肪酸组成一致,且含量变化不大。本实验可有效地从鱼粉压榨液中富集高EPA和DHA含量的鱼油,并经过固定化酶转化获得甘油酯型鱼油,以期为鱼粉加工副产物的高值化利用提供一定的参考。
[1] 李强, 肖井坤, 孙家峰.电解法处理鱼粉废水[J].大连海事大学学报, 2007, 33(1):146-149.
LI Q, XIAO J K, SUN J F.Study on treatment of fish meal wastewater by electrolysis[J].Journal of Dalian Maritime University, 2007, 33(1):146-149.
[2] GARCIA-SIFUENTES C, PACHECO-AGUILAR R, LUGO-S NCHEZ M, et al.Properties of recovered solids from stick-water treated by centrifugation and pH shift[J].Food Chemistry, 2009, 114(1):197-203.
NCHEZ M, et al.Properties of recovered solids from stick-water treated by centrifugation and pH shift[J].Food Chemistry, 2009, 114(1):197-203.
[3] 王亚男, 徐茂琴, 季晓敏, 等.分子蒸馏富集金枪鱼鱼油ω-3脂肪酸的研究[J].中国食品学报, 2014, 14(7):52-58.
WANG Y N, XU M Q, JI X M, et al.Study on ω-3 fatty acids enrichment of tuna oil with molecular distillation[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(7):52-58.
[4] HAO L P, CAO X J, HUR B K.Separation of single component of EPA and DHA from fish oil using silver ion modified molecular sieve 13X under supercritical condition[J].Journal of Industrial and Engineering Chemistry, 2008, 14(5):639-643.
[5] 刘书成, 李德涛, 欧冠强, 等.尿素包合法富集蛇鲻鱼油中EPA和DHA的研究[J].广东海洋大学学报, 2008, 28(3):61-65.
LIU S C, LI D T, OU G Q, et al.Concentration of DHA and EPA from fish oil of Saurida elongate by urea complexation[J].Journal of Guangdong Ocean University, 2008, 28(3):61-65.
[6] MEDINA A R, GIMÉNEZ A G, CAMACHO F G, et al.Concentration and purification of stearidonic, eicosapentaenoic, and docosahexaenoic acids from cod liver oil and the marine microalga Isochrysis galbana[J].Journal of the American Oil Chemists’ Society, 1995, 72(5):575-583.
[7] 刘汝萃, 王彩华, 肖晶, 等.鱼油的提取、富集与应用研究进展[J].粮食与食品工业, 2017, 24(5):5-8.
LIU R C, WANG C H, XIAO J, et al.Study on the extraction, enrichment and application of fish oil[J].Cereal &Food Industry, 2017, 24(5):5-8.
[8] LAWSON L D, HUGHES B G.Human absorption of fish oil fatty acids as triacylglycerols, free acids, or ethyl esters[J].Biochemical and Biophysical Research Communications, 1988, 152(1):328-335.
[9] 邵佩霞. 富含多不饱和脂肪酸甘油酯的酶法制备[D].广州:华南理工大学, 2010.
SHAO P X.Enzymatic preparation of glycerides rich in polyunsaturated fatty acids[D].Guangzhou:South China University of Technology, 2010.
[10] IKEDA I, SASAKI E, YASUNAMI H, et al.Digestion and lymphatic transport of eicosapentaenoic and docosahexaenoic acids given in the form of triacylglycerol, free acid and ethyl ester in rats[J].Biochimica et Biophysica Acta, 1995, 1259(3):297-304.
[11] 王琳琳, 高兴明, 韦海涛, 等.固定化酶在食品工业中的应用研究进展[J].轻工学报, 2021, 36(2):25-33.
WANG L L, GAO X M, WEI H T, et al.Research progress in the application of immobilized enzymes in food industry[J].Journal of Light Industry, 2021, 36(2):25-33.
[12] 李彦锋, 李军荣, 伏莲娣.固定化酶的制备及应用[J].高分子通报, 2001(2):13-17;23.
LI Y F, LI J R, FU L D.Preparation and application of immobilized enzymes[J].Polymer Bulletin, 2001(2):13-17;23.
[13] ZHAO X B, QI F, YUAN C L, et al.Lipase-catalyzed process for biodiesel production:Enzyme immobilization, process simulation and optimization[J].Renewable and Sustainable Energy Reviews, 2015, 44:182-197.
[14] 路雪纯, 辛嘉英, 张帅, 等.脂肪酶固定化及其在食品领域中应用的研究进展[J].食品工业科技, 2021, 42(17):423-431.
LU X C, XIN J Y, ZHANG S, et al.Research progress of lipase immobilization and its application in food field[J].Science and Technology of Food Industry, 2021, 42(17):423-431.
[15] WANG J, ZHU L L, WANG J Z, et al.Enzymatic Synthesis of Functional Structured Lipids from Glycerol and Naturally Phenolic Antioxidants[M]//Glycerine Production and Transformation - An Innovative Platform for Sustainable Biorefinery and Energy.IntechOpen, 2019.
[16] ISHIKAWA T, MINEGISHI H, SHIMANE Y.Production and characterization of halophilic esterase and lipase from halophilic microorganisms[J].Studia Universitatis Babes-Bolyai, Biologia, 2019, 64(1):124.
[17] 朱东奇, 李道明, 王卫飞, 等.酶法全酯化合成富含EPA/DHA甘油酯工艺研究[J].中国粮油学报, 2017, 32(8):63-70.
ZHU D Q, LI D M, WANG W F, et al.Technical study of EPA/DHA-enriched glycerides by enzymatic holoesterification process[J].Journal of the Chinese Cereals and Oils Association, 2017, 32(8):63-70.
[18] SOLAESA  G, SANZ M T, MELGOSA R, et al.Substrates emulsification process to improve lipase-catalyzed sardine oil glycerolysis in different systems.Evaluation of lipid oxidation of the reaction products[J].Food Research International, 2017, 100(Pt 1):572-578.
G, SANZ M T, MELGOSA R, et al.Substrates emulsification process to improve lipase-catalyzed sardine oil glycerolysis in different systems.Evaluation of lipid oxidation of the reaction products[J].Food Research International, 2017, 100(Pt 1):572-578.
[19] 王升帆, 王庭, 郗锋剑, 等.固定化脂肪酶催化制备甘油三酯型鱼油[J].中国油脂, 2021, 46(8):97-100;109.
WANG S F, WANG T, XI F J, et al.Preparation of triglyceride fish oil catalyzed by immobilized lipase[J].China Oils and Fats, 2021, 46(8):97-100;109.
[20] 马良, 张延秀, 范书琴, 等.酶法制备高含量多不饱和脂肪酸甘油三酯的工艺[J].食品工业, 2022, 43(6):43-45.
MA L, ZHANG Y X, FAN S Q, et al.The preparation of high-content polyunsaturated fatty acid triglyceride by enzymatic method[J].The Food Industry, 2022, 43(6):43-45.
[21] 李冲冲, 李子豪, 柳余莉, 等.鱼粉加工副产物中鱼油的精炼及其脂肪酸组成分析[J].食品科学, 2015, 36(20):190-193.
LI C C, LI Z H, LIU Y L, et al.Refinement of fish oil from byproducts of fish meal processing and its fatty acid composition analysis[J].Food Science, 2015, 36(20):190-193.
[22] 张蒙娜, 宋恭帅, 彭茜, 等.响应面法优化精制沙丁鱼油乙酯化工艺[J].食品工业科技, 2018, 39(20):122-127.
ZHANG M N, SONG G S, PENG X, et al.Optimization of ethyl esterification process of refined sardine oil by response surface methodology[J].Science and Technology of Food Industry, 2018, 39(20):122-127.
[23] XU Y, GUO S H, WANG W F, et al.Enzymatic hydrolysis of palm stearin to produce diacylglycerol with a highly thermostable lipase[J].European Journal of Lipid Science and Technology, 2013, 115(5):564-570.
[24] 刘向前, 李道明, 王卫飞, 等.Lipozyme CALB L固定化及催化合成EPA/DHA甘油酯的研究[J].中国油脂, 2016, 41(11):21-26.
LIU X Q, LI D M, WANG W F, et al.Immobilization of Lipozyme CALB L and its application in synthesis of EPA/DHA-enriched glycerides[J].China Oils and Fats, 2016, 41(11):21-26.
[25] 王卫飞, 马永钧, 范海星, 等.酶法合成富含DHA、EPA甘油三酯的研究[J].中国油脂, 2011, 36(2):5-8.
WANG W F, MA Y J, FAN H X, et al.Enzymatic production of DHA and EPA-enriched triacylglycerols[J].China Oils and Fats, 2011, 36(2):5-8.