纳米二氧化硅(SiO2NPs)是一种无毒、无污染的白色粉末状材料,具有粒径小、质量轻、性质稳定、表面易于修饰以及生物相容性良好等特性[1]。这些特性使得SiO2 NPs在医学、农业和食品等方面有广泛的应用[2]。在功能性食品的开发中,纳米食品添加剂会显著影响食品的颜色、味道、质地和保质期。因此纳米材料通常被用作颜色、风味添加剂、防腐剂或食品补充剂的载体[3]。其中,最新版的国标GB 2760—2014中,SiO2NPs通常作为食品添加剂,以保持粉末或颗粒产品的稳定性[4]。GUO等[5]研究表明,在含有多糖的功能性食品中,添加SiO2NPs不仅可以防止结块,还可以保持食品的颜色。除此之外,SiO2NPs可以与食物成分结合,以增加多糖和蛋白质的口服吸收[6],还可以黏附在脂质表面,通过脂肪酶延长脂质的消化[7]。虽然SiO2NPs在食品添加剂中应用广泛,但其还是会影响食物本身的消化、吸收和生物活性,会对肝脏、肺和肾脏等器官产生影响。研究表明,当超剂量摄入SiO2NPs时,会在生物体内引起氧化和炎症反应,颗粒表面产生的包括羟基自由基、过氧化氢和单线态氧等氧化性物质会导致肾脏和肺部损伤,同时造成肝脏细胞的充血甚至坏死[8]。如何提高SiO2NPs在食品领域的生物相容性已经成为新的热点领域。
在生物环境中,纳米材料与周围介质中的蛋白质相互作用,在其表面形成了多层蛋白质,即蛋白冠(protein corona,PC)[9]。蛋白冠可以和纳米颗粒表面的官能团相互作用,掩盖纳米粒子的原始表面特征从而影响氧化还原活性,改变纳米颗粒的细胞毒性并参与细胞摄取、能量转移和物质运输等关键过程的调节[10]。蛋白冠还能够减弱纳米粒子介导的细胞活性损伤、氧化应激和线粒体膜电位变化,缓解能量和物质代谢途径的紊乱[11]。小麦低聚肽(wheat oligopeptide,WOP)是从小麦蛋白中分离出的多肽混合物,比小麦蛋白具有更好的水溶性、稳定性和消化率[12]。有研究表明小麦肽具有一定的抗氧化能力,能够通过减少自由基,抑制氧化反应,降低自动氧化速率,保护细胞抵御氧化应激损伤,从而达到抗衰老的功能[13]。
本文以SiO2NPs和WOP为主要原料,对SiO2 NPs进行羧基修饰后,通过单因素和正交试验优化超声复合工艺,成功制备出WOP-SiO2 PC,并对该复合物的抗氧化性、起泡性及乳化性进行测定分析,为SiO2 NPs用作食品添加剂的开发和利用提供参考。
1 材料与方法
1.1 试剂与材料
环己烷(分析纯)、丁二酸酐(分析纯)、维生素C(分析纯)、无水乙醇(98%),天津市科密欧化学试剂有限公司;正己醇(分析纯),天津市大茂化学试剂厂;曲拉通X-100(分析纯),西陇科学股份有限公司;氨水(分析纯),中山市拜尔化工有限公司;正硅酸四乙酯(tetraethyl orthosilicate,TEOS)(分析纯),广州瑞狮生物科技有限公司;3-氨丙基三乙氧基硅烷(3-aminopropyltriethoxysilane,KH550)(分析纯),东莞市康锦新材料科技有限公司;N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)(分析纯),深圳中联化工有限公司;WOP(>90%),陕西贝尔奇生物科技有限公司;十二烷基硫酸钠(sodium dodecyl sulfat,SDS)(分析纯),天津市致远化学试剂有限公司;DPPH(分析纯),上海麦克林生化科技股份有限公司;ABTS(分析纯),福州飞净生物科技有限公司。
1.2 仪器与设备
TD5A离心机,凯特实验仪器有限公司;真空冷冻干燥机,杭州富瑞捷科技有限公司;UV5500紫外分光光度计,上海元析仪器有限公司;F96S荧光分光光度计,广州沪瑞明仪器有限公司;磁力搅拌器,上海越众仪器设备有限公司;恒温水浴锅,上海胜卫电子科技有限公司;FJ200-SH高速分散均质机,上海沪析实业有限公司;超声波清洗机,济南通海机械设备有限公司;F200XS透射电子显微镜,北京欧博通光学技术有限公司;EDK9500傅里叶变换红外光谱仪(Fourier transform infrared spectroscopy,FTIR),北京杜克科技有限公司。
1.3 食品级SiO2NPs的制备
SiO2NPs的合成采用改良的微乳液法[14]。以环己烷作为有机溶剂,曲拉通X-100作为表面活性剂,正己醇作为助表活剂,TEOS作为反应前驱体,氨水作为反应催化剂。具体制备步骤如下:将25.0 mL环己烷、5.5 mL正己醇和6.35 g(准至±0.01 g)曲拉通X-100共混,600 r/min搅拌10 min至澄清,再加入2.0 mL蒸馏水作为分散相,继续600 r/min搅拌45 min至形成透明且稳定的油包水微乳液,随后再加入0.5 mL NH3·H2O和1.0 mL TEOS到微乳液中不断搅拌下反应24 h后加入等体积的无水乙醇破乳,离心分离得到白色固体真空冷冻干燥48 h得到SiO2NPs。
1.4 SiO2NPs的表面修饰
SiO2NPs的表面修饰采用改良的表面接枝聚合物改性方法[15]。准确称取0.20 g SiO2NPs加入25.0 mL DMF溶液超声1 h制成分散液。称取5.00 g丁二酸酐和11.05 g KH550溶液加入25.0 mL DMF溶液中以800 r/min搅拌3 h后加入SiO2NPs分散液,在55 ℃下以800 r/min水浴搅拌8 h。在离心机中以4 000 r/min离心15 min后将固体样品用无水乙醇和蒸馏水各洗涤3次,真空冷冻干燥48 h制得羧基化SiO2NPs(COOH-SiO2NPs)。
1.5 单因素优化WOP-SiO2PC制备工艺
准确量取1 mg/mL的WOP水溶液10.0 mL,向其中添加不同质量分数(0.25%、0.50%、0.75%、1.00%、1.25%)的COOH-SiO2NPs,在不同温度(25、35、45、55、65 ℃)下超声不同时间(5、10、15、20、25 min),4 000 r/min离心10 min取上清液以285 nm为激发波长在300~400 nm间进行荧光光谱测定,计算上清液与WOP水溶液的荧光强度变化量。
1.6 正交试验设计优化WOP-SiO2PC制备工艺
在单因素基础上,选取超声波时间(A)、超声波温度(B)和SiO2NPs质量分数(D)3个影响因素,以峰值荧光变化量为指标,每个因素设计3个水平(根据单因素实验优化得出),选用L9(34)正交表优化实验方案,正交试验因素与水平见表1。
表1 WOP-SiO2 PC超声复合工艺正交试验因素水平表
Table 1 WOP-SiO2 PC ultrasonic composite process orthogonal test factor level table
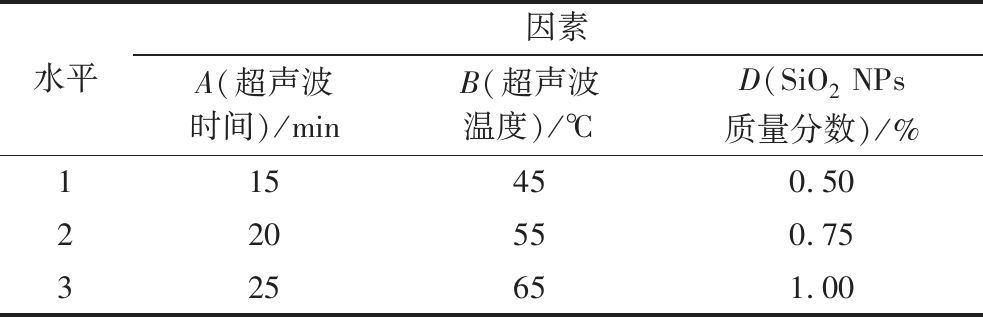
水平因素A(超声波时间)/minB(超声波温度)/℃D(SiO2 NPs质量分数)/%115450.50220550.75325651.00
1.7 SiO2 NPs、COOH-SiO2 NPs和WOP-SiO2 PC的表征
红外光谱测定用于评估SiO2 NPs、COOH-SiO2 NPs和WOP-SiO2 PC样品间的差异。将3种冻干样品进一步研磨,置于测量孔位上,然后进行扫描以获得样本光谱。光谱扫描范围为400~4 000 cm-1。透射电镜表征用于测定SiO2 NPs、COOH-SiO2 NPs和WOP-SiO2 PC样品的形貌特征,将制备的3种冻干样品分别分散在无水乙醇中,分别用透射电子显微镜观察各种物质的形貌特征。
1.8 WOP-SiO2 PC的性能测定
1.8.1 DPPH自由基清除能力测定
避光称取4 mg DPPH自由基粉末,加100.0 mL无水乙醇溶解,置于4 ℃冰箱保存10~12 h备用。设置实验组为准确称取不同质量WOP-SiO2 PC(8、16、24、32、40 mg),加入2.0 mL蒸馏水超声30 s后加入2.0 mL DPPH溶液4 000 r/min离心10 min,取上清液避光处静置30 min后使用紫外分光光度计在517 nm处测定吸光度。对照组用2.0 mL无水乙醇代替DPPH水溶液测定吸光度。设置空白组为2.0 mL无水乙醇加入2.0 mL DPPH溶液,测定吸光度。以上实验重复测定3次,按照上述方法对WOP、维生素C和COOH-SiO2NPs进行测定。DPPH自由基清除能力计算公式如公式(1)所示[16]:
DPPH自由基清除能力![]()
(1)
式中:A0,空白组517 nm处吸光度;A1,实验组517 nm处吸光度;A2,对照组517 nm处吸光度。
1.8.2 ABTS阳离子自由基清除能力测定
避光称取30 mg ABTS阳离子自由基粉末,加8.0 mL蒸馏水溶解。称取10 mg K2S2O8加15.0 mL蒸馏水溶解,将以上2种溶液按体积比1∶1等量混合,制备ABTS母液,置于4 ℃冰箱保存10~12 h备用。使用时,用无水乙醇稀释至吸光度在(0.7±0.02) Abs范围内。准确称取不同质量WOP-SiO2 PC(8、16、24、32、40 mg),加入2.0 mL蒸馏水超声30 s后加入2.0 mL ABTS溶液4 000 r/min离心10 min,取上清液避光处静置30 min后使用紫外分光光度计在734 nm处测定吸光度。对照组用2.0 mL无水乙醇代替ABTS溶液测定吸光度。设置空白组为2.0 mL无水乙醇并加入2.0 mL ABTS溶液,测定吸光度。以上实验重复测定3次。按照上述方法测定WOP、维生素C、COOH-SiO2NPs。DPPH自由基清除能力计算公式如公式(2)所示[16]:
ABTS阳离子自由基清除能力![]()
(2)
式中:A0,空白组734 nm处吸光度;A1,实验组734 nm处吸光度;A2,对照组734 nm处吸光度。
1.8.3 起泡性及起泡稳定性测定
准确称取不同质量WOP-SiO2 PC(0.25、0.50、0.75、1.00、1.25 g),加入10.0 mL 0.05 mol/L pH为7.0的磷酸盐缓冲溶液,超声20 s后使用高速均质机以10 000 r/min均质2 min,测量均质后泡沫和液体总体积。静置5 s后测量泡沫和液体总体积,重复3次。起泡能力和泡沫稳定性计算如公式(3)、公式(4)所示[17]:
起泡性![]()
(3)
起泡稳定性![]()
(4)
式中:V0,磷酸盐缓冲溶液体积,mL;V1,均质后泡沫和液体总体积,mL;V2,静置后泡沫和液体总体积,mL。
1.8.4 持水性测定
准确称取不同质量WOP-SiO2 PC(0.25、0.50、0.75、1.00、1.25 g),加入5.0 mL蒸馏水超声20 s后使用离心机以4 000 r/min离心15 min,测量离心后的样品质量m1,重复3次。持水性按公式(5)计算[17]:
持水性![]()
(5)
式中:m0,WOP-SiO2 PC质量,g;m1,离心后WOP-SiO2 PC质量,g。
1.8.5 持油性测定
准确称取WOP-SiO2 PC(0.25、0.50、0.75、1.00、1.25 g),加入5.0 mL 大豆油超声20 s后使用离心机以4 000 r/min离心15 min,测量离心后的样品质量m1,重复3次。持油性计算如公式(6)所示[17]:
持油性![]()
(6)
式中:m0,WOP-SiO2 PC质量,g;m1,离心后WOP-SiO2 PC质量,g。
1.8.6 乳化活性及乳化稳定性测定
准确称取不同质量WOP-SiO2 PC(0.25、0.50、0.75、1.00、1.25 g),加入10.0 mL蒸馏水和5.0 mL大豆油超声20 s后使用高速均质机以10 000 r/min均质2 min,吸取0.1 mL样液加入5.0 mL质量分数为0.1%的SDS溶液中用涡流振荡器混合均匀,使用紫外分光光度计在500 nm处测定吸光度A0,静置10 min后测量吸光度A1,重复3次。乳化性和乳化稳定性计算公式如公式(7)、公式(8)所示[17]:
乳化性![]()
(7)
乳化稳定性![]()
(8)
式中:ρ,WOP-SiO2 PC质量浓度,mg/mL;A0,起始500 nm处吸光值;A1,静置后500 nm处吸光值;φ,乳化液中油相的比例;N,稀释倍数。
2 结果与分析
2.1 不同因素对复合物制备体系的影响
2.1.1 超声波时间对复合物制备体系的影响
以285 nm为激发波长,在荧光光谱354 nm处的峰值代表WOP含有的色氨酸,此处峰值的荧光强度与色氨酸含量具有线性关系,可以通过反应前后WOP溶液的荧光强度变化量来判断WOP的复合程度。由图1-a可知,随着超声波时间的增加,荧光强度变化量呈先上升后下降的趋势,在超声波时间达到15 min时,荧光强度变化量达到最大值354.362±2.338。在超声波时间<15 min时,随着时间增加,WOP复合率提高,这可能是因为超声对于SiO2NPs具有较强的机械作用,可使原本团聚状态的SiO2NPs均匀分散在体系中,充分与WOP进行复合[18]。在超声波时间>15 min后,随着时间增加,WOP复合率降低,这可能是因为超声空化效应对WOP的二级结构及WOP-SiO2PC结构造成了破坏,降低了稳定性[19]。同时随着超声波时间增加,WOP在空气中发生一定的氧化,影响了结合能力,降低了复合率。
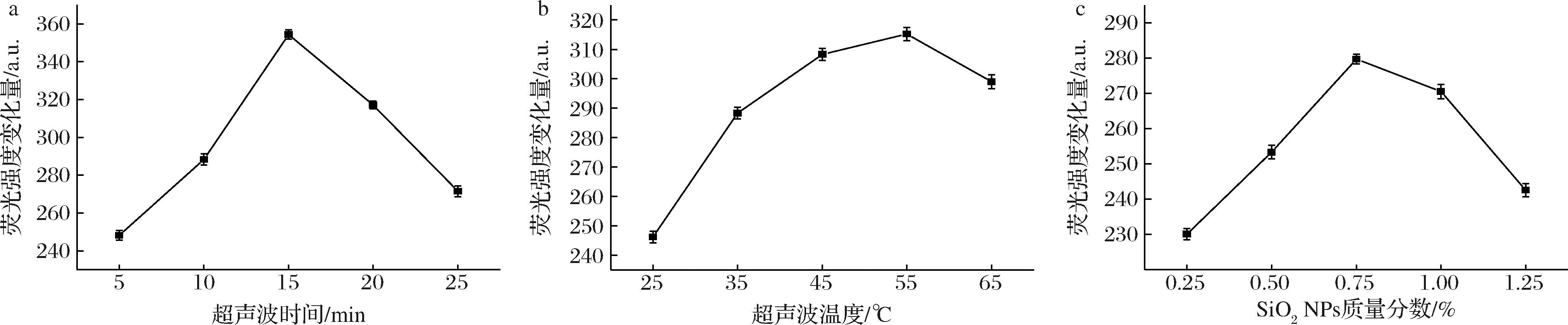
a-超声波时间;b-超声波温度;c-SiO2 NPs质量分数
图1 不同因素对复合物制备体系的影响
Fig.1 The effects of different factors on the preparation system of the composite
2.1.2 超声波温度对复合物制备体系的影响
由图1-b可知,荧光强度变化量随着超声波温度的增加呈先上升后下降的趋势,在超声波温度达到55 ℃时,荧光峰值变化量达到最大值315.221±2.204。在超声波温度<55 ℃时,随着温度增加,WOP复合率提高,这可能是因为WOP经适当的热处理后,肽链柔性增加而使得链与链之间相互缠绕、卷曲[20],在SiO2NPs表面形成更密集的空间结构。同时温度的升高提升了WOP的活性,加快了SiO2NPs表面羧基与小米低聚肽中氨基的结合速率。温度的升高还增加了体系内物质的分子热运动,使超声分散能力提高,反应更均匀充分。当超声波温度>55 ℃时,过高的温度使得WOP的活性降低,WOP的二级结构受到影响,使分子间交联度降低,复合物稳定性降低[21]。
2.1.3 SiO2NPs质量分数对复合物制备体系的影响
由图1-c可知,随着SiO2NPs质量分数的增加,荧光强度变化量呈先上升后下降的趋势。在SiO2NPs质量分数达到0.75%时,荧光峰值变化量达到最大值279.732±1.328。当SiO2NPs质量分数<0.75%时,随着SiO2NPs质量分数增加,WOP复合率提高,这可能是因为随着SiO2NPs质量分数的增加,体系内参与反应的羧基数量增加,SiO2NPs与WOP的界面相互作用增强,导致WOP复合率提高。而当SiO2NPs质量分数>0.75%时,WOP复合率降低,这可能是因为SiO2NPs质量分数过高,表面活性增大,交联度增加,更容易发生自聚集作用[22],导致反应的比表面积减小从而降低了体系内与参与反应的羧基数量以及界面相互作用,导致WOP复合率降低。
2.2 WOP-SiO2PC制备正交优化实验
正交试验结果见表2,进行极差分析可得到,实验各因素对WOP-SiO2PC制备体系影响主次顺序为:A>D>B,即超声波时间>SiO2NPs质量分数>超声波温度。通过极差分析确定的最优方案组合为A2B3D2,即SiO2NPs质量分数0.75%,超声波温度65 ℃,超声波时间20 min。综合以上分析,可以得出超声波时间是影响WOP-SiO2PC复合的主要因素,SiO2NPs质量分数和超声波温度也会影响复合率。以正交结果的最优方案重复试验3次,荧光强度变化量为385.26±2.245。
表2 WOP-SiO2PC复合正交试验结果
Table 2 Results of orthogonal experiments of WOP-SiO2PC
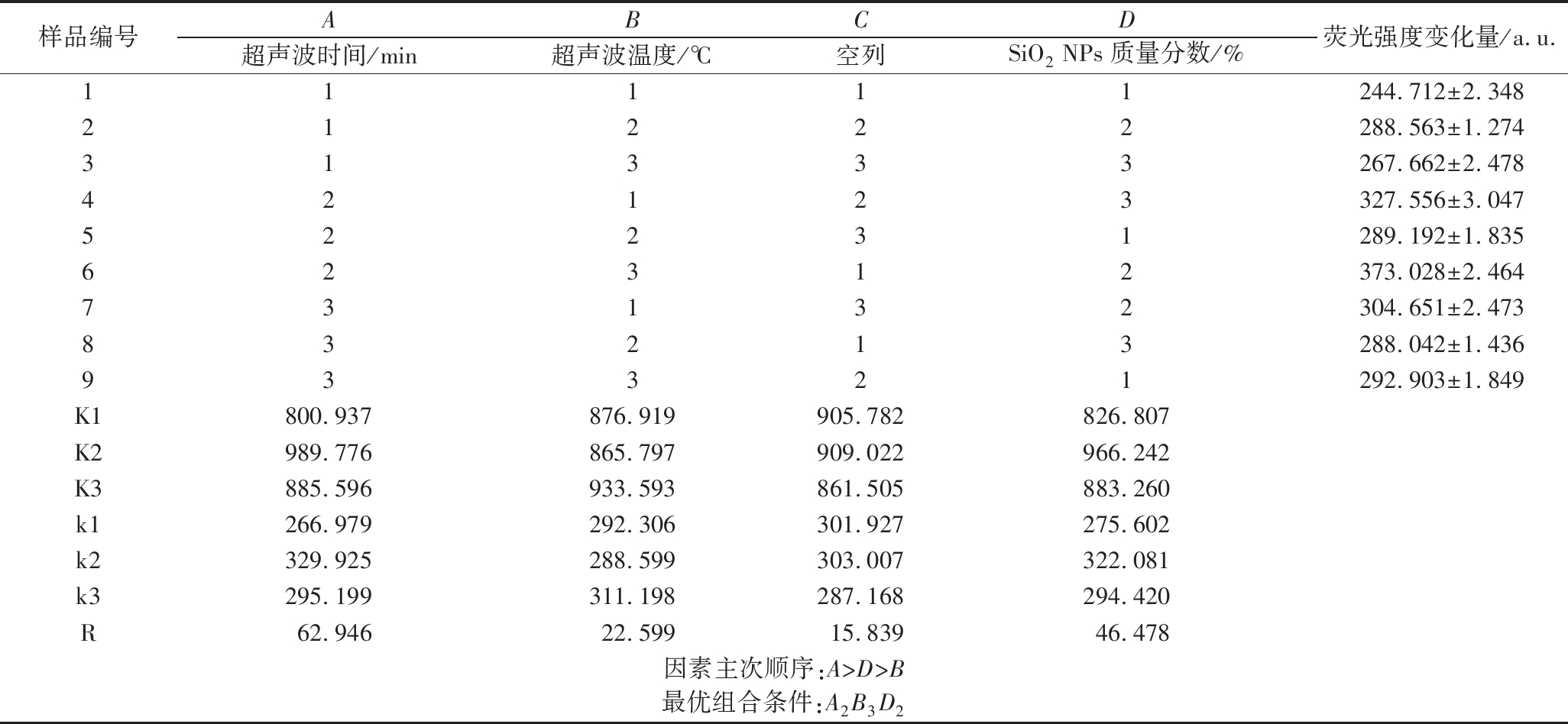
样品编号ABCD超声波时间/min超声波温度/℃空列SiO2 NPs质量分数/%荧光强度变化量/a.u.11111244.712±2.34821222288.563±1.27431333267.662±2.47842123327.556±3.04752231289.192±1.83562312373.028±2.46473132304.651±2.47383213288.042±1.43693321292.903±1.849K1800.937 876.919 905.782 826.807 K2989.776 865.797 909.022 966.242 K3885.596 933.593 861.505 883.260 k1266.979 292.306 301.927 275.602 k2329.925 288.599 303.007 322.081 k3295.199 311.198 287.168 294.420 R62.94622.59915.83946.478因素主次顺序:A>D>B最优组合条件:A2B3D2
2.3 SiO2NPs、COOH-SiO2NPs和WOP-SiO2 PC的表征
微乳液法是常见的合成SiO2NPs的方法之一,具有实验装置简单、操作容易和粒径可控等优点。由图2-a可知,采用反向微乳液法所制备的SiO2NPs形状均一、颗粒饱满,大多呈球形。该方法制备的SiO2NPs平均粒径约为(25.36±0.27) nm。图2-b中羧基化得到的COOH-SiO2NPs形状与粒径无明显变化,但聚集程度有所下降。图2-c中WOP-SiO2 PC平均粒径较SiO2NPs有所增加,为(28.13±0.33) nm,形状不规则程度增加,可以初步判定WOP-SiO2 PC制备成功。

a-SiO2 NPs;b-COOH-SiO2 NPs;c-WOP-SiO2 PC
图2 SiO2NPs、COOH-SiO2NPs、WOP-SiO2 PC的TEM表征
Fig.2 TEM characterization of SiO2 NPs, COOH-SiO2 NPs, and WOP-SiO2 PC
根据图3可以看出,制备得到的SiO2NPs在1 100 cm-1左右出现非常明显的硅氧基(—Si—O—)特征峰,该峰是对SiO2NPs基本结构的反映;在3 413 cm-1左右出现羟基(—OH)吸收峰说明制备的SiO2NPs表面具有大量的硅羟基(Si—OH)。COOH-SiO2NPs在3 413 cm-1的羟基(—OH)吸收峰消失,说明原SiO2NPs表面的羟基被其他基团取代;在1 660 cm-1出现碳氧双键(—C![]() O—)吸收峰,证明羧基成功修饰到SiO2NPs表面。WOP-SiO2 PC在1 655、1 533 cm-1左右分别出现酰胺I谱带(—C
O—)吸收峰,证明羧基成功修饰到SiO2NPs表面。WOP-SiO2 PC在1 655、1 533 cm-1左右分别出现酰胺I谱带(—C![]() O—)和酰胺II谱带(N—H),说明WOP-SiO2 PC中含有谷氨酰胺等酰胺类氨基酸或WOP中氨基酸的氨基与COOH-SiO2 NPs的羧基脱水缩合形成了酰胺键;在1 401 cm-1左右出现了苯环吸收峰,说明WOP-SiO2 PC中含有苯丙氨酸、酪氨酸等含苯环氨基酸;在3 284 cm-1左右又出现了新的羟基(—OH)吸收峰,说明WOP-SiO2 PC含有丝氨酸、苏氨酸或酪氨酸等含羟基氨基酸;上述特征峰的出现可以表明WOP-SiO2 PC成功制备。
O—)和酰胺II谱带(N—H),说明WOP-SiO2 PC中含有谷氨酰胺等酰胺类氨基酸或WOP中氨基酸的氨基与COOH-SiO2 NPs的羧基脱水缩合形成了酰胺键;在1 401 cm-1左右出现了苯环吸收峰,说明WOP-SiO2 PC中含有苯丙氨酸、酪氨酸等含苯环氨基酸;在3 284 cm-1左右又出现了新的羟基(—OH)吸收峰,说明WOP-SiO2 PC含有丝氨酸、苏氨酸或酪氨酸等含羟基氨基酸;上述特征峰的出现可以表明WOP-SiO2 PC成功制备。
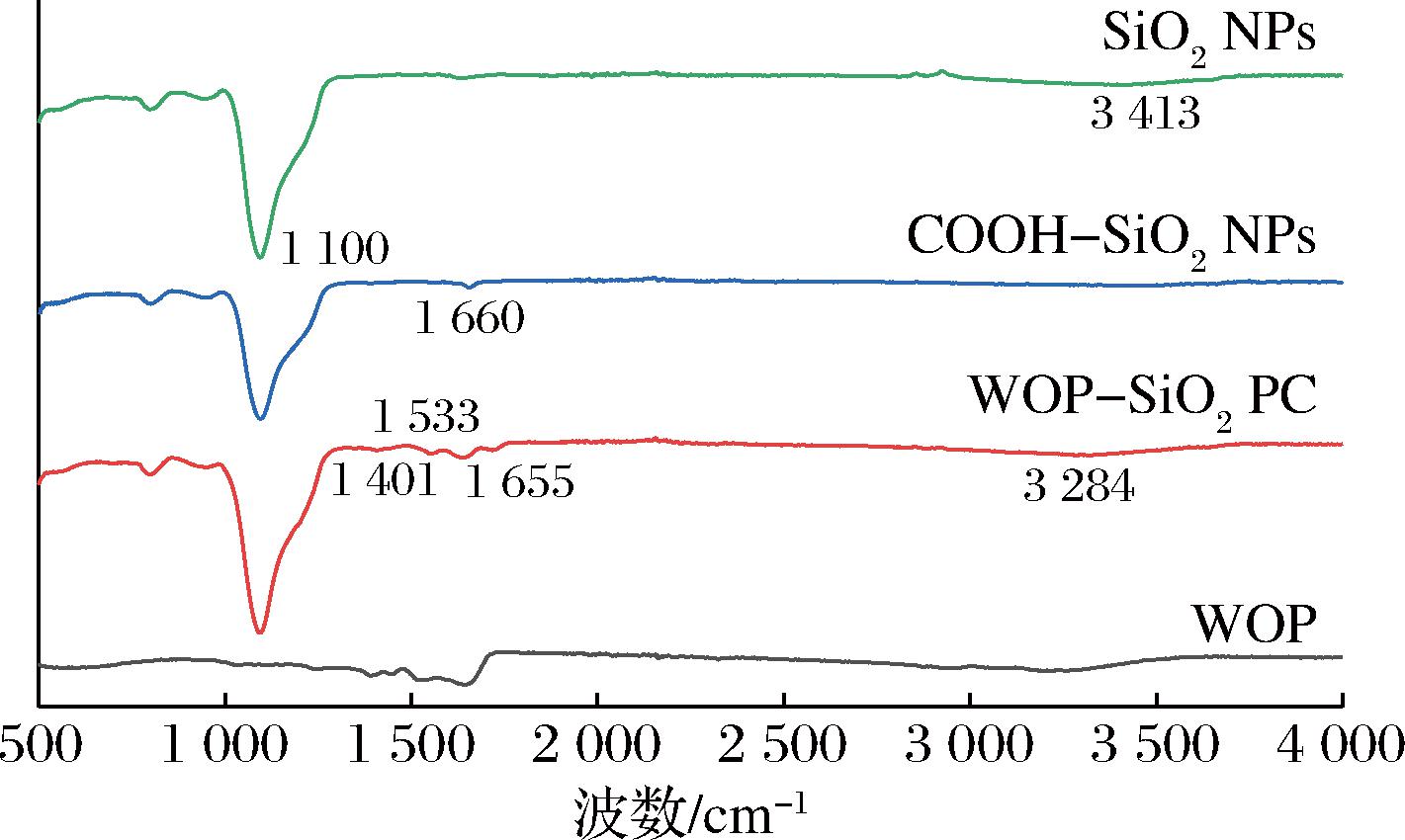
图3 不同物质的FTIR对比
Fig.3 Comparison of Fourier transform infrared spectroscopy (FTIR) of different substances
2.4 WOP-SiO2 PC性能测定
2.4.1 DPPH自由基、ABTS阳离子自由基清除能力测定
WOP-SiO2 PC的DPPH自由基清除能力如图4-a所示,以抗坏血酸为对照,质量浓度在2~10 mg/mL范围内的复合物对DPPH自由基清除率随质量浓度的增加呈下降趋势。当质量浓度为2 mg/mL时清除率最高达到38.35%。DPPH自由基清除能力为:维生素C>WOP>WOP-SiO2 PC>COOH-SiO2NPs。WOP的DPPH自由基清除能力可能是因为小麦蛋白酶解过程中释放出的部分物质可以作为质子供体,将DPPH自由基转变成为稳定的反磁性分子。同时酶解后的WOP具有更多的活性基团和位点使自由基连锁反应终止,从而呈现出一定的抗氧化能力[23-24]。WOP-SiO2 PC的ABTS阳离子自由基清除能力如图4-b所示,质量浓度在2~10 mg/mL范围内的复合物对ABTS阳离子自由基清除率随浓度的增加也呈下降趋势。当质量浓度为2 mg/mL时清除率最高达到55.12%。ABTS阳离子自由基清除能力为:维生素C>WOP>WOP-SiO2 PC>COOH-SiO2NPs。
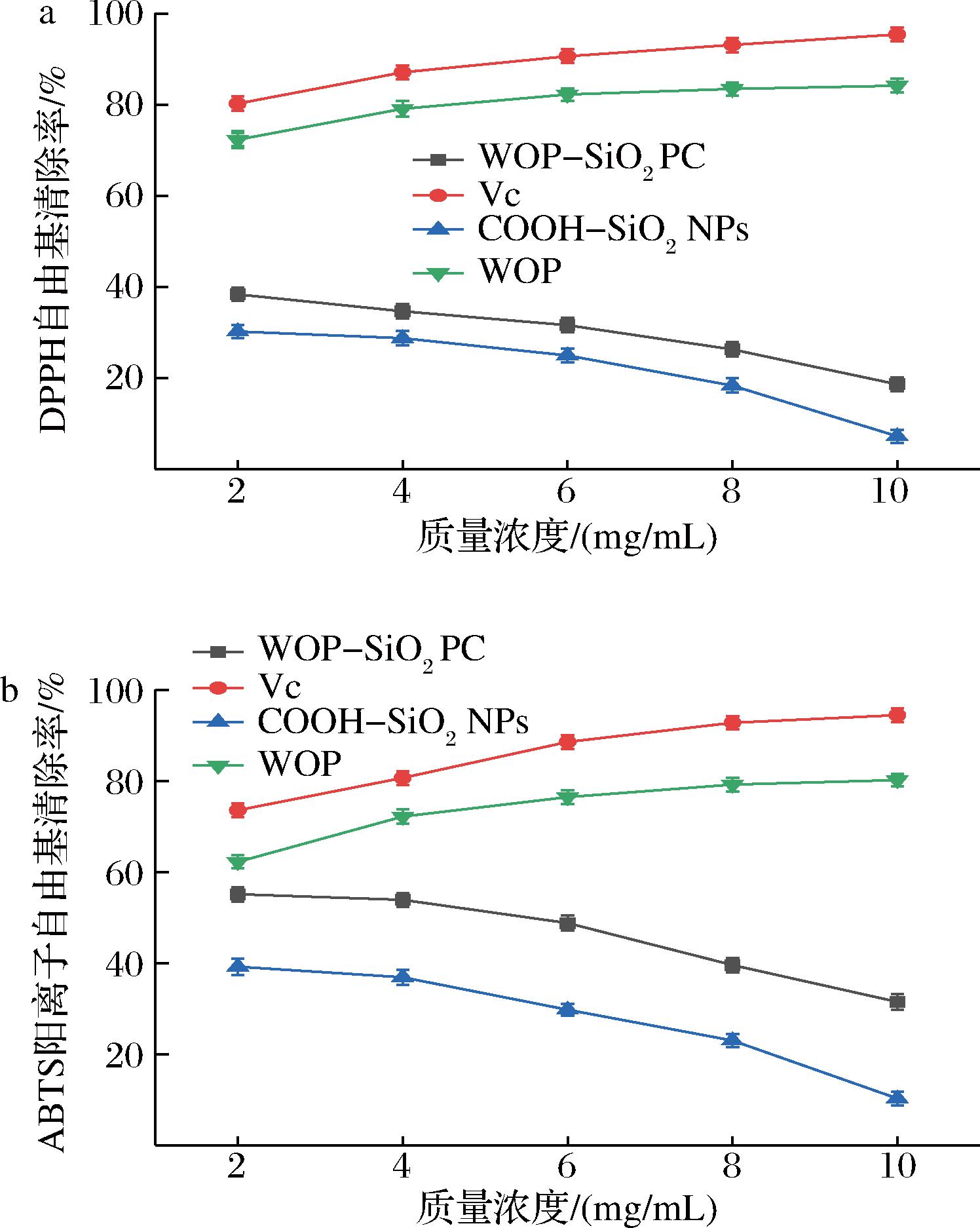
a-DPPH自由基清除能力;b-ABTS阳离子自由基清除能力
图4 维生素C、WOP、WOP-SiO2 PC、COOH-SiO2NPs的自由基清除能力对比
Fig.4 Comparison of free radical scavenging ability of vitamin C, WOP, WOP-SiO2 PC, and COOH-SiO2 NPs
WOP的ABTS阳离子自由基清除作用可能是由于酶解过程改变了空间构型、氨基酸组成和分子空间排列等,从而使WOP产生离子化的氨基或羧基等供氢体[25]。此外,某些氨基酸如酪氨酸含有可以提供质子的酚羟基,将氧化自由基还原,终止自由基连锁反应,以达到清除或抑制自由基的目的[26]。SiO2NPs是一种酸性氧化物,本身具有氧化能力且在生物环境下颗粒表面会生成大量自由基、过氧化氢等氧化性物质。其表面修饰的羧基也具有一定的氧化能力,与WOP复合后形成的WOP-SiO2 PC在一定浓度范围内其还原性高于氧化性,但随着浓度的增加,体系内的羧基和自由基数量增加,氧化能力增幅大于WOP对DPPH自由基的清除能力,导致复合物DPPH自由基、ABTS阳离子自由基清除能力下降。
2.4.2 起泡性和起泡稳定性测定
如图5所示,复合物质量浓度为25~125 mg/mL时,起泡性和起泡稳定性随着复合物质量浓度的增加均呈下降趋势。当复合物质量浓度为25 mg/mL起泡性和起泡稳定性均有最大值为103.51%和15.21%。这可能是因为高速均质过程中大量空气混入后形成水-空气界面,WOP的肽链在界面中伸展并相互作用形成的三维保护网络使界面膜得以加强,从而促进了泡沫的形成,赋予了复合物一定的起泡能力[27]。但随着WOP-SiO2 PC的增加,体系内的稳定性增加,界面张力增强,界面膜的黏度与强度降低。且复合物中的WOP主要含有的氨基酸为谷氨酰胺和脯氨酸等亲水性氨基酸[28],更多低聚肽中的亲水基团与水分子结合,使水油界面不能达到平衡,降低了被界面吸附的能力,使得起泡性能降低。随着时间增加,WOP的水解度增加,WOP的水解物分子质量过小也不利于泡沫的形成与稳定。
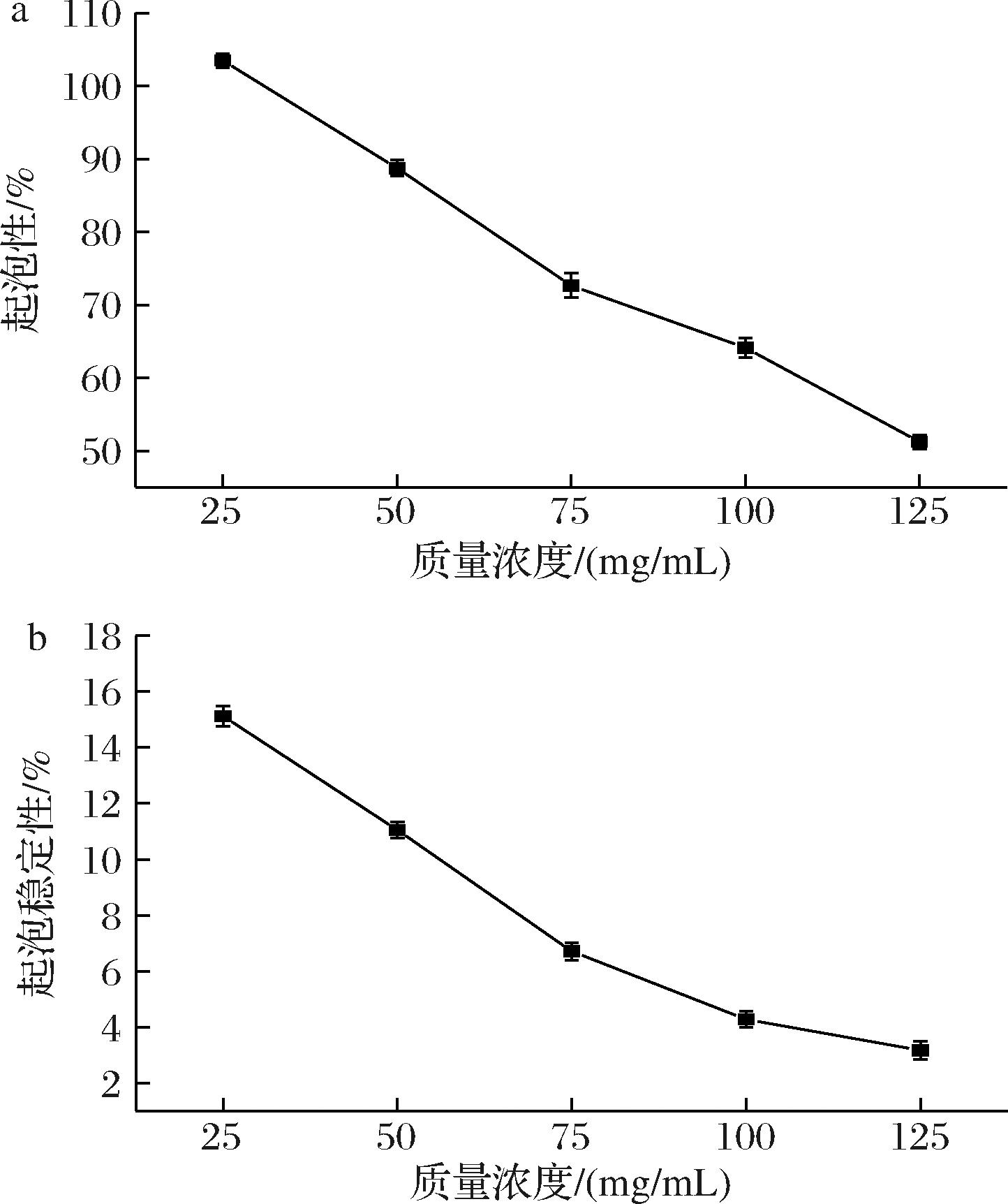
a-起泡性;b-起泡稳定性
图5 WOP-SiO2 PC的起泡性及起泡稳定性
Fig.5 Foaming property and foaming stability of WOP-SiO2 PC
2.4.3 持水性和持油性测定
如图6所示,质量浓度在25~125 mg/mL范围内的复合物的持水性和持油性随着复合物浓度的增加均呈上升趋势。当质量浓度为125 mg/mL时持水性和持油性均有最大值为423.67%和442.79%。这可能是因为SiO2NPs具有稀疏多孔的空间结构,可以有效的运载大量水分子。WOP-SiO2 PC表面修饰了羧基,表面具有很多可供反应的点位,能够透过氢键与水分子短时间结合[29]。修饰后的SiO2NPs具有更复杂的空间结构,使水分不易流失。且WOP中含有大量亲水性氨基酸,氨基酸中的亲水基团与水分子充分结合,进一步增强了复合物的持水性能。WOP-SiO2 PC的持油性如图6-b所示,随着复合物浓度的增加,持油性呈上升趋势。这可能是因为SiO2NPs具有稀疏多孔的空间结构,可以有效的运载大量油分,且WOP-SiO2 PC表面修饰了羧基与WOP,修饰后的SiO2NPs具有更复杂的空间结构,能更好的储存油分。不仅如此,WOP中含有部分疏水性氨基酸[30],疏水性残基吸附于油相使复合物与油相结合更加紧密,进一步增强了复合物的持油性能。
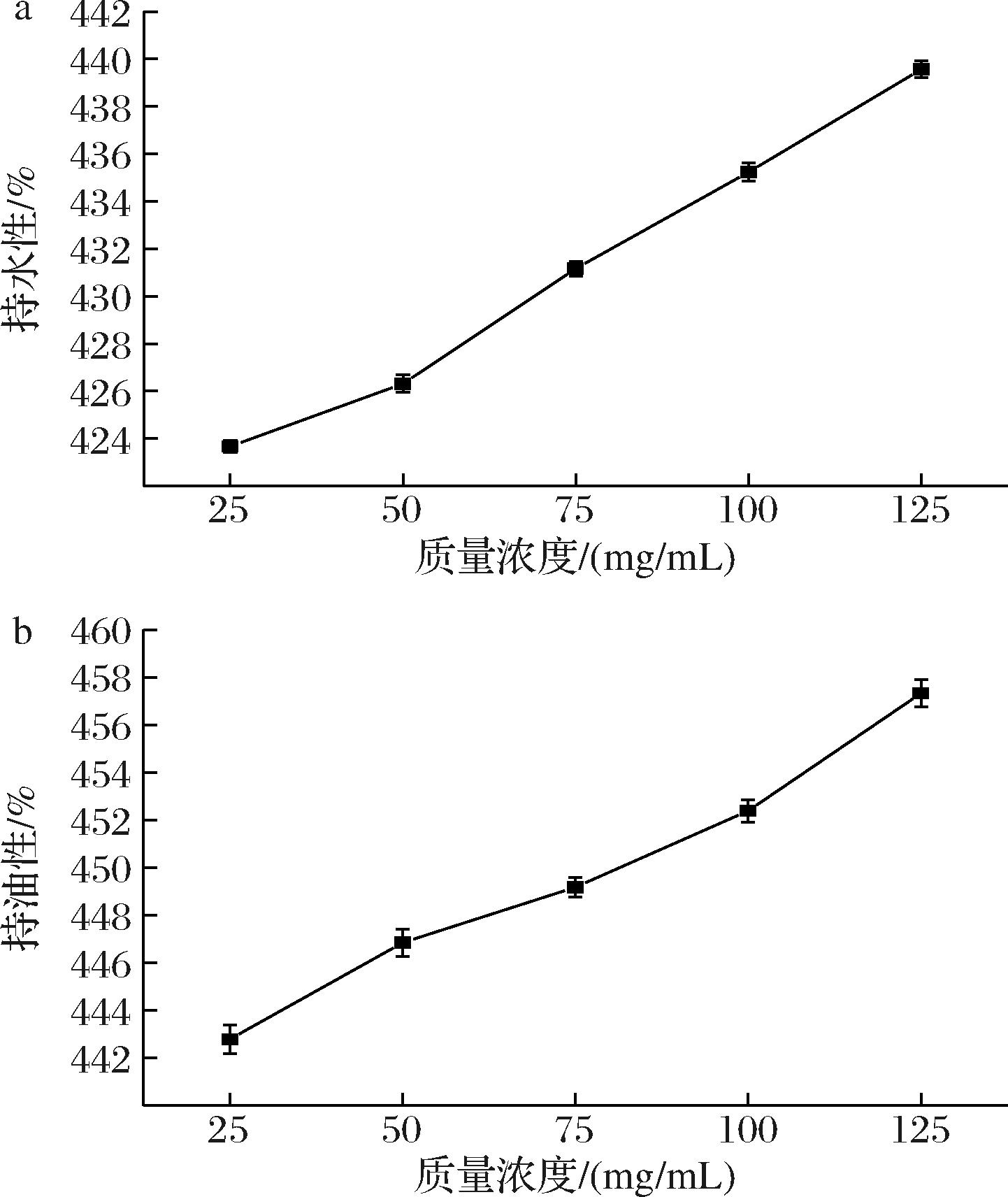
a-持水性;b-持油性
图6 WOP-SiO2 PC的持水性和持油性
Fig.6 Water-holding property and oil-holding property of WOP-SiO2 PC
2.4.4 乳化性及乳化稳定性测定
如图7所示,质量浓度在25~125 mg/mL范围内的复合物的乳化性随着复合物浓度的增加呈上升趋势,而乳化稳定性呈下降趋势。当质量浓度为125 mg/mL时乳化性有最大值为16.81 m2/g,而质量浓度为25 mg/mL时乳化稳定性达到最大值65.21%。这可能是因为WOP-SiO2 PC可以改善水-油界面行为,能在水/油界面可以形成稠密的包裹层,有效的阻止分散相液滴因静电吸引、界面能改变、空间结构等因素而发生絮凝、聚集或合并[31]。WOP作为两亲性物质同时含有亲水性氨基酸和疏水性氨基酸,能够自发的迁移至水/油界面并在界面形成高黏弹性薄膜,降低体系内的自由能[32]。且疏水性氨基酸的含量增加,使界面张力降低,进而提高复合物的乳化活性。但随着时间增加复合物开始沉降,同时WOP水解程度增加。WOP含有的氨基酸主要为亲水性氨基酸,亲水性残基吸附于水相,使水油界面平衡稳定性降低,导致被界面吸附的能力的降低,近一步使得乳化稳定性降低。
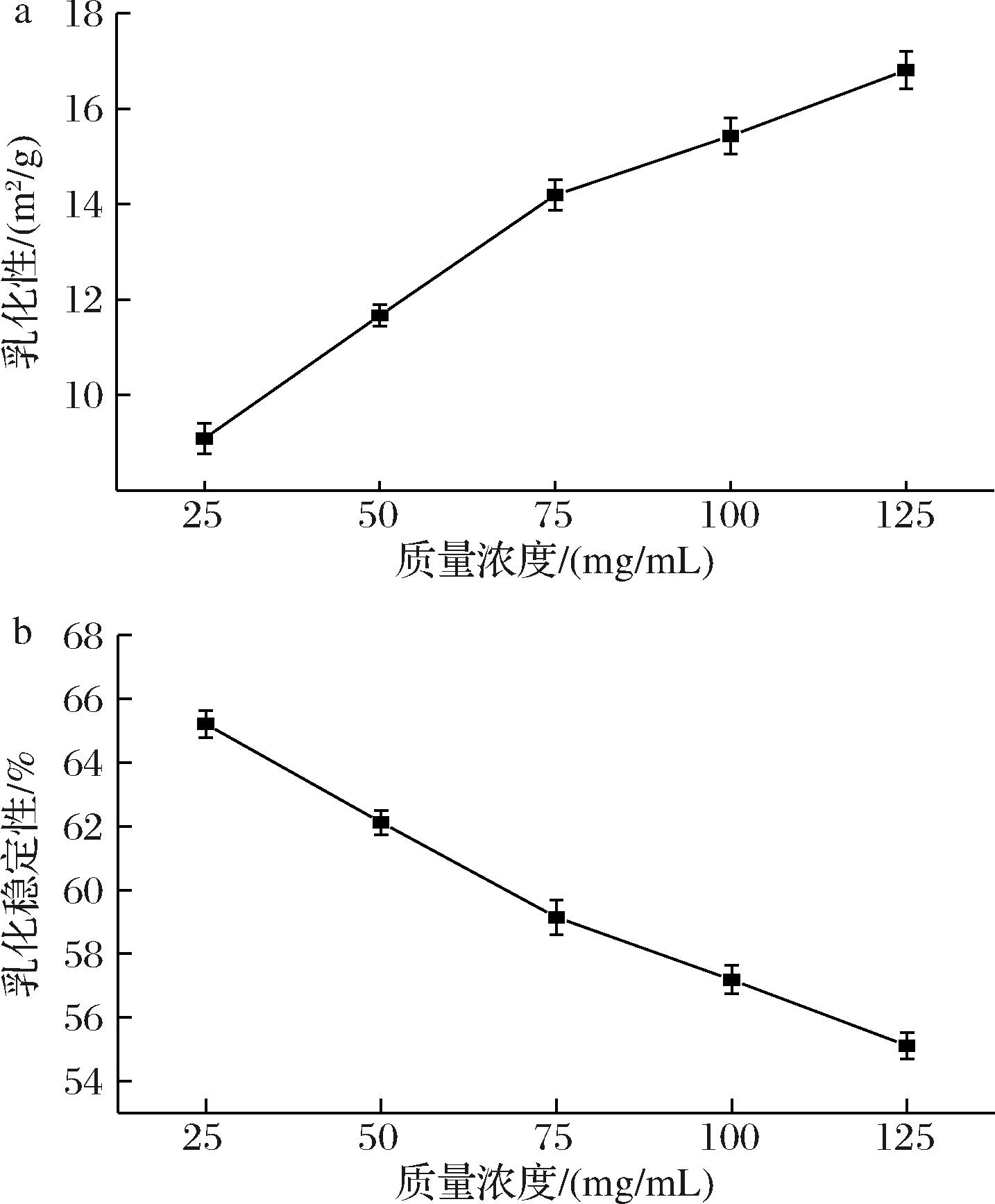
a-乳化性;b-乳化稳定性
图7 WOP-SiO2 PC的乳化性和乳化稳定性
Fig.7 Emulsifiability and emulsion stability of WOP-SiO2 PC
3 结论与讨论
本实验采用改良的反向微乳液法制备食品级SiO2NPs,然后利用改良的表面接枝聚合物改性方法进行表面羧基化,再通过超声复合SiO2NPs与WOP制备蛋白冠。以荧光峰值强度变化量作为单因素指标,进一步探索超声波时间、超声波温度和SiO2NPs对WOP-SiO2 PC制备的影响以确定最佳制备体系。实验获得的优化工艺条件为:超声波时间20 min,超声温度65 ℃,SiO2NPs 0.75%。此条件下荧光峰值变化量最大为385.26±2.245。
对WOP-SiO2 PC进行起泡能力、抗氧化能力和乳化能力测定。在一定浓度下WOP-SiO2 PC相较SiO2NPs与COOH-SiO2NPs具有更强的抗氧化能力,WOP-SiO2 PC的持水、持油能力均高于400%,起泡少、泡沫消失快且具有一定的乳化能力,这些性质表明WOP-SiO2 PC适合作为冲调类粉末状食物中的添加剂。
[1] 孙德权, 陆新华, 李伟明, 等.介孔二氧化硅纳米粒在农业中的应用[J].生物技术通报, 2022, 38(5):228-239.
SUN D Q, LU X H, LI W M, et al.Application of mesoporous silica nanoparticles in agriculture[J].Biotechnology Bulletin, 2022, 38(5):228-239.
[2] GAO Y T, LI J Z, ZHAO L J, et al.Distribution pattern and surface nature-mediated differential effects of hydrophilic and hydrophobic nano-silica on key direct compaction properties of Citri Reticulatae Pericarpium powder by co-processing[J].Powder Technology, 2022, 404:117442.
[3] YUAN E D, NIE S Y, LIU L Y, et al.Study on the interaction of Hericium erinaceus mycelium polysaccharides and its degradation products with food additive silica nanoparticles[J].Food Chemistry:X, 2021, 12:100172.
[4] YU J, KIM Y H, KIM H M, et al.Determination of the fate and biological responses of food additive silica particles in commercial foods[J].Food Chemistry, 2020, 331:127304.
[5] GUO Z Y, MARTUCCI N J, LIU Y Z, et al.Silicon dioxide nanoparticle exposure affects small intestine function in an in vitro model[J].Nanotoxicology, 2018, 12(5):485-508.
[6] RANJAN S, DASGUPTA N, SRIVASTAVA P, et al.A spectroscopic study on interaction between bovine serum albumin and titanium dioxide nanoparticle synthesized from microwave-assisted hybrid chemical approach[J].Journal of Photochemistry and Photobiology.B, Biology, 2016, 161:472-481.
[7] TZOUMAKI M V, MOSCHAKIS T, SCHOLTEN E, et al.In vitro lipid digestion of chitin nanocrystal stabilized o/w emulsions[J].Food &Function, 2013, 4(1):121-129.
[8] LIU Y W, HUANG Y, MOU Z, et al.Characterization and preliminary safety evaluation of nano-SiO2 isolated from instant coffee[J].Ecotoxicology and Environmental Safety, 2021, 224:112694.
[9] BRAHMKHATRI V P, SINGH A, CHAKRABORTY A, et al.Multilayer protein corona on gold nanorod surface:First evidence of soft corona protein-protein interactions using solution NMR spectroscopy[J].Applied Surface Science Advances, 2022, 11:100272.
[10] TOMAK A, YILANCIOGLU B, WINKLER D, et al.Protein corona formation on silver nanoparticles under different conditions[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2022, 651:129666.
[11] CUI G X, ZHANG L J, ZAKY A A, et al.Protein coronas formed by three blood proteins and food-borne carbon dots from roast mackerel:Effects on cytotoxicity and cellular metabolites[J].International Journal of Biological Macromolecules, 2022, 216:799-809.
[12] LI X X, LIAO A M, DONG Y Q, et al.In vitro dynamic digestion and anti-fatigue effects of wheat embryo albumin[J].Food &Function, 2022, 13(5):2559-2569.
[13] 刘文颖, 冯晓文, 程青丽, 等.小麦低聚肽的结构特征及其体外抗氧化活性[J].现代食品科技, 2021, 37(12):72-79.
LIU W Y, FENG X W, CHENG Q L, et al.Structural characteristics and in vitro antioxidative activity of wheat oligopeptides[J].Modern Food Science and Technology, 2021, 37(12):72-79.
[14] LI H, CHEN X P, SHEN D Q, et al.Functionalized silica nanoparticles:Classification, synthetic approaches and recent advances in adsorption applications[J].Nanoscale, 2021, 13(38):15998-16016.
[15] ALAVI M, THOMAS S, SREEDHARAN M.Modification of silica nanoparticles for antibacterial activities:Mechanism of action[J].Micro Nano Biotechnology Aspects, 2022, 1(1):49-58.
[16] 王荣, 罗倩, 冯怡.DPPH、ABTS和FRAP微量法测定山奈酚的抗氧化能力[J].广州化工, 2021, 49(3):58-59;63.
WANG R, LUO Q, FENG Y.Determination of antioxidant effects of kaempferol by micro-model of DPPH, ABTS and FRAP assay[J].Guangzhou Chemical Industry, 2021, 49(3):58-59;63.
[17] 赵国瑜, 范方宇, 黄瑾, 等.纳米SiO2改性4种大分子材料的乳液制备及性质[J].食品科学, 2022, 43(8):22-28.
ZHAO G Y, FAN F Y, HUANG J, et al.Preparation and properties of emulsions stabilized with four kinds of nano-SiO2-modified macromolecular material[J].Food Science, 2022, 43(8):22-28.
[18] ZOLGHADRNASAB M, MOUSAVI A, FARMANY A, et al.Ultrasound-mediated gene delivery into suspended plant cells using polyethyleneimine-coated mesoporous silica nanoparticles[J].Ultrasonics Sonochemistry, 2021, 73:105507.
[19] BU X N, ALHESHIBRI M.The effect of ultrasound on bulk and surface nanobubbles:A review of the current status[J].Ultrasonics Sonochemistry, 2021, 76:105629.
[20] YAN S Z, XU J W, ZHANG S, et al.Effects of flexibility and surface hydrophobicity on emulsifying properties:Ultrasound-treated soybean protein isolate[J].LWT, 2021, 142:110881.
[21] LI T, LU X M, ZHANG M R, et al.Peptide-based nanomaterials:Self-assembly, properties and applications[J].Bioactive Materials, 2021, 11:268-282.
[22] PRASAD BHATTA D, SINGLA S, GARG R.Microstructural and strength parameters of nano-SiO2 based cement composites[J].Materials Today:Proceedings, 2021, 46:6743-6747.
[23] TIAN S Q, DU K, YAN F, et al.Microwave-assisted enzymatic hydrolysis of wheat germ albumin to prepare polypeptides and influence on physical and chemical properties[J].Food Chemistry, 2022, 374:131707.
[24] JAMDAR F, ALI MORTAZAVI S, REZA SAIEDI ASL M, et al.Physicochemical properties and enzymatic activity of wheat germ extract microencapsulated with spray and freeze drying[J].Food Science &Nutrition, 2021, 9(2):1192-1201.
[25] CHEN W J, LIAO A M, HOU Y C, et al.Digestive characteristics and peptide release from wheat embryo proteins in vitro[J].Food &Function, 2021, 12(5):2257-2269.
[26] HUANG L R, JIA S F, WU R K, et al.The structure, antioxidant and antibacterial properties of thiol-modified soy protein isolate induced by allicin[J].Food Chemistry, 2022, 396:133713.
[27] BETTELLI M A, CAPEZZA A J, NILSSON F, et al.Sustainable wheat protein biofoams:Dry upscalable extrusion at low temperature[J].Biomacromolecules, 2022, 23(12):5116-5126.
[28] 王倩倩, 杜鹃, 陈鸣, 等.小麦肽的抗氧化与抗疲劳作用的研究[J].食品工业科技, 2021, 42(17):357-365.
WANG Q Q, DU J, CHEN M, et al.Study on the antioxidant and anti-fatigue effect of wheat peptides[J].Science and Technology of Food Industry, 2021, 42(17):357-365.
[29] HEIDARI A, ABDOLLAHI E, MOHAMMADI T, et al.Improving permeability, hydrophilicity and antifouling characteristic of PES hollow fiber UF membrane using carboxylic PES:A promising substrate to fabricate NF layer[J].Separation and Purification Technology, 2021, 270:118811.
[30] GONG X X, AN Q, LE L Q, et al.Prospects of cereal protein-derived bioactive peptides:Sources, bioactivities diversity, and production[J].Critical Reviews in Food Science and Nutrition, 2022, 62(11):2855-2871.
[31] SUN G Y, ZHANG H, LIU D W, et al.Co-adsorption behavior of aggregated asphaltenes and silica nanoparticles at oil/water interface and its effect on emulsion stability[J].Petroleum Science, 2022, 19(4):1793-1802.
[32] KARAMI Z, PEIGHAMBARDOUST S H, HESARI J, et al.Identification and synthesis of multifunctional peptides from wheat germ hydrolysate fractions obtained by proteinase K digestion[J].Journal of Food Biochemistry, 2019, 43(4):e12800.