鲜核桃为近年来我国市场上迅速崛起的干果鲜用的典型代表,其口感脆嫩,富含蛋白质、维生素E、不饱和脂肪酸和人体必需氨基酸等多种营养成分,比干核桃具有更高的抗氧化性[1-2]。近年来,鲜核桃深受国内消费者的喜爱,市场销售范围已由陕西、四川、山西等核桃主产区扩展至其他省份。青皮核桃果实为鲜核桃贮藏和销售的主要形式之一,果实青皮对于延长其核仁寿命具有一定积极作用。然而,核桃果实采后青皮极易发生褐变,严重时会进一步污染核仁,导致品质下降,缩短其贮藏寿命[3]。
果实褐变是影响其采后品质及寿命的主要因素。褐变的发生可能与酚类氧化、活性氧过量积累、细胞膜完整性破坏和低温胁迫的膜脂代谢紊乱等方面关系密切[4]。低温具有易操作和安全无毒等优点,在皇冠梨[5]、甜樱桃[6]和核桃果实[7]等的贮藏中应用广泛,显著延长其贮藏寿命。然而,温度过低可能会引起果实冷害的发生,而果实褐变可能是冷害的一种表现[8]。果实不同部位可能存在生理差异,进而导致其不同部位褐变程度的差异[9]。脯氨酸和可溶性糖均具有抗氧化性,可能与果实的抗寒性存在密切关系[10]。活性氧(reactive oxide species,ROS)包括过氧化氢(H2O2)、超氧阴离子(·O2-)和羟自由基(·OH)等。清除ROS的积累可以维持果实细胞膜结构完整性,防止多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)接触它们各自的酚类底物,能够减少龙眼果实采后果皮酶促褐变的发生[11]。
核桃果实采后青皮褐变及种仁品质是衡量其贮藏效果的重要方面。种仁品质主要包括粗脂肪、可溶性蛋白质含量和衡量油脂酸败及氧化的酸价(acid value,AV)和过氧化值(peroxide value,PV)等指标[3,12]。目前,有关不同贮藏温度对核桃果实的影响研究主要集中在青皮外观、酚类代谢和种仁营养品质等方面[13],关于不同贮藏温度条件下青皮不同部位的褐变差异及其原因未见研究。研究以‘清香’核桃果实为材料,测定0、2、5、8 ℃下果实不同部位褐变相关指标的变化和差异,探究其褐变差异的可能原因,为核桃果实低温冷藏提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
‘清香’核桃果实在青皮与果壳形成离层时,采收于陕西省周至县管理良好的核桃示范园。采收时选择大小一致、色泽均匀、无机械损伤和病虫害的果实,小心剪去果柄后,置于塑料果箱内运回西北农林科技大学。
福林酚、愈创木酚、三氯乙酸,北京索莱宝生物科技有限公司;邻苯二酚、盐酸羟胺、对氨基苯磺酸、α-萘胺,上海阿拉丁试剂有限公司;石油醚,成都市科隆化学品有限公司。
1.2 仪器与设备
D90相机,日本Nikon公司;A11型研磨分析仪,德国IKA公司;UV-3100型紫外可见分光光度计,中国上海美谱达仪器有限公司;MULTISKAN GO全波长酶标仪,美国Thermo Fisher公司;AG 22331型低温离心机,德国Eppendorf公司;CR-400型色差分析仪,日本Konica Minolta公司。
1.3 试验方法
1.3.1 样品处理
样品于室温摊放2 h散发田间热后分为4组,分别移至(0±0.5)、(2±0.5)、(5±0.5)、(8±0.5) ℃预冷24 h,采用厚度为0.03 mm的聚乙烯(polyethene 30,PE30)包装袋(规格25 cm × 35 cm)包装后,继续于该温度下进行封口贮藏。每组40袋,每袋10个果实。5、8 ℃果实贮藏30 d、0、2 ℃果实贮藏60 d,果实褐变严重时试验中止。
1.3.2 取样
核桃果实贮藏0、30、45、60 d时,每处理随机取3袋(3个重复),进行外观拍照和褐变情况统计后,分梗内、梗外、萼内和萼外4个部位分别取样。梗端和萼端的外部样品从青皮的赤道部位处分开分别取样,内部取近梗端和萼端部位的1/4样品;种仁取样时每处理种仁的固定1/4部位。取样后各部位分别于液氮条件采用研磨仪充分研磨,然后于-80 ℃超低温冰箱保存待用。
1.3.3 指标测定
1.3.3.1 外观
采用D90相机对核桃果实青皮外观进行拍照,观测记录青皮褐变、软褐和开裂情况。
1.3.3.2 褐变指数
核桃果实青皮褐变指数的评定级数参考弓弼等[14]的方法。依据青皮表面发生褐变的面积(S)分成5个等级。0级:无褐变;1级:S≤1/5;2级:S=1/5~2/5;3级:S=2/5~3/5;4级:S=3/5~4/5;5级:S=4/5~1。褐变指数/%=∑ (褐变级别×该级别数) ×100 /(检查总数×最高级别数)
1.3.3.3 可溶性总糖、游离脯氨酸和丙二醛(malondialdehyde,MDA)含量
可溶性总糖含量参考SULTANOVA等[15]的方法测定,略有修改。取0.1 g核桃青皮粉末加入H2O 1 mL,沸水浴40 min后快速冷却,离心15 min(4 ℃,10 000×g)。吸上清液0.05 mL加入蒸馏水1.95 mL、蒽酮-乙酸乙酯溶液0.5 mL和浓硫酸5 mL,沸水浴1 min,冷却后在630 nm波长下测定吸光值。
游离脯氨酸含量参考 LI等[5]的方法测定,略有修改。取0.2 g核桃青皮粉末加入磺基水杨酸(30 g/L)1.5 mL,沸水浴10 min,冷却后离心15 min(4 ℃,10 000×g)。吸上层清液1 mL加入醋酸1 mL和酸性茚三酮试剂1.5 mL,再次沸水浴30 min后冷却,加入甲苯2 mL,摇晃30 s后静置。待溶液分层后,吸取上层脯氨酸-甲苯溶液于520 nm处测定吸光值。
MDA含量参照 CHEN等[16]的方法测定,略有修改。取0.5 g核桃青皮粉样加入100 g/L三氯乙酸5 mL,静置30 min后离心20 min(4 ℃,8 000×g)。在1 mL上清液中加5 g/L硫代巴比妥酸溶液1 mL混匀在沸水中反应15 min,冷却后离心15 min(4 ℃,8 000×g),分别在450、532、600 nm 波长下测定上清液吸光值。
1.3.3.4 总酚含量和PPO、POD活性
总酚含量测定方法参考CHEN等[17],略有修改。称取0.1 g核桃青皮样品加入体积分数70%乙醇1.5 mL,离心10 min(4 ℃,10 000×g),吸取0.1 mL上清液加入2 mL 200 g/L Na2CO3和0.9 mL福林酚,30 min后在750 nm波长处测定其吸光值。
酶提取液制备:称取0.5 g核桃青皮粉样,加入 6 mL磷酸钠缓冲液(4 ℃预冷,0.1 mol/L,pH 6.8,含有40 g/L PVP、体积分数1% Triton X-100),混匀反应10 min后离心20 min (4 ℃,10 000×g),上清液用于测定POD和PPO活性。
酶活性测定:参考WANG等[3]方法测定POD和PPO活性,略有修改。POD活性:吸取酶液1 mL加入Na3PO4缓冲液(0.1 mol/L,pH 6.8)1 mL和愈创木酚溶液(25 mmol/L)3 mL,加入体积分数2%H2O2溶液0.2 mL。将每分钟OD470变化0.1计1个POD活力单位(U),单位为U/mg蛋白质。PPO活性:吸取酶液0.5 mL加入Na3PO4缓冲液(0.1 mol/L,pH 6.8)2 mL,加入邻苯二酚(0.05 mol/L)溶液2 mL。将每分钟OD410变化0.1计1个PPO活力单位(U),单位为U/mg蛋白质。
1.3.3.5 H2O2含量和·O2-产生率
H2O2含量测定:取0.25 g核桃青皮粉样,加入Na3PO4缓冲液(0.01 mol/L,pH 7.0)1.2 mL后,于冰上静置45 min后离心20 min(4 ℃、12 000×g)。吸取0.4 mL上清液加入Na3PO4缓冲液(0.01 mol/L,pH 7.0)0.4 mL和反应底物0.8 mL,完全反应15 min后于570 nm处测定吸光值。
·O2-产生率参考曹建康等[18]的方法测定,略有修改。称取0.4 g核桃青皮粉样加入K3PO4缓冲液(pH 7.8,含有10 g/L PVP)1.5 mL,离心15 min(4 ℃,10 000×g)后放置2 h。吸取上清液1 mL,加入0.9 mL PBS和盐酸羟胺溶液(10 mmol/L)0.1 mL,在25 ℃条件下放置1 h。吸取上清液1 mL加入1 mL 对氨基苯磺酸溶液(17 mmol/L)和1 mL α-萘胺溶液(7 mmol/L),在25 ℃下反应20 min后于530 nm处测定吸光值。
1.3.3.6 种仁品质
种仁的可溶性蛋白质含量采用考马斯亮蓝法进行测定,粗脂肪含量参考MA等[2]进行测定。AV根据GB 5009.229—2016《食品安全国家标准 食品中酸价的测定》进行测定,PV根据GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》进行测定。
1.4 数据处理
使用SPSS 25和Origin 2022软件分别进行数据统计分析和作图,采用Duncan方差分析法分析不同温度之间的差异显著性,数据为3个重复的平均值。
2 结果与分析
2.1 贮藏温度对核桃果实冷藏期青皮不同部位外观品质和褐变指数的影响
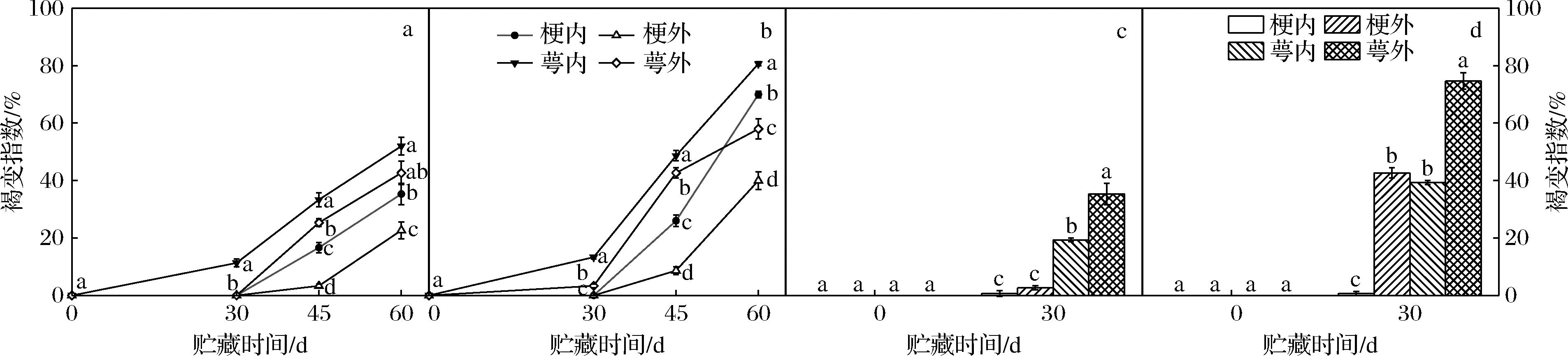
随着贮藏温度的升高和贮藏时间的延长,核桃果实青皮的褐变、裂果和软褐现象加重,其内部褐变由萼端逐渐向梗端蔓延,褐色丝状物明显增加(图1)。青皮不同部位的褐变指数均随着温度的升高和冷藏时间的延长呈上升趋势,以8 ℃处理各部位的褐变指数最高;4种温度下贮藏30~60 d时果实青皮内部萼端的褐变指数显著高于梗端(P<0.05),外部也是如此。贮藏30~60 d时,0、2 ℃果实青皮内部的褐变指数显著高于外部(P<0.05),贮藏30 d时,5、8 ℃果实青皮内部的褐变指数却显著低于外部(图2)。贮藏30 d内,0、2 ℃果实青皮的感官品质差异不大,之后2种温度果实青皮各部位的褐变指数快速上升,且以0 ℃果实的青皮褐变指数显著低于2 ℃果实(P<0.05),60 d时果实青皮外观品质仍然可以接受,感官品质保持最好。

图1 贮藏温度对核桃果实青皮不同部位外观品质的影响
Fig.1 Effect of storage temperatures on appearance quality in different green husk tissues of walnut fruit
a-0 ℃;b-2 ℃;c-5 ℃;d-8 ℃
图2 贮藏温度对核桃果实青皮不同部位褐变指数的影响
Fig.2 Effect of storage temperatures on browning index in different green husk tissues of walnut fruit
注:同一贮藏时间点不同小写字母表示处理间差异显著(P<0.05),相同字母表示处理间差异不显著(下同)。
2.2 贮藏温度对核桃果实冷藏期青皮不同部位可溶性总糖、游离脯氨酸和MDA含量的影响
贮藏期间,不同贮藏温度核桃果实萼端青皮的可溶性总糖含量显著高于梗端(P<0.05),总体均呈现下降趋势(图3-a~图3-d)。贮藏0~30 d时,4种温度下果实青皮不同部位的可溶性总糖含量均快速下降,以内部的下降速度快于外部,梗端的快于萼端;除5 ℃梗内外,0 ℃贮藏下果实青皮的可溶性总糖含量下降速度最慢;贮藏30~60 d时,0、2 ℃下4个部位的可溶性总糖含量变化较小。

a~d-可溶性总糖含量;e~h-游离脯氨酸含量;i~l-MDA含量
图3 贮藏温度对核桃果实青皮不同部位可溶性总糖含量、游离脯氨酸含量和MDA含量的影响
Fig.3 Effect of storage temperatures on the soluble total sugar content, content of free proline and MDA content in different green husk tissues of walnut fruit
贮藏期间,不同贮藏温度核桃果实萼端青皮的游离脯氨酸含量显著高于梗端(P<0.05),内部显著高于外部(P<0.05)(图3-e~h)。贮藏0~45 d时,0、2 ℃核桃果实青皮4个部位的游离脯氨酸含量趋势相似,均呈现上升趋势;45~60 d时,0 ℃外部的变化不明显,内部则呈现下降趋势,且以萼端下降速度快于梗端,2 ℃外部梗端变化不明显,内部梗端呈现下降趋势,萼端在内、外部均呈现上升趋势。贮藏30 d时,以8 ℃贮藏果实青皮4个部位的游离脯氨酸含量上升率显著大于5 ℃条件果实青皮(P<0.05)。
不同贮藏温度核桃果实冷藏期间青皮的MDA含量内部显著高于外部(P<0.05),萼端的MDA含量显著高于梗端(P<0.05)(图3-i~图3-l)。0、2 ℃核桃果实青皮的MDA含量变化趋势类似,且2 ℃萼端内、外部含量显著高于0 ℃(P<0.05)。5、8 ℃果实贮藏30 d时与0 d时相比,青皮4个部位的MDA含量也显著升高(P<0.05)。
2.3 贮藏温度对核桃果实冷藏期青皮不同部位总酚含量、PPO和POD活性的影响
贮藏期间,不同贮藏温度核桃果实青皮外部的总酚含量显著高于内部(P<0.05),内部的总酚含量除0 ℃下在贮藏45 d时萼端有1个高峰出现外,在其他贮藏期间无显著变化(图4-a~图4-d)。0 ℃核桃果实青皮外部萼端的总酚含量显著高于梗端,贮藏45 d时梗端的总酚含量显著下降,且显著低于萼端(P<0.05);在2 ℃时却相反,即梗端的总酚含量高于萼端,并在贮藏45 d时出现高峰,且显著高于此时萼端的总酚含量(P<0.05)。5、8 ℃果实贮藏30 d时,同样表现为外部梗端的总酚含量高于萼端,且以8 ℃贮藏果实青皮4个部位的总酚含量均低于其他所有贮藏温度。

a~d-总酚含量;e~h-PPO活性;i~l-POD活性
图4 贮藏温度对核桃果实青皮不同部位总酚含量、PPO和POD活性的影响
Fig.4 Effect of storage temperatures on total phenol content, PPO activity and POD activity in different green husk tissues of walnut fruit
不同贮藏温度核桃果实贮藏期间青皮外部的PPO活性显著高于内部(P<0.05),萼端的酶活性总体持续下降,梗端的酶活性均却出现高峰(图4-e~图4-h)。贮藏30 d时,0 ℃核桃果实青皮外部的PPO活性为萼端高于梗端,内部则为梗端高于萼端,2 ℃呈现相反趋势;45~60 d时,0、2 ℃核桃果实青皮的内部和外部的PPO活性均呈现以梗端显著高于萼端(P<0.05),5、8 ℃下贮藏30 d时核桃果实青皮酶活性与其表现相同。
各处理核桃果实贮藏期间青皮外部的POD活性显著高于内部(P<0.05),但内部梗端、萼端的POD活性极低而无差异(P>0.05)(图4-i~图4-l)。0、2 ℃核桃果实青皮外部无论梗端还是萼端的POD活性均先升高后降低,在贮藏30 d时活性达到峰值,0 ℃处理果实青皮外部萼端POD活性峰值显著高于梗端(P<0.05),但2 ℃果实青皮梗端峰值显著高于萼端;与0 d相比,在30 d时8 ℃贮藏果实青皮外部萼端和梗端的POD活性呈现下降趋势,与0、2 ℃下贮藏的果实相反。
2.4 贮藏温度对核桃果实冷藏期青皮不同部位H2O2含量和·O2-产生率的影响
不同贮藏温度核桃果实贮藏期间青皮外部的H2O2含量下降,且显著高于内部(P<0.05)(图5-a~图5-d)。贮藏期间除5 ℃外核桃果实青皮外部的H2O2含量在梗端和萼端之间不存在显著差异(P>0.05),内部贮藏0~30 d时除2 ℃外2个部位之间不存在显著差异(P>0.05),贮藏45~60 d时0 ℃萼端含量显著高于梗端(P<0.05),且0 ℃下2个部位H2O2含量为下降趋势,2 ℃下有些许上升。
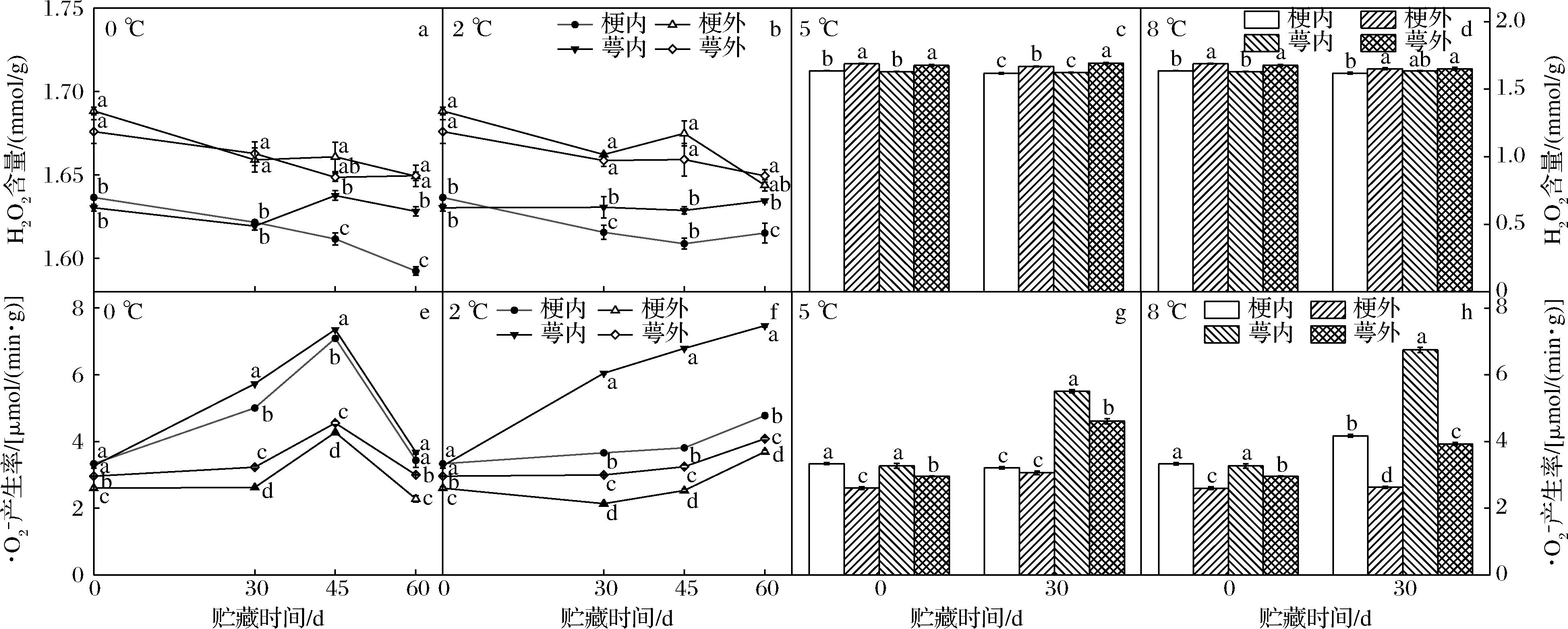
a~d-H2O2含量;e~h-·O2-产生率
图5 贮藏温度对核桃果实青皮不同部位H2O2含量和·O2-产生率的影响
Fig.5 Effect of storage temperatures on H2O2 content and ·O2- production rate in different green husk tissues of walnut fruit
不同贮藏温度核桃果实贮藏期间青皮内部的·O2-产生率显著高于外部(P<0.05),萼端·O2-产生率显著高于梗端(P<0.05)(图5-e~图5-h)。0 ℃核桃果实青皮·O2-产生率在贮藏30~60 d迅速上升后下降,45 d时达到高峰。整个贮藏期2 ℃核桃果实青皮4个部位均呈上升趋势,内部萼端的·O2-产生率极显著高于其他部位,在5、8 ℃贮藏果实同样表现为青皮内部萼端的变化最快。
2.5 贮藏温度对核桃果实冷藏期种仁品质的影响
不同温度贮藏下,核桃种仁可溶性蛋白质含量随贮藏时间的延长呈现先上升后略微下降趋势(表1)。贮藏0~30 d时,种仁中可溶性蛋白质含量随贮藏温度升高而升高,5、8 ℃可溶性蛋白质含量显著高于0、2 ℃(P<0.05);30~60 d时,0、℃下变化趋势相同,均在45 d时达到含量高峰,且0 ℃的可溶性蛋白质含量显著高于2 ℃(P<0.05),之后出现下降趋势,但45、60 d可溶性蛋白质含量无显著差异(P>0.05)。种仁中的粗脂肪含量总体呈现下降趋势(表1),贮藏45~60 d时,以0 ℃贮藏核桃种仁的脂肪含量显著高于2 ℃(P<0.05)。酸价和过氧化值是评价油脂品质优劣的重要指标。不同温度下贮藏,种仁的酸价和过氧化值均呈现上升趋势(表1)。贮藏0~30 d时,种仁酸价变化不明显,0、2、5 ℃之间不存在显著差异(P>0.05),但显著低于8 ℃(P<0.05);30~60 d时,2、0 ℃均持续上升,且2 ℃上升幅度显著大于0 ℃(P<0.05)。种仁过氧化值变化趋势与酸价趋势类似。说明温度越高脂肪变质更快,0 ℃处理更好的保持了油脂品质。
表1 贮藏温度对核桃种仁可溶性蛋白质、粗脂肪含量、AV和PV的影响
Table 1 Effects of storage temperatures on the soluble protein and crude fat contents, AV, and PV in walnut kernels
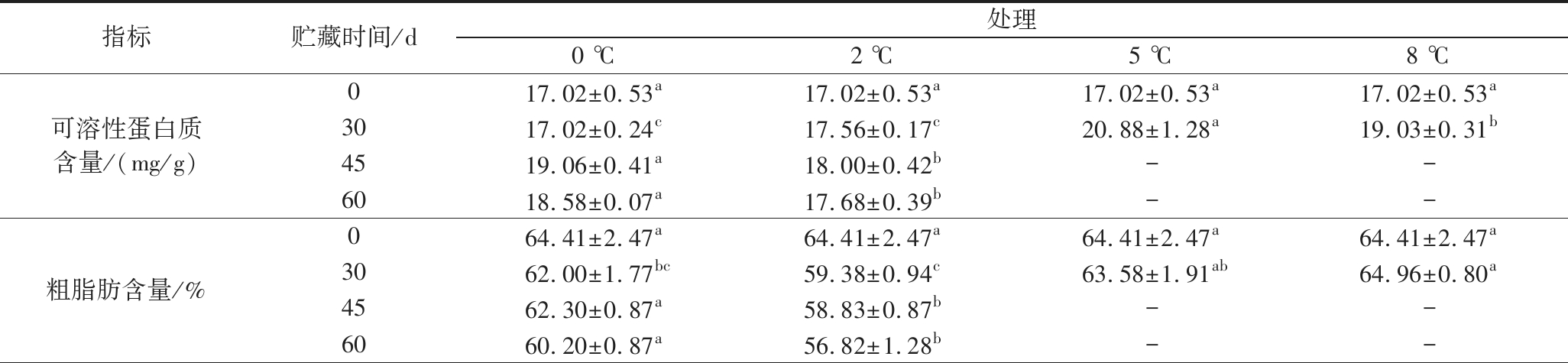
指标贮藏时间/d处理0 ℃2 ℃5 ℃8 ℃可溶性蛋白质含量/(mg/g)017.02±0.53a17.02±0.53a17.02±0.53a17.02±0.53a3017.02±0.24c17.56±0.17c20.88±1.28a19.03±0.31b4519.06±0.41a18.00±0.42b--6018.58±0.07a17.68±0.39b--粗脂肪含量/%064.41±2.47a64.41±2.47a64.41±2.47a64.41±2.47a3062.00±1.77bc59.38±0.94c63.58±1.91ab64.96±0.80a4562.30±0.87a58.83±0.87b--6060.20±0.87a56.82±1.28b--
续表1
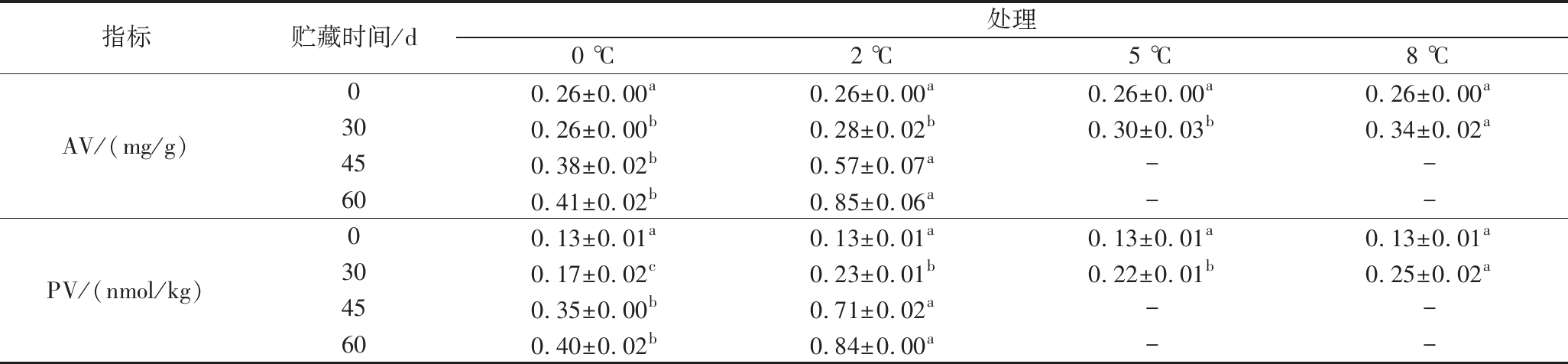
指标贮藏时间/d处理0 ℃2 ℃5 ℃8 ℃AV/(mg/g)00.26±0.00a0.26±0.00a0.26±0.00a0.26±0.00a300.26±0.00b0.28±0.02b0.30±0.03b0.34±0.02a450.38±0.02b0.57±0.07a--600.41±0.02b0.85±0.06a--PV/(nmol/kg)00.13±0.01a0.13±0.01a0.13±0.01a0.13±0.01a300.17±0.02c0.23±0.01b0.22±0.01b0.25±0.02a450.35±0.00b0.71±0.02a--600.40±0.02b0.84±0.00a--
注:表中“-”表示因试验终止未测定。同行的不同字母表示处理间差异显著(P<0.05),相同字母表示处理间差异不显著(P>0.05)。
3 结论与讨论
果实在采后贮藏过程中普遍出现褐变现象。核桃果实的青皮褐变是衡量其采后贮藏品质的重要方面之一。本试验发现,‘清香’核桃果实在0、2、5、8 ℃贮藏时,其青皮褐变程度随着温度的升高而加重,这与在桃子[19]和库尔勒香梨[20]等水果中的研究相似。这可能是由于低温通过延缓了果实的衰老进程维持了其贮藏品质,进而抑制了果实的褐变[21]。0、2 ℃核桃果实贮藏期间,其青皮内部的褐变指数显著高于外部(P<0.05),5、8 ℃贮藏果实却呈现相反的现象,而相关数据尚无法解释这一现象,关于其具体原因有待于进一步研究。
果实的褐变可能是果实遭受冷害时的一种外在表现。可溶性糖是水果中主要的能量来源,在维持细胞结构和抗寒性方面发挥重要作用[22]。核桃果实在不同温度贮藏期间,其青皮的可溶性总糖含量均呈现持续下降趋势,以2 ℃条件的下降幅度大于0 ℃,且其褐变程度高于后者(图3-a~图3-d)。SU等[23]发现,荔枝果实的褐变程度越轻,其可溶性糖含量更高。脯氨酸是一种有效的非酶抗氧化剂,被认为可以清除ROS,抑制脂质过氧化[24];果实受到低温胁迫时脯氨酸会积累[25]。本试验发现,核桃果实在8 ℃贮藏30 d时,其青皮的游离脯氨酸含量显著高于其他温度(图3-e~图3-h),同时0 ℃条件下果实青皮的MDA含量低于其他温度(图3-i~图3-l),说明核桃果实采后青皮褐变应该不是由于冷害所致。
果实采后贮藏期间的褐变通常是由于细胞中的酚类物质与氧化酶如PPO、POD接触,酚类物质氧化产生的褐色物质所致[26-27]。果实不同部位褐变程度的差异可能与相关酶活性不同有关[28]。苹果果实中不同部位褐变程度不同,其PPO活性也不同[9]。本研究中,核桃果实青皮萼端的褐变程度高于梗端,且二者的PPO活性存在差异。贮藏期间,0、2 ℃核桃果实青皮外部的PPO活性和总酚含量均高于内部,然而青皮内部褐变指数却高于外部,可能是因为青皮内部褐变较为严重,导致总酚含量下降与褐变产物的积累,进而抑制PPO活性[29]。此外,不同贮藏温度核桃果实青皮外部梗端的PPO活性均呈现先升高后下降趋势,2 ℃比0 ℃的活性高峰出现的早且高(图4-e~图4-h),可能是由于0 ℃低温通过抑制PPO活性和高峰出现抑制了酶促反应,进而延缓了褐变的发生[30]。POD利用活性氧催化果蔬中酚类物质的氧化,导致褐变的发生[31]。0 ℃和2 ℃贮藏核桃果实青皮内部的褐变与外部相比较为严重,然而其POD活性却显著低于外部(P<0.05),且POD活性与褐变指数之间无显著相关性,表明POD可能不是核桃果实青皮褐变的关键酶。
正常细胞的氧化酶和酚类物质存在区域化分布现象,当细胞膜完整性受损时两者才会发生反应引起褐变产生[26]。细胞中ROS生成量的增加,引发脂质过氧化现象发生,因而导致膜的完整性丧失与MDA含量的积累[27]。本研究发现,0、2 ℃贮藏核桃果实的青皮萼端内部褐变较为严重,·O2-产生率大,MDA含量高,H2O2含量在果实青皮内部同样表现为萼端含量显著高于梗端,这可能是由于萼端衰老程度高,ROS和MDA积累量多,细胞膜损坏程度更大,使得更多的酚类物质和褐变相关酶接触,进而引起核桃果实青皮萼端的褐变程度更高。
粗脂肪和蛋白质是核桃种仁中重要的营养物质,油脂AV、PV可反映核桃油脂氧化程度,从而反映核桃油脂的品质[3,12]。本研究发现,0 ℃相比于2、5、8 ℃贮藏条件而言,核桃果实除青皮褐变程度最轻外,显著延缓了种仁中脂肪的降解,其可溶性蛋白质含量相对更高,AV和PV上升更慢(表1),能够更好地保持其外观、营养和油脂品质,为其最适贮藏温度。这可能由于0 ℃低温通过延缓核桃果实青皮褐变,为其内部种仁提供了更新鲜的果壳,进而使其油脂酸败和氧化更为缓慢。
综上所述,核桃果实在0 ℃和2 ℃贮藏期为60 d,5、8 ℃贮藏期不足30 d,以0 ℃更好地维持了核桃果实的外观品质,抑制了青皮的褐变,同时延缓了种仁酸败,维持了较好的种仁品质,为保持核桃果实品质的适宜贮藏温度。0、2 ℃核桃果实青皮内部的褐变指数高于外部,5、8 ℃果实青皮内部的褐变指数则低于外部;4种温度下果实青皮外部的POD、PPO活性、总酚含量和H2O2含量均高于内部,但·O2-产生率和MDA含量均低于内部;各温度下青皮萼端的褐变指数、·O2-产生率、可溶性总糖和游离脯氨酸含量均高于梗端,而POD、PPO活性和H2O2含量则无明显规律。核桃果实青皮萼端的褐变指数高于梗端,萼端ROS积累过量,破坏了细胞膜的完整性,导致氧化酶与其酚类底物发生反应引起褐变,进一步导致萼端褐变程度更高。
[1] 马艳萍, 马惠玲, 刘兴华, 等.鲜食核桃和干核桃贮藏生理及营养品质变化比较[J].食品与发酵工业, 2011, 37(3):235-238.
MA Y P, MA H L, LIU X H, et al.Comparison of physiology and nutrition in dry and fresh walnut during the storage[J].Food and Fermentation Industries, 2011, 37(3):235-238.
[2] MA Y P, LI P, WATKINS C B, et al.Chlorine dioxide and sodium diacetate treatments in controlled atmospheres retard mold incidence and maintain quality of fresh walnuts during cold storage[J].Postharvest Biology and Technology, 2020, 161:111063.
[3] WANG J, LIANG S J, MA H L, et al.Effects of ethephon on fresh In-husk walnut preservation and its possible relationship with phenol metabolism[J].Journal of Food Science, 2016, 81(8):C1921-C1927.
[4] FAN M C, LI W X, HU X L, et al.Effect of micro-vacuum storage on active oxygen metabolism, internal browning and related enzyme activities in Laiyang pear (Pyrus bretschneideri Reld)[J].LWT - Food Science and Technology, 2016, 72:467-474.
[5] LI D, CHENG Y D, DONG Y, et al.Effects of low temperature conditioning on fruit quality and peel browning spot in ‘Huangguan’ pears during cold storage[J].Postharvest Biology and Technology, 2017, 131:68-73.
[6] ZHAO H D, WANG B G, CUI K B, et al.Improving postharvest quality and antioxidant capacity of sweet cherry fruit by storage at near-freezing temperature[J].Scientia Horticulturae, 2019, 246:68-78.
[7] YUAN X, HUANG S, MA H L, et al.Differential responses of walnut cultivars to cold storage and their correlation with postharvest physiological parameters[J].Horticulture, Environment, and Biotechnology, 2019, 60(3):345-356.
[8] CHEN S W, HSU M C, FANG H H, et al.Effect of harvest season, maturity and storage temperature on storability of carambola ‘Honglong’ fruit[J].Scientia Horticulturae, 2017, 220:42-51.
[9] MA Y P, LU X G, NOCK J F, et al.Peroxidase and polyphenoloxidase activities in relation to flesh browning of stem-end and calyx-end tissues of ‘Empire’ apples during controlled atmosphere storage[J].Postharvest Biology and Technology, 2015, 108:1-7.
[10] GAO H, ZHANG Z K, LV X G, et al.Effect of 24-epibrassinolide on chilling injury of peach fruit in relation to phenolic and proline metabolisms[J].Postharvest Biology and Technology, 2016, 111:390-397.
[11] LIN Y F, LIN Y X, LIN H T, et al.Inhibitory effects of propyl gallate on browning and its relationship to active oxygen metabolism in pericarp of harvested Longan fruit[J].LWT-Food Science and Technology, 2015, 60(2):1122-1128.
[12] MA Y P, LU X G, LIU X H, et al.Effect of 60Co γ-irradiation doses on nutrients and sensory quality of fresh walnuts during storage[J].Postharvest Biology and Technology, 2013, 84:36-42.
[13] 郭园园, 鲁晓翔, 李江阔, 等.不同贮藏温度对青皮核桃保鲜的影响[J].食品工业科技, 2013, 34(16):308-312.
GUO Y Y, LU X X, LI J K, et al.Effect of different storage temperature on the freshness retaining of green juglans[J].Science and Technology of Food Industry, 2013, 34(16):308-312.
[14] 弓弼, 蒋柳庆, 马惠玲.早实核桃3个品种青皮果实鲜贮特性比较[J].食品科学, 2016, 37(2):250-255.
GONG B, JIANG L Q, MA H L.Comparative storability of green walnut fruits of three early-fruiting varieties[J].Food Science, 2016, 37(2):250-255.
[15] SULTANOVA N, BAYRAMOVA N, ALIYEVA D R, et al.Induced changes in metabolic constituents of grapevine (Vitis vinifera L.) leaves infected with grapevine leafroll-associated virus-3[J].Physiological and Molecular Plant Pathology, 2019, 106:57-63.
[16] CHEN H J, GAO H Y, FANG X J, et al.Effects of allyl isothiocyanate treatment on postharvest quality and the activities of antioxidant enzymes of mulberry fruit[J].Postharvest Biology and Technology, 2015, 108:61-67.
[17] CHEN L Y, CHENG C W, LIANG J Y.Effect of esterification condensation on the Folin-Ciocalteu method for the quantitative measurement of total phenols[J].Food Chemistry, 2015, 170:10-15.
[18] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2017:116-118.
CAO J K, JIANG W B, ZHAO Y M.Experiment Guidance of Postharvest Physiology and Biochemistry of Fruits and Vegetables[M].Beijing:China Light Industry Press, 2017:116-118.
[19] LIU H, JIANG W B, CAO J K, et al.Effect of chilling temperatures on physiological properties, phenolic metabolism and antioxidant level accompanying pulp browning of peach during cold storage[J].Scientia Horticulturae, 2019, 255:175-182.
[20] JIA X H, WANG W H, DU Y M, et al.Optimal storage temperature and 1-MCP treatment combinations for different marketing times of Korla Xiang pears[J].Journal of Integrative Agriculture, 2018, 17(3):693-703.
[21] 王志华, 贾朝爽, 王文辉, 等.低温贮藏对‘金红’苹果能量代谢和品质的影响[J].园艺学报, 2020, 47(12):2277-2289.
WANG Z H, JIA C S, WANG W H, et al.Effects of low temperature storage on energy metabolism, related physiology and quality in ‘Jinhong’ apple fruit[J].Acta Horticulturae Sinica, 2020, 47(12):2277-2289.
[22] WANG J W, DONG S Z, JIANG Y G, et al.Influence of long-term cold storage on phenylpropanoid and soluble sugar metabolisms accompanied with peel browning of ‘Nanguo’ pears during subsequent shelf life[J].Scientia Horticulturae, 2020, 260:108888.
[23] SU Z H, HU M J, GAO Z Y, et al.Apple polyphenols delay senescence and maintain edible quality in litchi fruit during storage[J].Postharvest Biology and Technology, 2019, 157:110976.
[24] MEHTA S K, GAUR J P.Heavy-metal-induced proline accumulation and its role in ameliorating metal toxicity in Chlorella vulgaris[J].New Phytologist, 1999, 143(2):253-259.
[25] CAO S F, CAI Y T, YANG Z F, et al.MeJA induces chilling tolerance in loquat fruit by regulating proline and γ-aminobutyric acid contents[J].Food Chemistry, 2012, 133(4):1466-1470.
[26] ZHANG D D, XU X F, ZHANG Z K, et al.6-Benzylaminopurine improves the quality of harvested litchi fruit[J].Postharvest Biology and Technology, 2018, 143:137-142.
[27] SHAH H M S, KHAN A S, ALI S.Pre-storage kojic acid application delays pericarp browning and maintains antioxidant activities of litchi fruit[J].Postharvest Biology and Technology, 2017, 132:154-161.
[28] GAO L, YUAN Y, LI Y C, et al.Study on polyphenol oxidase activity in different parts of purple sweet potato[J].Advanced Materials Research, 2014, 898:149-152.
[29] 齐笑笑, 秦改花.石榴采后果皮褐变影响因子的研究[J].果树学报, 2017, 34(6):735-743.
QI X X, QIN G H.Study on the factors influencing postharvest browning of the pomegranate peel[J].Journal of Fruit Science, 2017, 34(6):735-743.
[30] HONG K Q, XU H B, WANG J N, et al.Quality changes and internal browning developments of summer pineapple fruit during storage at different temperatures[J].Scientia Horticulturae, 2013, 151:68-74.
[31] 齐笑笑. 果蔬采后酶促褐变机理及控制方法研究进展[J].北方园艺, 2017(11):190-194.
QI X X.Research advance in enzymatic browning and inhibition method of postharvest of fruits and vegetables[J].Northern Horticulture, 2017(11):190-194.