天然多糖通常由10个及以上的单糖分子通过糖苷键连接而成,是生物体维持正常生命活动必不可少的高分子化合物[1]。现有肿瘤治疗药物的成本和安全性依旧不理想,临床上肿瘤的治疗仍需开发新药物[2]。食用菌多糖巨大的抗癌潜力使其成为抗肿瘤药物开发的重要方向。云芝多糖、香菇多糖以及茯苓多糖等临床上已被用于抗肿瘤治疗及辅助治疗,其中香菇多糖注射液与吉非替尼可协同治疗非小细胞肺癌且无明显不良反应[3]。FOLEY等[4]建立S180肿瘤细胞株并成功在体外连续传代后,S180肿瘤细胞株与S180荷瘤小鼠已成为探究多糖作为新型抗肿瘤药物前景及其抗肿瘤机制研究的常用模型。CHIHARA等[5]证实了香菇多糖对小鼠S180肿瘤具有抑制作用。姜爽等[6]发现山慈菇多糖通过提高免疫能力发挥其抗S180肿瘤作用;季宇彬等[7]发现芦笋多糖对S180肿瘤的抑制作用与红细胞膜离子通道有关;刘燕琳等[8]发现桑黄多糖通过影响S180荷瘤小鼠的PTEN与C-myc基因表达水平发挥其抑瘤作用。
口蘑属为真菌门、担子菌亚门、层菌纲、无隔担子菌亚纲、伞菌目、口蘑科的一属。研究发现口蘑属多糖具有免疫调节、抗肿瘤和抗氧化等生理活性,灰褐纹口蘑能显著促进B、T淋巴细胞以及巨噬细胞RAW 264.7增殖,诱导细胞分泌肿瘤坏死因子-α[9];松口蘑多糖显著抑制人肝癌细胞HepG2和人非小细胞肺癌细胞A549增殖[10];杨树口蘑多糖能较好清除DPPH自由基、超氧阴离子自由基(·O2-)和羟自由基(·OH)[11]。
草黄口蘑[Tricholoma lascivum(Fr.)Gillet]是隶属于口蘑属的名贵食用菌,属树木外生菌根菌。目前四川小金县的野生草黄口蘑多糖的结构、生物活性及其分子机制尚未见报道。本研究以草黄口蘑子实体为原材料,经热水浸提法分离纯化后得到草黄口蘑多糖[Tricholoma lascivum (Fr.) Gillet polysaccharide,TLG-1],利用凝胶渗透色谱(gel permeation chromatography,GPC)、HPLC及核磁共振氢谱(1H-nuclear magnetic resonance spectroscopy,1H-NMR)技术对TLG-1的结构进行初步解析,构建S180荷瘤小鼠模型探究其体内抗肿瘤活性,并采用转录组测序技术(RNA sequencing,RNA-seq)技术对S180肿瘤组织总RNA进行生物信息学分析,探讨草黄口蘑多糖抗小鼠S180肿瘤机制,拟为草黄口蘑多糖的开发和利用提供一定的理论基础。
1 材料与方法
1.1 材料与设备
草黄口蘑采自四川省阿坝藏族自治州小金县;TLG-1经草黄口蘑子实体分离纯化所得;昆明小鼠(SPF级,符合西华师范大学伦理审查委员会的要求),南充市川北医学院动物实验中心;小鼠肉瘤细胞S180,上海细胞生物所;DEAE-52纤维素(S14024),山东戈麦斯化工有限公司公司;重水(分析纯),上海麦克林生化科技有限公司;透析袋(7 000 Da),Biosharp公司;三氟乙酸(LK60S11,色谱级)、乙腈(34851,分析纯),Sigma公司;鼠李糖、木糖、阿拉伯糖、甘露糖、葡萄糖及半乳糖(分析纯),成都曼思特生物科技有限公司。
ST40高速离心机,Eppendorf公司;WBK-3B电热恒温水浴锅,Thermo Fisher公司;KE-6000旋转蒸发仪,上海亚荣生化仪器厂;CTFD-10PT冷冻干燥机,南京赛飞生物科技有限公司;Spring-K40超纯水仪,重庆艾科浦公司;Power Pac HC基础电泳仪,Bio-Rad公司;DHG-9140A电热鼓风干燥箱,BIOBASE公司;300 Bruker DRX-600超导核磁共振仪,Bruker公司;1260 高效液相色谱仪,Agilent 公司。
1.2 实验方法
1.2.1 TLG-1的制备
干燥后的草黄口蘑子实体粉碎并过筛,加入纯水于100 ℃下水浴6 h,离心收集上清液。重复上述操作2次,上清液浓缩后加入4倍体积无水乙醇,收集沉淀并干燥。采用Sevag法除蛋白,再次干燥后即可得草黄口蘑粗多糖。复溶粗多糖,以纯水为流动相经DEAE-52纤维素色谱柱反复纯化,所得洗脱液浓缩、透析和冻干后,得到TLG-1。
1.2.2 TLG-1的GPC的测定
10 mg TLG-1溶于3 mL纯水中,过滤后采用GPC测定多糖的重均分子质量(weight-average molecular weight,Mw),并计算多分散系数。
1.2.3 TLG-1的HPLC的测定
20 mg TLG-1溶于2.5 mol/L的三氟乙酸(trifluoroacetic acid,TFA)溶液并封瓶,100 ℃水浴6 h,12 000 r/min 离心10 min 取上清液,TFA挥发除尽并干燥后得到TLG-1全水解产物。TLG-1全水解产物和单糖标准品分别溶于75%乙腈,以75%乙腈为流动相,进行HPLC 检测。
1.2.4 TLG-1的1H-NMR的测定
10 mg TLG-1溶于600 μL D2O,12 000 r/min离心10 min,取上清液置于核磁管中,检测1H-NMR信号。
1.2.5 S180荷瘤小鼠模型构建
无菌条件下将S180细胞接种于健康小鼠腹腔,7 d后,抽取小鼠腹水,生理盐水稀释至细胞数目为3×106个/mL的S180细胞悬液。分别给15只健康小鼠注射100 μL S180细胞悬液,饲养24 h。小鼠随机均分为3组,分别为空白对照组(control组),甘露聚糖肽阳性对照组(Man组),草黄口蘑多糖实验组(TLG-1组)。以20 mg/kg的剂量标准,采取灌胃方式给药8 d,注射体积均为100 μL。处死小鼠后快速剥离并称重其肿瘤组织以及肝、脾、胸腺。计算抑瘤率(p1)方法如公式(1)所示:
(1)
式中:p1,抑瘤率,%;A1,control组的平均瘤重,g;A2,Man组或TLG-1组的平均瘤重,g。
1.2.6 S180肿瘤组织总RNA提取、质检及测序
利用Trizol试剂提取3组S180肿瘤组织总RNA。1%琼脂糖凝胶电泳初步检测RNA有无DNA污染,NanoDrop检测RNA纯度,使用Agilent 2100检测28S/18S片段,并采取混样方式消除组间个体差异。由北京诺禾致源生物信息科技有限公司参照Illumina TraseqTM RNA文库制备试剂盒对S180肿瘤组织总RNA进行cDNA文库构建,库检合格后进行高通量测序。
1.3 生物信息学分析
去除测序后原始数据中含N、低质量和带有接头的序列后,检查测序错误率以及GC含量分布,最终获得高质量的分析数据。皮尔逊相关系数R2作为样本间相关性的评价指标。用subread软件对基因和转录组表达水平进行分析,校正后得到基因表达值FPKM。使用软件DESeq2对基因进行差异性表达分析,采用Cluster Profiler软件(P<0.05)对其进行基因本体(gene ontology,GO)富集分析,依据注释结果和官方分类进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。
1.4 统计学分析
对所有数据均利用SPSS软件进行单因素方差分析,体外活性数据采用t检验和Tukey检验进行处理;转录组数据采用最小显著性差异法进行分析,所得数据符合正态分布。P<0.05表示组间有显著差异,以*表示;P<0.01表示组间有极显著差异,以**表示。
2 结果与分析
2.1 TLG-1的分子质量
GPC结果(图1)显示,TLG-1在14.225~17.133 min处呈现单一对称的洗脱峰,15.548 min达到顶峰,Mw为13 442 Da,多分散系数为1.588 84。不同口蘑属多糖分子质量相差较大,其中松口蘑多糖的分子质量为72.14 kDa[12],而金福菇多糖的分子质量仅为4.10 kDa[13]。过高的分子质量会在一定程度上影响多糖溶解度,不利于多糖与膜内受体结合,分子质量过小则难以形成活性聚合物结构。一般认为,多糖分子质量在10~500 kDa能保持最大生物活性[14]。TLG-1的分子质量为13.44 kDa,满足保持最大生物活性的必需分子质量。
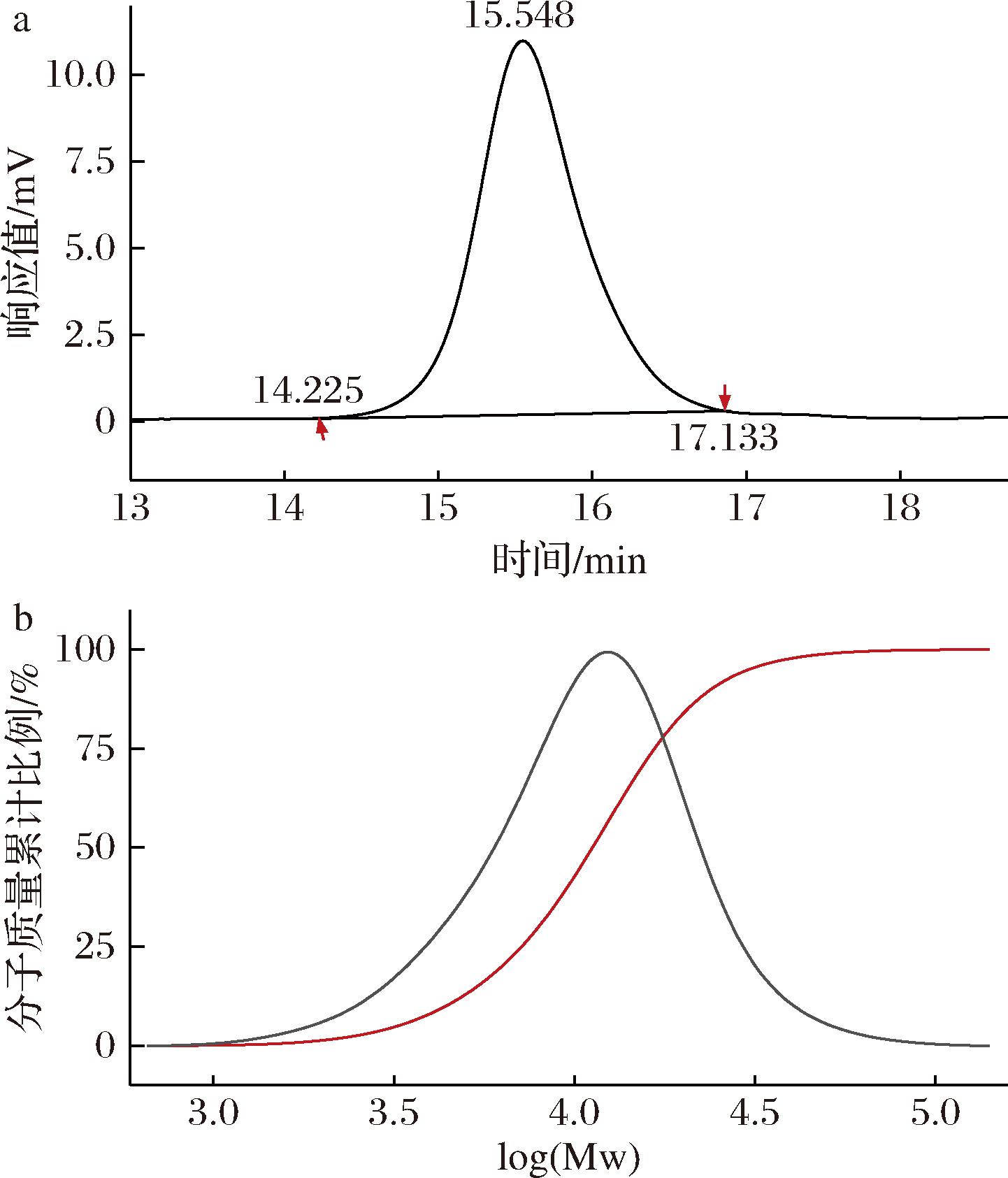
a-色谱图;b-分子质量分布曲线
图1 TLG-1的凝胶渗透色谱
Fig.1 GPC of TLG-1
2.2 TLG-1的单糖组成
采用HPLC法分析TLG-1的单糖组成及其比例。与单糖标准品的保留时间比对,结果显示,5.180 min处为木糖(xylose,Xyl),6.655 min处为甘露糖(mannose,Man),6.950 min处为葡萄糖(glucose,Glc),7.495 min处为半乳糖(galactose,Gal)。各水解单糖的峰面积显示TLG-1中Xyl、Man、Glc和Gal 含量比为1.57∶1.45∶2.84∶4.14(表1,图2)。Glc和Gal是口蘑属多糖的单糖组分中常见的两种单糖。如马尔康松口蘑多糖主要由Glc和Gal组成,其比例为7∶2[15]。不同提取方法得到的5种蒙古口蘑多糖均主要由Glc、Man和Gal 3种单糖组成,其中Glc的含量均高于50%,Gal的含量为9.00%~21.00%[16]。TLG-1的单糖组分显示含量最高的两种单糖亦为Glc(28.39%)和Gal(41.41%)。
表1 TLG-1的单糖组成分析
Table 1 Monosaccharide composition analysis of TLG-1
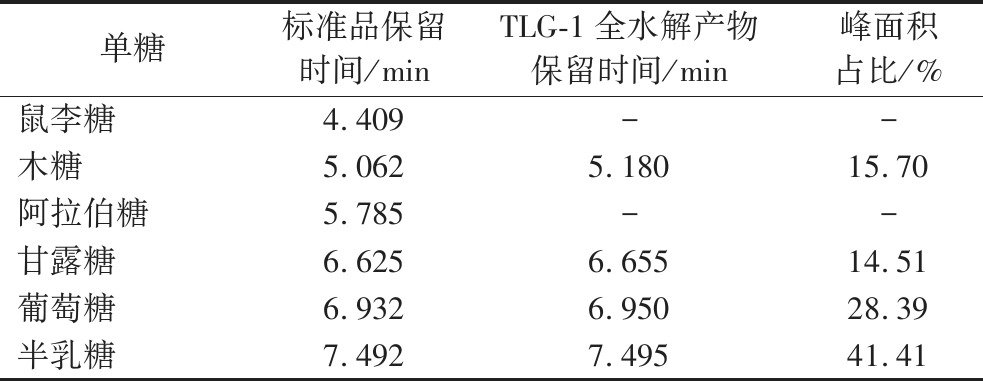
单糖标准品保留时间/minTLG-1全水解产物保留时间/min峰面积占比/%鼠李糖4.409--木糖5.0625.18015.70阿拉伯糖5.785--甘露糖6.6256.65514.51葡萄糖6.9326.95028.39半乳糖7.4927.49541.41
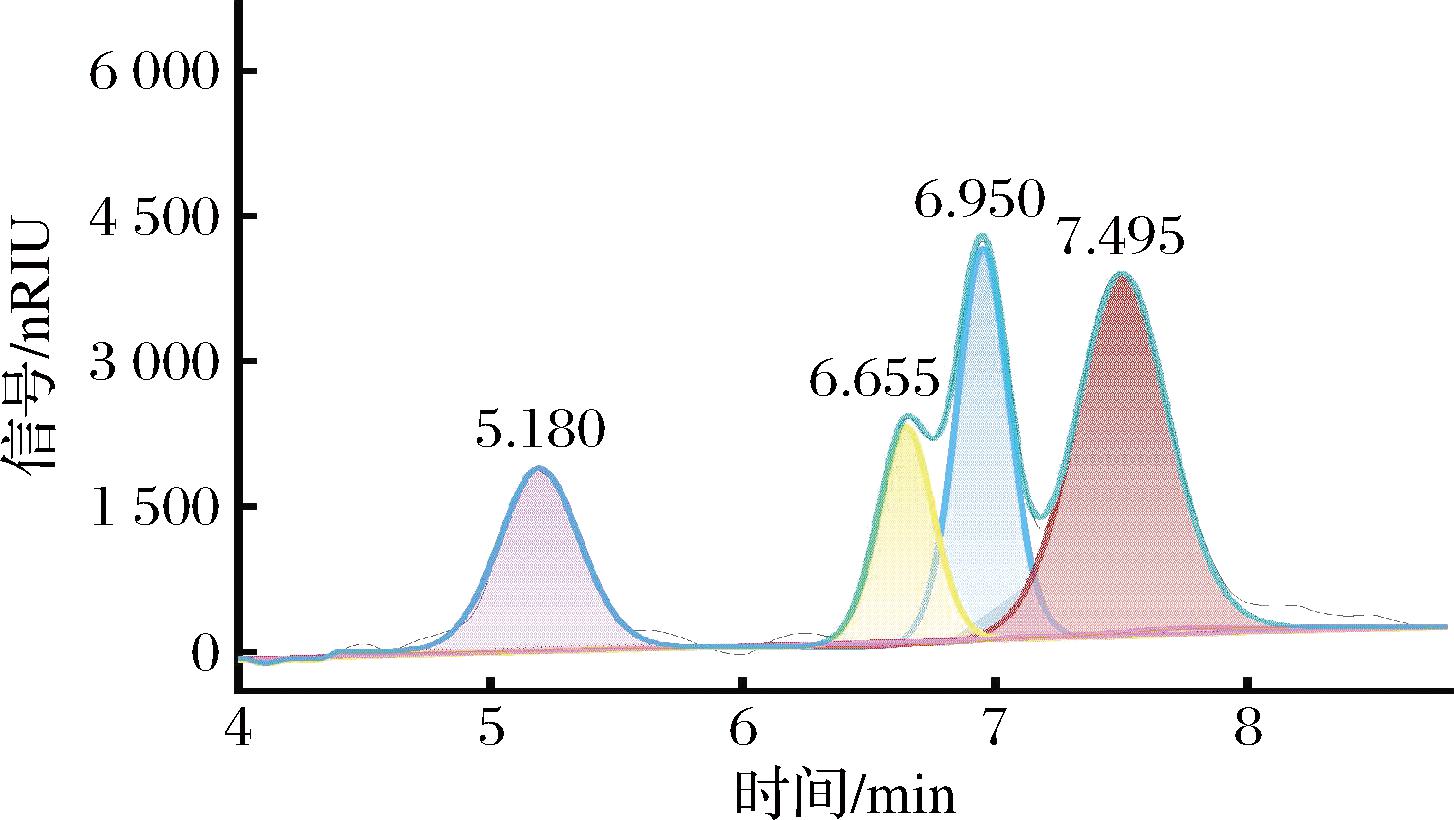
图2 TLG-1的高效液相色谱图
Fig.2 HPLC of TLG-1
2.3 TLG-1的1H-NMR
多糖的1H-NMR图谱由异头质子区(δ 4.30~5.90)和环质子区(δ 3.00~4.20)组成。TLG-1的1H-NMR谱数据结果(图3)显示,异头质子区范围内共有3个共振信号峰,化学位移分别为5.05、5.00、4.93。TLG-1单糖糖环上C2~C6的氢原子信号位于环质子区内。1H-NMR谱提示TLG-1至少含有3种处于不同化学环境的单糖残基[17]。

图3 TLG-1的1H-NMR图谱
Fig.3 The 1H-NMR spectra of TLG-1
2.4 TLG-1对小鼠S180肿瘤生长的抑制作用
TLG-1体内抑制小鼠S180肿瘤实验结果显示,在相同喂养条件下,control组、Man组和TLG-1组小鼠的S180肿瘤组织的平均重量分别为(0.96±0.18)g、(0.45±0.14)g以及(0.46±0.18)g。与control组对比发现,Man组和TLG-1组均显著抑制S180肿瘤的生长(P<0.01),抑瘤率分别为59.00%和53.80%。且给药期间,3组小鼠的肝、脾及胸腺指数均无显著变化,提示TLG-1能抑制S180肿瘤生长且无明显毒副作用(表2,图4)。
表2 TLG-1体内抑制小鼠S180肿瘤生长的效果
Table 2 Inhibitory effect of TLG-1 on tumor of S180 mice in vivo
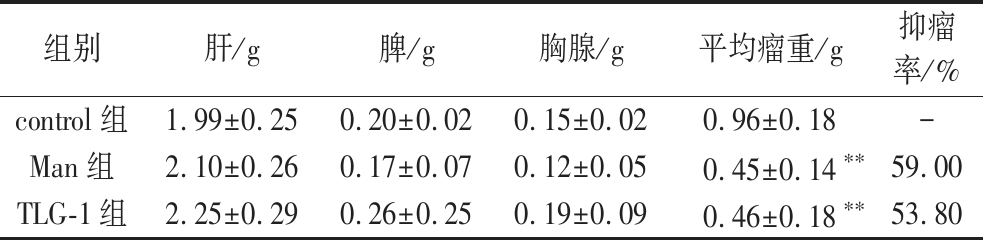
组别肝/g脾/g胸腺/g平均瘤重/g抑瘤率/%control组1.99±0.250.20±0.020.15±0.020.96±0.18-Man组2.10±0.260.17±0.070.12±0.050.45±0.14∗∗59.00TLG-1组2.25±0.290.26±0.250.19±0.090.46±0.18∗∗53.80
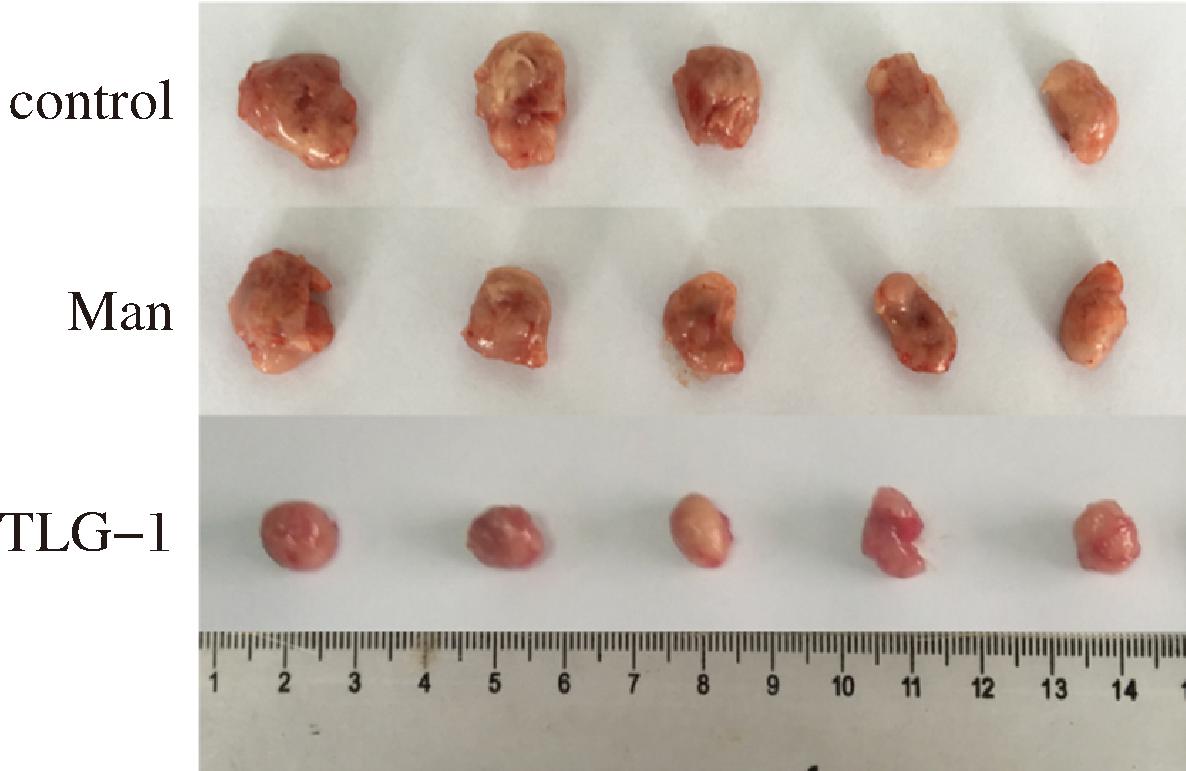
图4 各组小鼠S180肿瘤情况
Fig.4 S180 tumors of in each group
2.5 转录组测序数据质控结果
转录组测序后获得的原始数据经过滤处理后,control组、Man组和TLG-1组获得高质量分析数据的碱基总量分别为8.97 G、8.35 G和8.07 G。3组样品的Q20值均超过97.00%,Q30值在93.00%以上,GC含量不低于50.00%,测序错误率未超过0.03%,该结果提示转录组测序数据可靠,可进行后续分析研究(表3)。
表3 样品组转录组测序数据质量统计结果
Table 3 Quality assessment for sequencing data of transcriptome

样品原始数据/条分析数据/条分析数据总量/G错误率/%Q20/%Q30/%GC含量control组60 694 62059 771 5008.970.0397.6793.6350.78Man组56 592 57855 699 1728.350.0397.5793.4451.68TLG-1组55 183 25053 781 3568.070.0397.6993.7151.08
2.6 基因表达水平分析
采用皮尔逊相关系数R2来衡量样本组间基因表达水平相关性,结果显示(图5),TLG-1组与control组、Man 组的相关性R2值均大于0.95,但Man组与TLG-1组的相关性R2值较高,提示两组的变化趋势相似;而TLG-1组与control组的基因表达水平相关性较低,提示两组的差异基因较多。

图5 样本组间的皮尔逊相关性分析
Fig.5 Pearson correlation between groups
使用软件RSEM定量分析基因表达水平,FPKM<0.3、FPKM>1和FPKM>60分别表示基因表达水平低或不表达、有表达和高表达。结果表明,control组、Man组以及TLG-1组中有表达(FPKM>1)的基因分别有12 203、12 240和12 672个,占基因总数的23.18%、23.25%和24.07%;高表达(FPKM>60)的基因分别有1 052、1 028和1 006个,占基因总数的2.00%、1.95%和1.91%。
进一步分析3个组中极高表达(FPKM>2 200)的基因(表4),结果显示,mt-Co1、Rplp1、Eef1a1、Rpl36和Lgals1在,3组中均极高表达,其中mt-Co1在control组、TLG-1 组和Man组中均为FPKM值最高的基因,FPKM值分别为5 108.05、6 385.18和6 760.32。mt-Co1编码的细胞色素c氧化酶I(mitochondrially encoded cytochrome c oxidase I,MT-CO1)位于线粒体内膜,是复合物IV(complex IV)的重要组成部分,催化电子从细胞色素c转移到氧分子,参与线粒体膜ATP的合成[18],肿瘤细胞通过癌基因的激活促进代谢的重编程,导致高水平的糖酵解来代替由线粒体膜融合介导的氧化磷酸化[19]。在TLG-1组和Man 组中,mt-Co1的FPKM值高于control组,提示TLG-1能通过抑制癌基因的激活来降低肿瘤细胞糖酵解能力,抑制肿瘤生长。
表4 极高表达的基因(FPKM>2 200)
Table 4 Quantification of gene expression
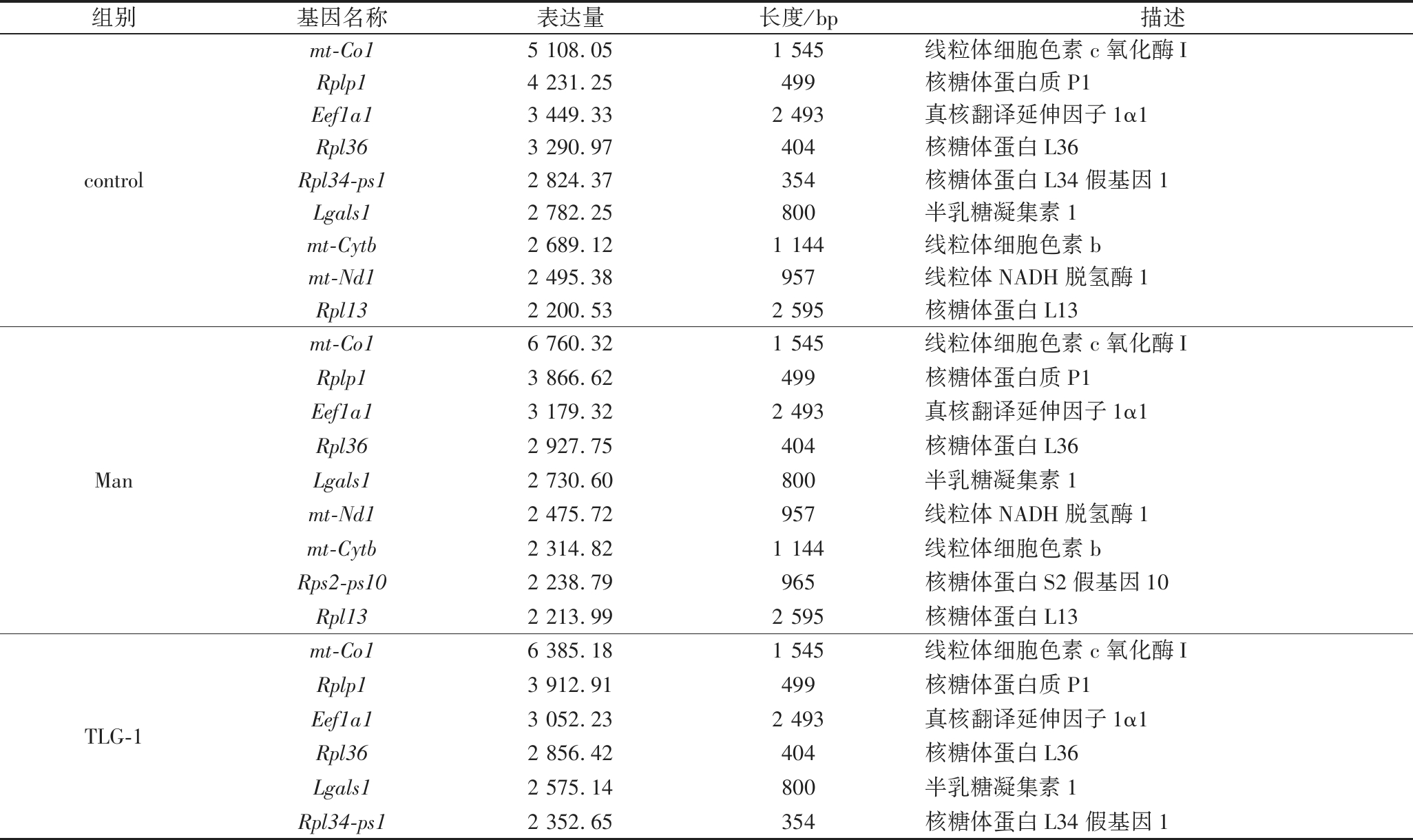
组别基因名称表达量长度/bp描述controlmt-Co15 108.051 545线粒体细胞色素c氧化酶IRplp14 231.25499核糖体蛋白质P1Eef1a13 449.332 493真核翻译延伸因子1α1Rpl363 290.97404核糖体蛋白L36Rpl34-ps12 824.37354核糖体蛋白L34假基因1Lgals12 782.25800半乳糖凝集素1mt-Cytb2 689.121 144线粒体细胞色素bmt-Nd12 495.38957线粒体NADH脱氢酶1Rpl132 200.532 595核糖体蛋白L13Manmt-Co16 760.321 545线粒体细胞色素c氧化酶IRplp13 866.62499核糖体蛋白质P1Eef1a13 179.322 493真核翻译延伸因子1α1Rpl362 927.75404核糖体蛋白L36Lgals12 730.60800半乳糖凝集素1mt-Nd12 475.72957线粒体NADH脱氢酶1mt-Cytb2 314.821 144线粒体细胞色素bRps2-ps102 238.79965核糖体蛋白S2假基因10Rpl132 213.992 595核糖体蛋白L13TLG-1mt-Co16 385.181 545线粒体细胞色素c氧化酶IRplp13 912.91499核糖体蛋白质P1Eef1a13 052.232 493真核翻译延伸因子1α1Rpl362 856.42404核糖体蛋白L36Lgals12 575.14800半乳糖凝集素1Rpl34-ps12 352.65354核糖体蛋白L34假基因1
Rplp1编码的核糖体蛋白质P1(acidic ribosomal phosphoprotein P1,RPLP1)属于60S核糖体亚基,可募集翻译因子到核糖体中,参与翻译的延伸阶段,促进蛋白质合成。在control组、TLG-1组及Man组中其FPKM值分别为4 231.25、3 912.91及3 866.62,说明TLG-1可下调Rplp1。Rplp1的下调会导致N-钙黏蛋白(N-cadherin,CDH2)的表达降低,而E-钙黏蛋白(E-cadherin,E-Cad)和紧密连接跨膜蛋白的表达则会增加[20]。提示TLG-1可通过抑制上皮间充质转化(epithelial-mesenchymal transition,EMT)过程并降低细胞运动,从而影响肿瘤细胞的迁移和侵袭能力。
Lgals1编码的半乳糖凝集素1(recombinant human galectin-1,LGALS1)是一种β-半乳糖苷结合蛋白,可识别显示在细胞表面和细胞外基质上的糖缀合物。LGALS1与整合素相互作用后,可磷酸化p38 MAPK,激活丝氨酸68上的扭曲家族bHLH转录因子1(twist family BHLH transcription factor 1,TWIST1),从而增加基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)和EMT调节转录因子的表达[21]。Lgals1的FPKM值在control组、TLG-1组及Man组中分别为2 782.25、2 575.14和2 730.60。TLG-1组的FPKM值低于control组和Man 组,表明TLG-1可下调Lgals1,提示TLG-1可能通过抑制p38 MAPK传导的EMT过程来调控肿瘤的浸润和转移。
Eef1a1编码的真核翻译延伸因子1α1(eukaryotic translation elongation factor 1 alpha 1,eEF1A1)在蛋白质合成中参与氨酰基-tRNA与核糖体结合的过程。在control组、TLG-1组及Man组中FPKM值分别为3 449.33、3 052.23和3 179.32。eEF1A1可调控信号转导与转录激活因子1(signal transducer and activator of transcription 1,STAT1)的表达,STAT1可与细胞周期蛋白D1(cyclin D1,CCND1)启动子中的C元件结合,从而增加CCND1的表达量,促进细胞周期从G1期进展到S期[22]。本实验中TLG-1和Man均能下调Eef1a1,提示TLG-1可通过阻滞肿瘤细胞周期的G1/S期进展来调节肿瘤细胞的增殖。
以上表明,TLG-1可上调mt-Co1,下调Rplp1、Eef1a1及Lgals1等基因来调节肿瘤的发展和转移,包括mt-Co1调控线粒体膜介导的氧化磷酸化,Rplp1和Lgals1调控EMT过程,Eef1a1调控细胞周期进展,共同调控S180肿瘤细胞的增殖。
2.7 差异表达基因(differentially expressed genes,DEGs)分析
Man组、TLG-1组分别与control组进行DEGs分析,显著差异表达的标准设定为Padj<0.05、|log2FoldChange|>0(图6)。分析结果为:与control组相比,Man组存在差异表达基因510个,包括252个上调基因、258个下调基因;TLG-1组存在960个差异表达基因,其中735个基因上调、225个基因下调。
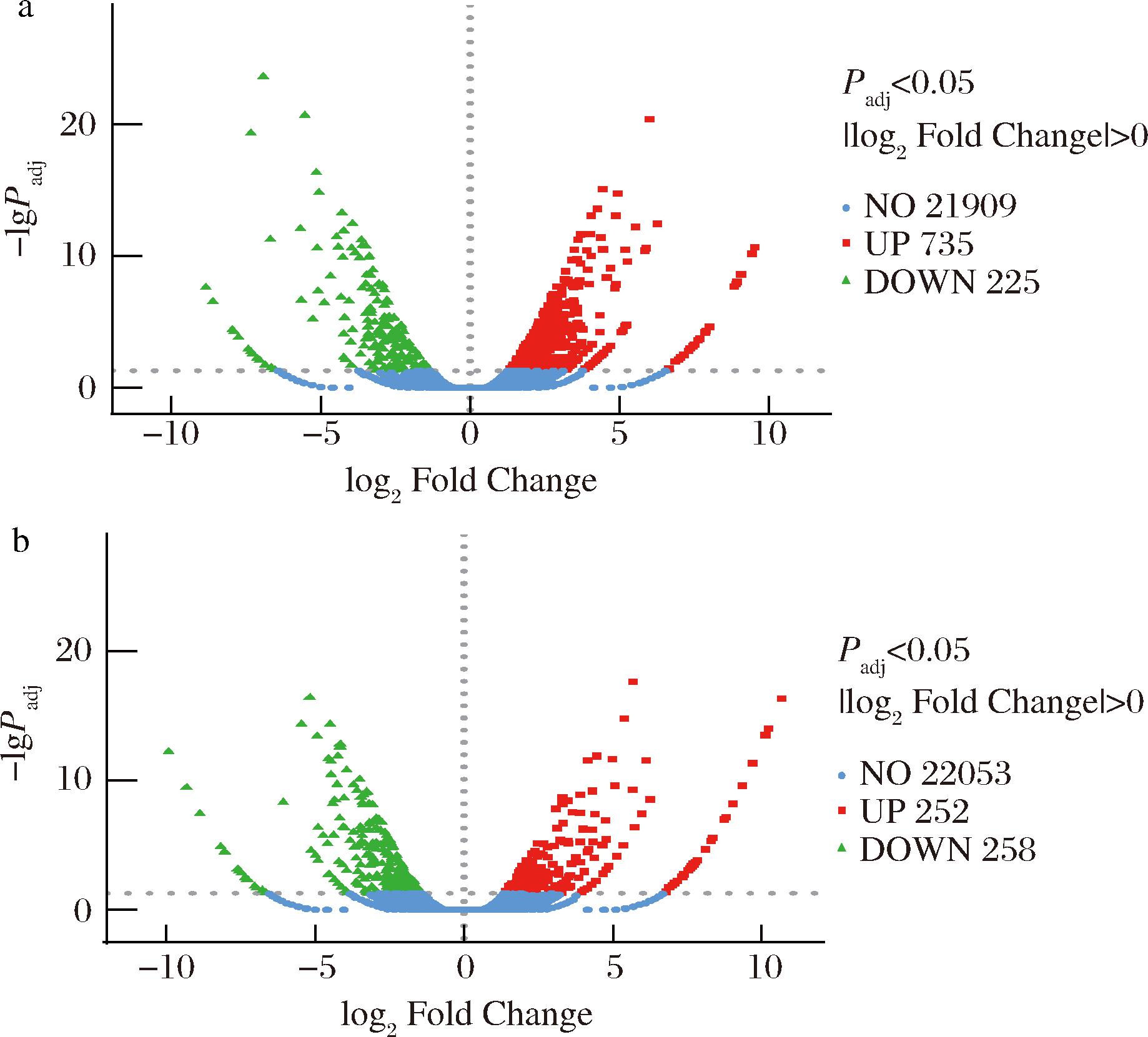
a-TLG-1 vs control;b-Man vs control
图6 差异表达基因火山图
Fig.6 Volcano plot of DEGs
分别取其中差异倍数较大的10个基因进行分析(表5~表6),Prlr在两组中均为正向调控,且log2FoldChange均最高,TLG-1组和Man组中分别为9.545 1和10.674 9。Prlr编码的催乳素受体,是一种I型细胞因子跨膜受体,可减少肿瘤细胞内核糖-5-磷酸和NADPH的生物合成并阻断DNA的复制[23]。提示TLG-1可能通过影响磷酸戊糖途径来调控S180肿瘤的生长。
表5 差异表达基因(Man vs control)
Table 5 DEGs of Man group vs control group
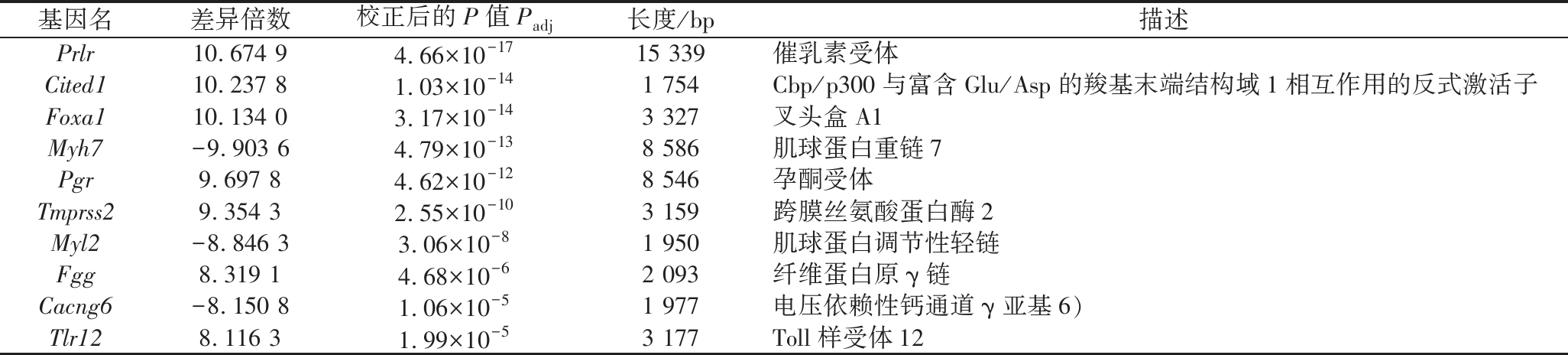
基因名差异倍数校正后的P值Padj长度/bp描述Prlr10.674 94.66×10-1715 339催乳素受体Cited110.237 81.03×10-141 754Cbp/p300与富含Glu/Asp的羧基末端结构域1相互作用的反式激活子Foxa110.134 03.17×10-143 327叉头盒A1Myh7-9.903 64.79×10-138 586肌球蛋白重链7Pgr9.697 84.62×10-128 546孕酮受体Tmprss29.354 32.55×10-103 159跨膜丝氨酸蛋白酶2Myl2-8.846 33.06×10-81 950肌球蛋白调节性轻链Fgg8.319 14.68×10-62 093纤维蛋白原γ链Cacng6-8.150 81.06×10-51 977电压依赖性钙通道γ亚基6)Tlr128.116 31.99×10-53 177Toll样受体12
表6 差异表达基因(TLG-1 vs control)
Table 6 DEGs of TLG-1 group vs control group

基因名差异倍数校正后的P值Padj长度/bp描述Prlr9.545 12.21×10-1115 339催乳素受体Cited19.444 66.97×10-111 754Cbp/p300与富含Glu/Asp的羧基末端结构域1相互作用的反式激活子Tmprss28.977 29.20×10-93 159跨膜丝氨酸蛋白酶2Tlr128.928 41.39×10-83 177Toll样受体12Foxa18.877 92.10×10-83 327叉头盒A1Myl2-8.845 62.10×10-81 950肌球蛋白调节性轻链2Fgg7.931 44.86×10-52 093纤维蛋白原γ链Tceal5-7.895 84.86×10-51 263转录延伸因子A样5Spint17.165 07.55×10-52 767Kunitz 1型丝氨酸肽酶抑制因子Pitx2-7.115 91.2×10-44 726配对样同源域2
Pitx2编码的配对样同源域2(paired-like homeodomain transcription factor 2,PITX2)可调节肿瘤细胞周期蛋白A1(cycin A1,CCNA1)的表达,CCNA1可与细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)伴侣结合并激活CDK,促进G1至S期细胞周期进程[24]。Pitx2仅在TLG-1组下调,log2FoldChange为-7.115 9。表明TLG-1可能通过抑制PITX2-CCNA1互作来调节肿瘤细胞周期。
Foxa1编码的叉头框蛋白A1(forkhead box A1,FOXA1)是驱动型转录因子(pioneer TF),可增加E-cad的表达量及降低波形蛋白水平,从而抑制肿瘤细胞的EMT过程[25]。Foxa1在Man组和TLG-1组中的log2FoldChange分别为10.134 0、8.877 9。表明TLG-1可作为EMT过程的抑制剂来调节肿瘤的转移。
综上,TLG-1能显著上调Prlr、Foxa1以及下调Pitx2等基因来调节S180肿瘤细胞的增殖、迁移和侵袭,其中包括Prlr抑制磷酸戊糖途径,Foxa1抑制EMT过程,以及Pitx2调控肿瘤细胞周期进程。
2.8 差异基因GO功能富集分析
转录差异基因进行GO功能富集分析的结果为:与control组相比,Man组和TLG-1组分别显著富集5 944个、6 323个GO门类,其中包含的生物过程分别有4 684个、4 981个,细胞组分分别有473个、504个,分子功能分别有788个、838个。按-lg(Padj)由大到小排序,分别取Man组和TLG-1组中3组生物学功能的前十进行分析(见图7)。

a-TLG-1 vs control;b-Man vs control
图7 差异表达基因GO富集结果(前10)
Fig.7 GO annotation enrichment of DEGs (Top10)
结果显示,TLG-1在生物学过程中,显著集中在细胞因子介导的信号通路T细胞的活化、以及适应性免疫应答等;在细胞组分中主要富集在质膜外侧及主要组织相容性复合体;在分子功能中主要是细胞因子及其受体活性、抗原结合、趋化因子及其受体结合与G蛋白偶联受体活性等。而Man抑制S180肿瘤的关键基因功能分类显著富集在吞噬、识别作用、防御反应以及循环免疫球蛋白介导的体液免疫应答。以上结果提示,TLG-1和Man均能诱导机体产生特异性免疫应答,TLG-1可激活细胞因子介导的信号通路,活化T细胞,从而引发细胞免疫,而Man主要引发体液免疫。
2.9 差异基因KEGG富集分析
差异基因KEGG富集分析结果显示(图8),相较于control组,TLG-1组共有838个差异基因成功注释到285条通路中;Man组共有545个差异基因成功富集并注释在262条通路中。按Padj由小到大进行排列,分别取TLG-1组、Man组前20条通路进行分析。结果显示,与control组相比, TLG-1组、Man组的差异基因均主要富集在细胞因子与细胞因子受体相互作用、细胞黏附分子、抗原处理和呈递等通路中。除此之外,TLG-1组差异基因还显著富集到趋化因子信号转导、自然杀伤细胞(natural killer cell,NK细胞)介导的细胞毒性以及Jak-STAT信号转导等通路中。
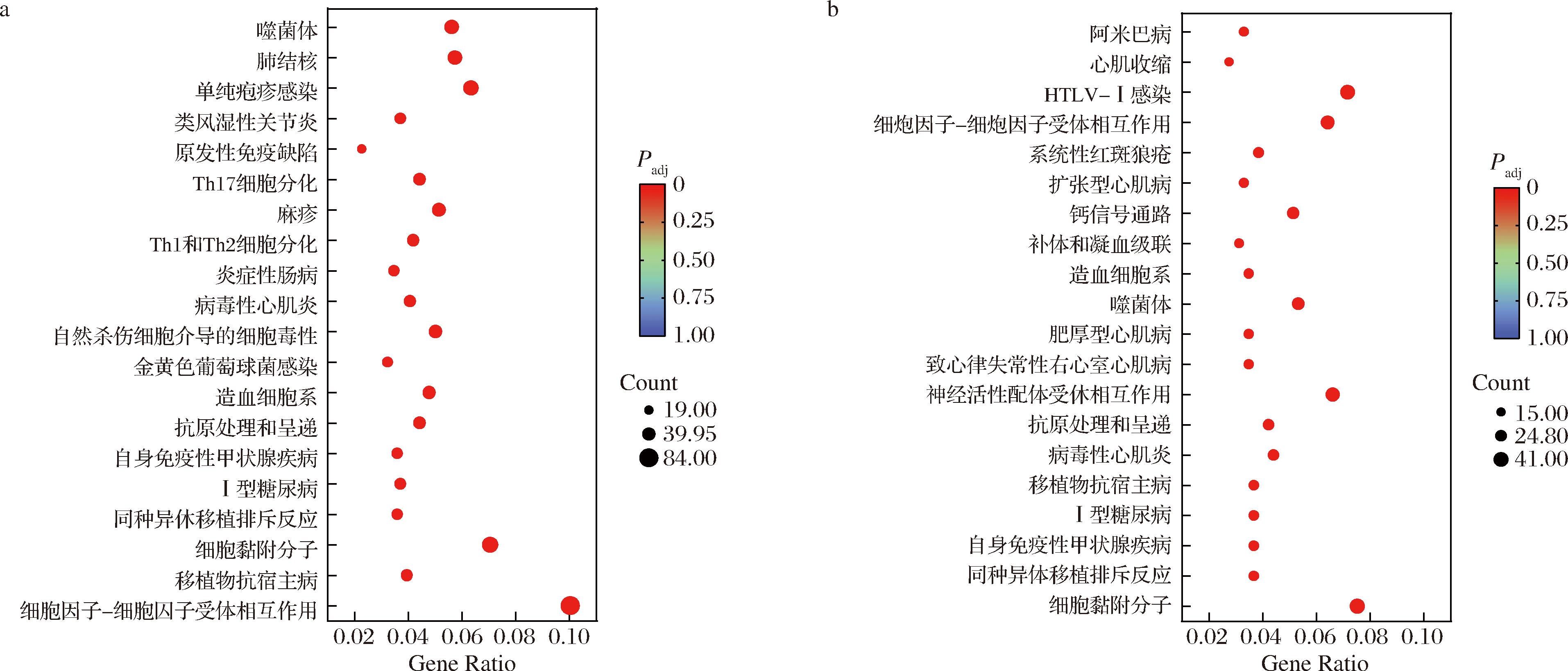
a-TLG-1 vs control;b-Man vs control
图8 差异表达基因KEGG富集结果(前20)
Fig.8 KEGG enrichment of DEGs (Top20)
TLG-1组富集在Jak-STAT信号通路的基因数为38个,基因比例为4.53%。Jak-STAT信号转导通路是调节跨膜受体与细胞核最重要的通路之一,参与细胞增殖、分化、凋亡和免疫调节[26]。经TLG-1处理后,该通路中表达上调的基因有Il21、Il12rb2、Il12b、Il2ra、Il2rb、Il2rg、Il15ra和Ifng等。
Il21、Il2ra、Il2rb、Il2rg、Il15ra属于白介素2(interleukin-2,IL-2)家族,其受体复合物均含白介素2受体γ亚基(interleukin-2 receptor subunit gamma,IL-2Rγ)。其中Il2ra、Il2rb及Il2rg分别编码白介素2受体α亚基(interleukin-2 receptor subunit alpha,IL-2Rα)、白介素2受体β亚基(interleukin-2 receptor subunit beta,IL-2Rβ)与IL-2Rγ,这三者共同组成白介素2受体(interleukin-2 receptor,IL-2R)。Il15ra编码的白介素15受体α亚基(interleukin-15 receptor subunit alpha,IL-15Rα)与IL-2Rβ、IL-2Rγ共同组成白介素15受体(interleukin-15 receptor,IL-15R)。IL-2和白介素15(interleukin-15,IL-15)与相应受体结合后均能促进CD4+和CD8+T细胞的增殖和活化,诱导辅助性T细胞分化并增强NK细胞和CD8+T细胞的溶解活性。但IL-2在促进CD8+T细胞蛋白质合成方面比IL-15效果更好[27]。提示TLG-1可通过增强CD8+T细胞和NK细胞来靶向杀伤肿瘤细胞。
Il21编码的白介素21(interleukin-21,IL-21)同样属于IL-2家族,也可增强CD8 T细胞和NK细胞的细胞毒性作用。与同家族的IL-2和IL-15不同, IL-21还可诱导肿瘤细胞凋亡并促进M2型巨噬细胞向M1型巨噬细胞转变[28]。提示TLG-1还可通过肿瘤相关巨噬细胞表型的转换来促进炎症、破坏细胞外基质以及细胞凋亡。
Il12rb2和Il12b则属于白介素12(interleukin-12,IL-12)家族,Il12a与Il12b作为两个独立基因共同编码IL-12,分别为白介素12α亚基(interleukin-12 subunit alpha,IL-12α)和白介素12β亚基(interleukin-12 subunit beta,IL-12β);白介素12受体(interleukin-12 receptor,IL-12R)则由Il12rb1、Il12rb2编码,分别为白介素12受体β1亚基(interleukin-12 receptor subunit beta1,IL-12Rβ1)及白介素12受体β2亚基(interleukin-12 receptor subunit beta2,IL-12Rβ2)。与IL-2家族相似,IL-12也可增强T细胞和自然杀伤细胞的活化和细胞毒性能力。与此同时,IL-12还可诱导Th0细胞分化为Th1细胞及干扰素-γ(interferon-gamma,IFN-γ)的分泌[29]。干扰素家族的IFN-γ由Ifng基因编码,可通过活化巨噬细胞,上调肿瘤细胞上的MHC表达以促进抗原处理与呈递等免疫机制来杀死肿瘤细胞[30]。提示TLG-1可诱导Th1细胞的分化及分泌大量IFN-γ从而促进抗原呈递和提高巨噬细胞活性。
以上结果提示TLG-1上调Jak-STAT信号通路中的Il21、Il12rb2、Il12b、Il2ra、Il2rb、Il2rg、Il15ra和Ifng等基因,通过活化T细胞、转换肿瘤相关巨噬细胞表型及分泌IFN-γ等,增强小鼠抗肿瘤免疫应答(图9),这与GO富集分析结果一致。
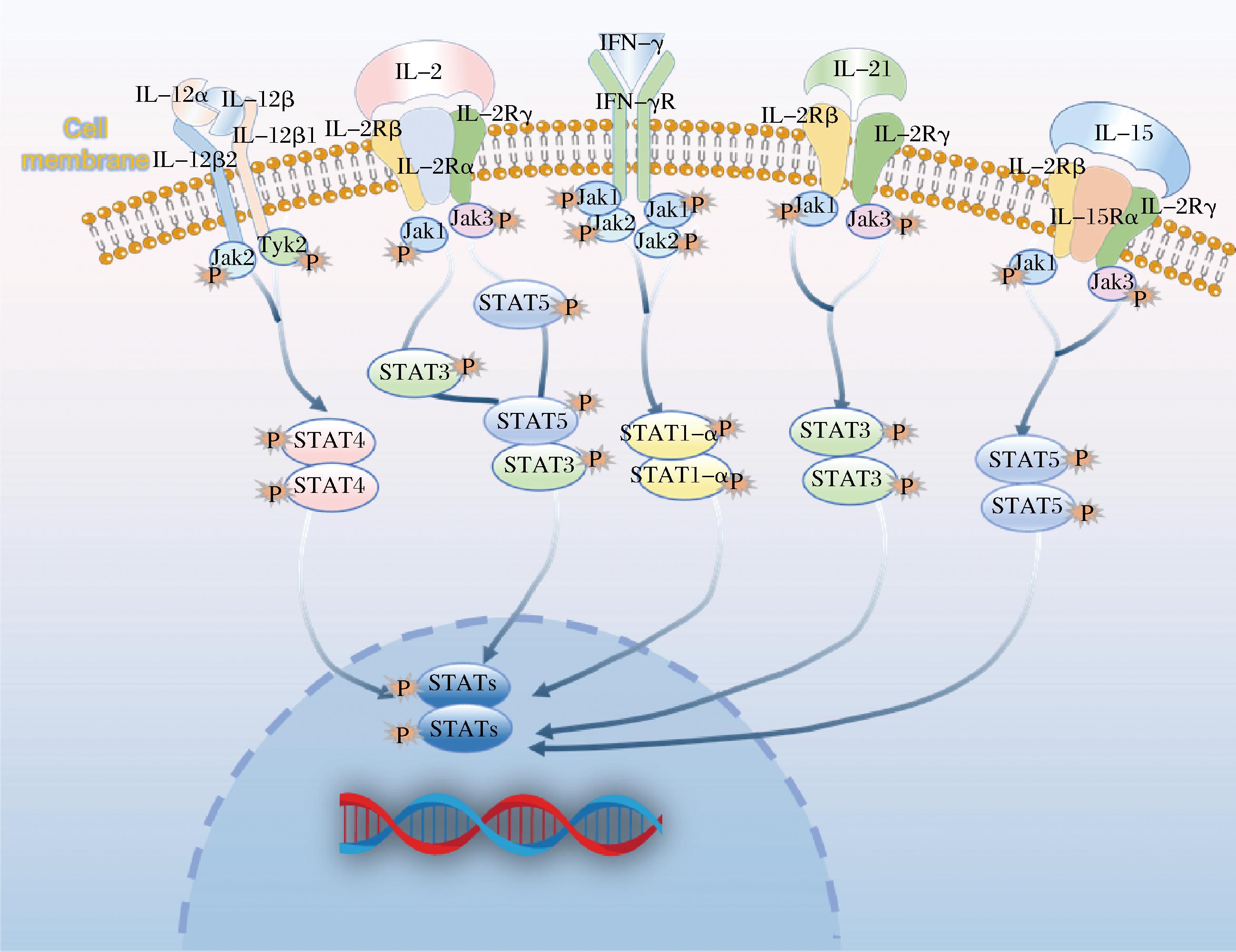
图9 Jak-STAT信号通路
Fig.9 Jak-STAT signaling pathway
3 讨论与结论
多糖具有免疫调节、抗肿瘤等生理活性及其无明显毒副作用的特点,在缓解肿瘤发生发展中扮演着重要的角色。不同多糖抑制肿瘤的生长和转移的基因往往不同。如网纹牛肝菌多糖可上调gadd45β和gadd45γ基因来诱导肿瘤细胞周期中G2/M的阻断,下调grb2来调节细胞之间的黏附和迁移能力[31]。
小孢枝瑚菌多糖下调Rpl34和Rpl36,减慢肿瘤细胞的有丝分裂和促进细胞凋亡,从而抑制肿瘤细胞的生长[32]。在我们的研究中,TLG-1可下调Eef1a1与Pitx2来抑制肿瘤细胞周期从G1期进展到S期,同时通过上调Foxa1,下调Rplp1和Lgals1基因来抑制肿瘤细胞的EMT过程并降低其运动能力。值得注意的是,TLG-1上调的mt-Co1和Prlr基因也可通过影响代谢途径来抑制肿瘤生长,其中mt-Co1可降低肿瘤细胞的糖酵解能力,而Prlr可抑制磷酸戊糖途径。
不同多糖抑制S180肿瘤涉及的信号通路有所差异。羊肚菌多糖可通过上调Prlr、Ghr和Fgf10/Fgfr2等信号激活PI3K-AKT信号通路来调控S180肿瘤细胞增殖和迁移等进程[33];黑灵芝多糖可通过TLR4介导的NF-κB和MAPK信号通路来抑制S180肿瘤生长[34]。而本研究中的草黄口蘑多糖主要通过调控Jak-STAT信号通路来抑制荷瘤小鼠S180肿瘤的生长。在Jak-STAT信号通路中,TLG-1主要通过上调白介素家族(IL-2R、IL-12、IL-12R、IL-21等)和干扰素家族(IFN-γ等),活化两面神激酶(janus kinase,JAK),进而磷酸化信号转导和转录激活因子(signal transducer and activator of transcription,STAT)STAT二聚体进入细胞核后招募相关基因进行表达[35],从而调控小鼠抗肿瘤免疫应答过程,最终达到抑制小鼠S180肿瘤生长和转移的作用。
综上所述,本研究结果显示TLG-1重均分子质量为13 442 Da,由木糖、甘露糖、葡萄糖和半乳糖4种单糖组成,其比例为1.57∶1.45∶2.84∶4.14。体内抗肿瘤活性显示,TLG-1能显著抑制小鼠S180肿瘤的生长,抑制率可达53.8%。转录组测序结果显示,TLG-1能显著上调mt-Co1、Prlr、Spint1和Foxa1以及下调Pitx2、Rplp1、Eef1a1及Lgals1等基因,抑制S180肿瘤细胞增殖、迁移和侵袭,调控Jak-STAT信号通路,参与抗肿瘤免疫应答调节,进而抑制S180肿瘤的生长和转移。以上结果为揭示草黄口蘑多糖抑制肿瘤细胞发生发展机制提供了一定科学依据。
[1] 江飞凤, 谭晓辉, 胡鹏刚, 等.超声-微波协同提取柚子皮多糖工艺优化及单糖组成、结构和抗氧化活性分析[J].食品与发酵工业, 2021, 47(2):196-204.
JIANG F F, TAN X H, HU P G, et al.Optimization of ultrasonic-microwave extraction process of pomelo peel polysaccharide and analysis of monosaccharide composition, structure and antioxidant activity[J].Food and Fermentation Industries, 2021, 47(2):196-204.
[2] KUMAR A, JAITAK V.Natural products as multidrug resistance modulators in cancer[J].European Journal of Medicinal Chemistry, 2019, 176:268-291.
[3] 李勤, 张嫚, 孟祥珍.香菇多糖注射液结合吉非替尼对非小细胞肺癌疗效、肺功能、不良反应影响研究[J].中华中医药学刊, 2021, 39(4):163-166.
LI Q, ZHANG M, MENG X Z.Effects of lentinan injection combined with gefitinib on efficacy, lung function and side effects of non-small cell lung cancer patients[J].Chinese Archives of Traditional Chinese Medicine, 2021, 39(4):163-166.
[4] FOLEY G E, DROLET B P.Sustained propagation of sarcoma 180 in tissue culture[J].Proceedings of the Society for Experimental Biology and Medicine, 1956, 92(2):347-352.
[5] CHIHARA G, MAEDA Y, HAMURO J, et al.Inhibition of mouse sarcoma 180 by polysaccharides from Lentinus edodes (Berk.) Sing[J].Nature, 1969, 222(5194):687-688.
[6] 姜爽, 徐婧瑶, 苏鑫, 等.山慈菇多糖的免疫调节作用及对小鼠骨肉瘤细胞S180体内生长抑制作用[J].食品科学, 2018, 39(13):216-221.
JIANG S, XU J Y, SU X, et al.Effects of pseudobulbus cremastrae seu pleiones polysaccharide on the regulation of immune function and the inhibition of tumor growth in sarcoma S180 tumor-bearing mice[J].Food Science, 2018, 39(13):216-221.
[7] 季宇彬, 汲晨锋.芦笋多糖对肿瘤小鼠红细胞离子通道活性的影响[J].中国食品学报, 2014, 14(7):27-31.
JI Y B, JI C F.Effect of Asparagus polysaccharide on erythrocyte ion channel in tumor model mice[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(7):27-31.
[8] 刘燕琳, 刘海燕, 常金, 等.桑黄多糖对肉瘤S180细胞体内外的抑瘤作用[J].中国药房, 2017, 28(22):3069-3072.
LIU Y L, LIU H Y, CHANG J, et al.Antitumor effect of Phellinus Linteus polysaccharide on sarcoma S180 cells in vivo and in vitro[J].China Pharmacy, 2017, 28(22):3069-3072.
[9] 陈茜, 侯怡铃, 杨彤, 等.灰褐纹口蘑多糖对免疫细胞的调节作用[J].食用菌学报, 2021, 28(4):64-74.
CHEN X, HOU Y L, YANG T, et al.Regulative effects of Tricholoma sinoportentosum polysaccharide extract on immune cells[J].Acta Edulis Fungi, 2021, 28(4):64-74.
[10] YOU L J, GAO Q, FENG M Y, et al.Structural characterisation of polysaccharides from Tricholoma matsutake and their antioxidant and antitumour activities[J].Food Chemistry, 2013, 138(4):2242-2249.
[11] 郭华, 刁全平, 张博, 等.杨树口蘑多糖的超声波辅助提取工艺及其抗氧化活性[J].食品工业科技, 2018, 39(5):180-184.
GUO H, DIAO Q P, ZHANG B, et al.Optimization of ultrasonic-assisted extraction and antioxidant activity of polysaccharides from Tricholoma populinum[J].Science and Technology of Food Industry, 2018, 39(5):180-184.
[12] YANG H R, CHEN L H, ZENG Y J.Structure, antioxidant activity and in vitro hypoglycemic activity of a polysaccharide purified from Tricholoma matsutake[J].Foods, 2021, 10(9):2184.
[13] MEHMOOD S, ZHOU L Y, WANG X F, et al.Structural elucidation and antioxidant activity of a novel heteroglycan from Tricholoma lobayense[J].Journal of Carbohydrate Chemistry, 2019, 38(3):192-211.
[14] 张玉, 张琪琳, 王静林, 等.香菇多糖构效关系、抗肿瘤作用机制及药代动力学研究进展[J].中国医院药学杂志, 2023, 43(7):804-812.
ZHANG Y, ZHANG Q L, WANG J L, et al.Advances in structure-activity relationship, anti-tumor mechanism and pharmacokinetics of lentinan[J].Chinese Journal of Hospital Pharmacy, 2023, 43(7):804-812.
[15] HOU Y L, DING X, HOU W R, et al.Structure elucidation and antitumor activity of a new polysaccharide from Maerkang Tricholoma matsutake[J].International Journal of Biological Sciences, 2017, 13(7):935-948.
[16] ZHANG N, YANG B, MAO K M, et al.Comparison of structural characteristics and bioactivity of Tricholoma mongolicum Imai polysaccharides from five extraction methods[J].Frontiers in Nutrition, 2022, 9:962584.
[17] 杜秀菊, 张劲松, 潘迎捷.核磁共振技术在食用菌多糖结构分析中的作用[J].中国食用菌, 2010, 29(1):3-6;19.
DU X J, ZHANG J S, PAN Y J.Application of the NMR techniques in structural analysis of polysaccharide from edible fungi[J].Edible Fungi of China, 2010, 29(1):3-6;19.
[18] ALHUSSONA A J, ALMANDEL A S, ALI M M, et al.Genetic variations of the mtCOX1 gene for Iraqi patients with tetralogy of fallot[J].Current Pediatric Research, 2021, 25(10):981-986.
[19] ORONSKY B T, ORONSKY N, FANGER G R, et al.Follow the ATP:Tumor energy production:A perspective[J].Anti-Cancer Agents in Medicinal Chemistry, 2014, 14(9):1187-1198.
[20] XIE C J, CAO K, PENG D X, et al.RPLP1 is highly expressed in hepatocellular carcinoma tissues and promotes proliferation, invasion and migration of human hepatocellular carcinoma Hep3b cells[J].Experimental and Therapeutic Medicine, 2021, 22(1):752.
[21] LI J M, TSENG C W, LIN C C, et al.Upregulation of LGALS1 is associated with oral cancer metastasis[J].Therapeutic Advances in Medical Oncology, 2018, 10:1758835918794622.
[22] HUANG J, ZHENG C Q, SHAO J, et al.Overexpression of eEF1A1 regulates G1-phase progression to promote HCC proliferation through the STAT1-cyclin D1 pathway[J].Biochemical and Biophysical Research Communications, 2017, 494(3-4):542-549.
[23] 黄佩琦. 催乳素受体PRLR在胰腺导管腺癌中的作用及分子机制研究[D].上海:上海交通大学, 2020.
HUANG P Q.The role and underlying molecular mechanism of prolactin receptor PRLR in pancreatic ductal adenocarcinoma[D].Shanghai:Shanghai Jiao Tong University, 2020.
[24] LIU Y, HUANG Y, ZHU G Z.Cyclin A1 is a transcriptional target of PITX2 and overexpressed in papillary thyroid carcinoma[J].Molecular and Cellular Biochemistry, 2013, 384(1-2):221-227.
[25] LIN M X, PAN J, CHEN Q, et al.Overexpression of FOXA1 inhibits cell proliferation and EMT of human gastric cancer AGS cells[J].Gene, 2018, 642:145-151.
[26] BOLLI R, DAWN B, XUAN Y T.Role of the JAK-STAT pathway in protection against myocardial ischemia/reperfusion injury[J].Trends in Cardiovascular Medicine, 2003, 13(2):72-79.
[27] YANG Y, LUNDQVIST A.Immunomodulatory effects of IL-2 and IL-15;Implications for cancer immunotherapy[J].Cancers, 2020, 12(12):3586.
[28] LEONARD W J, WAN C K.IL-21 signaling in immunity[J].F1000Research, 2016, 5:F1000 Faculty Rev-F1000 Faculty 224.
[29] NGUYEN K G, VRABEL M R, MANTOOTH S M, et al.Localized interleukin-12 for cancer immunotherapy[J].Frontiers in Immunology, 2020, 11:575597.
[30] 刘玲, 焦鹏涛, 王萌, 等.鸡干扰素γ与白介素2对外周血中Th1细胞分化相关细胞因子的影响[J].生物工程学报, 2022, 38(9):3329-3343.
LIU L, JIAO P T, WANG M, et al.Effects of chicken interferon-γ and interleukin-2 on cytokines related to Th1 cell differentiation in peripheral blood[J].Chinese Journal of Biotechnology, 2022, 38(9):3329-3343.
[31] SU S Y, DING X, HOU Y L, et al.Structure elucidation, immunomodulatory activity, antitumor activity and its molecular mechanism of a novel polysaccharide from Boletus reticulatus Schaeff[J].Food Science and Human Wellness, 2023, 12(2):647-661.
[32] DONG M M, HOU Y L, DING X.Structure identification, antitumor activity and mechanisms of a novel polysaccharide from Ramaria flaccida (Fr.) Quél[J].Oncology Letters, 2020, 20(3):2169-2182.
[33] 鲁艳, 黄瑶, 叶姿妤, 等.转录组分析探讨揭示羊肚菌多糖ME-X抗S180肿瘤的分子机制[J].四川农业大学学报, 2022, 40(4):519-528.
LU Y, HUANG Y, YE Z Y, et al.Transcriptomes analysis revealed the molecular mechanism about the anti-S180 tumor activity of the polysaccharide ME-X from Morchella esculenta[J].Journal of Sichuan Agricultural University, 2022, 40(4):519-528.
[34] ZHANG S S, NIE S P, HUANG D F, et al.Polysaccharide from Ganoderma atrum evokes antitumor activity via Toll-like receptor 4-mediated NF-κB and mitogen-activated protein kinase signaling pathways[J].Journal of Agricultural and Food Chemistry, 2013, 61(15):3676-3682.
[35] MORRIS R, KERSHAW N J, BABON J J.The molecular details of cytokine signaling via the JAK/STAT pathway[J].Protein Science: a Publication of the Protein Society, 2018, 27(12):1984-2009.