提高运动耐力在现实生活中具有重要的价值,不仅能满足运动员在竞技比赛中提高运动成绩的需求,同时能满足普通人对于提升身体素质、改善身体健康的需求,以及长时间的体力劳动、战场等特殊场景下的体力需求。如何提高运动耐力不仅是运动生理学家所关注的研究重点,更是令人困扰的现实问题。目前提高运动耐力的干预措施因受限于专业设备、合适的场所及药物副作用[1-2],所以探寻安全且便捷高效的干预措施显得尤为迫切。随着科学的发展,关于利用食物源成分减轻运动疲劳、延长运动时间的研究越来越多[3-4]。元动力作为一种新型药食同源化合物的组合物,其主要成分为多糖、膳食脂肪酸和人参皂苷等,在团队前期的运动实践中已经被证实具有显著提高运动耐力的作用,然而若将其更广范围的应用尚需要对其缓解运动疲劳、提高运动耐力的机制进行系统研究。本研究拟通过负重力竭游泳实验测定运动耐力,采用红外热成像法监测小鼠整体能量代谢,通过HE染色法考察对肌肉组织的影响,采用脲酶法、乳酸脱氢酶法及蒽酮-硫酸法考察其对血尿素氮、血乳酸、肝糖原及肌糖原的影响,采用GC-MS法对粪便短链脂肪酸含量的影响进行评价,综合评价其缓解运动疲劳、提高运动耐力的作用,为开发一种安全高效且适合日常食用的耐力类运动功能食品提供科学依据。
1 材料与方法
1.1 材料
1.1.1 试剂
玛咖提取物,10∶1浓缩,食品级,西安瑞林生物科技有限公司;乳酸、尿素氮、肝/肌糖原测定试剂盒,南京建成生物工程研究所;阿洛糖、蔗糖、葡萄糖、5-羟甲基糠醛、棕榈酸、亚油酸、人参皂苷、姜酚,上海源叶生物科技有限公司,化学纯级别。
1.1.2 仪器与设备
ONE Pro LT gen3热像仪,菲力尔公司;SPY-11234全自动酶标仪、RC6 Plus高速冷冻离心机,赛默飞世尔科技公司;GCMS-QP2010气质联用仪,岛津制作所。
1.1.3 实验动物
60只无特定病原体(specific pathogen free,SPF)级雄性C57BL/6小鼠(5周龄),体重(18±2) g,珠海百试通生物科技有限公司,许可证号:SCXK(粤)2020-0051。饲养条件:温度(25±2) ℃,湿度(55±5)%,12 h明暗循环模拟昼夜交替,实验过程中自由摄食和饮水。Co60辐照实验鼠维持饲料,江苏美迪森生物医药有限公司。本实验所有操作过程遵循广东海洋大学动物伦理规定,且经广东海洋大学动物伦理委员会批准(批准文号:GDOU-LAE-2022-006)。
1.2 实验方法
1.2.1 元动力的配制
元动力按以下各物质配比组成:阿洛糖28%、蔗糖12%、葡萄糖8%、5-羟甲基糠醛12%、棕榈酸18%、亚油酸18%、人参皂苷3%、姜酚1%。
1.2.2 实验动物的处理
小鼠适应性喂养7 d后,随机分为4个组,分别为空白对照组(NC)、玛咖阳性对照组(AC)、元动力低剂量组(YDL.L)、元动力高剂量组(YDL.H),NC组灌胃纯水,AC组灌胃0.45 g/kg·BW玛咖提取物,YDL.L组和YDL.H组分别灌胃0.45、1.8 g/kg BW元动力溶液,n=15,单只灌胃体积=0.01×小鼠体重(g),1 次/d,共28 d。元动力剂量的确定由前期实验探索而得。最后一天灌胃后,进行红外摄影,使用热像仪在小鼠上方1 m处进行拍摄,辐射率0.95,拍摄后图片使用FLIR TOOLs软件进行处理得出数据。接着部分小鼠进行负重力竭游泳试验(n=7),负重为5%体重,测定力竭游泳时间;剩余部分进行90 min不负重游泳试验(n=8),90 min后捞起小鼠擦干,休息15 min后,眼球取血,解剖收集肌肉、脏器,进行后续生化指标测定。
1.2.3 小鼠肌肉组织切片HE染色
按照文献[5]的方法对小鼠腓肠肌进行HE染色。
1.2.4 小鼠疲劳生理生化指标的测定
采用蒽酮-硫酸法对肝糖原、肌糖原含量进行测定,采用脲酶法试剂盒对血清尿素氮含量进行测定,采用乳酸脱氢酶比色法试剂盒对血清乳酸含量进行测定。
1.2.5 小鼠结肠组织及粪便中短链脂肪酸水平的测定
称取结肠组织或粪便样品50 mg,加100 μL体积分数15%磷酸,再加125 μg/mL的内标(异己酸)溶液100 μL和乙醚900 μL匀浆1 min,于4 ℃ 12 000 r/min离心10 min,混合溶液用0.22 μm有机微孔膜过滤,取上清液用GC-MS测试(柱箱温度:60 ℃,进样口温度:250 ℃,进样方式:分流,载气:He,离子源温度:230 ℃,接口温度:250 ℃,色谱柱:VF-WAXms)。得到短链脂肪酸的标准曲线,结合保留时间和峰形对目标物的峰面积进行定量。
1.2.6 统计学方法
使用SPSS 24.0软件,通过单因素方差(one-way ANOVA)对力竭游泳时间、血尿素氮、血乳酸、肝糖原、肌糖原等实验数据进行显著性分析,实验数据以平均数±标准差(x±s)表示,以P<0.05表示差异有统计学意义;通过计算皮尔森(Pearson)相关系数对数据之间相关性进行分析。
2 结果与分析
2.1 元动力对小鼠负重力竭游泳时间的影响
如图1所示,与NC组相比,AC组与YDL.L组的力竭游泳时间分别延长61.2%、119.8%,具有显著差异(P<0.05),YDL.H组延长257.4%,具有极显著差异(P<0.01)。与AC组比,YDL.L组、YDL.H组分别升高36.3%、121.6%。说明元动力能够显著延长耐力运动时间,其效果远超玛咖。
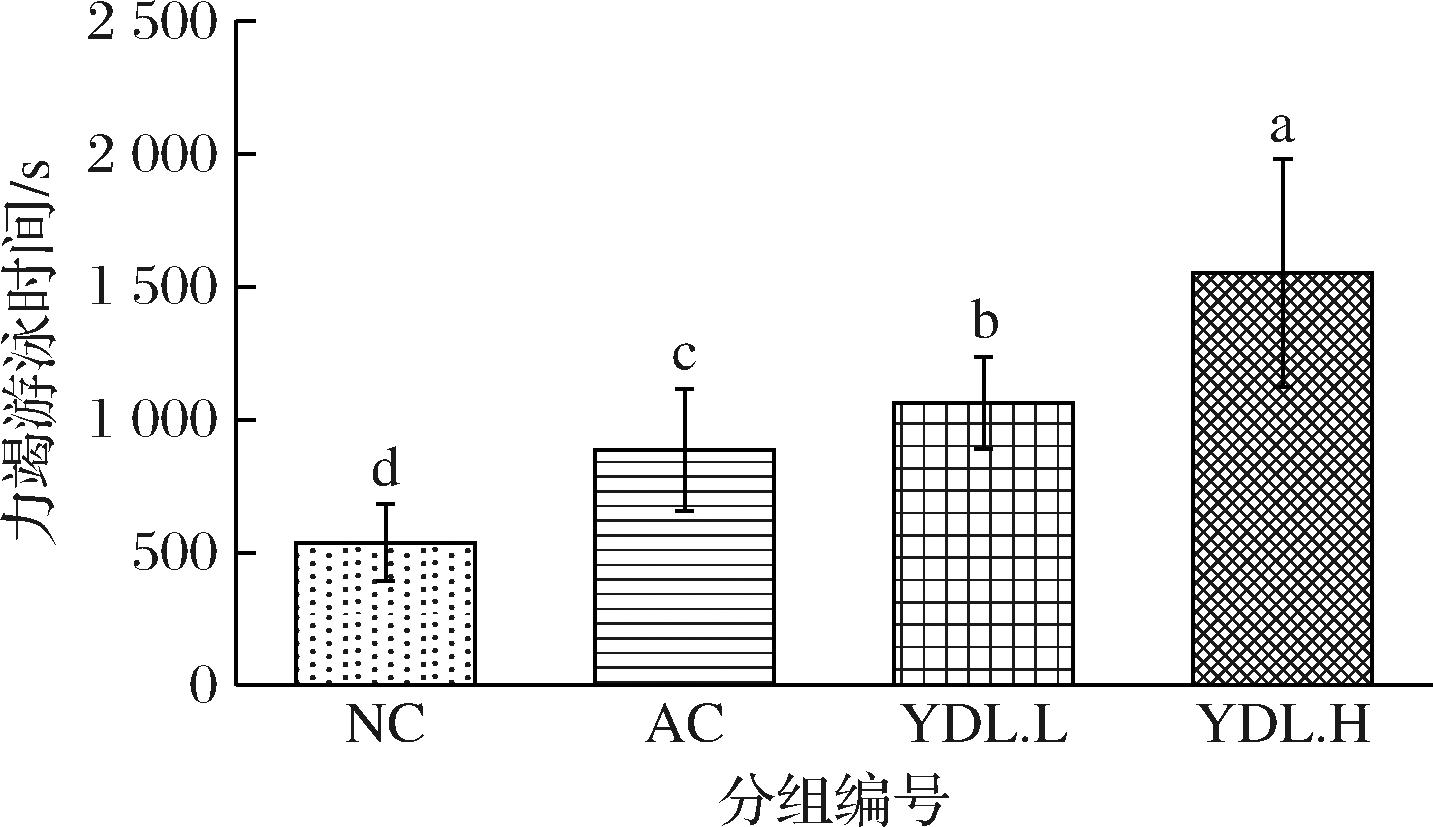
图1 不同剂量元动力及玛咖提取物对小鼠负重力竭游泳时间的影响
Fig.1 Effects of YDL and maca extract on exhaust swimming time of mice
注:不同字母代表组间差异显著(P<0.05)(下同)。
2.2 元动力对小鼠耐力运动后肌肉组织形态的影响
由图2可见,空白对照组在90 min耐力运动后,肌肉细胞因剧烈拉力变形,排列紊乱,细胞膜不清晰;细胞核分布紊乱,多出聚集、破裂或消失,肌肉纤维被大量炎症细胞包围。与NC组相比,AC组肌肉变形减轻,但仍然存在细胞膜不清晰、细胞核分布紊乱的现象;YDL.L组、YDL.H组肌肉细胞变形和破裂明显减轻,细胞膜清晰。说明元动力对耐力运动造成的肌肉损伤具有一定的保护作用。同时可以观察到低剂量元动力干预后肌肉纤维和纤维束显著变粗,YDL.L组显著粗于YDL.H组。
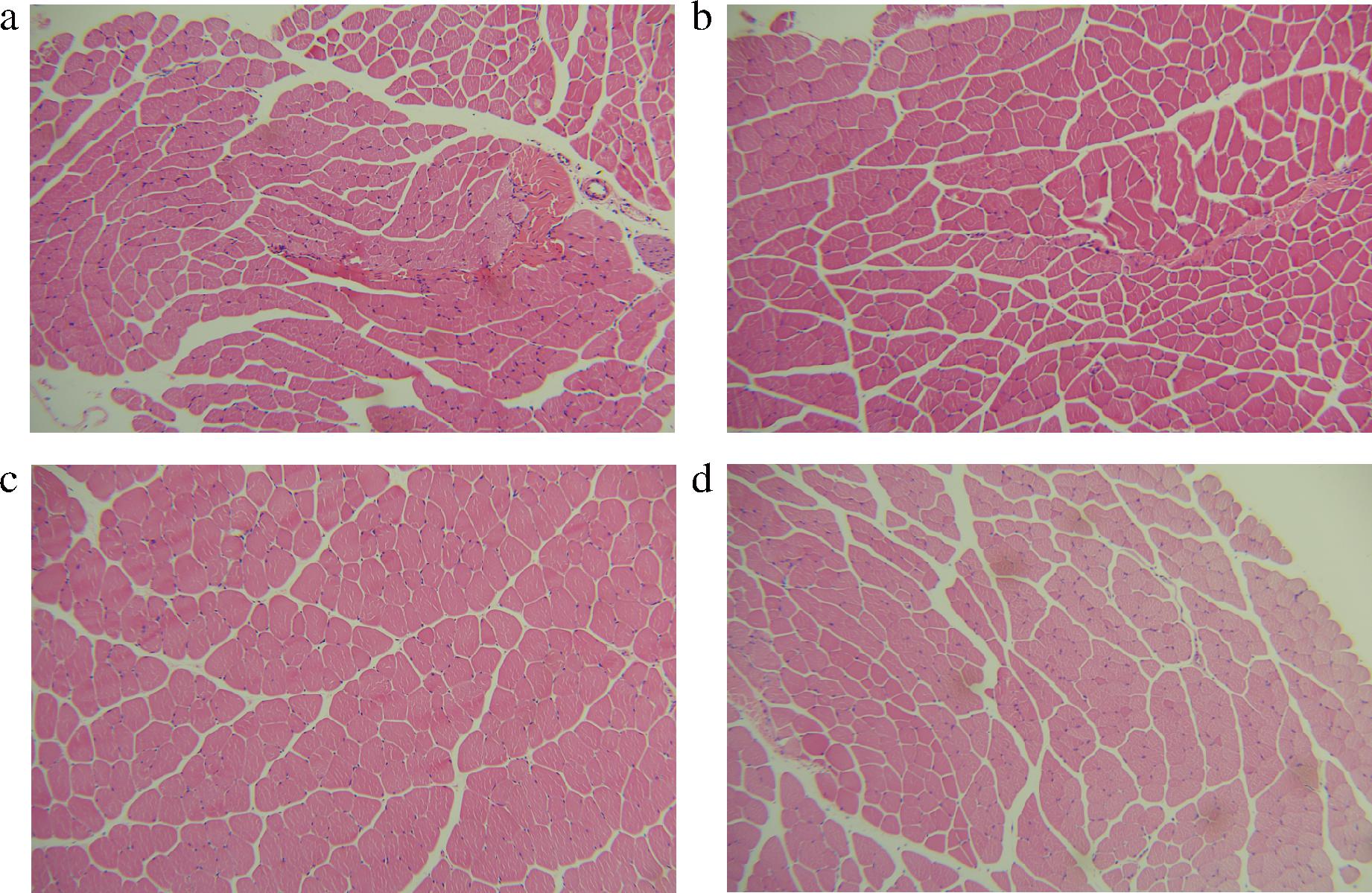
a-NC组;b-AC组;c-YDL.L组;d-YDL.H组
图2 空白组与实验组小鼠耐力运动后肌肉组织切片
Fig.2 Muscle tissue sections after endurance exercise in each group
2.3 元动力对小鼠整体能量代谢情况的影响
由图3可知,NC组小鼠整体体温水平较低,而AC组小鼠背部中心温度显著上升,尾部温度变化较小;YDL.L组、YDL.H组背部中心及尾部温度显著提高,YDL.H组显著高于YDL.L组和AC组,说明元动力能够显著提高小鼠整体能量代谢,YDL.H组显著高于AC组。
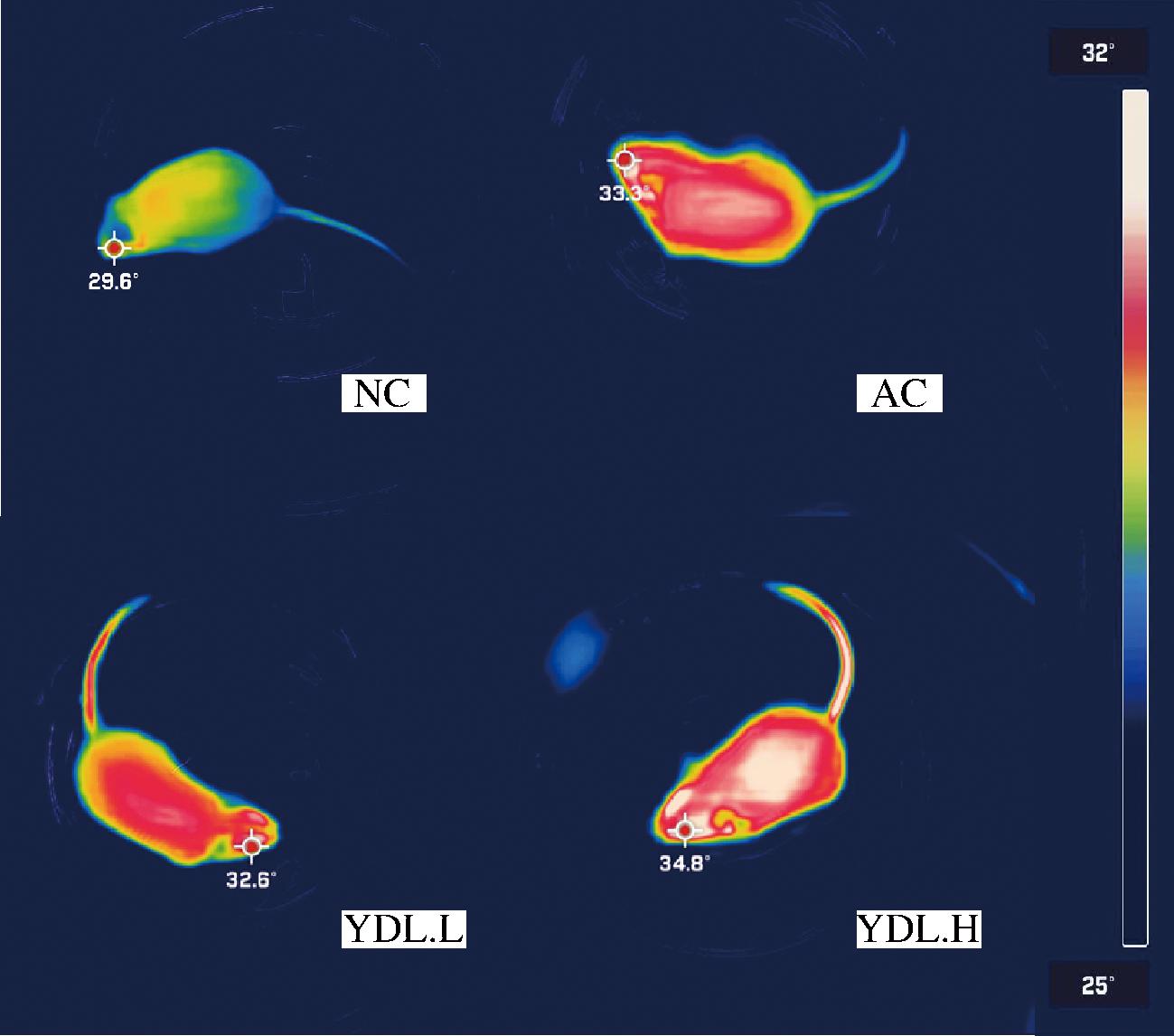
图3 空白组与实验组小鼠体表红外成像图
Fig.3 Infrared imaging of mouse body
由图4可见,通过分析小鼠身体各区域温度发现,与NC组相比,低剂量的元动力显著提升尾部、眼部、背部温度,分别升高19.11%、11.85%、10.10%,高剂量的元动力显著提升尾部、眼部、背部温度,分别提升23.41%、16.25%、14.46%。与AC组相比,低剂量元动力组尾部、眼部、背部温度分别提升6.89%、3.77%、3.84%,YDL.H组尾部、眼部、背部温度分别提升10.75%、7.85%、7.95%,元动力相较玛咖显著提高了小鼠的能量代谢。

a-尾部温度;b-眼部温度;c-背部温度
图4 空白组与实验组小鼠身体不同区域温度
Fig.4 Temperature of different areas of the mouse body
2.4 元动力对小鼠肌糖原和肝糖原水平的影响
由图5可知,与NC组相比,AC组、YDL.L组和YDL.H组小鼠肝糖原水平分别变化了-18.4%、1.6%、-3.4%,但组间无显著性差异(P>0.05)。与NC组相比,AC组、YDL.L组和YDL.H组小鼠肌糖原分别上升了46.8%、43.2%、40.7%,和NC相比肌糖原水平显著提高(P<0.05),但3组间无显著差异(P>0.05)。说明元动力和玛咖提取物均具有提高肌糖原储备的作用,两者作用效果相当。但对肝糖原的储备和利用无显著影响。
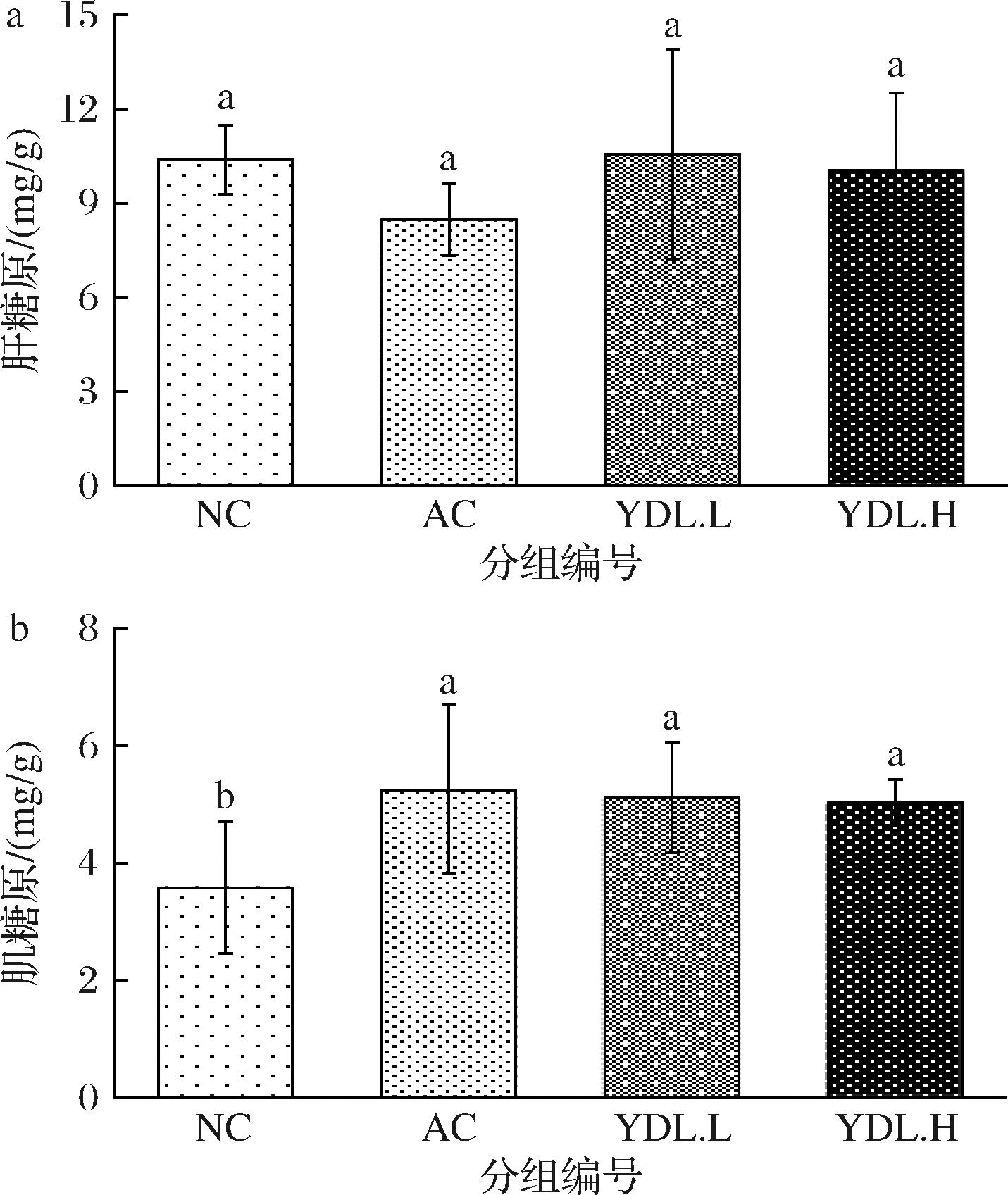
a-肝糖原;b-肌糖原
图5 空白组和实验组小鼠能量储备物质水平
Fig.5 Effects of YDL and maca extract on energy reserve substance level
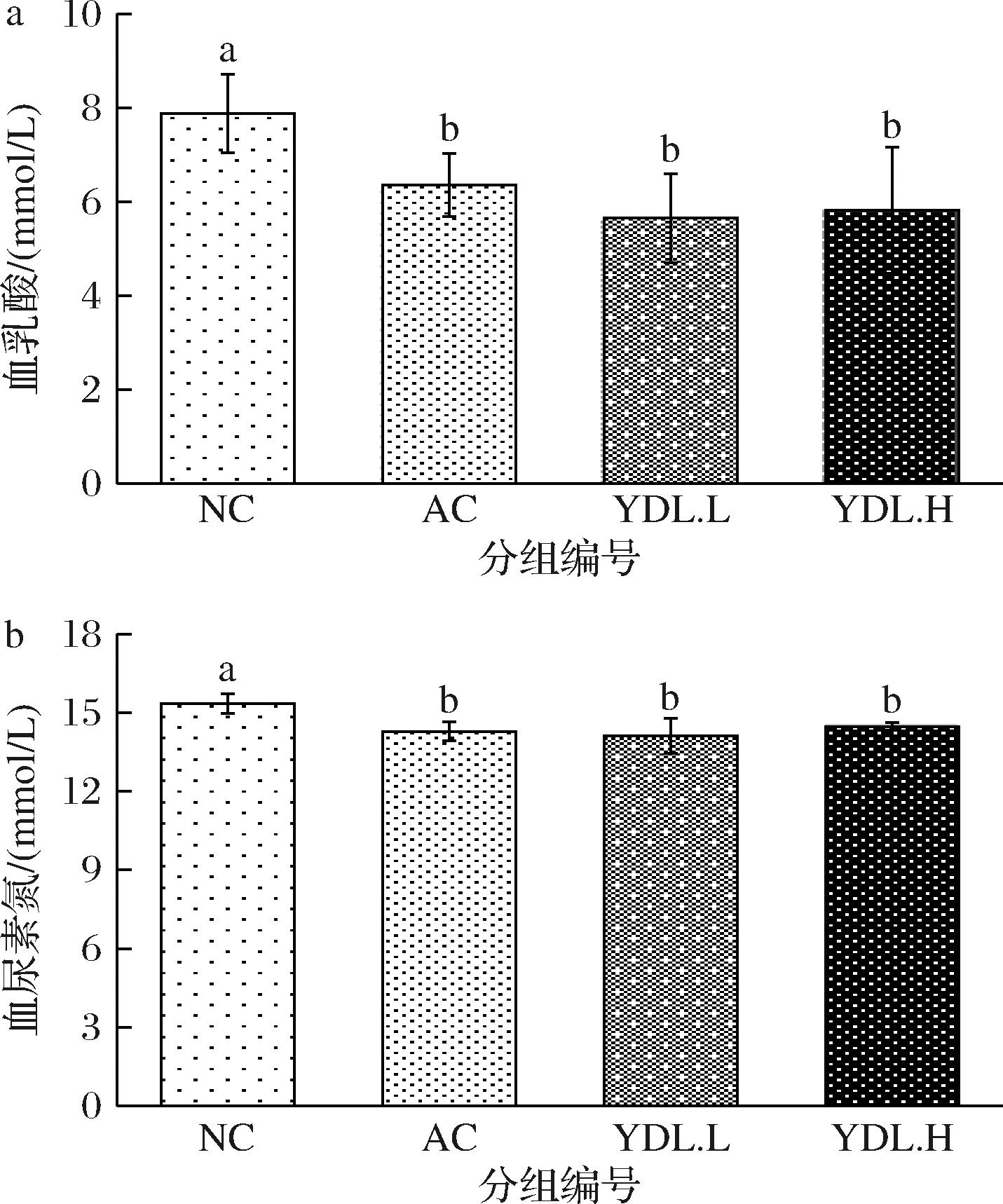
a-血乳酸;b-血尿素氮
图6 元动力和玛咖提取物对血清有害代谢
产物水平的影响
Fig.6 Effects of YDL and maca extract on serum harmful metabolites level
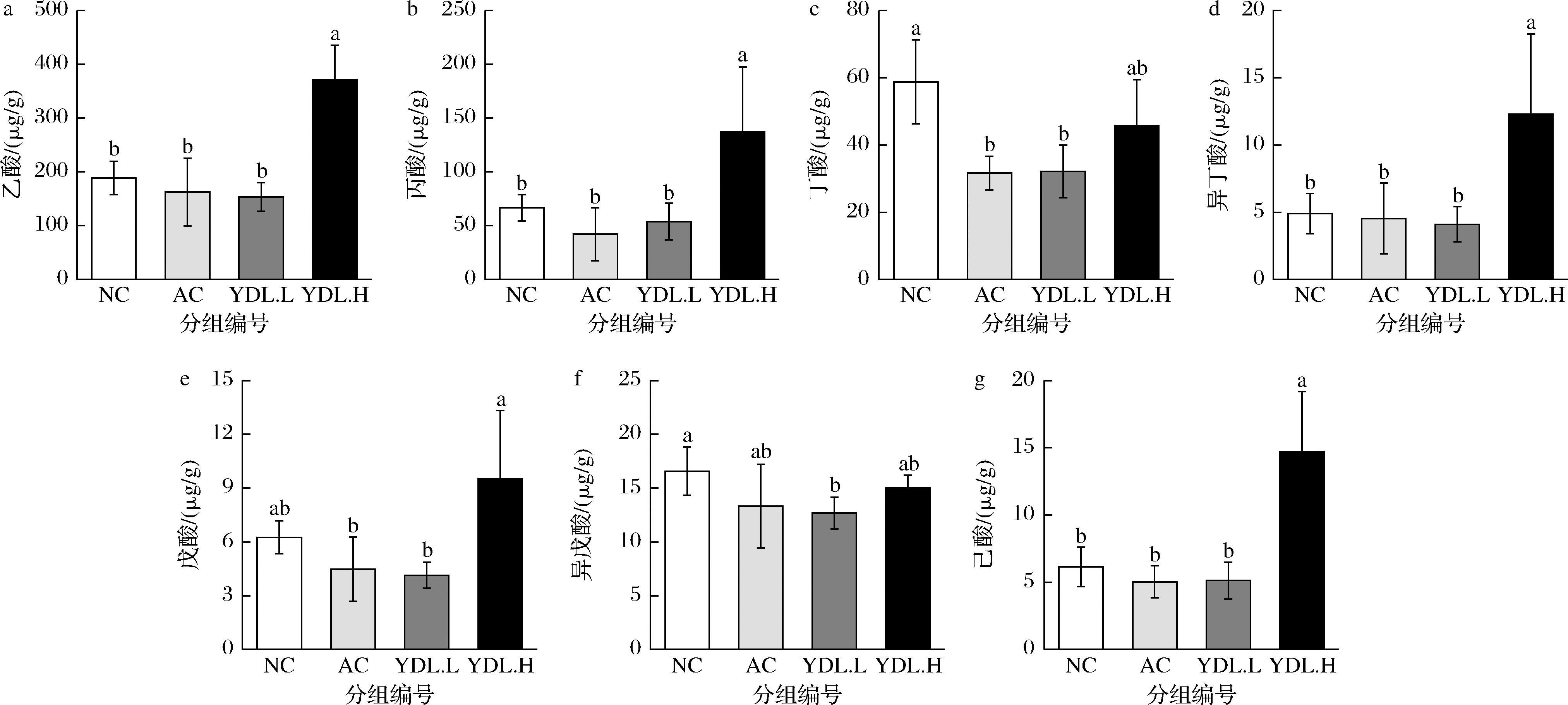
a-乙酸;b-丙酸;c-丁酸;d-异丁酸;e-戊酸;f-异戊酸;g-己酸
图7 元动力和玛咖对结肠组织中的短链脂肪酸含量的影响
Fig.7 Effects of maca and YDL on the SCFAs of colon
2.5 元动力对小鼠血清尿素氮和乳酸水平的影响
由图6可知,与NC组相比,AC组、YDL.L组和YDL.H组小鼠血尿素氮水平分别下降了6.9%、8.0%、5.7%,血乳酸水平分别下降了19.4%、28.3%、26.2%,和NC组相比均具有统计学意义(P<0.05)。与AC组相比,YDL.L组和YDL.H组血乳酸含量分别下降11.1%、8.5%,但差异不显著(P>0.05)。说明玛咖和元动力能够降低运动中有害代谢产物的积累。
2.6 元动力对小鼠结肠组织和粪便中短链脂肪酸浓度水平的影响
结肠组织中短链脂肪酸浓度水平如图7所示,与NC组相比,YDL.H组乙酸、丙酸、异丁酸、戊酸、己酸显著升高(P<0.05),分别升高了96.6%、105.9%、151.4%、52.4%、139.5%。与NC组相比,AC组和YDL.L组丁酸分别降低46.2%、45.2%(P<0.05),异戊酸分别降低19.6%、23.6%。与玛咖提取物相比,YDL.H组乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸、己酸分别升高了128.1%、226.5%、44.6%、170.8%、112.8%、12.6%、192.3%。说明高剂量元动力能够增加结肠组织中乙酸、丙酸、异丁酸、戊酸、己酸浓度水平,且较玛咖干预作用更明显。
粪便中短链脂肪酸结果如图8所示,与NC组相比,YDL.L组乙酸和戊酸浓度水平分别显著下降35.7%、21.4%(P<0.05);AC组、YDL.L组和YDL.H组丁酸分别升高51.8%、78.1%、91.1%(P<0.05),与肠道中丁酸水平呈相反趋势。与NC组相比,AC组、YDL.L组和YDL.H组己酸分别下降55.8%、51.3%、55.6%,差异显著(P<0.05)。各组肠道中丙酸、异戊酸无显著性差异(P>0.05)。
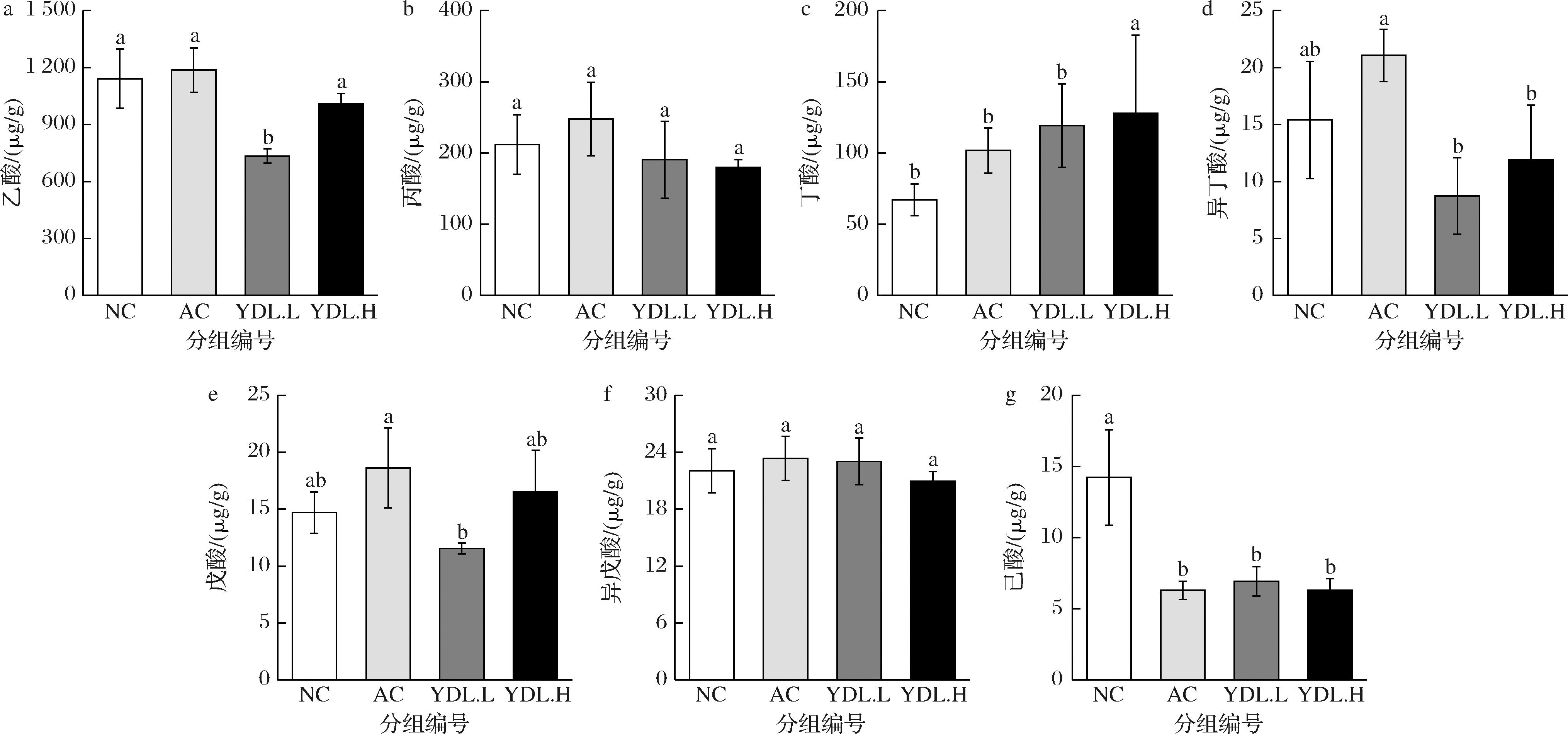
a-乙酸;b-丙酸;c-丁酸;d-异丁酸;e-戊酸;f-异戊酸;g-己酸
图8 元动力和玛咖对粪便中的短链脂肪酸含量的影响
Fig.8 Effects of maca and YDL on the SCFAs of feces
2.7 小鼠整体能量代谢与短链脂肪酸生成的相关性分析
如图9所示,尾部温度与粪便中的丁酸含量呈显著正相关(P<0.05),和粪便中己酸含量呈显著负相关(P<0.05);背部温度与粪便中己酸含量呈显著负相关(P<0.05)。
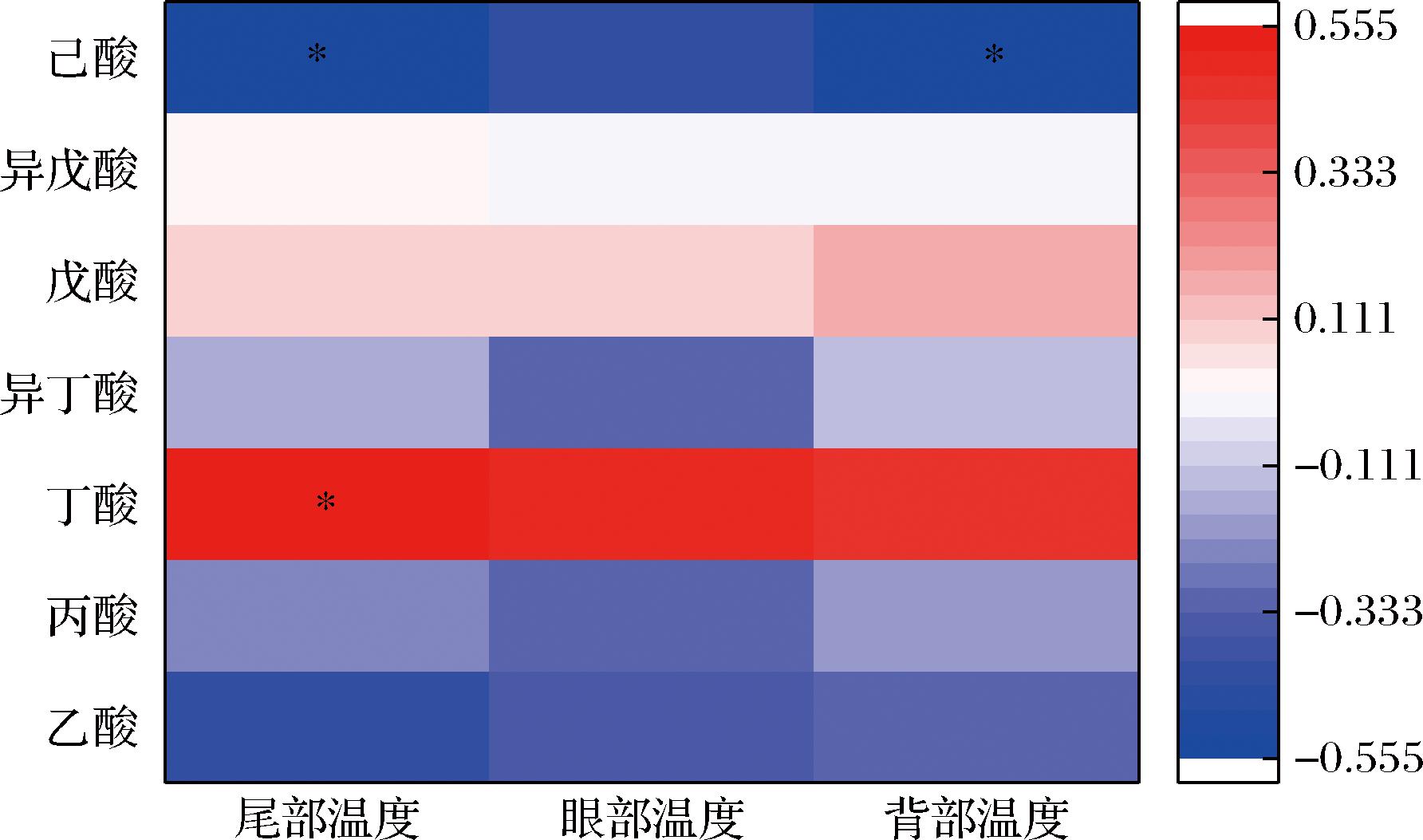
图9 小鼠身体温度与粪便中短链脂肪酸含量的皮尔森门相关性分析
Fig.9 Heatmap of correlations between body temperature and short-chain fatty acids content in feces
3 结论与讨论
元动力主要成分为糖类、脂肪酸、5-羟甲基糠醛(5-hydroxymethylfurfural,5-HMF)、人参皂苷、姜酚。虽然膳食多糖、膳食脂肪酸和人参皂苷已在过去的研究中被证实具有一定的抗疲劳作用[6-7],但单个的较低剂量的上述化合物在实践中并不能较大幅度地提高运动耐力。本研究基于中药组方的启示,将它们按一定比例进行组合制成元动力组合物,探究其对运动耐力的影响。研究结果发现,元动力组合物能够显著提高小鼠运动耐力,且其作用效果显著优于玛咖提取物。相对于单组分物质,多组分物质能够同时高效干预多个作用靶标,可能是元动力高效提高了运动耐力的原因。5-HMF占元动力含量的13.5%,5-HMF在过去被认为是食品加工产生的不良产物,近年来越来越多研究表明5-HMF对人体健康有着积极作用[8-9]。中草药具有广泛的生理活性作用,在煎煮过程中会发生美拉德反应和焦糖化反应从而生成HMF[10]。HMF可能是元动力及各类中草药发挥生理活性作用的关键成分之一。中草药及药食同源组合物具有成分复杂、作用途径多、作用靶点多的特点,解析中草药及药食同源组合物各类生理活性的具体作用机制极具挑战性,通过解析HMF的生理活性作用能够为药食同源食品的作用机制提供新的研究思路。
本研究发现YDL.H组提高了小鼠结肠组织中乙酸、丙酸、异丁酸、戊酸、己酸的浓度。短链脂肪酸能够作为直接能量物质,为机体提供能量[11]。结肠产生的短链脂肪酸大部分被吸收到结肠细胞中供其使用,为结肠细胞提供70%所需的能量[12]。短链脂肪酸不仅能够作为直接能量来源,并可参与糖异生、脂肪合成等代谢途径,从而促进全身能量稳态[13-14]。肠道中生成的短链脂肪酸能够通过肠道黏膜和肝门静脉进入体循环在全身范围内发挥相应的功能[12,15]。HU等[16]发现短链脂肪酸中的乙酸盐能够通过激活棕色脂肪细胞中的GPR43受体导致脂肪和线粒体生物生成,从而增加机体能量代谢;MURAKAMI等[17]发现丙酸盐可显著增加解偶联蛋白1的基因和蛋白质表达,从而增加骨骼肌细胞的产热能力和能量代谢。说明元动力能够通过增加结肠组织中乙酸、丙酸、异丁酸等短链脂肪酸生成从而达到促进能量代谢的作用。高剂量元动力干预后结肠组织中戊酸、己酸浓度同样显著升高,但戊酸、己酸在肠道健康中作用目前尚不完全明确,其与元动力提高耐力运动表现是否有关,尚待进一步研究。
本研究发现高剂量元动力干预后粪便中丁酸浓度显著升高,粪便短链脂肪酸浓度在一定程度上能够代表机体产生短链脂肪酸水平,说明元动力的干预能够促进丁酸生成。ZHANG等[18]发现丁酸盐能够激活产热相关通路以调节体温和全身能量消耗,但该研究没有从机体整体变化来阐释该现象。CRANE等[19]证实全身能量代谢的变化与通过红外成像检测到的产热之间存在很强的正相关性,因此通过红外热成像技术对小鼠全身能量代谢变化进行监测具有可行性。本研究通过红外热成像图像发现,灌胃高剂量元动力有助于小鼠整体能量代谢提高,其中元动力干预组的背部、尾部、眼部温度都显著高于空白对照组。小鼠正常体温范围为36~38.5 ℃[20],元动力的干预并没有使其高于正常体温范围,而是在正常范围内波动。据报道肌肉工作时所消耗的能量仅有20%转化为机械功[21],其余转化为热能,小鼠核心温度增加可能是肌肉工作时的副产物热能增加的结果。元动力可能通过增加肌肉糖原代谢从而使得机体整体能量代谢增加。通过红外热成像图可观察到,元动力干预后小鼠尾部温度显著增加。虽然已有研究表明肠道菌群产生的丁酸盐与体温之间的直接联系[22],为了确定小鼠肠道短链脂肪酸生成水平与能量代谢之间的相关性,本研究对小鼠粪便短链脂肪酸含量与身体各部位温度进行皮尔森相关性分析。结果表明乙酸、丙酸、异丁酸、戊酸、异戊酸与机体能量代谢无显著相关性,而小鼠尾部温度与粪便中的丁酸含量呈显著正相关,说明元动力提高小鼠的尾部温度的作用途径与肠道丁酸产生具有相关性。元动力可能通过影响肠道短链脂肪酸生成提高小鼠能量代谢。据报道耐力运动过程中氧自由基产生过多会导致脂质和蛋白质过氧化,肌肉细胞膜成分破坏,从而扰乱肌肉运动功能[23]。本研究中同样发现空白组的肌肉细胞膜不清晰,肌肉细胞变形且排列紊乱。据报道肠道产生的短链脂肪酸能够有效减少氧化应激[24],本研究推测短链脂肪酸能够通过减少氧化应激减轻运动中的肌肉损伤,这可能是元动力减少肌肉损伤的主要原因之一。
综上所述,低、高剂量的元动力28 d干预后小鼠负重力竭游泳时间显著延长,整体能量代谢显著提高,肌肉细胞变形和破裂减轻,肌糖原含量增加,血清中尿素氮、乳酸含量减少,粪便中丁酸含量升高,并且尾部温度与粪便中的丁酸含量呈显著正相关;低、高剂量的元动力干预可能通过增加肠道丁酸生成提高整体能量代谢从而提高运动耐力。
[1] SJÖQVIST F, GARLE M, RANE A.Use of doping agents, particularly anabolic steroids, in sports and society[J].Lancet, 2008, 371(9627):1872-1882.
[2] 臧振雷. 肌酸运动营养品对体育运动员运动能力的影响[J].食品研究与开发, 2021, 42(17):229-230.
ZANG Z L.Effect of creatine sports nutrition on sports ability of athletes[J].Food Research and Development, 2021, 42(17):229-230.
[3] FRITZEN A M, LUNDSGAARD A M, KIENS B.Tuning fatty acid oxidation in skeletal muscle with dietary fat and exercise[J].Nature Reviews.Endocrinology, 2020, 16(12):683-696.
[4] LIM W C, SHIN E J, LIM T G, et al.Ginsenoside Rf enhances exercise endurance by stimulating myoblast differentiation and mitochondrial biogenesis in C2C12 myotubes and ICR mice[J].Foods, 2022, 11(12):1709.
[5] WANG C, YUE F, KUANG S H.Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining[J].Bio-protocol, 2017, 7(10):e2279.
[6] WILSON P B.Does carbohydrate intake during endurance running improve performance? A critical review[J].Journal of Strength and Conditioning Research, 2016, 30(12):3539-3559.
[7] STUPIN M, KIBEL A, STUPIN A, et al.The physiological effect of n-3 polyunsaturated fatty acids (n-3 PUFAs) intake and exercise on hemorheology, microvascular function, and physical performance in health and cardiovascular diseases;is there an interaction of exercise and dietary n-3 PUFA intake?[J].Frontiers in Physiology, 2019, 10:1129.
[8] LEE C H, CHEN K T, LIN J A, et al.Recent advances in processing technology to reduce 5-hydroxymethylfurfural in foods[J].Trends in Food Science &Technology, 2019, 93:271-280.
[9] KONG F H, LEE B H, WEI K.5-hydroxymethylfurfural mitigates lipopolysaccharide-stimulated inflammation via suppression of MAPK, NF-κB and mTOR activation in RAW 264.7 cells[J].Molecules, 2019, 24(2):275.
[10] GAO H F, WEN X S, XIAN C J.Hydroxymethyl furfural in Chinese herbal medicines:Its Formation, presence, metabolism, bioactivities and implications[J].African Journal of Traditional, Complementary and Alternative Medicines, 2015, 12(2):43.
[11] CANI P D, VAN HUL M, LEFORT C, et al.Microbial regulation of organismal energy homeostasis[J].Nature Metabolism, 2019, 1(1):34-46.
[12] KIM C H.Control of lymphocyte functions by gut microbiota-derived short-chain fatty acids[J].Cellular &Molecular Immunology, 2021, 18(5):1161-1171.
[13] CAREY R A, MONTAG D.Exploring the relationship between gut microbiota and exercise:Short-chain fatty acids and their role in metabolism[J].BMJ Open Sport &Exercise Medicine, 2021, 7(2):e000930.
[14] SCHÖNFELD P, WOJTCZAK L.Short- and medium-chain fatty acids in energy metabolism:The cellular perspective[J].Journal of Lipid Research, 2016, 57(6):943-954.
[15] DALILE B, VAN OUDENHOVE L, VERVLIET B, et al.The role of short-chain fatty acids in microbiota-gut-brain communication[J].Nature Reviews.Gastroenterology &Hepatology, 2019, 16(8):461-478.
[16] HU J M, KYROU I, TAN B K, et al.Short-chain fatty acid acetate stimulates adipogenesis and mitochondrial biogenesis via GPR43 in brown adipocytes[J].Endocrinology, 2016, 157(5):1881-1894.
[17] MURAKAMI Y, OJIMA-KATO T, SABURI W, et al.Supplemental epilactose prevents metabolic disorders through uncoupling protein-1 induction in the skeletal muscle of mice fed high-fat diets[J].The British Journal of Nutrition, 2015, 114(11):1774-1783.
[18] ZHANG L, LIU C D, JIANG Q Y, et al.Butyrate in energy metabolism:There is still more to learn[J].Trends in Endocrinology and Metabolism:TEM, 2021, 32(3):159-169.
[19] CRANE J D, MOTTILLO E P, FARNCOMBE T H, et al.A standardized infrared imaging technique that specifically detects UCP1-mediated thermogenesis in vivo[J].Molecular Metabolism, 2014, 3(4):490-494.
[20] SANCHEZ-ALAVEZ M, ALBONI S, CONTI B.Sex- and age-specific differences in core body temperature of C57BL/6 mice[J].Age, 2011, 33(1):89-99.
[21] ABREU-VIEIRA G, XIAO C Y, GAVRILOVA O, et al.Integration of body temperature into the analysis of energy expenditure in the mouse[J].Molecular Metabolism, 2015, 4(6):461-470.
[22] WANG D, LIU C D, LI H F, et al.LSD1 mediates microbial metabolite butyrate-induced thermogenesis in brown and white adipose tissue[J].Metabolism:Clinical and Experimental, 2020, 102:154011.
[23] SLATTERY K, BENTLEY D, COUTTS A J.The role of oxidative, inflammatory and neuroendocrinological systems during exercise stress in athletes:Implications of antioxidant supplementation on physiological adaptation during intensified physical training[J].Sports Medicine, 2015, 45(4):453-471.
[24] LI G Y, JIN B H, FAN Z.Mechanisms involved in gut microbiota regulation of skeletal muscle[J].Oxidative Medicine and Cellular Longevity, 2022, 2022:2151191.