呋喃唑酮、呋喃西林和氯霉素因抗菌效果好,不易产生耐药性,曾作为广谱抗菌药物而广泛应用于畜禽养殖业,用于预防畜禽肠道传染病、皮肤创伤感染以及治疗伤寒等[1-2]。但这些残留在动物体内的禁用兽药会通过食物链蓄积在人体内,对人体健康构成潜在风险。例如,呋喃唑酮在机体内代谢残留标志物为3-氨基-2唑烷基酮,其能在弱酸条件下释放出来,抑制人体细胞内单胺氧化酶活性并产生致癌性化合物β-羟乙基肼[3];呋喃西林在机体内代谢残留标志物为氨基脲,在人体骨骼和主动脉中有慢性毒性[4];氯霉素可以透过胎盘屏障,对胎儿和新生儿可产生毒性反应,引发灰婴综合征[5]。因此,动物性食品中禁用兽药残留问题已成为世界各国关注的焦点和热点问题。澳大利亚、美国、欧盟等国家和地区均禁止在食用动物中使用上述药物[6-7],我国农业农村部公告第250号也明确指出:氯霉素及其盐、酯以及硝基呋喃类药物在所有可食用动物中不得检出。近年来,动物源性食品中兽药残留问题仍屡见不鲜,其中呋喃唑酮代谢物、呋喃西林代谢物和氯霉素是检出率较高的3种禁用兽药[8-10]。当前,我国作为畜禽肉生产和消费大国,肉类总产量约占世界总产量的30%左右,且以猪肉和鸡肉消费居多,其质量安全问题已严重影响到我国居民的身体健康和动物食品产业的可持续发展[11-12]。因此,建立高效经济且能同步测定畜禽肉中多种禁用兽药残留的快速检测方法就显得尤为迫切和重要。
迄今,动物源性食品中呋喃唑酮代谢物、呋喃西林代谢物及氯霉素残留的检测方法主要分为2大类。一类是仪器检测方法,如气相色谱法、液相色谱法以及各种色谱-质谱联用技术[13-17]。这些方法精密度、灵敏度高,可同时检测多种兽药残留,但该类法存在前处理复杂繁琐、需要专业人员操作、耗时长及成本高等不足,无法满足实时、现场、快速检测的要求[18]。另一类是利用抗原抗体特异性结合而建立的免疫学快速检测方法,此类方法操作简单快速,易于携带,适合于现场快速筛查。其中,胶体金免疫层析方法(colloidal gold immunochromatography assay, GICA)是目前应用最普遍的快速检测方法,已广泛应用于食品中药物残留现场监测,但因目前检测药物种类有限,无法满足高通量筛查的需求[19-20]。然而,胶体金多联检测卡的制备流程较为复杂,且影响因素众多[21-22]。例如,抗原包被浓度和抗体添加量过高,易产生非特异性结合和抑制率低的结果;吐温添加量和衍生化试剂浓度过高,会导致假阳性结果;合适的pH值对于金标抗体的制备也非常关键。因此,通过对检测体系的系列条件优化,有助于制备可同时检测多种兽药残留的多联检测卡。
本试验以猪肉和鸡肉作为研究对象,基于GICA法建立了一种可同时定性检测畜禽肉中呋喃唑酮代谢物、呋喃西林代谢物和氯霉素残留的快速检测方法,旨在为我国畜禽肉中多兽药残留的高通量快速检测以及食品安全提供科技支撑和技术保障。
1 材料与方法
1.1 材料与试剂
生鲜猪肉、鸡肉购于江苏省南京市农贸市场;阴性猪肉(抽样编号:LXJC032042023020003)和阴性鸡肉(抽样编号:LXJC032042023020006)由农业农村部肉及肉制品质量检验测试中心(南京)提供。
标准品溶液:呋喃唑酮代谢物、呋喃西林代谢物、呋喃它酮代谢物、呋喃妥因代谢物、莱克多巴胺、沙丁胺醇、克伦特罗、四环素、恩诺沙星、磺胺嘧啶、磺胺二甲基嘧啶、氯霉素碱、甲枫霉素、氟苯尼考,质量浓度均为100 μg/mL;氯霉素,质量浓度为100 μg/mL,天津阿尔塔科技有限公司。
试剂:呋喃西林代谢物抗原(antigen, Ag)、呋喃西林代谢物单克隆抗体(monoclonal antibody, mAb)、呋喃唑酮代谢物Ag、呋喃唑酮代谢物mAb、氯霉素Ag、氯霉素mAb、鸡免疫球蛋白Y(immunoglobulin Y, IgY)、羊抗鸡IgY(H+L),华测检测认证集团股份有限公司;乙酸乙酯、K2HPO4、Na2B4O7、KBH4、吐温-20、Na2HPO4·7H2O、NaH2PO4·2H2O(均为分析纯)、聚乙二醇(化学纯),国药集团化学试剂有限公司;柠檬酸钠、三羟甲基氨基甲烷(trometamol, Tris)、ProClinTM 300防腐剂(均为分析纯),美国Sigma-Aldrich公司;NaOH(分析纯),北京化工厂有限责任公司;牛血清白蛋白(bovine serum albumin, BSA),天津康源生物技术有限公司;浓HCl(质量分数约为37%)、氯金酸(分析纯),天津市科欧密化学试剂有限公司;邻硝基苯甲醛、海藻糖、蔗糖(均为分析纯),上海阿拉丁生化科技股份有限公司;试验用水均为超纯水。
1.2 仪器与设备
ACQUITY I-X超高效液相色谱串联质谱仪,美国Waters公司;FEI Tecnai G2 F30场发射透射电子显微镜,美国FEI公司;UV-1800紫外分光光度计,日本Shimadzu公司;arium® advance EDI纯水仪,德国Sartorious公司;HM3035 XYZ三维划膜喷金仪、ZQ2002微电脑斩切机、RB45玻璃纤维膜,上海金标生物科技有限公司;DHG-9140A电热鼓风干燥箱,上海一恒科学仪器有限公司;BG201吸水纸,深圳市安提生物科技有限公司;聚氯乙烯(polyvinyl chloride, PVC)底板,上海捷宁生物科技有限公司;AC-90硝酸纤维素(nitrocellulose filter, NC)膜,北京艾测星辉生物科技有限公司;LGJ-10冷冻干燥机,北京松源华兴科技发展有限公司;TGL-16高速冷冻离心机,四川蜀科仪器有限公司。
1.3 实验方法
1.3.1 胶体金溶液制备
参照文献[23]的方法,准确移取1 mL 10 g/L氯金酸溶液于300 mL超纯水中,100 ℃加热至沸腾,再加入3 mL 10 g/L柠檬酸钠溶液,混匀,保持沸腾30 min,待溶液颜色从黑逐渐变成酒红色且保持不变时,静置冷却至室温,然后将胶体金溶液用超纯水定容至300 mL,4 ℃避光保存。
1.3.2 胶体金质量鉴定
肉眼观察法:裸眼观察胶体金溶液的颜色、透明度和分散性,且底部是否产生沉淀,以此初步判定胶体金的质量[24]。
透射电镜法:准确移取20 μL胶体金溶液于附有超薄碳膜的铜网上,37 ℃孵育10 min后,用滤纸吸去残留液,待室温干燥后,将制备好的样品置于透射电镜中,观察胶体金颗粒大小和均匀度,有无颗粒的聚集情况,从而最终判定胶体金的质量[24]。
1.3.3 金标抗体制备与质量鉴定
参照文献[25]的方法,分别移取1 mL胶体金溶液于4个1.5 mL离心管中,用硼酸缓冲液调节至最适pH值。再分别加入羊抗鸡IgY、氯霉素mAb、呋喃唑酮代谢物mAb、呋喃西林代谢物mAb,混匀,室温静置30 min后,加入100 μL 0.1 g/mL BSA封闭30 min,4 ℃、12 500 r/min离心30 min,弃上清液,沉淀用金标抗体复溶液[0.1%(体积分数,下同)聚乙二醇,3%海藻糖、0.2% BSA、0.05% ProClinTM 300防腐剂和0.3% 吐温-20,由20 mmol/L pH值为8.0的Tris-HCl缓冲液配制]重悬,分别制备出4种金标抗体溶液。
参照文献[26]的方法,用扫描波长范围为450~750 nm的可见光扫描金标抗体溶液,观察其光谱曲线是否光滑,与胶体金相比在最大吸收峰处是否发生位置偏移,以此判定金标抗体是否制备成功。
1.3.4 GICA检测卡制备
GICA检测卡的结构如图1所示,具体制备步骤如下。
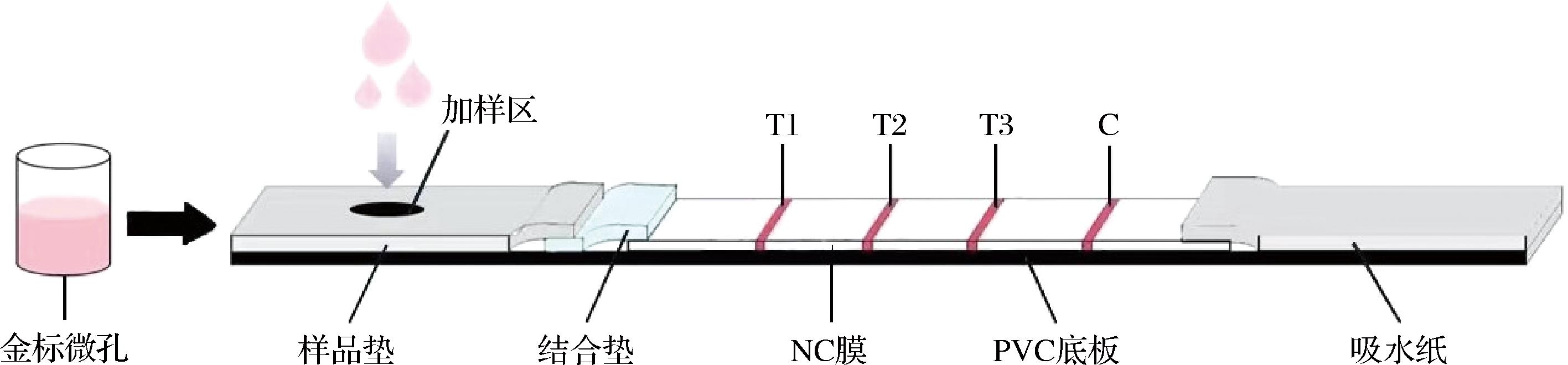
图1 GICA检测卡结构示意图
Fig.1 Schematic structure of GICA test card
金标微孔制备[25]:将4种金标抗体溶液等体积混匀,准确移取20 μL加入金标微孔,再加入50 μL冻干保护剂,混匀后置于冷冻干燥机中,-70 ℃预冻3 h,-55 ℃真空干燥24 h后备用。
NC膜包被:整个试验过程中喷涂量均设定为0.5 μL/cm。首先将呋喃唑酮代谢物Ag、呋喃西林代谢物Ag、氯霉素Ag按顺序依次喷涂在NC膜上作为检测线(T线),再将0.5 mg/mL鸡IgY喷涂到NC膜上作为质控线(C线),42 ℃烘干待用。
GICA检测卡组装:将NC膜、结合垫、样品垫、吸水纸按照顺序依次粘贴在PVC底板上,每个连接处均重叠1 mm,然后将组装好的长板切成4 mm宽的试纸条,装上外壳,密封干燥保存备用。
1.3.5 样品分析与结果判定
样品前处理:准确称取3.00 g(精确至0.01 g)均质样品于15 mL离心管中,加入2 mL 0.1 mol/L HCl溶液和0.2 mL衍生化试剂,摇匀至肉糜状,90 ℃衍生化10 min;加入2 mL 0.1 mol/L K2HPO4溶液和0.2 mL 1 mol/L的NaOH溶液,调节pH至7.0~7.5;加入4 mL乙酸乙酯,振荡提取1 min,4 000 r/min离心3 min,取2 mL上清液于5 mL离心管中,60 ℃氮吹至干,用1 mL正己烷和含0.1% 吐温-20的50 mmol/L Tris-HCl缓冲液(pH 8.0)复溶,涡旋混匀30 s,4 000 r/min离心3 min,下层作为待测液。
样品检测与结果判定:吸取150 μL待测液于金标微孔,反复轻柔吹吸30 s至微孔的试剂完全溶解,室温孵育2 min;从金标微孔中吸取80 μL反应液滴加于检测卡加样区,室温反应5 min,通过目视法对结果进行判定(图2)。若C线显色比T线强,则为阳性;若C线显色比T线弱或相当,则为阴性;若C线不显色,则检测结果无效。
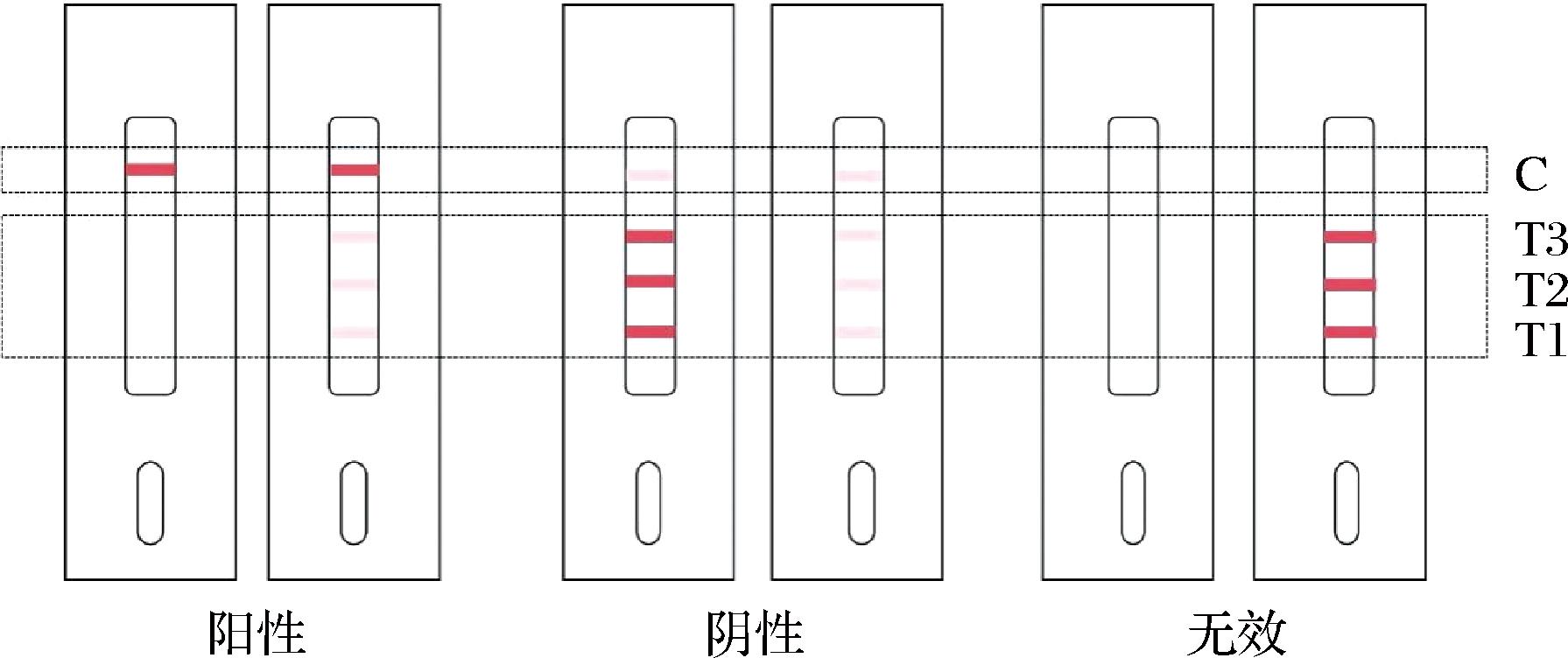
图2 目视判定示意图
Fig.2 Schematic diagram of visual determination
注:T1-呋喃唑酮代谢物;T2-呋喃西林代谢物;T3-氯霉素
1.3.6 GICA检测条件优化
抗原包被量的优化:将3种抗原用20 mmol/L磷酸缓冲液(pH 7.8)分别进行梯度稀释,共做4个梯度,即呋喃唑酮代谢物Ag:0.10、0.20、0.40、0.80 mg/mL;呋喃西林代谢物Ag:0.05、0.10、0.20、0.40 mg/mL;氯霉素Ag:0.05、0.10、0.20、0.40 mg/mL,并将其分别喷涂到NC膜上形成T线。将呋喃西林代谢物、呋喃唑酮代谢物、氯霉素的标准品溶液分别用甲醇稀释至100 ng/mL作为工作液,作为阳性对照,并以50 mmol/L Tris-HCl稀释液(pH 8.0)作为空白对照,按照1.3.5节进行样品前处理和分析检测。根据T线和C线显色以及加标抑制情况,确定抗原的最佳包被量。
抗体添加量的优化:为确保C线的显色稳定,在预实验基础上将羊抗鸡IgY添加量设定为4.0 μg,然后分别添加不同含量的呋喃唑酮代谢物mAb(2.0、4.0、6.0、8.0、10.0 μg)、呋喃西林代谢物mAb(1.0、2.0、3.0、4.0、5.0 μg)、氯霉素mAb(2.0、4.0、6.0、8.0、10.0 μg),按照1.3.3节制备金标抗体。将呋喃唑酮代谢物、呋喃西林代谢物、氯霉素的标准品溶液分别用甲醇稀释至100 ng/mL作为工作液,作为阳性对照,并以50 mmol/L Tris-HCl稀释液(pH 8.0)作为空白对照,按照1.3.5节进行样品前处理和分析检测。根据T线和C线显色以及加标抑制情况,确定金标抗体制备的最佳抗体添加量。
pH值的优化:将硼酸溶液与四硼酸钠溶液按不同的体积比分别配制成pH值范围为7.5~10.0的硼酸缓冲液,按照1.3.3节和1.3.5节分别进行金标抗体制备和分析检测。通过观察T线和C线的显色情况,确定金标抗体制备的最佳pH值。
衍生化试剂浓度的优化:将邻硝基苯甲醛用无水乙醇分别稀释为5、10、20、45 g/L的衍生化试剂,按照1.3.5节进行样品前处理和分析检测。通过观察T线和C线的显色情况,确定最佳衍生化试剂浓度。
吐温-20添加量的优化:分别移取0、10、30、50、70 μL 吐温-20于10 mL 50 mmol/L Tris-HCl稀释液(pH 8.0)中混匀,配制成不同浓度的复溶液。将样品复溶液与金标抗体混匀孵育2 min,滴加于检测卡加样区,并根据反应液的层析情况以及T线和C线的显色情况,确定样品复溶液中最佳表面活性剂的含量。
冻干保护剂的优化:在最佳pH值和抗体添加量条件下,按照1.3.3节制备金标抗体,对蔗糖、BSA和甘露醇的用量进行优化。选取4种冻干保护剂组合,分别为保护剂A(1.0 g蔗糖+0.5 g BSA+0.5 g甘露醇)、保护剂B(0.5 g蔗糖+1.0 g BSA+0.5 g甘露醇)、保护剂C(0.5 g蔗糖+0.5 g BSA+1.0 g甘露醇)和保护剂D(1.0 g蔗糖+1.0 g BSA+1.0 g甘露醇)。将上述4种冻干保护剂分别用10 mL 50 mmol/L Tris-HCl稀释液(pH 8.0)溶解,吸取50 μL与微孔中金标抗体混匀后冻干。采用50 mmol/L Tris-HCl稀释液(pH 8.0)作为样品待测液,按照1.3.5节进行样品前处理和分析检测,以不添加保护剂的金标抗体作为对照组,根据T线和C线的显色情况,分析不同冻干保护剂用量的保护效果。
1.3.7 性能评价
检出限:基于已建立的GICA方法,分别以阴性猪肉和鸡肉为基质,开展3种药物的系列梯度加标试验,即呋喃唑酮代谢物加标量:0.0、0.1、0.2、0.5、1.0、2.0、4.0 μg/kg;呋喃西林代谢物加标量:0.0、0.1、0.2、0.5、1.0、2.0、4.0 μg/kg;氯霉素加标量:0.0、0.02、0.05、0.1、0.2、0.5、1.0 μg/kg;按照1.3.5节对样品进行分析与结果判定,以T线颜色明显小于C线时的最低浓度作为本方法的检出限。
交叉反应:基于已建立的GICA方法,分别以阴性猪肉和鸡肉为基质,开展药物的交叉反应试验。选取呋喃唑酮代谢物和其他药物(呋喃西林代谢物、呋喃妥因代谢物、呋喃它酮代谢物、莱克多巴胺、沙丁胺醇、克伦特罗、氯霉素),各药物加标量均为0.2、0.5、5.0 μg/kg;呋喃西林代谢物和其他药物(呋喃唑酮代谢物、呋喃妥因代谢物、呋喃它酮代谢物、四环素、恩诺沙星、磺胺嘧啶、磺胺二甲基嘧啶),各药物加标量均为0.2、0.5、5.0 μg/kg;氯霉素的结构类似药物和硝基呋喃类代谢物(氯霉素碱、甲枫霉素、氟苯尼考、呋喃西林代谢物、呋喃妥因代谢物、呋喃它酮代谢物、呋喃唑酮代谢物),各药物加标量均为0.05、0.1、1.0 μg/kg,按照1.3.5节对样品进行分析与结果判定,以验证该方法的交叉反应情况。
与参比方法一致性分析:随机选取阴性猪肉和鸡肉各4份,每个基质分别设置3个加标样品(呋喃唑酮代谢物加标量:0.5、1.0、2.0 μg/kg;呋喃西林代谢物加标量:0.5、1.0、2.0 μg/kg;氯霉素加标量:0.1、0.2、0.5 μg/kg)和1个空白样品。采用本方法和国家现行有效标准(GB/T 21311—2007《动物源性食品中硝基呋喃类药物代谢物残留量检测方法 高效液相色谱/串联质谱法》、GB/T 22338—2008《动物源性食品中氯霉素类药物残留量测定》)对同一样品进行测定,以分析评价该方法与参比方法的一致性。
稳定性:随机选取5个批次的检测卡干燥密封,分别置于4 ℃、25 ℃和37 ℃下储存,90 d后取出备用。选用1倍检出限加标样品(呋喃唑酮代谢物加标量:0.5 μg/kg;呋喃西林代谢物加标量0.5 μg/kg;氯霉素加标量:0.1 μg/kg)和阴性样品各6份,分别按照1.3.5节对样品进行分析与结果判定,以验证该方法的稳定性。
其他性能指标:选取阴性猪肉和鸡肉各100份。设置空白样品,0.5倍检出限、1倍检出限和2倍检出限3个浓度水平,每个基质每个浓度水平各25份。按照1.3.5节对样品进行分析与结果判定,并根据《食品快速检测产品符合性评价技术要求》(国市监食检规〔2023〕1号)[27]计算得出该方法的灵敏度、假阳性率、假阴性率。
1.3.8 方法的实际应用
选用市售生鲜猪肉和鸡肉各5份,按照1.3.5节对样品进行分析与结果判定,并采用参比方法对其检测结果进行确证,以评价该方法的实际应用效果。
2 结果与分析
2.1 胶体金质量鉴定
通过肉眼观察,胶体金溶液澄清透亮无杂质、呈现酒红色,初步判定胶体金制备成功(图3-a);从透射电镜扫描结果还可知,胶体金颗粒大小均匀,平均粒径为20 nm,说明胶体金制备成功(图3-b)。

a-溶液图;b-透射电镜图
图3 胶体金溶液图及透射电镜扫描图
Fig.3 Colloidal gold solution and TEM photos of colloidal gold
2.2 金标抗体质量鉴定
为鉴定金标抗体是否制备成功,采用紫外可见分光光度计对其进行光谱扫描。由图4可见,胶体金和金标抗体溶液的吸收光谱均为光滑曲线,胶体金的最大吸收峰出现在521 nm处,而胶体金标记的呋喃唑酮代谢物mAb、呋喃西林代谢物mAb、氯霉素mAb和羊抗鸡IgY的最大吸收峰则分别出现在526 nm、527 nm、525 nm和524 nm处。金标抗体的最大吸收峰发生红移说明其物质内部结构发生改变,证实金标抗体制备成功。
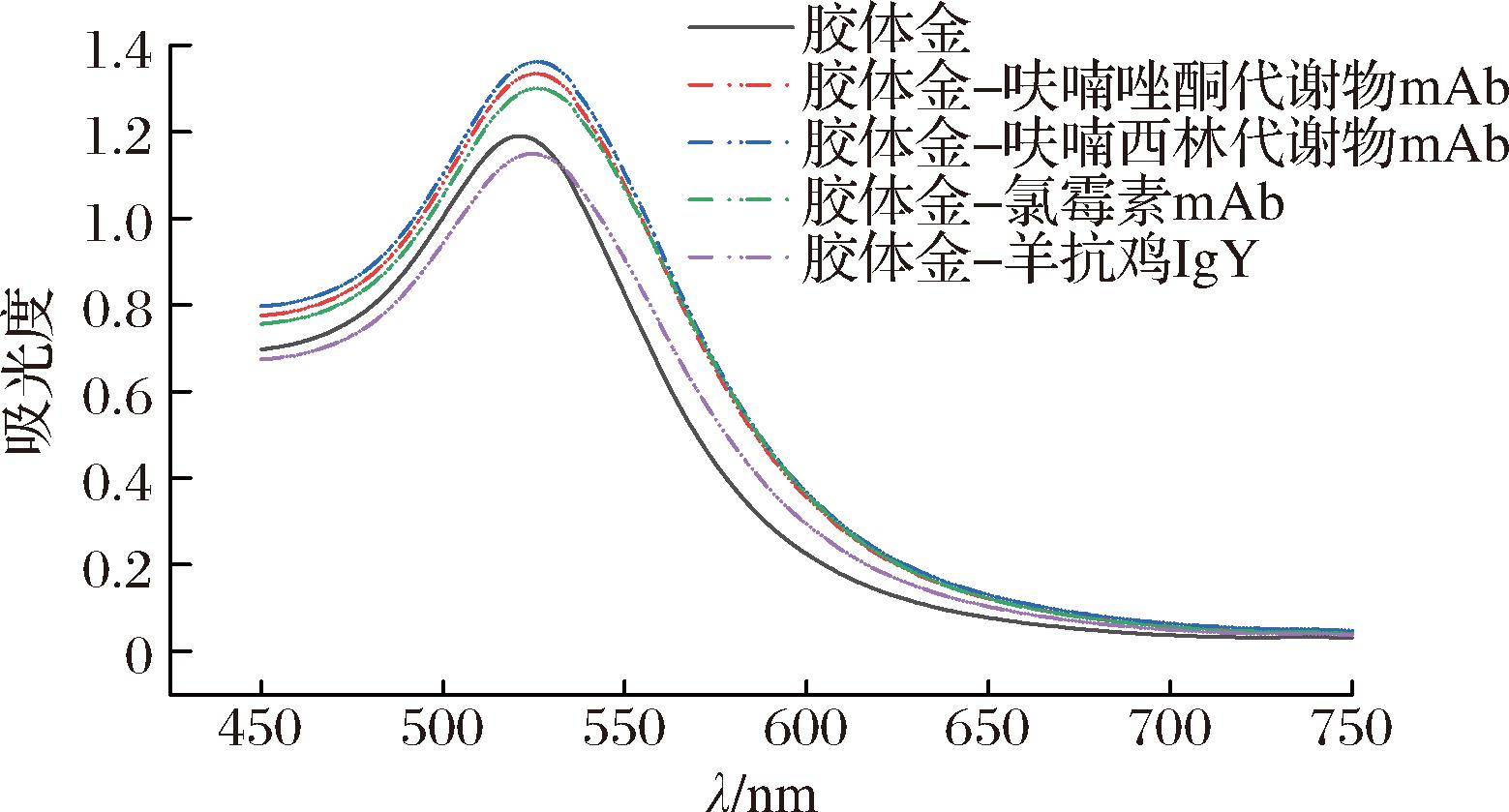
图4 胶体金与金标抗体的紫外可见吸收光谱
Fig.4 UV-visible absorption spectra of colloidal gold and gold-labeled antibodies
2.3 GICA检测条件优化
2.3.1 抗原包被量的优化
当抗原包被浓度过高时,抑制率不明显且存在非特异性结合现象;而当抗原包被浓度过低时,则易出现假阳性结果。由图5可知,当呋喃唑酮代谢物Ag、呋喃西林代谢物Ag、氯霉素Ag的包被量分别为0.20、0.10、0.10 mg/mL时,空白对照的T线显色清晰,且阳性对照的抑制效果好,未出现非特异性显色,可实现目视法判定。
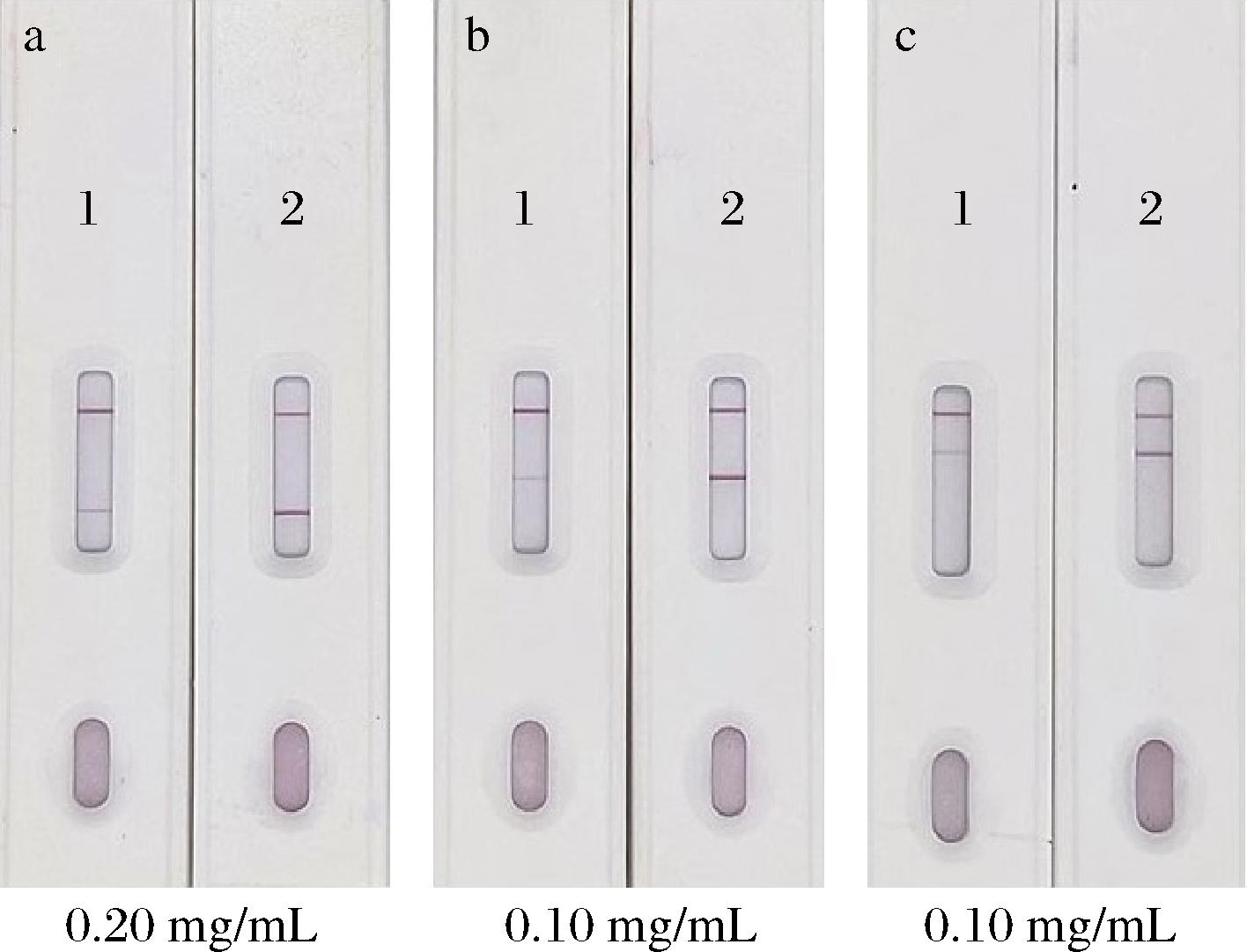
a-呋喃唑酮代谢物Ag;b-呋喃西林代谢物Ag;c-氯霉素Ag
图5 最适抗原包被量结果
Fig.5 Results of optimal antigen encapsulation
注:1-阳性对照;2-空白对照。
2.3.2 抗体添加量的优化
合适的抗体添加量有利于T线和C线显示高强度的颜色信号。当抗体添加量过多时,抑制率低且存在非特异性结合现象;而当抗体添加量过低时,则易产生假阳性结果。由图6可知,当呋喃唑酮代谢物mAb、呋喃西林代谢物mAb、氯霉素mAb的添加量分别为6.0、3.0、6.0 μg时,空白对照的T线显色清晰,且阳性对照的抑制效果好,未发生非特异性显色,可满足目视法判定。
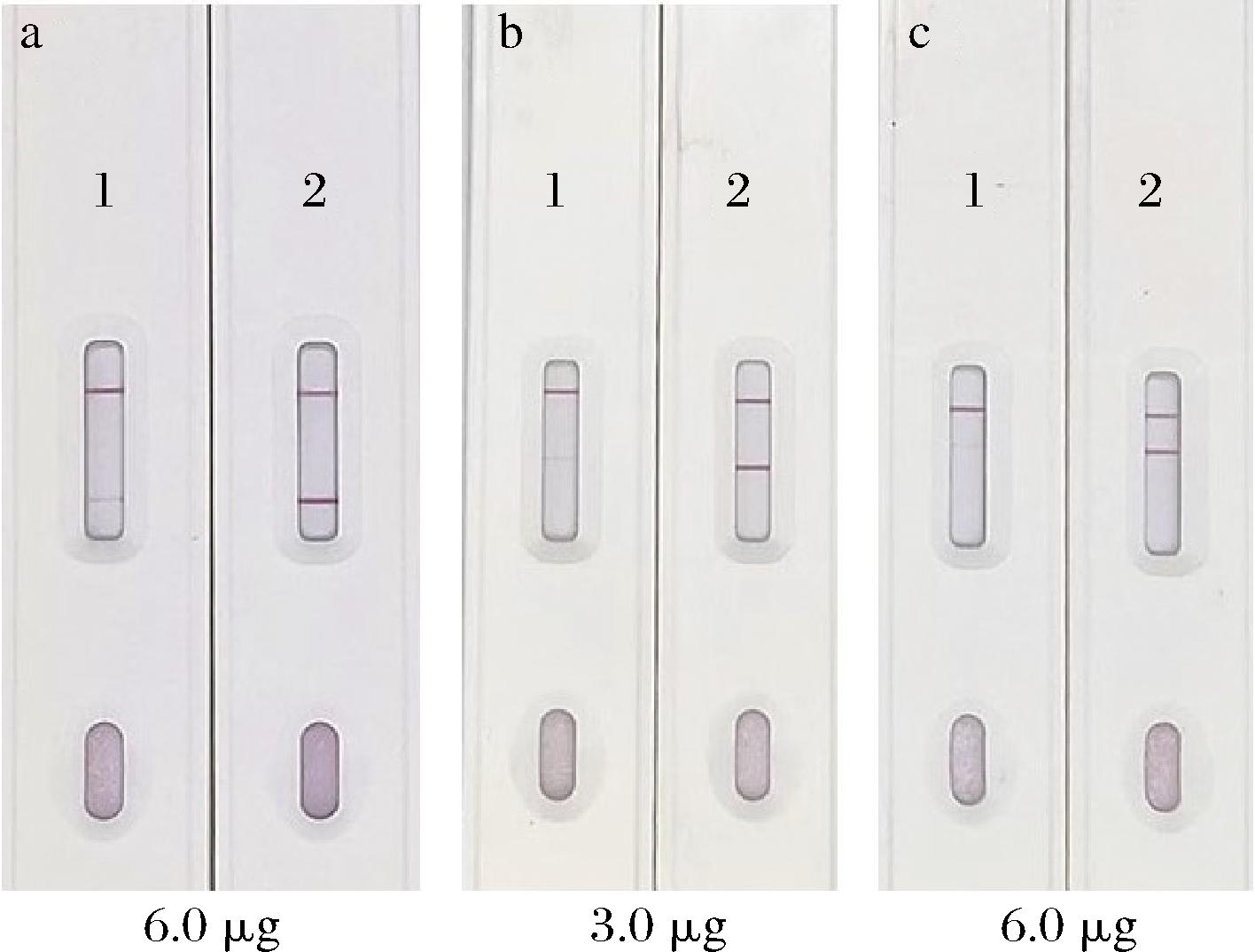
a-呋喃唑酮代谢物mAb;b-呋喃西林代谢物mAb;c-氯霉素mAb
图6 最适抗体添加量结果
Fig.6 Results of optimal antibody addition
注:1-阳性对照;2-空白对照。
2.3.3 pH值的优化
当胶体金的pH在抗体蛋白的等电点时,抗体蛋白与胶体金粒子能充分结合,不易发生聚集或沉淀,T线和C线显示高强度颜色信号;而当pH不适宜时,T线和C线均不显示或显示低强度颜色信号。因此,T线和C线颜色越深,表明结合能力越好,pH越合适。由图7可知,当胶体金溶液的pH值为8.1时,胶体金标记的氯霉素mAb和羊抗鸡IgY的显色强度最高;当胶体金溶液的pH值分别为8.7和9.0时,胶体金标记的呋喃唑酮代谢物mAb和呋喃西林代谢物mAb的显色强度最明显。因此,本试验分别选用8.7、9.0、8.1、8.1作为呋喃唑酮代谢物mAb、呋喃西林代谢物mAb、氯霉素mAb和羊抗鸡IgY金标抗体制备时的最适pH值。
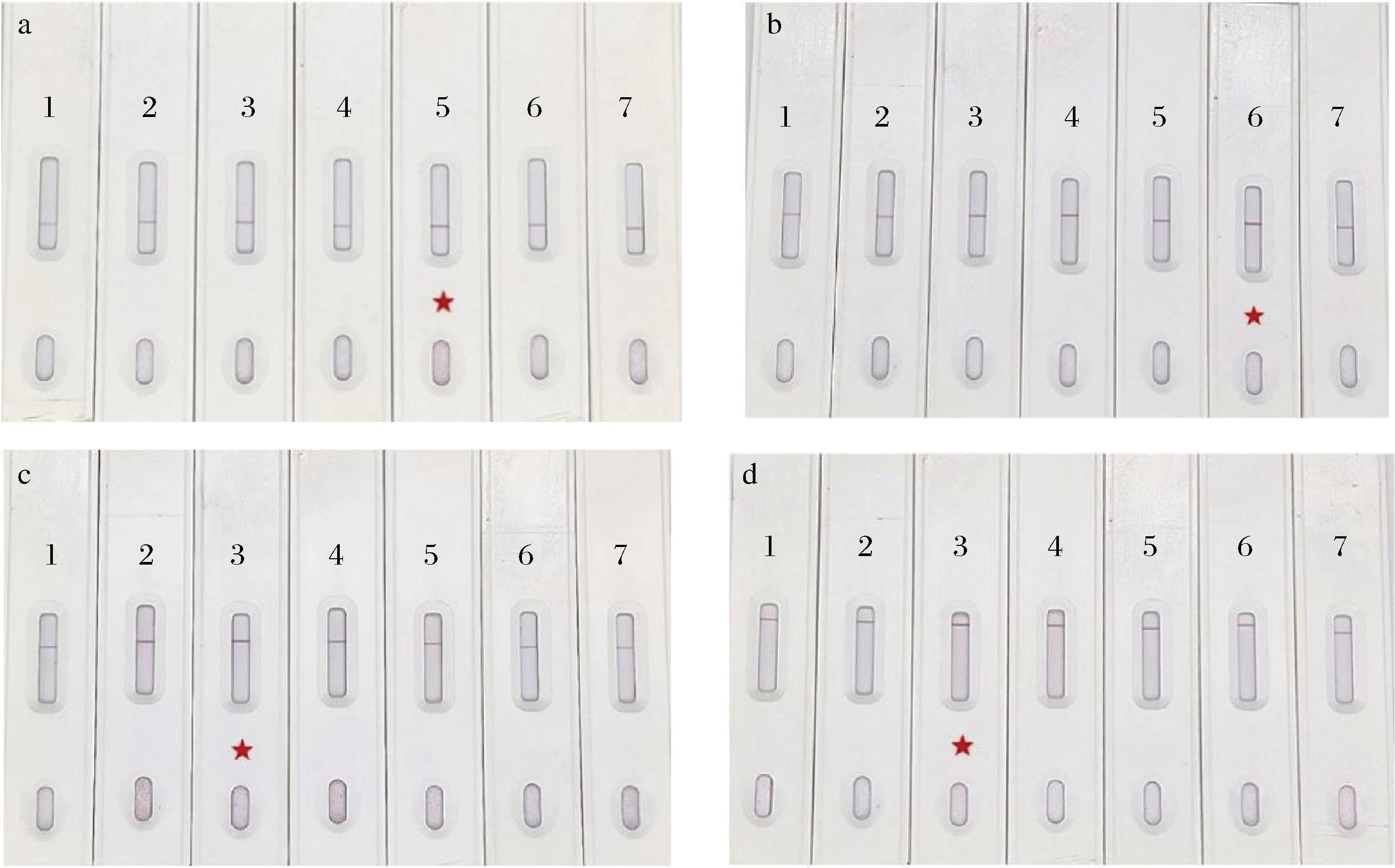
a-呋喃唑酮代谢物mAb;b-呋喃西林代谢物mAb;c-氯霉素mAb;d-羊抗鸡IgY
图7 pH值优化结果
Fig.7 Results of pH optimization
注:1~7表示pH值,分别为7.5、7.8、8.1、8.4、8.7、9.0、10.0。
2.3.4 衍生化试剂浓度的优化
衍生化作为检测硝基呋喃类药物代谢物的关键步骤,直接影响到检测结果的准确度。衍生化试剂浓度过高,T线不显示或显示低强度颜色信号,易导致结果出现假阳性;而当衍生化试剂浓度过低时,T线颜色越深但抑制率低。由图8可知,当衍生化试剂浓度为10 g/L时,空白对照的T显色清晰且阳性对照的抑制效果好,未发生非特异性显色,可满足目视法判定。因此,本试验选择10 g/L为最适衍生化浓度。

a-呋喃唑酮代谢物mAb;b-呋喃西林代谢物mAb;c-氯霉素mAb
图8 最适衍生化试剂浓度结果
Fig.8 Results of optimum density of derivatization reagent
注:1-阳性对照;2-空白对照。
2.3.5 吐温-20添加量的优化
吐温-20属于非离子型表面活性剂,适宜的吐温含量利于金标抗体在层析膜上充分释放,T线显示高强度颜色信号,但随着吐温含量的升高,T线显示低强度颜色信号,则会产生假阳性结果。由图9可知,当样品稀释液中不加吐温-20时,金标抗体在NC膜上发生堵塞;而当稀释液中添加吐温-20时,则堵塞现象消失。但同时也发现随着吐温-20添加量的增大,T线和C线的显色均有不同程度地减弱,影响其检测结果的准确性。因此,本试验选择堵膜现象消失时的最小添加量作为最适吐温-20添加量,即10 μL。
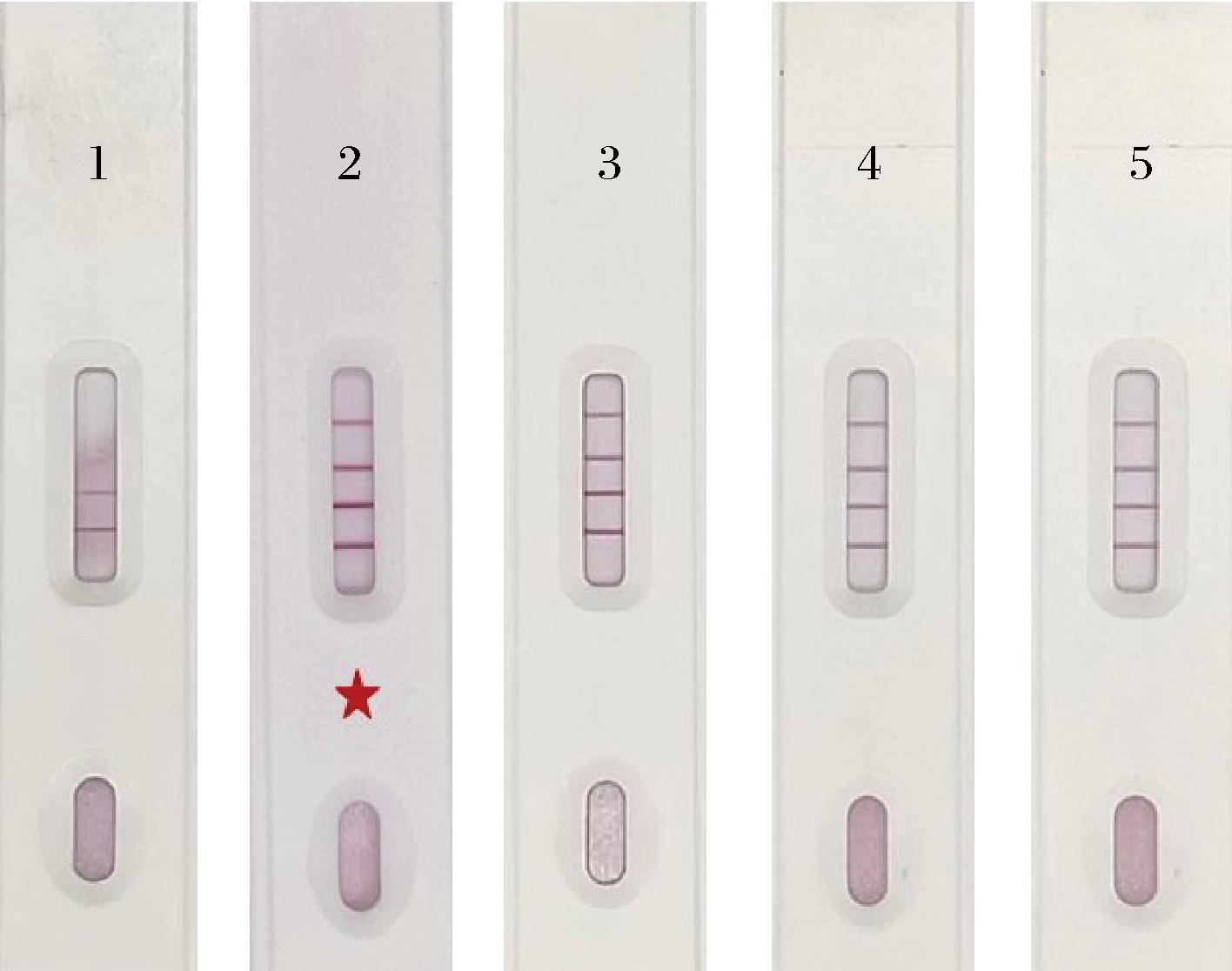
图9 吐温-20不同添加量的检测结果
Fig.9 Results of Tween-20 at different spiked levels
注:1~5代表吐温-20添加量,分别为0、10、30、50、70 μL。
2.3.6 冻干保护剂的优化
冻干保护剂在冷冻和干燥过程中,可以防止金标抗体变性,如糖类、多元醇类、蛋白质类等,而不同物质的配比可以影响到T线颜色深浅。由图10可知,直接冻干的金标抗体在检测时发生显色减弱,直接影响到目视判定;而添加保护剂的金标抗体虽显色清晰,但保护剂B、C、D却能引起胶体金颗粒聚沉,导致显色变黑,易出现假阴性判定。因此,本试验选择保护剂A(1.0 g蔗糖+0.5 g BSA+0.5 g甘露醇)作为金标抗体的冻干保护剂。
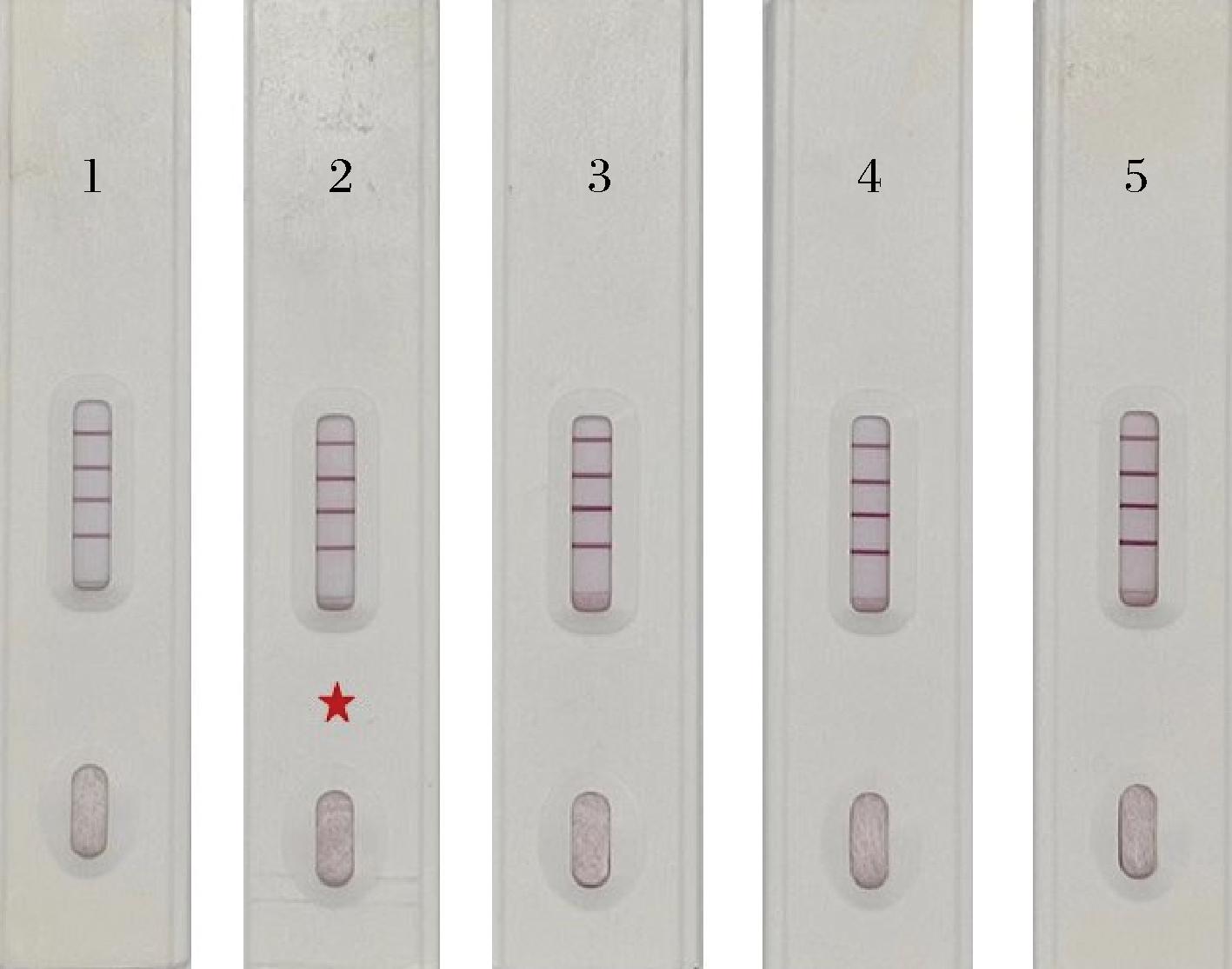
图10 不同冻干保护剂的检测结果
Fig.10 Results of different lyophilized protective agents
注:1~5分别代表未添加、保护剂A、保护剂B、保护剂C和保护剂D。
2.4 性能评价
2.4.1 检出限
由表1可知,呋喃唑酮代谢物、呋喃西林代谢物、氯霉素3种禁用药物在猪肉和鸡肉基质中的检出限均分别为0.5、0.5、0.1 μg/kg。
表1 三种禁用药物的检出限(n=3)
Table 1 Detection limit of 3 banned drugs (n=3)
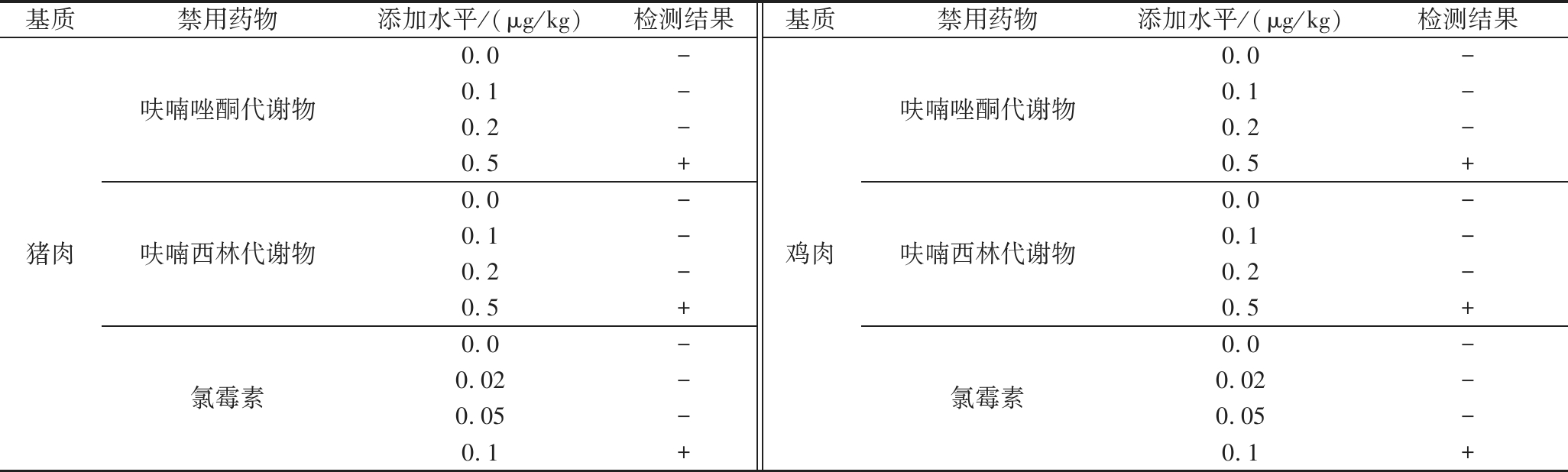
基质禁用药物添加水平/(μg/kg)检测结果基质禁用药物添加水平/(μg/kg)检测结果猪肉呋喃唑酮代谢物呋喃西林代谢物氯霉素0.0-0.1-0.2-0.5+0.0-0.1-0.2-0.5+0.0-0.02-0.05-0.1+鸡肉呋喃唑酮代谢物呋喃西林代谢物氯霉素0.0-0.1-0.2-0.5+0.0-0.1-0.2-0.5+0.0-0.02-0.05-0.1+
注:“+”阳性;“-”阴性(下同)。
2.4.2 交叉反应
由表2可知,呋喃唑酮代谢物与其结构类似物和其他药物在加标水平0.2~5 μg/kg时均无交叉反应;呋喃西林代谢物与其结构类似物和其他药物在加标水平0.2~5 μg/kg时均无交叉反应,氯霉素与其结构类似物和其他药物在加标水平0.05~1 μg/kg时均无交叉反应。
表2 交叉反应试验结果(n=3)
Table 2 Cross-reactivity results (n=3)

目标化合物结构类似药物和其他药物添加水平/(μg/kg)检测结果呋喃唑酮代谢物呋喃西林代谢物、呋喃妥因代谢物、呋喃它酮代谢物、莱克多巴胺、沙丁胺醇、克伦特罗、氯霉素0.2-0.5-5.0-
续表2
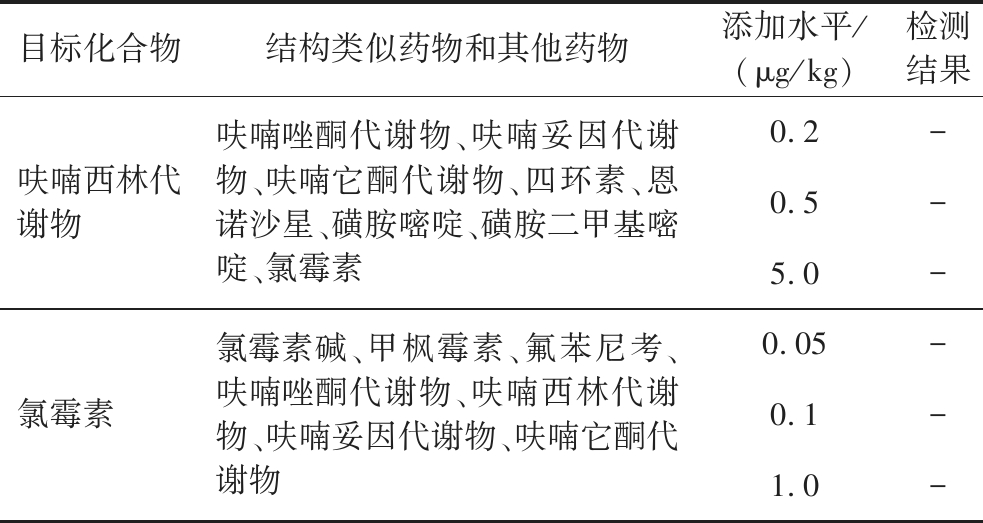
目标化合物结构类似药物和其他药物添加水平/(μg/kg)检测结果呋喃西林代谢物呋喃唑酮代谢物、呋喃妥因代谢物、呋喃它酮代谢物、四环素、恩诺沙星、磺胺嘧啶、磺胺二甲基嘧啶、氯霉素0.2-0.5-5.0-氯霉素氯霉素碱、甲枫霉素、氟苯尼考、呋喃唑酮代谢物、呋喃西林代谢物、呋喃妥因代谢物、呋喃它酮代谢物0.05-0.1-1.0-
2.4.3 与参比方法一致性分析
为证实GICA方法的准确性,分析比对本方法与参比方法的检测结果。由表3可知,GICA方法与参比方法的检测结果相同,符合率达到100%。
表3 GICA与参比方法检测样品中3种禁用药物的含量(n=3)
Table 3 Results of determination of 3 banned drugs in samples by GICA and comparison method (n=3)
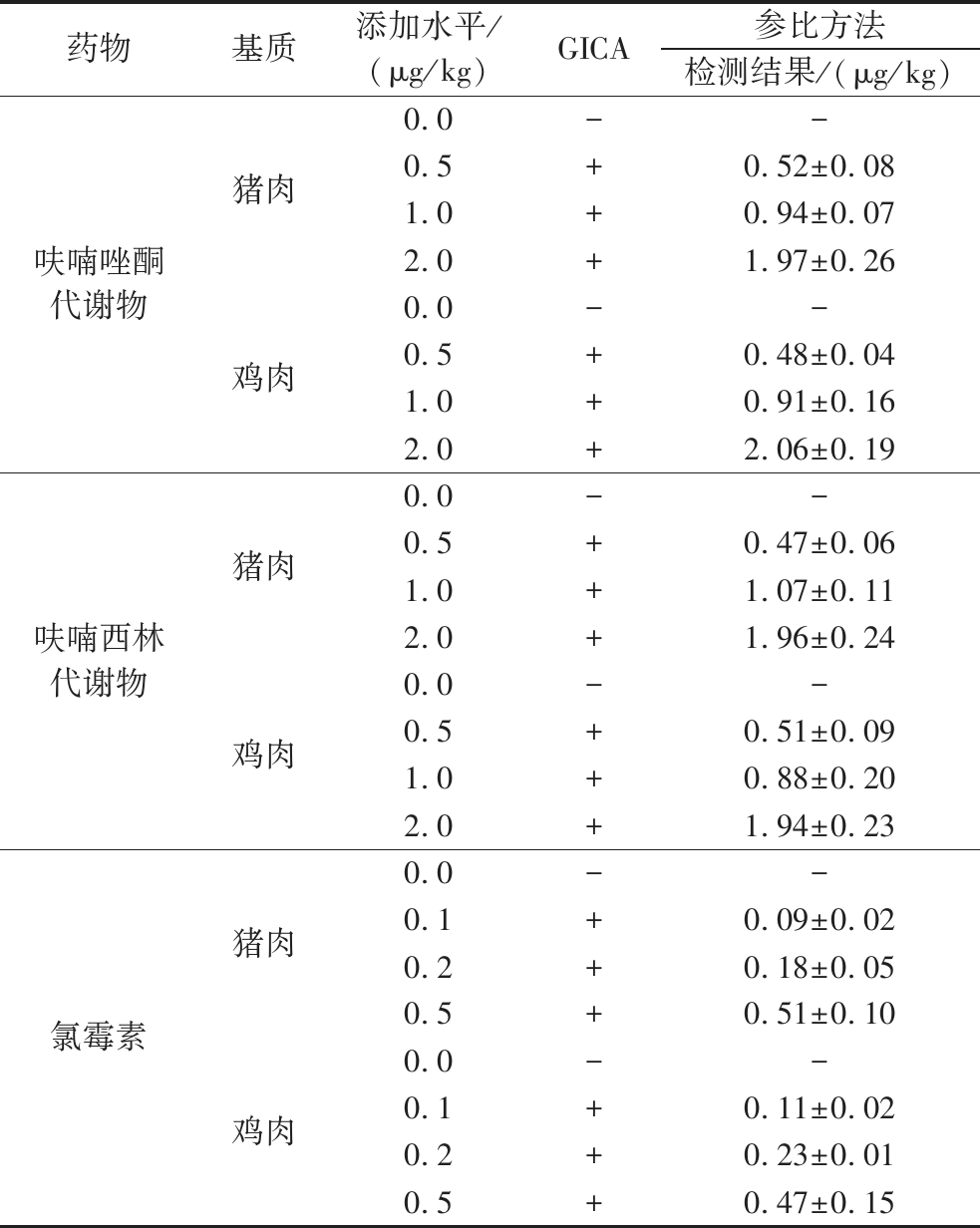
药物基质添加水平/(μg/kg)GICA参比方法检测结果/(μg/kg)呋喃唑酮代谢物猪肉鸡肉0.0--0.5+0.52±0.081.0+0.94±0.072.0+1.97±0.260.0--0.5+0.48±0.041.0+0.91±0.162.0+2.06±0.19呋喃西林代谢物猪肉鸡肉0.0--0.5+0.47±0.061.0+1.07±0.112.0+1.96±0.240.0--0.5+0.51±0.091.0+0.88±0.202.0+1.94±0.23氯霉素猪肉鸡肉0.0--0.1+0.09±0.020.2+0.18±0.050.5+0.51±0.100.0--0.1+0.11±0.020.2+0.23±0.010.5+0.47±0.15
2.4.4 稳定性
选用加标和阴性样品验证检测卡在不同温度下的储存稳定性。由表4可知,药物的添加水平为1倍检出限时,检测结果呈阳性,且检测同一样品时,不同批次检测卡检测结果相同。
表4 稳定性试验(n=6)
Table 4 Stability determination (n=6)

禁用药物添加水平/(μg/kg)检测结果4 ℃25 ℃37 ℃呋喃唑酮代谢物0.5+++呋喃西林代谢物0.5+++氯霉素0.1+++
根据阿伦尼乌斯经验公式,按照37 ℃下保存3个月等同于25 ℃下保存1年,可推算出该检测卡在室温、密封、干燥环境条件下至少可保存1年。
2.4.5 其他性能指标
本方法按照《食品快速检测产品符合性评价技术要求》计算各项性能指标。结果如表5所示,灵敏度≥98%、假阳性率≤2%、假阴性率≤2%。
表5 快速检测方法性能指标评价结果
Table 5 Performance index evaluation results of rapid detection methods
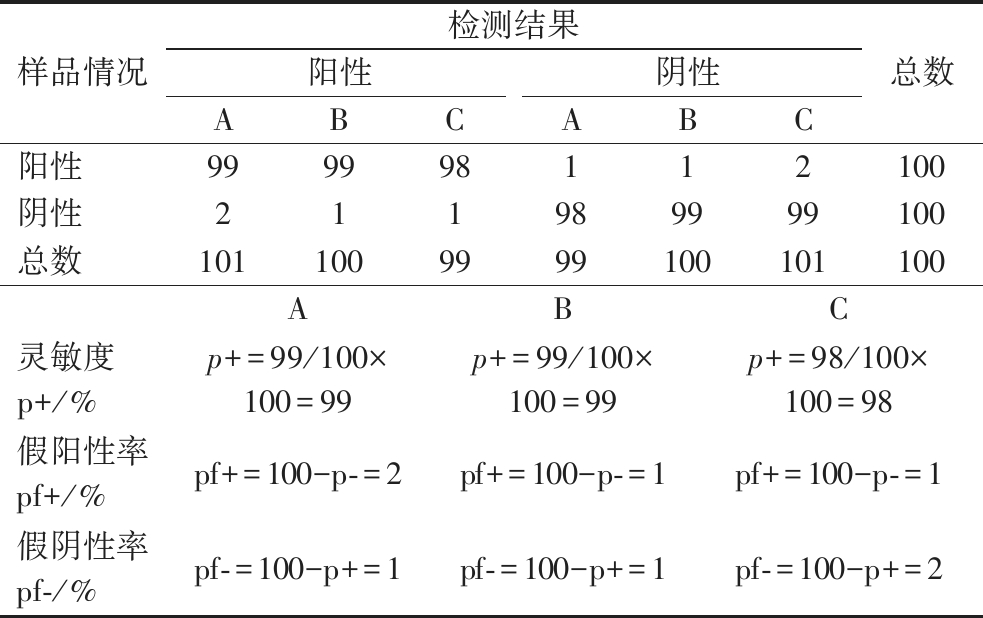
样品情况检测结果阳性阴性ABCABC总数阳性999998112100阴性211989999100总数1011009999100101100ABC灵敏度p+/%p+=99/100×100=99p+=99/100×100=99p+=98/100×100=98假阳性率pf+/%pf+=100-p-=2pf+=100-p-=1pf+=100-p-=1假阴性率pf-/%pf-=100-p+=1pf-=100-p+=1pf-=100-p+=2
注:A-呋喃唑酮代谢物;B-呋喃西林代谢物;C-氯霉素。灵敏度是指方法在实验条件下达到的实际检出限时,检出阳性结果的阳性样品数占总阳性样品数的百分比;假阳性率是指方法在实验条件下达到的检出限时,阴性样品中检出阳性结果的最大概率(以百分比计);假阴性率是指方法在实验条件下达到的检出限时,阳性样品中检出阴性结果的最大概率(以百分比计)。
2.5 方法的实际应用
为验证本方法的实际应用效果,在市场上随机各选取5份猪肉和鸡肉作为供试材料,采用本试验建立的方法进行检测。由表6可知,参比方法在1份猪肉中检出呋喃唑酮代谢物(2.36 μg/kg),1份鸡肉中检出呋喃西林代谢物(1.99 μg/kg),GICA检测结果也呈阳性,故GICA与参比方法检测结果一致。
表6 市售生鲜肉中药物残留的检测结果(n=3)
Table 6 Detection results of drug residues for municipal sold fresh meat (n=3)

基质样品序号GICA呋喃唑酮代谢物参比方法GICA呋喃西林代谢物参比方法GICA氯霉素参比方法猪肉1------2+2.36 μg/kg----3------4------5------鸡肉6------7------8--+1.99 μg/kg--9------10------
3 结论与讨论
目前,关于GICA同时测定猪肉和鸡肉中呋喃唑酮代谢物、呋喃西林代谢物和氯霉素3种兽药残留尚未见报道。本研究通过优化免疫试剂用量、pH值、衍生化试剂浓度、表面活性剂用量和冻干保护剂种类等因素,建立一种GICA定性同步检测猪、鸡肉中呋喃唑酮代谢物、呋喃西林代谢物、氯霉素残留的方法,并对检测卡的主要性能指标进行评价。研究结果表明,该方法的最低检出水平(检出限)等于参比方法的检出限水平(呋喃唑酮代谢物:0.5 μg/kg;呋喃西林代谢物:0.5 μg/kg;氯霉素:0.1 μg/kg),灵敏度≥98%,假阳性率≤2%,假阴性率≤2%,稳定性可以达到1年,并在市售食品检测时发现,该方法的检测结果与参比方法相一致,但样品前处理和检测时间可以从1~2 d缩短至35 min。
该方法采用GICA,一个检测卡用于同一样品中3种禁用兽药残留的检测,可以有效降低制作成本、缩短检测时间,较之单检技术更加方便快捷。因此,本方法的建立有助于解决畜禽肉中多种禁用兽药残留现场快速筛查的技术难题,同时也为其他药物残留检测技术研究提供新的思路和方法,对于我国动物性食品进出口贸易和保障人民群众身体健康具有重要意义。
[1] 王金明, 王冰聪, 曲婧喆, 等.动物源性食品中硝基呋喃检测方法分析[J].食品安全导刊, 2023(7):142-144.
WANG J M, WANG B C, QU J Z, et al.Analysis of ways and methods for rapid detection of antibiotic residues in animal-derived foods[J].China Food Safety Magazine, 2023(7):142-144.
[2] VURAN B, ULUSOY H I, SARP G, et al.Determination of chloramphenicol and tetracycline residues in milk samples by means of nanofiber coated magnetic particles prior to high-performance liquid chromatography-diode array detection[J].Talanta, 2021, 230:122307.
[3] TIMPERIO A M, KUIPER H A, ZOLLA L.Identification of a furazolidone metabolite responsible for the inhibition of amino oxidases[J].Xenobiotica;the Fate of Foreign Compounds in Biological Systems, 2003, 33(2):153-167.
[4] TAKAHASHI M, YOSHIDA M, INOUE K, et al.Chronic toxicity and carcinogenicity of semicarbazide hydrochloride in Wistar Hannover GALAS rats[J].Food and Chemical Toxicology:an International Journal Published for the British Industrial Biological Research Association, 2014, 73:84-94.
[5] WANG Y H, SONG W, ZHAO H Y, et al.DNA walker-assisted aptasensor for highly sensitive determination of Ochratoxin A[J].Biosensors &Bioelectronics, 2021, 182:113171.
[6] STOLKER A A M, BRINKMAN U A.Analytical strategies for residue analysis of veterinary drugs and growth-promoting agents in food-producing animals:A review[J].Journal of Chromatography.A, 2005, 1067(1-2):15-53.
[7] 徐一平, 胥传来.动物源食品中硝基呋喃类物质及其代谢物残留的检测技术研究[J].食品科学, 2007, 28(10):590-593.
XU Y P, XU C L.Determination overview on nitrofuran antibiotics and their metabolites residues in animal foods type[J].Food Science, 2007, 28(10):590-593.
[8] LI D, ZANG M, LI X, et al.A study on the food fraud of national food safety and sample inspection of China [J].Food Control, 2020, 116:107306.
[9] 刘青, 梁晓聪, 张巍, 等.2016—2019年陕西省动物源性食品中甲硝唑和氯霉素残留状况[J].卫生研究, 2021, 50(6):1019-1021;1024.
LIU Q, LIANG X C, ZHANG W, et al.Status of metronidazole and chloramphenicol residues in animal-derived foods in Shanxi province from 2016 to 2019[J].Journal of Hygiene Research, 2021, 50(6):1019-1021;1024.
[10] 林锏锐, 唐媛媛, 詹海毅, 等.2013—2018年湛江进出口水产品兽药残留结果分析[J].检验检疫学刊, 2019, 29(3):1-4.
LIN J R, TANG Y Y, ZHAN H Y, et al.Analysis of veterinary drug residue results of import and export aquatic products in Zhanjiang from 2013 to 2018[J].Journal of Inspection and Quarantine, 2019, 29(3):1-4.
[11] YANG Y F, ZHANG H, ZHOU G Y, et al.Risk assessment of veterinary drug residues in pork on the market in the People’s republic of China[J].Journal of Food Protection, 2022, 85(5):815-827.
[12] FEI Z X, SONG S F, GAO J, et al.Antibiotic residues in chicken meat in China:Occurrence and cumulative health risk assessment[J].Journal of Food Composition and Analysis, 2023, 116:105082.
[13] 胡红美, 郭远明, 孙秀梅, 等.超声波萃取-PSA净化-气相色谱法测定水产品中氯霉素[J].浙江海洋学院学报(自然科学版), 2016, 35(3):222-227.
HU H M, GUO Y M, SUN X M, et al.Determination of chloramphenicol and florfenicol in fishery products by gas chromatography combined with ultrasonic extraction and PSA purification[J].Journal of Zhejiang Ocean University (Natural Science), 2016, 35(3):222-227.
[14] ZHOU H, ZHANG M Y, CHEN Q Q, et al.Determination of amphenicol antibiotic residues in aquaculture products by response surface methodology modified QuEChERS method combined with UPLC-MS/MS[J].Microchemical Journal, 2023, 190:108729.
[15] YANG M, YI J, WEI C, et al.Rapid determination of nitrofuran metabolites residues in honey by ultrasonic assisted derivatization-QuEChERS-high performance liquid chromatography/tandem mass spectrometry[J].Journal of Food Composition and Analysis, 2022, 114:104812.
[16] LI X Q, LI H M, XU S, et al.Rapid quantification of trace chloramphenicol in honey under ambient conditions using direct analysis via real-time QTRAP mass spectrometry[J].Food Chemistry, 2019, 276:50-56.
[17] CHEN H Y, ZHANG L, HU Y, et al.Nanomaterials as optical sensors for application in rapid detection of food contaminants, quality and authenticity[J].Sensors and Actuators B:Chemical, 2021, 329:129135.
[18] 缪宇腾, 郁宏燕, 陆利霞, 等.动物源性食品中氯霉素残留检测方法进展[J].生物加工过程, 2020, 18(5):658-664.
MIAO Y T, YU H Y, LU L X, et al.Residual detection of chloramphenicol in animal derived food[J].Chinese Journal of Bioprocess Engineering, 2020, 18(5):658-664.
[19] 夏菲, 刘秀英, 高雪, 等.免疫层析技术在检测食品中硝基呋喃类药物的应用[J].中国食品学报, 2021, 21(11):397-409.
XIA F, LIU X Y, GAO X, et al.Application of immunochromatography in the detection of nitrofurans in food[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(11):397-409.
[20] 徐颖.胶体金免疫层析技术在食品检测中的应用研究[J].现代食品, 2022, 28(2):69-71.
XU Y.Application of colloidal gold immunochromatography in food detection[J].Modern Food, 2022, 28(2):69-71.
[21] WANG C, LI X M, PENG T, et al.Latex bead and colloidal gold applied in a multiplex immunochromatographic assay for high-throughput detection of three classes of antibiotic residues in milk[J].Food Control, 2017, 77:1-7.
[22] DONG X, GAO Y Q, ZHANG X, et al.Multiplex europium (III) nanoparticles immunochromatographic assay method for the detection of four nitrofuran metabolites in fish sample[J].Microchemical Journal, 2019, 150:104207.
[23] WU S M, YAN C X, FAN X H, et al.Development of enzyme-linked immunosorbent assay and colloidal gold-based immunochromatographic assay for the rapid detection of gentamicin in chicken muscle and milk[J].Chinese Journal of Analytical Chemistry, 2022, 50(10):100142.
[23] 陈殿.畜禽产品中氯霉素快速检测方法的建立[D].广州:华南农业大学, 2017.
CHEN D.The establishment of chloramphe nicol in the livestock product rapid detection method[D].Guangzhou:South China Agricultural University, 2017.
[24] 周嘉明, 封冰, 智军海.三氯杀螨醇胶体金免疫快速检测试纸条研制及在茶叶中的应用[J].食品安全质量检测学报, 2020, 11(15):5337-5342.
ZHOU J M, FENG B, ZHI J H.Development of dicofol colloidal gold immune rapid detection test strip and its application in tea[J].Journal of Food Safety &Quality, 2020, 11(15):5337-5342.
[25] 王佳.动物性食品中硝基呋喃类代谢物残留的定量免疫层析技术研究[D].重庆:西南大学, 2019.
WANG J.Immunochromatographic assays for quantitative determination of nitrofuran metabolite residues in animal-derived food[D].Chongqing:Southwest University, 2019.
[27] 国家市场监督管理总局. 市场监管总局关于规范食品快速检测使用的意见[EB/OL].[2023-01-29] https://www.samr.gov.cn/zw/zfxxgk/fdzdgknr/spcjs/art/2023/art_f6261b2078ba4f2fb68e028e7bead1f5.html.[2024-01-13].
State Administration for Market Regulation.Opinions of the State Administration for Market Regulation the Use of Rapid Food Testing[EB/OL].[2023-01-29] https://www.samr.gov.cn/zw/zfxxgk/fdzdgknr/spcjs/art/2023/art_f6261b2078ba4f2fb68e028e7bead1f5.html (in Chinese).[2024-01-13].