葡萄酒是一种成分复杂的发酵饮料,富含各种维生素、矿物质以及酚类物质等,由于其拥有独特的风味且具有一定保健功能而广受消费者喜爱[1]。O2在葡萄酒酿造到装瓶整个环节中起着重要的作用,适量的O2能够增强酿酒酵母活性,促进发酵,且有利于葡萄酒的成熟,过度氧化可使葡萄酒失去果香,发生褐变,从而降低葡萄酒的品质[2]。在酒精发酵过程中,酵母细胞受到环境胁迫(乙醇、酸、温度、金属离子等),引起胞内活性氧(reactive oxygen species,ROS)增加,过量ROS能够损坏细胞内的脂类、蛋白质、核酸等生物大分子物质,参与破坏细胞膜的流动性和渗透性,降低细胞活性,导致葡萄酒发酵异常[3]。
富含谷胱甘肽酵母制品(glutathione-enriched inactive dry yeast derivatives,g-IDYs)由高产谷胱甘肽(glutathione,GSH)的酵母干燥灭活制得,富含GSH和酵母氮源等功能性营养元素,在葡萄酒生产中可作为颜色和香气保护剂,兼具促进酒精发酵的功能[4]。GSH是一种生物活性三肽,其已经被证实具有抗氧化性、提供硫源[5]、清除自由基和缓解重金属胁迫等作用[6]。纯GSH粉末易被氧化且价格高昂,而添加g-IDYs能够在发酵和陈酿中直接释放GSH,改善葡萄酒风味,因此葡萄酒酿造中使用g-IDYs是较为常用提高效益的方式[7]。目前,市场上存在不同品牌的多种g-IDYs,其化学成分存在差异且使用剂量和添加时间各不相同,给酿造过程中的使用带来了较大困扰。近年来,国内外对g-IDYs在葡萄酒中的作用进行了较多研究,这些研究主要集中在g-IDYs对葡萄酒颜色、香气物质的影响以及g-IDYs与其他类型抗氧化剂对比等方面。本文分析了国内外相关文献,对g-IDYs的主要功能成分、在葡萄酒酿造中的作用机理及其应用进行了综述,以期为g-IDYs提高葡萄酒质量提供相关理论及见解。
1 g-IDYs主要功能成分
近年来,为了更好的提升葡萄酒的抗氧化能力及品质,葡萄酒辅料公司推出了多种g-IDYs产品,这些产品通常是纯灭活酵母或酵母衍生物复合制剂,表1列举了几种商业g-IDYs产品及其功能和用法。在g-IDYs的加工过程中,可以通过外源添加半胱氨酸的方式调节酵母硫代谢途径,从而增加酵母细胞内的GSH含量,研究表明g-IDYs比非富集GSH的酵母制品含有更多的含硫化合物[7]。g-IDYs在葡萄酒中能够释放高含量的GSH,也会释放细胞壁多糖和多种功能性营养成分,这些物质在葡萄酒酿造中不仅能够促进发酵进程,还会影响葡萄酒的风味。
表1 葡萄酒酿造中商业g-IDYs产品
Table 1 Commercial g-IDYs used in winemaking
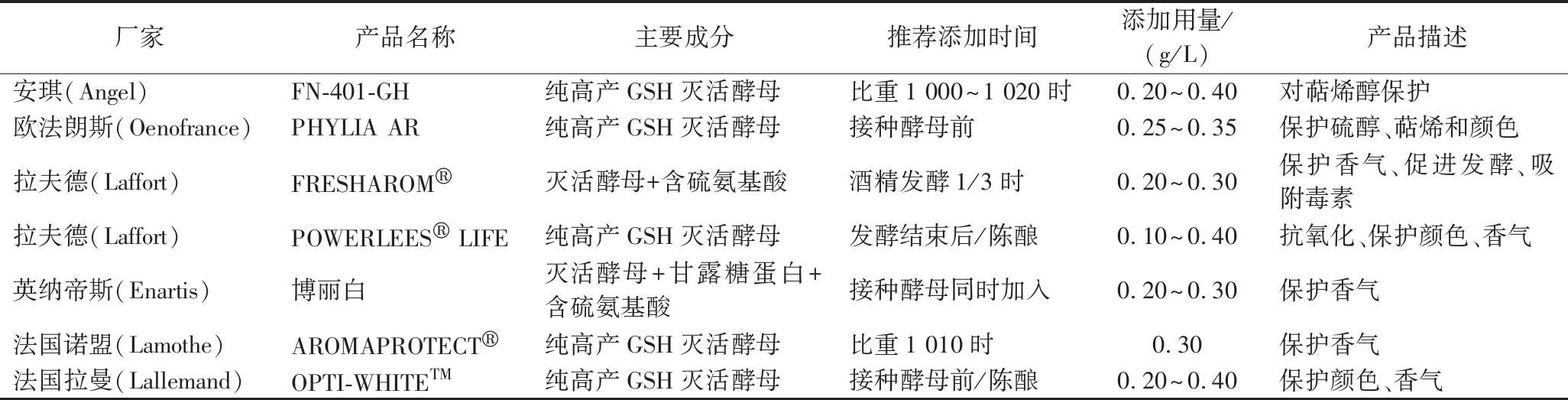
厂家产品名称主要成分推荐添加时间添加用量/(g/L)产品描述安琪(Angel)FN-401-GH纯高产GSH灭活酵母比重1 000~1 020时0.20~0.40 对萜烯醇保护欧法朗斯(Oenofrance)PHYLIA AR纯高产GSH灭活酵母接种酵母前0.25~0.35保护硫醇、萜烯和颜色拉夫德(Laffort)FRESHAROM®灭活酵母+含硫氨基酸酒精发酵1/3时0.20~0.30保护香气、促进发酵、吸附毒素拉夫德(Laffort)POWERLEES®LIFE纯高产GSH灭活酵母发酵结束后/陈酿0.10~0.40抗氧化、保护颜色、香气英纳帝斯(Enartis)博丽白灭活酵母+甘露糖蛋白+含硫氨基酸接种酵母同时加入0.20~0.30保护香气法国诺盟(Lamothe)AROMAPROTECT®纯高产GSH灭活酵母比重1 010时0.30保护香气法国拉曼(Lallemand)OPTI-WHITETM纯高产GSH灭活酵母接种酵母前/陈酿0.20~0.40保护颜色、香气
1.1 GSH特性及功能
g-IDYs以高产GSH酵母的灭活制品为原料,溶于葡萄酒后会释放高含量的GSH。GSH是由L-谷氨酸、甘氨酸和L-半胱氨酸经肽键脱水缩合而成的三肽,其分子结构见图1[8]。
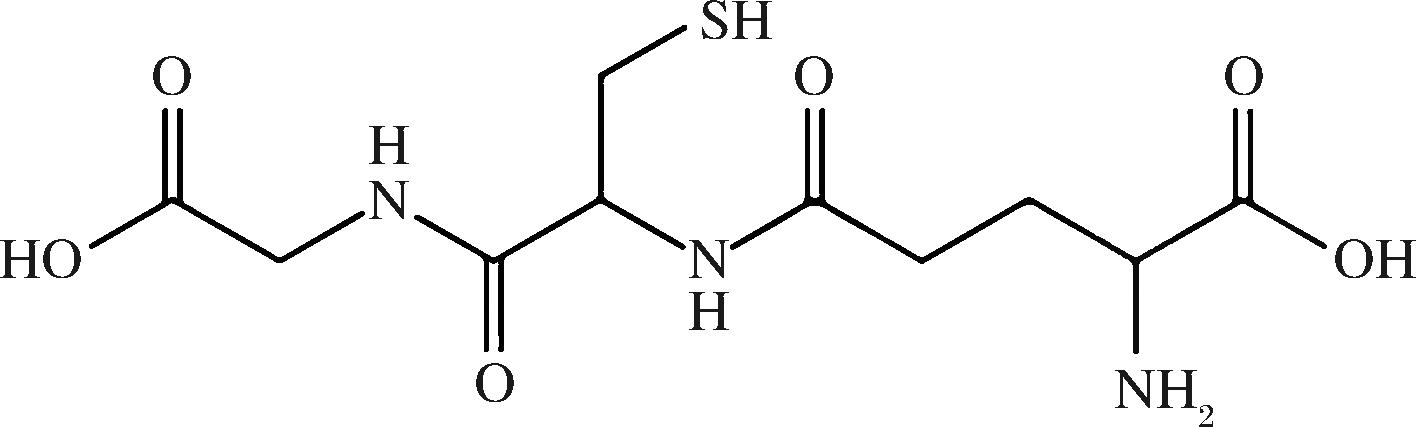
图1 还原型谷胱甘肽分子结构[8]
Fig.1 Molecular structure of GSH[8]
GSH中的半胱氨酸残基有一个氧化还原电位较低的活泼巯基,该特性使其成为一种非常重要的抗氧化剂[9]。葡萄酒氧化褐变主要是由于咖啡酸等酚类物质在多酚氧化酶催化下消耗O2生成邻醌类化合物,邻醌类化合物很不稳定,能够很快缩合形成褐色聚合物[10]。GSH能够与葡萄酒中的芳香硫醇竞争,与邻醌类化合物生成不容易氧化的无色反应产物(grape reaction product,GRP),减少醌类化合物聚合,抑制葡萄酒褐变,并限制香气物质的损失[11-12],具体反应过程如图2所示。此外,GSH还是酵母细胞中抗ROS酶系统——谷氧还原蛋白系统中的重要还原剂,其能够作为谷胱甘肽氧化物酶的底物清除ROS,保护酵母细胞抵御氧化应激,防止发酵异常[13]。
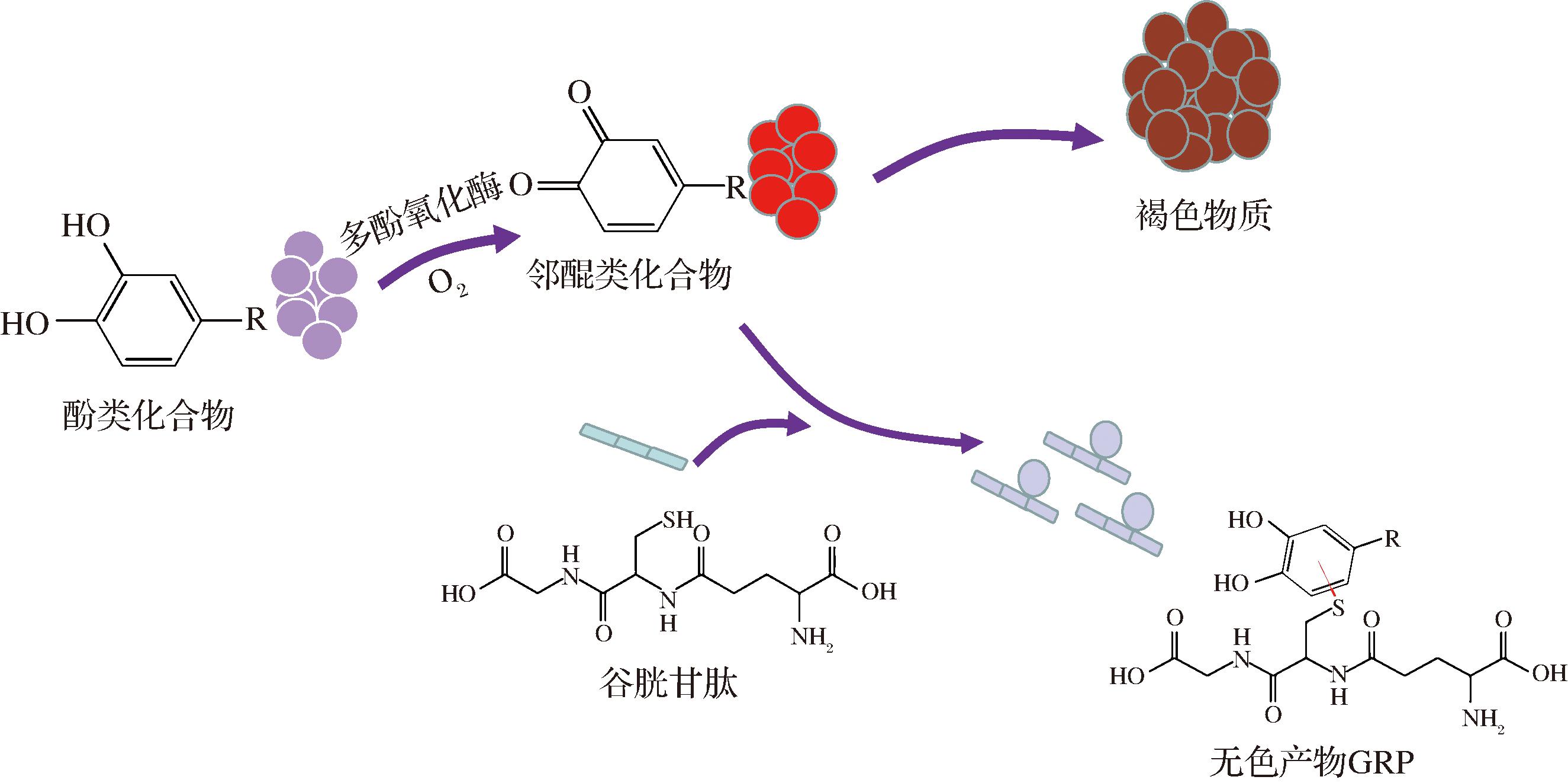
图2 GSH抑制酚类物质氧化褐变
Fig.2 GSH inhibits phenolic oxidation
1.2 酵母细胞壁多糖
酵母细胞壁多糖是g-IDYs的主要功能成分之一,根据菌株类型和生长因素的不同,细胞壁占菌体干重的10%~30%,多糖占细胞壁干重的70%左右[14-15]。酵母细胞壁可以分为内外两层,内层主要由葡聚糖构成,并镶嵌着一定数量的几丁质;外层主要是甘露聚糖和蛋白质结合形成的甘露糖蛋白。目前,甘露糖蛋白在葡萄酒酿造中的研究及应用较为广泛,其具有抗氧化、促进发酵、降低涩感、稳定酒石酸等作用[16]。在葡萄酒酿造环境的pH条件下,甘露糖蛋白带有负电荷,能够与带正电荷的不稳定蛋白质结合形成沉淀、也会通过静电或疏水相互作用与色素和单宁形成聚合物[14]。市场中已有纯化的甘露糖蛋白产品,这些产品根据甘露聚糖与蛋白质的成分比例不同而具有不同程度的溶解度和乳化性[17]。
1.3 功能性营养成分
g-IDYs是灭活的酵母制品,酵母菌菌体中富含多糖、蛋白质、脂类(麦角甾醇、亚油酸等)、维生素(泛酸、生物素、硫胺素等)、矿物质、核苷酸、氨基酸和多肽等功能性营养成分[4, 18]。在葡萄酒酒精发酵阶段,葡萄醪中的初始可同化氮浓度至少达到120~140 mg N/L才能保证酵母菌将糖分耗尽,通常在起酵三天后,葡萄酒中的氮源会被酵母菌消耗至较低浓度,酵母活性由此受到一定的抑制[19-20]。此外,麦角甾醇是构成酵母细胞膜重要的脂类成分,在酒精发酵的厌氧条件下,酿酒酵母能够吸收外源麦角甾醇,但不能自身合成[21],添加g-IDYs能够向葡萄酒中释放酵母氮源、麦角甾醇和其他营养物质,提升酵母活性,促进发酵进程[4]。
2 g-IDYs在葡萄酒酿造中的作用
g-IDYs分别适用于葡萄酒酿造中的浸渍、酒精发酵、苹乳发酵、陈酿等各个环节。图3显示了g-IDYs在葡萄酒酿造过程中适用的阶段及功能。
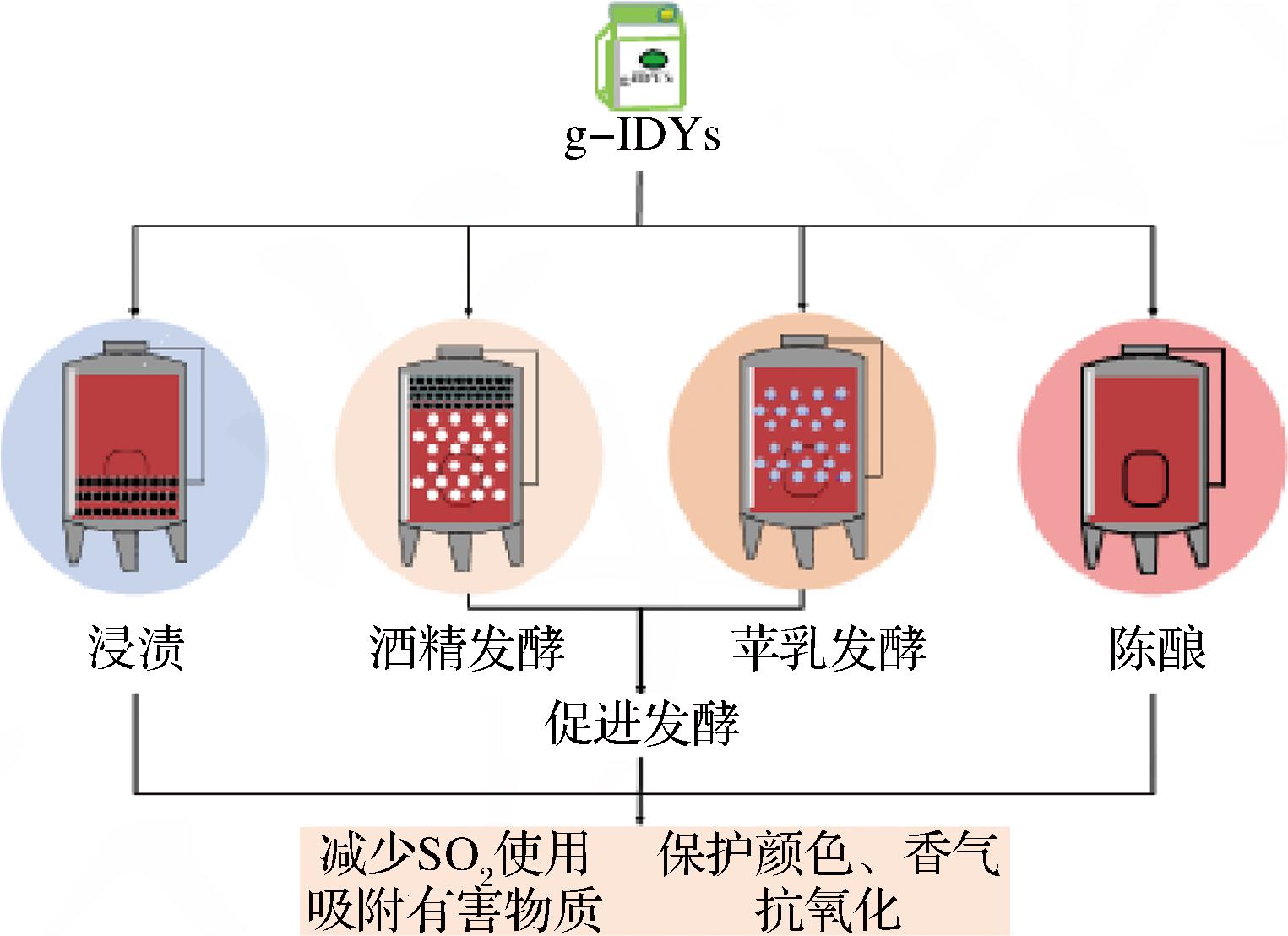
图3 g-IDYs在葡萄酒酿造各个阶段的应用
Fig.3 Application of g-IDYs in all stages of wine making
2.1 促进发酵
酒精发酵过程中,酵母菌会受到乙醇、营养物质缺乏、酵母代谢毒素、高浓度SO2等胁迫因素影响,导致发酵缓慢甚至中止[21]。例如,乙醇能够抑制酵母菌的糖转运系统[22],并且诱导H+向细胞内流[23],同时中链脂肪酸可作为H+载体,增加H+释放,降低细胞质pH[24]。乙醇和中链脂肪酸(如辛酸、癸酸等)会引起酵母细胞膜组织损伤,影响膜流动性[25-26]。另外,SO2进入酵母细胞能够解离为HSO3-和H+,并导致胞内ATP下降,降低酵母活力。图4显示了葡萄酒中存在的抑制剂对酵母代谢的作用机制。
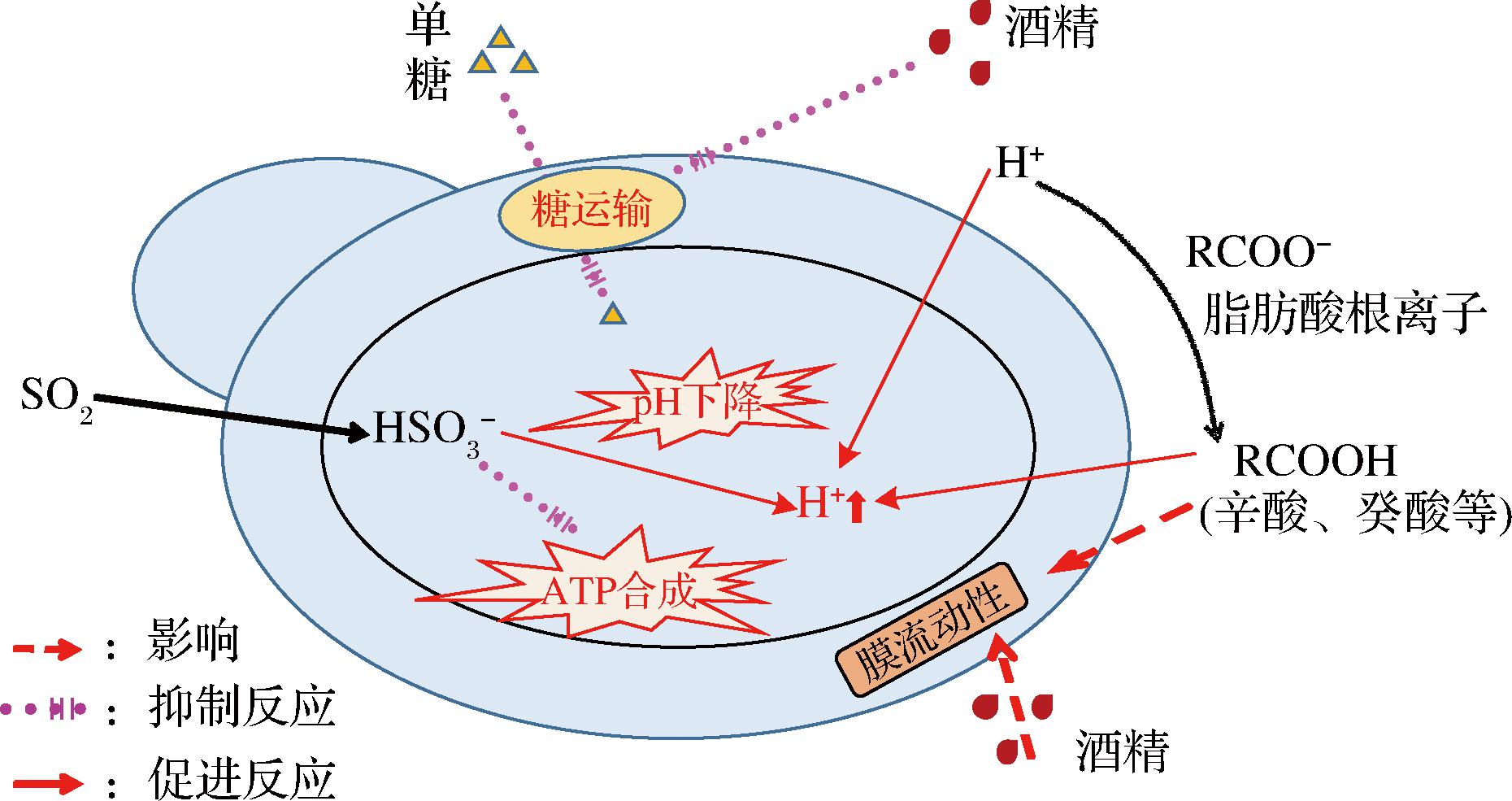
图4 葡萄酒中抑制剂对酵母代谢的作用机制
Fig.4 Mechanisms of inhibitors presented in wine on yeast metabolism
研究表明,添加酵母制品能够有效防止酒精发酵异常[27]。g-IDYs本质上是灭活干燥加工获得的酵母细胞制品,其含有多种化合物,包括酵母细胞壁和细胞膜上的多糖和脂质[28-29],细胞内的核苷酸、蛋白质、氨基酸、多肽、维生素、矿物质等[30],国际葡萄与葡萄酒组织允许灭活酵母及其提取物在葡萄酒中使用。g-IDYs可以向葡萄酒中直接释放营养成分,并能够吸附辛酸和癸酸等中链脂肪酸[31],从而促进酵母的活性和增长,加速发酵进程。祝霞等[32]发现在酒精发酵前添加酵母多糖能够提升酵母活力,并且提高酵母细胞内GSH含量,这可能是由于酵母多糖处理缓解了酵母细胞应激反应,从而减少了GSH消耗[33]。卢新军等[15]在葡萄酒中添加酵母细胞壁使发酵中的最大酵母活细胞数显著提高,并提升了发酵速度。许引虎等[34]进一步发现,酵母细胞壁与可同化氮联合使用能够更大程度的促进发酵。这些结果验证了g-IDYs可通过本身营养成分的作用成为酒精发酵促进剂。
2.2 吸附有害物质
葡萄酒中可能出现的有害物质主要包括农药残留、重金属、霉菌毒素和卤代芳香族有机物等。由于酿酒葡萄在生长发育过程中易受到多种真菌病害和虫害,在葡萄栽培过程中易使用农药进行病虫害防控,一些不易分解的农药会附着在葡萄表皮,伴随着发酵过程转移到葡萄酒中[35];机械设备、金属容器以及感染霉菌的原料可能会导致葡萄酒中的重金属(铅、镉、铜等)和霉菌毒素含量较高;使用防腐处理过的橡木制品及质量不达标的酿造生产用水可能会引起葡萄酒卤代芳香族有机物污染[36]。这些有害物质不仅会影响葡萄酒的风味及质量,更会危害人体健康。
g-IDYs中的灭活酵母细胞是优良的微生物吸附剂。已有研究表明酵母细胞壁具有吸附霉菌毒素和农药残留的作用[37-38],酵母细胞壁的网状结构有助于截留有害物质,研究表明酵母细胞壁中的甘露糖蛋白具有结合有机化合物的能力,包括被列为B级致癌物的赭曲霉毒素A[39]。g-IDYs释放出的GSH能够在谷胱甘肽硫转移酶催化下清除卤代芳香族有机物,也能与Cd2+、Cu2+、Zn2+等重金属离子形成螯合物后与酸不稳定的硫化物结合形成沉淀[6]。相比传统的物理化学方法,利用灭活酵母吸附葡萄酒中有害物质具有投资成本低、生物安全性高和风味损伤性小等特点。
2.3 减少SO2使用
葡萄酒酿造过程中,添加SO2可抑制腐败微生物生长,也可以保护葡萄酒不被氧化[40],但葡萄酒中添加过量的SO2会给人体健康带来危害,某些对硫过敏的人食用SO2处理过的食品后会出现恶心、呕吐等症状[41]。目前,已有许多研究证实在葡萄酒中添加还原型GSH可以减少SO2的使用量。黄倩[42]发现GSH和低剂量SO2联合作用可有效防止葡萄酒褐变,能够减少SO2添加量。LUKI 等[43]使用高功率超声联合GSH和低剂量SO2处理葡萄酒,进一步降低了SO2使用,他们还发现利用超高压技术与GSH和低剂量SO2联合使用也可有效保存葡萄酒[44]。
等[43]使用高功率超声联合GSH和低剂量SO2处理葡萄酒,进一步降低了SO2使用,他们还发现利用超高压技术与GSH和低剂量SO2联合使用也可有效保存葡萄酒[44]。
g-IDYs由于富含GSH而被认为是SO2潜在的替代品之一。PONS-MERCADÉ等[45]发现在模型酒中g-IDYs的耗氧能力强于SO2,表明g-IDYs能够有效减缓葡萄酒中风味物质氧化。GIMÉNEZ等[46]在未发酵的葡萄汁中同时加入g-IDYs和低剂量SO2,发现葡萄酒总耗氧量大于高剂量SO2单独使用,并明显减缓酒体褐变,这表明g-IDYs可以有效减少SO2的添加量,但当葡萄汁中存在漆酶时,g-IDYs不能够有效的阻止葡萄酒褐变。另有研究发现g-IDYs和葡萄果皮单宁以及葡萄籽单宁联合使用能够显著保护葡萄酒的颜色,降低SO2的使用[47]。
2.4 保护葡萄酒颜色
在葡萄酒酿造过程中,咖啡酸等酚类物质容易氧化形成褐色物质,降低葡萄酒质量[10]。研究表明,添加g-IDYs能够抑制葡萄酒褐变[46-47]。g-IDYs释放出的GSH能够与醌类物质结合,抑制褐色物质产生[27],酵母细胞壁中的甘露糖蛋白也可以和单宁、花青素等相互作用形成聚合物,一定程度上抑制色素聚集沉淀,从而保护葡萄酒颜色[48]。NIKOLANTONAKI等[49]利用超高分辨率质谱代谢组学技术证明了GSH能够在陈酿期间优先被消耗,从而保护了葡萄酒中其他抗氧化代谢物的损失。另有研究发现g-IDYs释放的GSH在酒精发酵中被快速消耗,但葡萄酒中产生的GRP反而少于其他类型酵母制品(inactive dry yeast derivatives,IDYs),这可能是由于g-IDYs释放的GSH在葡萄酒中被酵母菌直接吸收,而其他类型IDYs影响了酵母菌代谢,使葡萄酒中GSH含量增多,从而产生了更多的GRP[11]。
2.5 提升葡萄酒香气
葡萄酒香气物质丰富多样,是形成不同特色风格葡萄酒的关键因素。葡萄酒中的香气物质主要包括酯类、醇类、萜烯类、硫醇类、醛类、酮类等,这些物质能够赋予葡萄酒果香和花香,提升葡萄酒品质[50]。酿造过程中香气物质会通过氧化作用或其他反应产生变化,其中,酯类物质水解[51]、过量通氧会加速酯类和萜烯类物质的下降[2, 52],硫醇类物质与葡萄酒中的醌类物质结合而损失[53]。这些香气物质的氧化及损失不仅降低葡萄酒的风味,还会带来氧化味及其他异味,严重影响葡萄酒的品质。
研究表明,添加g-IDYs能够减少葡萄酒发酵和陈酿过程中香气的损失[54-55],且g-IDYs能够释放出大量的挥发性物质,起到丰富葡萄酒香气的作用[56]。AND JAR-ORTIZ等[54]在酒精发酵中添加g-IDYs,经过9个月的陈酿后发现酯类香气物质显著提高,可能是由于g-IDYs在葡萄酒中释放的挥发性物质对葡萄酒产生影响,或者在发酵过程中改变了酵母菌代谢副产物。另有研究表明从g-IDYs和营养型IDYs中分离出的小于3 kDa分子物质均可以减少通氧加速老化条件下的模型葡萄酒中典型葡萄酒萜烯物质的损失[52]。但LYU等[12]发现,酒精发酵前添加g-IDYs只对脂类香气有一定提升,而对其他香气物质的影响很小。这些结果表明g-IDYs提升葡萄酒香气物质的作用是由多种因素影响的,而其中的机制尚不清楚,因此,g-IDYs在葡萄酒中释放的物质成分对香气提升机制还需进一步探究。
JAR-ORTIZ等[54]在酒精发酵中添加g-IDYs,经过9个月的陈酿后发现酯类香气物质显著提高,可能是由于g-IDYs在葡萄酒中释放的挥发性物质对葡萄酒产生影响,或者在发酵过程中改变了酵母菌代谢副产物。另有研究表明从g-IDYs和营养型IDYs中分离出的小于3 kDa分子物质均可以减少通氧加速老化条件下的模型葡萄酒中典型葡萄酒萜烯物质的损失[52]。但LYU等[12]发现,酒精发酵前添加g-IDYs只对脂类香气有一定提升,而对其他香气物质的影响很小。这些结果表明g-IDYs提升葡萄酒香气物质的作用是由多种因素影响的,而其中的机制尚不清楚,因此,g-IDYs在葡萄酒中释放的物质成分对香气提升机制还需进一步探究。
3 g-IDYs抗氧化性及测定方法
3.1 g-IDYs抗氧化性
有许多研究证实了g-IDYs在葡萄酒中具有抗氧化性。g-IDYs能够通过提供GSH合成的前体物质或直接释放GSH的途径来提高酒体中GSH的含量,提升葡萄酒抗氧化能力,但g-IDYs中不仅只有GSH能够提高氧化作用,其释放的含硫、含氮化合物及部分醛类物质也会与醌类物质反应生成加成产物,防止葡萄酒氧化褐变[57],且酵母制品释放的脂类和多糖在葡萄酒中的抗氧化性也已被证明[58, 32]。
研究表明,g-IDYs在模拟酒中的耗氧量超过其能够释放同等浓度的纯GSH[45]。BAHUT等[57]发现g-IDYs释放出的GSH含量高低并不能决定其清除自由基的能力,而其释放出的含硫、含氮等亲核化合物的丰度及含量决定了其抗氧化能力的强弱。这些结果表明g-IDYs的抗氧化能力是由GSH和其他复杂的成分一起构成的,而其中的机制尚未明晰,因此,需要进一步探究g-IDYs释放的不同成分物质对葡萄酒的抗氧化作用机制。
3.2 g-IDYs抗氧化性测定方法
g-IDYs抗氧化性主要体现在对酚类物质和挥发性物质的保护,耗氧能力以及对自由基的清除能力等方面。近年来,较多研究使用添加g-IDYs后的葡萄酒、模型酒和水醇溶液测定g-IDYs抗氧化性,表2列举了测定g-IDYs抗氧化能力的试验方法。
表2 g-IDYs抗氧化性检验方法
Table 2 Methods for antioxidant test of g-IDYs
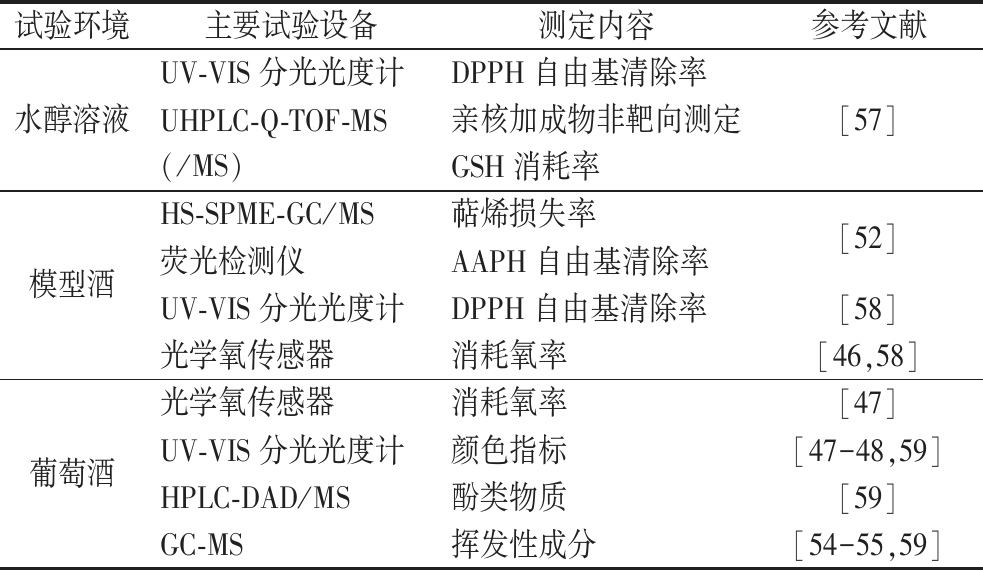
试验环境主要试验设备测定内容参考文献水醇溶液UV-VIS分光光度计UHPLC-Q-TOF-MS(/MS)DPPH自由基清除率亲核加成物非靶向测定GSH消耗率[57]模型酒HS-SPME-GC/MS萜烯损失率荧光检测仪AAPH自由基清除率UV-VIS分光光度计DPPH自由基清除率光学氧传感器消耗氧率[52][58][46,58]葡萄酒光学氧传感器消耗氧率[47]UV-VIS分光光度计颜色指标[47-48,59]HPLC-DAD/MS酚类物质[59]GC-MS挥发性成分[54-55,59]
自由基诱导剂AAPH可以与氧分子反应产生过氧自由基[60],DPPH是一种合成有机自由基,常用来评估抗氧化物的供氢能力,已有研究使用添加g-IDYs的模拟酒和葡萄酒测定自由基清除能力,以评估g-IDYs的抗氧化性[58],BAHUT等[57]首次将自由基清除能力的测定应用于评价纯化合物或混合物的抗氧化性能,但测定清除自由基能力不能提供g-IDYs中具体参与抗氧化作用的物质成分信息,他们进一步在g-IDYs水醇溶液中添加4-甲基醌(4-methylquinone,4MeQ)作为亲核试剂,用以模拟葡萄酒中的邻醌类物质,使用超高压液相色谱与飞行时间质谱联用技术对4MeQ与g-IDYs释放的亲核成分的加成物进行非靶向测定,并将多种IDYs产品中能够与醌类物质结合的亲核化合物绘制了指纹图谱,在分子层面分析了IDYs产品的抗氧化能力。另外,测定添加g-IDYs葡萄酒中的消耗溶解氧能力以及挥发性成分变化也是分析g-IDYs抗氧化能力常用的方法[45, 55]。测定g-IDYs抗氧化性时应将多种方法结合,才能准确的评估其抗氧化能力。
4 总结与展望
目前,g-IDYs已经在葡萄酒生产中进行了一定程度的推广应用,其发挥的作用也受到酿酒师和研究者的普遍关注和认可。葡萄酒酿造中添加g-IDYs能够促进酵母生长、吸附霉菌毒素和农药残留、保护葡萄酒的香气和颜色,并能一定程度上减少SO2的使用量。然而,g-IDYs在葡萄酒酿造中的作用机制未得到深入的研究,例如:①发酵过程中,g-IDYs释放出的GSH能够与邻醌类物质结合,也可以被酵母菌直接吸收,而具体的吸收机制尚不清楚;②g-IDYs释放的脂类、多糖,以及多种含硫、含氮化合物都参与了葡萄酒抗氧化,这些物质与GSH抗氧化功能的贡献机制尚未明确;③g-IDYs可以在葡萄酒中释放出风味物质,或在发酵中改变酵母代谢副产物来影响葡萄酒的香气和口感,而具体的代谢机制尚不清楚。同时,不当使用g-IDYs可能会导致葡萄酒产生不良气味,发酵营养失衡,增加葡萄酒败坏的风险。因此,迫切需要对g-IDYs释放的物质在葡萄酒酿造中的作用机制进行深入研究,为g-IDYs在葡萄酒酿造中的应用提供化学基础和理论知识,以供酿酒师更合理的使用g-IDYs提升葡萄酒品质。
今后,还应针对减少葡萄酒酿造中SO2使用,寻找g-IDYs与其他天然抗氧化剂(如葡萄籽单宁、葡萄果皮单宁)或物理技术(如高功率超声、超高压技术)联合的方法,同时,需要考虑葡萄酒中多酚氧化酶对g-IDYs抗氧化性的影响。这些相关研究将会为葡萄酒酿造中g-IDYs的应用拓展思路,并为改善酵母制剂成分的分析及开发提供参考和实践支持。
[1] HAUNSCHILD R, MARX W.On health effects of resveratrol in wine[J].International Journal of Environmental Research and Public Health, 2022, 19(5):3110.
[2] PÉREZ-MAGARI O S, MART
O S, MART NEZ-GIL A, BUENO-HERRERA M, et al.Kinetics of oxygen consumption, a key factor in the changes of young wines composition[J].LWT, 2023, 182:114786.
NEZ-GIL A, BUENO-HERRERA M, et al.Kinetics of oxygen consumption, a key factor in the changes of young wines composition[J].LWT, 2023, 182:114786.
[3] FEDOSEEVA I V, PYATRIKAS D V, STEPANOV A V, et al.The role of flavin-containing enzymes in mitochondrial membrane hyperpolarization and ROS production in respiring Saccharomyces cerevisiae cells under heat-shock conditions[J].Scientific Reports, 2017, 7:2586.
[4] 陈晓姣, 刁体伟, 赖晓琴, 等.酵母衍生物在果酒中的应用进展[J].食品与发酵工业, 2022, 48(4):287-293.
CHEN X J, DIAO T W, LAI X Q, et al.Advances on the application of yeast derivatives during winemaking[J].Food and Fermentation Industries, 2022, 48(4):287-293.
[5] ELSKENS M T, JASPERS C J, PENNINCKX M J.Glutathione as an endogenous sulphur source in the yeast Saccharomyces cerevisiae[J].Journal of General Microbiology, 1991, 137(3):637-644.
[6] 毛珍, 裘娟萍.酵母菌中谷胱甘肽的主要生理功能及其代谢调控[J].微生物学杂志, 2005, 25(1):94-96.
MAO Z, QIU J P.Main physiological function and metabolic modulation of glutathione in yeast[J].Journal of Microbiology, 2005, 25(1):94-96.
[7] BAHUT F, LIU Y Z, ROMANET R, et al.Metabolic diversity conveyed by the process leading to glutathione accumulation in inactivated dry yeast:A synthetic media study[J].Food Research International, 2019, 123:762-770.
[8] SANTOS L O, SILVA P G P, LEMOS JUNIOR W J F, et al.Glutathione production by Saccharomyces cerevisiae:Current state and perspectives[J].Applied Microbiology and Biotechnology, 2022, 106(5):1879-1894.
[9] TSUTSUI A, MORISHITA Y, FURUMACHI H, et al.Generation of cyclic glutathione via the thiolactonization of glutathione and identification of a new radical scavenging mechanism[J].Tetrahedron Letters, 2021, 68:152836.
[10] LI H, GUO A Q, WANG H.Mechanisms of oxidative browning of wine[J].Food Chemistry, 2008, 108(1):1-13.
[11] RODR GUEZ-BENCOMO J J, AND
GUEZ-BENCOMO J J, AND JAR-ORTIZ I, S
JAR-ORTIZ I, S NCHEZ-PAT
NCHEZ-PAT N F, et al.Fate of the glutathione released from inactive dry yeast preparations during the alcoholic fermentation of white musts[J].Australian Journal of Grape and Wine Research, 2016, 22(1):46-51.
N F, et al.Fate of the glutathione released from inactive dry yeast preparations during the alcoholic fermentation of white musts[J].Australian Journal of Grape and Wine Research, 2016, 22(1):46-51.
[12] LYU X, DEL PRADO D R, ARAUJO L D, et al.Effect of glutathione addition at harvest on Sauvignon Blanc wines[J].Australian Journal of Grape and Wine Research, 2021, 27(4):431-441.
[13] KOVA V, BERGANT M,
V, BERGANT M, 
 AN
AN AR J, et al.Causation of oxidative stress and defense response of a yeast cell model after treatment with orthodontic alloys consisting of metal ions[J].Antioxidants, 2021, 11(1):63.
AR J, et al.Causation of oxidative stress and defense response of a yeast cell model after treatment with orthodontic alloys consisting of metal ions[J].Antioxidants, 2021, 11(1):63.
[14] NGUELA J M, TEUF O, ASSUNCAO BICCA S, et al.Impact of mannoprotein N-glycosyl phosphorylation and branching on the sorption of wine polyphenols by yeasts and yeast cell walls[J].Food Chemistry, 2023, 403:134326.
[15] 卢新军, 张方方, 许引虎.酵母细胞壁对葡萄酒中酵母发酵代谢的影响[J].酿酒科技, 2015(4):49-51;57.
LU X J, ZHANG F F, XU Y H.Effects of yeast cell wall on yeast fermentation &metabolism of grape wine[J].Liquor-Making Science &Technology, 2015(4):49-51;57.
[16] 赵越凡, 王升楠, 赵鹏涛, 等.酵母多糖对葡萄酒品质的影响机理研究进展[J].食品与发酵工业, 2023, 49(17):316-323.
ZHAO Y F, WANG S N, ZHAO P T, et al.Research progress on the mechanism of wine quality by yeast polysaccharides[J].Food and Fermentation Industries, 2023, 49(17):316-323.
[17] LI J, KARBOUNE S.Characterization of the composition and the techno-functional properties of mannoproteins from Saccharomyces cerevisiae yeast cell walls[J].Food Chemistry, 2019, 297:124867.
[18] 张明芳, 王金晶, 钮成拓, 等.高温敏感型酵母的选育及其自溶物研究[J].食品与发酵工业, 2020, 46(1):50-55.
ZHANG M F, WANG J J, NIU C T, et al.Screening of thermosensitive autolytic mutant yeasts and analysis of yeast autolysates[J].Food and Fermentation Industries, 2020, 46(1):50-55.
[19] 姜越, 潘婷, 惠竹梅.模拟葡萄汁中可同化氮和还原糖对酵母发酵特性的影响[J].食品科学, 2018, 39(2):131-137.
JIANG Y, PAN T, XI Z M.Effect of assimilable nitrogen and reducing sugar concentrations of synthetic grape must on the fermentation characteristics of Saccharomyces cerevisiae[J].Food Science, 2018, 39(2):131-137.
[20] KEMSAWASD V, VIANA T, ARDÖ Y, et al.Influence of nitrogen sources on growth and fermentation performance of different wine yeast species during alcoholic fermentation[J].Applied Microbiology and Biotechnology, 2015, 99(23):10191-10207.
[21] GIRARDI PIVA G, CASALTA E, LEGRAS J L, et al.Characterization and role of sterols in Saccharomyces cerevisiae during white wine alcoholic fermentation[J].Fermentation, 2022, 8(2):90.
[22] MAURICIO J C, SALMON J M.Apparent loss of sugar transport activity in Saccharomyces cerevisiae may mainly account for maximum ethanol production during alcoholic fermentation[J].Biotechnology Letters, 1992, 14(7):577-582.
[23] LE O C, VAN UDEN N.Effects of ethanol and other alkanols on passive proton influx in the yeast Saccharomyces cerevisiae[J].Biochimica et Biophysica Acta, 1984, 774(1):43-48.
O C, VAN UDEN N.Effects of ethanol and other alkanols on passive proton influx in the yeast Saccharomyces cerevisiae[J].Biochimica et Biophysica Acta, 1984, 774(1):43-48.
[24] ALEXANDRE H, MATHIEU B, CHARPENTIER C.Alteration in membrane fluidity and lipid composition, and modulation of H(+)-ATPase activity in Saccharomyces cerevisiae caused by decanoic acid[J].Microbiology, 1996, 142(Pt 3):469-475.
[25] LLOYD D, MORRELL S, CARLSEN H N, et al.Effects of growth with ethanol on fermentation and membrane fluidity of Saccharomyces cerevisiae[J].Yeast, 1993, 9(8):825-833.
[26] S -CORREIA I.Synergistic effects of ethanol, octanoic, and decanoic acids on the kinetics and the activation parameters of thermal death in Saccharomyces bayanus[J].Biotechnology and Bioengineering, 1986, 28(5):761-763.
-CORREIA I.Synergistic effects of ethanol, octanoic, and decanoic acids on the kinetics and the activation parameters of thermal death in Saccharomyces bayanus[J].Biotechnology and Bioengineering, 1986, 28(5):761-763.
[27]  NGELES POZO-BAY
NGELES POZO-BAY N M, AND
N M, AND JAR-ORTIZ I, MORENO-ARRIBAS M V.Scientific evidences beyond the application of inactive dry yeast preparations in winemaking[J].Food Research International, 2009, 42(7):754-761.
JAR-ORTIZ I, MORENO-ARRIBAS M V.Scientific evidences beyond the application of inactive dry yeast preparations in winemaking[J].Food Research International, 2009, 42(7):754-761.
[28] KOT A M, GIENTKA I, BZDUCHA-WR BEL A, et al.Comparison of simple and rapid cell wall disruption methods for improving lipid extraction from yeast cells[J].Journal of Microbiological Methods, 2020, 176:105999.
BEL A, et al.Comparison of simple and rapid cell wall disruption methods for improving lipid extraction from yeast cells[J].Journal of Microbiological Methods, 2020, 176:105999.
[29] YAMMINE M, BRAY F, FLAMENT S, et al.Reliable approach for pure yeast cell wall protein isolation from Saccharomyces cerevisiae yeast cells[J].ACS Omega, 2022, 7(34):29702-29713.
[30] TOMÉ D.Yeast extracts:Nutritional and flavoring food ingredients[J].ACS Food Science &Technology, 2021, 1(4):487-494.
[31] POZO-BAY N M A, ANDUJAR-ORTIZ I, ALCAIDE-HIDALGO J M, et al.Characterization of commercial inactive dry yeast preparations for enological use based on their ability to release soluble compounds and their behavior toward aroma compounds in model wines[J].Journal of Agricultural and Food Chemistry, 2009, 57(22):10784-10792.
N M A, ANDUJAR-ORTIZ I, ALCAIDE-HIDALGO J M, et al.Characterization of commercial inactive dry yeast preparations for enological use based on their ability to release soluble compounds and their behavior toward aroma compounds in model wines[J].Journal of Agricultural and Food Chemistry, 2009, 57(22):10784-10792.
[32] 祝霞, 宋茹茹, 宋欣芫, 等.甘露聚糖对酿酒酵母菌株生长及抗氧化活性的影响[J].食品与发酵工业, 2021, 47(22):49-54.
ZHU X, SONG R R, SONG X Y, et al.Effects of mannan on growth and antioxidant activity of Saccharomyces cerevisiae[J].Food and Fermentation Industries, 2021, 47(22):49-54.
[33] GUO W Y, GU X L, TONG Y Q, et al.Protective effects of mannan/β-glucans from yeast cell wall on the deoxyniyalenol-induced oxidative stress and autophagy in IPEC-J2 cells[J].International Journal of Biological Macromolecules, 2019, 135:619-629.
[34] 许引虎, 李辉, 熊涛, 等.有机氮和酵母细胞壁对赤霞珠高糖原料酒精发酵的影响[J].中国酿造, 2021, 40(4):45-49.
XU Y H, LI H, XIONG T, et al.Effect of organic nitrogen and yeast cell wall on alcoholic fermentation of Cabernet Sauvignon high-sugar raw materials[J].China Brewing, 2021, 40(4):45-49.
[35] 赵珊珊, 李敏敏, 陈捷胤, 等.农药在葡萄酒酿造过程中残留变化及干扰风味品质研究进展[J].食品科学, 2022, 43(1):223-231.
ZHAO S S, LI M M, CHEN J Y, et al.Progress in pesticide residue changes during wine brewing and interference with flavor quality[J].Food Science, 2022, 43(1):223-231.
[36] 孙晓涵,张雪,石宝晖等.葡萄酒中非生物代谢来源有害物质的研究进展[J/OL].食品与发酵工业,1-8[2024-03-14].https://doi.org/10.13995/j.cnki.11-1802/ts.035786.
SUN X H, ZHANG X, SHI B H, et al.Advances in the study of harmful substances of non-biological metabolic origin in wine[J/OL].Food and Fermentation Industries,1-8[2024-03-14].https://doi.org/10.13995/j.cnki.11-1802/ts.035786.
[37] SOLOVYOV V V, MARHUNOVA A M, PERMIAKOVA O L, et al.Yeast cell walls adsorption capacity[J].IOP Conference Series:Earth and Environmental Science, 2020, 613(1):012143.
[38] PHILIPP C, EDER P, HARTMANN M, et al.Plant fibers in comparison with other fining agents for the reduction of pesticide residues and the effect on the volatile profile of Austrian white and red wines[J].Applied Sciences, 2021, 11(12):5365.
[39] PETRUZZI L, BAIANO A, DE GIANNI A, et al.Differential adsorption of ochratoxin A and anthocyanins by inactivated yeasts and yeast cell walls during simulation of wine aging[J].Toxins, 2015, 7(10):4350-4365.
[40] FRANCO-LUESMA E, FERREIRA V.Reductive off-odors in wines:Formation and release of H2S and methanethiol during the accelerated anoxic storage of wines[J].Food Chemistry, 2016, 199:42-50.
[41] VALLY H, MISSO N L A, MADAN V.Clinical effects of sulphite additives[J].Clinical and Experimental Allergy:Journal of the British Society for Allergy and Clinical Immunology, 2009, 39(11):1643-1651.
[42] 黄倩. 葡萄酒泥中谷胱甘肽的抗氧化应用[D].石河子:石河子大学, 2020.
HUANG Q.Antioxidant application of glutathione in wine puree[D].Shihezi:Shihezi University, 2020.
[43] LUKI K, BRN
K, BRN I
I M,
M,  URKO N, et al.Quality characteristics of white wine:The short- and long-term impact of high power ultrasound processing[J].Ultrasonics Sonochemistry, 2020, 68:105194.
URKO N, et al.Quality characteristics of white wine:The short- and long-term impact of high power ultrasound processing[J].Ultrasonics Sonochemistry, 2020, 68:105194.
[44] LUKI K,
K,  URKO N, TOMA
URKO N, TOMA EVI
EVI M, et al.Phenolic and aroma changes of red and white wines during aging induced by high hydrostatic pressure[J].Foods, 2020, 9(8):1034.
M, et al.Phenolic and aroma changes of red and white wines during aging induced by high hydrostatic pressure[J].Foods, 2020, 9(8):1034.
[45] PONS-MERCADÉ P, ANGUELA S, GIMÉNEZ P, et al.Measuring the oxygen consumption rate of some inactivated dry yeasts:Comparison with other common wine antioxidants[J].OENO One, 2021, 55(2):147-158.
[46] GIMÉNEZ P, JUST-BORRAS A, PONS P, et al.Biotechnological tools for reducing the use of sulfur dioxide in white grape must and preventing enzymatic browning:Glutathione;inactivated dry yeasts rich in glutathione;and bioprotection with Metschnikowia pulcherrima[J].European Food Research and Technology, 2023, 249(6):1491-1501.
[47] FERRER-GALLEGO R, PUXEU M, NART E, et al.Evaluation of Tempranillo and Albari o SO2-free wines produced by different chemical alternatives and winemaking procedures[J].Food Research International, 2017, 102:647-657.
o SO2-free wines produced by different chemical alternatives and winemaking procedures[J].Food Research International, 2017, 102:647-657.
[48] RINALDI A, GONZALEZ A, MOIO L, et al.Commercial mannoproteins improve the mouthfeel and colour of wines obtained by excessive tannin extraction[J].Molecules, 2021, 26(14):4133.
[49] NIKOLANTONAKI M, JULIEN P, COELHO C, et al.Impact of glutathione on wines oxidative stability:A combined sensory and metabolomic study[J].Frontiers in Chemistry, 2018, 6:182.
[50] KRITZINGER E C, BAUER F F, DU TOIT W J.Role of glutathione in winemaking:A review[J].Journal of Agricultural and Food Chemistry, 2013, 61(2):269-277.
[51] MAKHOTKINA O, KILMARTIN P A.Hydrolysis and formation of volatile esters in New Zealand Sauvignon Blanc wine[J].Food Chemistry, 2012, 135(2):486-493.
[52] RODR GUEZ-BENCOMO J J, AND
GUEZ-BENCOMO J J, AND JAR-ORTIZ I, MORENO-ARRIBAS M V, et al.Impact of glutathione-enriched inactive dry yeast preparations on the stability of terpenes during model wine aging[J].Journal of Agricultural and Food Chemistry, 2014, 62(6):1373-1383.
JAR-ORTIZ I, MORENO-ARRIBAS M V, et al.Impact of glutathione-enriched inactive dry yeast preparations on the stability of terpenes during model wine aging[J].Journal of Agricultural and Food Chemistry, 2014, 62(6):1373-1383.
[53] NIKOLANTONAKI M, WATERHOUSE A L.A method to quantify quinone reaction rates with wine relevant nucleophiles:A key to the understanding of oxidative loss of varietal thiols[J].Journal of Agricultural and Food Chemistry, 2012, 60(34):8484-8491.
[54] AND JAR-ORTIZ I, CHAYA C, MART
JAR-ORTIZ I, CHAYA C, MART N-
N- LVAREZ P J, et al.Impact of using new commercial glutathione enriched inactive dry yeast oenological preparations on the aroma and sensory properties of wines[J].International Journal of Food Properties, 2014, 17(5):987-1001.
LVAREZ P J, et al.Impact of using new commercial glutathione enriched inactive dry yeast oenological preparations on the aroma and sensory properties of wines[J].International Journal of Food Properties, 2014, 17(5):987-1001.
[55] ALFONZO A, PRESTIANNI R, GAGLIO R, et al.Effects of different yeast strains, nutrients and glutathione-rich inactivated yeast addition on the aroma characteristics of Catarratto wines[J].International Journal of Food Microbiology, 2021, 360:109325.
[56] RAZA A, SONG H L, BEGUM N, et al.Direct classification of volatile organic compounds in heat-treated glutathione-enriched yeast extract by headspace-gas chromatography-ion mobility spectrometry (HS-GC-IMS)[J].Food Analytical Methods, 2020, 13(12):2279-2289.
[57] BAHUT F, ROMANET R, SIECZKOWSKI N, et al.Antioxidant activity from inactivated yeast:Expanding knowledge beyond the glutathione-related oxidative stability of wine[J].Food Chemistry, 2020, 325:126941.
[58] NIOI C, LISANTI M T, MEUNIER F, et al.Antioxidant activity of yeast derivatives:Evaluation of their application to enhance the oxidative stability of white wine[J].LWT, 2022, 171:114116.
[59] 齐转宁, 许引虎, 安长红, 等.谷胱甘肽酵母衍生物制剂对‘维欧妮’干白葡萄酒品质的影响[J].食品与发酵工业, 2019, 45(7):157-164.
QI Z N, XU Y H, AN C H, et al.Impacts of glutathione-enriched inactive dry yeast preparations on the quality of ‘Viognier’ dry white wine[J].Food and Fermentation Industries, 2019, 45(7):157-164.
[60] NOGUCHI N, YAMASHITA H, GOTOH N, et al.2, 2′-Azobis (4-methoxy-2, 4-dimethylvaleronitrile), a new lipid-soluble azo initiator:Application to oxidations of lipids and low-density lipoprotein in solution and in aqueous dispersions[J].Free Radical Biology &Medicine, 1998, 24(2):259-268.