食品在生产、储存和运输过程中常常受到来自生物、物理、化学等因素的影响,从而对人体健康造成潜在的威胁。食品安全问题作为人们日常生活中的头等大事,应受到全面的监督和检测,以促进食品行业的良性发展,保障食品安全。传统的食品安全仪器检测方法如液相色谱-质谱法[1]、气相色谱法[2]、高效液相色谱法[3]等,虽具有成熟、稳定、灵敏度高、选择性强等特点,但昂贵的大型仪器、严苛的使用环境要求和较高的操作门槛,限制了公众的广泛使用。因此,开发高效、便携和灵敏的新型材料检测技术仍然十分必要。
水凝胶是一种具有三维网络结构的材料,具有亲和性高、孔径可调、吸水膨胀、吸收能力强、生物降解性强、机械稳定性好等优点,有望在未来食品安全等领域发展中发挥突出作用[4]。迄今为止,科研人员已经设计了无数由合成或天然交联剂组成的水凝胶,然而受生物相容性的限制,只有部分聚合物如聚乙二醇、聚乳酸-羟基乙酸和一些天然聚合物(DNA、多糖、蛋白质)可被用作水凝胶骨架[5]。其中DNA因其生物相容性好、可编程性强、精确的分子识别能力和很小的毒性而成为水凝胶骨架很好的选择[6]。根据骨架制备的交联构筑方式不同,DNA水凝胶可以分为DNA分子的化学连接和DNA链之间的物理缠绕两种形式。其中,化学连接法指聚合物通过共价键结合在一起,这赋予了水凝胶强大的机械强度和环境稳定性;物理方法指水凝胶由非共价(如氢键和静电相互作用)相互作用形成[7]。为让DNA水凝胶对刺激信号作出响应,使其能够根据一个或多个信号改变其结构来达到实验设计的目的,“刺激响应型DNA水凝胶”应运而生,其可以识别pH、温度、光等信号的变化,并通过核酸“开关结构”控制水凝胶的组装或裂解[8]。DNA水凝胶具有的这种独特的凝胶和溶胶转变能力,使其在传感领域受到了广泛的关注[9],并进一步应用到食品安全领域。
本文简述了DNA水凝胶的物理和化学合成方法,根据信号响应类型不同,分类介绍了温度响应型、pH响应型、光子响应型、生物分子响应型和多重响应型刺激信号的DNA水凝胶,综述了DNA水凝胶在检测真菌毒素、重金属离子、食源性致病菌、抗生素残留、非法添加剂等食品安全领域的研究进展,并进一步讨论了DNA水凝胶在食品安全领域研究面临的挑战和未来发展方向。
1 DNA水凝胶的合成方式
根据DNA水凝胶的合成方法,可将DNA水凝胶分为物理水凝胶和化学水凝胶两类,如图1所示。
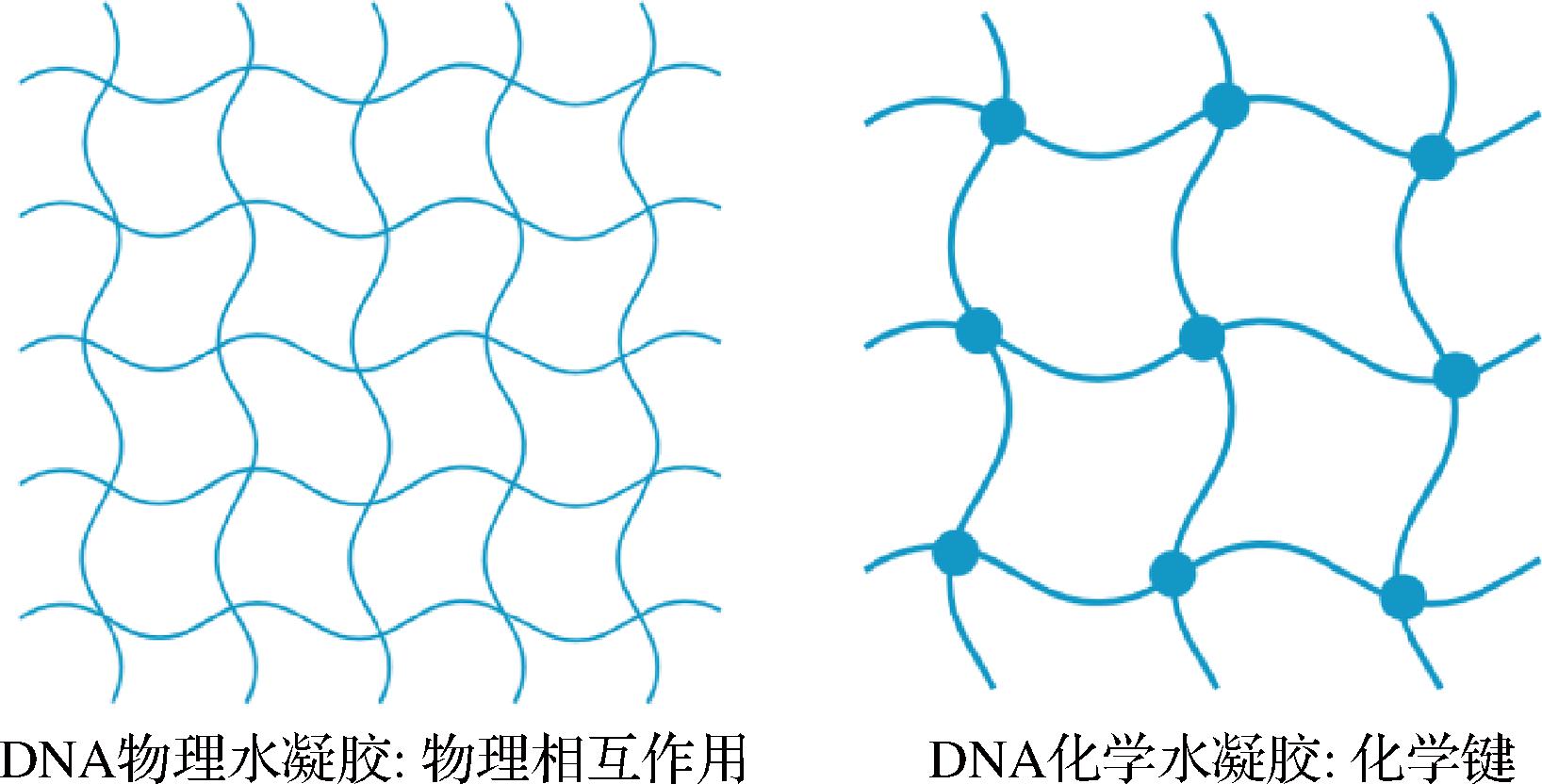
图1 DNA水凝胶合成方式示意图
Fig.1 Schematic diagram of DNA hydrogel synthesis
1.1 物理成胶法
DNA物理水凝胶是由非共价键(氢键或范德华力等)和DNA链间缠绕物理相互作用形成的,通常不需要引入其他物质,而且其更易对pH、温度等刺激做出响应。成胶方法比较简单,使两条Y形DNA(Y-DNA)的末端序列互相咬合形成i-motif结构,进而将所有Y-DNA连接起来形成稳定的三维网络结构[10]。而后在Y-DNA的基础上,设计出了连接体DNA(L-DNA),L-DNA可与Y-DNA交联形成DNA水凝胶[11]。此外,通过2次滚环扩增反应,使长链DNA分子通过链间缠绕也可以制备出水凝胶[12]。
1.2 化学成胶法
DNA化学水凝胶是以化学键作为交联点形成的水凝胶,可利用其他基团修饰的DNA链或通过DNA连接酶实现化学交联,具有较高的机械强度、稳定性和形状记忆性能。成胶方法比较复杂,以X形DNA(X-DNA)为例,4条局部碱基互补的单链DNA(single-stranded DNA,ssDNA)通过黏性末端的回文序列和T4连接酶,可以形成稳定的水凝胶三维网络结构[13]。此外,还可以利用自由基聚合反应将丙烯酰胺与修饰有甲基丙烯酰胺基团的多个ssDNA链,通过碱基互补配对和共聚交联形成稳定的水凝胶[14]。表1简要概括了DNA水凝胶2种成胶方式的特点。
表1 DNA水凝胶成胶方式
Table 1 Synthesis of DNA hydrogel

成胶方式操作复杂程度是否需要引入其他物质成胶原理性能物理成胶简单不需要物理相互作用更容易对pH、温度等刺激做出响应化学成胶复杂需要化学键连接具有较高的机械强度、稳定性和形状记忆性能
2 不同刺激响应信号型DNA水凝胶
根据刺激信号的类型不同,DNA水凝胶可分为温度响应型、pH响应型、光子响应型、生物分子响应型和多重响应型。
2.1 温度响应型DNA水凝胶
温度是一种常见的外界刺激信号,温度响应型DNA水凝胶主要通过碱基之间的氢键形成,其响应行为与双链DNA(double-stranded,ds-DNA)的熔融温度(Tm)有关。如以ds-DNA为交联剂,N-异丙基丙烯酰胺聚合物通过聚合反应形成DNA水凝胶,该水凝胶对温度有较强的响应性,根据温度变化表现出相应的体积变化[15]。温度响应型DNA水凝胶还可以通过包埋在DNA水凝胶中纳米颗粒的温度变化产生响应,如当聚丙烯酰胺DNA水凝胶中包封的纳米金颗粒(Au nanoparticles,AuNPs)被激活后,产生热量使温度上升,热诱导的核酸双链解离使水凝胶基质变为无定形状态,水凝胶的硬度发生了变化[16]。为了使这种温度响应形变可逆,WANG等[17]报道了一种通过双丙烯酰胺和核酸双链体或硼酸酯-葡糖胺和核酸双链体协同交联并包封有AuNPs或金纳米棒的水凝胶,如图2所示,根据温度变化可以在水凝胶低刚度和高刚度之间切换。温度响应型DNA水凝胶具有形状记忆、自我修复等特性,主要作为信息存储装置而广泛应用于医学领域,在食品领域应用较少,需要进一步关注。
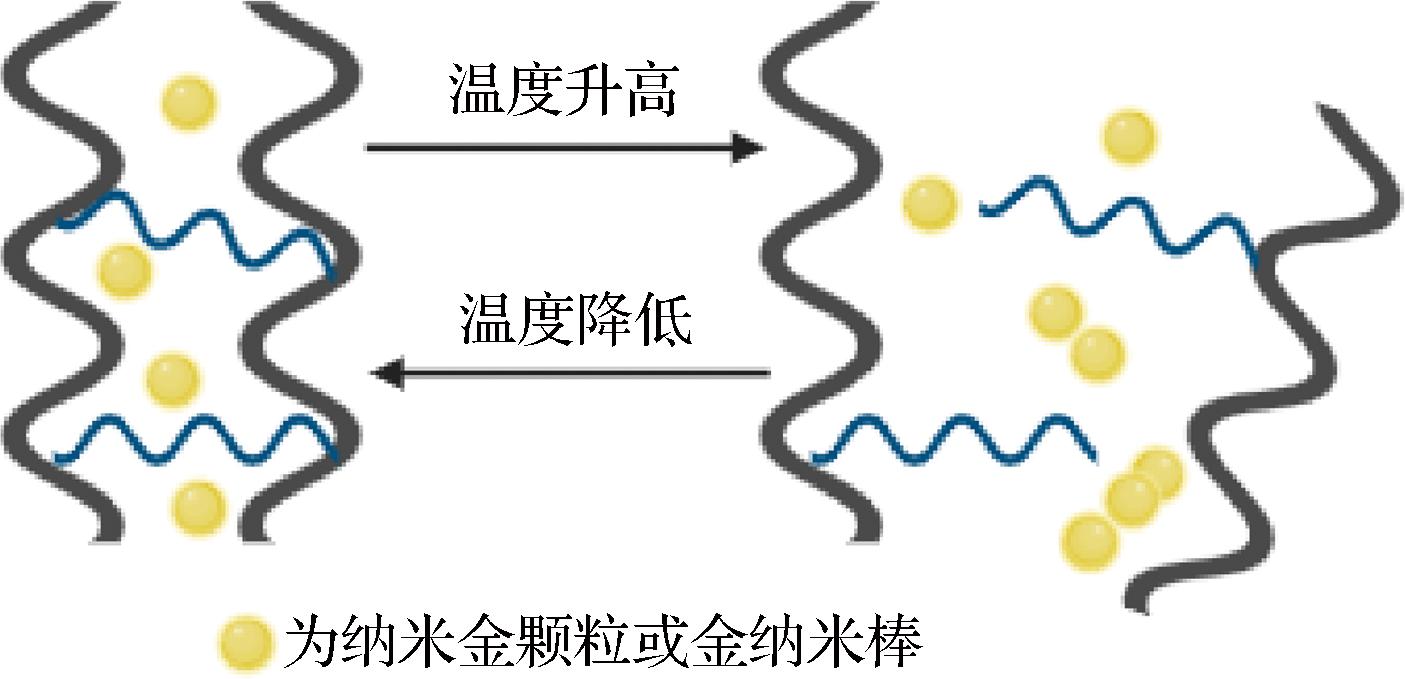
图2 温度响应型水凝胶响应机理[17]
Fig.2 Response mechanism of temperature responsive hydrogel[17]
2.2 pH响应型DNA水凝胶
pH梯度的存在是pH响应型DNA水凝胶的基础,当pH变化时,DNA水凝胶可以在凝胶态和液态之间转变。如三螺旋“C-G·C+”常被引入DNA水凝胶中以实现pH响应功能,通过改变pH形成C-G·C+三链体来释放引发剂链,在中性稳定环境中成溶胶态,在酸性环境中触发溶胶到凝胶的转变[18]。在此基础上,LU等[19]进一步引入了2种三螺旋结构(C-G·C+、T-A·T)构建,并通过pH控制的可逆水凝胶,如图3所示,在pH=7.0时,形成水凝胶,当通过添加盐酸将pH值调节至5.0时,水凝胶裂解成液态,并且这种反应是可逆的。此外,SHI等[20]通过将动力学连锁单元结合到DNA水凝胶中,设计了DNA双交叉骨架聚合体系,大大提升了水凝胶的机械强度和pH响应效率。pH响应型DNA水凝胶因其良好的生物相容性,在生物传感和药物递送等领域有较大的应用潜力,也可以进一步拓展到食品安全检测领域。
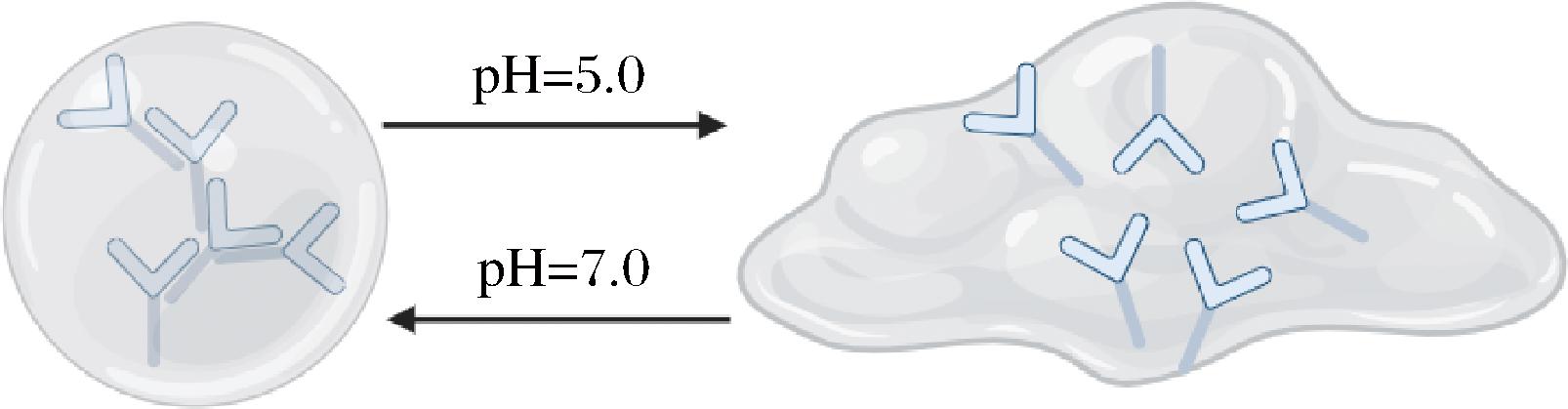
图3 pH响应型水凝胶响应机理[19]
Fig.3 Response mechanism of pH responsive hydrogel[19]
2.3 光子响应型DNA水凝胶
光子响应型DNA水凝胶在光照下会发生物理或化学变化,如KASAHARA等[21]报道了一种基于Y形DNA纳米结构光激活自组装的DNA水凝胶形状控制光刻方法,如图4所示,用光激活的接头来启动Y结构的自组装,其中交联剂DNA最初是无活性的,但在紫外线照射后被激活,在紫外线暴露区域形成形状受控的DNA水凝胶。
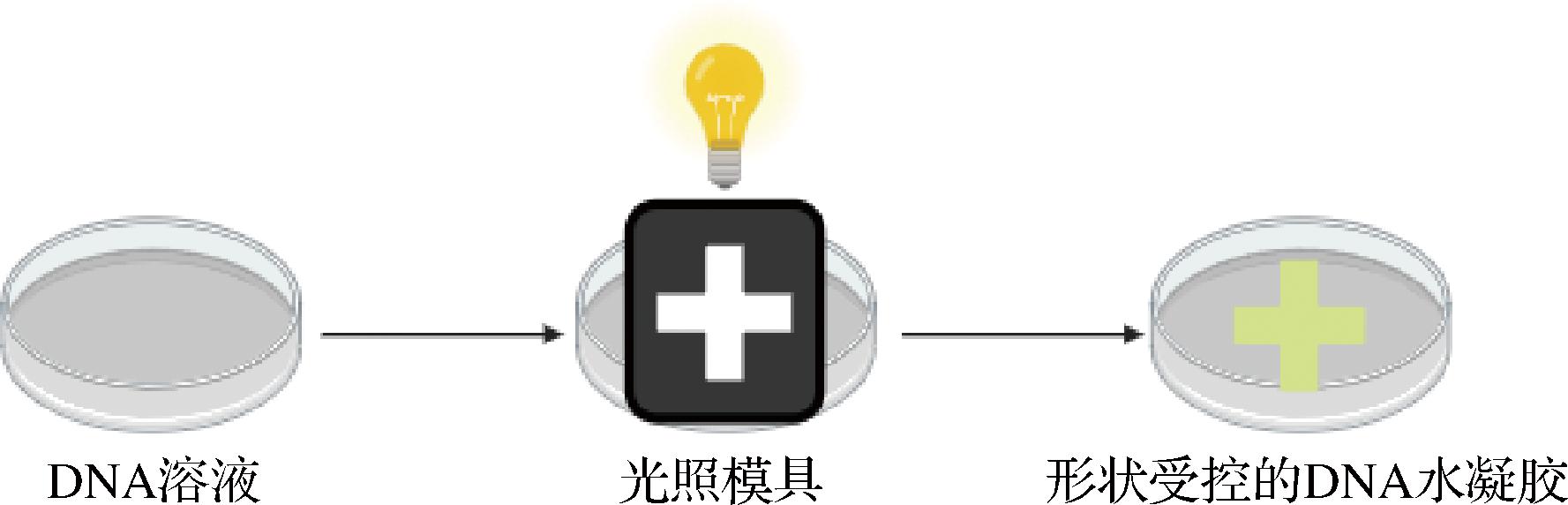
图4 光响应型DNA水凝胶响应机理[21]
Fig.4 Response mechanism of photo responsive DNA hydrogel[21]
LIU等[22]设计了一种包封AuNP的光响应性DNA水凝胶,在近红外光照射下产生有效的光热转换,对小鼠肿瘤有明显的抑制作用。CHEN等[23]首次将杂化链式反应(hybridization chain reaction,HCR)引入光子晶体(photonic crystals,PhCs)DNA水凝胶中,并将该水凝胶用作测定黄曲霉毒素B1(aflatoxin B1,AFB1)的生物传感器,通过使用特定的序列作为交联剂,HCR对交联剂的延伸驱动了水凝胶的溶胀,而二维 PhCs阵列的光学特性将这种溶胀转化为德拜衍射环的变化,对AFB1具有良好的测定性能和较高的特异性识别,由于DNA分子的高度可编程性,通过设计适配体序列,可以利用二维PhCs可视化光学特性的优势将此传感器的响应靶点扩展到各种分子,有望成为靶标现场快速检测的重要方法。光子响应DNA水凝胶的功能特性使其主要在摄影、光学存储、生物医学成像等领域应用广泛,同时在食品检测领域也有一定程度的应用。
2.4 生物分子响应型DNA水凝胶
具有生物分子刺激响应的水凝胶作为一种新型的智能材料,因其优异的生物学性能而大受关注,可对生物分子如糖和蛋白质等作出响应。如XIANG等[24]基于X-DNA和末端脱氧核苷酸转移酶(terminal deoxynucleotidyl transferase,TdT)聚合制备了纯DNA水凝胶,TdT聚合显著减少了所需的原始DNA基序数量,并赋予了水凝胶较高的机械强度,通过将葡萄糖氧化酶包封到DNA水凝胶中形成级联反应,可以实现葡萄糖的可视化检测,是一种很有发展的模块化平台。MA等[25]开发了一种由滚动扩增反应(rolling circle amplification,RCA)产生的长ssDNA组成,DNA双链体交联的DNA水凝胶,可以选择性地从溶液中捕获和分离蛋白质,并且无需复杂的分离过程,由于这种DNA水凝胶可以独立捕获溶液中的靶标,因此可以使用靶向不同化合物的多个DNA水凝胶同时分离溶液中的不同化合物,这项工作不仅拓展了DNA水凝胶的应用,还为开发新型选择性生物材料铺平了道路。食品安全检测大多是对食品中的生物分子进行检测,因此生物分子响应型DNA水凝胶在食品安全领域中显示出巨大的潜力。
2.5 多重响应型DNA水凝胶
GUO等[26]合成了一种对温度和pH都有响应的DNA水凝胶,当pH=5.2时,水凝胶呈凝胶态;pH=7.5时,水凝胶呈溶胶态;当温度为25 ℃时,水凝胶呈凝胶态;当温度45 ℃时,水凝胶呈溶胶态,并且在这个过程中凝胶态和溶胶态的转变是可逆的。SU等[27]采用“one-pot”快速合成法,以2-甲酰基苯硼酸为交联剂,分别与羧甲基壳聚糖和表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)形成希夫氏碱和硼酸酯键,构建了双动态共价交联网络,可对pH和温度双重响应,pH的降低和温度的升高都会加速水凝胶的裂解,提高EGCG的释放率,从而促进伤口愈合。多重响应型DNA水凝胶的出现,进一步拓展了DNA水凝胶的功能特性,使用起来更加灵活高效。
3 DNA水凝胶在食品安全领域的应用
食品安全问题存在于田间牧场、运输储存、超市餐桌等食品供应链的多个环节中,在食品安全领域中开发能满足多环境条件下准确且快速的检测技术是保障食品安全的重要一步。由于具备刺激响应性、生物相容性、三维孔隙率和低成本等多重优势,使DNA水凝胶生物传感器在食品安全快速检测中的应用越来越广泛,主要用于检测真菌毒素、重金属离子、食源性致病菌、抗生素残留、非法添加剂等。
3.1 DNA水凝胶在真菌毒素检测中的应用
粮油质量安全一直是国际社会关注的重要问题,保障粮油质量安全对国民的健康、社会和谐、国家稳定意义重大。目前粮油质量存在很多的安全隐患[28],其中真菌毒素如AFB1、玉米赤霉烯酮(zearalenone,ZEN)、赭曲霉毒素A(ochratoxin,OTA)、呕吐毒素(deoxynivalenol,DON)等是较为常见的粮油污染因素,鉴于这些真菌毒素的广泛分布和严重危害性,亟需开发简单、快速、高灵敏度的真菌毒素检测方法。如图5所示,本文作者所在的团队开发了一种基于适配体交联的DNA水凝胶用于检测ZEN,A链和修饰有淬灭基团的B链在丙烯酰胺单体存在时发生共聚形成聚合物PS-A和PS-B,修饰有荧光基团FAM的适配体作为信号探针和交联剂可以与PS-A和PS-B通过碱基互补配对,交联形成DNA水凝胶,在ZEN加入后可以准确快速的识别并使水凝胶发生裂解,水凝胶裂解的同时,修饰有荧光基团的适配体链和修饰有淬灭基团的适配体互补链分离,荧光信号上升,通过对荧光强度变化的检测和分析,可完成对ZEN的定性和定量分析。
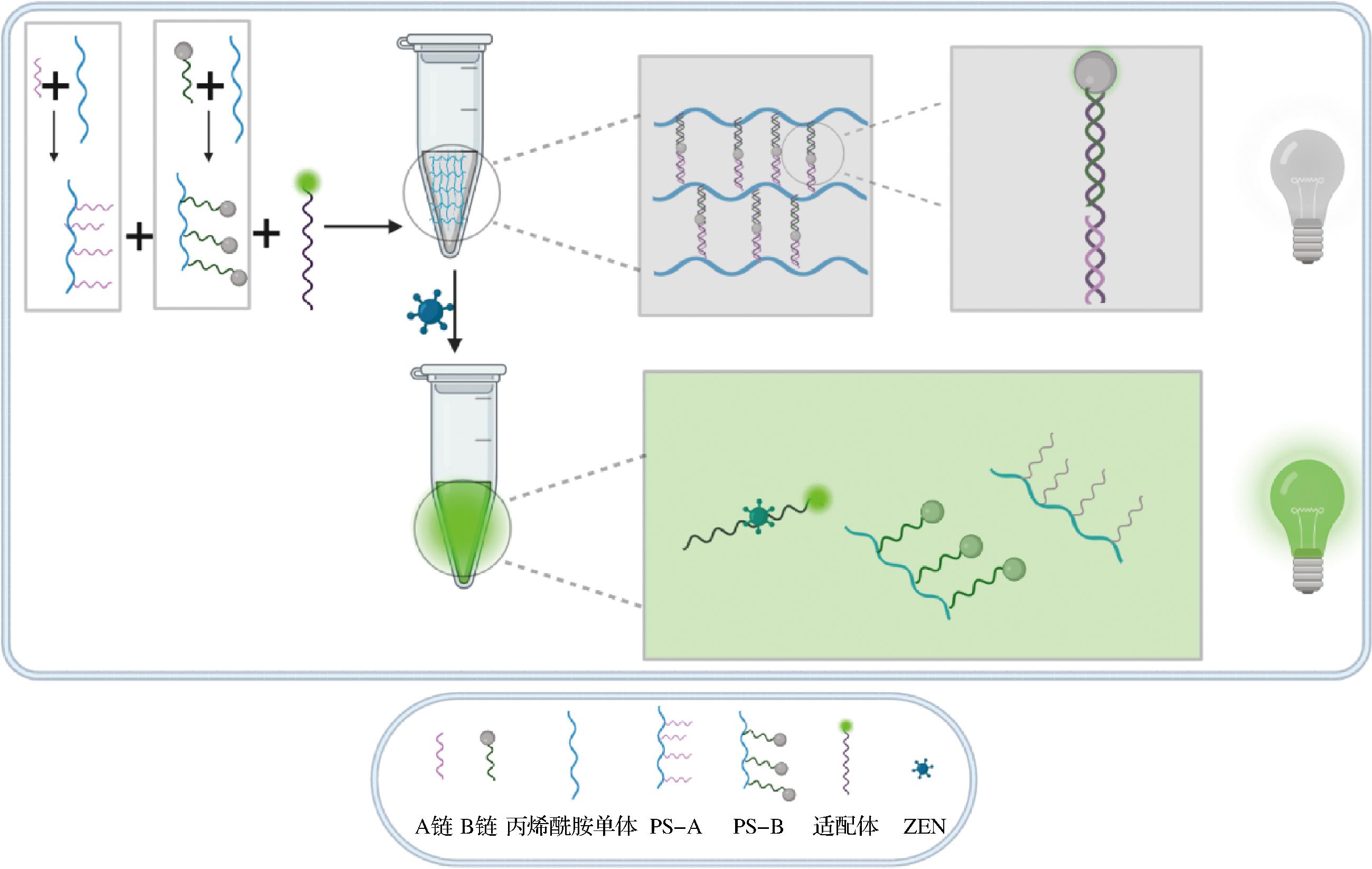
图5 一种用于检测真菌毒素ZEN的DNA水凝胶生物传感器
Fig.5 A DNA hydrogel biosensor for detecting mycotoxin ZEN
FAN等[29]设计了一种基于铜纳米团簇修饰的血红素包封靶向响应DNA水凝胶,用于真菌毒素OTA的双模传感,OTA的存在可以直接控制DNA水凝胶的解离,引起铜纳米团簇的荧光猝灭和预包被血红素的释放,由于适配体与OTA结合的特殊结构,G-四链体可以与血红素自组装,生成具有过氧化物酶活性的G-四链体/血红素DNA酶,可催化H2O2进一步淬灭铜纳米团簇的荧光以进行信号放大,同时还可以催化3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)的氧化产生比色信号,通过单个信号转换,该策略可以实现相互补充和自验证,以确保结果的可靠性和准确性。ZHENG等[30]以AFB1适配体作为水凝胶的交联剂和识别原件,并结合信号放大策略,构建了AFB1响应的DNA水凝胶,AFB1的存在引起水凝胶的裂解并释放包裹的辣根过氧化物酶(horseradish peroxidase,HRP),添加的核酸外切酶I(exonuclease-I,Exo-I)将已经与适配体结合的AFB1特异性识别并切割下来,使AFB1再次参与到水凝胶裂解中,实现了信号的放大,释放更多的HRP催化体系外的过氧化氢促使TMB显色,从而实现AFB1可视化精准定量。这种信号放大策略为提升DNA水凝胶的灵敏度提供了新思路。
3.2 DNA水凝胶在重金属离子检测中的应用
重金属污染已成为全球性重大问题,对人体健康造成不良影响,重金属污染主要有2种暴露途径:土壤中的重金属污染物通过食物链直接进入人体;通过影响水体和大气环境间接对人体健康造成威胁[31]。重金属离子的监测一直是一项重要挑战,DNA水凝胶可以修饰许多与金属离子相互作用的官能团,在对重金属的检测中表现出巨大的潜力。汞是一种常见的重金属元素,具有较高的生物毒性,即使微量的汞也会导致严重的健康问题,例如脑功能障碍、肾脏和免疫系统损伤。ZHANG等[32]开发了一种基于电化学信号变化检测Hg2+的DNA水凝胶生物传感器,制备简单且可重复使用,其检测原理为DNA修饰的电极可捕获互补探针,形成双螺旋结构阻止电子转移,一旦Hg2+和DNA探针特异性结合就会形成T-Hg2 +-T与T-T错配的相互作用,电化学信号上升,该生物传感器在水样检测方面表现出优异的性能。铅通过食物链在人体内蓄积,对人体健康造成严重危害,世界卫生组织建议自来水中Pb2+的最大污染水平浓度为48 nmol/L,因此非常需要开发一种成本低、制备简单的传感器,以快速定量检测Pb2+。LIU等[33]开发了一种基于Pb2+激活DNA酶进一步引发DNA水凝胶裂的生物传感器,Pb2+的存在激活DNA酶切割其底物链,导致DNA水凝胶裂解,通过裂解DNA水凝胶释放的游离水分子来定量检测,满足3.0 nmol/L的检出限,并在自来水中进行了验证,可以满足实际检测要求,为刺激响应型DNA水凝胶在自来水安全监测方向提供了新的视角。
3.3 DNA水凝胶在食源性致病菌检测中的应用
近年来,因食源性致病菌造成的食品中毒事件正在不断增加,严重威胁了人类的健康,如大肠杆菌(Escherichia coli)O157∶H7由于其低感染剂量和高致病性等特点引起了研究人员和世界卫生组织的高度重视,因此精准快速的检测食品中的食源性致病菌对食品安全问题有着重要的意义,是预防和控制食源性疾病传播的重要环节[34]。ZHANG等[35]开发了一种基于醛磁珠、滚环扩增技术构建的DNA水凝胶,并应用于大肠杆菌O157∶H7的快速可视化检测,该方法的检测灵敏度和特异性较高,1 h内检出限为4×10 CFU/mL,可在30 min内检测完成。XU等[36]研发了一种基于噬菌体-DNA探针的通用双模水凝胶阵列,采用荧光/微流控芯片电泳法同时快速检测食品中大肠杆菌O157∶H7,大肠杆菌和凝胶单体混合均匀形成水凝胶后,将噬菌体-DNA探针特异性结合到凝胶包封的大肠杆菌上,修饰后的噬菌体DNA在水凝胶网络中进行RCA,使用短链互补DNA(complementary DNA,cDNA)与水凝胶网络中的RCA产物杂交形成双链,添加荧光染料后,随着DNA长度的延长,荧光信号得到增强,用于肉眼快速筛选靶标,微流控芯片电泳检测残留cDNA,进一步准确灵敏地检测大肠杆菌O157∶H7,该方法已经扩展到使用相应的鼠伤寒沙门氏菌噬菌体检测鼠伤寒沙门氏菌,为同时快速筛选和精确定量检测食源性细菌提供了一种通用方法。
3.4 DNA水凝胶在残留抗生素检测中的应用
抗生素类药物具有抑制或杀灭微生物的作用,不仅可以预防和治疗人类及畜禽细菌感染等疾病,还可用作饲料添加剂,在畜牧业中得到广泛应用,然而,有些不良商家为追求养殖利益滥用抗生素,造成畜禽体内抗生素残留超标,无论是畜禽体内残留还是排入环境,抗生素最终都会经食物链直接或间接地进入人体,危害人类健康。因此,开发快速且准确的抗生素检测方法对于保障食品安全至关重要[37]。WANG等[38]研究了一种使用金纳米棒(Au nanorods,AuNRs)阵列和嵌入DNA酶的DNA水凝胶制成的新型表面增强拉曼光谱(surface enhancement of Raman scattering,SERS)开关传感器检测食品中的链霉素,自组装的AuNRs阵列用作链霉素分析检测的SERS底物,利用可切换响应的三维DNA水凝胶来精确控制拉曼报告基因4-MB的释放,链霉素存在下,链霉素与适配体之间的特异性相互作用破坏了Pb2+诱导的G-四链体结构,游离Pb2+释放激活Pb-DNA酶,使SERS底物上的DNA水凝胶裂解并释放4-MB,吸附的4-MB引起的SERS信号与链霉素的量成正比,产生强烈的拉曼信号。
3.5 DNA水凝胶在非法添加剂检测中的应用
非法添加剂一般具有强致畸性和强致癌性,对人体危害巨大,是多国禁止用于食品中的物质。如三聚氰胺作为一种化工原料,用于制造三聚氰胺树脂,严禁人为添加到食品中,一些不法商家为提高含氮量在食品中添加三聚氰胺,造成食品中蛋白质含量高的假象,此类不合格食品被人食用后严重影响人体健康[39]。WANG等[40]设计了一种DNA水凝胶与微流控芯片相结合用于三聚氰胺检测,在三聚氰胺存在的情况下,特定的适配体将与之竞争性结合,导致DNA水凝胶中的交联程度下降,通过检测DNA水凝胶分解后嵌入的AuNPs的释放,可以实现比色定量检测,使用手机拍摄的图像并使用特定软件进行分析,可用于实现即时检验,该方法在食品安全分析中有很高的应用潜力。莱克多巴胺(ractopamine,RAC)作为一种具有严重副作用的非法饲料添加剂,在肉制品中以痕量含量存在,会导致人体出现严重的健康问题,如急性中毒、心脏病和癌症。BIAN等[41]研究制备了Au@Pd包封的DNA水凝胶作为靶响应和信号放大材料,为RAC检测构建了超灵敏光学平台。RAC的加入通过竞争核酸适配体结合来降低交联密度,从而导致水凝胶塌陷并释放出预封装的Au@Pd来充当信号放大器和信息输出单元,该方法融合了DNA杂交技术和纳米颗粒催化技术,在RAC的定量检测中表现出优异的性能,同时也为DNA水凝胶的信号放大机制提供了又一种思路。
4 结论与展望
本文简要介绍了DNA水凝胶的合成方式,综述了近年来DNA水凝胶刺激响应的信号类别和在食品安全领域的应用。DNA水凝胶具有如序列可设计性、精确的识别能力、可控的刺激响应、良好的生物相容性和生物降解性等一系列独特的性质,这些使DNA水凝胶在食品安全领域应用广泛。但依然存在很多挑战:
1)由于食品基质的复杂性,有必要研发更稳定的DNA水凝胶,以减小检测条件对检测结果的影响。
2)尽管各种信号的视觉感受简单而直接,灵敏度和定量问题依然限制着DNA水凝胶的使用,利用信号放大机制等方法来提高灵敏度仍然需要深入研究。
3)虽然已经研究了一些刺激响应水凝胶的控制释放原理,但理论动力学研究很少直接说明DNA水凝胶的释放特性。所以仍需要进一步深入探讨DNA水凝胶对外界刺激响应的动力学研究,以完善水凝胶在“控制释放”方面的发展,使DNA水凝胶的设计更加合理,适应更多的生物传感应用。
4)待检测物的扩散时间虽然在很大程度上取决于其自身的大小,但缓慢的扩散依然会干扰灵敏度、延长检测时间,需要引入更多的新方法来实现快速响应。
5)成本高、大规模制备困难仍然是制约DNA水凝胶生物传感器在实际应用方面的主要障碍,开发出更高效的合成方法或者通过与其他材料的混合来降低制造成本是一项长期的挑战。
随着药学、医学、生命科学、食品科学等相关学科的进步和学科交叉的融合,DNA水凝胶是拥有更广阔前途的材料,可应用于食品供应链的多个阶段来保障食品安全。
[1] KAFOURIS D, CHRISTOFIDOU M, CHRISTODOULOU M, et al.A validated UPLC-MS/MS multi-mycotoxin method for nuts and cereals:Results of the official control in Cyprus within the EU requirements[J].Food and Agricultural Immunology, 2017, 28(1):90-108.
[2] AL-TAHER F, BANASZEWSKI K, JACKSON L, et al.Rapid method for the determination of multiple mycotoxins in wines and beers by LC-MS/MS using a stable isotope dilution assay[J].Journal of Agricultural and Food Chemistry, 2013, 61(10):2378-2384.
[3] OK H E, CHOI S W, KIM M, et al.HPLC and UPLC methods for the determination of Zearalenone in noodles, cereal snacks and infant formula[J].Food Chemistry, 2014, 163:252-257.
[4] WANG Y R, ZHU Y, HU Y, et al.How to construct DNA hydrogels for environmental applications:Advanced water treatment and environmental analysis[J].Small, 2018, 14(17):e1703305.
[5] KAHN J S, HU Y W, WILLNER I.Stimuli-responsive DNA-based hydrogels:From basic principles to applications[J].Accounts of Chemical Research, 2017, 50(4):680-690.
[6] WANG D, HU Y, LIU P F, et al.Bioresponsive DNA hydrogels:Beyond the conventional stimuli responsiveness[J].Accounts of Chemical Research, 2017, 50(4):733-739.
[7] CUI H X, HAN W, YANG D Y, et al.Molecular design, synthesis and applications of DNA hydrogel[J].Chinese Science Bulletin, 2014, 59(2):107-115.
[8] LIU J W.Oligonucleotide-functionalized hydrogels as stimuli responsive materials and biosensors[J].Soft Matter, 2011, 7(15):6757-6767.
[9] CULVER H R, CLEGG J R, PEPPAS N A.Analyte-responsive hydrogels:Intelligent materials for biosensing and drug delivery[J].Accounts of Chemical Research, 2017, 50(2):170-178.
[10] CHENG E J, XING Y Z, CHEN P, et al.A pH-triggered, fast-responding DNA hydrogel[J].Angewandte Chemie (International Ed.in English), 2009, 48(41):7660-7663.
[11] ZHANG L, LEI J P, LIU L, et al.Self-assembled DNA hydrogel as switchable material for aptamer-based fluorescent detection of protein[J].Analytical Chemistry, 2013, 85(22):11077-11082.
[12] LEE J B, PENG S M, YANG D Y, et al.A mechanical metamaterial made from a DNA hydrogel[J].Nature Nanotechnology, 2012, 7(12):816-820.
[13] UM S H, LEE J B, PARK N, et al.Enzyme-catalysed assembly of DNA hydrogel[J].Nature Materials, 2006, 5(10):797-801.
[14] GUO W W, LU C H, ORBACH R, et al.pH-stimulated DNA hydrogels exhibiting shape-memory properties[J].Advanced Materials, 2015, 27(1):73-78.
[15] UZUMCU A T, GUNEY O, OKAY O.Nanocomposite DNA hydrogels with temperature sensitivity[J].Polymer, 2016, 100:169-178.
[16] CHANG G R, WANG Y L, GONG B Y, et al.Reduced graphene oxide/amaranth extract/AuNPs composite hydrogel on tumor cells as integrated platform for localized and multiple synergistic therapy[J].ACS Applied Materials &Interfaces, 2015, 7(21):11246-11256.
[17] WANG C, LIU X, WULF V, et al.DNA-based hydrogels loaded with Au nanoparticles or Au nanorods:Thermoresponsive plasmonic matrices for shape-memory, self-healing, controlled release, and mechanical applications[J].ACS Nano, 2019, 13(3):3424-3433.
[18] LI Y J, CHEN J, DONG Y C, et al.Construction of pH-triggered DNA hydrogels based on hybridization chain reactions[J].Chemical Research in Chinese Universities, 2020, 36(2):243-246.
[19] LU S S, WANG S, ZHAO J H, et al.A pH-controlled bidirectionally pure DNA hydrogel:Reversible self-assembly and fluorescence monitoring[J].Chemical Communications, 2018, 54(36):4621-4624.
[20] SHI J Z, ZHU C Y, LI Q, et al.Kinetically interlocking multiple-units polymerization of DNA double crossover and its application in hydrogel formation[J].Macromolecular Rapid Communications, 2021, 42(14):e2100182.
[21] KASAHARA Y, SATO Y, MASUKAWA M K, et al.Photolithographic shape control of DNA hydrogels by photo-activated self-assembly of DNA nanostructures[J].APL Bioengineering, 2020, 4(1):016109.
[22] LIU B, SUN J, ZHU J J, et al.Injectable and NIR-responsive DNA-inorganic hybrid hydrogels with outstanding photothermal therapy[J].Advanced Materials, 2020, 32(39):e2004460.
[23] CHEN Q S, WU L F, ZHAO F, et al.Construction of hybridization chain reaction induced optical signal directed change of photonic crystals-DNA hydrogel sensor and its visual determination for aflatoxin B1[J].Food Chemistry, 2023, 418:135891.
[24] XIANG B B, HE K Y, ZHU R, et al.Self-assembled DNA hydrogel based on enzymatically polymerized DNA for protein encapsulation and enzyme/DNAzyme hybrid cascade reaction[J].ACS Applied Materials &Interfaces, 2016, 8(35):22801-22807.
[25] MA Y Z, HE S W, HUANG J Y.DNA hydrogels as selective biomaterials for specifically capturing DNA, protein and bacteria[J].Acta Biomaterialia, 2022, 147:158-167.
[26] GUO W W, LU C H, QI X J, et al.Switchable bifunctional stimuli-triggered poly-N-isopropylacrylamide/DNA hydrogels[J].Angewandte Chemie (International Ed.in English), 2014, 53(38):10134-10138.
[27] SU K Z, DENG D Y, WU X X, et al.On-demand detachable adhesive hydrogel based on dual dynamic covalent cross-linked with NIR/pH dual-responsive properties for diabetic wound healing[J].Chemical Engineering Journal, 2024, 479:147646.
[28] 许继平, 韩佳琪, 张新, 等.基于可信区块链和可信标识的粮油质量安全溯源研究[J].食品科学, 2023, 44(3):48-59.
XU J P, HAN J Q, ZHANG X, et al.Quality and safety traceability of grains and oils based on trusted blockchain and trusted identity[J].Food Science, 2023, 44(3):48-59.
[29] FAN P F, LI Q J, ZHANG Z D, et al.A G-quadruplex-assisted target-responsive dual-mode aptasensor based on copper nanoclusters synthesized in situ in a DNA hydrogel for ultrasensitive detection of ochratoxin A[J].Talanta, 2024, 270:125550.
[30] ZHENG M Y, LIU H M, YE J, et al.Target-responsive aptamer-cross-linked hydrogel sensors for the visual quantitative detection of aflatoxin B1 using exonuclease I-Triggered target cyclic amplification[J].Food Chemistry:X, 2022, 15:100395.
[31] 张群. 食品中重金属离子高灵敏快速检测技术研究与应用[J].食品与生物技术学报, 2023, 42(4):112.
ZHANG Q.Research and application of high sensitive and rapid detection technology for heavy metal ions in food[J].Journal of Food Science and Biotechnology, 2023, 42(4):112.
[32] ZHANG Y Y, ZHANG C, MA R, et al.An ultra-sensitive Au nanoparticles functionalized DNA biosensor for electrochemical sensing of mercury ions[J].Materials Science &Engineering.C, Materials for Biological Applications, 2017, 75:175-181.
[33] LIU J P, BI Y H, TAI W J, et al.The development of a paper-based distance sensor for the detection of Pb2+ assisted with the target-responsive DNA hydrogel[J].Talanta, 2023, 257:124344.
[34] 周炳武, 于泽, 闫兆伦, 等.食品中肠出血性大肠杆菌O157∶H7的检测技术研究进展[J].中国食品添加剂, 2024, 35(1):303-313.
ZHOU B W, YU Z, YAN Z L, et al.Research progress in detection of Enterohemorrhagic Escherichia coli O157∶H7 in food[J].China Food Additives, 2024, 35(1):303-313.
[35] ZHANG T, TAO Q, BIAN X J, et al.Rapid visualized detection of Escherichia coli O157:H7 by DNA hydrogel based on rolling circle amplification[J].Chinese Journal of Analytical Chemistry, 2021, 49(3):377-386.
[36] XU J, YU J L, LIU W Y, et al.A universal dual-mode hydrogel array based on phage-DNA probe for simultaneous rapid screening and precisely quantitative detection of Escherichia coli O157:H7 in foods by the fluorescent/microfluidic chip electrophoresis methods[J].Analytica Chimica Acta, 2024, 1287:342053.
[37] 付海燕, 卢欢欢, 龙婉君, 等.动物源食品中抗生素残留检测方法与研究进展[J].轻工学报, 2023, 38(6):37-45.
FU H Y, LU H H, LONG W J, et al.Progress in the detection methods of antibiotic residues in animal derived food and research[J].Journal of Light Industry, 2023, 38(6):37-45.
[38] WANG X M, CHEN C, WATERHOUSE G I N, et al.Ultra-sensitive detection of streptomycin in foods using a novel SERS switch sensor fabricated by AuNRs array and DNA hydrogel embedded with DNAzyme[J].Food Chemistry, 2022, 393:133413.
[39] 张淑芳, 崔婷婷.HPLC法测定含乳饮料中的三聚氰胺[J].食品安全导刊, 2022(13):66-68.
ZHANG S F, CUI T T.Determination of melamine in milk beverage by HPLC[J].China Food Safety Magazine, 2022(13):66-68.
[40] WANG Z G, CHEN R P, HOU Y, et al.DNA hydrogels combined with microfluidic chips for melamine detection[J].Analytica Chimica Acta, 2022, 1228:340312.
[41] BIAN Y L, ZHOU Z X, LI G H, et al.Bimetallic nanozymes laden DNA hydrogel for ultrasensitive optical detection of ractopamine[J].Sensors and Actuators B:Chemical, 2023, 380:133402.