人参为五加科植物人参(Panax ginseng C.A.Mey.)的干燥根和根茎,具有大补元气、复脉固脱、补脾益肺、生津养血、安神益智的功效。其中主根和地上茎之间的一个盘结状的地下根茎部位称为芦头(参芦)。通过人参芦头可以鉴别人参的生长年限、生长环境、品质优劣等特征。人参芦头含有人参皂苷、挥发油、氨基酸,以及多种无机元素(铁、铝、钙、钡、铜、锰、磷、锶、钛、锆、镉、铬、镍等),因而人参芦头具有良好的药用价值。据《本草正义》等古代典籍记载人参芦头具有升阳举陷,治疗脾虚气陷、久泻、脱肛的功效[1]。自五代《海药本草》提出人参“用时去其芦头,不去者吐人”之说,部分医籍如《本经逢源》将其“专入吐剂”。人参芦头占人参重量的比例为12%~15%,由于其具有催吐或类似副作用,因而人参在炮制的过程中往往去芦,去芦使用导致人参整体有效成分中人参皂苷的损失和人参资源浪费,不利于我国循环经济的发展。
人参芦头中富含多种人参皂苷,人参皂苷是人参的主要活性物质,WANG等[2]报道有131种皂苷单体在林下参和园参的主根及芦头中检出。刘静玉等[3]利用高效薄层色谱和高效液相色谱指纹图谱以及模式识别的方式对人参根茎和主根的主要皂苷成分进行比较分析,发现人参芦头与主根和全参化学成分类型一致,其中人参皂苷Ro、Rb1等6个成分在人参芦头中相对含量显著高于主根。CHEN等[4]采用液质联用技术对产自新西兰的人参和西洋参不同部位(细根、芦头、主根、茎和叶)的人参皂苷成分进行了分析,发现与其他组织相比,细根中的人参皂苷含量最丰富,新西兰人参[(142.49±1.14) mg/g]和西洋参[(115.69±3.51) mg/g]结果一致。对于两者各种人参皂苷,Rb1在地下部位(细根、芦头和主根)含量最高,而人参皂苷Re在地上部位(茎和叶)最高。
不同类型的人参皂苷单体之间可以进行转化,人参皂苷的转化方法可以分为化学转化[5]和生物转化[6],生物转化包括酶解法[6]和微生物发酵转化法[7]。微生物发酵转化法是指微生物利用底物中的碳源和氮源,产生相应的酶与人参皂苷中的糖苷键发生反应,使得糖苷键被水解,进而转化为相对应类型的皂苷。如:BAI等[8]利用植物乳杆菌产β-葡萄糖苷酶的特性,将Rb1转化成Rk1和Rg5。卲淇等[9]从水果和酸菜汁中分离出的发酵乳杆菌、植物乳杆菌和植物乳球菌能将Rb1转化为F2和Compound K;QUAN等[10]研究指出发酵乳杆菌在发酵人参的过程中,可以先将人参皂苷转化为Rd,人参皂苷Rd又可以进一步被转化为稀有皂苷F2,最终转化为Rg3和CK。研究表明,微生物转化具有反应特异性强、副产物少、条件温和、对环境友好等优点,且微生物繁殖能力强、生长周期短、适应能力好,易于工业放大生产,因而微生物发酵转化技术被广泛应用于天然产物的生物转化及结构修饰中[11]。
本研究构建了基于超高液相色谱法(ultra high performance liquid chromatography,UHPLC)的人参皂苷单体检测方法,在此基础之上,通过微生物发酵转化法筛选出了能够发酵人参芦头转化人参皂苷Rd的最佳菌株LM 4-2,利用单因素试验与响应面试验设计,确定了菌株LM 4-2的最佳发酵条件以及可能的转化通路,同时,研究还对发酵液的抗氧化和抑菌功能进行了测试,为人参芦头微生物发酵转化人参皂苷Rd、提高人参资源的综合利用提供参考。
1 材料与方法
1.1 材料与试剂
人参芦头,天津百赛斯生物科技有限公司;Lactobacillus iatae S-7、Lactobacillus ruminis K19、Lactobacillus plantarum 2992、Lactobacillus plantarum 6595、Lacticaseibacillus casei N5,浙江省农科院提供;Bacillus subtilis LM 4-2(CGMCC 1.15213),本课题组筛选得到;PhantaTM Max Super-Fidelity DNA聚合酶,天津舒伯格文生物试剂贸易有限公司;MRS肉汤培养基, 广州市左克生物科技发展有限公司;MRS培养基, 上海吉至生化科技有限公司;琼脂糖、Gelred核酸染料, 生工生物工程(上海)股份有限公司;细菌通用引物27F、1492R,北京擎科生物科技有限公司;正丁醇、HPLC级甲醇, 上海麦克林生化科技股份有限公司。
1.2 仪器与设备
5425离心机, 天津奥佳科技股份有限公司;JC-80数显细胞破碎混合器, 宁波韩电电器有限公司;DYCP-31F型琼脂糖水平电泳仪电泳槽, 北京六一生物科技有限公司;BXM-30R型立式高压蒸汽灭菌锅, 上海博迅医疗生物仪器股份有限公司;HH-2型电热恒温水浴锅, 唐山力辰科技有限公司;722N型紫外光分光光度计, 上海析谱仪器有限公司;ZQZY-CF-9.9振荡培养箱, 上海知楚仪器有限公司;SW-CJ-2D型超净工作台, 苏州净化设备有限公司;YDZ-50烘箱, 上海一恒科学仪器有限公司;VORTEX-6涡旋振荡器, 海门市其林贝尔仪器制造有限公司;BCD-215WTM(E) 冰箱, 美的公司;BYJ1-20L-D实验室超纯水仪, 华创科技有限公司;IMS-100制冰机, 常熟市雪科电器有限公司;FW100粉碎机, 天津市泰斯特仪器有限公司;JP-060S超声波清洗机, 深圳市洁盟清洗设备有限公司;ACQUITY Arc超高效液相色谱仪, Waters公司;N-1300旋转蒸发仪, 上海爱朗仪器有限公司。
1.3 人参皂苷单体检测方法体系的构建
采用超高效液相色谱仪进行人参皂苷样品和标准品的检测,并绘制13种人参皂苷(Rg1、Re、Rf、Rh1、Rb1、Rc、Rb2、Rd、F2、Rg3、CK、Rh2、PPD,结构图见电子增强出版附图1,https://doi.org/10.13995/j.cnki.11-1802/ts.038539)标准品的线性回归方程。
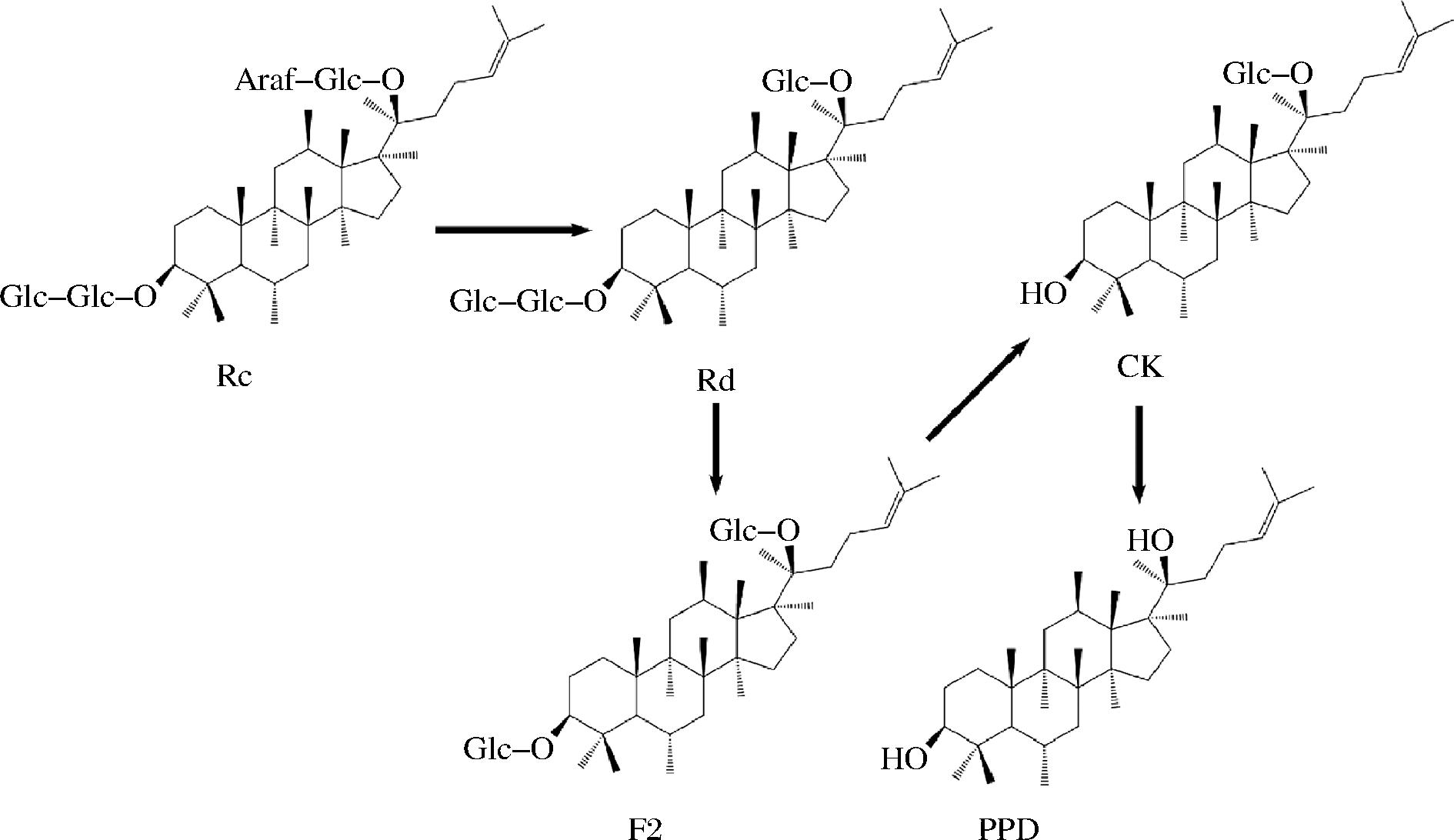
图1 菌株B.subtilis LM 4-2转化人参皂苷Rc的可能途径
Fig.1 Potential pathway for the transformation of ginsenoside Rc by B.subtilis LM 4-2
色谱条件:Waters XBridge C18色谱柱(3.0 mm×150 mm,2.5 μm);流动相A为纯水,流动相B为纯乙腈,进行梯度淋洗(0~16 min,81% A,16~20 min,81%~76% A,20~46 min,76%~60% A,46~50 min,60%~10% A,50~60 min,10% A,60~65 min,10%~81% A,65~80 min 81%A):流量0.5 mL/min:柱箱温度30 ℃;检测波长203 nm;进样量10 μL。
精确度测定:采用上述超高效液相色谱条件,选取13种人参皂苷单体分别配置成1 mg/mL的标准溶液,混合后进行5次重复进样,对检测的标准品峰面积进行比较,计算测量值与相对标准偏差(relative standard deviation,RSD)。
稳定性试验:采用上述的超高效液相色谱条件,选取13种人参皂苷单体,配置成质量浓度为1 mg/mL的标准溶液,混合后进行间隔时间段重复进样,记录每次检测的相应峰面积,对检测的标准品峰面积进行比较,计算测量值与RSD。
加标回收率测试:精密称取已知各个皂苷含量的人参提取物,加入13种人参皂苷单体标准品,按照上述色谱条件测定人参皂苷单体含量,计算13种人参皂苷单体的回收率。
1.4 人参芦头发酵及人参皂苷提取
参考苏敏等[12]提取人参皂苷的方法,将人参芦头用粉碎机进行粉碎,粉碎后过40目筛,取粉碎后的人参芦头粉1 g放入50 mL三角瓶中,按料液比1∶10(g∶mL)混匀制成匀浆,放入高压蒸汽灭菌锅121 ℃灭菌30 min。灭菌好的人参匀浆冷却,按照1%的接种量(100 μL)分别加入培养好的菌液(OD值 0.8),在三角瓶中混合均匀后,置于摇床中进行发酵,发酵条件为120 r/min、30 ℃、18 h、时间4 d,发酵在正常大气含氧量条件下进行;同时设立平行的空白对照组(加入1 mL无菌水代替菌液至三角瓶中,其他条件不变)。发酵结束后,在三角瓶中分别加入50 mL水饱和正丁醇,静置12 h后,进行超声处理(250 W、50 Hz、30 min),过滤后弃去初滤液,吸取25 mL续滤液于50 mL蒸馏瓶中采用旋转蒸发仪进行旋转蒸干,将干燥的粉末用甲醇溶解,定容至5 mL,质量浓度为0.1 g/mL,采用2.5 mL注射器吸取1 mL溶液,用0.22 μm滤头过滤后置于液相小瓶中,用于后续超高效液相色谱检测。
1.5 抗氧化性检测
采用DPPH自由基清除能力检测试剂盒进行抗氧化检测,其原理是DPPH 自由基有单电子,其醇溶液呈紫色,在 515 nm处有强吸收。当有抗氧化剂存在时,DPPH自由基被清除,其溶液颜色变浅,515 nm的吸光度下降,在一定范围内其吸光度的变化与自由基被清除的程度成正比。
提取物样本的制备:为了保持前处理的一致性,未发酵的人参芦头粉末加入无菌水,之后放入高压灭菌锅中进行灭菌处理,将灭菌后的人参芦头与发酵后样品(包括人参芦头粉与发酵液)分别置于60 ℃烘箱烘干至恒重,粉碎打粉,过40目筛。分别称取约 0.05 g 样本,分别加入 1 mL 提取液,40 ℃水浴浸提 30 min。室温10 000 r/min离心10 min,取上清液,置冰上待测。
1.6 抑菌性检测
采用牛津杯法进行测定,选取大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌作为待测菌株,将牛津杯置于培养好菌体的双层平板中,人参芦头发酵提取物样本前处理同1.5节,处理后的提取物用无菌水稀释至所需要的浓度,往双层90 mm平皿中的牛津杯中分别滴加200 μL,置于37 ℃培养箱静置培养16~20 h后,测量各抑菌圈直径,同时以无菌水作为对照,通过抑菌圈的大小反映抑菌物质对指示菌的抑制程度。抑菌性能评价标准:抑菌圈<10 mm无抑菌作用, 10 mm<抑菌圈<15 mm中度抑菌,抑菌圈>15 mm高度抑菌。
双层平皿的制备:取平皿分别倾注营养琼脂培养基15~18 mL,使其在平板内均匀摊布,放置水平台面上使凝固,作为底层,将平皿倒置,平均划分区域并标记添加物。另取半固体营养琼脂培养基适量放冷至48~50 ℃,将病原菌菌悬液原液稀释至106 CFU/mL左右,每4.5 mL半固体营养琼脂培养基加入0.5 mL,倒入每平皿中,使其在底层上均匀摊布,作为菌层。放置在水平台上冷却后,在每个平皿中以划分好的区域等距离均匀安置4个牛津杯。
抑菌试验:采用牛津杯法进行,取不同浓度的人参芦头发酵产物,每个牛津杯中分别滴加200 μL,37 ℃静置培养16~20 h后,测量各抑菌圈直径。
2 结果与分析
2.1 人参皂苷单体检测方法的构建
2.1.1 精确度试验
对人参皂苷Rg1、Re、Rf、Rh1、Rb1、Rc、Rb2、Rd、F2、Rg3、CK、Rh2、PPD质量浓度为1 mg/mL标准溶液进行5次平行试验,记录峰面积值,对检测的标准品峰面积进行比较,计算出平均值与RSD,其结果见表1。
表1 精确度试验结果
Table 1 Results of precision experiment

皂苷重复次数12345峰面积平均值RSD/%Rg12 255 1742 255 8522 253 6162 204 5372 235 5262 240 9410.98Re4 342 8694 302 1374 324 7884 352 0374 352 3554 334 8370.49Rf5 227 0635 203 5065 215 6795 230 2415 269 7355 229 2450.48Rh17 470 2657 474 3547 455 4887 452 3717 429 9567 456 4870.24Rb14 145 0774 144 9034 071 5304 145 3354 099 8744 121 3440.83Rc4 740 8134 707 0774 682 4124 745 3364 769 5394 729 0350.72Rb25 831 6815 867 4505 825 2435 868 7565 858 3465 850 2950.35Rd8 634 6088 734 5418 617 3148 536 9548 695 6428 643 8120.88F25 766 6005 666 3695 664 7415 642 5625 721 5365 621 4580.97Rg33 470 7653 466 3503 410 3843 467 9423 426 9723 448 4830.81CK5 814 6045 708 2915 700 5985 821 2235 814 0565 805 1830.98Rh211 530 39111 478 89611 561 89411 554 76311 586 34211 542 4570.35PPD9 209 5999 043 2499 022 1649 132 5649 145 2619145 2610.77
由表1可知,皂苷Rg1、Re、Rf、Rh1、Rb1、Rc、Rb2、Rd、F2、Rg3、CK、Rh2、PPD的RSD分别为0.98%、0.49%、0.48%、0.24%、0.83%、0.72%、0.35%、0.88%、0.97%、0.81%、0.98%、0.35%、0.77%,结果表明 5 次测定的峰面积RSD均小于 1%,液相测定结果精密度良好。
2.1.2 稳定性试验
对人参皂苷Rg1、Re、Rf、Rh1、Rb1、Rc、Rb2、Rd、F2、Rg3、CK、Rh2、PPD质量浓度为1 mg/mL标准溶液选择时间节点0、2、4、8、16、24 h进行测定,记录峰面积值,对检测的标准品峰面积进行比较,计算出平均值与平均值的RSD。由表2可知,皂苷Rg1、Re、Rf、Rh1、Rb1、Rc、Rb2、Rd、F2、Rg3、CK、Rh2、PPD的RSD分别为 0.94%、0.36%、0.55%、0.32%、0.89%、0.76%、0.41%、0.85%、0.32%、0.62%、0.23%、0.26%、0.21%,结果显示皂苷峰面积RSD均小于 1%,表明皂苷标准溶液在 24 h 内稳定。
表2 稳定性试验结果
Table 2 Results of stability experiment
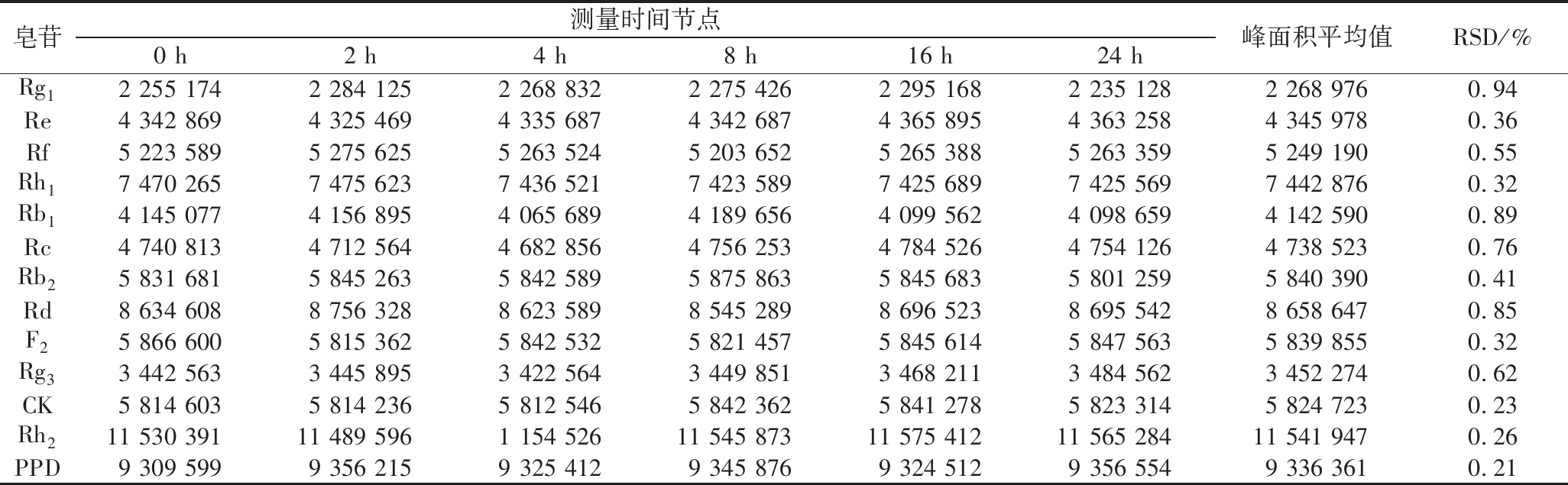
皂苷测量时间节点0 h2 h4 h8 h16 h24 h峰面积平均值RSD/%Rg12 255 1742 284 1252 268 8322 275 4262 295 1682 235 1282 268 9760.94Re4 342 8694 325 4694 335 6874 342 6874 365 8954 363 2584 345 9780.36Rf5 223 5895 275 6255 263 5245 203 6525 265 3885 263 3595 249 1900.55Rh17 470 2657 475 6237 436 5217 423 5897 425 6897 425 5697 442 8760.32Rb14 145 0774 156 8954 065 6894 189 6564 099 5624 098 6594 142 5900.89Rc4 740 8134 712 5644 682 8564 756 2534 784 5264 754 1264 738 5230.76Rb25 831 6815 845 2635 842 5895 875 8635 845 6835 801 2595 840 3900.41Rd8 634 6088 756 3288 623 5898 545 2898 696 5238 695 5428 658 6470.85F25 866 6005 815 3625 842 5325 821 4575 845 6145 847 5635 839 8550.32Rg33 442 5633 445 8953 422 5643 449 8513 468 2113 484 5623 452 2740.62CK5 814 6035 814 2365 812 5465 842 3625 841 2785 823 3145 824 7230.23Rh211 530 39111 489 5961 154 52611 545 87311 575 41211 565 28411 541 9470.26PPD9 309 5999 356 2159 325 4129 345 8769 324 5129 356 5549 336 3610.21
2.1.3 加标回收率试验
对检测的13种皂苷含量的样品,通过加入一定量的标准品,按照1.3节高效液相色谱法测定总皂苷含量,回收率按公式(1)计算,结果见表3:
表3 加标回收率试验结果
Table 3 Results of adding standard recovery rate test
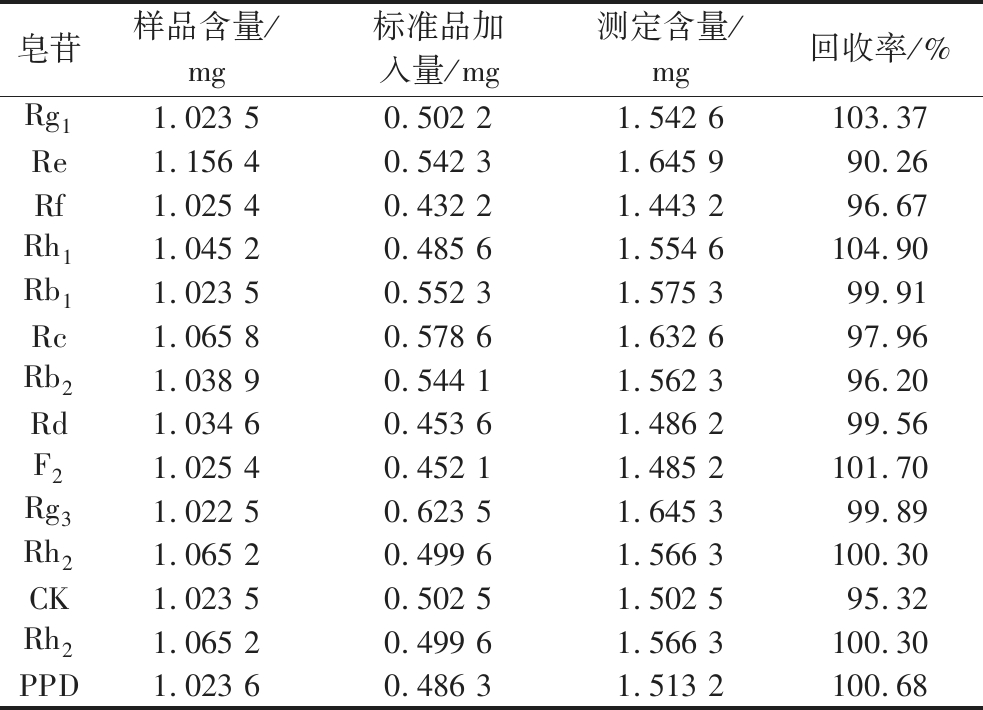
皂苷样品含量/mg标准品加入量/mg测定含量/mg回收率/%Rg11.023 5 0.502 2 1.542 6 103.37 Re1.156 4 0.542 3 1.645 9 90.26 Rf1.025 4 0.432 2 1.443 2 96.67 Rh11.045 2 0.485 6 1.554 6 104.90 Rb11.023 5 0.552 3 1.575 3 99.91 Rc1.065 8 0.578 6 1.632 6 97.96 Rb21.038 9 0.544 1 1.562 3 96.20 Rd1.034 6 0.453 6 1.486 2 99.56 F21.025 40.452 11.485 2101.70Rg31.022 5 0.623 5 1.645 3 99.89 Rh21.065 2 0.499 6 1.566 3 100.30 CK1.023 50.502 51.502 595.32Rh21.065 2 0.499 6 1.566 3 100.30 PPD1.023 60.486 31.513 2100.68
回收率/%=(实际测定含量-样品原有含量)/加入标准品的含量×100
(1)
由表3可知,皂苷Rg1、Re、Rf、Rh1、Rb1、Rc、Rb2、Rd、F2、Rg3、CK、Rh2、PPD的加样回收率分别为103.37%、90.26%、96.67%、104.90%、99.91%、97.76%、96.20%、99.56%、101.70%、99.89%、95.32%、100.30%、100.68%, 13种皂苷加样回收率在95%~105%,能够满足检测的需求。
2.1.4 人参皂苷标准曲线的绘制
在精确度、稳定性以及加标回收测定研究的基础之上,得出13种人参皂苷的保留时间及线性回归方程(表4),用于后续发酵试验分析。
表4 13种人参皂苷的标准曲线线性回归方程
Table 4 Standard curve linear regression equation of 13 types of ginsenosides
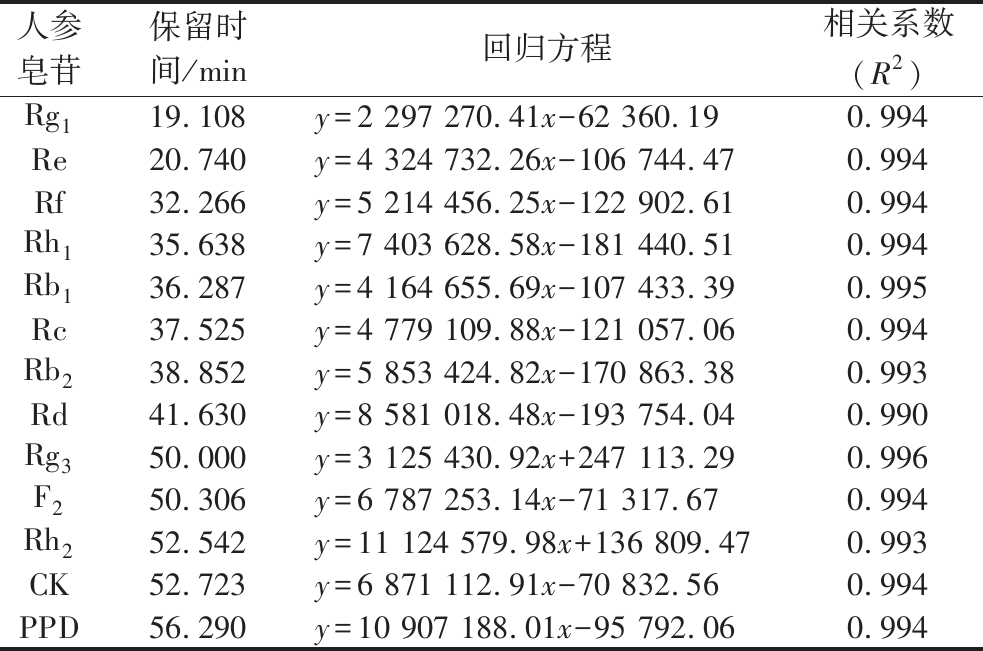
人参皂苷保留时间/min回归方程相关系数(R2)Rg119.108y=2 297 270.41x-62 360.190.994Re20.740y=4 324 732.26x-106 744.470.994Rf32.266y=5 214 456.25x-122 902.610.994Rh135.638y=7 403 628.58x-181 440.510.994Rb136.287y=4 164 655.69x-107 433.390.995Rc37.525y=4 779 109.88x-121 057.060.994Rb238.852y=5 853 424.82x-170 863.380.993Rd41.630y=8 581 018.48x-193 754.040.990Rg350.000y=3 125 430.92x+247 113.290.996F250.306y=6 787 253.14x-71 317.670.994Rh252.542y=11 124 579.98x+136 809.470.993CK52.723y=6 871 112.91x-70 832.560.994PPD56.290y=10 907 188.01x-95 792.060.994
2.2 最优发酵菌株的筛选
将备选6株菌株活化后进行PCR扩增16S rDNA序列,测序结果与NCBI 数据库比对,确定无杂菌污染后,将菌株B.subtilis LM 4-2采用LB培养基,其余5种菌株采用MRS培养基进行扩大培养,培养温度均为30 ℃,摇床转速 120 r/ min,发酵在正常大气含氧量条件下进行。待菌体生长到对数生长后期(OD值0.8),按1%的接种量分别接种到含有人参芦头的培养基中进行液体发酵,发酵液体积为10 mL,发酵条件30 ℃,摇床转速 120 r/min;采用超高效液相色谱仪检测各个菌种发酵的人参芦头中人参皂苷的转化率,确定最优发酵菌株。不同菌株发酵结果(表5)显示,菌株B.subtilis LM 4-2的发酵人参芦头产物中人参皂苷含量最高(32.436 mg/g),其中人参皂苷单体Rb1、Rg3,F2、CK和PPD含量均高于其他5株菌株,Rd含量为(3.665±0.115) mg/g显著高于其他5株菌株,表明其具有较好的发酵人参芦头转化人参皂苷的能力,根据发酵产物参皂苷含量确定最优发酵菌株为菌株B.subtilis LM 4-2。
表5 人参芦头发酵后人参皂苷单体含量的检测结果 单位:mg/g
Table 5 Content of ginsenoside monomers after fermentation of ginseng rhizome

人参皂苷菌株空白123456Rb16.843±0.4836.927±0.3187.670±0.1058.528±0.0968.946±0.9038.894±0.2639.209±0.377Re7.242±0.2523.729±0.2373.710±0.2943.054±0.0755.435±0.8155.349±0.3455.694±0.214Rf3.731±0.1772.190±0.6612.686±0.0133.008±0.1652.580±0.8082.826±0.0492.622±0.087Rc3.427±0.4314.140±0.0254.384±0.1344.970±0.2104.808±0.4664.607±0.0261.727±0.230Rb22.188±0.0963.536±0.0643.601±0.0684.822±0.0754.449±0.2504.311±0.1654.058±0.056Rd1.135±0.2391.211±0.1351.319±0.1561.427±0.2081.765±0.0671.471±0.1463.665±0.115Rg32.015±0.2720.297±0.8270.325±0.0940.157±0.0810.792±0.0420.931±0.8132.110±0.109Rh20.552±0.1380.477±0.0900.468±0.1010.503±0.1050.518±0.1460.515±0.1110.544±0.111Rg11.289±0.1240.655±0.0400.865±0.1750.862±0.0980.986±0.1270.943±0.0491.221±0.175Rh10.803±0.3081.202±0.1671.234±0.1421.155±0.1891.089±0.2041.161±0.2041.154±0.026F20.035±00.049±0.0010.048±0.0040.041±0.0010.047±0.0030.058±0.0030.103±0.003CK0.137±0.0020.048±0.0020.042±00.076±0.0010.066±00.105±0.0040.235±0.004PPD0.016±00.016±00.016±00.016±00.016±00.016±00.094±0Total29.413±0.19424.477±0.19726.368±0.09928.619±0.10031.497±0.29531.187±0.16832.436±0.116
注:1-Lactobacillus plantarum 2992;2-Lactobacillus plantarum 6595;3-Lacticaseibacillus casei;4-Lactobacillus iatae S-7;5-Lactobacillus ruminis K19;6-Bacillus subtilis LM 4-2
在菌株B.subtilis LM 4-2人参芦头发酵过程中,人参皂苷Rc含量显著低于其他试验菌株,而人参皂苷Rd含量显著增加,通过对发酵过程中人参皂苷含量的变化分析推测,菌株B.subtilis LM 4-2产生的相应糖苷水解酶对人参皂苷Rc上的阿拉伯糖基团进行水解,进而将Rc转化为人参皂苷Rd;与其他菌株相比,人参皂苷F2、CK和PPD含量均有少量生成,推测人参皂苷Rd被进一步水解去除葡萄糖基团,逐步产生下游产物F2、CK和PPD(图1)[13],通过对发酵4 d后的人参皂苷含量与未发酵人参芦头(空白对照)中人参皂苷含量比较(表5),菌株LM 4-2发酵液中Rc含量降低49.61%,Rd含量增加222.91%,F2、CK和PPD含量增加分别为194.29%、71.53%和487.50%。上述结果表明菌株LM 4-2发酵人参芦头后有助于增加人参皂苷总含量,菌株B.subtilis LM 4-2能够显著促进人参皂苷Rc向Rd的转化,这与ZHANG等[14]报道的结果相一致。
2.3 菌株LM 4-2发酵人参芦头转化Rd特性分析
研究通过单因素试验,分别考察了接种量、料液比、发酵温度和发酵时间对菌株B.subtilis LM 4-2发酵人参芦头转化Rd的影响,由图2可知,在接种量为6%~9%时,人参皂苷Rd的含量先增加后降低,在接种量为7%的时候,人参皂苷Rd含量最大,达到了4.054 mg/g;在料液比为1∶2与1∶10范围时,人参皂苷Rd的含量先增加后降低,在料液比为1∶6的时候,人参皂苷Rd含量最大,达到了3.863 mg/g;在发酵温度为28~33 ℃时,人参皂苷Rd的含量先增加后降低,在温度为30 ℃的时候,人参皂苷Rd含量最大,达到了5.167 mg/g;在发酵时间为15~25 d的时候,随着时间的增加,人参皂苷Rd含量增加,当达到20 d的时候,人参皂苷Rd含量最大,达到5.995 mg/g,随后人参皂苷Rd含量降低。单因素试验结果表明所选取的各个因素对人参皂苷Rd的转化均具有影响,为进一步探索上述各因素组合对于Rd产量的影响,优化发酵效率,研究采用响应面分析对发酵条件进行了优化。

a-发酵时间;b-接种量;c-料液比;d-温度
图2 各因素对菌株B.subtilis LM 4-2发酵人参芦头转化Rd的影响
Fig.2 Effects of factors on the transformation of ginsenoside Rd by the strain B.subtilis LM 4-2 fermentation of ginseng rhizome
2.4 菌株LM 4-2发酵人参芦头转化Rd发酵条件的优化
通过四因素三水平试验对接种量、料液比、温度、发酵时间4种单因素的交互作用进行分析,如表6所示;采用Design-Expert 13软件,根据Box-Behnken进行响应面法优化,通过多元回归分析,如表7所示;建立的回归方程:Y=6.78-0.076 0A+0.296 7B-0.303 8C+0.128 4D+0.080 8AB-0.217 3AC+0.288 0AD-0.134 7BC-0.141 0BD+0.334 2CD-0.584 4A2-1.31B2-1.09C2-0.385 3D2。根据方差分析结果(表8),回归模型的F值为19.37,P<0.000 1,表明二次回归方程模型可信,具有统计学意义。回归方程决定系数R2值为0.950 9,说明方程拟合程度良好,自变量与响应面之间线性关系显著,可用于人参皂苷Rd产量检测试验的理论预测。失拟项P值为0.956 2大于0.05,表明模型无失拟因素存在。根据P值大小,确定影响人参皂苷Rd含量的因素次序为温度(C)>料液比(B)>发酵时间(D)>接种量(A)。
表6 响应面设计因素与水平
Table 6 Independent variables and their coded and actual levels used for response surface design

水平因素料液比(g∶mL)接种量/%发酵时间/d温度/℃-11∶25152801∶57203011∶1092533
表7 响应面试验设计方案及结果
Table 7 Experimental design and results for response surface analysis
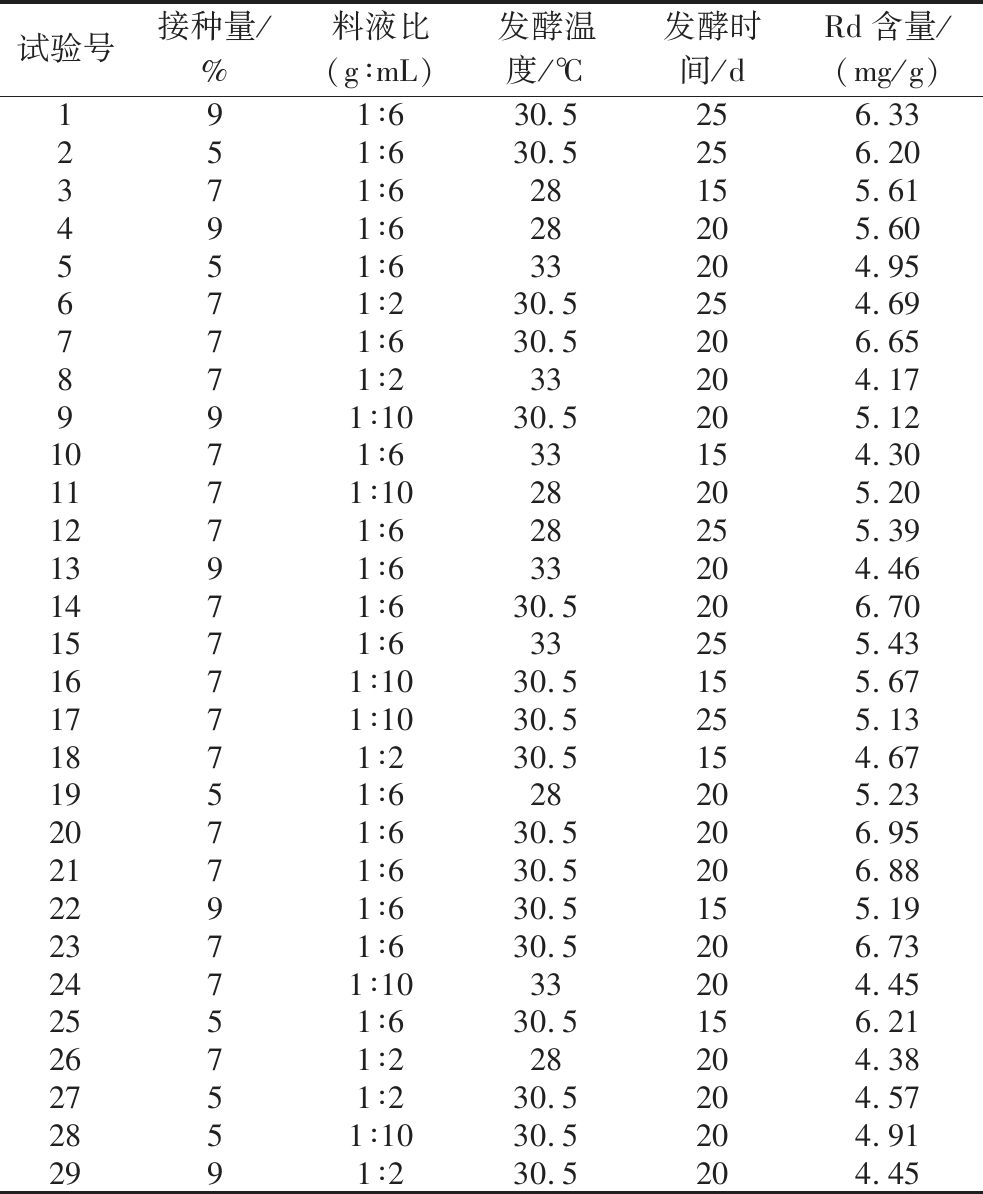
试验号接种量/%料液比(g∶mL)发酵温度/℃发酵时间/dRd含量/(mg/g)191∶630.5256.33 251∶630.5256.20 371∶628155.61 491∶628205.60 551∶633204.95 671∶230.5254.69 771∶630.5206.65 871∶233204.17 991∶1030.5205.12 1071∶633154.30 1171∶1028205.20 1271∶628255.39 1391∶633204.46 1471∶630.5206.70 1571∶633255.43 1671∶1030.5155.67 1771∶1030.5255.13 1871∶230.5154.67 1951∶628205.23 2071∶630.5206.95 2171∶630.5206.88 2291∶630.5155.19 2371∶630.5206.73 2471∶1033204.45 2551∶630.5156.21 2671∶228204.38 2751∶230.5204.57 2851∶1030.5204.91 2991∶230.5204.45
表8 回归方程的方差分析
Table 8 ANOVA analysis of variance for regression equations
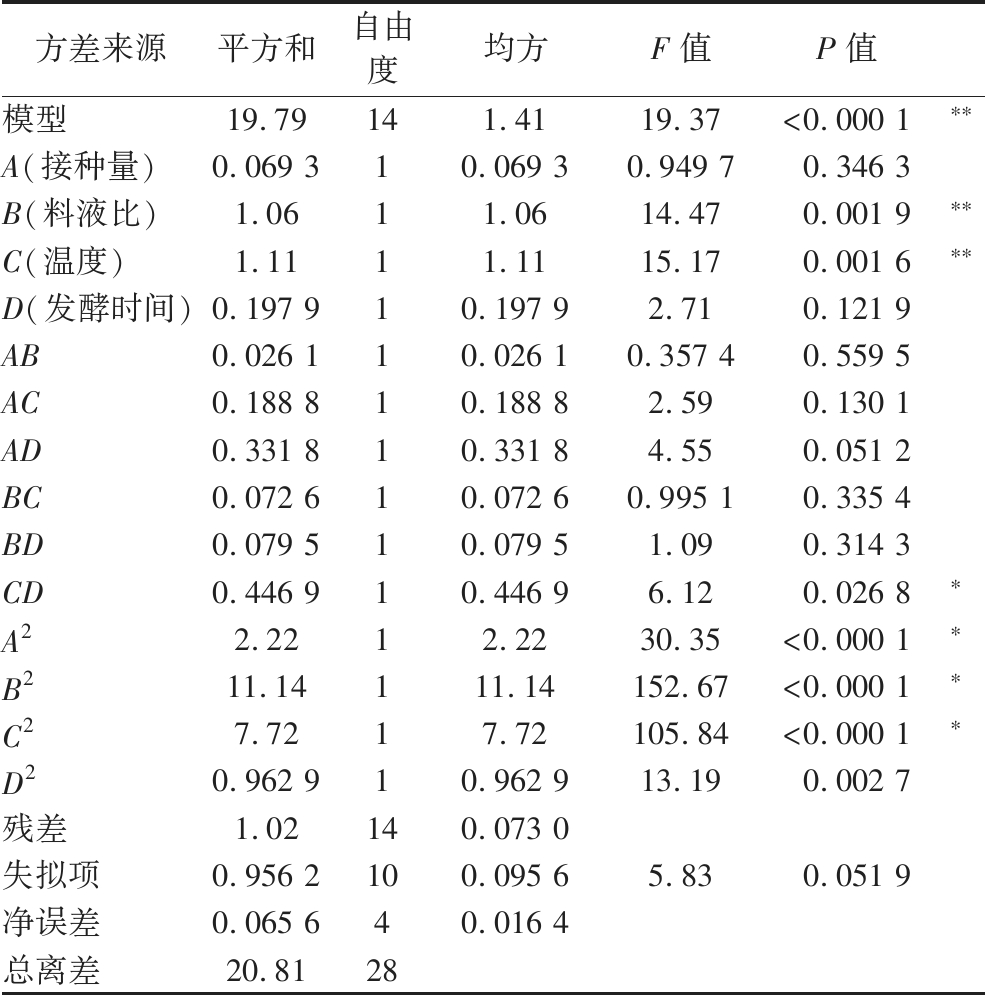
方差来源平方和自由度均方F值P值模型19.79141.4119.37<0.000 1∗∗A(接种量)0.069 310.069 30.949 70.346 3B(料液比)1.0611.0614.470.001 9∗∗C(温度)1.1111.1115.170.001 6∗∗D(发酵时间)0.197 910.197 92.710.121 9AB0.026 110.026 10.357 40.559 5AC0.188 810.188 82.590.130 1AD0.331 810.331 84.550.051 2BC0.072 610.072 60.995 10.335 4BD0.079 510.079 51.090.314 3CD0.446 910.446 96.120.026 8∗A22.2212.2230.35<0.000 1∗B211.14111.14152.67<0.000 1∗C27.7217.72105.84<0.000 1∗D20.962 910.962 913.190.002 7残差1.02140.073 0失拟项0.956 2100.095 65.830.051 9净误差0.065 640.016 4总离差20.8128
注:**极显著差异, P<0.01;*显著差异, P<0.05。
由图3可知,响应面图的等高线图均为椭圆形,响应面三维图均有稳定点,且为极大值。结果显示接种量和发酵时间交互性作用显著(P<0.05),料液比,温度和发酵时间的交互作用不显著(P>0.05)。通过Design-Expert软件的进行数据处理分析,得出最佳优化的发酵条件为料液比1∶4.3(g∶mL)、发酵时间20.51 d、接种量7.49%、温度30.47 ℃,该条件下人参皂苷Rd的含量最大预测值为6.383 mg/g。结合实际操作情况,选取发酵条件为料液比1∶4.3(g∶mL)、发酵时间20 d、接种量7.5%、温度30 ℃,为检验模型的准确性,采用优化后的最佳发酵条件进行发酵验证实验,3次实验得到人参皂苷Rd含量平均值为(6.375±0.006) mg/g。预测值与实际值接近,说明该回归模型方程优化的发酵工艺可信。


图3 各因素交互作用对评分的响应面和等高线图
Fig.3 Contour plot and response surface of each factor interaction pair scores
2.5 发酵提取物抗氧化性检测结果分析
采用DPPH自由基清除能力检测试剂盒对发酵提取物的抗氧化能力进行测定,如图4所示,与对照相比,随着发酵提取物浓度增加,发酵提取物对DPPH自由基的清除效果也不断增强,在质量浓度为50 mg/mL时,对DPPH自由基的清除率为82.55%,与对照相比(75.65%),差异显著(P<0.05)。
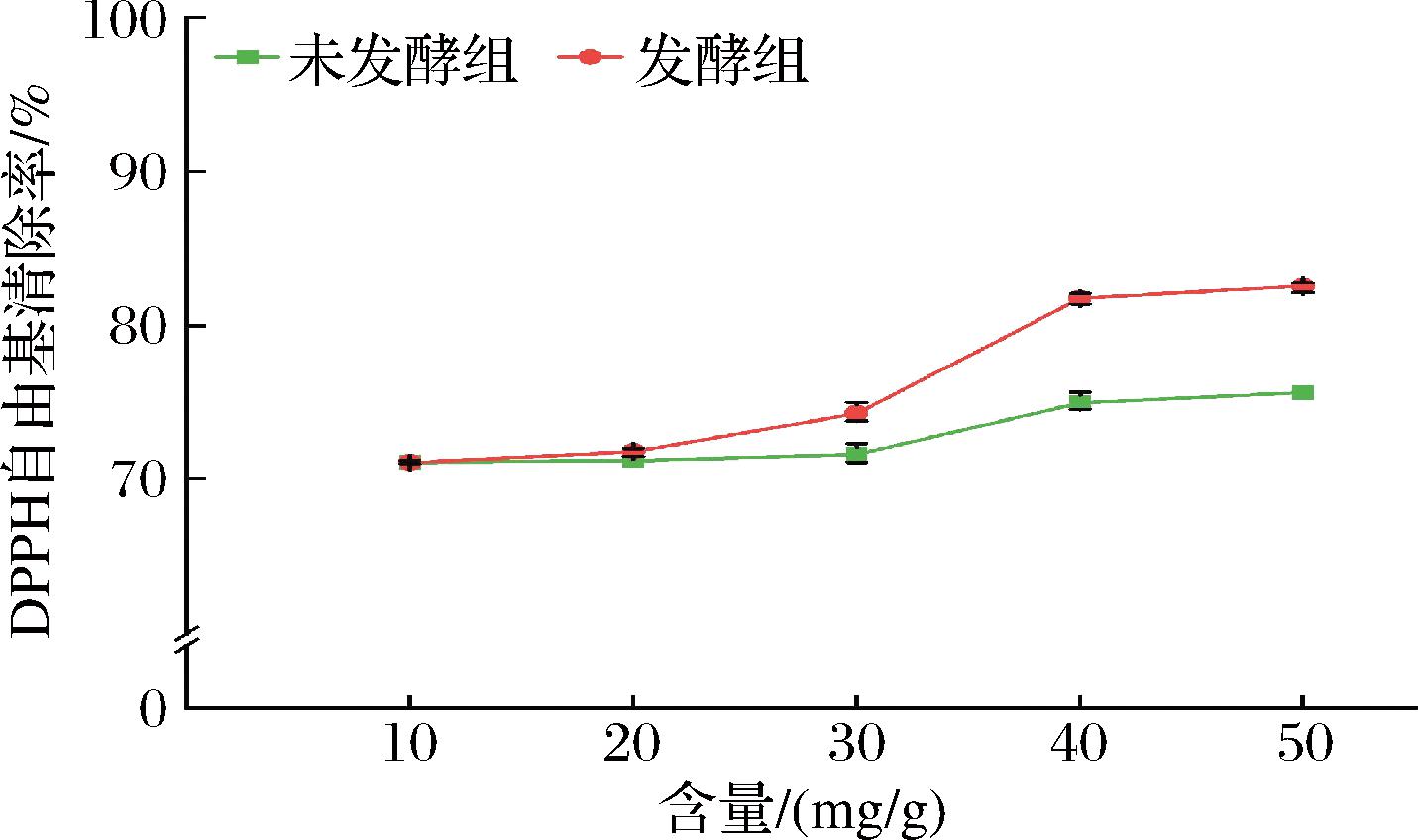
图4 发酵提取物的DPPH自由基清除率
Fig.4 DPPH radical scavenging activity of fermented extracts
2.6 发酵提取物的抑菌性检测结果
通过牛津杯法测试了人参芦头发酵提取物的抑菌效果,以无菌水作为空白对照,结果显示(表9)在提取物质量浓度达到1.0 mg/mL时,对测试菌株金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌均产生抑制作用,抑菌圈直径分别为11、12和14 mm,随着发酵液浓度增加,金黄色葡萄球菌和枯草芽孢杆菌的抑菌圈逐渐增加,大肠杆菌则不明显;根据上述抑菌结果,研究进一步精细设置人参芦头发酵液浓度,考察人参芦头发酵液对不同测试菌株的最低抑制浓度,由试验结果(表10)可知,金黄色葡萄球菌的最小抑菌浓度为1.0 mg/mL,对枯草芽孢杆菌的最小抑菌浓度为0.75 mg/mL,对大肠杆菌的最小抑菌浓度为1.0 mg/mL。
表9 人参芦头发酵提取物的抑菌作用
Table 9 Antibacterial effect of fermented extracts of ginseng rhizome
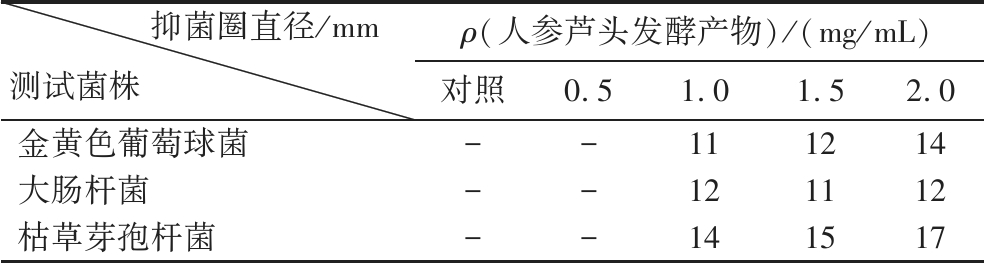
抑菌圈直径/mm测试菌株ρ(人参芦头发酵产物)/(mg/mL)对照0.51.01.52.0金黄色葡萄球菌--111214大肠杆菌--121112枯草芽孢杆菌--141517
注:“-”表示无抑菌效果。
表10 人参芦头发酵提取物的最低抑菌浓度
Table 10 Minimum inhibitory concentration of fermented extracts of ginseng rhizome

供试菌ρ(人参芦头发酵产物)/(mg/mL)0.50.751.001.25金黄色葡萄球菌+++--大肠杆菌+++--枯草芽孢杆菌+---
注:“-”表示无菌生长,“+”表示有菌生长,“++”表示有菌体生长明显。
3 结论与讨论
本研究建立了基于超高液相色谱的人参皂苷检测方法,并在此基础之上,从6株候选菌株中筛选出能够发酵人参芦头、转化人参皂苷Rd产量最高的菌株B.subtilis LM 4-2,并进一步通过单因素试验与响应面试验设计,确定了菌株B.subtilis LM 4-2的最佳发酵条件;研究还对人参芦头发酵提取物的抗氧化性和抑菌效果进行了测定,确定了对测试菌株的最低抑制浓度,为菌株B.subtilis LM 4-2发酵人参芦头转化人参皂苷Rd的实践应用提供参考。
[1] 韩金荣, 张葆霞, 李美丽等.《黄帝内经》脾胃学研究[M].银川:阳光出版社:202103.500.
HAN J R, ZHANG B X, LI M L, et al.Study on Spleen and Stomach in Huangdi Neijing[M].Yinchuan:Sunshine Press:202103.500.
[2] WANG H P, ZHANG Y B, YANG X W, et al.Rapid characterization of ginsenosides in the roots and rhizomes of Panax ginseng by UPLC-DAD-QTOF-MS/MS and simultaneous determination of 19 ginsenosides by HPLC-ESI-MS[J].Journal of Ginseng Research, 2016, 40(4):382-394.
[3] 刘静玉, 金武燮, 谷丽华, 等.基于高效薄层色谱和高效液相色谱指纹图谱及模式识别的人参根茎和主根比较研究[J].国际中医中药杂志, 2023, 45(11):1408-1414.
LIU J Y, JIN W X, GU L H, et al.Comparative study on rhizome and main root of Panax ginseng based on HPTLC and HPLC fingerprints and pattern recognition[J].International Journal of Traditional Chinese Medicine, 2023, 45(11):1408-1414.
[4] CHEN W, BALAN P, POPOVICH D G.Comparison of ginsenoside components of various tissues of New Zealand forest-grown Asian ginseng (Panax ginseng) and American ginseng (Panax quinquefolium L.)[J].Biomolecules, 2020, 10(3):372.
[5] CAO J, LIU C, WANG Q Q, et al.A novel catalytic application of heteropolyacids:Chemical transformation of major ginsenosides into rare ginsenosides exemplified by Rg1[J].Science China Chemistry, 2017, 60(6):748-753.
[6] TRAN T N A, SON J S, AWAIS M, et al.β-glucosidase and its application in bioconversion of ginsenosides in Panax ginseng[J].Bioengineering, 2023, 10(4):484.
[7] LIU Z, LI J X, WANG C Z, et al.Microbial conversion of protopanaxadiol-type ginsenosides by the edible and medicinal mushroom Schizophyllum commune:A green biotransformation strategy[J].ACS Omega, 2019, 4(8):13114-13123.
[8] BAI Y P, G NZLE M G.Conversion of ginsenosides by Lactobacillus plantarum studied by liquid chromatography coupled to quadrupole trap mass spectrometry[J].Food Research International, 2015, 76(Pt 3):709-718.
NZLE M G.Conversion of ginsenosides by Lactobacillus plantarum studied by liquid chromatography coupled to quadrupole trap mass spectrometry[J].Food Research International, 2015, 76(Pt 3):709-718.
[9] 卲淇, 陈贺, 尹成日.乳酸菌对人参皂苷Rb1的生物转化研究[J].延边大学学报(自然科学版), 2016, 42(2):177-180.
SHAO Q, CHEN H, YIN C R.Biotransformation of ginsenoside Rb1 by lactic acid bacteria[J].Journal of Yanbian University (Natural Science Edition), 2016, 42(2):177-180.
[10] QUAN L H, KIM Y J, LI G H, et al.Microbial transformation of ginsenoside Rb1 to compound K by Lactobacillus paralimentarius[J].World Journal of Microbiology &Biotechnology, 2013, 29(6):1001-1007.
[11] 李倩, 于丹, 国立东, 等.微生物发酵转化皂苷类化合物机制的研究进展[J].中草药, 2022, 53(22):7264-7278.
LI Q, YU D, GUO L D, et al.Research progress on mechanism of transformation of saponins by microbial fermentation[J].Chinese Traditional and Herbal Drugs, 2022, 53(22):7264-7278.
[12] 苏敏, 朴春红, 梁德春, 等.产β-葡萄糖苷酶酵母菌的分离鉴定及其在人参皂苷Rg3转化中的应用[J].食品科学, 2018, 39(14):172-178.
SU M, PIAO C H, LIANG D C, et al.Screening and identification of β-glucosidase-producing yeast and its application in the bioconversion of ginsenoside Rg3[J].Food Science, 2018, 39(14):172-178.
[13] SHI Z Y, ZENG J Z, WONG A S T.Chemical structures and pharmacological profiles of ginseng saponins[J].Molecules, 2019, 24(13):2443.
[14] ZHANG R, TAN S Q, ZHANG B L, et al.Two key amino acids variant of α-L-arabinofuranosidase from Bacillus subtilis str.168 with altered activity for selective conversion ginsenoside rc to rd[J].Molecules, 2021, 26(6):1733.