脂质与生物体的生理健康密切相关。它们参与生物膜的形成,为生命活动提供能量,参与物质运输、能量转化、信息识别和传递等关键生物过程[1-2]。由于脂质结构复杂、物理和化学性质多样且无先进可靠的检测方法,难以对脂质进行系统和全面的分析。长期以来,对与脂质代谢相关的表型和作用机制之间的关系知之甚少。2003年首次提出的脂质组学作为代谢组学的一个分支,主要研究脂质的种类、丰度和空间分布;此外,它有助于分析脂质在代谢途径和代谢网络中的生物学作用,是全面分析生物体内脂质分子的高效方法[3]。近年来,随着各种新型分析仪器和生物信息学的发展,脂质组学受到了广泛关注且发展迅速。根据脂质结构可将脂质分为8大类,包括脂肪酰类(fatty acyls,FA)、甘油酯类(glycerolipids,GL)、甘油磷脂类(glycerophospholipids,GP)、鞘脂类(sphingolipids,SP)、固醇脂类(sterol lipids,ST)、孕烯醇酮脂类(prenol lipids, PR)、糖脂类(saccharolipids,SL)和聚酮类(polyketides,PK),涵盖超过45 000种脂类[4]。基于质谱的脂质组学具有高通量、灵敏度高和准确性高的特性,有助于应对脂质的复杂性和多样性,已成为研究生物体内脂质组成不可或缺的方法[5]。目前,已有大量研究利用脂质组学对家畜肉产品进行评价,例如,可用于家猪[6]和太和乌骨鸡肌肉[7]的表征和鉴别;LI等[8]使用定量脂质组学揭示了哺乳期间驴乳脂质的变化。
综上,本文将总结脂质组学在家畜肉产品评价中的应用,为脂质组学在畜牧业的应用提供参考并为日后深入探究饲料营养对家畜肉产品营养价值调控提供基础。
1 脂质
1.1 脂质概述
脂质可定义为疏水或中性小分子,难溶于水,易溶于有机溶剂,包括氯仿、乙醚和酒精。脂质作为各种代谢产物的重要组成部分,具有独特的生物学功能,特别在维持生理动态平衡方面具有重要作用[1]。在人体健康中,脂质代谢异常与糖尿病、癌症、阿尔茨海默病等多种疾病密切相关[9-10]。此外,脂质还与食物感官评定和脂溶性维生素的吸收有关[11]。
1.2 脂质的分类及生理功能
可根据脂质代谢途径研究计划提出的分类体系将脂质分为8大类(表1)[4]。不同脂质的结构复杂多样,在各种组织和细胞中具有多种生物和营养功能。
表1 脂质的分类
Table 1 Classification of lipids
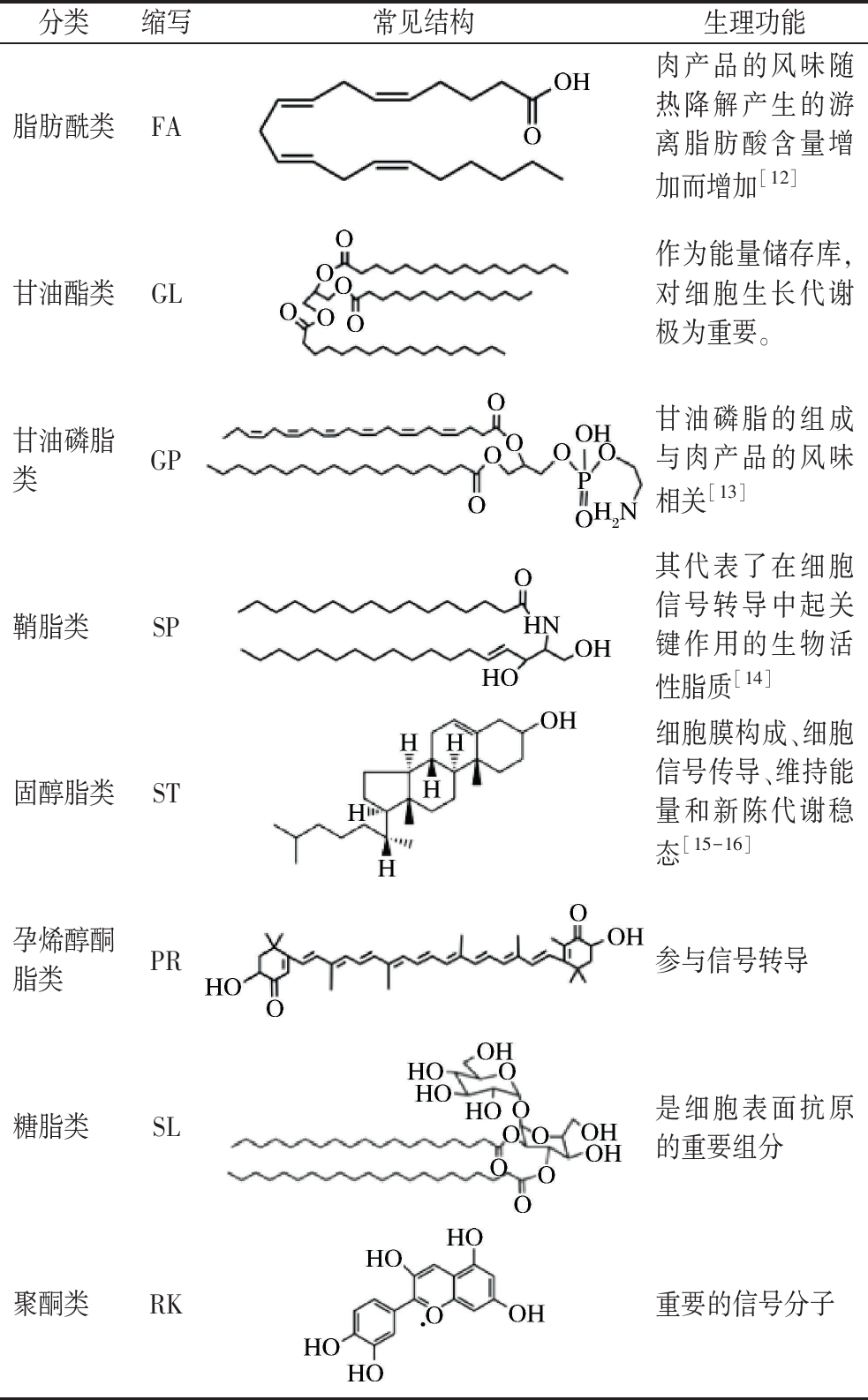
分类缩写常见结构生理功能脂肪酰类FA肉产品的风味随热降解产生的游离脂肪酸含量增加而增加[12]甘油酯类GL作为能量储存库,对细胞生长代谢极为重要。甘油磷脂类GP甘油磷脂的组成与肉产品的风味相关[13]鞘脂类SP其代表了在细胞信号转导中起关键作用的生物活性脂质[14]固醇脂类ST细胞膜构成、细胞信号传导、维持能量和新陈代谢稳态[15-16]孕烯醇酮脂类PR参与信号转导糖脂类SL是细胞表面抗原的重要组分聚酮类RK重要的信号分子
1.2.1 甘油酯类生理功能
肉产品中脂质的不同种类及其组成对肉产品的质量和风味有直接影响。脂类化合物在酶的作用下发生水解,释放出游离脂肪酸,游离脂肪酸的增加会促进脂肪氧化酸败[17]。甘油酯类通常由甘油骨架和脂肪酸组成,主要分为甘油一酯、甘油二酯和甘油三酯。甘油三酯是甘油酯类中最丰富、最重要的中性脂质,在sn-1、sn-2和sn-3位点上各有一个脂肪酸,其作为能量储存库,对细胞生长代谢极为重要。通常认为脂质过氧化是导致肉品质下降的主要原因,脂质过氧化会影响肉产品的颜色和营养价值并可能产生有毒有害物质。有研究[18-19]表明,脂质氧化与脂质分子间存在直接联系,且肉产品脂质氧化所涉及的主要脂质分子为甘油三酯和磷脂。脂肪酸组成作为评价肉品质营养价值的一个重要因素,降低多不饱和脂肪酸的含量可减少肉脂质氧化反应的发生[20]。ENSER等[21]指出,当脂肪酸分布在甘油磷脂中而不是甘油三酯中时,其可具有更高的利用率和氧化稳定性。因此,通过对脂质分子进行调节能够有效提高肉产品品质。
1.2.2 甘油磷脂类生理功能
甘油磷脂类广泛存在于动植物细胞中,侧链脂肪酸的碳原子数在14~24,每条链有0~6个双键[22],是生物膜的重要结构和功能成分,参与维持细胞的完整性,主要包括磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰甘油、磷脂酰肌醇、磷脂酰丝氨酸和磷脂酸。有研究表明,甘油磷脂的组成与肉产品的风味相关[13]。此外,也有研究表明,甘油磷脂类脂质还具有其他生物学作用,例如,磷脂酰甘油具有显著的潜在治疗作用,有研究表明,它可以抑制甲型流感病毒感染,减少炎症细胞浸润的发展[23]。
1.2.3 鞘脂类生理功能
鞘脂类是一种具有鞘磷脂骨架的两性脂质,是生物膜中的主要脂质。其代表了在细胞信号转导中起关键作用的生物活性脂质[14]。鞘脂类主要包括鞘磷脂、神经酰胺和溶血鞘磷脂等;其具有的抗炎特性和预防结肠癌的作用引起了人们的广泛关注[24-25]。NORRIS等[26]研究表明,鸡蛋中所含有的鞘磷脂对于高脂肪日粮诱导的肥胖小鼠具有改善体重增加、高血糖和高血脂的作用。此外,鞘磷脂及其代谢物是中枢神经系统髓鞘的基本成分,因此,饮食中补充鞘磷脂可促进婴儿神经发育[27-28]。
脂质还参与关键的生物过程,如物质运输以及信息识别和传递,例如溶血磷脂酸与过氧化物酶体增殖物激活受体结合后可调控基因的表达量[29];鞘脂类脂质中,神经酰胺具有促进细胞生长和增殖的作用:脂质激酶作用于神经酰胺后进行磷酸化反应,生成的鞘氨醇-1-磷酸可作为第一信使与G蛋白偶联受体相互作用,进而促进细胞生长和增殖等[30]。
1.2.4 脂肪酰类生理功能
大部分脂质均为内源性脂质,但另一部分不能从饮食中获得前体后内源性合成的脂质,必须从饮食中摄取[31],如亚油酸和亚麻酸等必需脂肪酸。脂质不仅是必需脂肪酸的来源,还可以促进脂溶性物质的吸收。有研究指出,心血管疾病的患病风险可随着多不饱和脂肪酸摄入量的增加而降低,并且高多不饱和脂肪酸的摄入可提高神经和视觉功能并对健康高龄患者的认知功能具有促进作用[32-33]。
1.2.5 固醇脂类生理功能
固醇脂类是通过不同合成途径产生的重要脂质,在生物体的各种生理过程中具有许多基本功能,包括细胞膜构成、细胞信号传导、维持能量和新陈代谢稳态[15-16]。综上所述,研究脂质分布及其营养价值具有重要意义。
2 脂质组学及其分析技术
脂质的生物学意义推动了脂质研究作为一门学科的发展,即脂质组学。脂质组学是代谢组学的一个分支,主要研究细胞、组织和生物体中的分子脂质[3],包括脂质种类、丰度以及它们的生物活性、亚细胞定位和组织分布的分析和研究[34]。与代谢组学类似,脂质组学旨在对生物系统中存在的脂质分子进行全面分析,并同时检测生物体中脂质分子对于内外刺激(如营养水平、环境应激、疾病、药物干预和基因突变)所产生的变化[35]。质谱的高速发展以及高效的分离技术可以稳定、快速和灵敏地检测不同生物样品中存在的大量单个脂质。它极大地增强了对个体脂质和/或脂质(亚)类在不同病理、生理过程中的代谢特性和生物活性的理解。虽然脂质组学是一门新兴的科学,但它在疾病、药物研发、食品和植物等不同领域已展现出巨大的发展潜力。脂质组学工作流程如图1所示,主要包括样本收集、脂质萃取、质谱检测和数据分析。
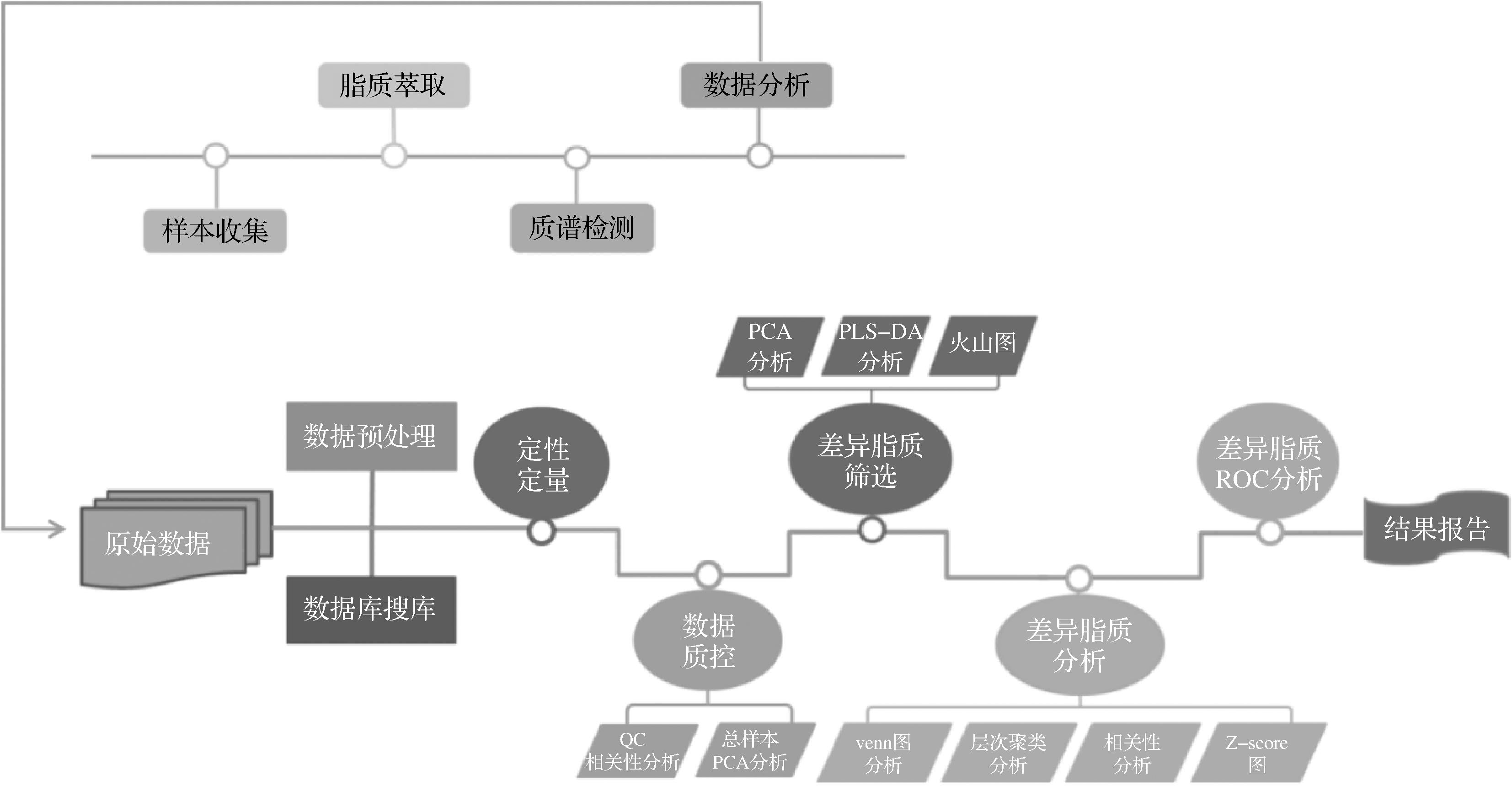
图1 脂质组学工作流程
Fig.1 Workflow of lipidomics
2.1 基于色谱的分离检测技术
随着色谱技术的发展与成熟,目前已大量应用于分析复杂食品中脂质分子的研究。色谱技术具有多个种类:(1)气相色谱法:目前,由于气相色谱法在对脂质分子进行分离前需要进行一系列复杂的前处理,在这个过程中会对脂质分子(特别是极性脂质分子)的结构产生影响,甚至消除很多结构信息,因此,气相色谱法目前在脂质组学中的应用较为局限,但是在对于脂肪酸进行分析时,常选用气相色谱法[36],例如,王彦平等[37]利用气相色谱法从猪背最长肌中分离测定出了10种脂肪酸,并表明该方法对于脂肪酸的测定具有快速、准确和操作简便的优点;(2)液相色谱法:由于液相色谱法具有的高分辨率、重现性好的特点,在各个检测领域都已被广泛应用。在脂质分子分析方面,液相色谱法有其独特的特点,例如液相系统与外界隔离,避免了脂质与空气接触,减少了脂质分子的氧化降解[38],随着发展已产生了如HPLC、超高效液相色谱法(ultra-HPLC,UHPLC)等更精细的技术,目前已有大量研究应用超高效液相色谱法对肉产品中脂质组成进行了鉴定[39-40];(3)薄层色谱法(thin-layer chromatography,TLC):薄层色谱法具有简单方便、成本便宜、分析速度快和可快速定量的特点[41]等。对于更高灵敏度及精度的要求,二维色谱技术(two-dimensional, 2D)逐渐开始发展,如2D高效液相色谱法(LC×LC)、2D气相色谱法(GC×GC)等,均可应用于食品中的脂质分离检测。
2.2 基于光谱的分离检测技术
光谱技术主要包括两种,(1)红外光谱,其测定原理为基于红外吸收;(2)拉曼光谱,其测定原理为基于非弹性光散射。不同的脂质分子都具有其独特的振动光谱,因此,根据解读光谱即可以推断样品中存在的脂质分子,红外光谱和拉曼光谱都是通过测定样品中各化学键相关的振动能级以鉴定脂质分子。这两种方法是互补的,两种方法相结合应用能够得到样品中分子组成的完整信息[42]。GAO等[42]将红外光谱和拉曼光谱结合使用,根据不同的脂质特征峰,成功建立了判别不同来源肉骨粉的物种判别模型。此外,核磁共振波谱是光谱技术的一个分支,其测定原理基于外部磁场激发样品核自旋,记录由于弛豫现象而产生的电磁辐射来分析分子结构,其与振动光谱技术不同的地方在于核磁共振时通过测定原子核的磁性进行的。
2.3 基于质谱的检测技术
质谱是目前分析脂质分子的主要方法,其在特异性、灵敏度、检测范围及检测量上具有独特的优势[43]。通常基于质谱的脂质分析技术主要可以分为直接进样质谱法(direct infusion-mass spectrometry, DI-MS)和GC-MS,苏馨等[44]利用气相色谱-质谱法对杜泊羊、萨福克羊和乌珠穆沁羊背最长肌脂肪酸含量进行了测定,以探究不同品种间肉品质的差异。质谱分析可根据检测样品的不同而选择合适的分离技术、离子源、质量分析仪等。近年来,随着技术的发展,离子迁移质谱(ion mobility-mass spectrometry, IM-MS)和质谱成像(mass spectrometry imaging, MSI)技术发展迅速,扩大了基于质谱的检测技术在脂质组学中的应用。
3 脂质组学在家畜肉品质研究中的应用
选择营养均衡的饮食有利于健康,甚至可以预防或缓解疾病。饮食与肥胖、糖尿病、动脉粥样硬化、高血压、恶性肿瘤、骨质疏松、炎症性疾病甚至感染性疾病等多种疾病有关[45]。家畜产品作为人类饮食中营养物质的重要来源,对其进行营养价值研究的主要目标是了解其所含有的营养物质的生物学功能并探究改善方法,以达到促进健康、预防或延缓疾病的目的。动物的品种、屠宰年龄、性别、部位、饲养方式及日粮均会显著影响肉产品中脂质组成,进而使肉产品的营养价值及风味等发生变化。因此,利用脂质组学鉴定肉产品中脂质组成或上述影响因素对肉产品的影响不仅可以为消费者选择更好的肉产品提供依据,也可为科学养殖提供新的见解。目前,已有大量研究利用脂质组学探究肉产品中脂质组成,表2总结了不同品种应用脂质组学对其肉产品进行研究的结果,为探究其营养价值和质量提供了新思路。
表2 脂质组学在家畜肉产品评价中的应用
Table 2 Application of lipidomics in the evaluation of livestock meat products
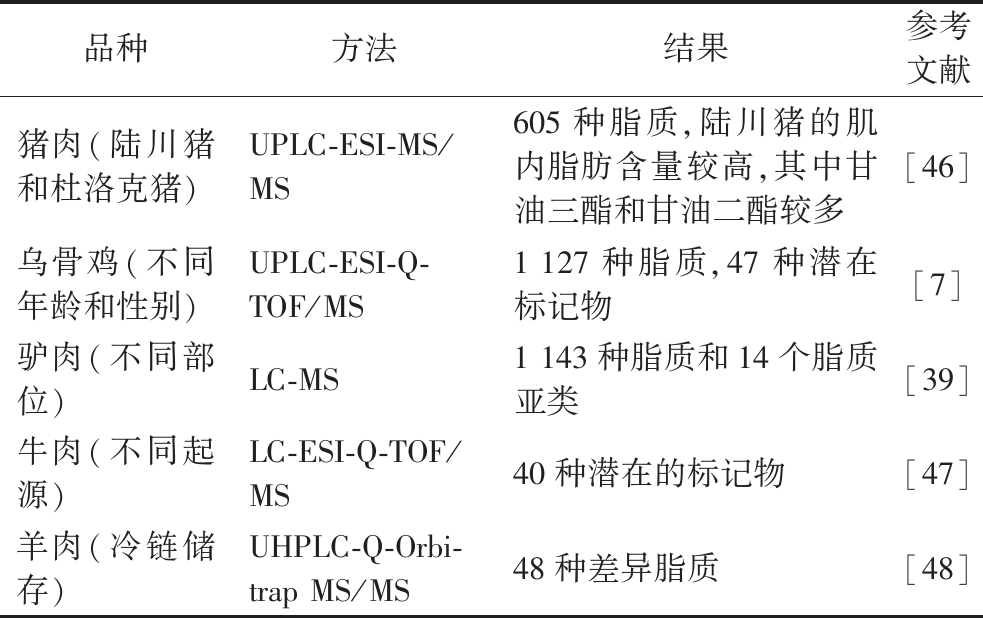
品种方法结果参考文献猪肉(陆川猪和杜洛克猪)UPLC-ESI-MS/MS605种脂质,陆川猪的肌内脂肪含量较高,其中甘油三酯和甘油二酯较多[46]乌骨鸡(不同年龄和性别)UPLC-ESI-Q-TOF/MS1 127种脂质,47种潜在标记物[7]驴肉(不同部位)LC-MS1 143种脂质和14个脂质亚类[39]牛肉(不同起源)LC-ESI-Q-TOF/MS40种潜在的标记物[47]羊肉(冷链储存)UHPLC-Q-Orbi-trap MS/MS48种差异脂质[48]
3.1 脂质组学用于反刍动物肉品质的评价
近年来,反刍动物肉产品因其具有较高的营养价值,越来越受消费者的青睐。弓宇[49]通过利用脂质组学对比了蒙古牛背最长肌黄色脂肪和西门塔尔牛背最长肌白色脂肪的差异,共发现23种脂质,其中肉豆蔻酸、亚油酸、油酸、磷脂酰胆碱、卵磷脂等脂质相对含量发生了显著变化,且这些差异脂质在蒙古牛中主要参与能量代谢、脂质代谢等生命活动;将差异脂质进行KEGG通路富集,结果表明蒙古牛和西门塔尔牛间主要的差异代谢通路为亚油酸代谢通路。
在最近的另一项研究中,应用UHPLC-Q-Orbitrap质谱分析了羊肉在储存期间的脂质变化。共鉴定出48种显著变化的脂质,在储存的前12 天,磷脂酰胆碱和磷脂酰乙醇胺水平升高,在12 d后开始下降;在整个冷链储存过程中,溶血磷脂酰乙醇胺和溶血磷脂酰胆碱的含量增加;12 d后,磷脂酰胆碱和磷脂酰乙醇胺的累积引起了大量氧化反应,说明最佳冷链储存时间为12 d[48]。
乌其尔·依热格吉牧[50]利用脂质组学对不同部位脂肪组织进行分析,结果表明在尾部脂肪中甘油二酯显著上升,并显著高于肌内脂肪和肾周脂肪,同时发现在尾部脂肪中油酸和亚油酸含量显著高于骨骼肌脂肪和肾周围脂肪。LI等[51]利用脂质组学探究去势对羔羊腰大肌品质的影响,结果表明去势后羔羊腰大肌中有224种脂质分子增加,脂质分子的变化产生了更丰富的风味前体物质,有利于羔羊肉品质的提升,且去势降低了羔羊睾酮水平,促进了脂肪沉积。武海燕[52]利用脂质组学对不同月龄苏尼特羊骨骼肌脂肪沉积的差异进行对比,结果表明18月龄与6月龄、30月龄与6月龄苏尼特羊骨骼肌间差异显著的代谢途径为亚油酸代谢、磷酸戊糖途径,30月龄与6月龄、30月龄与18月龄苏尼特羊骨骼肌间差异显著的代谢途径为甘油磷脂代谢途径,18月龄与6月龄、30月龄与18月龄苏尼特羊骨骼肌间差异显著的代谢途径为谷胱甘肽代谢途径,表明不同月龄间苏尼特羊骨骼肌脂肪沉积及代谢存在显著差异,富集到的差异代谢通路可作为调节苏尼特羊骨骼肌脂肪沉积的潜在调节途径。
综上所述,已有大量研究利用脂质组学对反刍动物肉品质进行评价,且主要集中于不同部位、饲养方式及品种等差异方面的研究,但对于日粮中添加天然饲料添加剂对于反刍动物脂质代谢影响的研究较少,仍需进一步发展。
3.2 脂质组学用于单胃动物肉品质的评价
脂质是影响肉质和营养价值的关键膳食成分。MI等[6]使用UPLC-ESI-MS/MS鉴定了不同品种猪肉样品中的1 180种脂质,其中,藏猪肉含有28类差异脂质,吉林猪肉含有18类差异脂质。此外,结果表明三门峡猪肉的多不饱和脂肪酸含量显著高于藏猪肉和吉林猪肉。这些结果表明,脂质种类可以用于区分不同猪肉样品的肉质。
ZHANG等[46]对不同品种猪的肌肉进行脂质组学(UPLC-ESI-MS/MS)和转录组学分析,揭示了肌内脂肪含量的差异,发现陆川猪的肌内脂肪含量显著高于杜洛克猪。此外,共检测到23类605种脂质,与杜洛克猪相比,陆川猪有194种脂质分子上调,45种脂质下调。李洁[53]对比分析了150日龄、210日龄和300日龄的沙子岭猪和大白猪皮下脂肪组织的脂质组成,结果表明150日龄时,沙子岭猪和大白猪皮下脂肪组织的差异脂质亚类为鞘磷脂、磷脂酰甘油、磷脂酰胆碱、溶血磷脂酰胆碱、甘油二酯和植物鞘氨醇,210日龄时的差异脂质亚类为磷脂酰甘油、辅酶、半乳糖二酰基丙三醇,300日龄时的差异脂质亚类为磷脂酰甘油、心磷脂、植物鞘氨醇。磷脂酰甘油在3个日龄下均被鉴定为差异脂质且在沙子岭猪皮下脂肪组织中含量显著低于大白猪。此外,李洁[53]还发现差异脂质分子中酰基链的组成差异显著,与大白猪皮下脂肪组织相比,沙子岭猪皮下脂肪组织中单不饱和脂肪酸的含量更高,多不饱和脂肪酸的含量更低。对同一品种不同日龄猪的脂质组成进行对比发现,沙子岭猪和大白猪中磷脂酰胆碱、磷脂酰甘油、心磷脂和鞘磷脂等脂质分子的含量均随日龄的增加显著下降。
MI等[7]对太和乌骨鸡肉不同年龄、性别及部位进行了脂质组学分析,结果表明,306 d的乌骨鸡其不饱和脂肪酸中DHA含量显著高于89 d的乌骨鸡;与雌性乌骨鸡相比,雄性乌骨鸡中磷脂及DHA含量更高。腿部肌肉中甘油三酯、多不饱和脂肪酸及植物神经酰胺含量显著高于胸部肌肉,证明腿部肌肉营养价值相对胸部更高。
LI等[40]利用脂质组学对驴背最长肌和内脏脂肪组织进行研究表明,不同部位间脂质分子差异较大,在背最长肌和内脏脂肪组织中分别鉴定出1 146和1 134种脂质,并表明了脂质分子差异会导致脂肪酸组成不同,多不饱和脂肪酸在甘油三酯中优先分布在sn-1位点,在磷脂酰胆碱和磷脂酰乙醇胺中优先分布在sn-2位点。背最长肌中甘油三酯中多不饱和脂肪酸含量显著低于内脏脂肪组织,而磷脂酰胆碱和磷脂酰乙醇胺中多不饱和脂肪酸含量的趋势相反;且通过对差异脂质进行KEGG通路富集筛选出甘油酯代谢和甘油磷脂代谢通路可作为调节肌内脂肪沉积的关键途径。此外,LI等[39]在另一项比较德州驴背最长肌、臀肌和腿肌脂质特征的研究中表明,与臀肌和腿肌相比,背最长肌中肌内脂肪含量更高,且主要由富含饱和脂肪酸和单不饱和脂肪酸的甘油三酯组成,在鉴定到的差异脂质中,甘油三酯、甘油磷脂和鞘脂类含量最高,其代谢过程可作为调节肌内脂肪沉积的关键途径,对肉质的多汁性、嫩度及风味有显著影响。
4 结语
总的来说,脂质组学已经取得了快速进展,基于质谱的脂质组学在畜禽肉产品的脂质谱分析、质量鉴定和来源溯源等方面取得了快速进展。先进的分析技术,特别是基于LC-MS的方法与生物信息学工具相结合,可以深入了解对畜禽肉产品相关研究中的生物过程和分子组成,目前的分析方法已经允许脂质分析具有高通量、分辨率、灵敏度和结构鉴定能力。然而,还存在一些限制,阻碍了脂质组学的广泛应用,例如,在数据处理、数据挖掘和数据解释方面还需要进一步发展;肉产品中的脂质结构复杂多样,使用现有方法很难分离和检测所有的脂质种类。复杂样品中的脂质浓度可能包含数千种类型的脂质,可能会有很大的变化,这使得准确的定量分析具有挑战性;许多脂质难以合成,脂质组学方法缺乏标准,严重影响了脂质鉴定和定量;使用不同仪器收集的有关脂质谱的信息可以显示出差异,并且需要使用标准化命名系统准确定义脂质类别和结构。因此,脂质组学领域的科技进步备受期待,以改善脂质分离与定量、质谱检测与表征以及数据处理。同时,脂质组学与转录组学、代谢组学的结合运用可加强对于肉产品营养价值及其相关生物过程进行全面了解,有利于畜牧业的精确营养和日粮干预。虽然目前已有大量研究应用脂质组学探究肉产品品质及其相关生物过程,然而,饲料营养对家畜肉产品中脂质组成调控的研究较少,仍需进一步研究。
[1] HAN X L.Lipidomics for studying metabolism[J].Nature Reviews.Endocrinology, 2016, 12(11):668-679.
[2] KOUBA M, MOUROT J.A review of nutritional effects on fat composition of animal products with special emphasis on n-3 polyunsaturated fatty acids[J].Biochimie, 2011, 93(1):13-17.
[3] HAN X L, GROSS R W.Global analyses of cellular lipidomes directly from crude extracts of biological samples by ESI mass spectrometry:A bridge to lipidomics[J].Journal of Lipid Research, 2003, 44(6):1071-1079.
[4] FAHY E, SUBRAMANIAM S, BROWN H A, et al.A comprehensive classification system for lipids[J].Journal of Lipid Research, 2005, 46(5):839-861.
[5] CARRASCO-PANCORBO A, NAVAS-IGLESIAS N, CUADROS-RODR GUEZ L.From lipid analysis towards lipidomics, a new challenge for the analytical chemistry of the 21 st century.Part I:Modern lipid analysis[J].TrAC Trends in Analytical Chemistry, 2009, 28(3):263-278.
GUEZ L.From lipid analysis towards lipidomics, a new challenge for the analytical chemistry of the 21 st century.Part I:Modern lipid analysis[J].TrAC Trends in Analytical Chemistry, 2009, 28(3):263-278.
[6] MI S, SHANG K, LI X, et al.Characterization and discrimination of selected China’s domestic pork using an LC-MS-based lipidomics approach[J].Food Control, 2019, 100:305-314.
[7] MI S, SHANG K, JIA W, et al.Characterization and discrimination of Taihe black-boned silky fowl (Gallus gallus domesticus Brisson) muscles using LC/MS-based lipidomics[J].Food Research International, 2018, 109:187-195.
[8] LI M H, LI W X, WU J R, et al.Quantitative lipidomics reveals alterations in donkey milk lipids according to lactation[J].Food Chemistry, 2020, 310:125866.
[9] WANG C, KONG H W, GUAN Y F, et al.Plasma phospholipid metabolic profiling and biomarkers of type 2 diabetes mellitus based on high-performance liquid chromatography/electrospray mass spectrometry and multivariate statistical analysis[J].Analytical Chemistry, 2005, 77(13):4108-4116.
[10] YI M, ZHANG C H, ZHANG Z Y, et al.Integrated metabolomic and lipidomic analysis reveals the neuroprotective mechanisms of Bushen Tiansui formula in an A β 1-42-induced rat model of Alzheimer’s disease[J].Oxidative Medicine and Cellular Longevity, 2020, 2020:5243453.
[11] 崔益玮, 王利敏, 戴志远, 等.脂质组学在食品科学领域的研究现状与展望[J].中国食品学报, 2019, 19(1):262-270.
CUI Y W, WANG L M, DAI Z Y, et al.Recent advances and prospect of lipidomics in food science[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(1):262-270.
[12] 崔伟, 孟祥忍, 高子武, 等.牛肉低温蒸煮过程中挥发性风味成分及其前体物动态变化[J].食品与机械, 2022, 38(4):20-28;244.
CUI W, MENG X R, GAO Z W, et al.Dynamic changes of volatile flavor components and their precursors during low temperature cooking of beef[J].Food &Machinery, 2022, 38(4):20-28;244.
[13] 吕经秀, 韩婷婷, 刘裕, 等.脂质组学在肉品中的研究进展[J].肉类研究, 2022, 36(10):57-63.
LYU J X, HAN T T, LIU Y, et al.Research progress of lipidomics in meat[J].Meat Research, 2022, 36(10):57-63.
[14] ALEWIJNSE A E, PETERS S L M.Sphingolipid signalling in the cardiovascular system:Good, bad or both?[J].European Journal of Pharmacology, 2008, 585(2-3):292-302.
[15] QIU J Q, LI T Z, ZHU Z J.Multi-dimensional characterization and identification of sterols in untargeted LC-MS analysis using all ion fragmentation technology[J].Analytica Chimica Acta, 2021, 1142:108-117.
[16] SIMONETTI G, DI FILIPPO P, POMATA D, et al.Characterization of seven sterols in five different types of cattle feedstuffs[J].Food Chemistry, 2021, 340:127926.
[17] CHAKRABARTY S, BUI Q, BADEANLOU L, et al.S1P/S1PR3 signalling axis protects against obesity-induced metabolic dysfunction[J].Adipocyte, 2022, 11(1):69-83.
[18] CARPENTIER Y A, PORTOIS L, SENER A, et al.Correlation between liver and plasma fatty acid profile of phospholipids and triglycerides in rats[J].International Journal of Molecular Medicine, 2008, 22(2):255-262.
[19] PAN J P, WANG H, LI Y, et al.Comparative proteomic analysis reveals the effects of different fatty acid forms on high-fat diet mice[J].Food Science and Human Wellness, 2022, 11(2):316-322.
[20] 王建红. 中链甘油三酯对肉仔鸡脂肪代谢和肉品质的影响及其作用机理[D].北京:中国农业大学, 2015.
WANG J H.Effects of medium-chain triglyceride on lipid metabolism and meat quality and the mechanisms in broilers[D].Beijing:China Agricultural University, 2015.
[21] ENSER M, SCOLLAN N D, CHOI N J, et al.Effect of dietary lipid on the content of conjugated linoleic acid (CLA) in beef muscle[J].Animal Science, 1999, 69(1):143-146.
[22] LI X B, HE Q X, HOU H R, et al.Targeted lipidomics profiling of marine phospholipids from different resources by UPLC-Q-Exactive Orbitrap/MS approach[J].Journal of Chromatography.B, Analytical Technologies in the Biomedical and Life Sciences, 2018, 1096:107-112.
[23] NUMATA M, KANDASAMY P, NAGASHIMA Y, et al.Phosphatidylglycerol suppresses influenza A virus infection[J].American Journal of Respiratory Cell and Molecular Biology, 2012, 46(4):479-487.
[24] CANELA N, HERRERO P, MARINÉ S, et al.Analytical methods in sphingolipidomics:Quantitative and profiling approaches in food analysis[J].Journal of Chromatography.A, 2016, 1428:16-38.
[25] SUGAWARA T, AIDA K, DUAN J J, et al.Analysis of chemical structures of glucosylceramides from rice and other foodstuffs[J].Journal of Nutritional Science and Vitaminology, 2019, 65(Supplement):S228-S230.
[26] NORRIS G H, PORTER C M, JIANG C, et al.Dietary sphingomyelin attenuates hepatic steatosis and adipose tissue inflammation in high-fat-diet-induced obese mice[J].The Journal of Nutritional Biochemistry, 2017, 40:36-43.
[27] NILSSON Å.Role of sphingolipids in infant gut health and immunity[J].The Journal of Pediatrics, 2016, 173:S53-S59.
[28] TANAKA K, HOSOZAWA M, KUDO N, et al.The pilot study:Sphingomyelin-fortified milk has a positive association with the neurobehavioural development of very low birth weight infants during infancy, randomized control trial[J].Brain &Development, 2013, 35(1):45-52.
[29] TSUKAHARA R, HANIU H, MATSUDA Y, et al.Heart-type fatty-acid-binding protein (FABP3) is a lysophosphatidic acid-binding protein in human coronary artery endothelial cells[J].FEBS Open Bio, 2014, 4:947-951.
[30] VUTUKURI R, KOCH A, TRAUTMANN S, et al.S1P d20:1, an endogenous modulator of S1P d18:1/S1P2-dependent signaling[J].FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology, 2020, 34(3):3932-3942.
[31] KAUR N, CHUGH V, GUPTA A K.Essential fatty acids as functional components of foods: A review[J].Journal of Food Science and Technology, 2014, 51(10):2289-2303.
[32] SWANSON D, BLOCK R, MOUSA S A.Omega-3 fatty acids EPA and DHA:Health benefits throughout life[J].Advances in Nutrition, 2012, 3(1):1-7.
[33] RODRIGUES H G, TAKEO SATO F, RUI C R, et al.Fatty acids as modulators of neutrophil recruitment, function and survival[J].European Journal of Pharmacology, 2016, 785:50-58.
[34] DENNIS E A.Lipidomics joins the omics evolution[J].Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(7):2089-2090.
[35] XU T R, HU C X, XUAN Q H, et al.Recent advances in analytical strategies for mass spectrometry-based lipidomics[J].Analytica Chimica Acta, 2020, 1137:156-169.
[36] ROACH J A G, YURAWECZ M P, KRAMER J K G, et al.Gas chromatography—High resolution selected-ion mass spectrometric identification of trace 21∶0 and 20∶2 fatty acids eluting with conjugated linoleic acid isomers[J].Lipids, 2000, 35(7):797-802.
[37] 王彦平, 郭建凤, 呼红梅, 等.猪肌肉脂肪酸成分的气相色谱测定方法[J].畜牧与兽医, 2017, 49(3):57-61.
WANG Y P, GUO J F, HU H M, et al.Method for determination of fatty acid composition of porcine muscle using gas chromatography[J].Animal Husbandry &Veterinary Medicine, 2017, 49(3):57-61.
[38] HINES K M, HERRON J, XU L B.Assessment of altered lipid homeostasis by HILIC-ion mobility-mass spectrometry-based lipidomics[J].Journal of Lipid Research, 2017, 58(4):809-819.
[39] LI M M, ZHU M X, CHAI W Q, et al.Determination of lipid profiles of Dezhou donkey meat using an LC-MS-based lipidomics method[J].Journal of Food Science, 2021, 86(10):4511-4521.
[40] LI M M, ZHU M X, CHAI W Q, et al.Determination of the heterogeneity of intramuscular fat and visceral adipose tissue from Dezhou donkey by lipidomics and transcriptomics profiling[J].Frontiers in Nutrition, 2021, 8:746684.
[41] RABIEI Z, BIGDELI M R, RASOULIAN B, et al.The neuroprotection effect of pretreatment with olive leaf extract on brain lipidomics in rat stroke model[J].Phytomedicine:International Journal of Phytotherapy and Phytopharmacology, 2012, 19(10):940-946.
[42] GAO F, BEN-AMOTZ D, YANG Z L, et al.Complementarity of FT-IR and Raman spectroscopies for the species discrimination of meat and bone meals related to lipid molecular profiles[J].Food Chemistry, 2021, 345:128754.
[43] HOL APEK M, LIEBISCH G, EKROOS K.Lipidomic analysis[J].Analytical Chemistry, 2018, 90(7):4249-4257.
APEK M, LIEBISCH G, EKROOS K.Lipidomic analysis[J].Analytical Chemistry, 2018, 90(7):4249-4257.
[44] 苏馨, 李金泉, 赵存, 等.内蒙古地区杜泊羊、萨福克羊和乌珠穆沁羊脂肪酸含量分析[J].今日畜牧兽医, 2021, 37(10):4, 7.
SU X, LI J Q, ZHAO C, et al.Analysis of fatty acid content of dorper sheep, Suffolk sheep and wuzhumuqin sheep in Inner Mongolia[J].Today Animal Husbandry and Veterinary Medicine, 2021, 37(10):4, 7.
[45] QI L.Gene-diet interactions in complex disease:Current findings and relevance for public health[J].Current Nutrition Reports, 2012, 1(4):222-227.
[46] ZHANG Z W, LIAO Q C, SUN Y, et al.Lipidomic and transcriptomic analysis of the longissimus muscle of Luchuan and duroc pigs[J].Frontiers in Nutrition, 2021, 8:667622.
[47] WANG K, XU L, WANG X, et al.Discrimination of beef from different origins based on lipidomics:A comparison study of DART-QTOF and LC-ESI-QTOF[J].LWT- Food Science and Technology, 2021, 149(20):111838.
[48] 贾玮, 李芮廷, 刘树兴, 等.基于超高效液相色谱-四极杆-静电场轨道离子阱串联质谱的冷链贮藏过程中滩羊肉的脂质组学研究[J].分析测试学报, 2021, 40(3):295-302.
JIA W, LI R T, LIU S X, et al.Lipidomics study of Tan-sheep meat in cold chain storage based on ultra high performance liquid chromatography-quadrupole-orbitrap mass spectrometry[J].Journal of Instrumental Analysis, 2021, 40(3):295-302.
[49] 弓宇. 蒙古牛和西门塔尔牛脂肪特性及脂质代谢组学分析[D].呼和浩特:内蒙古农业大学, 2021.
GONG Y.Fat characteristics and lipid metabolome analysis of Mongolian cattle and Simmental cattle[D].Hohhot:Inner Mongolia Agricultural University, 2021.
[50] 乌其尔·依热格吉牧.苏尼特羊不同部位脂质代谢组分析[D].呼和浩特.内蒙古农业大学,2019.
WU QI ER·YI RE GE JI MU.Analysis of lipid metabolism in different parts of Sunit sheep[D].Hohhot.Inner Mongolia Agricultural University, 2019.
[51] LI J, TANG C H, ZHAO Q Y, et al.Integrated lipidomics and targeted metabolomics analyses reveal changes in flavor precursors in psoas major muscle of castrated lambs[J].Food Chemistry, 2020, 333:127451.
[52] 武海燕. 分析不同月龄苏尼特羊骨骼肌沉积脂肪组织的代谢差异[D].呼和浩特:内蒙古农业大学, 2021.
WU H Y.Analysis of skeletal muscle adipose tissue metabolism in Sunit sheep of different aged[D].Hohhot:Inner Mongolia Agricultural University, 2021.
[53] 李洁. 沙子岭猪与大白猪皮下脂肪脂质沉积差异及其血清代谢标志物研究[D].杭州:浙江大学, 2022.
LI J.Study on the difference of subcutaneous fat and lipid deposition between Shaziling pig and large white pig and its serum metabolic markers[D].Hangzhou:Zhejiang University, 2022.