食疗保健在我国已有数千年发展历史。古时人们就在日常饮食中加入食药两用物质,以食疗食养方法达到保健和预防疾病的目的。2020年,我国保健食品消费市场值超2 700亿元,年产业增速超15%[1]。我国65岁以上老龄人口2020年已达1.91亿,预计2057年将达4.25亿[2]。在人口老龄化的疾病负担和保健需求驱动下,可预期未来保健食品市场将持续增长。然而,由于具有营养与功效的双重属性,我国保健食品的管理正面临诸多挑战,例如疗效声称和宣传缺乏依据、特殊人群使用的潜在安全性问题、部分经营者将其作为药品销售等[3],因此保健食品评价、审批、功能声称等相关法律法规仍待完善。
中日两国地理位置较近,日本自古不断向我国学习中华文化,造就如今两国饮食、传统医学和保健观念有诸多共同之处。日本是最早提出保健(功能性)食品概念的国家,至2020年,其健康食品市场总销售额已达4 482亿日元[4]。日本政府配套出台了上市审批、功能评价、标签规定和安全监管等系列法律法规,管理机制已相对成熟,相关优势方案可供我国优化保健食品管理策略借鉴。本文就中日两国保健食品的定义、分类、评价和管理策略进行对比性论述,以期为我国完善保健食品管理机制提供参考。
1 我国保健食品管理现状
1.1 保健食品的定义
我国食品可归为普通食品与特殊食品两类。特殊食品有特定食用人群的限制和相关法规管制,上市前需进行注册审批,包括保健食品、婴幼儿配方食品和特殊医学用途配方食品3种。其中,保健食品的品类最多、功效和应用范围最广。1997年,国家技术监督管理局发布的GB 16740—1997《保健(功能)食品通用标准》中将保健食品定义为“具有一般食品的共性,能调节人体的机能,适于特定人群食用,但不以治疗疾病为目的”的一个食品种类。2014年,国家卫计委发布的GB 16740—2014《食品安全国家标准 保健食品》中更新了保健食品定义,新定义在延续“保健食品类别归属于食品,具有特定保健功能及非药物性”基础上,补充强调了“对人体不会产生危害”的安全属性。
1.2 我国保健食品审批流程
我国保健食品的注册审批由国家市场监督管理总局(State Administration for Market Regulation,SAMR;原国家食品药品监督管理总局)各部门协同管理,法规依据为2016年发布的《保健食品注册与备案管理办法》。我国保健食品按出产地可分国产和进口两类,注册流程有所不同[5]。
国产保健食品提交注册申请前,申请人需向SAMR认可的保健食品检验机构提交产品样品,进行样品的安全、功能、成分、卫生和产品稳定性的全面检测。完成后,向当地市场监督管理局提交《国产保健食品注册申请表》、检测结果和样品。监管部门5日内确定是否受理申请,若通过则开展样品生产现场核查,并向检验机构送检抽样产品,完成后将申请材料、审查意见和检验结果一同上报SAMR。对初审合格的产品,SAMR组织审查食品、营养、医学、药学和其他技术资料,审查通过者可授予《国产保健食品批准证书》。进口保健食品注册则无需向当地市场监督管理局提交注册申请,直接向SAMR提交《进口保健食品注册申请表》、申请资料及样品,其他步骤与国产保健食品注册流程相同,最后颁发《进口保健食品批准证书》。注册流程详见图1。此外,我国保健食品实行注册与备案双轨制,需进行注册和备案的食品类别存在差异:原料在保健食品原料目录外的保健食品及首次进口的保健食品(除补充维生素、矿物质等营养物质的保健食品外)需进行注册;而原料已列入保健食品原料目录的保健食品及首次进口的补充营养物质类保健食品则需进行备案,备案人根据国产/进口保健食品材料要求向SAMR提交备案,备案材料符合要求者当场备案,存档备案信息并发放备案号。
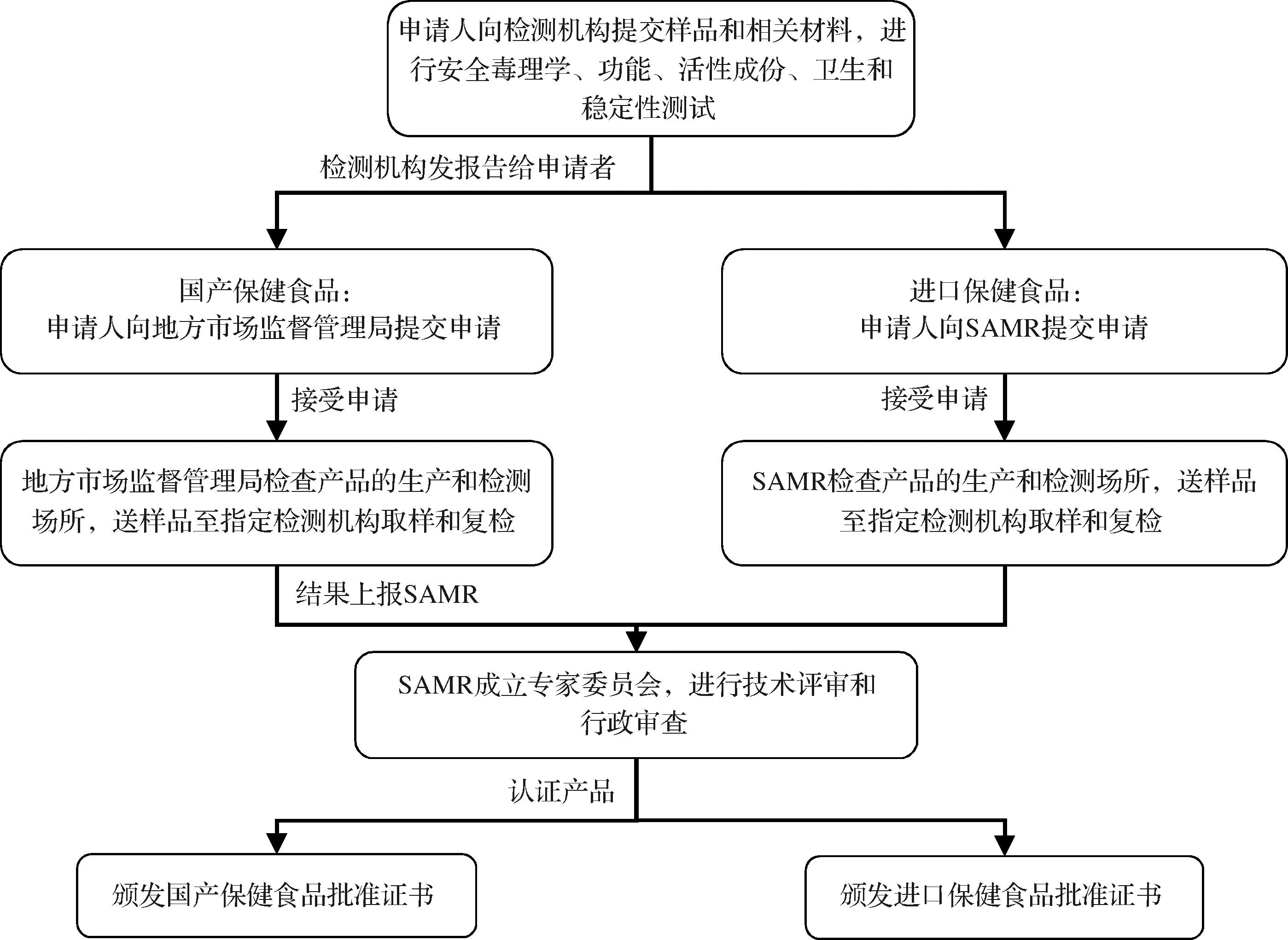
图1 我国国产/进口保健食品审批流程
Fig.1 Approval process for domestic/imported health foods in China
1.3 我国保健食品功能评价方法
我国卫生部于2003年首次发布了27种保健功能的《保健食品检验与评价技术规范》。该规范于2018年废止,但并未立即出台新技术规范,这导致保健食品的评价与管理一时缺乏关键依据。2020年,SAMR发布新的《允许保健食品声称的保健功能目录》意见征求稿,并于2022年更新[6-7]。新目录中删除3种保健功能(促进泌乳、改善生长发育、改善皮肤油份),仅认可24种保健功能,包括:(有助于)增强免疫力、抗氧化、改善睡眠、控制体内脂肪、改善骨密度、改善痤疮、改善黄褐斑、改善皮肤水份状况、调节肠道菌群、消化、润肠通便、维持血脂/血脂/血压健康水平、排铅;(辅助)改善记忆、保护胃黏膜;缓解视觉疲劳、体力疲劳;清咽润喉、耐缺氧、改善缺铁性贫血;对化学性肝损伤/电离辐射危害有辅助保护作用。新目录配套的《保健食品功能检验与评价方法》为以上每项保健功能详细制定了动物和人体的试验项目/原则、功能学检验方法及结果判定标准。动物实验部分包括实验原理、实验动物选择、根据剂量进行分组、产品喂养时间、相关仪器及材料、具体的实验步骤、相关数据处理方法及结果判定方法、相关注意事项等,部分功能可不进行动物实验验证。人体试食试验部分包括受试者纳入/排除标准、试验设计方法及分组要求、样品剂量及具体使用方法、观察指标选择、相关数据处理及结果判定方法和注意事项等。值得注意的是,《方法》仅为推荐性指南,并非强制要求。
1.4 我国保健食品标签规定
保健食品标签指产品外包装和内置说明书印有或贴有的内容。根据我国《保健食品标识规定》[8],保健食品标签应注明:产品名称、保健食品特有标志(“蓝帽子”)、净含量、警示语、原/辅料、功效或标志性成分及含量、适宜/不适宜人群、保健功能、食用量及方法、规格、贮藏方法、保质期、注意事项、生产日期、执行标准、许可证编号、企业名称与地址、投诉服务电话。标签内容的基本要求为:名称以汉字为主要文字,可配拼音或外文,但需与汉字直接对应且以汉字为主体;标识内容需与产品实际情况一致,不得呈现误导性文字或图片,不得暗示与其他产品类似,不得标示虚假信息或夸大保健作用,更不得描述或声称有疾病治疗作用[9]。
1.5 我国保健食品的安全监管
安全是作为食品的最重要属性。为保证食品安全,保障公众身体健康和生命安全,我国制定了《中华人民共和国食品安全法》[10],该法规第三条强调:“食品安全工作实行预防为主、风险管理、全程控制、社会共治,建立科学、严格的监督管理制度”;第七十八条强调:“保健食品的标签、说明书不得涉及疾病预防、治疗功能,内容应当真实,与注册或者备案的内容相一致,载明适宜人群、不适宜人群、功效成分或者标志性成分及其含量等,并声明‘本品不能代替药物’。保健食品的功能和成分应当与标签、说明书相一致。”此外,原卫生部制定了保健食品专用法规《保健食品管理办法》[11],其中规定:申请保健食品需提供有直接管辖权的卫生行政部门发放的有效食品生产经营卫生许可证及三批产品的质量与卫生检验报告;进口保健食品则需额外提供口岸进口食品卫生监督检验机构的检验合格证。《办法》也对保健食品生产和评价做了具体安全性要求:①申请《保健食品批准证书》须提交毒理学安全性评价报告;②原料及产品须符合食品卫生要求,即对人体无任何急性、亚急性或慢性危害;③生产过程、生产条件须符合相应食品生产规范和卫生要求,加工过程不转化或产生有害中间体;④直接与保健食品接触的包装材料或容器须符合有关卫生标准或卫生要求。此外,GB 16740—2014《食品安全国家标准 保健食品》中也包含保健食品相关安全标准,如微生物、重金属、放射物质的测定方法和标准;原/辅料和食品添加剂的农药、兽药、生物毒素残留限量标准。
2 日本特定保健用食品管理现状
2.1 日本特殊食品分类和定义
日本的特殊食品根据认证方式、成分、功能和标记分为3类:特定保健用食品、营养机能食品和功能性标示食品。其中,特定保健用食品(Food for Specified Health Uses,FOSHU)定义为含对人体生理学功能产生影响的保健功效成份、有助于增进健康或降低疾病的食品,根据具体功能可分10类[12]:辅助降低血胆固醇水平、辅助降血压、促进矿物质吸收、改善牙齿健康、改善胃肠环境、辅助降低餐后血糖水平、降低血甘油三酯水平、降低体脂、补充皮肤水分、改善骨骼健康。FOSHU上市前需通过日本国家认证[13]。营养机能食品是指用于补充特定营养成分的食品,特定营养成分包括可添加的维生素13种、矿物质6种、脂肪酸1种,其无需国家认证,仅需在销售前按规定申报营养补充功能[14]。功能性标示食品指是由经营者负责、以科学的依据在商品包装上进行功能性标识、并向消费者厅申报的食品;该类食品也无需国家认证,仅报告因含某物质而具某功能[15]。这些特殊食品中,FOSHU与我国保健食品的概念和范畴最为接近,故本文以此展开论述和比较。
2.2 FOSHU的分类与授权规则
日本的FOSHU批准制度将其分为5个子类:常规型、规格基准型、降低疾病风险型、再授权型和条件限制型,分类依据包括产品类型、有效活性成分和科学证据支持程度(表1)[16-17]。常规型FOSHU的授权需通过疗效、安全性和质量控制等全面评估;规格基准型仅适用于有足够科学证据证明其功效的营养素和其他食物成分,其授权需符合预先确定的每日剂量上下限和健康声明措辞;降低疾病风险型FOSHU包括钙(骨质疏松)和叶酸(神经管缺陷)两种成分[18],在通过疗效、安全性、质量控制等全面评估,且meta分析证明其降低疾病风险有效性后可授权;再授权型FOSHU指已获批准、但口味或名字发生变化的产品,需有稳定性和质量控制方法的评估;条件限制型FOSHU指添加了目前尚无明确证据或机制未知活性成分的FOSHU,该类FOSHU标签须注明“本产品包括(物质名称),可能适用于(健康声明),尽管该有效性理由不一定成立”[15]。
表1 日本FOSHU分类
Table 1 Classification of FOSHU in Japan

类别定义和要求常规型针对日常饮食的FOSHU类别,其健康声明的安全性和有效性已通过一系列安全/稳定性测试和临床试验,并获得消费者厅批准,可进行特定健康声明。规格基准型指含有某些活性成分的FOSHU,这些活性成分已被证明符合特定健康声明、成分和/或质量的标准和规范。有科学证据积累的FOSHU可在消费者厅单独审查后批准为规格基准型FOSHU。降低疾病风险型在功效已有医学和营养学证据前提下,该类别允许产品标签上描述其降低疾病风险的功效,目前允许的2种成分为钙和叶酸。再授权型在已认证FOSHU基础上改变其风味或名称的FOSHU。条件限制型指具有一定功效、但其科学数据未达常规类FOSHU结论性要求的食品。该类FOSHU申请过程较简单和宽松,但标签须包含以下声明:“本产品包括(物质名称),可能适用于(健康声明),尽管该有效性理由不一定成立”。
2.3 FOSHU审批流程
日本FOSHU审批流程由消费者厅(相当于我国市场监督管理部门)负责执行,主要步骤如下[19]:首先,企业向消费者厅提交设置许可申请书、审查申请书及附件;消费者厅向消费者委员会下设的新开发食品评价第一调查会和新开发食品调查部会进行调查,向食品安全委员会下设的新开发食品专门调查会进行咨询,该委员会负责评估产品安全性(部分无需食品健康影响评价的产品则不涉及该部门的评价),向厚生劳动省下的医药·生活卫生局进行意见征询,三者可同时进行,分别向消费者厅给出答复,审查结束后可由申请人将产品样品提交给医药·健康·营养研究所或认证的试验机构进行成分、功效和安全性检测。各部门完成评估后,将报告或答复发回消费者厅。最后,消费者厅从日本学术界遴选资深专家成立医学、营养、食品卫生和制药的专家委员会;根据产品声称的健康益处,将申请分配给相应专家委员会进行审查和评论,若通过则可授予FOSHU产品证书(图2)。
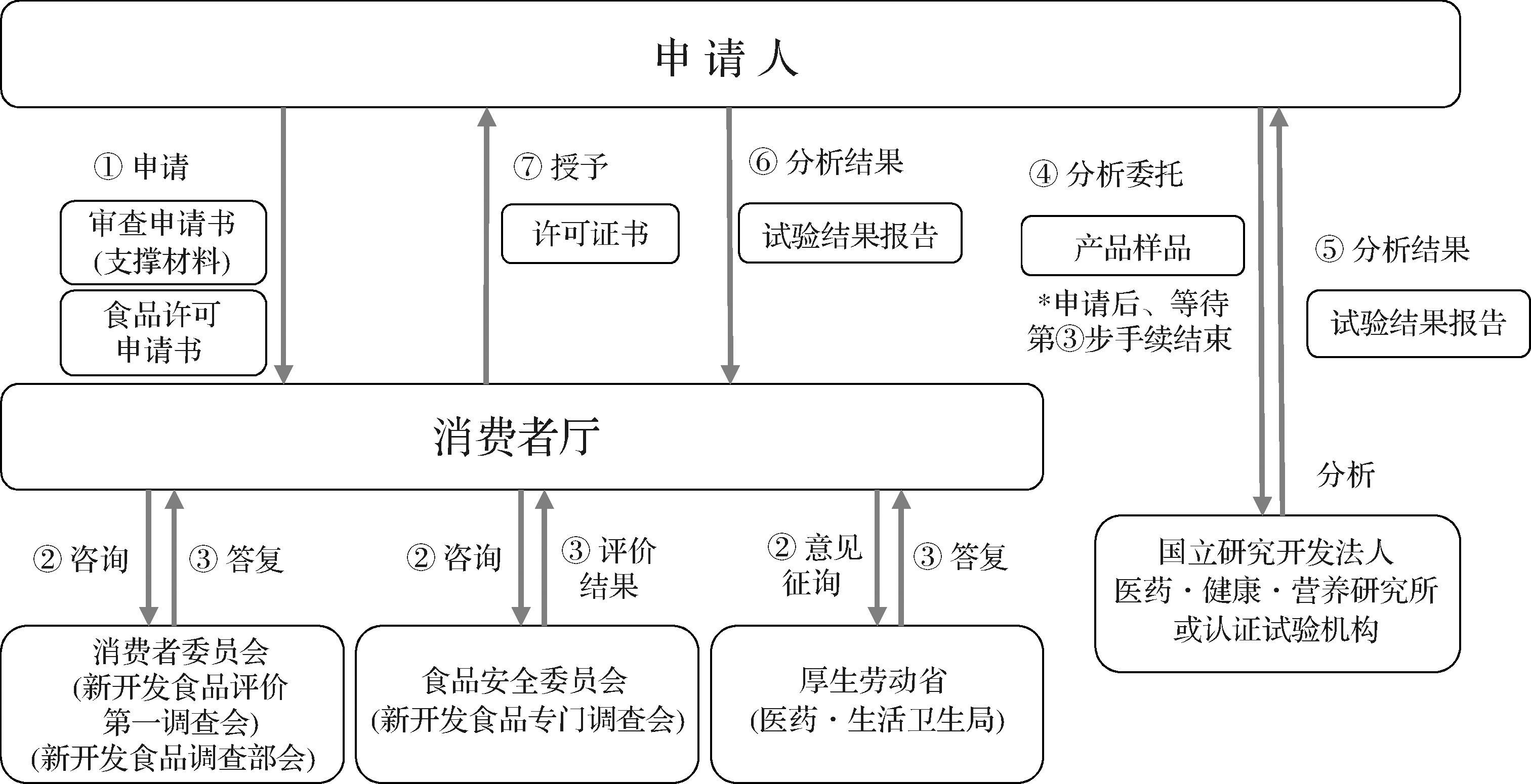
图2 日本FOSHU审批流程
Fig.2 Approval process for FOSHU in Japan
2.4 FOSHU功能评价方法
日本《关于编制特定保健用途食品申请表格的说明》[20]中明确了总体评价原则和7种功能人体试食试验的具体研究方法,包括:辅助降血胆固醇、辅助降中长期甘油三酯、辅助降餐后甘油三酯、辅助降血压、辅助餐后血糖、辅助降身体脂肪和肠道调节。具体要求包括:试验方法(应进行双盲平行或双盲交叉对照研究)、评估指标(如低密度脂蛋白胆固醇、甘油三酯、甘油三酯和空腹/餐后血糖的水平或曲线下面积等)、摄入期(一般要求12周,另加4周随访期)、研究对象(指标正常或略高于正常值)、受试者人数(确保足够进行分层分析)和有效性的确定(组间差异显著性水平一般设定P<0.05)。该《说明》同时包含FOSHU注册所需申请表及附件具体内容,详见表2。
表2 日本FOSHU注册申请表及附件
Table 2 Registration application form and attachment for FOSHU in Japan

类别内容基本信息申请人的姓名、地址和出生日期;销售办事处的名称和地址标签产品名称;到期日或最佳日期;内部含量产品相关内容食品许可及促进健康的理由(附件1:促进健康详细理由)健康声称(附件3:医学和营养学资料)原材料和添加剂的组成(附件4:安全材料;附件5:稳定性材料;附件6:物理、化学和生物特性及其试验方法的材料;附件7:营养成分定性和定量检测结果及检测方法说明)生产方法(附件9:质量控制方法材料)营养价值和热能价值(附件8:营养和热能含量试验报告)注意事项食用注意事项及特殊预防措施(附件2:建议每日摄入量和预防措施)附件内容附件1-9;附件10:不附某附件的理由;附件11:其他支持申请的资料
2.5 FOSHU标签规定
获得消费者厅许可后,产品标签中可标注FOSHU的专用标识(图3)。标签的信息还需包括:商标名、名称、原材料名、赏味期限、内容量、许可表示(如:该产品中含有某物质,有助于通便,适用于想要调理肠胃或想要疏通肠胃的人;该声明为改善胃肠环境FOSHU专用)、饮食中的用途(如以主食、主菜为主,保持饮食均衡)、营养成分(能量卡数;蛋白质、脂肪及碳水化合物克数;相当于食盐克数及参与成分克数)、每日摄取标准量(如每日食用几袋)、摄取方法(如溶于水后食用)、摄取注意事项(如:若摄取过多会导致腹部松弛,请遵守每日用量)、烹饪或保存方法(如请于阴凉处保存、避免阳光直射)、制造者、一日摄取目标量营养成分占总营养成分比例[21-22]。对于条件限制型FOSHU,许可标志需换成有“附带条件”声明的专用标识(图3)。

图3 日本一般特殊保健用食品和条件限制型特殊保健用食品标识[23]
Fig.3 Labels of general and conditionally food for specified health uses in Japan[23]
2.6 FOSHU安全监管
日本管理FOSHU的主要适用法律为《食品安全基本法》[24]。该法律将风险分析的概念引入食品安全管理。其中食品安全保障体系由风险评估、风险管理和风险沟通3要素组成。风险评估机构(食品安全委员会)和风险管理组织(厚生劳动省、消费者厅等)相互独立运作从而确保食品安全[25]。消费者厅就食品安全设计了安全卫生标签系统,该系统包括食品有效期、食品添加剂及过敏反应3类标签信息的展示[26]。官方文件中对食品有效期、食品添加剂和过敏反应均有设有相关设置指南和测试方法。FOSHU上市审查的安全性要求包括[27]:①食品及相关成分安全;②有充分的食用经验,若无则需基于科学依据进行充分的安全性评估。安全性审查需提交的资料包括:①通过体外和动物试验确认安全摄取量的基础资料;②通过人体试验确认摄取过量和长期摄取时的安全性资料。
3 中日保健食品管理和功能评价方法的比较
3.1 定义和分类的比较
在定义上,我国保健食品与日本FOSHU基本一致,但两者的分类差异明显。我国保健食品为单分类管理,而日本FOSHU呈现多样化分类,包括常规型和规格基准型FOSHU两个主分类及降低疾病风险、再授权和条件限制三个辅助分类。主分类中,常规型FOSHU的评估步骤简易,审批时效性高;规格基准型FOSHU则需进行更严格的有效性评估和追踪评估长期安全性,以确保提供更高质量产品[28]。3个辅助分类FOSHU可为特别情况下的保健需求提供审批依据。分类的多样化丰富了FOSHU的功能和适用范围,为大众不同健康需求提供了更有针对性的选择,有助于提高产品市场竞争力,促进行业规范化管理和发展。
3.2 审批流程的比较
中日两国的保健食品申请审批程序总体相似:①注册均需进行产品功效、安全性和稳定性评价的科学证据报告,要求的科学数据相似,且均需将材料和样品送至政府认证的第三方机构进行评估;②均采用初审和复审两级审批;初审需提交的申请材料基本相似,复审时均成立由不同领域专家组成的独立专家委员会;③在审批时间上,两国均在每年的3月、6月、9月和12月进行评估[17,29]。但两国也有明显不同之处:①保健食品评价机构有所差异。我国由SAMR授权机构进行评价,目前认可的保健食品检验机构包括安全性毒理学49家、功能学31家、功效成分/卫生学/稳定性检测34家、真菌菌种鉴定3家、益生菌菌种鉴定2家及兴奋剂检测和药材品种鉴定各1家[30]。而日本则由担任国立研究开发法人的医药/健康/营养研究所或认证试验机构进行。②评价结果认证方面,我国保健食品由SAMR直接认证评价结果的有效性,而日本FOSHU的评价结果须在日本期刊上发表(若该期刊为行业赞助期刊则需将样品及文件送健康和营养研究所检验)[31],因此可接受进一步同行评审,提高评价结果的科学性;缺点是导致注册成本更高、时间更长。日本注册流程平均需18个月,而我国流程约13个月[32-33]。③两国的正式审批各由SAMR和消费者厅负责。我国SAMR为专设监管机构,负责药品、食品、保健食品、医疗器械和化妆品的上市和安全管理,SAMR的设置消除了各政府机构间可能存在的标准冲突,使得注册效率高、一致性强。日本则由消费者厅统筹管理注册,但审批过程中需向3个隶属厚生劳动省的内阁府消费者委员会、食品安全委员会、医药生活卫生局征询意见,各部门相互独立,有利于提高审批过程的科学性和公正性。④注册审批过程中,我国SAMR认为有必要,可要求调查公司的生产现场,而日本无此规定[34]。⑤审批模式上,我国保健食品采用分类管理模式(实行大量注册及个别备案管理并行模式),日本特殊保健用食品则只能在注册申请通过后才能上市。
3.3 功能评价方法的比较
中日两国保健食品功能评价方法总体设计相似,但也存在差异。我国2022年更新《保健食品功能检验与评价方法》后,认可的保健功能虽减少至24种,但为所有功能类别提供了具体评价方法,如动物实验造模、人体研究志愿者招募、给药、观察指标检测和统计分析等步骤的操作流程和细则。而日本的FOSHU评价指南以“总-分”形式构成,首先以较大篇幅说明了通用的评价方法和规范,后扩展说明了7种功能的人体试食试验流程(未包含促进矿物质吸收、改善牙齿健康和补充皮肤水分3类)。就详细程度而言,我国评价指南更为详细和具体。但日本指南也多有可借鉴之处,例如:①当人体研究已获得了关于活性成分的作用、作用机制和处置的证据时,允许在附相关数据后,省略动物体外和体内研究;②人体试验中的食用时间有特定要求,如目标食用方法为早餐,则不认可在其他时间服用样品的研究证据;③未做固定例数的样本量要求,而是基于主要结局指标和分层分析计划,要求确保样本量可满足统计显著性需求,更符合临床试验的科学原则;④对统计方法的透明性要求更严格,需事前明确统计分析计划,包括异常值和缺失值处理标准;不进行未计划的亚组分析、敏感性分析等额外分析,避免选择性报告阳性结果或隐瞒阴性结果;⑤对条件限制型FOSHU,允许通过安慰剂对照的非随机研究提供证据,要求匹配重要的基线特征。此外,日本指南虽未对所有功能提供详尽研究方法,但要求研究者将产品研究相关成果发表于影响力高的期刊杂志上,也可间接促使申请人根据产品研发目的开展严谨研究,获得足够科学的证据。
3.4 标签管理的比较
两国的保健食品均有独特的产品标志。中国为蓝帽子标识,下方标注国食健注开头的批准文号;日本为K字形的人型标志(图3),象征日语健康(kenkou)[35]。两国标签管理显著不同的是:我国在确认产品有认可范围内的保健功能、且通过审批后即授予蓝帽子标识,若未通过则不予授予;而日本FOSHU在审批过程中,产品若未被明确认定具有某种保健功效,消费者厅仍许可其以条件限制型FOSHU种类上市,并将标志替换为条件限制型FOSHU专有标志。我国的严格规定虽保证了保健食品在功能上的确定性,但同时也限制了保健食品功能的多样性。日本一般FOSHU可声称的保健功能种类(10种)虽不如我国丰富(24种),但条件限制型FOSHU种类和功能繁多,可满足更多人群的需求、大幅促进市场发展。
3.5 安全监管的比较
针对食品安全,中日两国均由多级别多部门监管,且设立食品安全委员会,外由非政府组织及消费者进行监督食品安全。我国主要在注册审批阶段控制保健食品的安全性,如要求提交产品对人体无任何急性、亚急性或慢性危害的毒理学报告。而日本提出功能性食品概念虽早,但屡历重大食品安全事件(如森永牛奶砒霜中毒事件、米糠油症事件等)[36],因此针对FOSHU的食品安全制定了完善的监管措施,包括安全性评价、标签和宣传语的规范、生产和销售的规范及监督和检查等相应措施。在生产销售环节,日本建立了一套食品安全追溯系统,包括原料来源、生产过程、质量检测等信息的记录和管理[37]。若发生安全性事件,可通过收集生产、加工、运输及销售等各环节信息,确定事件原因和溯源,同时撤回产品、及时通知消费者并采取相关措施[38]。
4 结语
日本FOSHU起步较早,其管理制度在全球保健食品行业内处于领先位置。从中日两国保健食品分类、审批、功能评价、标签管理和安全监管的比较结果来看,借鉴日本的管理方法和经验有助于完善我国保健食品管理。从产品分类角度,我国可进一步细分保健食品类别,拓展功能覆盖范围,例如为基于传统中医食药两用物质的食疗产品设立单独子类,便于其声称中医功效,以突出我国本土保健食品特色;同时为不同子类设计辨识度高的标识,并提出匹配子类特点的标签内容要求。审批流程上,可增加对功效和安全性证据公开发表的要求,更有利于提高结果真实性和便于公众监督。评价方法上,可参考日本事先明确统计分析计划的要求,提高研究过程的透明性,避免选择性报告。安全监管上,完善产品质量问题投诉机制和溯源体系,避免虚假宣传、仿冒产品和诱导购买等违法行为损害行业形象。保健食品的生命力源于其功效和安全性,而健全规范、合理并且符合我国国情的管理制度,才能够保证保健食品能够被科学有效地使用,维持该行业健康持续发展。
[1] 田明, 王玉伟, 冯军, 等.我国功能性食品与保健食品的比较研究[J].食品科学, 2023, 44(15):390-396.
TIAN M, WANG Y W, FENG J, et al.Comparative studies on functional foods and health foods in China[J].Food Science, 2023, 44(15):390-396.
[2] 杜鹏, 李龙.新时代中国人口老龄化长期趋势预测[J].中国人民大学学报, 2021, 35(1):96-109.
DU P, LI L.Long-term trends projection of China’s population aging in the new era[J].Journal of Renmin University of China, 2021, 35(1):96-109.
[3] 邓颖峰. 保健食品广告监管:问题、原因及改善策略研究:以“权健事件” 监管为例[D].广州:暨南大学, 2021.
DENG Y F.The research on the causes and improvement strategies of advertisement supervision of healthy food[D].Guangzhou:Jinan University, 2021.
[4] DOM NGUEZ D
NGUEZ D AZ L, FERN
AZ L, FERN NDEZ-RUIZ V, C
NDEZ-RUIZ V, C MARA M.An international regulatory review of food health-related claims in functional food products labeling[J].Journal of Functional Foods, 2020, 68:103896.
MARA M.An international regulatory review of food health-related claims in functional food products labeling[J].Journal of Functional Foods, 2020, 68:103896.
[5] 赵立春, 廖夏云.保健食品的研发与应用[M].成都:四川大学出版社, 2018.
ZHAO L C, LIAO X Y.Research and Application of Health Food [M].Chengdu:Sichuan University Press, 2018.
[6] 国家市场监督管理总局. 关于公开征求《允许保健食品声称的保健功能目录 非营养素补充剂(2020年版)(征求意见稿)》意见的公告[Z/OL].2020.https://www.samr.gov.cn/hd/zjdc/202011/t20201124_323851.html.
[7] 国家市场监督管理总局. 市场监管总局关于公开征求《关于发布允许保健食品声称的保健功能目录 非营养素补充剂(2022年版)及配套文件的公告(征求意见稿)》意见的公告[Z/OL].2022.https://www.samr.gov.cn/hd/zjdc/202201/t20220113_339092.html.
[8] 李玉衡. 《保健食品标识管理规定》之详解:本刊记者专访北京市药品监督管理局保健品化妆品技术审评中心主任刘东红[J].首都医药, 2008, 15(1):51-52.
LI Y H.Detailed explanation of “Regulations on the Management of Health Food Labeling” —Interview with LIU Donghong, Director of Health Products Cosmetics Technical Evaluation Center of Beijing Drug Administration[J].Capital Medicine, 2008, 15(1):51-52.
[9] 徐兴利, 黄家伟.特医食品标识指南来了![J].食品界, 2023(2):16-18.
XU X L, HUANG J W.The special medicine food labeling guide is coming![J].Food Industry, 2023(2):16-18.
[10] 全国人民代表大会常务委员会. 中华人民共和国食品安全法[Z/OL].2015.https://flk.npc.gov.cn/detail2.html?ZmY4MDgxODE3YWIyMmUwYzAxN2FiZDhkODVhMjA1ZjE
[11] 中华人民共和国国务院新闻办公室. 保健食品管理办法[Z/OL].2014.http://www.scio.gov.cn/m/ztk/xwfb/2014/gxbjhcjxfscyhhbzdqkfbh/xgzc30323/Document/1361361/1361361.htm
[12] 医药·健康·营养研究所.保健食品的安全性和有效性信息[Z/OL].2023 https://hfnet.nibiohn.go.jp/specific-health-food/
[13] SHIMIZU T.Health claims on functional foods:The Japanese regulations and an international comparison[J].Nutrition Research Reviews, 2003, 16(2):241-252.
[14] 日本消费者厅. 保健機能食品について[Z/OL].2023.https://www.caa.go.jp/policies/policy/food_labeling/foods_with_nutrient_function_claims/
Consumer Affairs Agency of Japan.About Food with Health Claims [Z/OL].2023.https://www.caa.go.jp/policies/policy/food_labeling/foods_with_nutrient_function_claims/
[15] OHAMA H, IKEDA H, MORIYAMA H.Health foods and foods with health claims in Japan[J].Toxicology, 2006, 221(1):95-111.
[16] PATEL D, DUFOUR Y, DOMIGAN N.Functional food and nutraceutical registration processes in Japan and China:A diffusion of innovation perspective[J].Journal of Pharmacy &Pharmaceutical Sciences:a Publication of the Canadian Society for Pharmaceutical Sciences, Societe Canadienne Des Sciences Pharmaceutiques, 2008, 11(4):1-11.
[17] 斎藤衛郎. 特定保健用食品の役割[J].Yakugaku Zasshi, 2007, 127(3):407-416.
Shiro S.Roles of food for specified health uses [J].Yakugaku Zasshi, 2007, 127(3):407-416.
[18] YAMADA K, SATO-MITO N, NAGATA J, et al.Health claim evidence requirements in Japan[J].The Journal of Nutrition, 2008, 138(6):1192S-1198S.
[19] 日本消費者庁. 特定保健用食品の申請手続について[Z/OL].2023.https://www.mhlw.go.jp/topics/bukyoku/iyaku/syoku-anzen/hokenkinou/tetuduki.html
Consumer Affairs Agency of Japan.Application procedures for food for specified health uses [Z/OL].2023.https://www.mhlw.go.jp/topics/bukyoku/iyaku/syoku-anzen/hokenkinou/tetuduki.html
[20] 日本消費者庁. 特定保健用食品申請に係る申請書作成上の留意事項[Z/OL].2023.https://www.caa.go.jp/policies/policy/food_labeling/foods_for_specified_health_uses/notice/assets/food_labeling_cms201_220831_03.pdf
Consumer Affairs Agency of Japan.Instructions for preparing application forms for purposes of food for specified health uses [Z/OL].2023.https://www.caa.go.jp/policies/policy/food_labeling/foods_for_specified_health_uses/notice/assets/food_labeling_cms201_220831_03.pdf
[21] 日本消費者庁. 特定保健用食品とは[Z/OL].2023.https://www.caa.go.jp/policies/policy/food_labeling/health_promotion/pdf/food_labeling_cms206_200602_01.pdf
Consumer Affairs Agency of Japan.What is food for specified health uses [Z/OL].2023.https://www.caa.go.jp/policies/policy/food_labeling/health_promotion/pdf/food_labeling_cms206_200602_01.pdf
[22] 日本消費者庁. 特定保健用食品の表示許可等について[Z/OL].2011.https://www.caa.go.jp/notice/assets/food_labeling_cms206_230623_02.pdf.
Consumer Affairs Agency of Japan.The labeling and licensing system for food for specified health uses [Z/OL].2011 https://www.caa.go.jp/policies/policy/food_labeling/health_promotion/pdf/food_labeling_cms206_200602_01.pdf
[23] 田明, 张孜仪, 赵静波, 等.日本保健功能食品的管理及对我国的启示[J].中国食品卫生杂志, 2019, 31(3):240-245.
TIAN M, ZHANG Z Y, ZHAO J B, et al.Research on health functional food in Japan and its enlightenment to China[J].Chinese Journal of Food Hygiene, 2019, 31(3):240-245.
[24] 日本法令検索. 食品安全基本法[Z/OL].2021.https://elaws.e-gov.go.jp/document?lawid=415AC0000000048
Consumer Affairs Agency of Japan.Food Safety Basic Laws [Z/OL].2021.https://elaws.e-gov.go.jp/document?lawid=415AC0000000048
[25] 日本消費者庁. 食品の安全を守る仕組み[Z/OL].2023.https://www.caa.go.jp/policies/policy/consumer_safety/food_safety/food_safety_portal/safety_system/
Consumer Affairs Agency of Japan.Food safety protection mechanism [Z/OL].2023.https://www.caa.go.jp/policies/policy/consumer_safety/food_safety/food_safety_portal/safety_system/
[26] 日本消費者庁. 安全や衛生に関する表示の制度について[Z/OL].2023.https://www.caa.go.jp/policies/policy/food_labeling/food_sanitation/
Consumer Affairs Agency of Japan.System of safety and hygiene labeling [Z/OL].2023.https://www.caa.go.jp/policies/policy/food_labeling/food_sanitation/
[27] 日本厚生労働省. 「健康食品」の安全性の確保[Z/OL].2023.https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/shokuhin/hokenkinou/index.html
Consumer Affairs Agency of Japan.Ensuring the safety of health foods [Z/OL].2023.https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/shokuhin/hokenkinou/index.html
[28] ADEFEGHA S A.Functional foods and nutraceuticals as dietary intervention in chronic diseases;novel perspectives for health promotion and disease prevention[J].Journal of Dietary Supplements, 2018, 15(6):977-1009.
[29] 日本厚生労働省. 保健食品等の承認審査に係る公表制度について[Z/OL].2019.https://www.mhlw.go.jp/stf/newpage_14998.html
Consumer Affairs Agency of Japan.Disclosure system for the approval review of health foods and related products [Z/OL].2019.https://www.mhlw.go.jp/stf/newpage_14998.html
[30] 国家市场监督管理总局. 食品复检机构查询[Z/OL].2023.https://www.samr.gov.cn/rkjcs/
[31] MARTIROSYAN D, ADANY A, KANYA H.Japan’s health food industry:An analysis of the efficacy of the FOSHU system[J].Bioactive Compounds in Health and Disease, 2021, 4(4):63.
[32] WARFEL K, ASO Y, GEE D L.Regulation of functional foods in Japan:Foods for specialized health uses (FOSHU)[J].Journal of the American Dietetic Association, 2007, 107(8):A34.
[33] 李昂. 我国保健食品监管法律制度研究[D].太原:山西财经大学, 2020.
LI A.Research on the legal system of functional food supervision in china[D].Taiyuan:Shanxi University of Finance &Economics, 2020.
[34] 冯军, 徐乃莹, 田明, 等.新时代我国加强食品安全工作及推进对策[J].中国发展观察, 2023(1):99-104.
FENG J, XU N Y, TIAN M, et al.Strengthening food safety work and promoting countermeasures in China in the new era[J].China Development Observation, 2023(1):99-104.
[35] 山田和彦, 田中弘之, 石見佳子, 等.保健機能食品の課題と展望[J].日本栄養·食糧学会誌,2017, 70(3):91-99.
YAMADA K, TANAKA H, ISHIMI Y, et al.Issues and prospects of health function food[J].Journal of the Japan Society of Nutrition and Food Science, 2017, 70(3):91-99.
[36] 卢凌霄, 徐昕.日本的食品安全监管体系对中国的借鉴[J].世界农业, 2012(10):4-7.
LU L X, XU X.Reference of Japanese food safety supervision system to China[J].World Agriculture, 2012(10):4-7.
[37] CHIBA T.Information system on the safety and effectiveness of health foods and recent topics[J].Yakugaku Zasshi:Journal of the Pharmaceutical Society of Japan, 2018, 138(12):1517-1521.
[38] 周素娟, 徐琨, 王献仁.日本特定保健用食品与我国保健食品管理的异同[J].中国卫生监督杂志, 2007, 14(2):103-105.
ZHOU S J, XU K, WANG X R.Comparative study on health food management in Japan and China[J].Chinese Journal of Health Inspection, 2007, 14(2):103-105.