麸曲以麸皮为主要原料,是白酒生产的主要发酵剂之一,工业上可运用麸曲进行微生物扩培,积累特定的代谢产物[1]。目前对麸曲的研究大多集中在制作工艺、理化特性及发酵性能的优化。郑自强等[2]使用产纤维素酶的枯草芽孢杆菌(Bacillus subtilis)制作麸曲,通过响应面法优化制曲工艺,制得具有多种纤维素酶活性的细菌麸曲。武顺等[3]对麸曲制作工艺进行优化后麸曲的四甲基吡嗪含量显著增加。郭凯凯等[4]将高产酯酿酒酵母运用于清香型麸曲酒生产中,提高了乙酸乙酯和总酯含量,提升了白酒品质。麸曲中富含大量功能性微生物,将其运用于白酒酿造过程中,可为酒体带来多种风味物质,赋予白酒独特的风格[5-6]。
清香型白酒作为我国四大香型白酒之一,具有柔和、绵甜、清爽、纯净的风格特征,拥有独特的花果香味。酯类物质作为白酒中易挥发性化合物,多呈现果香、花香,在香气协调及提升白酒口感等方面具有重要作用[7-9]。其中,乙酸乙酯是清香型白酒的特征香气成分,具有花果香气,其含量的高低决定着清香型白酒的质量等级。清香型白酒中的乙酸乙酯主要由生香酵母和酶催化形成[10]。酵母作为酿酒过程中最常见的功能微生物,在白酒风味形成过程中起着重要作用[11]。异常威克汉姆酵母(Wickerhamomyces anomalus)是一种非酿酒酵母,广泛存在于葡萄、桑葚、柑橘等水果表面,且可从谷物、传统酒曲中分离得到,已有研究发现将其运用于白酒酿造可增加基酒的乙酸乙酯含量,显著提升酒体感官品质[12-13]。
酵母的生长情况与培养条件密切相关,如发酵培养基、培养时间、培养温度、水料比、接种量等均会影响其生长,且白酒生产中微生物的生长发酵情况直接影响成品酒的质量和产量。因此,研究酵母培养条件对酵母生长的影响,可为酵母在白酒酿造生产中的应用提供重要的理论依据。本文以麸曲中W. anomalus活菌数为检测指标,结合单因素试验与响应面法试验对酵母麸曲制作工艺进行优化,得到的酵母麸曲应用于模拟固态发酵白酒酿造中,通过气相色谱法测定各种白酒的挥发性成分,对结果进行偏最小二乘判别分析(partial least-squares discrimination analysis,PLS-DA),以期提升白酒的香气和品质,为白酒的工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
W. anomalus(ICAB10259),中国食品发酵工业研究院有限公司。
酵母膏胨葡萄糖培养基(yeast peptone dextrose medium,YPD液体培养基)(g/L):酵母浸粉10、蛋白胨20、葡萄糖20,北京奥博星生物技术有限责任公司。无水乙醇、浓硫酸、NaOH等(均为分析纯),天津市福晨化学试剂厂;正丙醇标准品(色谱纯),美国Sigma-Aldrich公司;0.9%无菌生理盐水,山东齐都药业有限公司;麸皮,市售;大曲,山西某酒企提供。
1.2 仪器与设备
1300系列II级A2型生物安全柜,美国Thermo Fisher Scientific公司;LDZX-50L-I立式高压蒸汽灭菌器,上海申安医疗器械厂;LRH-250生化培养箱,上海一恒科技仪器有限公司;DJS-D2016R叠加恒温培养振荡器,上海世平实验设备有限公司;AutoSystem XL气相色谱仪、CP-Wax 57CB毛细管色谱柱(50 m×0.25 mm×0.2 μm),美国Perkin Elmer公司。
1.3 酵母种子液制备
将YPD液体培养基装于250 mL的摇瓶中,灭菌(115 ℃、20 min);接入1%的W. anomalus,置于30 ℃恒温培养箱中培养12 h。
1.4 酵母培养条件的优化——单因素试验
使用酵母麸曲为原料,研究不同培养时间、培养温度、水料比、酵母接种量条件下酵母的最佳生长量。
1.4.1 培养时间对酵母生长量的影响
将10%种子液(体积质量比)接种于水料比(质量分数)为1∶1的酵母麸曲原料中,充分搅拌均匀,用4层纱布封盖,保证足够的通氧量。将接种好的酵母麸曲放置于25 ℃恒温培养箱中,分别培养12、24、36、48、60、72、84、96 h。
1.4.2 培养温度对酵母生长量的影响
将10%种子液(体积质量比)接种于水料比(质量分数)为1∶1的酵母麸曲原料中,同时保证足够的通氧量,分别置于18、24、30、36、42 ℃的培养箱中,培养36 h。
1.4.3 水料比对酵母生长量的影响
将10%种子液(体积质量比)接种于水料比(质量分数)分别为0.5∶1、0.6∶1、1.0∶1、1.25∶1和1.5∶1的酵母麸曲原料中,置于25 ℃培养箱中培养36 h。
1.4.4 酵母接种量对酵母生长量的影响
分别将5%、7.5%、10%、12.5%、15%种子液(体积质量比)接种于水料比(质量分数)为1∶1的酵母麸曲原料中,置于25 ℃培养箱中培养36 h。
1.5 酵母培养条件的优化——响应面法试验设计
在单因素试验的基础上,选取时间(A)、温度(B)、水料比(C)3个因素为自变量,以试验中酵母活菌数(Y)为响应值,进行响应面分析法试验,试验设计见表1。
表1 响应面试验因素与水平
Table 1 Factors and levels in the response surface test

水平因素A(时间)/hB(温度)/℃C(水料比)-124240.6∶1036301.0∶1148361.25∶1
1.6 酵母活菌计数方法
准确称取10 g样品,置入装有90 mL无菌生理盐水的250 mL三角瓶中,振荡均匀,在30 ℃条件下放置30 min,再取1 mL加入无菌水9 mL,以此类推,根据实际情况逐级稀释,一般稀释至10-4~10-6。取100 μL稀释液在YPD培养基上进行涂布,在30 ℃恒温恒湿培养箱培养24~36 h,进行菌落数的计算[14]。
1.7 发酵工艺
实验室模拟清香型白酒固态发酵方法,其中不同实验组分别添加大曲麸曲比例为1∶0、1∶0.5、1∶1、1∶2、0∶1的曲粉,与前期研究使用相同生产工艺进行白酒的酿造[15]。
1.8 酒体香气成分检测
采用气相色谱法对酒体中挥发性风味物质进行检测。使用气相色谱仪检测蒸馏酒样品中的正丙醇,采用外标法对正丙醇进行定量分析,检测条件如下:
柱温程序:初始温度30 ℃,保持5 min,以5 ℃/min升至60 ℃,再以6 ℃/min升至120 ℃,保持5 min后以8 ℃/min程序升温至210 ℃,保持5 min。载气为N2,流速为1 mL/min,分流比为10∶1;H2流速为45 mL/min;空气流速为450 mL/min;检测器和进样器温度分别为260、240 ℃;进样量为1 μL。
1.9 数据分析
使用IBM SPSS 26.0对数据进行统计分析,使用Origin 2021进行作图;使用Design Expert 8.0.6进行回归拟合及方差分析;使用SIMCA 14.1进行PLS-DA,计算预测自变量投影重要性指标(variable importance in projection,VIP);用平均值±标准偏差来表示实验结果,检验的显著性水平P<0.05。
2 结果与分析
2.1 单因素试验结果
麸皮富含淀粉、维生素及无机盐等营养成分,且结构疏松多孔,有利于麸曲中酵母的生长代谢和通氧散热等。酵母麸曲的工艺控制条件主要包括培养时间、培养温度、水分添加量、通氧量等。本试验通过分别控制酵母麸曲的培养时间、培养温度、水料比与酵母接种量,探究酵母麸曲的最佳培养条件。
控制酵母麸曲的培养时间,探究其对酵母生长量的影响,结果如图1-a所示。在培养时间小于36 h时,随着培养时间的增加,麸曲中酵母数量显著上升,在36 h时达到最大值(5.80×109 CFU/g);随着培养时间继续延长,酵母的活菌数发生显著减少,在96 h时达到最低值(1.33×109CFU/g),甚至小于培养时间为12 h时的活菌数。因此,培养时间约控制在36 h。
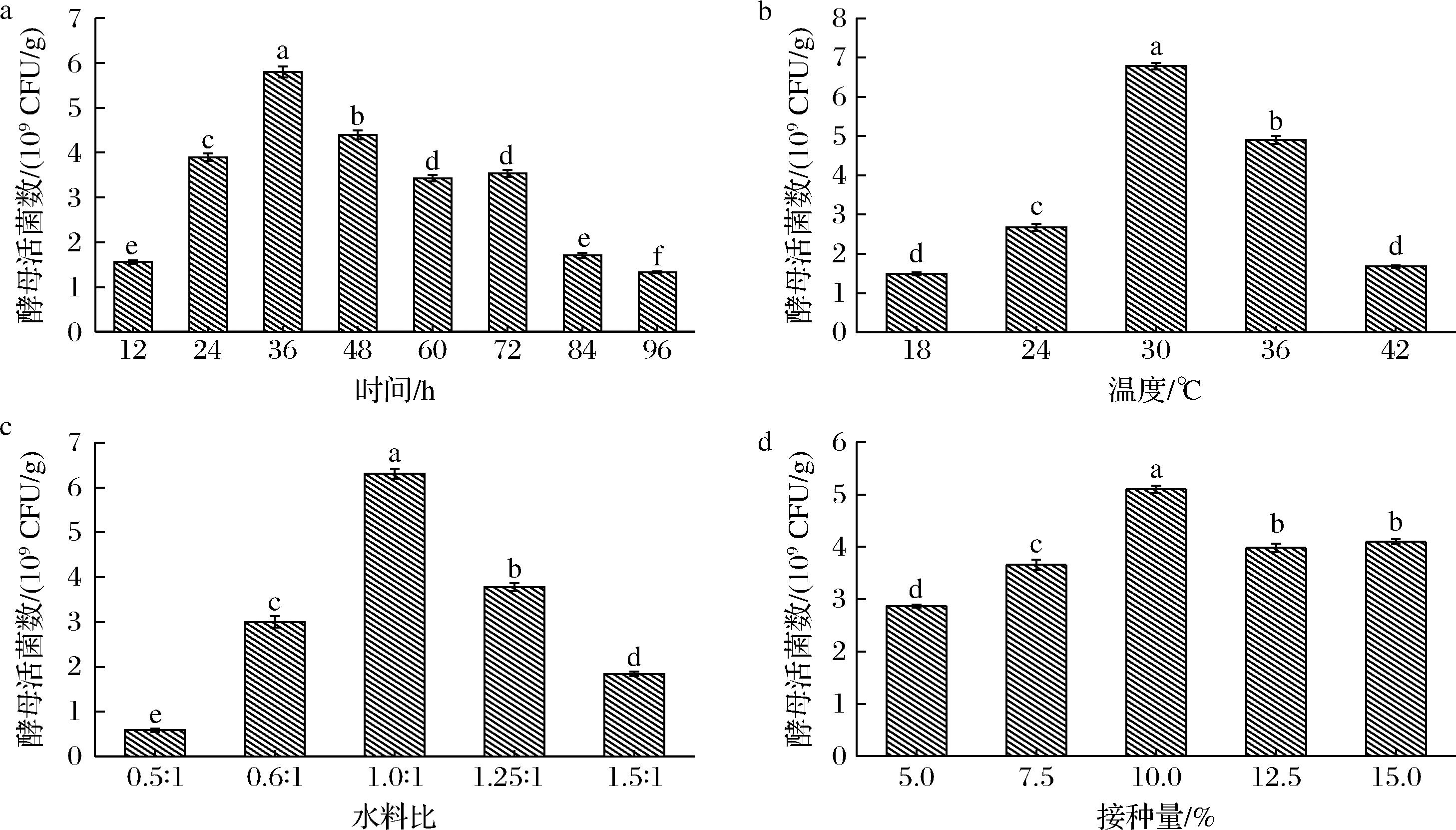
a-培养时间;b-培养温度;c-水料比;d-酵母接种量
图1 培养条件对酵母活菌数的影响
Fig.1 Effect of culture conditions on viable count of yeast
注:相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。
温度是曲药培菌的一大重要指标,对酵母的生长情况具有显著影响。培养温度对酵母活菌数的影响如图1-b所示。随温度的升高,酵母活菌数呈先上升后下降的趋势,其中在24~36 ℃之间生长量显著提高,在30 ℃时活菌数达到最大值6.78×109 CFU/g。在酵母培养过程中,随着温度的上升,逐渐接近酵母的最适生长温度,酵母生长旺盛,活菌数提高;但随着温度继续升高,高于酵母的最适生长温度,酵母的生长又受到抑制,活菌数随之下降。因此,培养温度约选在30 ℃。
控制酵母麸曲的水料比试验结果如图1-c所示,在一定范围内酵母活菌数随着水分添加量的增大而明显上升,当水料比为1.0∶1时,活菌数达到峰值(6.31×109 CFU/g),超过水料比为0.5∶1时的10倍。然而,当水分添加量持续上升,酵母的生长量又发生了明显的下降。微生物的生长繁殖离不开水分,但水分过多则会使底物结团,不利于疏松通气,进而抑制酵母的生长。因此,约选择1.0∶1的水料比更适合酵母的生长。
由图1-d可知,酵母活菌数随着酵母接种量的增加呈先上升后下降的趋势,在接种量为10.0%时酵母生长量最大,此时活菌数达到5.10×109 CFU/g。适当的接种量可以加快菌株的生长繁殖;当接种量过小时,酵母增殖缓慢,导致最终活菌数较低;而接种量过高,菌体前期生长过快,菌体密度过高,营养供给不足,也会使最终活菌数下降[16]。本研究中,当接种量>10%时,酵母的生长受到了抑制,因此,酵母的接种量约控制在10%。
2.2 响应面优化试验结果
2.2.1 响应面试验设计与结果及方差分析
根据响应面分析设计条件进行实验,测定不同培养条件下酵母活菌数,试验设计与结果如表2所示。运用Design Expert 8.0.6软件进行二次多元回归拟合,得到回归方程:Y=-3 134.92+54.30A+160.96B+546.53C-0.72AB+0.71AC+8.46BC-0.44A2-2.26B2-370.89C2。
表2 Box-Behnken试验设计与结果
Table 2 Box-Behnken design with experimental results

序号A时间/hB温度/℃C水料比酵母活菌数/(109 CFU/g)136361.256.86236300.9257.04336241.255.67436300.9257.15524240.9254.57624301.256.27724360.9256.45836360.65.72936300.9257.121036240.65.191148360.9255.621236300.9257.041348240.9255.821424300.65.321548300.65.751636300.9256.981748301.256.81
由表3可知,模型的P小于0.000 1,说明回归模型具有极显著性,失拟项(P=0.104 6>0.05)不显著,变异系数为1.68%(<10%),说明非试验因素对结果影响不大,模型可用于试验拟合。模型相关系数R2为0.992 6,说明该模型与实际试验拟合较好。校正后的决定系数![]() 为0.983 2,与R2接近,说明模型有充分的准确性和通用性。因此,可用此模型来分析和预测酵母麸曲培养中各因素对酵母菌落数的影响。
为0.983 2,与R2接近,说明模型有充分的准确性和通用性。因此,可用此模型来分析和预测酵母麸曲培养中各因素对酵母菌落数的影响。
表3 回归模型方差分析
Table 3 Variance analysis for the established regression model
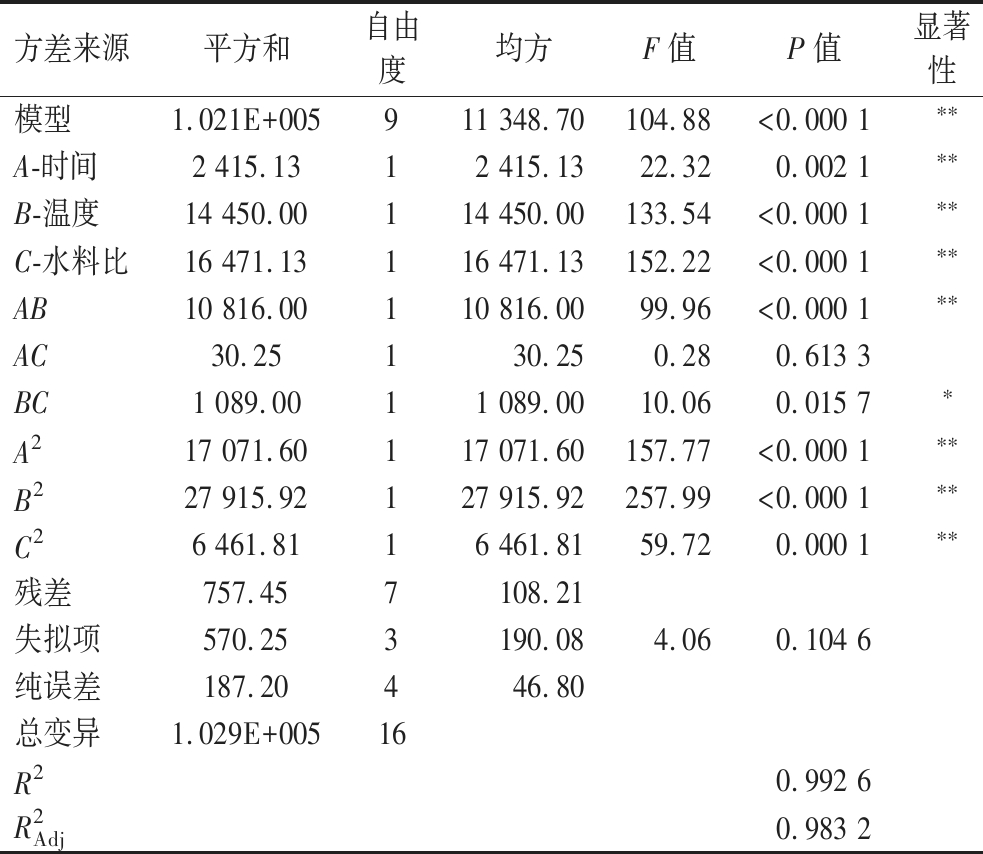
方差来源平方和自由度均方F值P值显著性模型1.021E+005911 348.70104.88<0.000 1∗∗A-时间2 415.1312 415.1322.320.002 1∗∗B-温度14 450.00114 450.00133.54<0.000 1∗∗C-水料比16 471.13116 471.13152.22<0.000 1∗∗AB10 816.00110 816.0099.96<0.000 1∗∗AC30.25130.250.280.613 3BC1 089.0011 089.0010.060.015 7∗A217 071.60117 071.60157.77<0.000 1∗∗B227 915.92127 915.92257.99<0.000 1∗∗C26 461.8116 461.8159.720.000 1∗∗残差757.457108.21失拟项570.253190.084.060.104 6纯误差187.20446.80总变异1.029E+00516R20.992 6R2Adj0.983 2
注:P<0.01、**表示差异极显著(P<0.05)、*表示差异显著。
2.2.2 Box-Behnken响应面分析交互作用
依据回归方程式绘制响应面图及等高线图,由图2~图4可知,培养时间与温度的交互作用对酵母活菌数影响最大,温度和水料比的交互作用对酵母活菌数影响次之,时间和水料比的交互作用对酵母活菌数影响不显著。
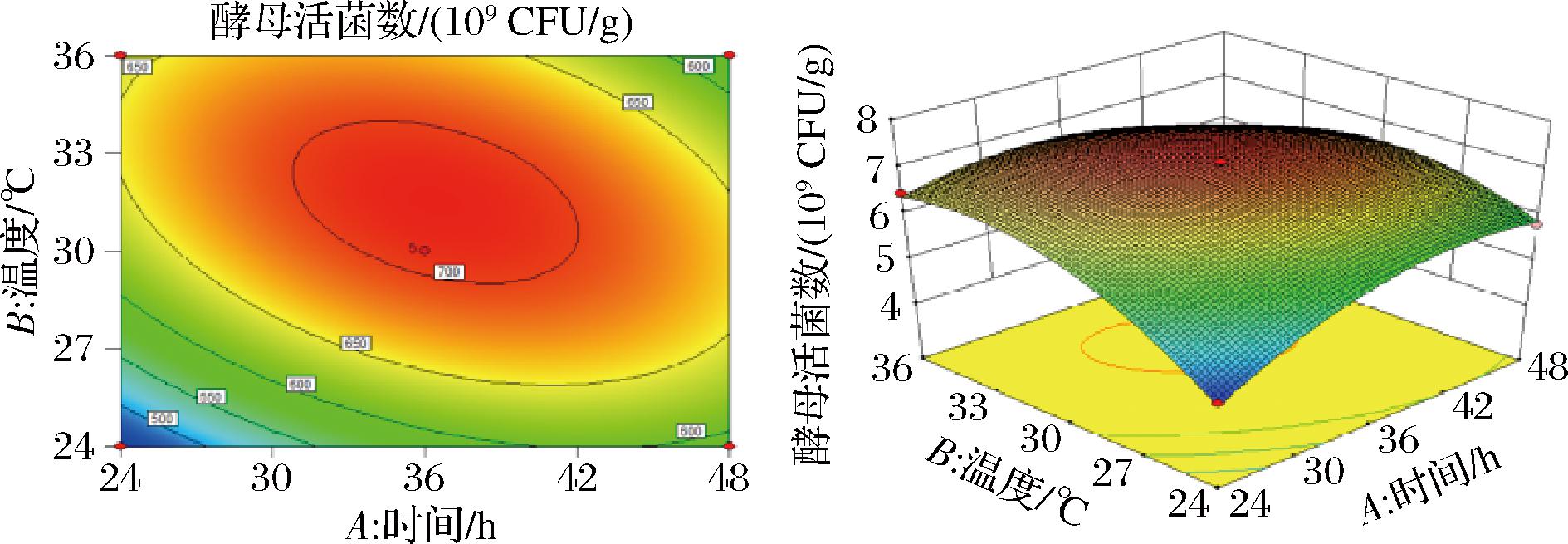
图2 时间与温度对酵母活菌数的交互作用
Fig.2 Interaction between time and temperature on viable count of yeast
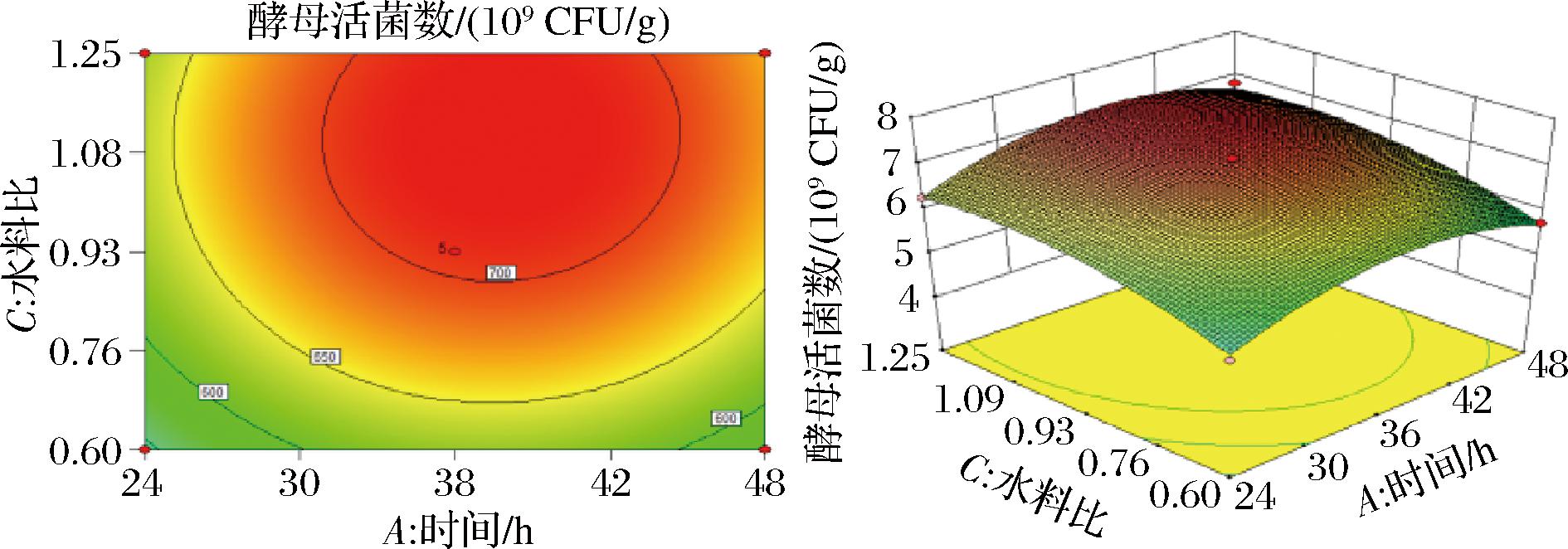
图3 时间与水料比对酵母活菌数的交互作用
Fig.3 Interaction between time and water-to-material ratio on viable count of yeast
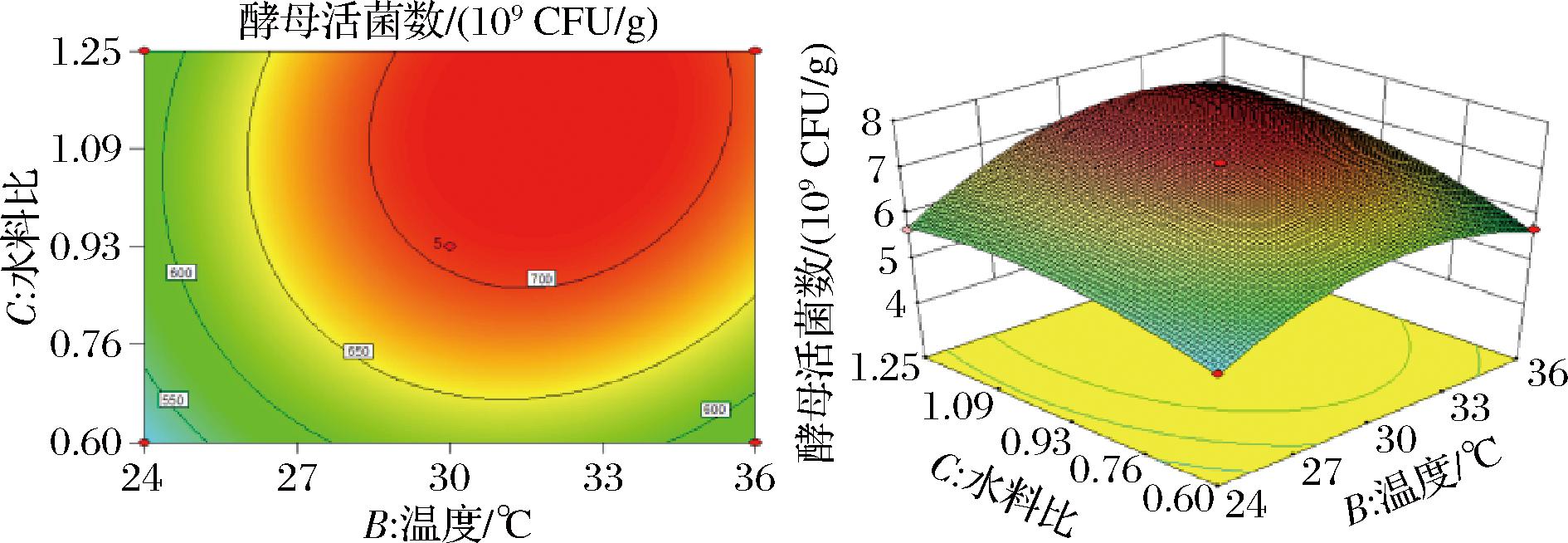
图4 温度与水料比对酵母活菌数的交互作用
Fig.4 Interaction between temperature and water-to-material ratio on viable count of yeast
2.2.3 最优培养条件验证
通过模型预测酵母麸曲的最优培养条件为培养时间37.74 h、培养温度31.83 ℃、水料比1.13∶1,此时酵母活菌数的预测值为7.27×109 CFU/g。考虑到实际情况对上述条件进行调整,最终的优化条件为培养时间38 h、培养温度32 ℃、水料比1.10∶1,进行3次重复试验,酵母活菌数为(7.25±0.04)×109 CFU/g,与理论预测值较接近,说明用该模型对酵母麸曲的培养条件进行优化具有实际应用价值。
2.3 酵母麸曲应用于白酒酿酒试验
2.3.1 酒体香气成分分析
将培养条件优化后的酵母麸曲按一定比例应用于白酒工艺中,运用气相色谱法对5种蒸馏后酒液的香气化合物成分及相对含量进行分析鉴定,结果如表4所示。在使用5种不同大曲麸曲比例制成的白酒中共检测到47种共有香气成分,其中酯类化合物22种、醇类化合物15种、醛类化合物6种、酮类化合物2种和杂环类化合物2种。
表4 不同大曲麸曲比例酿造白酒的香气成分分析
Table 4 Analysis of the aroma components in Baijiu produced with different proportion of Daqu and Fuqu

化合物香气阈值/(μg/L)质量浓度/(mg/L)1∶01∶0.51∶11∶20∶1酯类甲酸乙酯19 800.001.43±0.22b0.53±0.26c0.62±0.47c1.50±0.21b2.42±0.35a乙酸乙酯32 551.60206.56±37.50e390.75±7.10d627.01±13.55c822.84±34.54b1 346.90±50.39a丁酸乙酯81.500.11±0.09b0.28±0.49ab0.17±0.15b0.10±0.05b0.79±0.23a异戊酸乙酯6.890.13±0.10b0.74±0.26a0.42±0.34ab0.08±0.07b0.11±0.06b乙酸正丁酯\0±00.37±0.340.04±0.060.30±0.530±0乙酸异戊酯93.904.31±4.011.81±1.550.54±0.330.30±0.060.33±0.02戊酸乙酯26.780.14±0.140.72±0.560.77±0.770.28±0.070.31±0.02己酸乙酯55.330.34±0.04d330.14±19.60c414.21±30.52b513.55±21.01a333.77±49.10c庚酸乙酯13 153.170.13±0.15b0.40±0.22b0.13±0.11b0.52±0.74b1.64±0.34a乳酸乙酯128 083.806.40±10.230.15±0.070.36±0.270.14±0.150.21±0.10己酸丁酯678.000.07±0.04ab0.21±0.08a0.13±0.12ab0.11±0.11ab0.02±0.02b己酸异戊酯2 700.000.14±0.06ab0.28±0.15ab0.34±0.33ab0.08±0.07b0.49±0.11a癸酸乙酯1 122.300.8±0.28b0.24±0.23b2.19±1.15a0.44±0.18b1.05±0.55ab丁二酸二乙酯353 193.251.54±0.750.45±0.381.75±0.320.98±1.101.66±0.13月桂酸乙酯400.001.64±1.411.18±1.560.13±0.150.43±0.670.74±0.11苯乙酸乙酯406.000.49±0.732.18±0.700.67±1.161.62±2.764.27±3.75乙酸苯乙酯908.002.80±0.6410.15±9.184.14±1.955.76±2.683.70±3.16十四酸乙酯180.007.08±7.713.32±3.840.74±0.670.59±0.761.27±0.24棕榈酸乙酯4 500.003.19±2.28ab2.36±2.23ab0.67±0.51b0.45±0.24b4.87±1.66a硬脂酸乙酯\0.26±0.265.95±7.380.28±0.310.34±0.230.28±0.02油酸乙酯3 500.000.62±0.25ab0.33±0.02b0.57±0.48ab0.87±0.15a1.09±0.07a亚油酸乙酯4 000.000.96±0.090.50±0.441.14±0.881.14±0.990.39±0.28醇类甲醇90 000.0088.01±9.62a76.96±11.37a85.62±14.06a62.04±18.50a29.37±17.75b叔戊醇\0±00.14±0.190.02±0.030.01±0.030±0仲丁醇50 000.000.03±0.02b0.42±0.40b0.11±0.08b0.36±0.51b64.75±19.74a正丙醇53 952.63165.15±9.26a131.28±1.62b74.16±8.52c59.18±7.81d37.65±7.18e异丁醇28 300.00501.64±40.36a379.82±16.73b333.80±28.26b249.44±29.27c199.26±11.53c2-戊醇25 500.000.21±0.060.29±0.400.15±0.070.08±0.070.06±0.04正丁醇2 733.3513.26±3.84a0.10±0.06c0.17±0.07c1.74±2.73c6.41±1.45b2-甲基丁醇18 000.00385.21±24.99a327.27±30.26a238.62±47.61b174.71±46.69bc149.38±44.86c异戊醇179 190.83631.88±4.65a432.25±35.87b393.67±26.68b288.56±13.04c181.94±15.58d正戊醇64 000.000.27±0.37b2.81±2.49a0.42±0.55ab0.27±0.26b0.63±0.11ab正己醇5 370.000.27±0.160.7±0.560.46±0.270.09±0.090.48±0.213-丁二醇(左消旋)\0.19±0.120.17±0.186.23±9.14.62±7.710.94±3.153-丁二醇(内消旋)\0.27±0.16b0.21±0.15b0.24±0.19b0.36±0.33b1.42±0.70a2丙二醇\0.33±0.37b0.52±0.39b0.41±0.38b0.51±0.36b1.64±0.26aβ-苯乙醇28 922.7310.72±8.8213.94±11.7115.2±13.089.10±8.3122.24±4.36醛类乙醛1 200.00358.26±34.83a119.78±16.86bc157.49±34.84b90.82±7.24c95.32±19.76c丙醛\0.43±0.30ab0.66±0.28a0.13±0.01b0.32±0.08ab0.47±0.09ab异丁醛\0.19±0.060.19±0.010.44±0.400.35±0.280.21±0.05乙缩醛2 090.00283.46±55.19a159.55±42.75b82.78±17.29cd92.35±15.02c21.32±9.77d糠醛44 029.730.29±0.28ab0.25±0.11ab0.65±0.83ab0.13±0.08b1.13±0.47a苯甲醛4 203.100.35±0.35b0.09±0.04b0.09±0.07b0.30±0.45b1.09±0.25a酮类丙酮\0.14±0.04c0.41±0.46bc0.13±0.04c1.54±1.27b3.05±0.52a3-羟基-2-丁酮36 000.008.39±12.19b0.07±0.03b0.12±0.07b1.48±1.28b33.46±5.66a杂环类三甲基吡嗪 729.860.19±0.090.21±0.230.07±0.040.20±0.270.06±0.05四甲基吡嗪80 073.160.26±0.170.06±0.080.22±0.140.20±0.210.25±0.01
注:表中1∶0、1∶0.5、1∶1、1∶2、0∶1分别表示酿造白酒所用曲粉中大曲麸曲比例。阈值参考文献[17-21],“\”表示未查阅到相关资料。相同字母表示样品间差异不显著(P>0.05),不同字母表示样品间差异显著(P<0.05),未标字母表示样品间无显著差异。
清香型白酒的主要香气成分是酯类及醛类物质,使其具有清甜的特点[22]。与大曲组(1∶0)相比,麸曲组(0∶1)中乙酸乙酯含量增加明显,麸曲组的含量是大曲组的6.52倍。乙酸乙酯为清香型白酒中主要的呈香物质,具有菠萝样香气,可协调其他物质带来的不良口感,并赋予白酒清香感[23]。同时,乙酸乙酯可增加白酒醇厚度,有效提升白酒品质。另外麸曲组的己酸乙酯的含量较大曲组也有显著的增加。己酸乙酯具有典型的水果香气,使酒体具有窖香感,也是白酒中的重要酯类化合物[24]。麸曲组中其他酯类如庚酸乙酯、油酸乙酯等含量较大曲组也有显著提升,这些酯类物质具有鲜花香气,也为白酒带来更丰富的风味[17, 22]。
麸曲组的甲醇及高级醇(正丙醇、异丁醇、异戊醇等)较大曲组有明显下降,其中正丙醇含量降低77.20%,异丁醇含量降低60.28%,异戊醇含量降低71.21%。高级醇是酒体中的重要成分,适量的高级醇可赋予酒体醇厚甘甜的风味[25]。但高级醇含量过高则会破坏酒体质量,使白酒具有苦味,且令人产生头痛恶心等上头现象,其含量的降低可有效减少白酒对人体健康的危害[26]。同时,麸曲组的3-羟基-2-丁酮含量有明显提升,是大曲组的3.99倍,这增强了白酒香气中的奶油味[17]。
2.3.2 挥发性物质差异分析
以47种共有香气组分作为因变量,不同大曲麸曲比例作为自变量,运用PLS-DA可有效区别不同大曲与麸曲比例酿造的5种白酒样品。如图5-a所示,添加麸曲酿造的白酒样本与仅使用大曲酿造的白酒在PLS-DA得分图上明显分开,添加麸曲酿造的白酒位置相近,位于左上角;而仅使用大曲酿造的白酒位于右下角。本次分析中的自变量拟合指数(R2x)为0.723,因变量拟合指数(R2y)为0.927,模型预测指数(Q2)为0.611,R2和Q2超过0.5表示模型拟合结果可接受,对于不同大曲麸曲比例酿造的白酒的预测率为61.1%[27]。
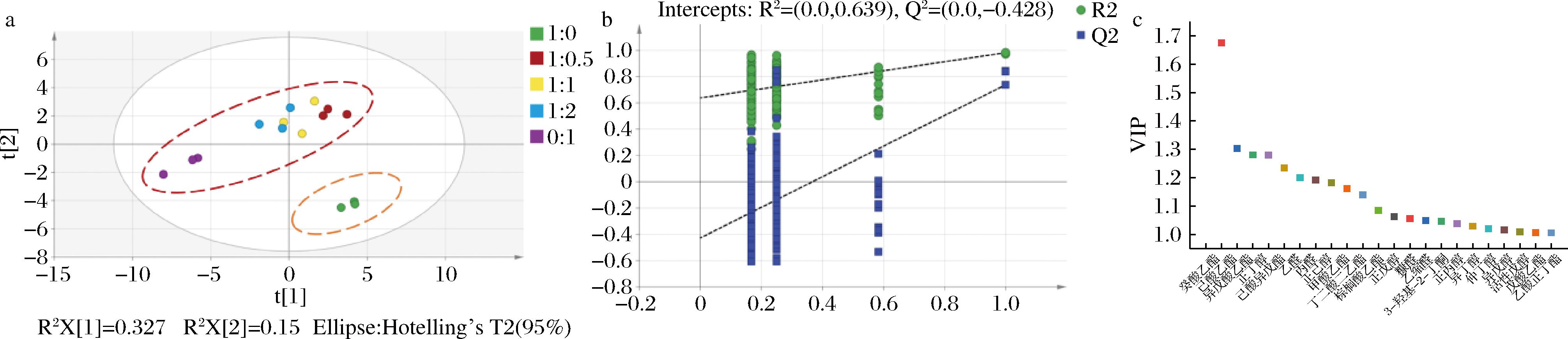
a-不同大曲麸曲比例所产白酒的PLS-DA得分图;b-置换检验试验图;c-22个合格标记化合物的VIP值图
图5 重要的标记化合物定性定量分析
Fig.5 Qualitative and quantitative analysis of important marked compounds
此外,本研究还进行了PLS-DA模型置换检验(n=200),以评估模型是否过度拟合数据。如图5-b所示,本实验置换检验的R2=0.639、Q2=-0.428,右侧的R2和Q2均高于左侧,且Q2与y轴相交于负半轴,说明该模型不存在过拟合现象,模型验证有效,认为该结果可用于白酒曲粉成分的鉴别分析。
同时通过计算VIP来确定作为潜在标记化合物的挥发性化合物(通常以VIP>1.0作为筛选标准)。确定了22种潜在的标记化合物,依照VIP值由高到低排序分别为癸酸乙酯、己酸乙酯、异戊酸乙酯、正丁醇、己酸异戊酯、乙醛、丙醛、正己醇、甲酸乙酯、丁二酸二乙酯、棕榈酸乙酯、正戊醇、糠醛、乙缩醛、正丙醇、3-羟基-2-丁酮、异丁醇、仲丁醇、异戊醇、活性戊醇、戊酸乙酯、乙酸正丁酯。其中,癸酸乙酯VIP最高(1.67),其余潜在标记化合物的VIP介于1.00~1.30(图5-c)。
3 结论
本研究将W. anomalus用于制作酵母麸曲,以麸曲的酵母活菌数为响应值,通过单因素试验和响应面法相结合对麸曲的培养条件进行优化,根据实际情况进行调整后得到最佳培养条件为:培养时间38 h、培养温度32 ℃、水料比1.10∶1、接种量10%。最佳培养条件下制得的麸曲酵母活菌数为(7.25±0.04)×109 CFU/g。将该条件下制得的酵母麸曲应用于模拟固态发酵白酒,由酵母麸曲制得的白酒产物的乙酸乙酯含量较大曲组有明显增加,是大曲组的6.52倍,表明该麸曲具有一定的产酯类物质的性能。偏最小二乘判别分析结果表明,添加麸曲酿造的白酒与仅使用大曲酿造的白酒的香气成分具有明显区别。后续可将该工艺制作的麸曲应用于工厂实际生产中,以期提高白酒的酯类物质含量,增加白酒香气成分,达到提升白酒品质的目标。
[1] 胡丽娟, 薛高尚, 卢向阳, 等.响应面法优化芽孢杆菌25-2产纤维素酶发酵条件[J].酿酒科技, 2012(4):21-26.
HU L J, XUE G S, LU X Y, et al.Optimization of fermentation conditions of Bacillus 25-2 for cellulase production by response surface methodology[J].Liquor-Making Science &Technology, 2012(4):21-26.
[2] 郑自强, 卫春会, 邓杰, 等.一株产纤维素酶枯草芽孢杆菌的麸曲制作及其产酶特性研究[J].食品与机械, 2021, 37(10):12-17.
ZHENG Z Q, WEI C H, DENG J, et al.Study on the production of Fuqu and the characteristics of enzyme about a cellulase producing Bacillus subtilis[J].Food &Machinery, 2021, 37(10):12-17.
[3] 武顺, 王德良, 闫寅卓.产吡嗪类细菌的麸曲制作工艺优化[J].中国酿造, 2016, 35(2):13-17.
WU S, WANG D L, YAN Y Z.Optimization of processing technology of Fuqu with pyrazine-producing bacteria[J].China Brewing, 2016, 35(2):13-17.
[4] 郭凯凯, 肖楠, 肖冬光.高产酯酿酒活性干酵母在清香型麸曲酒生产中的应用研究[J].酿酒科技, 2018(1):38-40;46.
GUO K K, XIAO N, XIAO D G.Application of active dry yeast with high-yield of acetate ester in the production of Qingxiang fuqu Baijiu[J].Liquor-Making Science &Technology, 2018(1):38-40;46.
[5] LIU H L, SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].Journal of Agricultural and Food Chemistry, 2018, 66(22):5425-5432.
[6] DONG W W, YANG Q, LIAO Y X, et al.Characterisation and comparison of the microflora of traditional and pure culture Xiaoqu during the Baijiu liquor brewing process[J].Journal of the Institute of Brewing, 2020, 126(2):213-220.
[7] 陈志宏, 张汆, 徐有山.白酒中风味物质分析研究进展[J].中国酿造, 2020, 39(6):13-16.
CHEN Z H, ZHANG C, XU Y S.Research progress on the flavor substances in Baijiu[J].China Brewing, 2020, 39(6):13-16.
[8] 牛云蔚, 李雯慧, 肖作兵.白酒风味物质分析研究进展[J].食品科学技术学报, 2021, 39(2):23-31;90.
NIU Y W, LI W H, XIAO Z B.Research progress on analysis of flavor compounds in Baijiu[J].Journal of Food Science and Technology, 2021, 39(2):23-31;90.
[9] ZOU W, ZHAO C Q, LUO H B.Diversity and function of microbial community in Chinese strong-flavor Baijiu ecosystem:A review[J].Frontiers in Microbiology, 2018, 9:671.
[10] WANG W H, FAN G S, LI X T, et al.Application of Wickerhamomyces anomalus in simulated solid-state fermentation for Baijiu production:Changes of microbial community structure and flavor metabolism[J].Frontiers in Microbiology, 2020, 11:598758.
[11] HU Y L, YANG Q, CHEN D, et al.Study on microbial communities and higher alcohol formations in the fermentation of Chinese Xiaoqu Baijiu produced by traditional and new mechanical technologies[J].Food Research International, 2021, 140:109876.
[12] FU Z L, SUN B G, LI X T, et al.Isolation and characterization of a high ethyl acetate-producing yeast from Laobaigan Daqu and its fermentation conditions for producing high-quality Baijiu[J].Biotechnology &Biotechnological Equipment, 2018, 32(5):1218-1227.
[13] 谢再斌, 王太玉, 王茜, 等.异常威克汉姆酵母在白酒酿造中的应用研究[J].中国酿造, 2022, 41(5):18-22.
XIE Z B, WANG T Y, WANG Q, et al.Application of Wickerhamomyces anomalus in Baijiu-brewing[J].China Brewing, 2022, 41(5):18-22.
[14] 乔宗伟, 张文学, 张丽莺, 等.浓香型白酒发酵过程中酒醅的微生物区系分析[J].酿酒, 2005, 32(1):18-22.
QIAO Z W, ZHANG W X, ZHANG L Y, et al.Analysis on microbes in brewing mass of strong aromatic spirits during fermentation[J].Liquor-making, 2005, 32(1):18-22.
[15] 张小娜, 余安玲, 董若兰, 等.高粱品种对白酒发酵的影响[J].食品与发酵工业, 2023, 49(9):96-102.
ZHANG X N, YU A L, DONG R L, et al.Effect of sorghum varieties on the fermentation of Baijiu[J].Food and Fermentation Industries, 2023, 49(9):96-102.
[16] 范光森, 刘朋肖, 吴秋华, 等.有氧条件下酿酒酵母YF1914产乙醇发酵条件优化及其产香特性[J].食品工业科技, 2019, 40(13):52-58.
FAN G S, LIU P X, WU Q H, et al.Optimization of cultural conditions for ethyl alcohol production by Saccharomyces cerevisiae YF1914 in aerobic conditions and its aroma-producing characteristics[J].Science and Technology of Food Industry, 2019, 40(13):52-58.
[17] 方颂平, 刘露, 吴文睿, 等.小米对浓香型白酒酿造及风格特征的影响[J].食品与发酵工业, 2021, 47(8):122-127.
FANG S P, LIU L, WU W R, et al.Influence of millet in the brewing and flavor characteristics of strong flavor Baijiu[J].Food and Fermentation Industries, 2021, 47(8):122-127.
[18] 范文来, 徐岩.白酒79个风味化合物嗅觉阈值测定[J].酿酒, 2011, 38(4):80-84.
FAN W L, XU Y.Determination of odor thresholds of volatile aroma compounds in Baijiu by a forced-choice ascending concentration series method of limits[J].Liquor Making, 2011, 38(4):80-84.
[19] GAO W J, FAN W L, XU Y.Characterization of the key odorants in light aroma type Chinese liquor by gas chromatography-olfactometry, quantitative measurements, aroma recombination, and omission studies[J].Journal of Agricultural and Food Chemistry, 2014, 62(25):5796-5804.
[20] 孙细珍, 杜佳炜, 黄盼, 等.现代工艺和传统工艺酿造小曲清香型白酒感官表征及风味成分分析[J].食品科学, 2021, 42(6):282-290.
SUN X Z, DU J W, HUANG P, et al.Analysis of sensory characteristics and flavor components in light-flavor Chinese liquor(Baijiu) made with Xiaoqu starter by modern and traditional technologies[J].Food Science, 2021, 42(6):282-290.
[21] 王喆. 特色小曲清香型白酒关键挥发性化合物及其相关微生物分析研究[D].武汉:华中农业大学, 2021.
WANG Z.Analysis and research on key volatile compounds and related microorganisms of Xiaoqu liquor with special characteristics[D].Wuhan:Huazhong Agricultural University, 2021.
[22] 冒德寿, 牛云蔚, 姚征民, 等.顶空固相微萃取-气相色谱质谱联用和气相色谱嗅闻技术鉴定清香型白酒特征香气物质[J].中国食品学报, 2019, 19(7):251-261.
MAO D S, NIU Y W, YAO Z M, et al.Characterization of the key aroma compounds in Chinese light aroma-type liquors by headspace solid-phase microextraction-gas chromatography-mass spectrometry, gas chromatography-olfactometry[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(7):251-261.
[23] 许银, 杨强, 张龙, 等.高产乙酸乙酯酵母菌的筛选及其在清香型小曲白酒生产中的应用[J].中国酿造, 2021, 40(8):76-80.
XU Y, YANG Q, ZHANG L, et al.Screening of high-yield ethyl acetate yeast and its application in the light-flavor Xiaoqu Baijiu production[J].China Brewing, 2021, 40(8):76-80.
[24] FAN W L, QIAN M C.Characterization of aroma compounds of Chinese “Wuliangye” and “Jiannanchun” liquors by aroma extract dilution analysis[J].Journal of Agricultural and Food Chemistry, 2006, 54(7):2695-2704.
[25] LI W, CHEN S J, WANG J H, et al.Genetic engineering to alter carbon flux for various higher alcohol productions by Saccharomyces cerevisiae for Chinese Baijiu fermentation[J].Applied Microbiology and Biotechnology, 2018, 102(4):1783-1795.
[26] JIANG J, LIU Y C, LI H H, et al.Modeling and regulation of higher alcohol production through the combined effects of the C/N ratio and microbial interaction[J].Journal of Agricultural and Food Chemistry, 2019, 67(38):10694-10701.
[27] YUN J, CUI C J, ZHANG S H, et al.Use of headspace GC/MS combined with chemometric analysis to identify the geographic origins of black tea[J].Food Chemistry, 2021, 360:130033.