静电纺丝技术是一种利用高压静电场作用从聚合物溶液或熔体中生产连续纳米纤维的技术[1]。电纺纤维具有制备简便、比表面积大、形态可控、负载能力好、机械性能优良等优点,适用于生物活性保护[2]、药物传递[3]、食品活性包装[4]、酶固定化[5]、纳米传感器[6]等多个领域。在包装材料方面,多糖和蛋白质等天然生物聚合物以其来源丰富、无毒无害、可生物降解、生物相容性好而受到许多研究者的密切关注[7]。现如今,关于静电纺丝制备的生物聚合物纳米纤维在食品包装上的应用引起了国内外许多学者的兴趣。
葡聚糖是一种细菌多糖,由α-1,6连接的d-吡喃葡萄糖残基和一些α-1,2-、α1,3-或α-1,4连接的侧链组成,其生物相容性和生物降解性对药物输送和支架等生物医学领域具有重要意义[8]。玉米醇溶蛋白是一种醇溶蛋白,由于其含有大量的谷氨酰胺、亮氨酸、脯氨酸和丙氨酸等非极性疏水氨基酸残基,所以玉米醇溶蛋白不溶于水,只能分散于特定比例的乙酸、醇类溶剂、阴离子洗涤剂、尿素或碱(pH≥11)的水溶液中[9]。玉米醇溶蛋白的生物降解性、可持续性和疏水性等特性使其在生物可降解膜的研究中受到广泛应用。
通常在对天然高分子纳米纤维进行应用研究均需对其进行交联,交联的方法包括化学交联法和酶法交联,其中戊二醛熏蒸是最常见的交联方式[10]。但有研究表明戊二醛残留具有细胞毒性,这可能会限制其在食品工程或组织工程等领域的应用[11]。美拉德反应是还原糖的羰基与蛋白质的氨基之间发生的反应,研究表明美拉德反应是一种绿色化学交联方式[12]。ZHANG等[13]利用木糖引起的美拉德反应对电纺的谷朊蛋白/玉米醇溶蛋白纳米纤维进行糖基化,处理后纤维的物理性能得到提升。ETXABIDE等[14]通过添加乳糖并进行热处理来促进糖基化作用,使制备的鱼明胶膜溶解度显著降低。
本文采用静电纺丝法制备葡聚糖/玉米醇溶蛋白纳米纤维,旨在研究不添加和添加5%的葡萄糖或木糖后,美拉德反应交联对纳米纤维性质的影响,为其应用提供一定依据。通过扫描电子显微镜观察纤维微观形态变化以及直径分布。通过傅里叶红外光谱、X射线衍射、热分析技术研究组分间的分子间相互作用和热稳定性。通过接触角测试表征纤维浸润性的变化。通过拉伸测试来研究美拉德反应交联对纳米纤维机械性能的影响。通过水蒸气透过率表征美拉德反应交联对纳米纤维水蒸气阻隔性能的影响。
1 材料与方法
1.1 材料与仪器
葡聚糖、葡萄糖、木糖,阿拉丁生化科技股份有限公司;玉米醇溶蛋白(Z3625,22~24 kDa),Sigma Aldrich公司。
JDF05静电纺丝机,长沙纳仪仪科技有限公司;SU-8010扫描电子显微镜,日本日立公司;DR-508A电脑试验拉力机,东莞市东日仪器有限公司;BSA124S 电子天平,赛多利斯科学仪器有限公司;X射线衍射仪,德国 Bruker D8 Advance;STA449F3DSC/TG 同步热分析仪,德国 NETZSCHN;傅里叶红外光谱仪,BRUKER光谱仪器公司;OCA 20视频接触角测量仪,德国Dataphysics。
1.2 溶液配制
参考LUO等[15]的研究,将500 g/L葡聚糖溶液和300 g/L的玉米醇溶蛋白溶解在乙酸水溶液(乙酸∶水=1∶1,体积比)中制备静电纺丝溶液。基于前期的研究[16],在每种溶液中加入50 g/L的葡萄糖或木糖溶液。然后充分搅拌,使其完全溶解。
1.3 静电纺丝
为了将每种溶液输送到针尖(20 G,内径为0.5 mm),使用10 mL塑料注射器。设定静电纺丝电压18 kV,溶液流速1.0 mL/h,针尖距接收端的距离为15 cm。
1.4 美拉德反应
美拉德反应在温度为60 ℃,相对湿度为50%的条件下进行,反应时间0、2和5 d。将未添加、添加葡萄糖以及添加木糖的纳米纤维分别记为DZM0、gDZM0、xDZM0;美拉德反应2 d后的纤维分别记为DZM2、gDZM2、xDZM2;反应5 d后的纤维分别记为DZM5、gDZM5、xDZM5。
1.5 扫描电镜分析
剪取纳米纤维膜经真空喷金处理后,于扫描电子显微镜(scanning electron microscope,SEM)上观察纳米纤维的微观形貌。使用软件Nano Measure 从纳米纤维的扫描电子显微镜图中随机选取 40 根纤维,对其直径进行统计,根据所得数据拟合得出纤维平均直径并计算标准差。
1.6 红外光谱测试
红外光谱测试采用溴化钾压片法,扫描范围:4 000.0~400.0 cm-1,分辨率2.0 cm-1,累加32次,以空气为背景,每次扫描前扣除背景。
1.7 热性能分析
采用差示扫描量热法(different scanning calorimetry,DSC)和热重分析法(thermogravimetry analysis,TGA)对纳米纤维膜进行热特性分析。精准称取6~10 mg样品,放入铝坩埚中,密封,并以相同条件的空坩埚作参比。在干燥的N2环境中,以10 ℃/min的速度从20 ℃升温至600 ℃。
1.8 X射线衍射分析
从纳米纤维上剪下长×宽为2 cm×2 cm的片状样品,在X-pert Power衍射仪上进行检测分析,Cu Kα(λ=1.540 6 Å),倾角0.02°,扫描速度 1°/min,扫描范围2θ=10.0°~90.0°,电压 40.0 kV,电流30.0 mA。
1.9 水接触角试验
使用视频接触角测量仪测量纤维的水接触角。在厚度约0.2 mm的纤维上剪取约20 mm×40 mm的薄片,固定于测试平台的载玻片上。测定水接触角,用精密注射器沉降3 μL水于薄膜表面,待液滴接触薄膜3 s后测量接触角。
1.10 机械性能试验
采用电脑试验拉力机进行机械性能测试,测量试样的拉伸强度、弹性模量和断裂伸长率。切取厚度为0.2 mm,长×宽为40 mm×15 mm的纤维膜薄片,放入夹具,在电脑中输入精准测量后的样品厚度、宽度和截距,设定拉力荷载5 N,拉伸速率5 mm/min。每个样品重复至少4次。拉伸强度、弹性模量和断裂伸长率的计算如公式(1)~公式(3)所示[17]:
拉伸强度![]()
(1)
断裂伸长率![]()
(2)
弹性模量![]()
(3)
1.11 水蒸气渗透率试验
用直径为6 cm的纳米纤维圆片封住10 mL透水杯的杯口,然后置于干燥器中。在6 h内,每间隔1 h测量1次,每个样品重复3 次试验,保留所有样品的重量和记录。水蒸气渗透率(water vapor permeability,WVP)计算如公式(4)所示:
(4)
式中:Ws/t,重量随时间的线性回归,g/s;A,纳米纤维与水蒸气的接触面积,cm2;L,厚度,cm;ΔP,饱和蒸气压差,Pa(2 237.8 Pa,28.0 ℃)。
1.12 数据分析
对所测得的纳米纤维试验数据进行统计分析,用平均值±标准差表示。利用Origin 2023软件进行单因素方差分析(ANOVA)以及Tukey检验显著性分析(P<0.05)并作图。
2 结果与分析
2.1 纤维形态
采用SEM观察纳米纤维的形貌,分析交联前后葡聚糖玉米醇溶蛋白纳米纤维直径的变化。由图1可知制备的纤维质地均匀,圆润光滑,交联前后纤维没有明显的膨胀或收缩。DZM0、gDZM0和xDZM0平均直径分别为447、450、451 nm,纤维直径没有明显的差异,表明交联反应前葡萄糖和木糖的加入对纤维直径的影响较弱。美拉德反应过程中,纤维形态得以保持,且从图中可得添加葡萄糖和木糖纤维直径的变化趋势较缓。1-乙基 -3-(3-二甲氨基丙基)碳二亚胺N-羟基琥珀酰亚胺和京尼平在湿的状态下进行交联的过程中,纳米纤维的膨胀与交联同时发生[18]。而KWAK等[19]研究发现糖交联在干燥条件下进行时,纤维形态得到良好保持。

图1 葡聚糖/玉米醇溶蛋白纳米纤维交联前后的扫描电镜图和纤维直径分布图
Fig.1 The SEM images and fiber diameter distribution of dextran/zein nanofibers before and after crosslinking
2.2 红外光谱分析
图2显示交联前后的纳米纤维傅里叶变换红外光谱(Fourier transform infrared spectrometer,FTIR),以此来分析纤维各组分之间的官能团作用。在3 290.72~3 302.31 cm-1范围内的吸收峰对应宽的O—H和N—H伸缩振动。2 929.13~2 933.77 cm-1范围内的吸收峰对应脂族基团的C—H伸缩振动。1 649.66~1 654.30 cm-1和1 531.45~1 540.72 cm-1范围内的吸收峰分别对应酰胺I带C![]() O和酰胺Ⅱ带C—N的振动伸缩[20]。1 014.56~1 019.20 cm-1范围内对应的则是C—O的伸缩带,交联后谱带强度的降低,则证明葡萄糖和木糖的羰基与蛋白质的游离氨基之间发生了美拉德反应[21]。
O和酰胺Ⅱ带C—N的振动伸缩[20]。1 014.56~1 019.20 cm-1范围内对应的则是C—O的伸缩带,交联后谱带强度的降低,则证明葡萄糖和木糖的羰基与蛋白质的游离氨基之间发生了美拉德反应[21]。
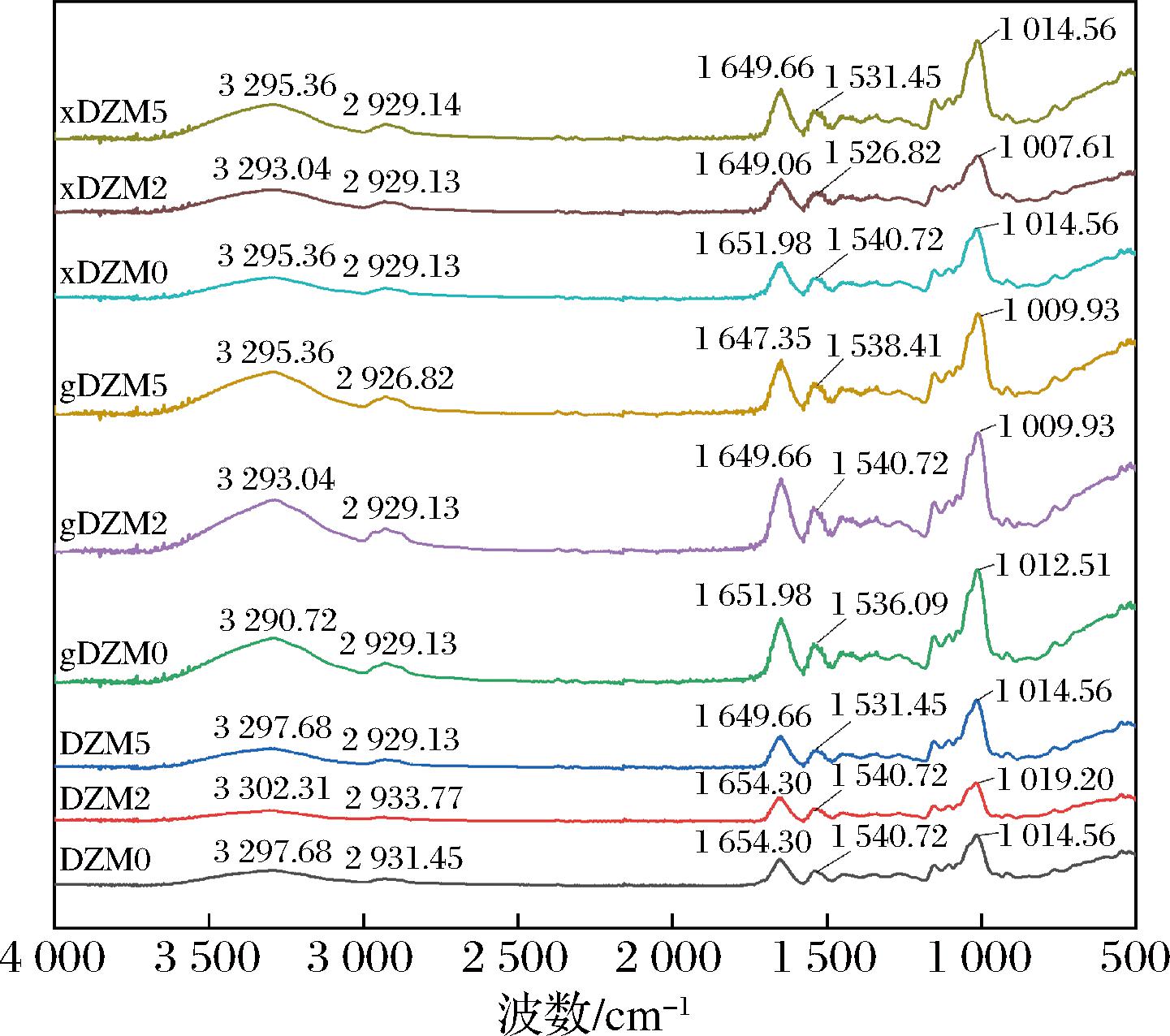
图2 葡聚糖/玉米醇溶蛋白纳米纤维交联前后的红外光谱图
Fig.2 The FTIR spectra of dextran/zein nanofibers before and after crosslinking
2.3 热性能分析
交联前后的葡聚糖/玉米醇溶蛋白纳米纤维的DSC曲线如图3所示,再结合表1可知所有纳米纤维的DSC曲线有2个特征吸热峰。
表1 葡聚糖/玉米醇溶蛋白纳米纤维交联前后的DSC数据
Table 1 The DSC data of dextran/zein nanofibers before and after crosslinking
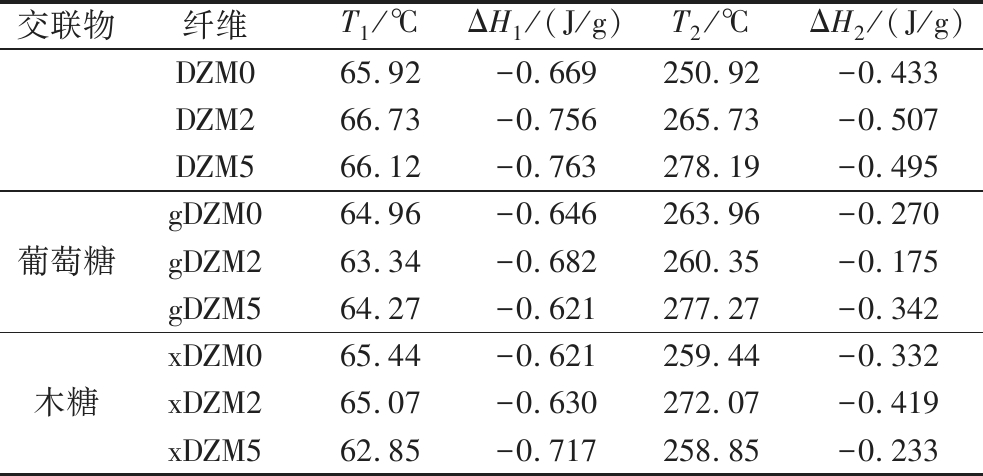
交联物纤维T1/℃ΔH1/(J/g)T2/℃ΔH2/(J/g)DZM065.92-0.669250.92-0.433DZM266.73-0.756265.73-0.507DZM566.12-0.763278.19-0.495葡萄糖gDZM064.96-0.646263.96-0.270gDZM263.34-0.682260.35-0.175gDZM564.27-0.621277.27-0.342木糖xDZM065.44-0.621259.44-0.332xDZM265.07-0.630272.07-0.419xDZM562.85-0.717258.85-0.233
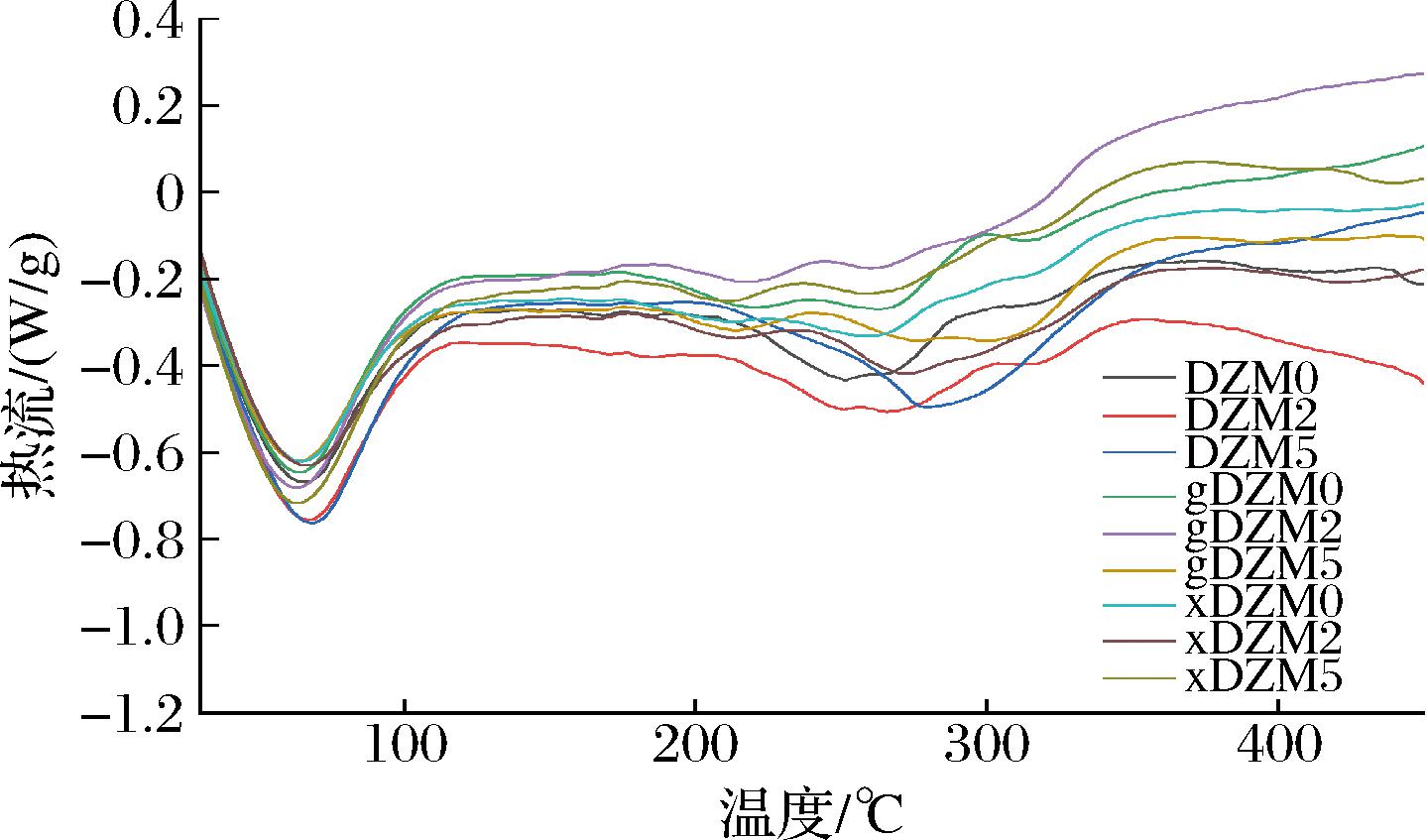
图3 葡聚糖/玉米醇溶蛋白纳米纤维交联前后的DSC谱图
Fig.3 The DSC spectra of dextran/zein nanofibers before and after crosslinking
65 ℃左右的吸热峰对应纳米纤维的有序或聚集结构被破坏,此时温度定为T1,焓变为ΔH1。T1的变化是葡萄糖或木糖与葡聚糖/玉米醇溶蛋白之间相容性的有效指标[22]。交联前后纳米纤维的T1变化不大,显示葡萄糖和木糖与聚合物之间具有良好的相容性,ΔH1则降低,表明葡聚糖链的链段流动性增强[16]。250~280 ℃内的吸热峰表示纤维发生分解,此时的温度定为T2,焓变为ΔH2。DZM0,gDZM0和xDZM0的T2分别为250.92、263.96、259.44 ℃,gDZM0和xDZM0显示更高的分解温度,表明葡萄糖和木糖与葡聚糖/玉米醇溶蛋白分子间的相互作用。随着反应的进行,交联葡萄糖纳米纤维的T2呈上升趋势,交联木糖的纳米纤维T2 呈下降的趋势,但xDZM2具有最高的分解温度T2,为272.07 ℃。
在高温下的耐分解性是包装材料的一个重要特性,这会影响包装对环境应力的适应性以及通过焚烧处理的可能性[17]。根据图4和表2可知,纳米纤维降解过程分两步进行。在58~63 ℃纤维初步降解,吸附的水分蒸发,失重率在5%~10%;在296~307 ℃纤维发生第二阶段的降解,失去大部分质量。葡聚糖和玉米醇溶蛋白分别在315.7和325 ℃有降解峰,降解过程包含链断裂和内部共价键的断裂[15, 23],这与纤维第二阶段的降解重合。交联葡萄糖和木糖后,纤维在第二阶段的失重率降低,gDZM2具有最低的失重率,为67.57%。而在600 ℃后只剩余无机化合物的重量,gDZM5具有最高的残余物重量比,为22.96%。
表2 葡聚糖/玉米醇溶蛋白纳米纤维交联前后的TGA数据
Table 2 The TGA data of dextran/zein nanofibers before and after crosslinking
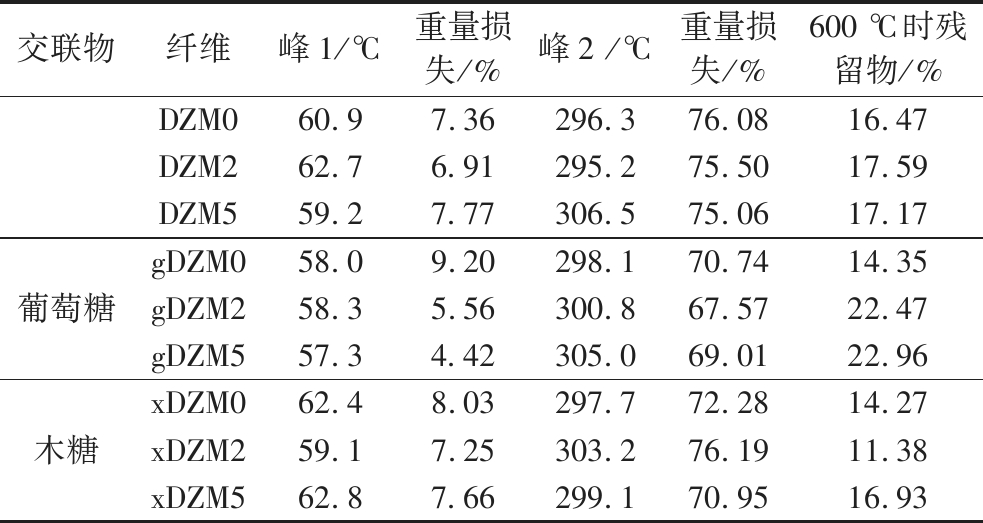
交联物纤维峰1/℃重量损失/%峰2 /℃重量损失/%600 ℃时残留物/%DZM060.97.36296.376.0816.47DZM262.76.91295.275.5017.59DZM559.27.77306.575.0617.17葡萄糖gDZM058.09.20298.170.7414.35gDZM258.35.56300.867.5722.47gDZM557.34.42305.069.0122.96木糖xDZM062.48.03297.772.2814.27xDZM259.17.25303.276.1911.38xDZM562.87.66299.170.9516.93
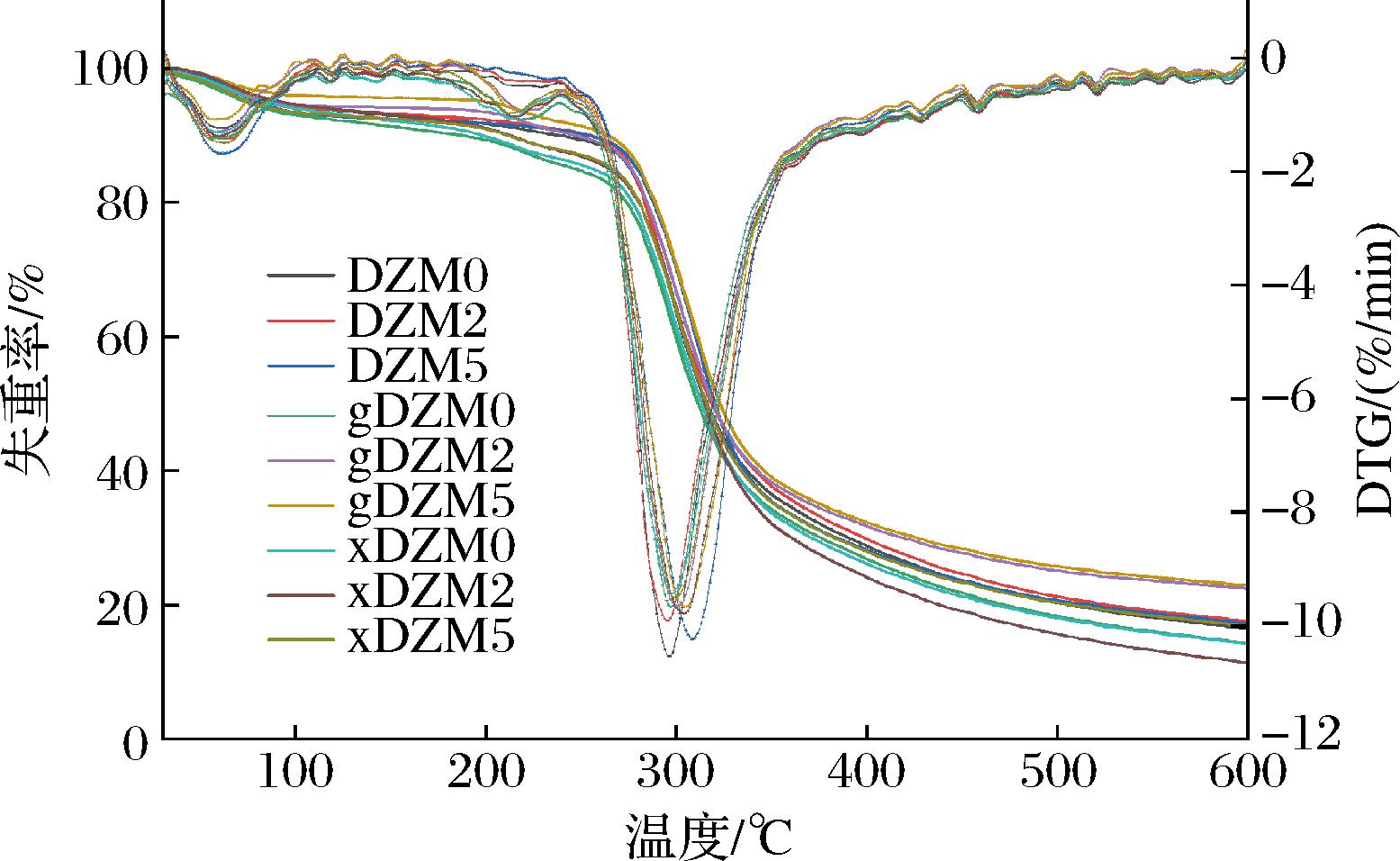
图4 葡聚糖/玉米醇溶蛋白纳米纤维交联前后的TGA谱图
Fig.4 The TGA spectra of dextran/zein nanofibers before and after crosslinking
2.4 X射线衍射分析
采用XRD分析交联作用对纳米纤维晶体结构和结晶度的影响。根据研究可知,电纺可能对结晶形成起阻碍作用,并促进聚合物无定形结构的形成[24]。衍射峰的强度表明了纳米纤维结晶性的变化。已知玉米醇溶蛋白的晶体结构源自α-螺旋结构,且制备的纳米纤维基本呈现无定形结构,表现较低的结晶性。如图5所示,纳米纤维在20°左右有强的衍射峰,说明具有一定的结晶性,但在美拉德反应过程中,交联纤维的结晶性减弱,可能是蛋白质构象变化的结果。
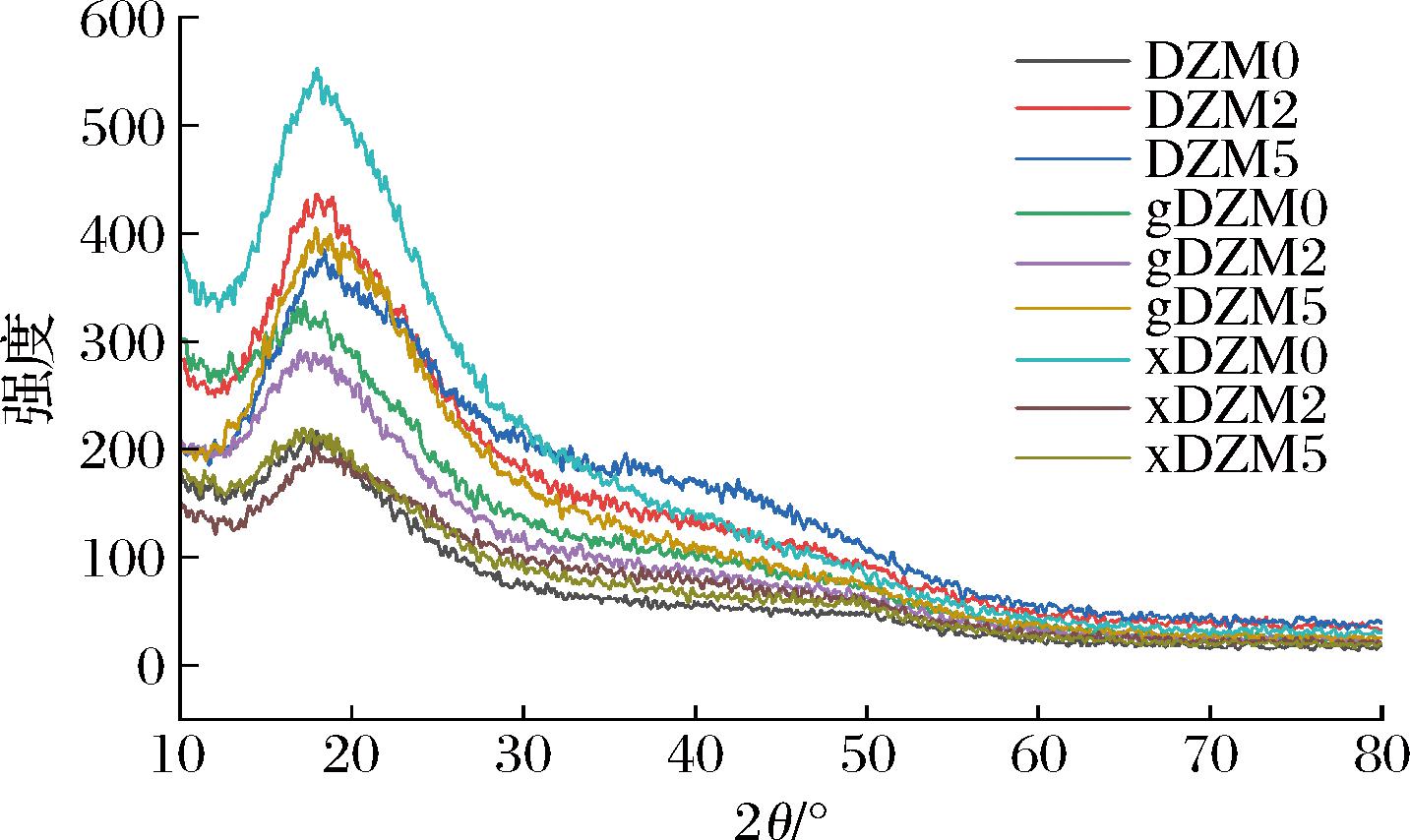
图5 葡聚糖/玉米醇溶蛋白纳米纤维交联前后的XRD谱图
Fig.5 The XRD patterns of dextran/zein nanofibers before and after crosslinking
2.5 水接触角分析
为研究交联葡萄糖或木糖对纳米纤维疏水性能的影响,采用水接触角衡量纤维的润湿程度,比较交联前后的变化。包装材料接触角的增加可以延长食品包装中抗菌剂的释放时间,从而使食品保质期延长[15]。如图6所示,DZM0、gDM0、xDZM0的水接触角分别为109.4°,125.4°,120.5°,表明含有葡萄糖和木糖的纳米纤维具有更好的疏水性能。在美拉德反应过程中,未交联纤维的水接触角呈下降趋势,而交联纤维的水接触角都呈增加趋势,纤维的疏水性能明显增强,这归因于交联葡萄糖和木糖使葡聚糖/玉米醇溶蛋白纳米纤维结构更加紧密以及美拉德反应诱使非极性基团朝外形成的疏水表面。
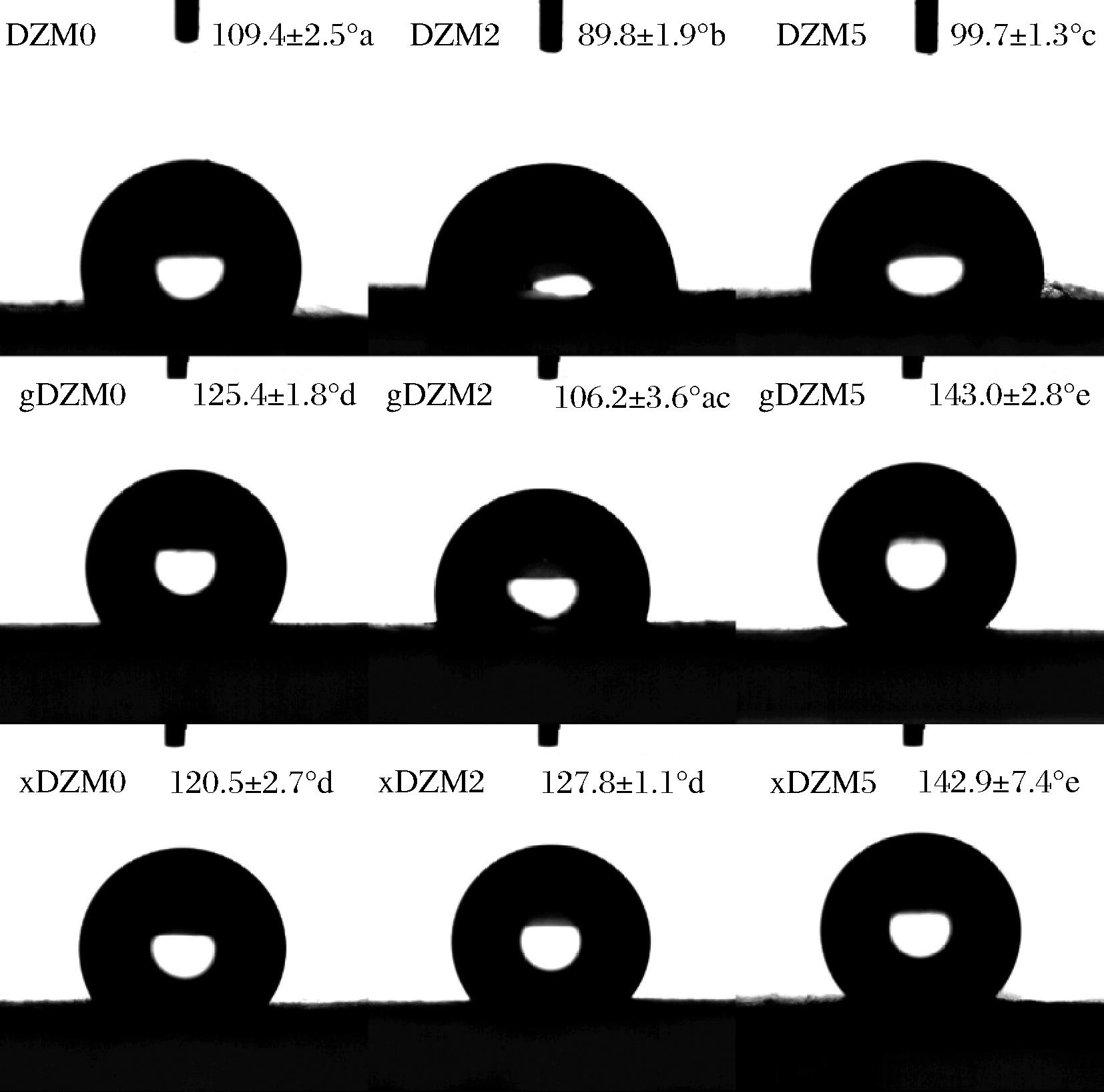
图6 葡聚糖/玉米醇溶蛋白纳米纤维交联前后的水接触角
Fig.6 The water contact angle of dextran/zein nanofibers before and after crosslinking
2.6 力学性能分析
机械性能是纳米纤维实际应用中的一个重要特征[25]。图7为纤维拉伸测试结果,图7-a为弹性模量、图7-b为断裂伸长率、图7-c为拉伸强度。根据图7-a可知,交联纤维的弹性模量显著增强,且随美拉德反应的进行而进一步增强,这归因于聚合物链之间的分子纠缠和相互作用导致复合膜的抗变形能力提高[26]。拉伸强度表现纳米纤维在断裂前每一有效横截面积所保持的最大拉力,从图7-b和图7-c可看出,交联葡萄糖对纳米纤维拉伸强度和断裂伸长率变化的影响较弱,而交联木糖对其变化的影响较强。xDZM2有最高的拉伸强度和断裂伸长率,与xDZM5表现相反。KCHAOU等[22] 在制备葡萄糖交联的鱼明胶膜过程中发现交联明胶膜的拉伸应力和断裂伸长率都随着交联度的增加而增加。有研究表明,美拉德反应可使纳米纤维拉伸强度得到改善以及糖分子的增塑作用与纤维伸长率的增加相关,且静电纺丝相比于薄膜浇筑工艺,水溶剂的蒸发速度更快,因此糖分子的塑化效果不明显,仅出现美拉德反应引起的拉伸性能的改善[18, 27]。
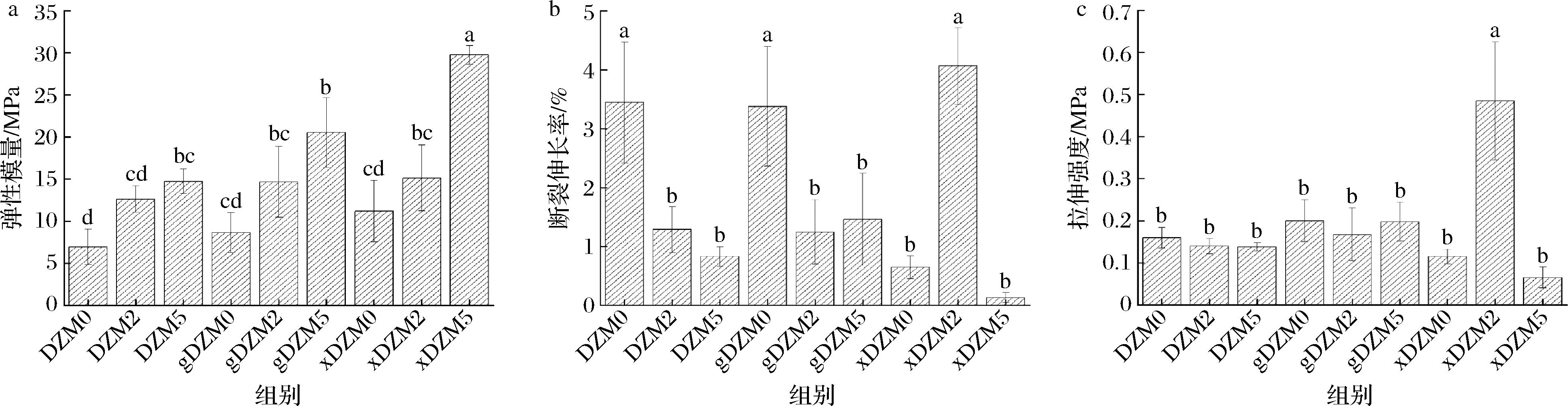
a-弹性模量;b-断裂伸长率;c-拉伸强度
图7 葡聚糖/玉米醇溶蛋白纳米纤维交联前后的拉伸测试结果
Fig.7 The tensile test results of dextran/zein nanofibers before and after crosslinking
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.7 水蒸气透过率分析
水蒸气渗透通常涉及水汽的吸收和扩散,且反应纳米纤维的水蒸气阻隔性能,其变化与亲水和疏水组分的比例以及极性和非极性基团的排列有关[14, 28]。从图8可知添加葡萄糖和木糖后,gDZM0表现高的水蒸气透过率,xDZM0则无明显变化。在美拉德反应的影响下,未交联和交联葡萄糖的纤维表现较高的水蒸气透过率,其变化趋势相似,而交联木糖纤维的水蒸气透过率则随反应时间的延长逐渐降低,表明交联木糖的纤维具有更好的水蒸气阻隔性能。
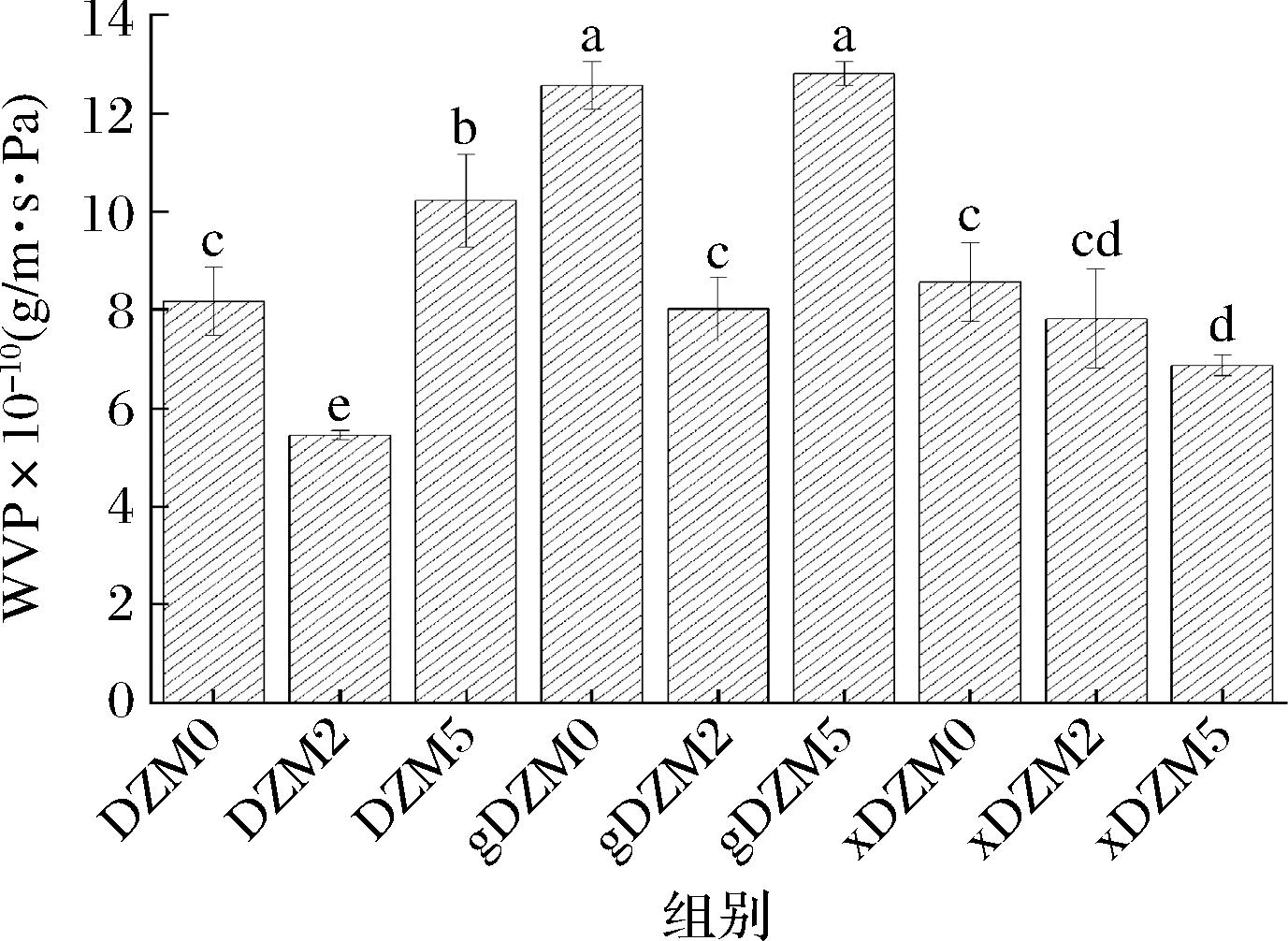
图8 葡聚糖/玉米醇溶蛋白纳米纤维交联前后的水蒸气透过率
Fig.8 The water vapor permeability of dextran/zein nanofibers before and after crosslinking
3 结论
本研究通过静电纺丝法成功制备美拉德反应交联葡萄糖和木糖的葡聚糖/玉米醇溶蛋白纳米纤维,并观察反应0、2、5 d后纳米纤维性质的变化。电纺制备的纤维光滑均匀,形态规则,且在美拉德反应交联后纤维形态无明显变化。交联木糖的纳米纤维的具有较高的水接触角和水蒸气阻隔性,对纤维的机械强度也有一定的改善作用。交联葡萄糖的纳米纤维则具有较高的热稳定性。综上所述,美拉德反应交联木糖对葡聚糖/玉米醇溶蛋白纳米纤维性能的改善作用更强,也为食品活性包装材料研究中纳米纤维的改性提供了一种有效方法。
[1] ZHOU F L, GONG R H, PORAT I.Mass production of nanofibre assemblies by electrostatic spinning[J].Polymer International, 2009, 58(4):331-342.
[2] DEHNAD D, EMADZADEH B, GHORANI B, et al.Bioactive-loaded nanovesicles embedded within electrospun plant protein nanofibers;a double encapsulation technique[J].Food Hydrocolloids, 2023, 141:108683.
[3] ABDUL HAMEED M M, ALI PADUSHA MOHAMED KHAN S, THAMER B M, et al.Electrospun nanofibers for drug delivery applications:Methods and mechanism[J].Polymers for Advanced Technologies, 2023, 34(1):6-23.
[4] DRAGO E, FRANCO P, CAMPARDELLI R, et al.Zein electrospun fibers purification and vanillin impregnation in a one-step supercritical process to produce safe active packaging[J].Food Hydrocolloids, 2022, 122:107082.
[5] RATHER A H, KHAN R S, WANI T U, et al.Overview on immobilization of enzymes on synthetic polymeric nanofibers fabricated by electrospinning[J].Biotechnology and Bioengineering, 2022, 119(1):9-33.
[6] GHORANI B, EMADZADEH B, FOOLADI E, et al.Designing a colorimetric nanosensor based on dithizone and cholesteric liquid crystals loaded in electrospun cellulose acetate nanofibers:Monitoring the quality of pistachio as a case study[J].Journal of Applied Polymer Science, 2023, 140(7):e53472.
[7] DENG L L, LI Y, FENG F Q, et al.Encapsulation of allopurinol by glucose cross-linked gelatin/zein nanofibers:Characterization and release behavior[J].Food Hydrocolloids, 2019, 94:574-584.
[8] CENGIZ-ÇALL O
O LU F.Dextran nanofiber production by needleless electrospinning process[J].e-Polymers, 2014, 14(1):5-13.
LU F.Dextran nanofiber production by needleless electrospinning process[J].e-Polymers, 2014, 14(1):5-13.
[9] GITERU S G, ALI M A, OEY I.Recent progress in understanding fundamental interactions and applications of zein[J].Food Hydrocolloids, 2021, 120:106948.
[10] 邓伶俐, 李阳, 张辉.静电纺丝食品级天然高分子研究进展[J].中国食品学报, 2020, 20(7):278-288.
DENG L L, LI Y, ZHANG H.Research progress of food-grade natural biopolymer by electrospinning[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(7):278-288.
[11] 罗仕园, 杨诚, 陈载晗, 等.气流辅助静电纺丝制备负载姜黄素纳米纤维及美拉德反应对纤维性质的影响[J].食品与发酵工业, 2022, 48(22):46-53.
LUO S Y, YANG C, CHEN Z H, et al.Preparation of curcumin-loaded nanofibers by air-assisted electrospinning and the effect of Maillard reaction on fiber properties[J].Food and Fermentation Industries, 2022, 48(22):46-53.
[12] LIU S Q, LUO S Y, LI Y L, et al.Influence of the Maillard reaction on properties of air-assisted electrospun gelatin/zein/glucose nanofibers[J].Foods, 2023, 12(3):451.
[13] ZHANG Y P, DENG L L, ZHONG H, et al.Impact of glycation on physical properties of composite gluten/zein nanofibrous films fabricated by blending electrospinning[J].Food Chemistry, 2022, 366:130586.
[14] ETXABIDE A, URANGA J, GUERRERO P, et al.Improvement of barrier properties of fish gelatin films promoted bygelatin glycation with lactose at high temperatures[J].LWT - Food Science and Technology, 2015, 63(1):315-321.
[15] LUO S Y, SAADI A, FU K, et al.Fabrication and characterization of dextran/zein hybrid electrospun fibers with tailored properties for controlled release of curcumin[J].Journal of the Science of Food and Agriculture, 2021, 101(15):6355-6367.
[16] DENG L L, LI Y, FENG F Q, et al.Study on wettability, mechanical property and biocompatibility of electrospun gelatin/zein nanofibers cross-linked by glucose[J].Food Hydrocolloids, 2019, 87:1-10.
[17] ALIZADEH-SANI M, TAVASSOLI M, MCCLEMENTS D J, et al.Multifunctional halochromic packaging materials:Saffron petal anthocyanin loaded-chitosan nanofiber/methyl cellulose matrices[J].Food Hydrocolloids, 2021, 111:106237.
[18] KWAK H W, PARK J, YUN H, et al.Effect of crosslinkable sugar molecules on the physico-chemical and antioxidant properties of fish gelatin nanofibers[J].Food Hydrocolloids, 2021, 111:106259.
[19] KWAK H W, KIM J E, LEE K H.Green fabrication of antibacterial gelatin fiber for biomedical application[J].Reactive and Functional Polymers, 2019, 136:86-94.
[20] WANG H L, HAO L L, WANG P, et al.Release kinetics and antibacterial activity of curcumin loaded zein fibers[J].Food Hydrocolloids, 2017, 63:437-446.
[21] SIIMON K, REEMANN P, P DER A, et al.Effect of glucose content on thermally cross-linked fibrous gelatin scaffolds for tissue engineering[J].Materials Science &Engineering.C, Materials for Biological Applications, 2014, 42:538-545.
DER A, et al.Effect of glucose content on thermally cross-linked fibrous gelatin scaffolds for tissue engineering[J].Materials Science &Engineering.C, Materials for Biological Applications, 2014, 42:538-545.
[22] KCHAOU H, BENBETTAÏEB N, JRIDI M, et al.Enhancement of structural, functional and antioxidant properties of fish gelatin films using Maillard reactions[J].Food Hydrocolloids, 2018, 83:326-339.
[23] WANG P, LI Y, ZHANG C, et al.Characterization and antioxidant activity of trilayer gelatin/dextran-propyl gallate/gelatin films:Electrospinning versus solvent casting[J].LWT, 2020, 128:109536.
[24] DENG L L, ZHANG X, LI Y, et al.Characterization of gelatin/zein nanofibers by hybrid electrospinning[J].Food Hydrocolloids, 2018, 75:72-80.
[25] JIANG S H, CHEN Y M, DUAN G G, et al.Electrospun nanofiber reinforced composites:A review[J].Polymer Chemistry, 2018, 9(20):2685-2720.
[26] BRZOSKA N, MÜLLER M, NASUI L N, et al.Effects of film constituents on packaging-relevant properties of sodium caseinate-based emulsion films[J].Progress in Organic Coatings, 2018, 114:250-258.
[27] YUN H, KIM M K, KWAK H W, et al.The role of glycerol and water in flexible silk sericin film[J].International Journal of Biological Macromolecules, 2016, 82:945-951.
[28] SHEN C Y, DENG Z A, RAO J S, et al.Characterization of glycosylated gelatin/pullulan nanofibers fabricated by multi-fluid mixing solution blow spinning[J].International Journal of Biological Macromolecules, 2022, 214:512-521.