近年来,酿酒酵母作为典型的模式生物被广泛应用于合成生物学等行业的生产和研究中[1],但其在工业发酵过程中可能会受到各种代谢产物的抑制或外在环境条件的影响[2]。在极端环境条件下,酿酒酵母的细胞机制快速发生变化,如调节代谢通路、改变基因的表达[3]等。因此,通过适当的策略选育高耐性酵母菌株是非常有意义的。目前,国内外有关酿酒酵母的耐受性的研究大多集中在其与细胞壁、细胞膜[3]、海藻糖及热激蛋白[4]、氧化产物及抗氧化酶系[5]、质子泵[6]及氨基酸[7]等的关系上。
核酸修复蛋白对于维持DNA分子结构和功能的完整性方面非常重要[8]。各种内部或外部因素常会导致DNA分子的损伤或改变。核酸切除修复(nucleotide excision repair,NER)作为酵母DNA损伤的修复途径之一[9],包括转录偶联核苷酸切除修复(transcription-coupled nucleotide excision repair,TC-NER)和全基因组核苷酸切除修复(global-genome nucleotide excision repair,GG-NER)2种修复途径。不同的GG-NER蛋白形成核苷酸切除修复因子复合物NEF1(Rad1-Rad10)、NEF2(Rad4和Rad23)、NEF3(Rad2和六亚基RNA聚合酶II转录因子TFIIH)、NEF4(Rad16和Rad7)[10]。NEF2和NEF4都能结合紫外线损伤的DNA,Rad7和Rad16蛋白在修复的早晚期发挥作用[11]。研究表明RAD23和RAD4基因缺失的酵母菌株对紫外线敏感,且与RAD23缺失菌株相比,RAD4缺失对紫外线更加敏感,其NER途径完全缺陷[12],紫外损伤的NER途径同样也需要Rad16-Rad7复合物。目前,核酸修复蛋白对于酿酒酵母耐受性的研究主要集中在抗紫外性能上,而对于其他耐受性方面的研究却鲜有报道。
相对酵母中复杂的核酸修复系统,细菌的修复系统更为简单。在大多数细菌中,参与该机制的主要为UVRA、UVRB和UVRC基因编码的3种蛋白,并且依赖ATP[13]。UvrA蛋白是细菌中参与NER途径的DNA损伤感应蛋白,其表达受SOS机制的调控[14]。在瑞士乳杆菌(Lactobacillus helveticus)中,UVRA基因被紫外照射、氧化压力激活,其表达量受pH诱导,UVRA赋予菌体抗氧化和耐酸的特性[15]。利用IPTG诱导lac启动子使嗜热栖热菌(Thermus thermophiles)中UVRA在大肠杆菌中表达,发现该菌能够在中性pH下耐高温、在室温下耐低pH。此外,有研究表明DNA修复蛋白、分子伴侣以及热休克蛋白作为全局调控蛋白,在乳酸菌胁迫响应中发挥着重要的作用[16]。张梦汝[17]探究了DNA修复蛋白RecO在乳酸菌抗胁迫能力方面的作用,研究结果表明,RecO对维持乳酸乳球菌在环境胁迫条件下的生存能力至关重要。
本研究选择工业酿酒酵母菌株AY12的单倍体a45为出发菌株,探究了酿酒酵母自身核酸切除修复基因RAD16、RAD7、RAD23和RAD4以及巴氏醋杆菌中核酸切除修复UVRA基因与其耐受性的关系,利用基因工程手段构建了一系列过表达和敲除重组菌株,旨在提高酿酒酵母的耐受性,为研究酿酒酵母耐受性机制提供新的思路和理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
本研究所用菌株和质粒见表1。
表1 本研究所用菌株与质粒
Table 1 Strains and plasmids used in this study
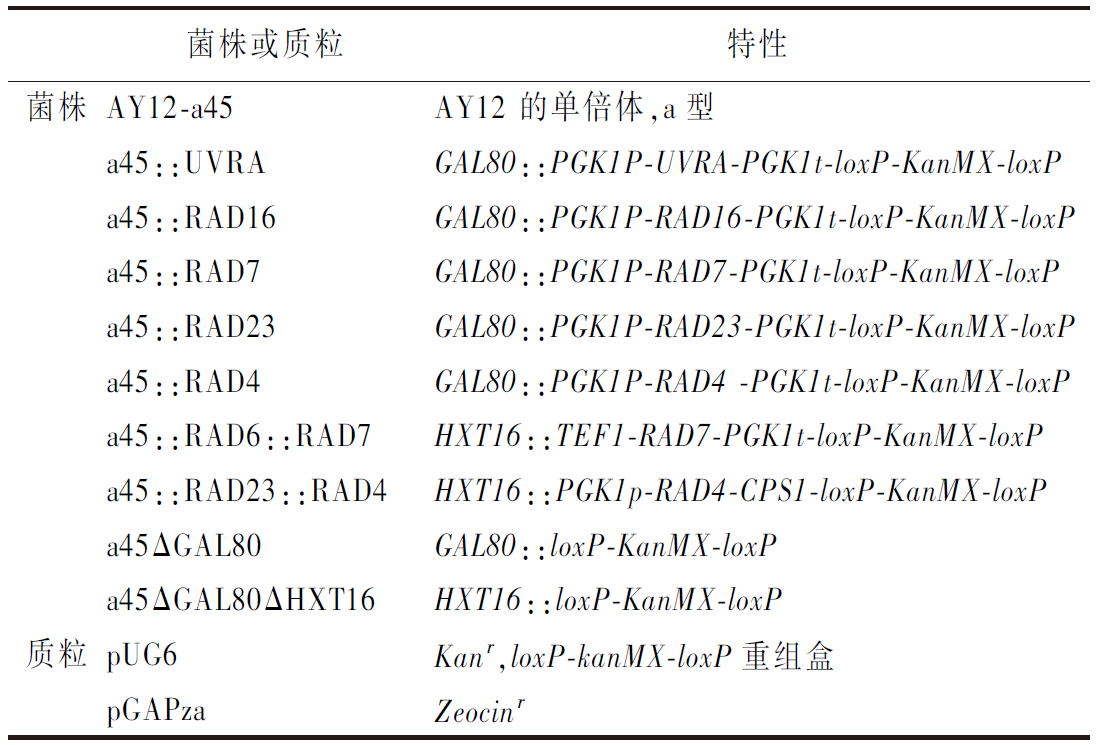
菌株或质粒特性菌株AY12-a45AY12 的单倍体,a型a45::UVRAGAL80::PGK1P-UVRA-PGK1t-loxP-Kan-MX-loxPa45::RAD16GAL80::PGK1P-RAD16-PGK1t-loxP-Kan-MX-loxPa45::RAD7GAL80::PGK1P-RAD7-PGK1t-loxP-Kan-MX-loxPa45::RAD23GAL80::PGK1P-RAD23-PGK1t-loxP-Kan-MX-loxPa45::RAD4GAL80::PGK1P-RAD4 -PGK1t-loxP-Kan-MX-loxPa45::RAD6::RAD7HXT16::TEF1-RAD7-PGK1t-loxP-Kan-MX-loxPa45::RAD23::RAD4HXT16::PGK1p-RAD4-CPS1-loxP-Kan-MX-loxPa45ΔGAL80GAL80::loxP-KanMX-loxPa45ΔGAL80ΔHXT16HXT16::loxP-KanMX-loxP质粒pUG6Kanr,loxP-kanMX-loxP重组盒pGAPzaZeocinr
1.1.2 培养基
YEPD培养基(g/L):葡萄糖0.2,蛋白胨2,酵母浸粉1;
LB培养基(g/L):蛋白胨1,酵母浸粉0.5,氯化钠1;
YEPG半乳糖诱导培养基(g/L):蛋白胨2,半乳糖2,酵母浸粉1。
1.1.3 试剂
质粒提取试剂盒、DNA回收试剂盒,Omega Bio-Tek(美国)公司;限制性内切酶、Taq DNA聚合酶、Primer STAR DNA聚合酶、连接酶、Yeast RNAiso Kit酵母Total RNA提取试剂盒、PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒、SYBR®Premix Ex TaqTMII试剂盒,TaKaRa(大连)公司。
1.2 试验方法
1.2.1 酵母的转化
利用醋酸锂转化法将带有目的基因上下同源臂及抗性基因的表达盒转化至酿酒酵母中,经稀释后涂布于含有G418抗性(300 μg/mL)的YEPD平板上,30 ℃静置培养48 h。培养结束后,对转化子进行PCR验证。以单基因过表达菌株为骨架构建双基因突变株,采用Cre/loxP系统去除单基因过表达菌株的KanMX基因。
1.2.2 实时定量PCR
采用SYBR Premix Ex TaqⅡ (Tli RNaseH Plus),RT-qPCR法检测菌株中RAD16、RAD7、RAD23、RAD4基因转录水平。以UBC6基因作为内参基因。PCR程序表达如下:预变性反应条件为95 ℃ 30秒,PCR反应40个循环,条件为95 ℃ 5秒,60 ℃ 30秒。定量分析采用2-ΔΔCt方法。
1.2.3 酿酒酵母耐受性及细胞存活率的测定
将待测菌株接入含5 mLYEPD培养基的试管中,30 ℃,180 r/min摇床培养12 h后转接300~500 μL菌液至新鲜的YEPD培养基中培养4 h至对数中期。调节菌液浓度,保证所有初始菌体浓度一致。
1.2.3.1 耐受性的测定
按照菌液浓度依次递减的顺序,每个浓度取2 μL的菌液整齐的滴于固体培养基平板上,置于30 ℃恒温培养箱中培养24~72 h,观察菌体的生长,比较不同菌株的耐受情况。
紫外耐受性:实验组用254 nm紫外灯处理90 s,对照组不做处理;高温耐受性:100 μL实验组和对照组菌液分别于1.5 mL离心管中,实验组55 ℃水浴5 min热激处理,对照组不做任何处理;4-NQO、高盐、乙醇、乙酸耐受性:分别含有适量4-NQO、8% NaCl、10%乙醇、0.4%乙酸的YEPD培养基平板。
1.2.3.2 存活率的测定
紫外胁迫存活率:紫外处理过的菌液取10-4浓度的菌液100 μL涂布于YPD平板上,每个样品涂布3个平行,未用紫外处理的菌液取10-5浓度的菌液涂布,同样每个样品涂布3个平行;4-NQO存活率:取10-4浓度的菌液100 μL涂布于含4-NQO的YPD平板上,取10-5浓度的菌液涂布于YPD平板上,同样每个都涂布3个平行。30 ℃培养1~4 d,长出单菌落,然后计数。按照公式(1)计算细胞存活率:
(1)
式中:X,酵母胁迫处理后的细胞存活率,%;CA,胁迫处理后的细胞存活数的平均值;CB,未处理YEPD板上的总细胞数的平均值。
1.2.4 生长曲线的测定
利用全自动生长曲线分析仪检测出发菌株与重组菌株的生长曲线,具体操作参考葛峻伶等[18]的方法。
1.2.5 发酵力的测定
等量菌液接入无菌含杜氏管的试管中,杜氏小管需充满培养基,不可有气泡,于30 ℃恒温培养箱中培养,每个小时观察1次,记录菌株的产气情况。
2 结果与分析
2.1 重组菌株的构建
重组表达盒中包含目的基因的上游同源臂BA与下游同源臂BB。通过酵母同源重组机制,重组表达盒能够整合至目的基因位点处,从而实现基因的敲除或过表达。基因GAL80和HTX16作为酿酒酵母高表达位点,其缺失并不会对菌株的生长以及基本性能产生影响,因此选择GAL80和HXT16作为菌株的过表达位点[19]。以RAD16基因为例,根据敲除和过表达后的酵母基因组序列,设计上下游引物,以阳性转化子与出发菌株a45的基因组为模板进行PCR验证,敲除和过表达验证结果如图1和图2所示。
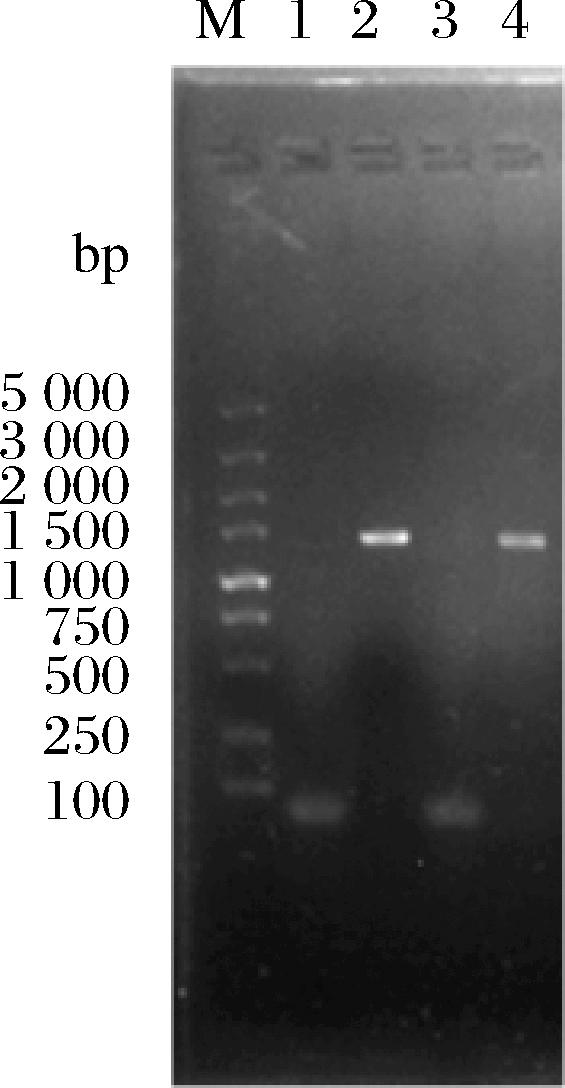
图1 重组菌株a45ΔRAD16的PCR验证
Fig.1 The PCR verification of the mutant a45ΔRAD16
注:M:DL5000 Marker;1:a45为模板,引物为Δ16A-K-F/Δ16A-K-R,无条带;2:a45ΔRAD16为模板,引物为Δ16A-K-F/Δ16A-K-R,长度为1 302 bp;3:a45为模板,引物为Δ16K-B-F/Δ16K-B-R,无条带;4:a45ΔRAD16为模板,Δ16K-B-F/Δ16K-B-R为引物,长度为1 367 bp。
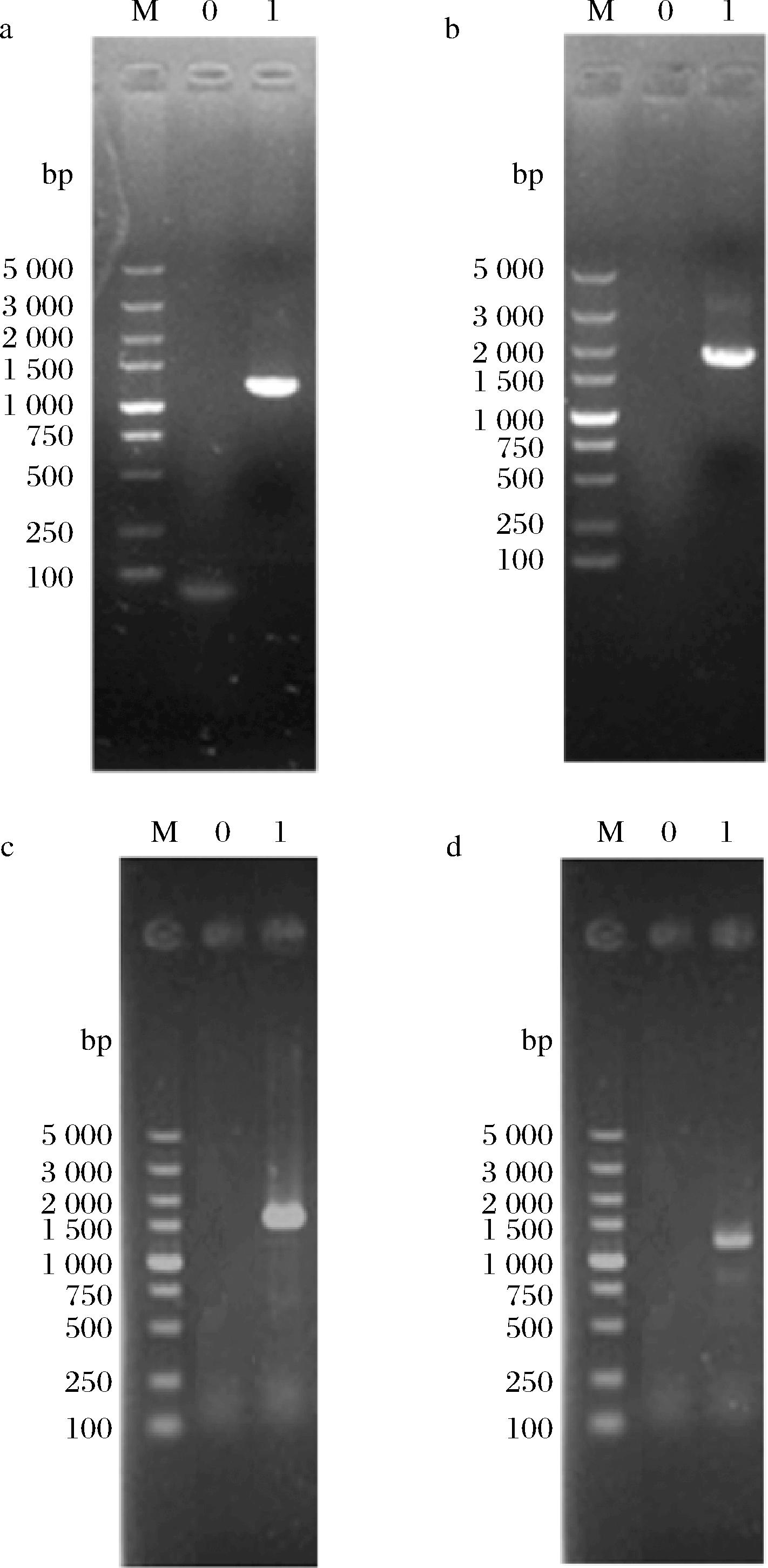
图2 重组菌株a45::RAD16的PCR验证
Fig.2 The PCR verification of the mutant a45::RAD16
注:a图中:M:DL5000 Marker,0:以a45为模板,无条带,1:以a45::RAD16为模板,引物为R1-F/R1-R,长度为1 230 bp;b图中:M:DL5000 Marker,0:以a45为模板,无条带,1:以a45::RAD16为模板,引物为U4-F/U4-R,长度为1 881 bp;C图中:M:DL5000 Marker,0:以a45为模板,无条带,1:以a45::RAD16为模板,引物为P-R16-F/P-R16-R,长度为1 476 bp;d图中:M:DL5000 Marker,0:以a45为模板,无条带,1:以a45::RAD16为模板,引物为R16-K-F/R16-K-R,长度为1 134 bp。
由图1和图2可知,以重组菌株为模板时,能够扩增出单一明亮的条带,且长度与预期一致;以出发菌株a45基因组为模板则无法扩增出条带。验证结果表明重组盒已经成功替代了目的基因,实现了RAD16基因的敲除和过表达。
2.2 RAD16、RAD7、RAD23和RAD4基因过表达对酿酒酵母耐受性的影响
大量文献报道UV照射引起的DNA损伤主要通过NER途径修复[20-22]。但NER途径与酿酒酵母高渗、乙醇、乙酸等耐受性是否有联系并没有报道。因此,探究了过表达基因RAD16、RAD7、RAD4和RAD23对酿酒酵母对UV、4-NQO、乙醇、乙酸、高温和高渗等胁迫因子的耐受性。结果如图3所示,培养基中加入8%NaCl后,菌株的生长性能受到抑制,但重组菌株的生长性能优于菌株a45、a45ΔGAL80和a45ΔGAL80ΔHXT16。说明RAD16、RAD7、RAD23和RAD4基因参与了高渗胁迫响应。但组合过表达的重组菌株作用并没有叠加,可能是因为在响应酿酒酵母高渗胁迫过程中并没有协同作用或核酸切除修复只是在众多响应机制中起到部分作用,且参与核酸切除修复的蛋白种类多,过表达其中几种,并没有加强整个修复途径的作用。此外,用NaCl处理后,出发菌株a45中RAD16、RAD7、RAD23和RAD4基因相对表达量显著提高,结果如图4所示,分别提高了6、5、3.3、3.6倍左右,由此可进一步推测基因RAD16、RAD7、RAD23和RAD4参与了酿酒酵母高渗胁迫响应机制。相反,在UV、4-NQO、乙醇、乙酸和高温等胁迫因子存在的条件下,重组菌株a45::RAD16、a45::RAD7、a45::RAD4、a45::RAD23、a45::RAD16::RAD7及a45::RAD23::RAD4和出发菌株没有明显差异,但文献报道在拟南芥中过表达酵母RAD7基因的同源基因具有较高的抗紫外线能力[23],推测可能因为植物的修复机制与酵母有所差异。
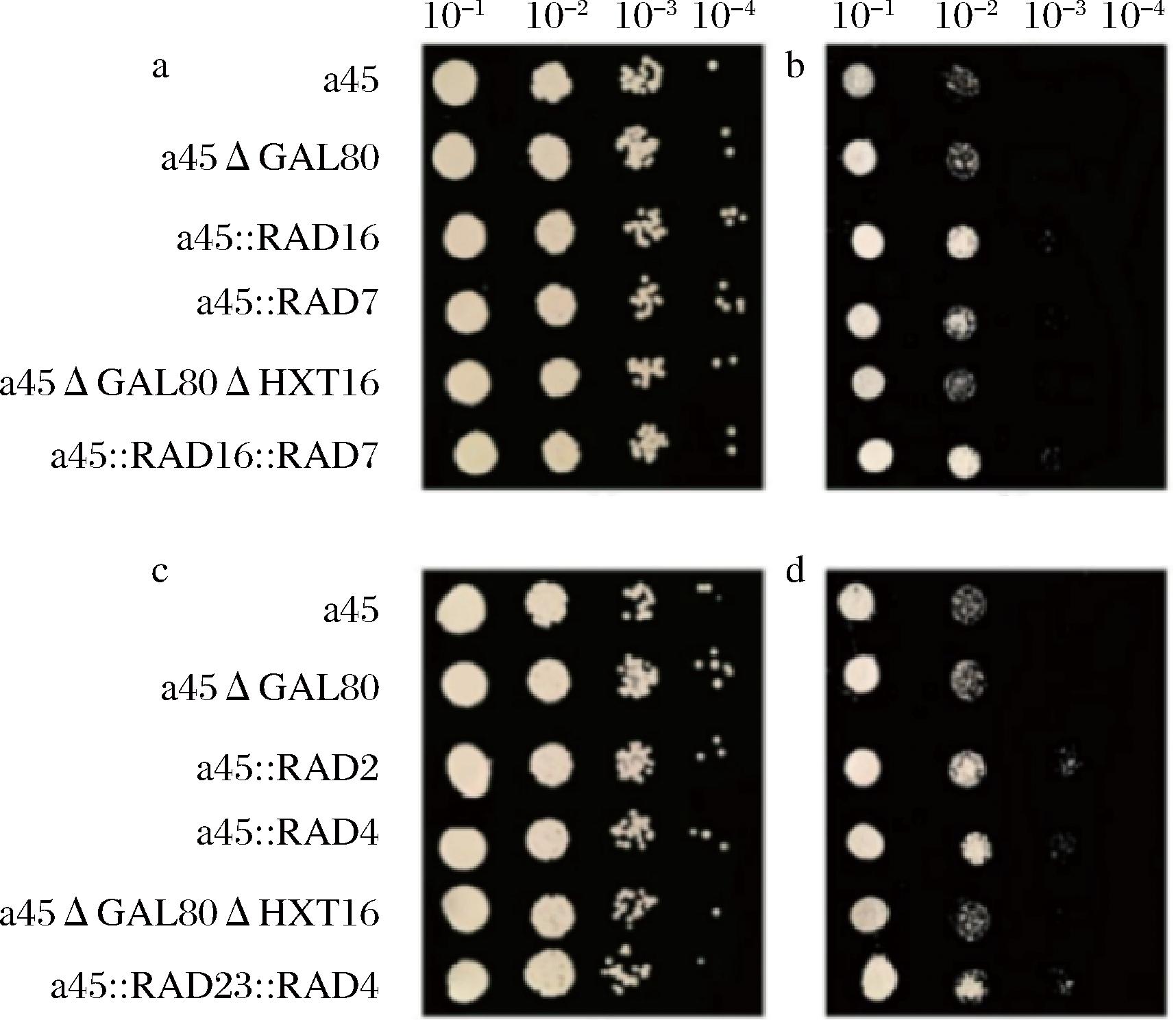
a-RAD16、RAD7基因过表达菌株在无胁迫条件下的生长性能;b-RAD16、RAD7基因过表达菌株在8%NaCl胁迫条件下的生长性能;c-RAD23、RAD4基因过表达菌株在无胁迫条件下的生长性能;d-RAD23、RAD4基因过表达菌株在8%NaCl胁迫条件下的生长性能
图3 RAD16、RAD7、RAD23和RAD4基因过表达对菌株耐渗性能的影响
Fig.3 Effect of overexpression of RAD16、RAD7、RAD23 and RAD4 genes on tolerance to osmotic stress of strains
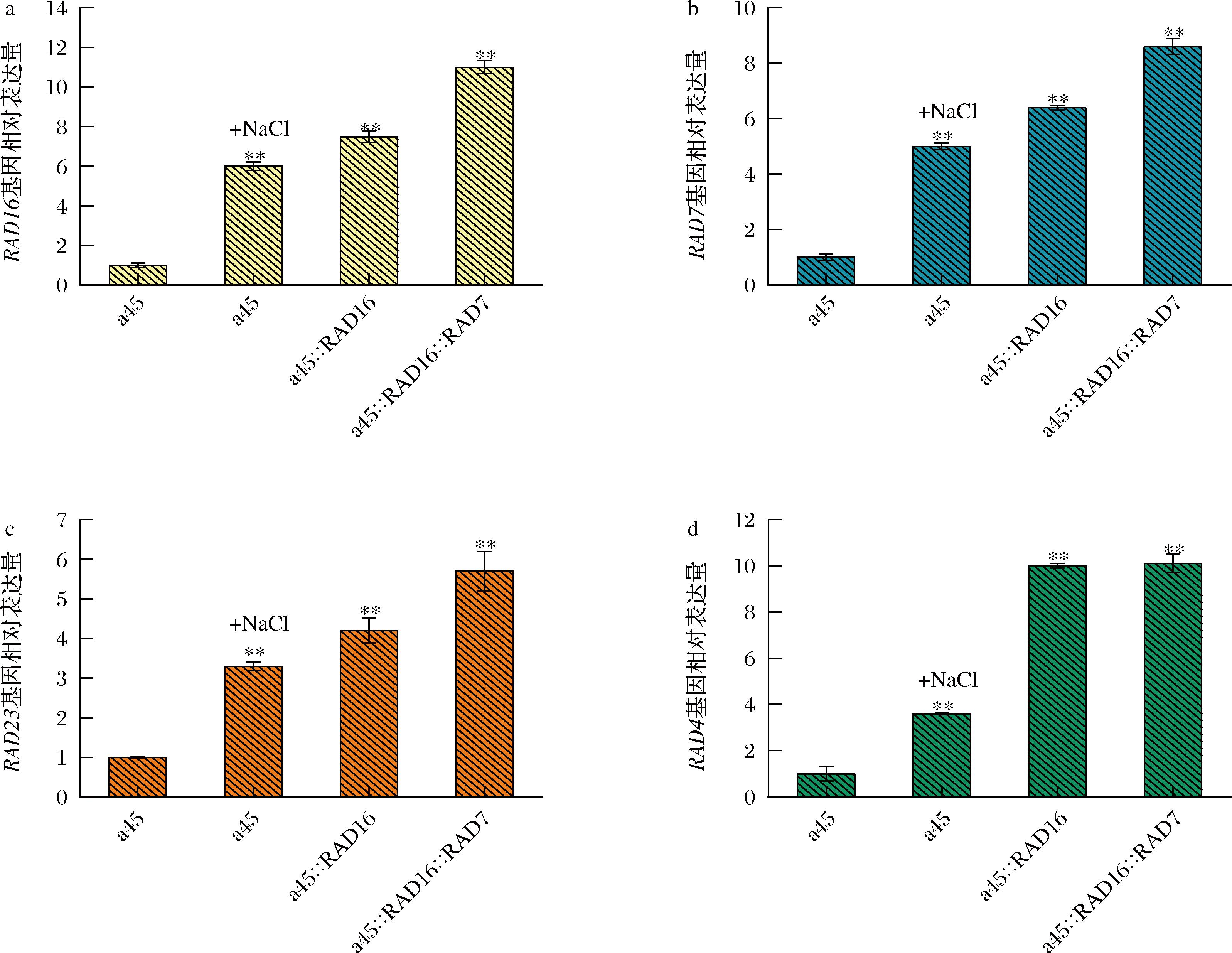
a-菌株a45、a45在8%NaCl胁迫下、a45::RAD16和a45::RAD16::RAD7中RAD16相对表达量;b-菌株a45、a45在8%NaCl胁迫下、a45::RAD7和a45::RAD16::RAD7中RAD7相对表达量;c-菌株a45、a45在8%NaCl胁迫下、a45::RAD23和a45::RAD23::RAD4中RAD23相对表达量;d-菌株a45、a45在8%NaCl胁迫下、a45::RAD4和a45::RAD23::RAD4中RAD相对表达量
图4 菌株RAD16、RAD7、RAD23、RAD4相对表达量
Fig.4 The relative expression levels of strains RAD16、RAD7、RAD23 and RAD4
注:*表示P< 0.05,**表示P< 0.01,n=3,P值根据突变株和亲本菌株计算得出。
为了进一步探讨对高渗耐受性的影响,在8% NaCl条件下进行了杜氏管发酵和生长曲线的测定。耐渗杜氏管发酵结果如表2所示,在8% NaCl胁迫下,所有菌株的产气能力明显受到抑制,菌株a45、a45ΔGAL80和a45ΔGAL80ΔHXT16在18 h开始产气,在21 h时杜氏管有1/2气体,而重组菌株a45::RAD16、a45::RAD7、a45::RAD23、a45::RAD16::RAD7和a45::RAD23::RAD4在15 h开始产气,21 h杜氏管已经充满气体,菌株a45::RAD4在16 h开始产气,21 h杜氏管有3/4气体。说明在8% NaCl胁迫条件下过表达RAD16、RAD7、RAD23和RAD4基因提高了a45生长性能,推断a45::RAD16、a45::RAD7、a45::RAD23、a45::RAD16::RAD7和a45::RAD23::RAD4的生长性能和产酒精能力优于a45、a45ΔGAL80和a45ΔGAL80ΔHXT16。组合过表达菌株并没有达到更优结果,与图3结果一致,进一步说明在高渗胁迫响应中可能没有协同作用。8% NaCl胁迫条件下的生长曲线也验证了这一结果,如图5、图6所示,进一步说明过表达RAD16、RAD7、RAD4、RAD23提高了a45对NaCl的耐受性,且并未对菌株的基本生长性能产生影响。

a-菌株a45、a45ΔGAL80、a45::RAD16、a45::RAD7在无胁迫条件下的生长曲线;b-菌株a45、a45ΔGAL80、a45::RAD16、a45::RAD7在8%NaCl胁迫条件下的生长曲线;c-菌株a45、a45ΔGAL80ΔHXT16、a45::RAD16::RAD7在无胁迫条件下的生长曲线;d-菌株a45、a45ΔGAL80ΔHXT16、a45::RAD16::RAD7在8%NaCl胁迫条件下的生长曲线
图5 过表达RAD16和RAD7基因对菌株生长性能的影响
Fig.5 Effects of overexpression of RAD16 and RAD7 genes on growth performance of strains
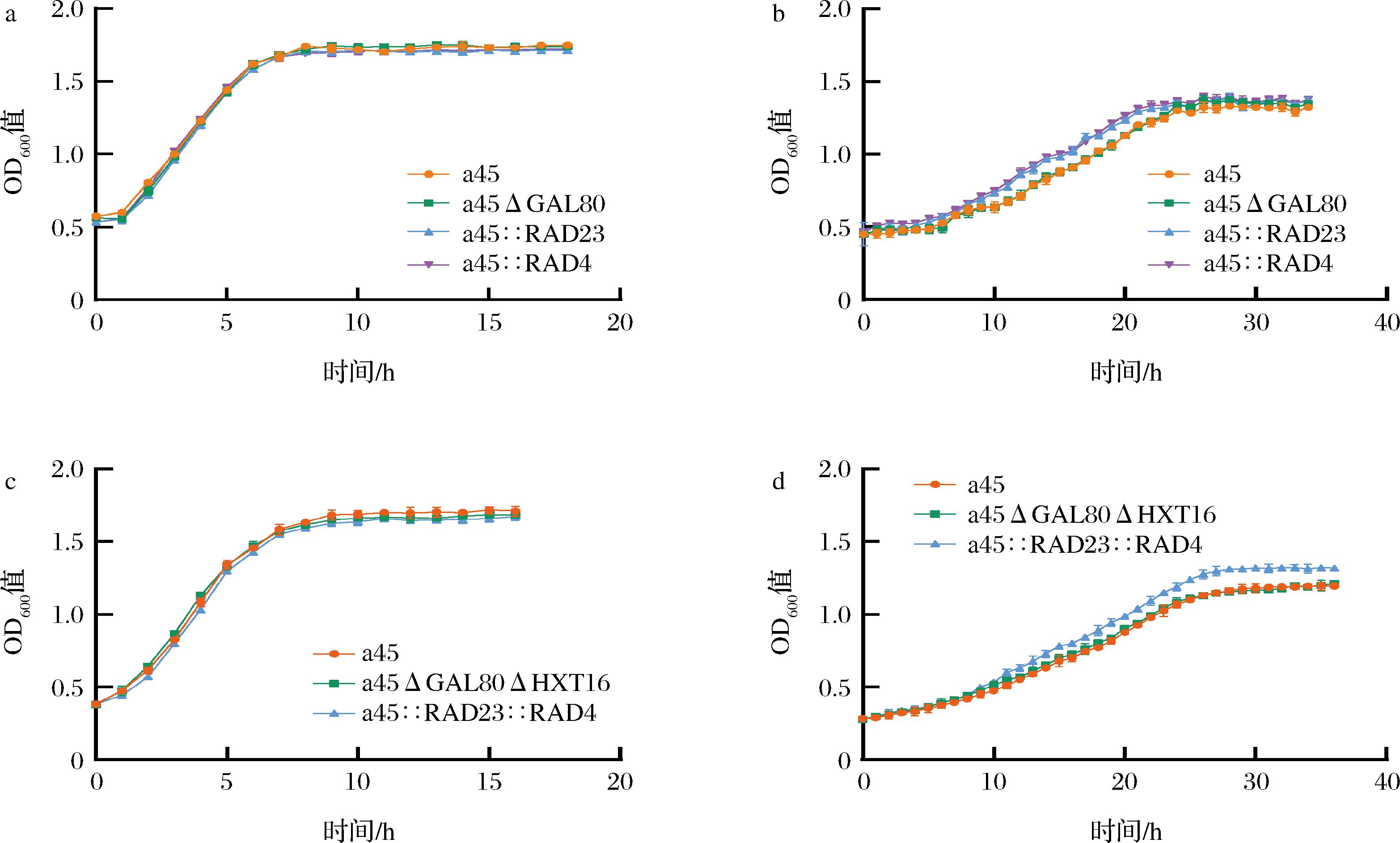
a-菌株a45、a45ΔGAL80、a45::RAD23、a45::RAD4在无胁迫条件下的生长曲线;b-菌株a45、a45ΔGAL80、a45::RAD23、a45::RAD4在8%NaCl胁迫条件下的生长曲线;c-菌株a45、a45ΔGAL80ΔHXT16、a45::RAD23::RAD4在无胁迫条件下的生长曲线;d-菌株a45、a45ΔGAL80ΔHXT16、a45::RAD23::RAD4在8%NaCl胁迫条件下的生长曲线
图6 过表达RAD23和RAD4基因对菌株生长性能的影响
Fig.6 Effects of overexpression of RAD23 and RAD4 genes on growth performance of strains
表2 杜氏小管发酵产气情况
Table 2 Gas production of Duchenne tubule fermentation

菌株对照8%NaCl5 h6 h7 h8 h9 h15 h16 h17 h18 h19 h20 h21 ha45+++++++++++---+++++++a45ΔGAL80+++++++++++---++++++a45ΔGAL80ΔHXT16+++++++++++---++++++a45::RAD16+++++++++++++++++++++++++++a45::RAD7+++++++++++++++++++++++++++a45::RAD16::RAD7+++++++++++++++++++++++++++a45::RAD23+++++++++++++++++++++++++++a45::RAD4+++++++++++-+++++++++++++a45::RAD23::RAD4+++++++++++++++++++++++++++
注:“-”表示杜氏小管中没有气体,“+”表示产气,“++”表示产1/2气体,“+++”表示3/4气体,“++++”表示杜氏小管中充满气体(下同)。
2.3 过表达巴氏醋酸杆菌UVRA基因对酿酒酵母耐受性的影响
有研究报道巴氏醋杆菌(Acetobacter pasteurii)UVRA基因参与细菌NER途径,对其乙酸耐受性有直接作用,且通过基因工程手段在大肠杆菌中过表达巴氏醋杆菌的UVRA基因,发现其对于提高菌体的乙酸耐受性也有一定的作用[24]。研究发现UvrA蛋白对清除UV诱导的DNA损伤有重要作用,CAPPA等[15]报道了UVRA基因在瑞士乳杆菌(Lactobacillus helveticus)细胞抗氧化应激中的作用,同时表明UVRA基因还参与了紫外线照射引起的DNA损伤的修复和酸的适应性反应。UvrA蛋白是细菌在NER过程中最初的DNA损伤感应蛋白,可提高细菌对酸、氧化、高温及低pH的耐受性,鉴于UVRA基因对细菌耐受性提高发挥的重要作用,将外源基因UVRA引入到酿酒酵母可能对于选育优良耐受性能的酿酒酵母有极大的推动作用。目前尚未有相关文献报道UVRA基因与酿酒酵母耐受性之间的关系。因此该部分实验在酿酒酵母AY12的单倍体a45中引入外源基因UVRA,从而进一步阐明UVRA基因与酵母耐受性的关系。
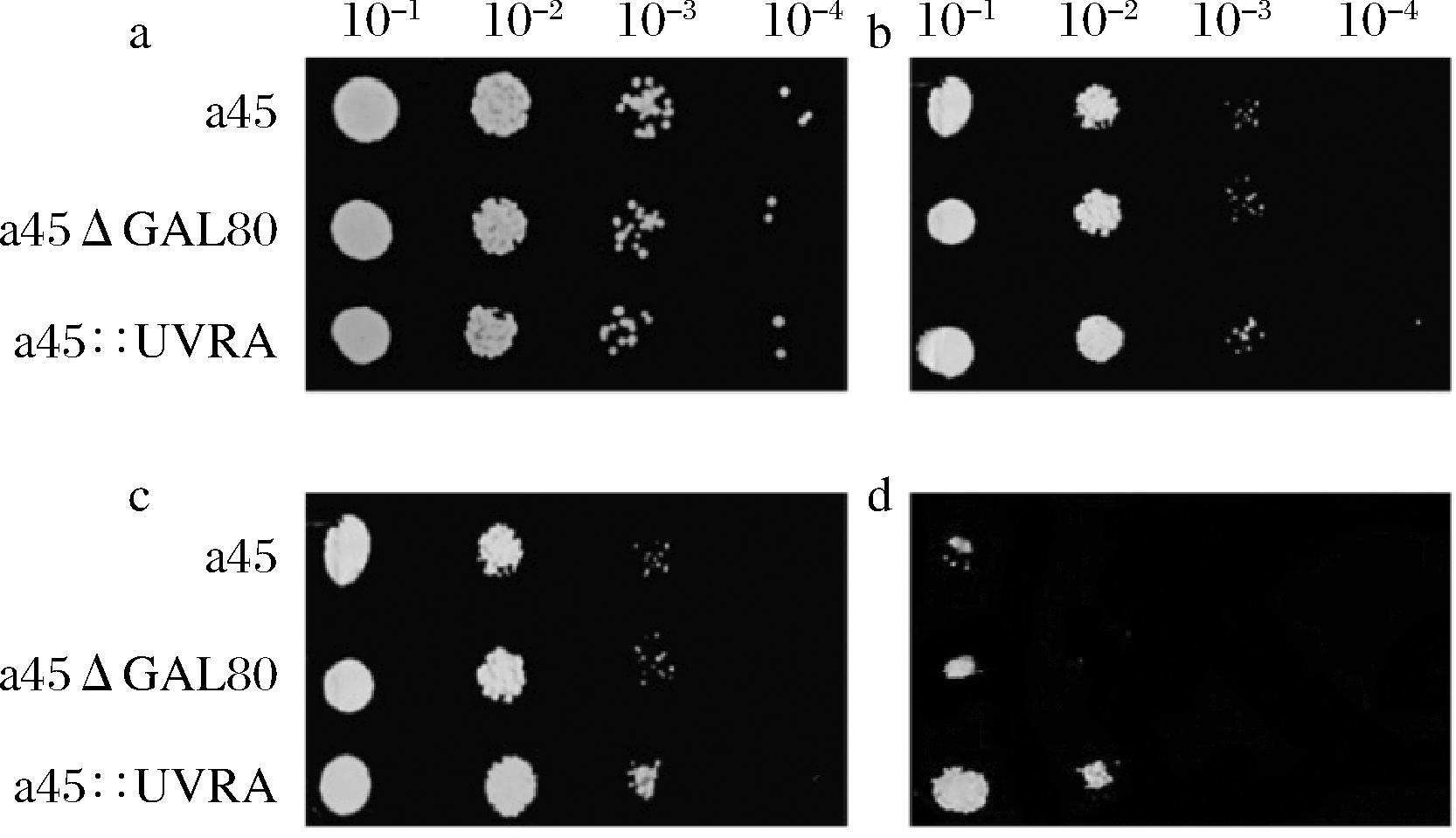
如图7-a所示,未用UV照射时,重组菌株与出发菌株的生长性能基本一致。用UV照射90 s后,a45::UVRA菌株的生长性能与a45、a45ΔGAL80菌株有细微差异,进一步发现存活率提高了1倍左右,如图7-b所示。说明UVRA基因在酿酒酵母中过表达降低了细胞对UV照射的敏感度。文献报道基因UVRA与细菌紫外敏感度、抗氧化、耐酸、耐盐及温度胁迫等有关[15,25],因此本实验随后探究了UVRA基因在酿酒酵母中过表达是否会对酵母的其他耐受性产生影响。研究结果表明重组菌株在H2O2、4-NQO、乙酸、乙醇和高温等胁迫条件下的生长性能与出发菌株相比并无明显差异,如图8所示。但在NaCl胁迫条件下,结果相对稳定,在7%、8%和9%NaCl条件下所有菌株生长都受到抑制,并且随着浓度的增大,抑制作用更加明显,如图9所示。但胁迫条件下a45::UVRA的生长性能优于a45和a45ΔGAL80,在8%和9% NaCl条件下更为明显,重复多次实验得到同样结果,说明UVRA基因和高渗胁迫应激反应或其他影响之间存在一定联系。
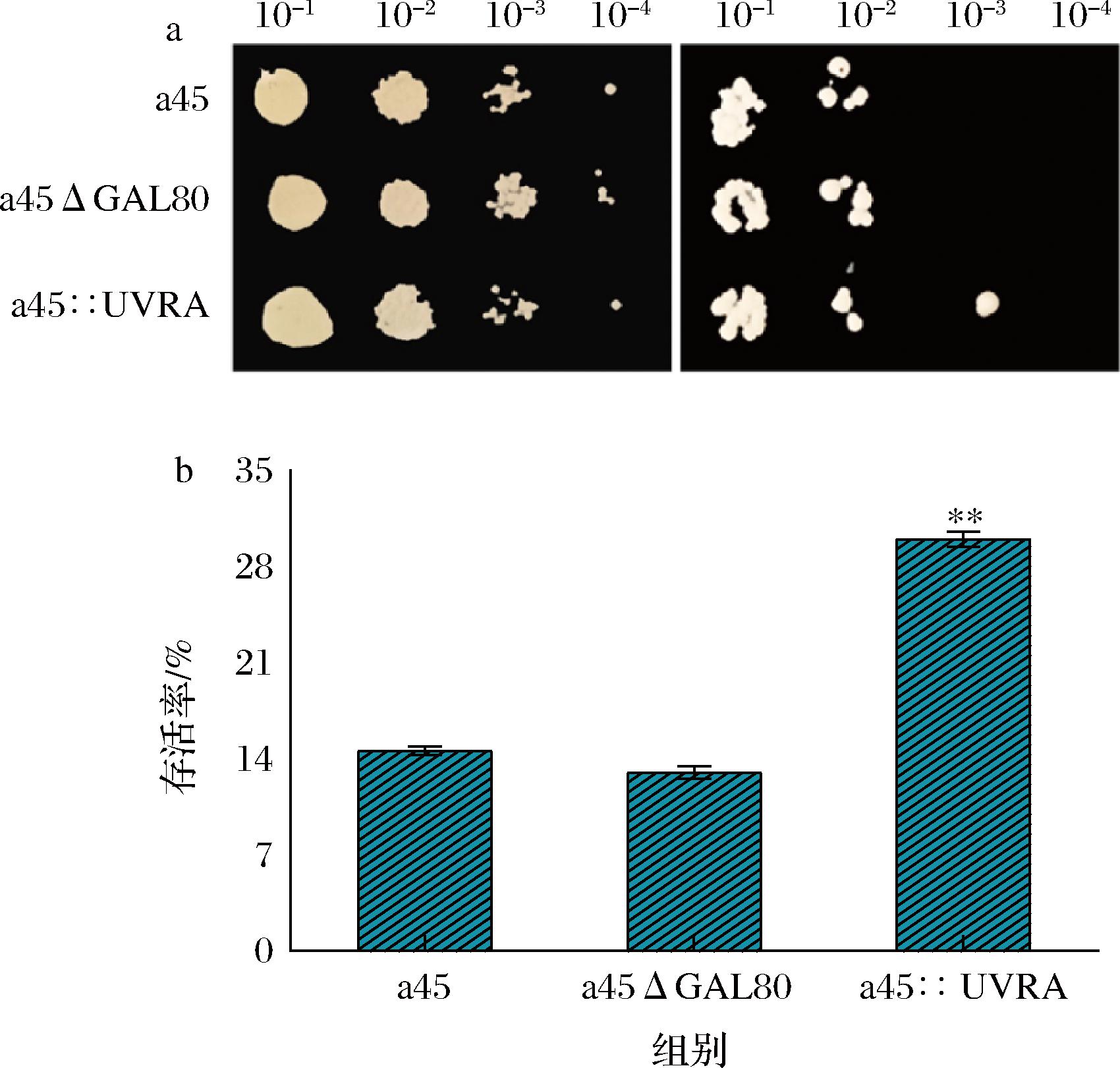
a-UV照射后重组菌株与出发菌株耐受性点板图;b-UV照射后重组菌株与出发菌株的存活率
图7 UVRA过表达菌株在UV辐射下的生长性能
Fig.7 Growth performance of UVRA overexpressing strains under UV radiation
注:*P<0.05,**P<0.01,n=3,P值根据突变株和亲本菌株计算得出。

a-对照;b-5 mmol/L H2O2胁迫; c-0.8 μg/mL 4-NQO胁迫; d-对照; e-0.4%乙酸胁迫; f-10%乙醇胁迫;g-对照;h-42 ℃恒温培养4 d;i-42 ℃恒温培养4 d
图8 过表达UVRA对菌株耐受性能的影响
Fig.8 Effect of overexpression of UVRA on tolerance of strains
a-对照; b-7%NaCl胁迫;c-8%NaCl胁迫;d-9%NaCl胁迫
图9 过表达UVRA对菌株耐渗性能的影响
Fig.9 Effect of overexpression of UVRA on tolerance to osmotic stress of strains
通过杜氏管发酵实验来进一步解析酿酒酵母的生长性能和产酒精的能力。图9表明在平板上菌株a45::UVRA在NaCl胁迫条件下的生长能力优于酿酒酵母a45和重组菌株a45ΔGAL80,且在8%NaCl和9%NaCl条件下作用最为明显,由于9%NaCl胁迫下菌株生长时间较长,因此选择8%NaCl作为杜氏管发酵的胁迫条件,实验结果见表3。结果表明在不加胁迫的培养基中,所有菌株生长良好,重组菌株的产气能力并未受到影响。在8%NaCl胁迫下,所有菌株的产气能力受到明显抑制,a45::UVRA在16 h左右才开始产气,而a45和a45ΔGAL80在18 h左右才开始产气,在21 h时菌株a45::UVRA杜氏管已充满气体,而a45和a45ΔGAL80只充满一半左右的气体,表明过表达UVRA基因使酵母菌株在8%NaCl胁迫条件下产气能力有所提高,推断a45::UVRA的生长性能和产酒精能力都优于a45和a45ΔGAL80。
表3 杜氏小管发酵产气情况
Table 3 Gas production of Duchenne tubule fermentation
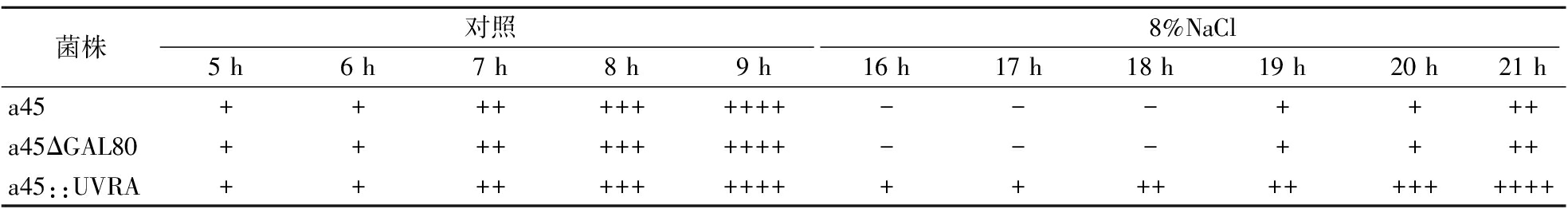
菌株对照8%NaCl5 h6 h7 h8 h9 h16 h17 h18 h19 h20 h21 ha45+++++++++++---++++a45ΔGAL80+++++++++++---++++a45::UVRA++++++++++++++++++++++++
为了进一步测定重组菌株的生长性能,比较NaCl胁迫条件下菌株的生长性能差异,根据1.2.4节所示方法进行了生长曲线的测定,结果如图10所示。在不加NaCl胁迫的YEPD培养基中,重组菌株的生长性能和出发菌株相比并无明显改变(图10-a),在7%、8%和9%NaCl处理的条件下,菌株生长都受到抑制,随着NaCl浓度的增大,菌株达到稳定期所需的时间更长(图10-b~图10-d)。并且发现在3个浓度条件下a45::UVRA在稳定期的OD600值相对较高,说明其生长能力优于a45和a45ΔGAL80,而a45和a45ΔGAL80的生长能力基本一致。这表明UVRA基因的过表达提高了酿酒酵母a45对高渗胁迫的耐受性,这与文献中UVRA基因的过表达提高了Lactococcus lactis对高渗胁迫的耐受性[25]结果一致,但UVRA基因与NaCl耐受性关联机制有待进一步研究。
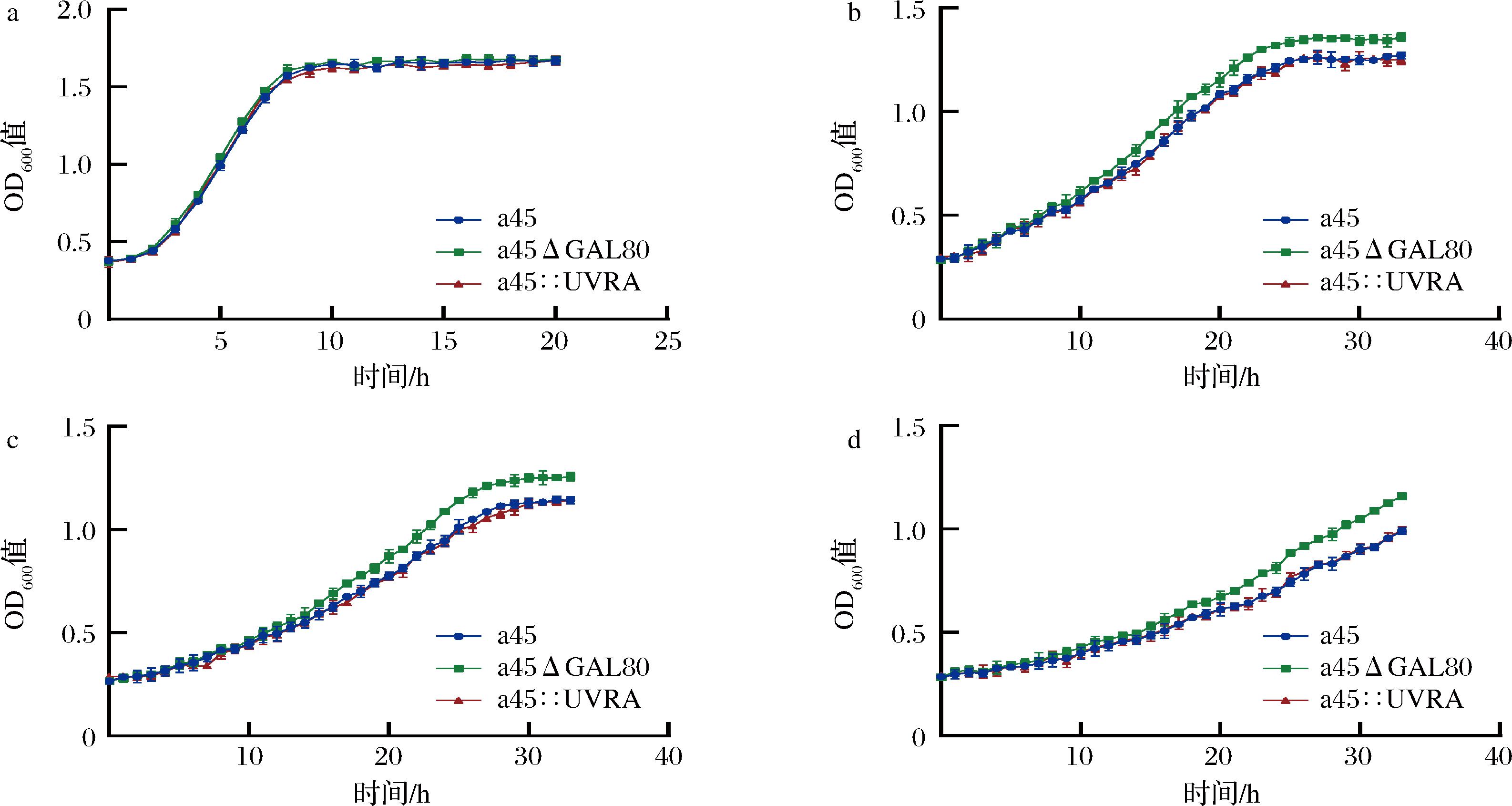
a-对照;b-7%NaCl胁迫;c-8%NaCl胁迫;d-9%NaCl胁迫
图10 过表达UVRA对菌株生长性能的影响
Fig.10 Effects of overexpression of UVRA on growth performance of strains
3 结论与讨论
本课题主要研究核酸切除修复相关基因对酿酒酵母耐受性的影响,以实验室菌株酿酒酵母AY12单倍体a45为出发菌株,通过基因工程手段获得系列重组菌株,进行重组菌株与出发菌株的耐受性能的比较。RT-PCR结果发现酿酒酵母a45在用NaCl处理后,RAD16、RAD7、RAD23和RAD4基因相对表达量分别提高了5.5、5、3.3、3.6倍,说明它们与酿酒酵母高渗胁迫响应机制有关联,且进一步实验结果表明这些基因的过表达提高了酿酒酵母a45对高渗胁迫的耐受性以及在高渗条件下的产酒精能力。但NER途径如何影响酿酒酵母高渗应激反应,这个途径中还有哪些元件参与其中还需更深入的研究。
过表达UVRA基因可以降低酿酒酵母对紫外的敏感度,UV照射后,梯度稀释点板效果并不显著,但存活率提高了1倍左右。同时UVRA基因的过表达也提高了酿酒酵母的高渗耐受性,ZHENG等[26]过表达UVRA使得一些乙醇氧化、TCA循环和分子伴侣的酶被上调,以改善醋酸发酵。因此,猜测这可能是由于UVRA的过表达导致基因组完整性的增加,一些涉及偏振膜、钠离子外排和液泡钠离子隔离的机制增强、与渗透应激有关的基因及其编码的酶被上调有关[27],从而改善了酿酒酵母的高渗耐受性。本研究基于酿酒酵母复杂多变的发酵环境及核酸切除修复途径与细菌和酵母耐受性的关系,探究了核酸切除修复基因对酿酒酵母耐受性的影响,提高了酿酒酵母的高渗耐受性,在一定程度上为研究酿酒酵母耐受性机制提供新的思路和理论基础。
[1] 白逢彦. 走出中国:酿酒酵母的起源、驯养与演化[J].微生物学报, 2023, 63(5):1748-1770.
BAI F Y.Out of China:Origin, domestiction and evolution of Saccharomyces cerevisiae[J].Acta Microbiologica Sinica, 2023, 63(5):1748-1770.
[2] MORARD M, MAC AS L G, ADAM A C, et al.Aneuploidy and ethanol tolerance in Saccharomyces cerevisiae[J].Frontiers in Genetics, 2019, 10:82.
AS L G, ADAM A C, et al.Aneuploidy and ethanol tolerance in Saccharomyces cerevisiae[J].Frontiers in Genetics, 2019, 10:82.
[3] YONA A H, MANOR Y S, HERBST R H, et al.Chromosomal duplication is a transient evolutionary solution to stress[J].Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(51):21010-21015.
[4] CUI D Y, LIU L, SUN L J, et al.Genome-wide analysis reveals Hsf1 maintains high transcript abundance of target genes controlled by strong constitutive promoter in Saccharomyces cerevisiae[J].Biotechnology for Biofuels and Bioproducts, 2023, 16(1):72.
[5] 刘欢, 杨宇纯, 刘超, 等.酿酒酵母氧化胁迫应答反应机制[J].生物资源, 2019, 41(4):298-304.
LIU H,YANG Y C,LIU C, et al.Advances in response mechanism of saccharomyces cerevisiae to oxidative stress[J].Biotic Resources, 2019, 41(4):298-304.
[6] STRATFORD M, NEBE-VON-CARON G, STEELS H, et al.Weak-acid preservatives:pH and proton movements in the yeast Saccharomyces cerevisiae[J].International Journal of Food Microbiology, 2013, 161(3):164-171.
[7] DING J, HOLZWARTH G, BRADFORD C S, et al.PEP3 overexpression shortens lag phase but does not alter growth rate in Saccharomyces cerevisiae exposed to acetic acid stress[J].Applied Microbiology and Biotechnology, 2015, 99(20):8667-8680.
[8] CHATTERJEE N, WALKER G C.Mechanisms of DNA damage, repair, and mutagenesis[J].Environmental and Molecular Mutagenesis, 2017, 58(5):235-263.
[9] ATAIAN Y, KREBS JE.Five repair pathways in one context:Chromatin modification during DNA repair[J].Biochemistry and Cell Biology, 2006, 84(4):490-504.
[10] GUZDER S N, SUNG P, PRAKASH L, et al.The DNA-dependent ATPASE activity of yeast nucleotide excision repair factor 4 and its role in DNA damage recognition[J].Journal of Biological Chemistry, 1998, 273(11):6292-6296.
[11] REED S H.Nucleotide excision repair in chromatin:The shape of things to come[J].DNA Repair, 2005, 4(8):909-918.
[12] MUELLER J P, SMERDON M J.Rad23 is required for transcription-coupled repair and efficient overrall repair in Saccharomyces cerevisiae[J].Molecular and Cellular Biology, 1996, 16(5):2361-2368.
[13] BATTY D P, WOOD R D.Damage recognition in nucleotide excision repair of DNA[J].Gene, 2000, 241(2):193-204.
[14] JANION C.Some aspects of the SOS response system-a critical survey[J].Acta Biochimica Polonica, 2001, 48(3):599-610.
[15] CAPPA F, CATTIVELLI D, COCCONCELLI P S.The uvrA gene is involved in oxidative and acid stress responses in Lactobacillus helveticus CNBL1156[J].Research in Microbiology, 2005, 156(10):1039-1047.
[16] YAMAMOTO N, KATO R, KURAMITSU S.Cloning, sequencing and expression of the uvrA gene from an extremely thermophilic bacterium, Thermus thermophilus HB8[J].Gene, 1996, 171(1):103-106.
[17] 张梦汝. DNA修复蛋白RecO及亮氨酸代谢对乳酸菌多种胁迫抗性的影响[D].无锡:江南大学, 2014.
ZHANG M R.The effect of DNA repair protein RecO and leucine metabolism on the tolerance of lactic acid bacteria to multiple stresses[D].Wuxi:Jiangnan University, 2014.
[18] 葛峻伶, 郭莹, 刘小二, 等.一次敲除BAT2同时过表达Lg-ATF1对啤酒酵母产醇酯的影响[J].现代食品科技, 2019, 35(6):171-176;272.
GE J L, GUO Y, LIU X E, et al.Effect of BAT2 deletion with Lg-ATF1 overexpression on the production of higher alcohols and ester in brewer's yeast[J].Modern Food Science and Technology, 2019, 35(6):171-176;272.
[19] 魏亚楠, 王金晓, 林良才, 等.适量产乙酸酯酿酒酵母菌株的选育[J].食品与发酵工业, 2021, 47(13):98-106.
WEI Y N, WANG J X, LIN L C, et al.Breeding of Saccharomyces cerevisiae strains with appropriate yield of acetate esters[J].Food and Fermentation Industries, 2021, 47(13):98-106.
[20] LETTIERI T, KRAEHENBUEHL R, CAPIAGHI C, et al.Functionally distinct nucleosome-free regions in yeast require Rad7 and Rad16 for nucleotide excision repair[J].DNA Repair, 2008, 7(5): 734-743.
[21] XIE Z W, LIU S Q, ZHANG Y B,et al.Roles of Rad23 protein in yeast nucleotide excision repair[J].Nucleic Acids Research, 2004, 32(20):5981-5990.
[22] WANG Z, WEI S, REED S H, et al.The RAD7, RAD16, and RAD23 genes of Saccharomyces cerevisiae:Requirement for transcription-independent nucleotide excision repair in vitro and interactions between the gene products[J].Molecular and Cellular Biology, 1997, 17(2):635-643.
[23] LAHARI T, LAZARO J, MARCUS J M, et al.RAD7 homologues contribute to Arabidopsis UV tolerance[J].Plant Science, 2018, 277:267-277.
[24] ZHENG Y, CHEN X J, WANG J, et al.Expression of gene uvrA from Acetobacter pasteurianus and its tolerance to acetic acid in Escherichia coli[C].Berlin:Springer, 2015.
[25] MOGHADDAM T K, ZHANG J, DU G C.UvrA expression of Lactococcus lactis NZ9000 improve multiple stresses tolerance and fermentation of lactic acid against salt stress[J].Journal of Food Science and Technology, 2017, 54(3):639-649.
[26] ZHENG Y, WANG J, BAI X L, et al.Improving the acetic acid tolerance and fermentation of Acetobacter pasteurianus by nucleotide excision repair protein UvrA[J].Applied Microbiology and Biotechnology, 2018, 102(15):6493-6502.
[27] 杜春迎, 赵辉, 赵志昌, 等.发酵工业中酿酒酵母耐性机制的研究进展[J].食品工业科技, 2012, 33(13):378-382.
DU C Y, ZHAO H, ZHAO Z C, et al.Research progress in the tolerance mechanism of Saccharomyces cerevisiae in fermentation industry[J].Science and Technology of Food Industry, 2012, 33(13):378-382.