凤爪是一种以鸡爪为原料,经加工而制成的休闲食品,富含胶原蛋白、维生素及矿物质等营养元素[1]。因其具有独特的口感及营养价值,深受人们喜爱。凤爪这类肉制品的加工工艺较为复杂,在加工过程中极易受到多种微生物污染,造成产品腐败变质。由于凤爪含有丰富的蛋白质,传统“热杀菌”技术会导致蛋白质变性,致使产品口感变差[2]。辐照技术作为一种“冷杀菌技术”(包括X射线、γ射线和电子束辐照),目前已被广泛认为是延长肉制品货架期的有效安全措施[3]。因此,目前多采用辐照技术来杀灭预包装凤爪食品中的微生物,延长产品货架期。然而辐照灭菌的效果受辐照加工工艺(辐照剂量、剂量率以及辐照源)及产品初始微生物含量、种类等因素的影响[4]。这导致即使经过辐照灭菌后,凤爪在贮藏、运输和销售过程中依然会出现胀袋、腐败变质等现象,造成大量的食物浪费和经济损失。因此系统地解析胀袋凤爪中微生物的结构,对提升产品质量,保障食品安全具有积极意义。
常见的腐败微生物分离鉴定主要依赖纯培养法,根据分离出的微生物形态、生理生化特性及分子生物学特性来确定其种属关系。张园园等[5]利用纯培养法解析胀袋红烧肉、牛排酱与番茄酱中的微生物,发现芽孢杆菌属(Bacillus)和柠檬酸杆菌属(Citrobacter)是导致红烧肉及酱料胀袋的微生物。吴海虹等[6]从胀袋泡椒凤爪中分离出了解脂耶氏酵母(Yarrowia lipolytica)。SILVA等[7]发现嗜冷梭状芽孢杆菌是导致巴西真空包装牛肉片胀袋的微生物。但培养基上可培养微生物的种类极少,估计只涉及0.001%~1%,不能正常反映样本中实际的腐败菌菌相结构[8]。近年来,随着测序技术的快速发展,高通量测序技术因其快速、准确的特点被广泛用于食品中微生物的多样性分析[9]。采用纯培养法与高通量测序技术联合的方式,能够更加准确地分析食品中的微生物多样性。张双虹等[10]利用纯培养方法结合高通量测序技术的手段分析了胀袋袋装番茄酱中的微生物多样性。王玉荣等[11]利用宏基因组测序与纯培养技术解析了胀袋生抽酱油中的菌相结构。
目前,国内外鲜有利用高通量测序技术对胀袋凤爪中菌群结构进行分析的研究。因此,本研究采用纯培养法结合高通量测序技术分析真空包装辐照胀袋的凤爪产品中的微生物多样性,对分离出的微生物进一步进行产气胀袋验证试验,明确导致凤爪腐败胀袋的微生物类型,以期为凤爪在加工过程中的微生物污染控制、辐照工艺优化、降低企业经济损失及保障食品安全提供理论依据。
1 材料与方法
1.1 材料与试剂
2022年7月收集来自某食品企业经剂量7 kGy 60CO~γ射线辐照后胀袋凤爪(A1、A2、A3),辐照后未胀袋凤爪(B1、B2、B3),生产日期均为5月,再收集一批辐照后的正常凤爪用于验证试验,生产日期为2022年11月,均由四川省原子能辐照工程中心提供,所有样品在4 ℃保藏用于后续分析;PCA、NA、MRS、VRBGA、CFC固体培养基,MRS、NB液体培养基,青岛海博生物技术有限公司;细菌基因组DNA提取试剂盒、快速DNA提取试剂盒、PCR体系,天根生化科技(北京)有限公司;引物27F/1492R、ITS1/ITS4,北京擎科生物科技股份有限公司成都分公司。
1.2 仪器与设备
拍打式无菌均质器,上海力辰仪器科技有限公司;5415R型离心机、PCR仪,德国Eppendorf公司;iBright CL1000智能成像系统,美国Thermo Fisher公司。
1.3 微生物的分离鉴定
1.3.1 微生物的分离纯化
从2组样品中分别混合称取10 g凤爪于无菌均质袋中,加入90 mL 质量浓度8.5 g/L无菌生理盐水,均质2 min,吸取1 mL样液,梯度稀释至适当浓度,分别涂布于MRS、PCA、NA、VRBGA、CFC及PDA培养基上,除PDA培养基在28 ℃下正置培养5 d,其余培养基在35 ℃下培养2 d。培养结束后,从各种平板中挑取形态、大小及颜色不同的菌落进行反复纯化,直至获得单菌落,于-80 ℃保藏菌株。
1.3.2 分子生物学鉴定
参照试剂盒的说明提取细菌及真菌的DNA,分别以27F/1492R、ITS1/ITS4为引物扩增细菌及真菌DNA片段。采用相同的PCR扩增体系及扩增程序进行扩增。PCR扩增体系为:2×Taq PCR MasterMix Ⅱ 25 μL,上、下游引物各1 μL,模板2 μL,并用ddH2O补足至50 μL。扩增程序为:94 ℃预变性 4 min,循环1次;94 ℃变性30 s,58 ℃退火30 s,72 ℃下延伸1 min,35个循环;72 ℃下稳定延伸5 min,最后在10 ℃进行保存。扩增产物以10 g/L琼脂糖进行凝胶电泳检测,合格的PCR产物委托北京擎科生物科技股份有限公司成都分公司进行测序。将测序结果提交到NCBI网站(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行BLAST比对。选取BLAST结果中同源性较高的菌的序列,使用MEGA11.0软件根据Neighbor-Joining法构建菌种系统发育树。
1.4 高通量测序及生物信息学分析
根据MagAttract® PowerSoil® Pro DNA Kit(QIAGEN,德国)的说明书从2 g剪碎的凤爪组织中抽提总DNA。利用338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rRNA基因的V3-V4可变区进行PCR扩增。检测合格的PCR产物委托上海美吉生物医药科技有限公司在Illumina Miseq PE250平台上进行高通量测序。
将测序得到的PE reads根据测序质量对双端Reads进行质控和过滤,使用Flash(V1.2.11)根据双端Reads之间的overlap关系进行拼接,获得拼接后的序列。然后用fastp(V0.20.0)软件对拼接后的原始数据进行过滤,得到高质量的序列数据。使用Uparse(V7.1)软件,根据97%的相似性对非重复序列(不包括单个序列)的操作分类单位(operational taxonomic units,OTUs)进行聚类,并在聚类过程中识别和去除嵌合体。使用RDP分类器(V2.13)对照细菌Silva数据库(V138)对每个OTU代表性序列进行物种分类注释和分析,设置置信阈值为0.7。基于OTU丰度表及OTU分类表进行后续分析。
1.5 产气胀袋验证试验
将分离到的菌株重新纯化2~3次,2~11号菌株在MRS液体培养基中35 ℃培养12 h,1号、12号、13号菌株在分别NB液体培养基中35 ℃及28 ℃培养12 h,调整菌悬液浓度为106 CFU/mL。将正常的凤爪在无菌条件下于菌悬液中浸泡10 s后,真空包装于无菌袋中,分别置于35 ℃及28 ℃下恒温培养15 d,同时以未接种的样本为空白对照,观察产品胀袋情况。
1.6 数据分析
使用MEGA 11.0软件构建系统发育树;使用R 4.2.0软件中的“vegan”,“ggplot”包进行绘图,P<0.05时,被视为差异显著。
2 结果与分析
2.1 分子生物学鉴定结果
依据菌落形态特征,总共从胀袋组样本中分离到了13株典型菌株,包括11株细菌及2株酵母,而正常组样本中未分离到菌株。利用MEGA 11软件,构建系统发育树。由细菌的系统发育树(图1)可知,1号菌株为嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia),其可以污染食品加工环境,进而引起食品的腐败变质,还可以分解利用食品中的蛋白质、脂肪、磷脂等物质,加速食品腐败[12-13]。此外,Stenotrophomonas还能形成生物膜,其特殊结构能够有效保地护菌株不受外界条件变化的影响,如消毒剂、抗生素、温度变化及辐射等[12,14]。高鹏等[15]发现S.maltophilia可引起真空包装肘花的胀袋。2号、3号、9号菌株鉴定为短乳杆菌(Lactobacillus brevis);5号、7号、10号和11号菌株为植物乳杆菌(Lactiplantibacillus plantarum);4号、6号、8号菌株为欺诈明串珠菌(Leuconostoc fallax)。L.brevis、L.plantarum及L.fallax都属于乳酸菌,是肉及肉制品中常见的腐败菌,它们通过大量繁殖,产生CO2、醛类、醇类等挥发性物质,引起食品胀袋,出现腐败变质现象[16]。GRANT等[17]分别从辐照的气调包装猪肉(1.75 kGy)及真空包装鸡肉(2.5 kGy)中分离出大量的乳酸菌。NIEMAND等[18]从2.5 kGy辐照的牛肉糜中分离出了L.plantarum及L.brevis。乳杆菌耐辐照的原因可能是因为其细胞厚度与辐射性之间存在一定的相关性以及其极强的耐酸性[18-19]。

图1 细菌系统进化树
Fig.1 Phylogenetic tree of bacteria
此外,还从中分离出了2株热带假丝酵母(Candida tropicalis)(图2)。C.tropicalis是一种食品腐败菌,同时也是条件致病菌[20],它们从胀袋组样本中被分离出来,可能来源于加工环境,但其耐辐照机理目前尚不清楚。
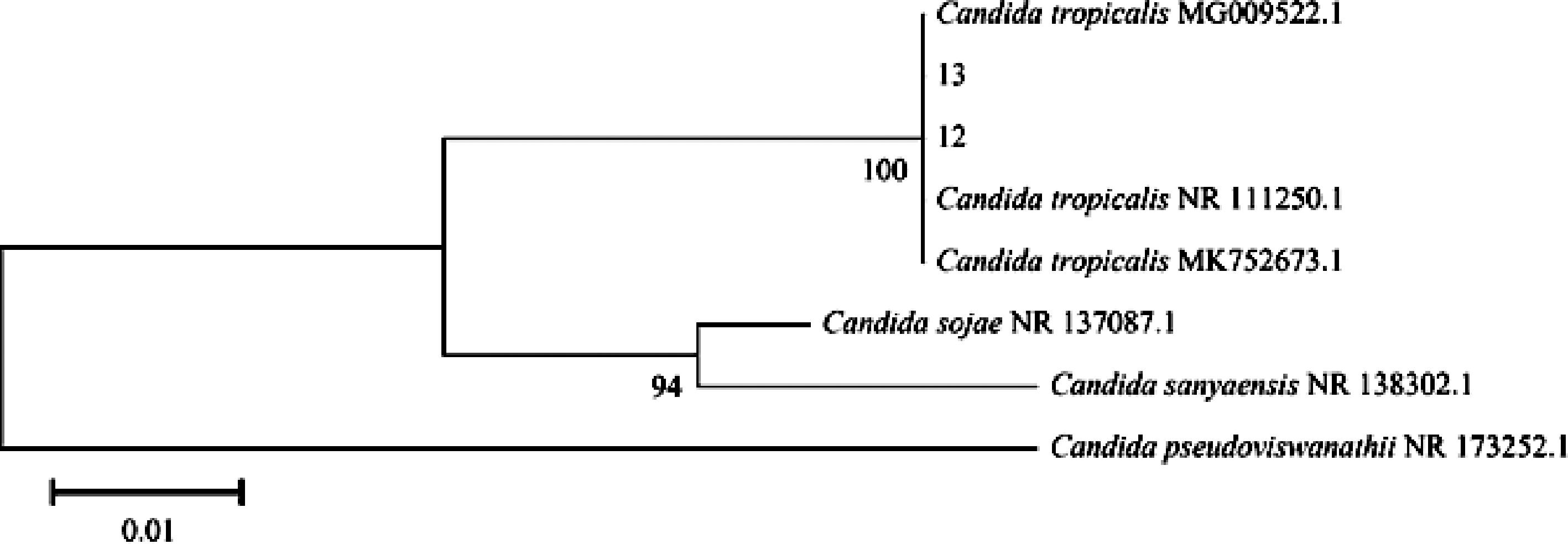
图2 真菌系统进化树
Fig.2 Phylogenetic tree of fungi
与之前的报道略有不同,杨琴[21]从胀袋的泡椒凤爪中分离出了Y.lipolytica、毕赤氏酵母(Pichia guilliermondii)、肠膜明串珠菌(Leuconostoc mesenteroides)和产玩假丝酵母(Candida utilis)4种微生物。吴海虹等[6]从胀袋泡椒凤爪中分离出了Y.lipolytica。总之,依据分子生物学方法,从胀袋的辐照凤爪中分离鉴定了5种微生物,分别为:S.maltophilia、L.brevis、L.plantarum、L.fallax及C.tropicalis。但传统的纯培养法难以进一步揭示胀袋凤爪中微生物的菌相结构,因此,需要通过高通量测序技术来进一步展示样本中微生物的群落结构变化。
2.2 高通量测序结果
2.2.1 Alpha多样性分析
图3为正常组与胀袋组中菌群的Alpha多样性指数,包括Shannon指数(A)和Chao1指数(B)。在本研究中,从2种不同种类的样品中获得了总共485 173个序列,平均长度为428 bp。原始数据经过质控过滤后,将97%相似性的序列聚类成962个OTU,基于OTU表可计算样本的Alpha多样性指数。Shannon指数可用来反映样本中的物种多样性,Chao1指数则用来评估样本中的物种丰富度,而Coverage指数则用来展示样本的文库覆盖率。2组样本的覆盖率都达到99.9%,这表明凤爪样本中几乎所有的菌群都被检测到了,能够反映样本中菌群的真实情况。正常组中细菌的Shannon指数及Chao1指数均显著(P<0.05)高于胀袋组,这表明正常组凤爪相较于胀袋组凤爪拥有更高的菌群丰富度及多样性。但随着贮藏时间的延长,由于真空包装环境的存在,一些好氧菌逐渐死亡,兼性厌氧菌快速增长繁殖,占据优势地位,从而使胀袋组样本中细菌多样性下降。
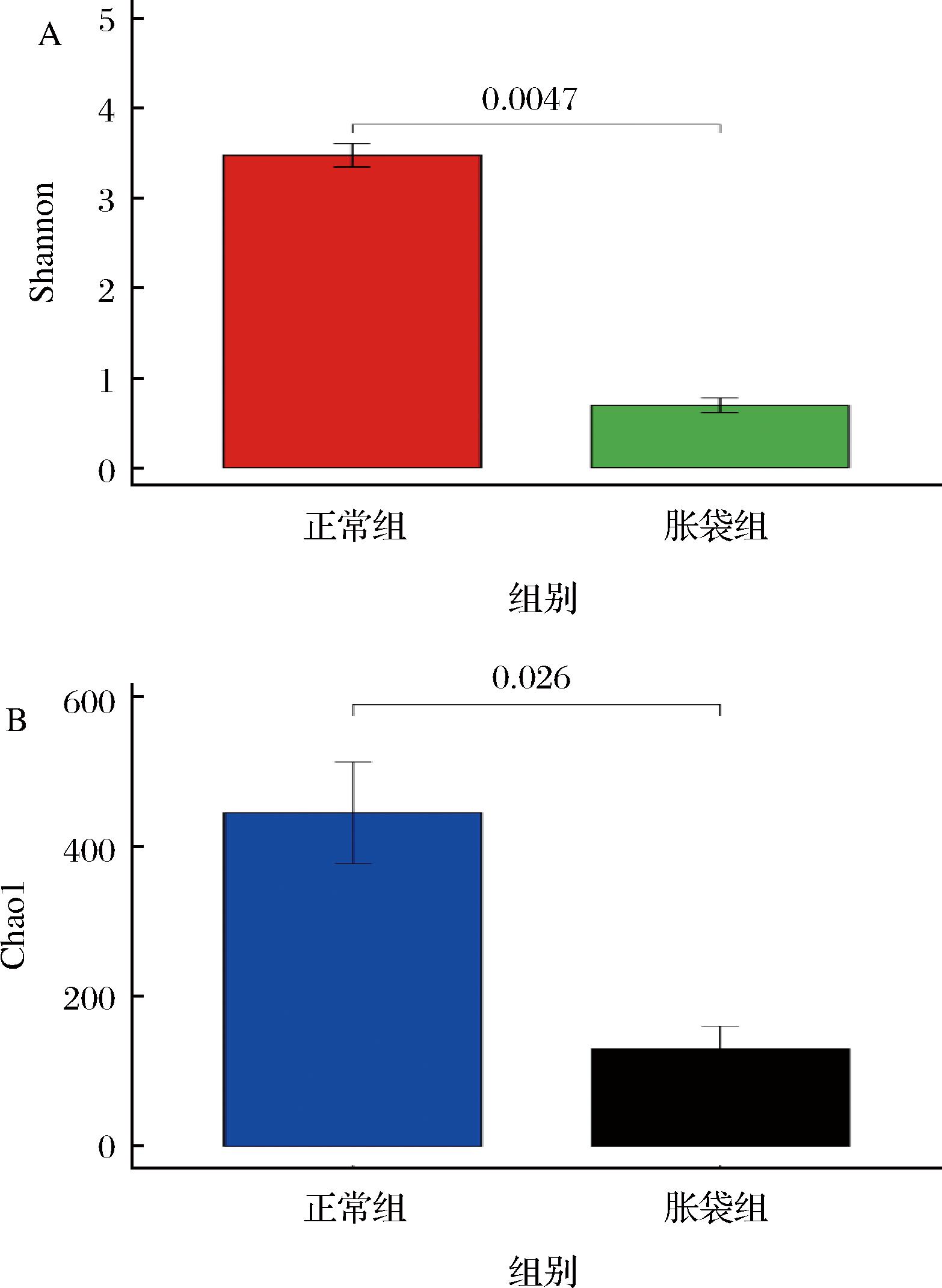
A-Shannon指数;B-Chao1指数
图3 两组样本的Alpha多样性指数
Fig.3 Alpha diversity index of two groups of samples
2.2.2 样本中的菌相组成变化
图4为不同类型凤爪的菌相组成图,包括在门水平下的相对丰度图(A)以及属水平下的相对丰度图(B)。在正常组中,主要菌群为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)及拟杆菌门(Bacteroidota),其平均相对丰度分别为63.29%、21.21%、6.75%、6.90%。在胀袋组中主要菌群为Firmicutes(98.18%)、Actinobacteriota(0.87%)及Proteobacteria(0.55%)。这与胀袋番茄酱中微生物多样性基本一致[10]。虽然纯培养法的结果显示正常组中菌落总数小于<2 lg CFU/g,但成品凤爪在辐照后,相对丰度占比较高的优势菌属包括不动杆菌属(Acinetobacter)、无色杆菌属(Achromobacter)、冷杆菌属(Psychrobacter)及乳杆菌属(Lactobacillus),其平均相对丰度分别为22.39%、14.83%、11.51%、9.51%,而链球菌属(Streptococcus)、罗思氏菌属(Rothia)、巨球菌属(Macrococcus)、假单胞菌属(Pseudomonas)、黄杆菌属(Flavobacterium)及金色杆菌属(Chryseobacterium)也占有一定比例,其相对丰度分别为3.28%、3.20%、3.04%、2.64%、2.29%、2.05%。这表明依然有部分耐辐照微生物存活。GUESMI等[22]在经过10 kGy 60CO~γ射线辐照的豆根中同样发现有Proteobacteria、Firmicutes、Actinobacteriota及Bacteroidota的微生物存活。值得注意的是,Pseudomonas及Acinetobacter的微生物会分解利用食品中的含氮物质(如蛋白质、氨基酸),将其转化为氨与三甲胺等物质,并且产生异味,造成食品腐败变质[23]。在胀袋组中,菌相结构较为单一,Lactobacillus占据绝对优势(平均占比97.30%),Rothia(0.06%)也占据一定比例,其他属的微生物则大幅度下降,这表明Lactobacillus是主要的微生物污染源。Lactobacillus细菌具有兼性厌氧的特点,在真空包装的条件下依然能够生长,以肉制品中的营养物质为底物进行代谢,产生乳酸,致使产品pH值下降。有研究表明Lactobacillus是气调包装烤鸭及真空包装的香肠中的优势菌[24-25]。Pseudomonas、Acinetobacter及Psychrobacter的细菌需氧生长,在厌氧条件下生长会受到抑制,从而导致其相对丰度降低。基于属水平的t-test检验结果(图4-C)可以看出Acinetobacter、Psychrobacter、Pseudomonas及Flavobacterium、Chryseobacterium等在胀袋组样本中的比例显著下降(P<0.05),推测它们可能来源于凤爪加工阶段的污染,但由于真空包装的环境,使得其生长受到明显的抑制。而Lactobacillus的丰度则显著上升(P<0.05),说明Lactobacillus较为适应真空包装环境,进而导致产品产气胀袋、腐败变质。Lactobacillus不耐高温,它们可能来源于泡制及包装阶段,因此凤爪在加工过程中需要注重加工环境及加工温度的控制,避免将环境中的微生物带入产品,进一步有针对性地研究相关抑菌技术来有效延长产品的货架期。

A-门水平;B-属水平;C-基于属水平的t检验结果
图4 两组样本细菌在门水平和属水平的相对丰度以及基于属水平的t检验结果
Fig.4 Relative abundance of bacteria at the phylum level and genus level and t-test results based on the genus level for the two groups of samples
总之,通过纯培养法和高通量测序技术,在胀袋组中都检测到了乳酸菌,有效地证实了这些微生物在胀袋凤爪中的存在。然而,2种方法的结果也存在一些差异。比如,通过纯培养法分离到了S.maltophilia,而在高通量测序中未检测到。相反的,高通量测序技术中检测到的部分微生物,在培养法中未找到。原因可能在利用高通量测序对16S rDNA的可变区进行扩增时,不同物种之间的可变区存在一定差异,导致部分物种无法被检测到[26]。另一方面,许多微生物至今无法在培养基中生长[8]。此外,本研究发现正常组中依然存在多种微生物,而在纯培养法中未检测到。这可能是因为高通量测序技术是对样本中所有DNA进行测序,其包含了活细胞和死细胞,这可能干扰测序结果。总之,2种方法的结果通过相互印证和补充,更完整地展示了胀袋凤爪中微生物的概况。
2.3 产气胀袋验证
为明确引起凤爪胀袋的微生物种类,将分离出的菌株进一步进行回接产气验证。结果表明,对照组在贮藏过程中未出现胀袋现象,分离出的所有L.brevis及L.fallax均可引起产品产气胀袋,而L.plantarum、S.maltophilia及C.tropicalis均不能引起产品产气胀袋。L.brevis及L.fallax是异型发酵乳酸菌[27-28],它们在厌氧条件下可发酵糖类物质生成乳酸,此外,还能生成醇、酸及CO2,CO2的过度积累将会导致产品产气胀袋。这表明L.brevis及L.fallax是引起凤爪胀袋的主要原因。
3 结论
本研究通过纯培养法及高通量测序技术分析真空包装辐照后的正常凤爪产品及胀袋凤爪产品中的微生物多样性。纯培养法从胀袋组中分离出L.plantarum、L.brevis、S.maltophilia、L.fallax及C.tropicalis共5种微生物,而高通量测序的结果表明Lactobacillus微生物的相对丰度在正常组中较低,而在胀袋组中较高,是胀袋凤爪中的优势菌。2种方法的结果表明Lactobacillus微生物是引起真空包装辐照凤爪产气胀袋的优势菌。此外,产气胀袋验证试验表明L.brevis、L.fallax可引起产品的胀袋。辐照作为凤爪类休闲食品灭菌效果和加工效率最佳的加工手段,因产品包装、初始微生物含量和工艺参数设置等因素,仍会出现产品胀袋等现象,本研究可为胀袋产品的微生物群落多样性研究和天然抑菌剂研发提供一定理论参考。
[1] 彭荣, 蔡琼, 刘丹, 等.贮藏条件对新型泡椒凤爪脂质氧化的影响[J].食品与发酵工业, 2019, 45(22):208-212.
PENG R,CAI Q, LIU D, et al.Effects of storage conditions on lipid oxidation of novel pickled chicken feet[J].Food and Fermentation Industries, 2019, 45(22):208-212.
[2] 尹含靓, 杜秋, 谭益升, 等.泡椒凤爪加工过程中细菌群落组成及变化分析[J].现代食品科技, 2022, 38(10):79-85.
YIN H L, DU Q, TAN Y S, et al.Analysis of bacterial community composition and changes at each step in the processing of pickled chicken feet[J].Modern Food Science and Technology, 2022, 38(10):79-85.
[3] JIA W, SHI Q Y, ZHANG R, et al.Unraveling proteome changes of irradiated goat meat and its relationship to off-flavor analyzed by high-throughput proteomics analysis[J].Food Chemistry, 2021, 337:127806.
[4] 姚涛, 沈韫韬, 徐琰, 等.辐照技术在猪肉加工制品中的应用[J].肉类工业, 2021(1):44-46.
YAO T, SHEN Y T, XU Y, et al.Application of irradiation technology in pork processed products[J].Meat Industry, 2021(1):44-46.
[5] 张园园, 朱瑶迪, 李苗云, 等.胀袋红烧肉和酱料包中产气微生物的分离与鉴定[J].现代食品科技, 2022, 38(7):107-112;26.
ZHANG Y Y, ZHU Y D, LI M Y, et al.lsolation and identification of gas-producing microorganisms from bagging red braised pork and sauce packs[J].Modern Food Science and Technology, 2022, 38(7):107-112;26.
[6] 吴海虹, 王新新, 刘芳, 等.泡椒凤爪中解脂耶氏酵母的分离鉴定及生长特性分析[J].现代食品科技, 2014, 30(11):84-88;64.
WU H H, WANG X X, LIU F, et al.Isolation and identification of Yarrowia lipolytica strains from chicken feet with pickled peppers and analysis of their growth characteristics[J].Modern Food Science and Technology, 2014, 30(11):84-88;64.
[7] SILVA A R, PAULO É N, SANT'ANA A S, et al.Involvement of Clostridium gasigenes and C.algidicarnis in ‘blown pack’ spoilage of Brazilian vacuum-packed beef[J].International Journal of Food Microbiology, 2011, 148(3):156-163.
[8] AMANN R I, LUDWIG W, SCHLEIFER K H.Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J].Microbiological Reviews, 1995, 59(1):143-169.
[9] LEE H W, YOON S R, KIM S J, et al.Identification of microbial communities, with a focus on foodborne pathogens, during kimchi manufacturing process using culture-independent and-dependent analyses[J].LWT-Food Science and Technology, 2017, 81:153-159.
[10] 张双虹, 刘孟涛, 陆婉瑶, 等.Illumina Miseq高通量测序方法对袋装番茄酱微生物多样性分析[J].食品工业科技, 2021, 42(18):119-125.
ZHANG S H, LIU M T, LU W Y,et al.Analysis of microbial diversity in the bagged tomato sauce by Illumina Miseq high throughput sequencing[J].Science and Technology of Food Industry, 2021, 42(18):119-125.
[11] 王玉荣, 席啦, 易宗伟, 等.基于宏基因组测序和纯培养技术解析胀袋生抽酱油的微生物类群[J].食品与发酵工业, 2024,50(4):165-170;177.
WANG Y R, XI L, YI Z W, et al.Analysis of microbial groups in aerogenesis soy sauce based on metagenome sequencing and pure culture technology[J].Food and Fermentation Industries, 2024,50(4):165-170;177.
[12] MAES S, HEYNDRICKX M, VACKIER T, et al.Identification and spoilage potential of the remaining dominant microbiota on food contact surfaces after cleaning and disinfection in different food industries[J].Journal of Food Protection, 2019, 82(2):262-275.
[13] WAGNER E M, FISCHEL K, RAMMER N, et al.Bacteria of eleven different species isolated from biofilms in a meat processing environment have diverse biofilm forming abilities[J].International Journal of Food Microbiology, 2021, 349:109232.
[14] LEI Y, ZHANG Y L, CHENG Y Q, et al.Monitoring and identification of spoilage-related microorganisms in braised chicken with modified atmosphere packaging during refrigerated storage[J].Food Science and Human Wellness, 2023, 12(1):28-34.
[15] 高鹏, 伏毅, 陈谦, 等.真空包装肘花胀袋微生物的鉴定及验证[J].湖北农业科学, 2016,55(13):3434-3438.
GAO P, FU Y, CHEN Q, et al.Ldentification and verification test of microorganisms of swollen bag of pork jelly[J].Hubei Agricultural Sciences, 2016,55(13):3434-3438.
[16] 杨啸吟, 张一敏, 梁荣蓉, 等.包装冷却肉中微生物腐败及其挥发性气味的研究进展[J].食品科学, 2021, 42(1):285-293.
YANG X Y, ZHANG Y M, LIANG R R, et al.Microbial spoilage and formation and detection of volatile odor compounds in packaged chilled meat:A review[J].Food Science, 2021, 42(1):285-293.
[17] GRANT I R, PATTERSON M F.A numerical taxonomic study of lactic acid bacteria isolated from irradiated pork and chicken packaged under various gas atmospheres[J].The Journal of Applied Bacteriology, 1991, 70(4):302-307.
[18] NIEMAND J G, HOLZAPFEL W H.Characteristics of lactobacilli isolated from radurised meat[J].International Journal of Food Microbiology, 1984, 1(2):99-110.
[19] HASTINGS J W, HOLZAPFEL W H.Conventional taxonomy of lactobacilli surviving radurization of meat[J].The Journal of Applied Bacteriology, 1987, 62(3):209-216.
[20] XIONG H B, ZHOU X H, XIANG W L, et al.Integrated transcriptome reveals that d-limonene inhibits Candida tropicalis by disrupting metabolism[J].LWT, 2023, 176:114535.
[21] 杨琴. 泡椒凤爪中兼性厌氧产气微生物的分离、鉴定与控制研究[D].南昌:江西农业大学, 2016.
YANG Q. The research on the isolation, identification and control of the facultative anaerobic aerogenesis microorganisms from chicken feet with pickled peppers[D].Nanchang:Jiangxi Agricultural University, 2016.
[22] GUESMI S, NAJJARI A, PUJIC P, et al.Roots of the xerophyte Panicum turgidum host a cohort of ionizing-radiation-resistant biotechnologically-valuable bacteria[J].Saudi Journal of Biological Sciences, 2022, 29(2):1260-1268.
[23] WANG X Y, XIE J.Assessment of metabolic changes in Acinetobacter johnsonii and Pseudomonas fluorescens co-culture from bigeye tuna (Thunnus obesus) spoilage by ultra-high-performance liquid chromatography-tandem mass spectrometry[J].LWT, 2020, 123:109073.
[24] VON HOLY A, CLOETE T E, HOLZAPFEL W H.Quantification and characterization of microbial populations associated with spoiled, vacuum-packed Vienna sausages[J].Food Microbiology, 1991, 8(2):95-104.
[25] CHEN X, CHEN W W, LU X, et al.Effect of chitosan coating incorporated with oregano or cinnamon essential oil on the bacterial diversity and shelf life of roast duck in modified atmosphere packaging[J].Food Research International, 2021, 147:110491.
[26] DI BELLA J M, BAO Y G, GLOOR G B, et al.High throughput sequencing methods and analysis for microbiome research[J].Journal of Microbiological Methods, 2013, 95(3):401-414.
[27] RICE T, SAHIN A W, LYNCH K M, et al.Isolation, characterisation and exploitation of lactic acid bacteria capable of efficient conversion of sugars to mannitol[J].International Journal of Food Microbiology, 2020, 321:108546.
[28] TEIXEIRA P. LACTOBACILLUS Lactobacillus brevis[M]. Amsterdam: Elsevier, 2014: 418-424.