2型糖尿病(type 2 diabetes mellitus,T2DM)是胰岛素分泌不足引起的代谢性疾病。近年患病率不断增加,严重危害人类的健康及生活[1]。世界卫生机构建议改变饮食和生活方式是糖尿病的首要干预措施。饮食干预是预防和控制高血糖有效且低成本的方法[2]。据研究显示,豆类为主的饮食可以减弱血糖反应并促进胰岛素分泌[3],其中红小豆营养价值高,是蛋白质、膳食纤维、维生素和矿物质的重要来源,被称为“减肥豆” [4]。据报道,高脂饮食中补充红小豆粉,可显著降低T2DM小鼠空腹血糖、胰岛素及糖耐量水平,还可显著逆转高脂饮食引起的小鼠肠道微生物菌群的失衡[5]。另一项研究发现,食用熟红豆对糖尿病小鼠肝功有保护作用[6]。在饮食中给予红小豆多糖,通过激活PI3K/AKT信号通路来降低糖尿病大鼠的糖耐量、胰岛素水平[7]。每天补充摄入红小豆生物活性物质如蛋白9.4 g、多糖7.14 g、总酚20.16 mg和总黄酮5.38 mg,对糖尿病患者预后产生良好的抵抗作用[8]。这些研究证明红小豆膳食具有调节血糖的潜力。但豆类加工性能差、口感粗糙、味道不佳、消化难且含有抗营养因子,限制其消费及相关功能食品的推广。
萌发是一种简单且低成本的技术,可以提高发芽种子食品的营养和营养保健质量。萌发可以刺激内源性酶活性,改变生化反应,增加多酚、抗坏血酸、硫胺素等营养化合物的含量,尤其是γ-氨基丁酸(γ-aminobutyric acid,GABA)的含量[9]。GABA主要由谷氨酸(glutamic acid,Glu)在萌发过程中通过谷氨酸脱羧酶的催化作用产生。GABA是人类神经系统中一种主要的抑制性神经递质,在缓解焦虑、调节血液、预防癌症等方面具有重要作用[10]。同时,最新研究表明,GABA可在体内诱导α细胞介导的β样细胞新生,并可通过升高葡萄糖转运蛋白4改善胰岛素抵抗,同时降低糖异生途径和胰高血糖素受体基因表达[11],这为改善糖尿病治疗带来希望。富含GABA食品引起了研究人员和消费者的关注,红小豆富含谷氨酸,可以像其他谷物一样用于制作营养丰富的富含GABA芽豆食品。目前对萌发红小豆的功能特性的研究非常有限,而且富含GABA红小豆调节血糖的作用效果尚不清楚。因此,该研究先利用真空联合萌发胁迫红小豆富集GABA,再利用动物体内实验,对富含GABA红小豆调控血糖的效果进行评价,为芽豆功能食品开发及应用提供技术参考。
1 材料与方法
1.1 材料与试剂
红小豆(品种:珍珠红),购自大庆瑞泽丰农业科技有限公司,并在4 ℃下保存至使用;GABA标准品,Sigma Aldrich公司;链脲菌素、4%多聚甲醛、谷氨酸、柠檬酸、次氯酸钠、氯化钙及重蒸酚,上海源叶生物科技有限公司;血清空腹血糖、胰岛素试剂盒,南京建成生物技术有限公司;血清总蛋白、总胆红素、谷丙转氨酶和谷草转氨酶试剂盘,成都斯马特科技有限公司。
1.2 仪器与设备
BZF-30真空干燥箱(极限真空度为1.33 kPa),上海博讯医疗生物仪器有限公司;ZXMP-R1230恒温恒湿培养箱(配有独立加水装置及自动控温系统),上海智城分析仪器制造有限公司;TU-1810PC紫外可见分光光度计,北京普析通用仪器有限公司;Agilent1200液相色谱1200, 安捷伦科技有限公司;H2050R高速台式冷冻离心机,湘仪离心机仪器有限公司;SCIENTZ-18N冷冻干燥机,宁波新芝生物科技有限公司;580鱼跃血糖仪,江苏鱼跃医疗设备股份有限公司。
1.3 实验方法
1.3.1 萌发红小豆制备
将精选清洗后红小豆种子用10 g/L的NaClO溶液浸泡15 min,之后用无菌水冲洗3次,加入4倍体积的水,浸泡液中加入0.4 mmol/L CaCl2,在35 ℃浸泡16 h,缓冲液pH 5。浸泡结束后用去离子水清洗红小豆,均匀平铺在4层纱布的发芽板上,盖上较润湿的纱布放入到可以调节温度的真空干燥箱中,将温度设定到31 ℃,抽真空至-0.1 MPa后,关闭真空泵,真空处理16 h后,将发芽板转移到31 ℃恒温恒湿培养箱中继续发芽至48 h,萌发期间每1 h喷射一次2 mmol/L的谷氨酸钠,萌发结束后,一部分低温干燥用于测定GABA的含量及动物实验的材料,其中用于动物实验的红小豆为萌发后的芽豆。按照上述胁迫技术处理红小豆,可将其中红小豆GABA含量由原来2.57 mg/100 g提高到249.47 mg/100 g。GABA含量测定采用柱前衍生高效液相色谱法,以 GABA的峰面积(Y) 和浓度(X,mmol/L)作为因子进行线性分析,回归方程为Y=7.472 7X-0.024 1,R2=0.996 3。
1.3.2 实验动物、造模、分组、膳食干预用量
1.3.2.1 实验动物
实验动物选择的是SPF级C57BL/6 J雄性小鼠(n=64),6周龄,体重18~22 g,购于长春市亿斯实验动物技术有限责任公司(许可证号:SCXK(吉)2018-0007),饲养于黑龙江八一农垦大学生物技术中心。动物饲养室温20~25 ℃,相对湿度(50±5)%,12 h明暗交换。动物自由进食、进水,开始实验前动物适应性喂养1周,期间认真观察小鼠的精神状态,并记录小鼠每天摄食量,为后期膳食干预物含量的确定提供参考。本实验严格按照动物管理条例办法执行,动物伦理批准号为Spxy2023020。
1.3.2.2 T2DM造模、分组、膳食干预用量
将健康C57BL/6 J小鼠分为正常对照组(8只)和糖尿病组(56只)。正常对照普通饲料喂养,造模组饲喂TP23300 60%高脂模型饲料,连续饲喂4周后,造模组禁食不禁水12 h后,以50 mg/kg链脲佐菌素(streptozocin,STZ)剂量注射(0.1 mol/L柠檬酸缓冲液,pH=4.0),腹腔注射STZ后检测小鼠空腹血糖,以连续3 d造模小鼠空腹血糖大于12 mmol/L视为造模成功[12]。
对造模成功T2DM小鼠进行分组,分别为模型组M,高脂饮食(high fat diet,HFD)+低剂量富含GABA发芽红小豆组TF1(15 g/100 g),HFD+中剂量富含GABA发芽红小豆组TF2(25 g/100 g),HFD+高剂量富含GABA发芽红小豆TF3(35 g/100 g),HFD+红小豆干预组B(35 g/100 g),HFD+GABA干预组TG(0.1 g/kg),HFD+二甲双胍组TS(0.1 g/kg)。膳食干预剂量按照红小豆中GABA含量进行折算,同时结合膳食指南杂豆类每天摄入量50~150 g。TF1、TF2、TF3、B组用不同剂量发芽红小豆和正常红小豆替换部分高脂饲料对小鼠进行膳食干预,先将正常红小豆和萌发红小豆烘干打碎成粉,再将棒状高脂饲料压碎,两者按干预比例混合均匀,取少量放入注射器管内压棒,一次制作够小鼠3 d食用的量,之后放入冰箱冷藏。M组一直是高脂膳食,C组普通饲料,TG、TS组+高脂膳食+药物处理。每组8只小鼠,第1周为适应喂养,第2~5周高脂膳食,同时在第5周结束后注射STZ,第6周处于观察造模情况,膳食干预从第7周开始,直到12周结束,共计干预时间为6周。膳食干预期间,每2周测量各组小鼠体重及空腹血糖。膳食干预至12周结束后,禁食不禁水12 h,采用戊巴比妥钠麻醉小鼠后,进行解剖采血,血样室温静止30 min,4 ℃下离心10 min (3 000 r/min)后收集血清。此外,摘取小鼠肝脏、盲肠等组织,立即放入液氮冷冻,保存于-80 ℃待用。
1.3.3 糖脂代谢相关的生化指标检测
各组T2DM小鼠膳食干预及给药处理6周结束后,检测血清空腹血糖(serum fasting blood glucose,FBG)、胰岛素水平(insulin level,INS)均按照试剂盒说明书操作;血清中谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate transaminase,AST)、总蛋白(total protein)及总胆红素(total bilirubin)指标通过罗氏全自动生化分析仪(Cobas c702)进行测定。胰岛素抵抗指数(insulin resistance index,HOMA-IR)、胰岛 β细胞分泌指数(islet β-cell index,HOMA-β)分别按照公式(1)、公式(2)计算:
胰岛素抵抗指数(HOMA-IR)
(1)
胰岛β细胞分泌指数![]()
(2)
1.3.4 组织病理学分析
膳食干预及给药结束后,解剖小鼠取出一小部分肝脏、胰腺和盲肠立即浸入4%多聚甲醛中固定,HE染色由武汉博尔夫生物科技有限公司(中国,武汉)完成。
1.4 数据统计分析
血清生化系列指标采用SPSS 22.0软件中的单因素方差分析和Duncan多重比较法对数据进行统计分析,当P<0.05表示组间或组内具有统计学意义。折线图及柱形图均采用GramPad prism 7.04绘制,并利用该软件对图像进行组合。
2 结果与分析
2.1 富含GABA红小豆对T2DM小鼠体重的影响
试验期间各组小鼠体重变化情况如图1所示,干预初期小鼠体重在18~20 g上下波动,且各组小鼠体重之间无显著差异。经高脂膳食结合腹腔SZT注射构建T2DM模型后,进入膳食干预期即第7周,发现M模型组小鼠体重显著高于C正常对照(P<0.05),但其他各处理组与M组之间无显著差异(P>0.05)。膳食干预结束即第12周,M组小鼠体重显著高于C对照组(P<0.05),TF3、TG和TS组小鼠体重显著低于M模型组(P<0.05),表明富含GABA红小豆膳食干预和口服GABA(TG)、二甲双胍(TS)可降低T2DM糖尿病小鼠体重,对抵抗超重具有一定效果,与以往相似研究结果吻合[13]。
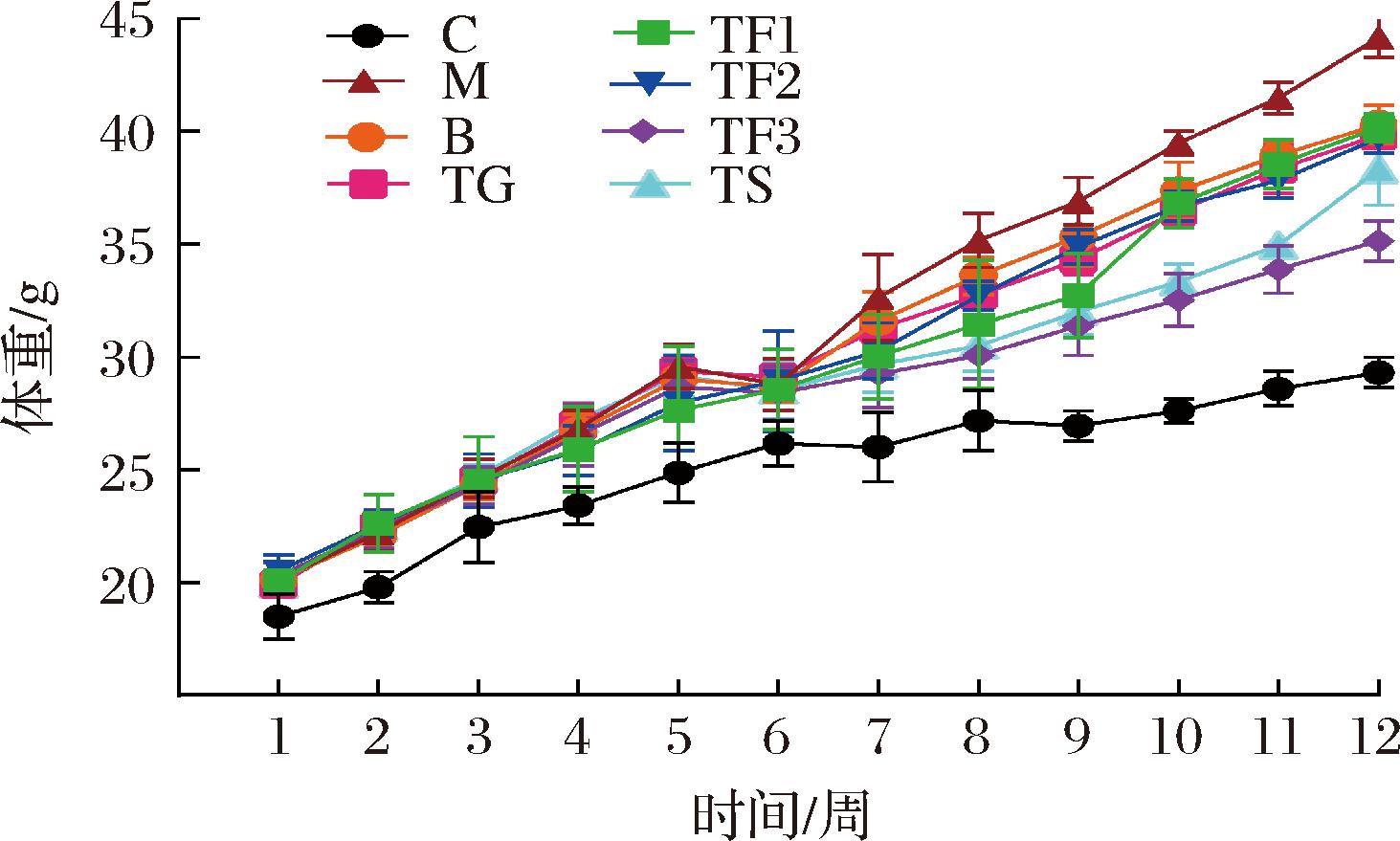
图1 富含GABA红小豆对T2DM小鼠体重的影响
Fig.1 Effect of GABA rich adzuki beans on body weight of T2DM mice
2.2 富含GABA红小豆对T2DM小鼠摄食量的影响
试验小鼠通过自由采食方式摄入富含GABA红小豆及其他干预物,小鼠第1、3、5、7、9和12周摄食量变化情况如图2所示,开始初期(第1周),所有小鼠摄食量几乎一致,自第2周开始饲喂高脂饲料构建T2DM模型,第3周时,M模型组小鼠摄食量显著高于C对照组(P<0.05),第5周M模型组小鼠摄食量均明显降低(P<0.05),可能因该周进行STZ注射,诱发小鼠采食量下降。第7周膳食干预开始,小鼠摄食量逐渐恢复正常,其中M及处理组小鼠摄食量显著高于C对照组(P<0.05),第9周M组摄食量达到峰值,明显高于膳食干预组(P<0.05);第12周,膳食干预结束,M组小鼠摄食量急剧下降,其他干预组摄食量波动较小。M组小鼠可能因病情严重而导致食欲下降,而富含GABA红小豆膳食干预缓解了T2DM小鼠食欲不佳的状态。
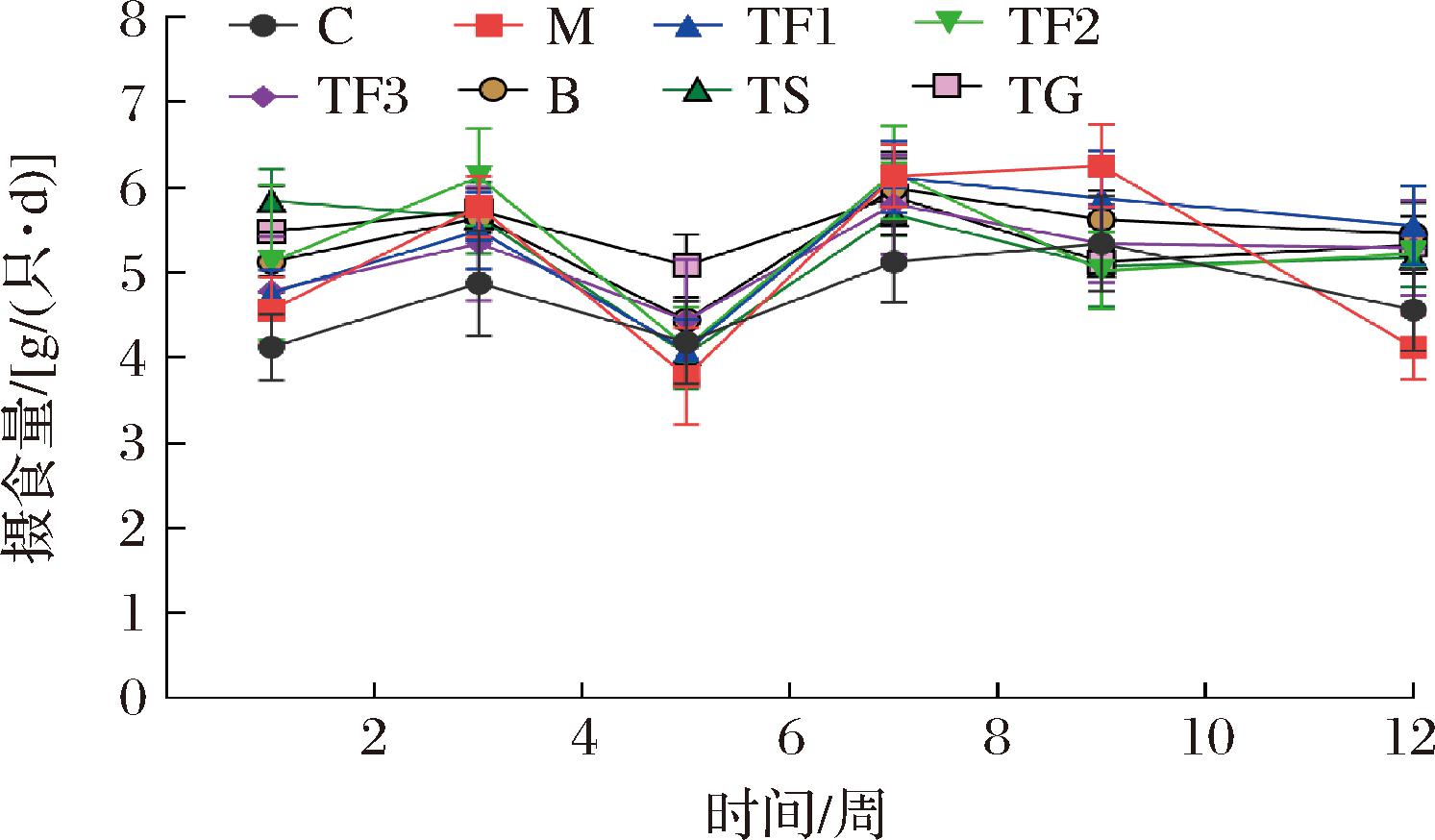
图2 富含GABA红小豆对T2DM小鼠摄食量的影响
Fig.2 Effect of GABA rich adzuki bean on food intake of T2DM mice
2.3 富含GABA红小豆对T2DM小鼠糖代谢水平的影响
2.3.1 对T2DM小鼠空腹血糖的影响
由图3可知,在第7周膳食干预初期,与C组相比,各处理组小鼠空腹血糖显著升高(P<0.05)。第9周后,不同剂量富含GABA红小豆膳食及GABA、二甲双胍组的小鼠血糖值开始出现变化,与M模型组相比,各处理组小鼠FBG值均明显下降。截至12周时,各干预组血糖值显著降低(P<0.05),且组间均一性良好,具体来说M模型组小鼠FBG为(18.21±1.27) mmol/L,而TF3膳食干预组FBG为(8.36±0.78) mmol/L,相比M组下降54.09%,TG组[(10.12±1.46) mmol/L]相比M组下降44.42%,TS组[(10.84±1.21) mmol/L]相比M组下降40.47%,TF3、TG和TS组与M模型组之间均存在显著差异(P<0.05)。表明富含GABA红小豆膳食干预具有良好平衡血糖的效果。
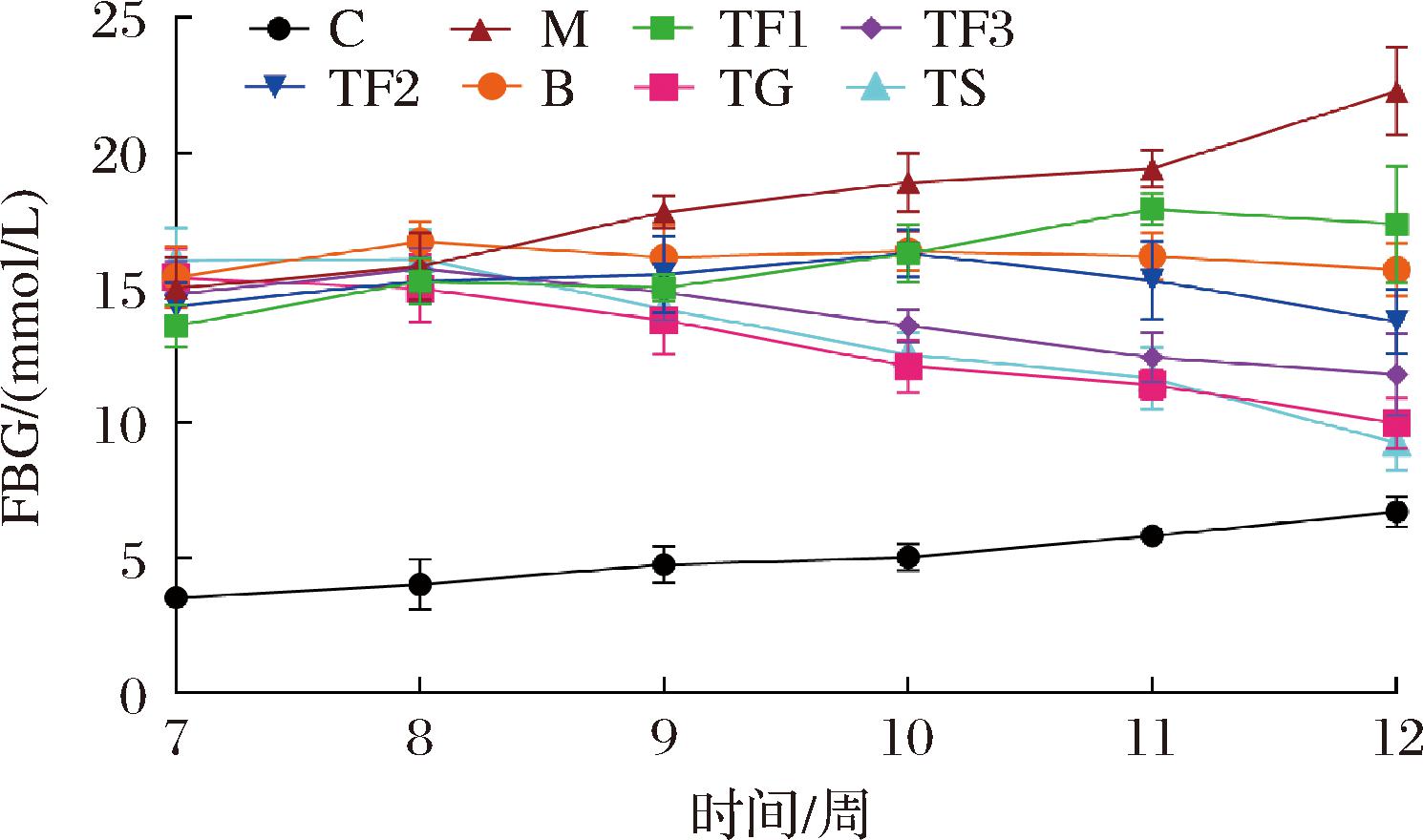
图3 富含GABA红小豆对T2DM小鼠FBG的影响
Fig.3 Effect of GABA rich adzuki beans on FBG of T2DM mice
2.3.2 对T2DM小鼠糖耐量的影响
由图4-A可知,C组小鼠注射后30 min血糖升高,然后恢复正常水平,M组30 min内血糖升高幅度最大,直到120 min依然保持一个较高水平,并且图4-B中M组的曲线下面积(area under curve,AUC)是C组的2.77倍,说明M组小鼠有严重的葡萄糖耐受不良反应。TF1、TF2、TF3、B、TG和TS组在注射30 min后血糖都升高,且保持一段时间,在120 min时都出现明显的回落,说明富含GABA红小豆和药物提高T2DM小鼠的葡萄糖耐受能力。其中,药物治疗组TG和TS组的回落幅度最大,说明TG和TS干预可改善糖耐量受损。TF3组明显比B组的AUC低,说明当添加同等剂量的富含GABA红小豆和原料红小豆时,富含GABA红小豆更有利于改善糖耐量,推测与富含GABA红小豆中GABA含量有密切关系,且富含GABA红小豆膳食干预T2DM小鼠对葡萄糖耐受力的恢复上呈剂量依赖性关系。
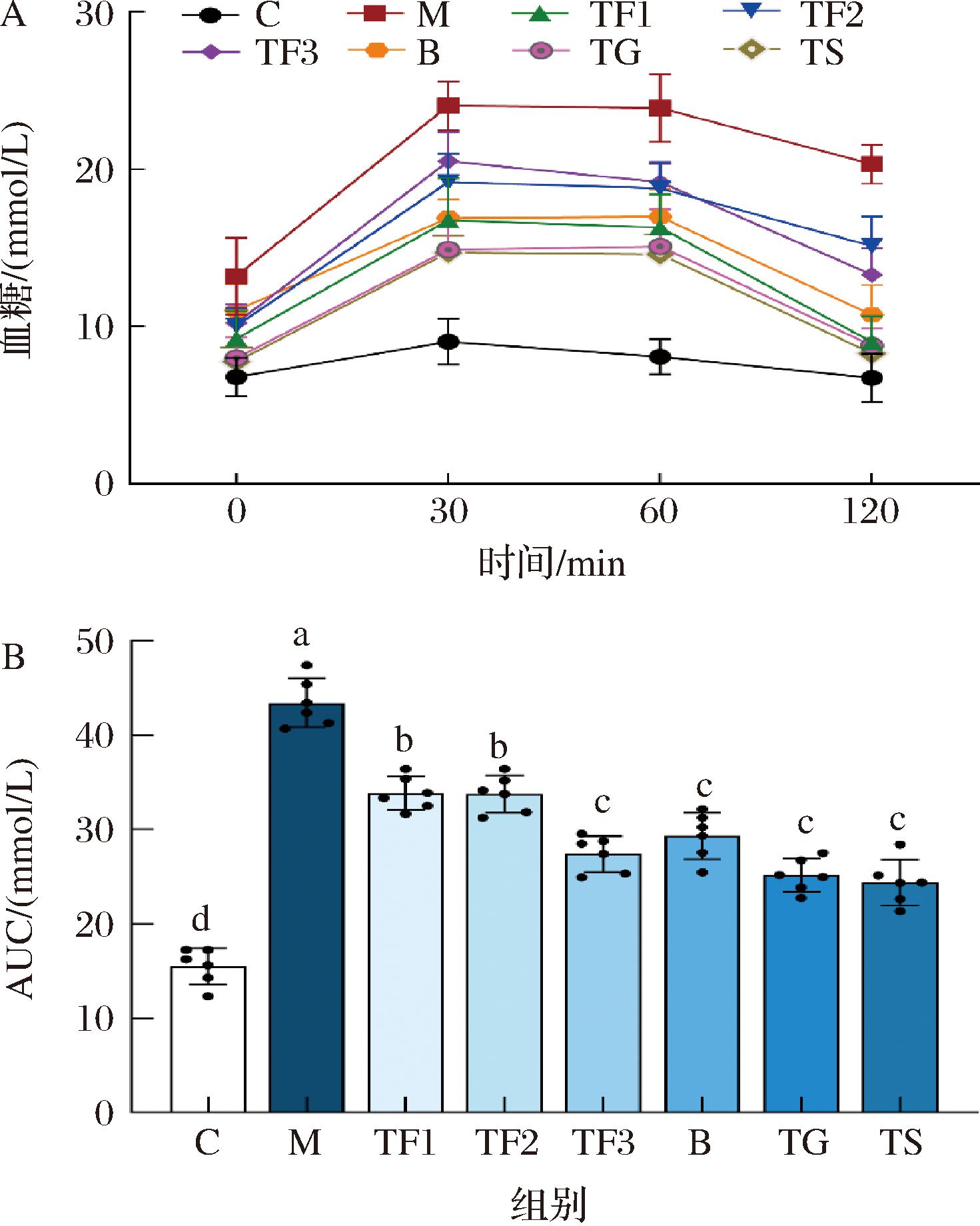
A-血糖含量;B-曲线下面积
图4 富含GABA红小豆对T2DM小鼠糖耐量的影响
Fig.4 Effect of GABA rich adzuki beans on glucose tolerance in T2DM mice
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.3.3 对T2DM小鼠血清空腹血糖、胰岛素、HOMA-IR和HOMA-β的影响
由图5-A可知,与C组相比,M模型组小鼠FBG[(18.21±2.69) mmol/L]显著升高(P<0.05)。经富含GABA膳食及给药干预6周后,TF1、TF2、TF3膳食干预组,均出现不同程度下降,其中TF3组FBG水平下降最为明显(P<0.05),比GABA(TG)及二甲双胍(TS)阳性对照组分别低21.05%、29.66%。说明富含GABA红小豆有一定的降低血糖的效果,且血糖变化与摄入量具有效应关系。图5-B比较了各组小鼠的血清胰岛素水平,M模型组小鼠INS含量显著低于C组小鼠(P<0.05),说明M组小鼠存在胰岛素分泌缺陷。经6周膳食干预后,与对照组相比,高剂量富含GABA红小豆(TF3)及药物TG和TS组小鼠胰岛素水平显著上调(P<0.05),分别提高了25.02%、26.06%、30.58%,但仍未调节至正常水平,可能因高脂及STZ注射使小鼠胰岛组织功能受损,进而引发胰岛素释放能力降低。根据FBG及INS浓度,计算用于评价糖尿病小鼠胰岛功能的HOMA-IR和HOMA-β指标,其结果如图5-C、5-D所示,与C组相比,M组HOMA-IR显著升高(P<0.05)、且HOMA-β指数显著降低(P<0.05),说明高脂及精细化饮食引起小鼠胰岛素抵抗,并破坏了胰岛β细胞功能。与M组相比,TF3作为膳食补充剂则显著下调HOMA-IR,下调量为43%,且显著增加了胰岛β细胞分泌指数(P<0.05),表明TF3膳食干预可改善2型糖尿病小鼠血清INS水平,缓解IR程度。
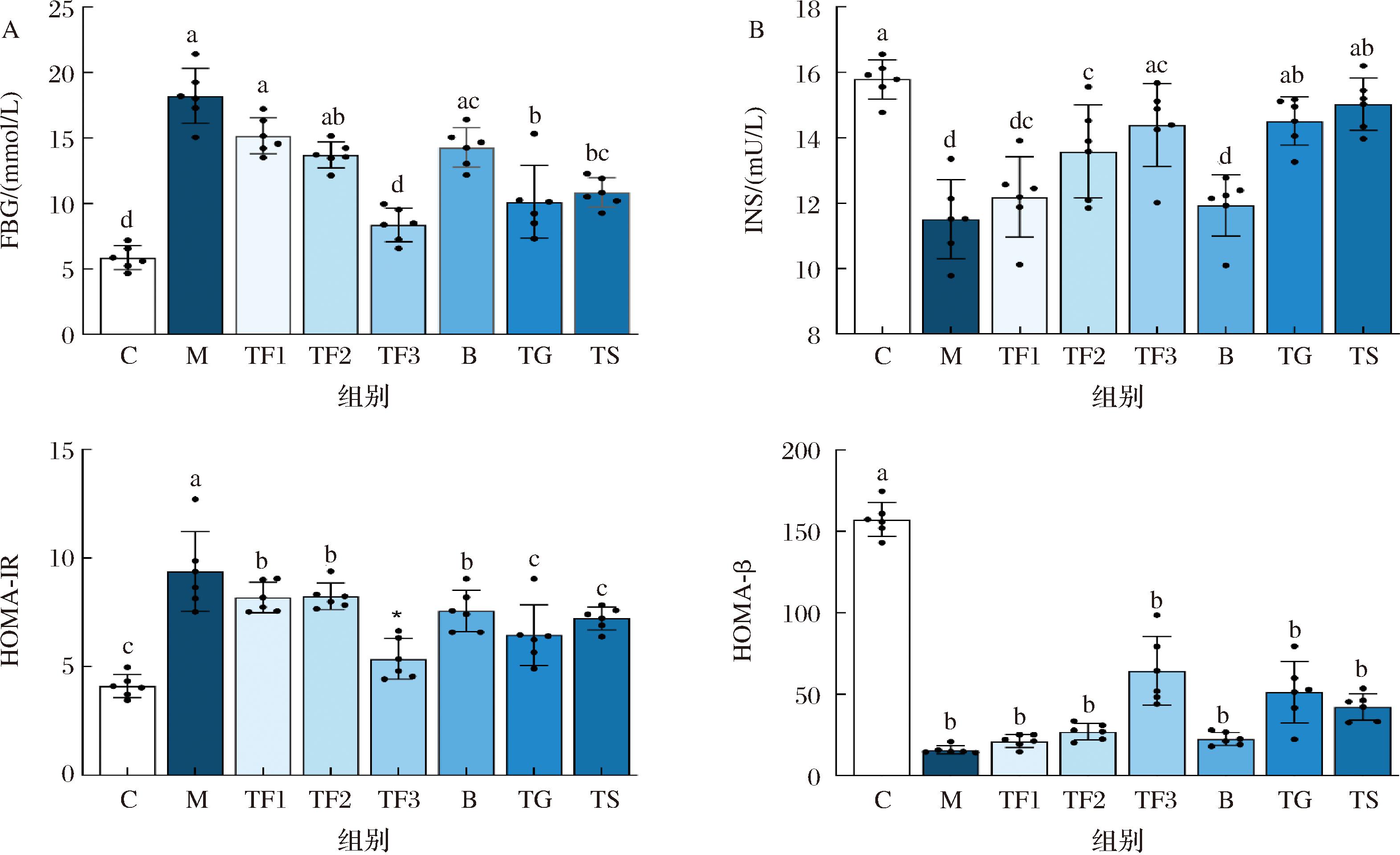
A-FBG;B-INS;C-HOMA-IR;D-HOMA-β
图5 富含GABA红小豆对T2DM小鼠血清糖代谢指标的影响
Fig.5 Effect of GABA rich aduki bean on serum glucose metabolism in T2DM mice
2.3.4 对T2DM小鼠肝功能相关指标的影响
肝脏是葡萄糖代谢的重要场所,也是胰岛素和胰高血糖素作用的靶组织。在调控机体代谢规律及平衡糖脂代谢稳态中扮演重要角色[14]。血清总蛋白、总胆红素以及ALT、AST是评判肝脏代谢、合成及损害的重要指标。因此,为了进一步考察富含GABA红小豆对T2DM小鼠肝功能的影响,对上述4个因子进行分析,其结果如图6所示。

A-血清中ALT含量;B-血清中AST含量;C-总蛋白浓度;D-总胆红素浓度
图6 富含GABA红小豆对T2DM小鼠肝脏指标的影响
Fig.6 Effect of GABA rich aduki beans on liver indexes of T2DM mice
由图6可知,相比C组,不同处理组小鼠血清中ALT和AST含量均明显升高。与M组相比,TF3组中ALT和AST含量略有下降(图6-A、6-B)。此外,M组小鼠的总蛋白浓度相比对照显著降低(P<0.05),各处理组均可不同程度提高总蛋白浓度,但组间差异不显著(P>0.05),其中TF3组总蛋白浓度为(69.27±3.57) g/L,仅次于二甲双胍处理组(图6-C)。由图6-D可知,不同剂量膳食干预组以剂量依赖性的方式降低T2DM小鼠的总胆红素水平,其中TF3处理组效果优于TF1、TF2组,但不及TG、TS药物对照组(图6-D)。根据ALT、AST和总胆红素在血液中浓度升高,且白蛋白产生减少,可判定糖尿病小鼠肝细胞受到实质损伤,其损伤程度与以上指标相一致。通过摄入高剂量富含GABA红小豆可以缓解T2DM小鼠肝损伤程度,值得注意的是TF3组小鼠血清中AST/ALT值始终大于3,表明高剂量富含GABA红小豆膳食可能具有一定的护肝功效。
2.3.5 对T2DM小鼠组织形态学的影响
由图7-A可知,C组小鼠肝组织肝索排列整齐,未出现充血及肿胀现象,没有空泡出现,只有极少微小脂滴存在。M组肝脏细胞轻度异常,肝细胞结构疏松,可见较多细胞呈现明显水肿及局部细胞变性坏死现象(图中红色箭头),并有较多细胞出现脂肪变性和脂肪空泡存在,部分空泡已相互融合形成更大的空泡(图中绿色箭头)。与M组相比,TF3组肝细胞形态趋于规则,无充血、脂肪空泡明显减少,但局部存在已融合的大空泡。TG、TS组肝组织形态趋于正常,仅存在少数空泡。整体而言,TS小鼠肝脏组织形态与C组最为相近,其次是TG及TF3组。表明高剂量富含GABA红小豆膳食干预T2DM小鼠具有改善肝脏组织病变及保肝作用。各组小鼠胰腺组织整体结构基本正常,腺泡上皮细胞形状多为锥形,未出现明显坏死和变性,仅组织间质出现血管充血及扩张(见图中红色箭头),经TF3、TG和TS干预后,胰岛组织结构更趋于正常对照组,表明各组小鼠胰腺组织没有出现严重的病理学变化(图7-B)。由图7-C可知,相比C组,M模型组小鼠盲肠组织结构呈现轻度异常,有较多黏膜上皮细胞存在(黄色箭头),肠内黏膜层遍布较多杯状细胞(红色箭头),肠黏膜下层呈现明显疏松水肿,但未见明显炎症细胞浸润(绿色箭头)。总之,TF3膳食干预后,T2DM小鼠肝脏、胰腺及肠道组织病变均有明显修复现象,说明TF3与TG、TS一样具有修复组织损伤的作用,进而缓解糖尿病的症状。

A-干肝脏;B-胰腺;C-盲肠
图7 小鼠肝脏、胰腺和盲肠组织病理学切片图
Fig.7 Histopathological sections of liver, pancreas, and cecum of mice
3 结论与讨论
通常,糖代谢障碍是T2DM疾病导致的一个明显症状,这与高卡路里饮食、肥胖密切相关,可促使代谢异常与胰岛素抗性,增加了肝脏中葡萄糖产生和胰岛素分泌的缺陷[15]。本研究发现,TF3膳食干预T2DM小鼠后,可显著降低T2DM小鼠体重和空腹血糖水平,对抵抗超重及平衡血糖效果均优于阳性对照,还可缓解T2DM小鼠食欲不佳的状态。表明TF3膳食对调节HFD+STZ诱导T2DM小鼠的体表特征有积极作用。CHAIYASUT等[12]给予T2DM小鼠补充发芽黑糙米,有助于预防和管理糖尿病,并可抵抗因高脂饲料摄入而引发糖尿病小鼠体重的增加,与本研究结果吻合。葡萄糖耐量试验已被广泛用于评价糖尿病患者的葡萄糖利用和胰岛素敏感性的研究[16]。正常C组小鼠的血糖水平在腹腔注射葡萄糖2 h后可恢复至正常水平,且组内小鼠血糖波动幅度较小。M模型组小鼠在注射葡萄糖2 h后血糖显著升高(P<0.05),2 h后尚未恢复到初始水平,而富含GABA红小豆膳食干预6周后,低中高剂量组的AUC值均明显高于M模型组(P<0.05)。说明富含GABA红小豆膳食干预可改善T2DM小鼠的葡萄糖耐量。SOHRABIPOUR等[17]也采用腹腔葡萄糖耐量试验来考察GABA对T2DM小鼠糖耐量的影响,结果显示GABA可显著改善T2DM小鼠的葡萄糖耐量,改善机制可能是GABA增加了葡萄糖的输注速率。与对照组相比,高剂量富含GABA红小豆(TF3)及TG和TS组小鼠胰岛素水平分别上调了25.02%、26.06%、30.58%,但仍未调节至正常水平,其中TF3组可使HOMA-IR显著下调43%,且增强了胰岛β细胞分泌指数,表明TF3膳食干预通过改善血清血糖和胰岛素水,来平衡T2DM小鼠葡萄糖稳态,进而缓解小鼠糖尿病症状。据报道以豆类为主的饮食可显著降低T2DM患者的餐后血糖水平,并能促进胰岛素分泌[18]。肝脏状态异常会损害胰腺β细胞功能及存活率,引发外周胰岛素抵抗。大量研究报道,糖尿病会导致AST和ALT水平的升高[19-20]。同样,本研究中,观察到糖尿病小鼠血清中ALT、AST和总胆红素浓度升高,而总蛋白下降,然而,使用富含GABA红小豆干预后降低了这些肝脏损伤标志物的水平,且总蛋白含量明显得到恢复。此外,TF3膳食干预后,T2DM小鼠肝脏、胰腺及肠道组织病变均有明显修复,与前期的生化指标变化规律相互印证。表明富含GABA红小豆膳食可能具有一定的护肝功效,同样发挥着护肝和修复肝脏损伤的功能,但其具体的详细调控机制仍有待深入研究。
总之,C57BL/6J糖尿病小鼠给予高剂量富含GABA红小豆膳食干预6周后,可显著降低T2DM小鼠体重和空腹血糖水平,减轻胰岛素抵抗,增强胰岛素敏感性,对抵抗超重及平衡血糖效果均优于阳性对照,并可降低血清中AST、ALT及总胆红素的水平,有效改善糖尿病引起的小鼠肝功能指标的异常,并能缓解高脂饮食造成的肝脏、胰腺和盲肠组织病理性损伤。表明富含GABA红小豆具有维持血糖稳态,减轻小鼠糖尿病症状的作用。
[1] 马娇,张园园,马琴,等.低GI枸杞杂粮代餐粉的配方优化及其降血糖作用研究[J/OL].食品与发酵工业:1-13.https://doi.org/10.13995/j.cnki.11-1802/ts.035665. MA J, ZHANG Y Y, MA Q, et al.Formula optimization of low GI barbary wolfberry multigrain meal replacement powder and its hypoglycemic effect[J/OL].Food and Fermentation Industries:1-13.https://doi.org/10.13995/j.cnki.11-1802/ts.035665.
[2] NGUELEFACK T B, FOFIE C K, NGUELEFACK-MBUYO E P, et al. Multimodal α-glucosidase and α-amylase inhibition and antioxidant effect of the aqueous and methanol extracts from the trunk bark of Ceiba pentandra[J]. BioMed Research International, 2020, 2020:3063674.
[3] XIONG Q, LI Z M, NIE R J, et al. Comparison of the effects of a bean-based and a white rice-based breakfast diet on postprandial glucose and insulin levels in Chinese patients with type 2 diabetes[J]. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research, 2021, 27: e930349.
[4] SHI Z X, YAO Y, ZHU Y Y, et al. Nutritional composition and biological activities of 17 Chinese adzuki bean (Vigna angularis) varieties[J]. Food and Agricultural Immunology, 2017, 28(1):78-89.
[5] ZHAO Q Y, HOU D Z, FU Y X, et al. Adzuki bean alleviates obesity and insulin resistance induced by a high-fat diet and modulates gut microbiota in mice[J]. Nutrients, 2021, 13(9):3240.
[6] WU G J, BAI Z Y, WAN Y J, et al. Antidiabetic effects of polysaccharide from azuki bean (Vigna angularis) in type 2 diabetic rats via insulin/PI3K/AKT signaling pathway[J]. Food Hydrocolloids, 2020, 101:105456.
[7] ZHAO Q Y, HOU D Z, LARAIB Y, et al. Comparison of the effects of raw and cooked adzuki bean on glucose/lipid metabolism and liver function in diabetic mice[J]. Cereal Chemistry, 2021, 98(5):1081-1090.
[8] LIU Y P, WANG Q Y, LI S S, et al. Convenient food made of extruded adzuki bean attenuates inflammation and improves glycemic control in patients with type 2 diabetes: A randomized controlled trial[J]. Therapeutics and Clinical Risk Management, 2018, 14:871-884.
[9] JIAO C F, LIU Y S. GABA mediates NO/cGMP/GSK-3-induced isoflavone accumulation in soybean sprouts[J]. LWT, 2021, 135:110027.
[10] 李海峰, 李冰冰, 石硕硕, 等. γ-氨基丁酸在食品中的应用研究进展[J]. 河南工业大学学报(自然科学版), 2023, 44(1):117-125.
LI H F, LI B B, SHI S S, et al. Research progress on the application of γ-aminobutyric acid in food[J]. Journal of Henan University of Technology (Natural Science Edition), 2023, 44(1):117-125.
[11] YI Z, WASEEM GHANI M, GHANI H, et al. Gimmicks of gamma-aminobutyric acid (GABA) in pancreatic β-cell regeneration through transdifferentiation of pancreatic α- to β-cells[J]. Cell Biology International, 2020, 44(4):926-936.
[12] CHAIYASUT C, SIVAMARUTHI B S, PENGKUMSRI N, et al. Germinated Thai black rice extract protects experimental diabetic rats from oxidative stress and other diabetes-related consequences[J]. Pharmaceuticals, 2016, 10(1):3.
[13] SI X, SHANG W T, ZHOU Z K, et al. Gamma-aminobutyric acid enriched rice bran diet attenuates insulin resistance and balances energy expenditure via modification of gut microbiota and short-chain fatty acids[J]. Journal of Agricultural and Food Chemistry, 2018, 66(4):881-890.
[14] 石磊, 瞿华, 郑宏庭, 等. 肝脏糖脂代谢研究的趋势变化分析与展望[J]. 生理学报, 2021, 73(5):781-794.
SHI L, QU H, ZHENG H T, et al. Developmental trend analysis and perspectives on researches related to hepatic glucose and lipid metabolism[J]. Acta Physiologica Sinica, 2021, 73(5):781-794.
[15] BRØNS C, JENSEN C B, STORGAARD H, et al. Impact of short-term high-fat feeding on glucose and insulin metabolism in young healthy men[J]. The Journal of Physiology, 2009, 587(Pt 10):2387-2397.
[16] KUO F Y, CHENG K C, LI Y X, et al. Oral glucose tolerance test in diabetes, the old method revisited[J]. World Journal of Diabetes, 2021, 12(6):786-793.
[17] SOHRABIPOUR S, SHARIFI M R, TALEBI A, et al. GABA dramatically improves glucose tolerance in streptozotocin-induced diabetic rats fed with high-fat diet[J]. European Journal of Pharmacology, 2018, 826:75-84.
[18] XIONG Q, LI Z M, NIE R J, et al. Comparison of the effects of a bean-based and a white rice-based breakfast diet on postprandial glucose and insulin levels in Chinese patients with type 2 diabetes[J]. Medical Science Monitor: International Medical Journal of Experimental and Clinical Research, 2021, 27: e930349.
[19] LOMONACO R, GODINEZ LEIVA E, BRIL F, et al. Advanced liver fibrosis is common in patients with type 2 diabetes followed in the outpatient setting: The need for systematic screening[J]. Diabetes Care, 2021, 44(2):399-406.
[20] KUCHAY M S, KRISHAN S, MISHRA S K, et al. Effect of dulaglutide on liver fat in patients with type 2 diabetes and NAFLD: Randomised controlled trial (D-LIFT trial)[J]. Diabetologia, 2020, 63(11):2434-2445.