枇杷属于蔷薇科枇杷属植物,是我国南方主要经济树种和名贵特产果树之一。枇杷在9月份左右开始进入花期,其花期长、花量大,花序为簇生,每个花序上可多达200朵花[1]。为提高枇杷产量及品质,在种植过程中需进行疏花管理,每年每株枇杷树约有60%~80%的花蕾被疏去[2-3],疏掉的枇杷花除少量被加工成花茶,大部分被丢弃,造成极大的资源浪费。国家卫健委2019年第2号公告中明确了枇杷花为新食品原料[4],这为枇杷花在食品加工领域的应用奠定了基础。以枇杷花及其功能提取物为原料,创制健康食品,不仅避免枇杷花资源浪费,且产品附加值高,作为天然植物健康食品也必然受到人们青睐,具有广阔市场。
中医认为枇杷花味淡,性温可入药,可用于治疗感冒咳嗽、鼻塞流涕、虚劳久咳、痰血等症状[5]。现代研究表明,枇杷花含有多种功能物质,主要包括氨基酸、维生素C、黄酮类、多酚类和三萜类等[6-11],具有抗炎、抗氧化、抑菌、抗肿瘤等多种功效[12-19]。近年来,对于枇杷花的研究主要集中在枇杷花茶工艺及其品质分析、单一功能物质提取及其活性评价[20-22],以抗炎活性为指标进行抗炎物质提取制备的研究较少,关于品种及采收期对抗炎活性物质制备的影响鲜见报道。目前,体外抗炎活性评价方法有细胞实验法和化学方法,一氧化氮(NO)法和牛血清白蛋白(bovine albumin,BSA)变性法是常用的化学评价方法。细胞实验法操作较复杂,检测周期长,而NO作为炎症发病机制中关键信号分子,其生成抑制率的测定操作简便,且能快速检测。胡帅[23]采用NO生成抑制率对粟谷蛋白及其消化产物进行了抗炎作用评价。
因此,本文以NO生成抑制率为评价指标,优化枇杷花抗炎活性物质的提取工艺;在此基础上,对不同品种、不同采收期枇杷花抗炎提取物的成分及活性进行分析,以期为枇杷花抗炎物质的制备及其开发利用提供一定理论指导。
1 材料与方法
1.1 材料与试剂
枇杷花由宁海县现代果树研究所提供;二水合硝普钠(sodium nitroprusside dihydrate,SNP)、磺胺、盐酸萘乙二胺、乙醇等分析纯试剂、甲酸、甲醇(色谱纯),国药集团化学试剂有限公司;白麻苷、百蕊草素、金丝桃苷、芦丁、槲皮苷、阿福豆苷、山奈酚标准品,成都普瑞法科技开发有限公司。
1.2 仪器与设备
HRY-250智能恒温恒湿培养箱,波赛福实验仪器有限公司;UV-2000紫外可见分光光度计,上海瞬宇恒平科技有限公司;415R型冷冻离心机,德国Eppendorf公司;1260型高效液相色谱仪,安捷伦科技有限公司。
1.3 实验方法
1.3.1 NO生成抑制率的测定
参考KETNAWA等[24]的方法,以NO清除能力评价抗炎活性,将0.2 mL样品、1.3 mL PBS和0.5 mL SNP溶液混匀放入恒温培养箱中,37 ℃下光照2 h后加入2 mL Griess试剂,室温避光反应20 min,在540 nm处测定溶液的吸光值,空白组以蒸馏水替代样品。NO生成抑制率计算公式如公式(1)所示:
(1)
式中:D为NO生成抑制率;A0为空白组吸光值;A1为样品组吸光值。
1.3.2 提取溶剂对提取物抗炎活性的影响
称取一定量枇杷花粉末,以甲醇、乙醇、丙酮、乙酸乙酯为提取溶剂,在料液比为1∶30(g∶mL),室温条件下浸泡提取1 h后离心(8 000 r/min,10 min)取上清液,测其NO生成抑制率。
1.3.3 溶剂浓度对提取物抗炎活性的影响
称取一定量枇杷花粉末,以不同体积分数乙醇(100%、80%、60%、40%、20%)为提取溶剂,在料液比1∶30(g∶mL),室温条件下浸泡提取1 h,离心(8 000 r/min,10 min)取上清液测其NO生成抑制率。
1.3.4 温度对提取物抗炎活性的影响
称取一定量枇杷花粉末, 以40%乙醇为提取溶剂,按料液比1∶30(g∶mL),分别在不同温度下(40、50、60、70、80 ℃)浸泡提取 1 h,离心(8 000 r/min,10 min)取上清液测其NO生成抑制率。
1.3.5 时间对提取物抗炎活性的影响
称取一定量枇杷花粉末,以40%乙醇为提取溶剂,在料液比1∶30(g∶mL),60 ℃条件下分别提取20、40、60、80、100 min,离心(8 000 r/min,10 min)取上清液测其NO生成抑制率。
1.3.6 料液比对提取物抗炎活性的影响
称取一定量枇杷花粉末,以40%乙醇为提取溶剂,在料液比分别为1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL),60 ℃条件下浸泡提1 h,离心(8 000 r/min,10 min)取上清液测其NO生成抑制率。
1.3.7 枇杷花抗炎活性物质提取工艺的优化
根据实验结果,选取对提取物抗炎活性影响较大的3个因素,设计L9(33)正交试验,以确定枇杷花抗炎活性物质提取的最优条件,L9(33)正交实验设计具体见表1。
表1 L9(33)正交试验因素水平设计
Table 1 L9(33) orthogonal test factor level setting

水平因素A(温度)/℃B(料液比)(g∶mL)C(时间)/min1401∶20202501∶30403601∶4060
1.3.8 不同采收期枇杷花抗炎提取物成分分析
分别收集10月、11月、12月白沙和大红袍2个枇杷品种的枇杷花,经过除杂、干燥、粉碎过筛后,以1.3.7节优化提取条件制得枇杷花抗炎提取物。采用HPLC对提取物进行分析,具体操作如下:
样品过0.22 μm滤膜后进行HPLC分析,色谱柱:InfinityLab Poroshell 120 EC-C18柱(150 mm×4.6 mm,5.0 μm);流动相:甲醇-0.2%甲酸水溶液(20∶80,体积比),等梯度洗脱;流速:0.9 mL/min;检测波长:370 nm;柱温30 ℃;进样量:10 μL。以白麻苷、百蕊草素、金丝桃苷、芦丁、槲皮苷、阿福豆苷、山奈酚等标准品制作标曲,计算样品中相应物质的含量。
1.4 数据处理
每个实验均平行测定3次,结果取平均值,所有数据采用SPSS Statistics 21软件分析,用Origin 2018和GraphPad Prism 8.0作图。
2 结果与分析
2.1 提取溶剂对提取物抗炎活性的影响
甲醇、乙醇、丙酮、乙酸乙酯等常用提取溶剂对枇杷花提取物抗炎活性的影响如图1所示,丙酮提取物对NO生成抑制率影响最大,达到80.27%,表明其抗炎活性最强,即丙酮提取效果最佳;其次是甲醇和乙醇,二者提取物的NO生成抑制率分别为67.94%和66.63%;而乙酸乙酯极性相对较小,其提取液的NO生成抑制效果较差,表明枇杷花抗炎活性物质可能是极性较强的物质。兼顾操作安全性,综合考虑选择乙醇作为提取溶剂。
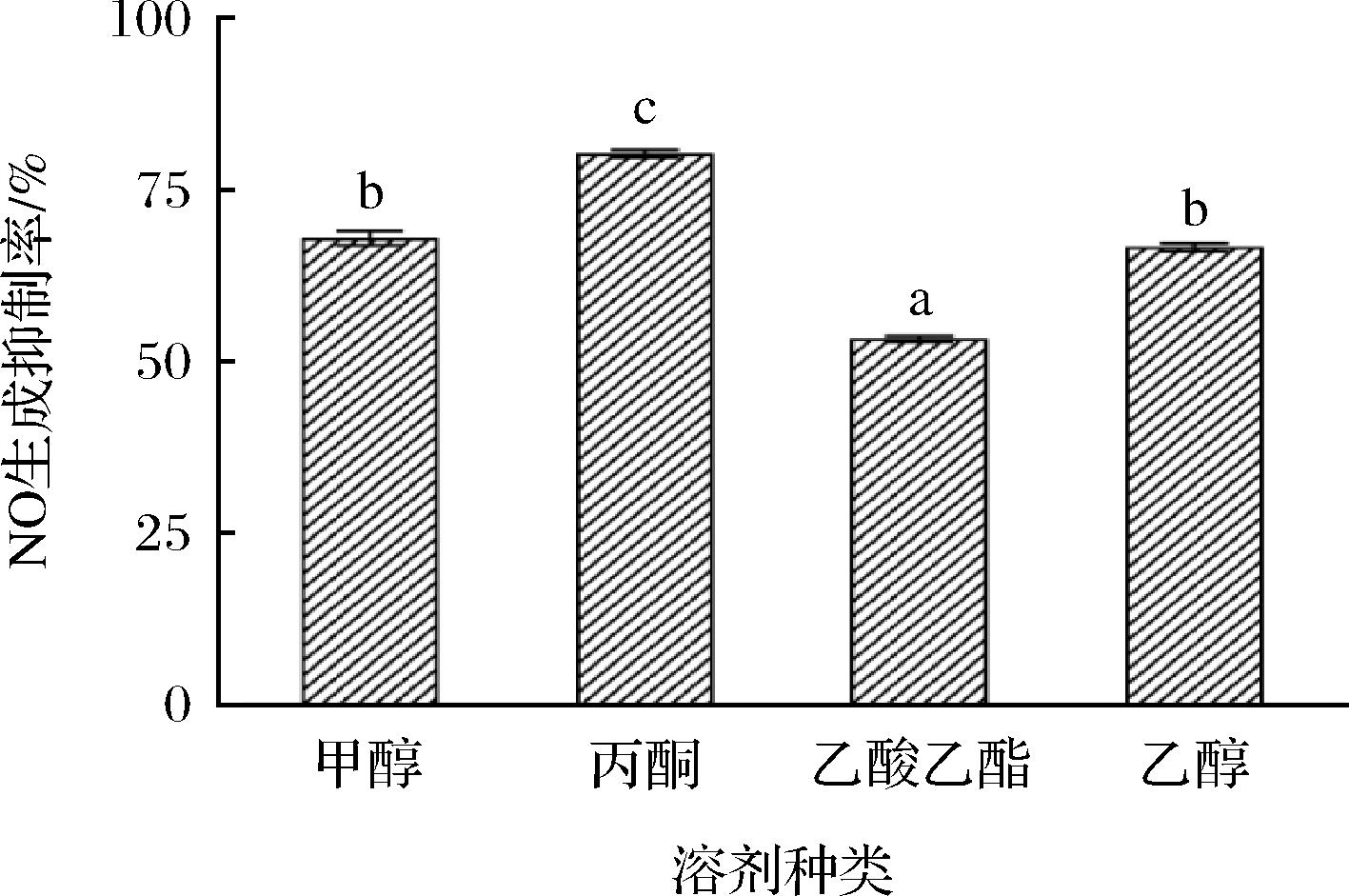
图1 提取溶剂对提取物抗炎活性的影响
Fig.1 Effect of extraction solvent on the anti-inflammatory activity of extracts
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 溶剂体积分数对提取物抗炎活性的影响
提取溶剂体积分数的不同对提取物效果有一定影响,乙醇体积分数对枇杷花提取物抗炎活性的影响如图2所示,乙醇体积分数对提取物抗炎活性影响较小,NO生成抑制率随着乙醇体积分数的增加呈现先升高后下降的趋势,乙醇体积分数为40%时NO生成抑制率达到最大;随着乙醇体积分数的不断增加,提取物对NO生成抑制率的影响降低,后趋于平缓。这可能是因为随着乙醇体积分数的增加,溶剂的极性不断增大,有利于枇杷花抗炎物质的溶出,但随着溶剂极性的不断增大,影响了枇杷花中部分水溶性功能物质的溶出,反而导致提取物活性有所下降。因此选择40%乙醇溶液提取枇杷花抗炎物质较为合适。
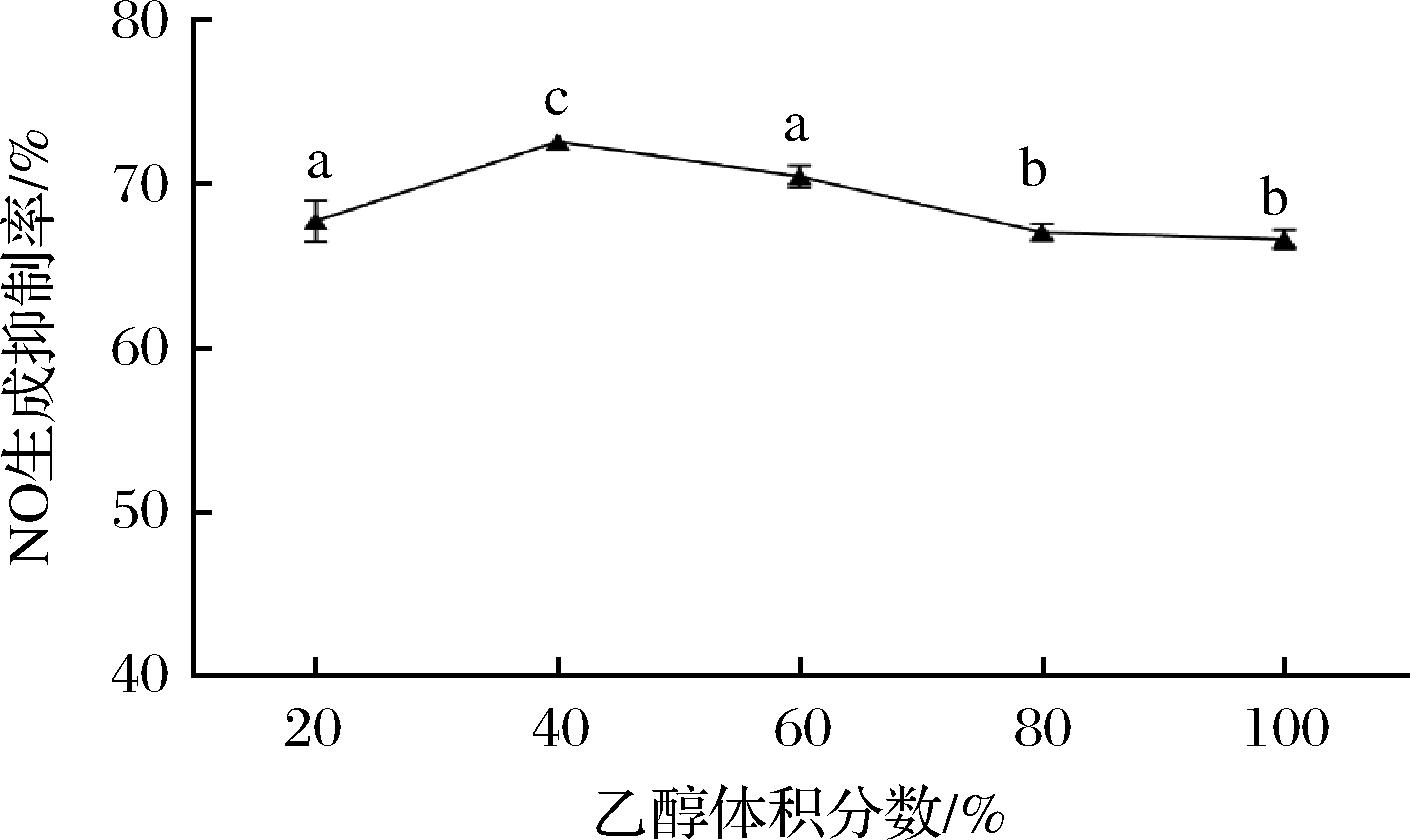
图2 溶剂体积分数对提取物抗炎活性的影响
Fig.2 Effect of solvent volume fraction on the anti-inflammatory activity of extracts
2.3 提取温度对提取物抗炎活性的影响
提取温度对枇杷花提取物抗炎活性的影响如图3所示,随着温度的升高,NO生成抑制率先上升后下降,50 ℃时抑制率最高;温度高于50 ℃之后,NO生成抑制率下降,可能是由于提取温度过高,提取物中部分热敏性物质被降解或结构发生了变化,从而导致提取物NO生成抑制率降低,因此选取50 ℃作为提取温度较合适。
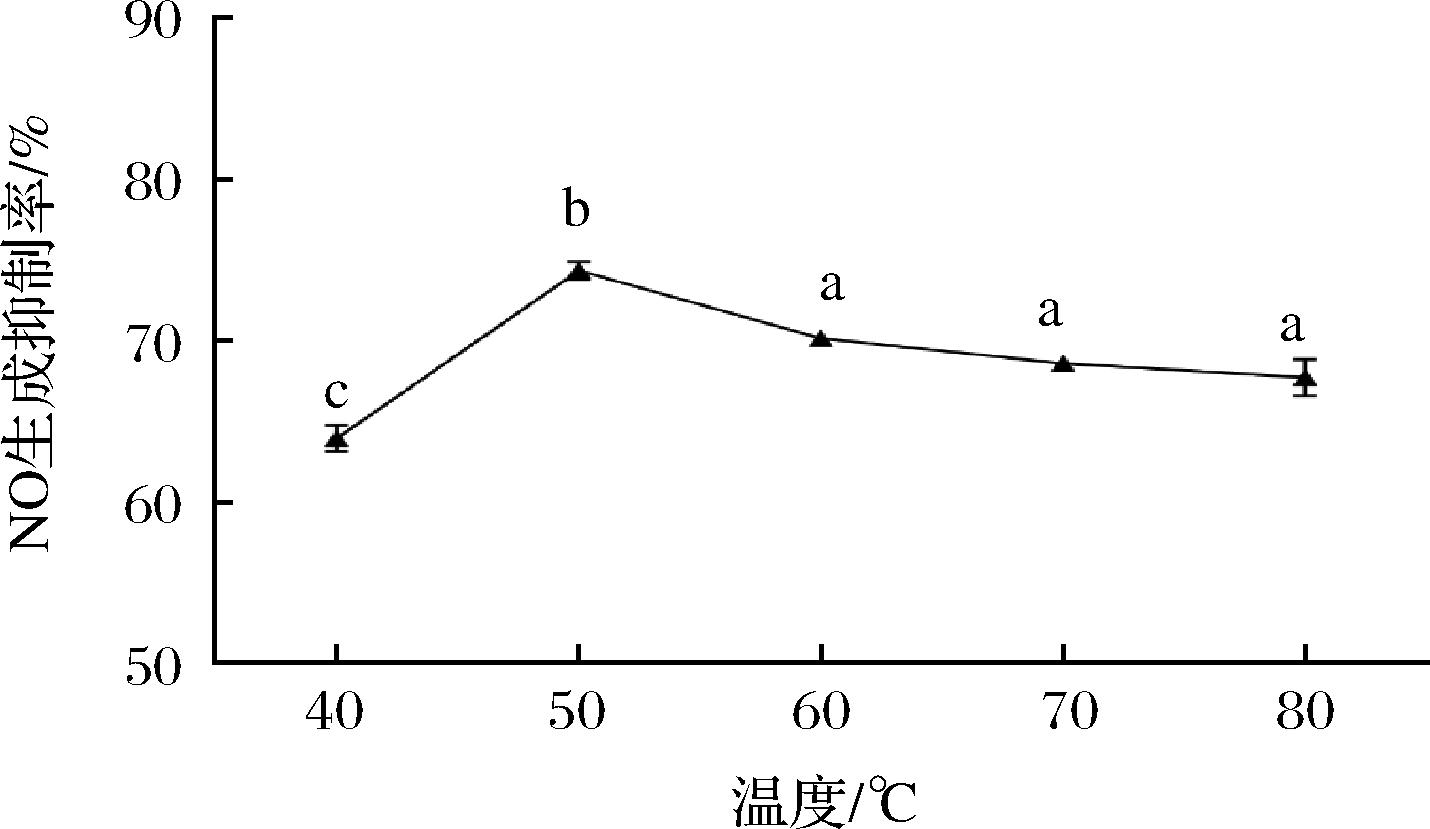
图3 温度对提取物抗炎活性的影响
Fig.3 Effect of temperature on the anti-inflammatory activity of extracts
2.4 提取时间对提取物抗炎活性的影响
提取时间对枇杷花提取物抗炎活性的影响如图4所示,随着提取时间的延长,提取物抗炎活性逐渐提升,40 min时NO生成抑制率达到最大值;但随着提取时间继续延长,NO生成抑制率显著下降(P<0.05),这可能是因为加热时间过长,提取物中一些热不稳定性物质发生降解,从而导致其抗炎活性下降。提取时间达到60 min后提取物抗炎活性无显著性差异(P>0.05)。因此,40 min为适宜的提取时间。
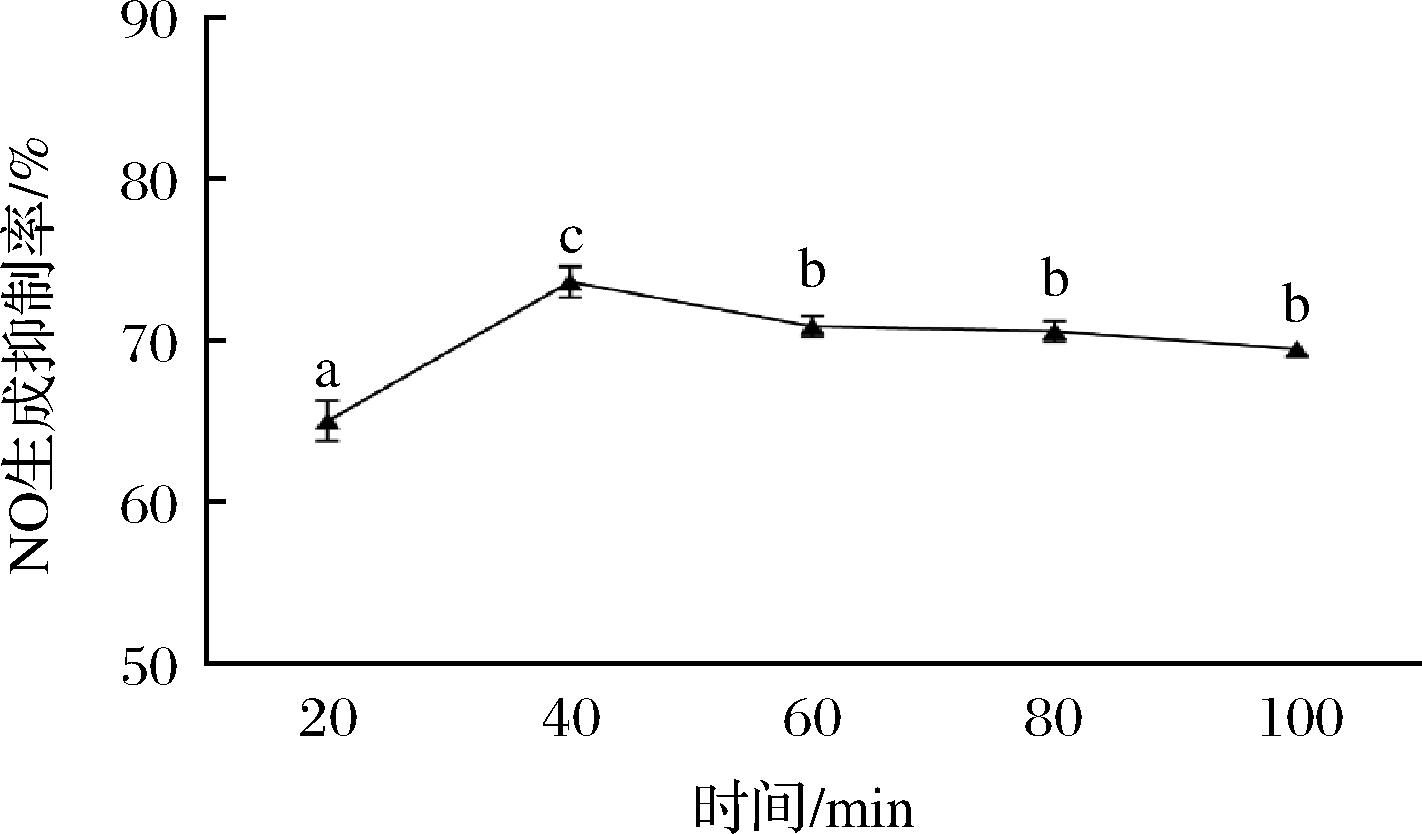
图4 时间对提取物抗炎活性的影响
Fig.4 Effect of time on the anti-inflammatory activity of extracts
2.5 料液比对提取物抗炎活性的影响
料液比对提取物抗炎活性的影响如图5所示,随着料液比的增大,NO生成抑制率先上升再下降最后趋于平稳,在料液比为1∶30(g∶mL)时,NO生成抑制率最大,原因可能是料液比过小时,枇杷花中的抗炎活性物质无法全部溶解出来,随着料液比的增加,抗炎活性物质溶出逐渐增多,但随着料液比继续增大,部分杂质溶出亦加大,反而不利于提取物抗炎活性,因此,料液比为1∶30(g∶mL)时,枇杷花提取物抗炎活性较好。
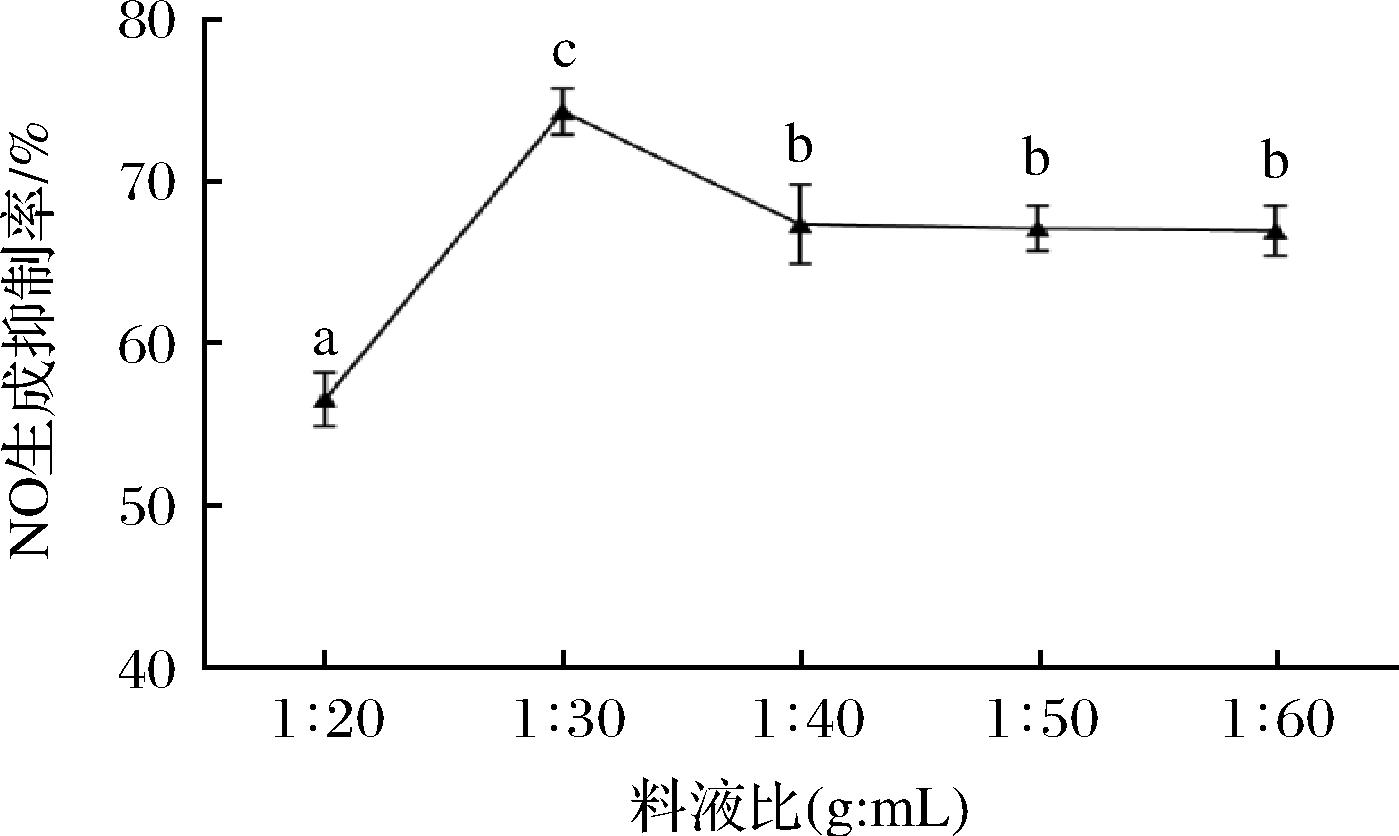
图5 料液比对提取物抗炎活性的影响
Fig.5 Effect of solid-liquid ratio on the anti-inflammatory activity of extracts
2.6 枇杷花抗炎活性物质提取工艺的优化
选取对提取物抗炎活性影响较大的3个因素:提物温度、料液比、提取时间,进行L9(33)正交试验,结果见表2和表3。经过F检验发现提取温度和料液比对提取物NO生成抑制率有显著影响(P<0.05),而提取时间则无显著影响(P>0.05)。由表2可以看出,3个因素的主次关系为A>B>C,最优条件为A2B3C3,即提取温度为50 ℃,料液比为1∶40(g∶mL),提取时间为60 min。该条件下提取液对NO生成抑制率达到75.92%,抗炎活性最佳。HPLC分析(图6)表明该提取物中主要为黄酮类物质,且金丝桃苷和芦丁含量最高。
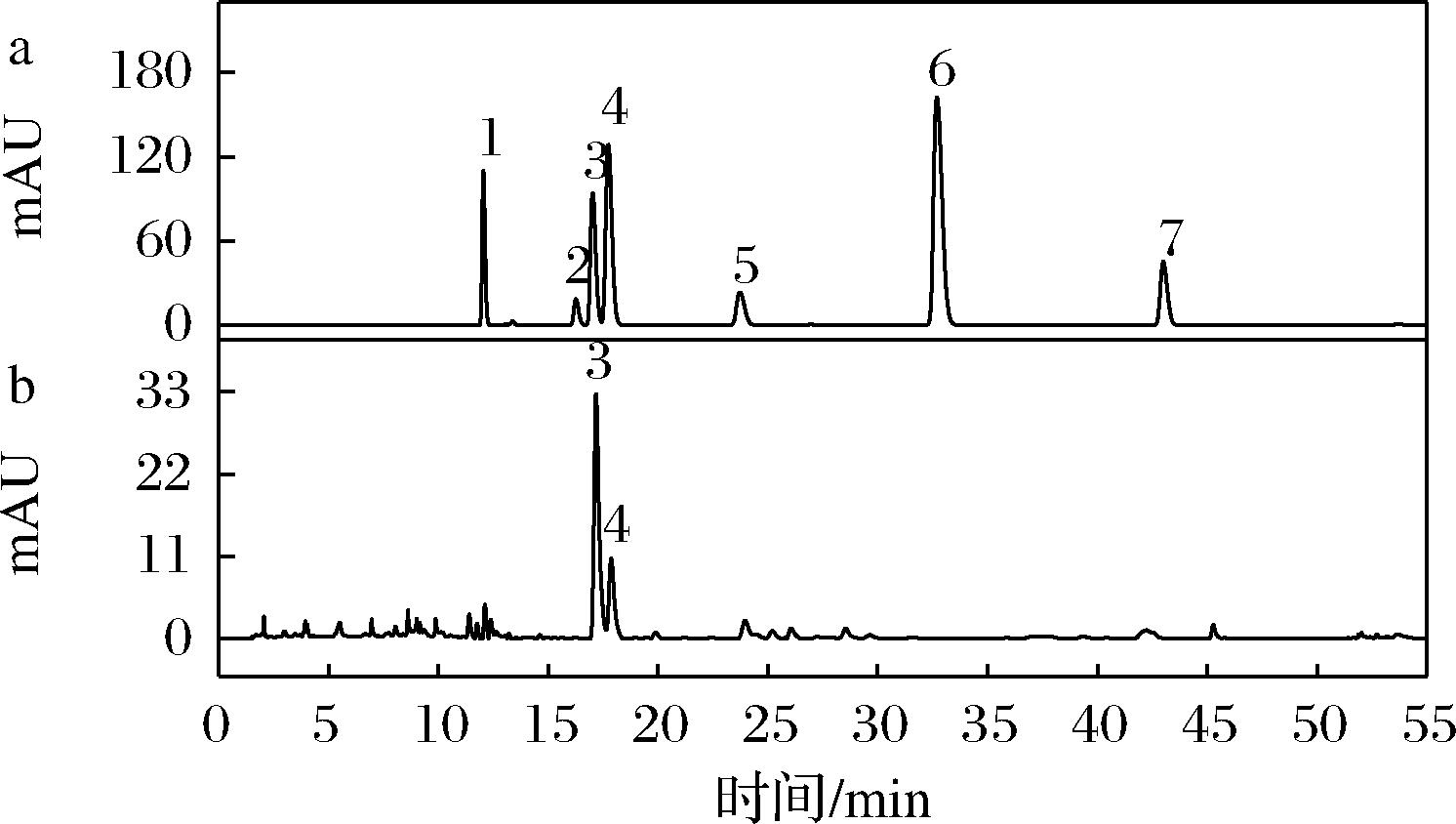
1-白麻苷;2-百蕊草素;3-金丝桃苷;4-芦丁;5-槲皮苷;6-阿福豆苷;7-槲皮素a-标准品;b-提取物
图6 枇杷花抗炎提取物的高效液相色谱图
Fig.6 HPLC analysis of anti-inflammatory extract from loquat flowers
表2 正交试验结果
Table 2 Orthogonal test results
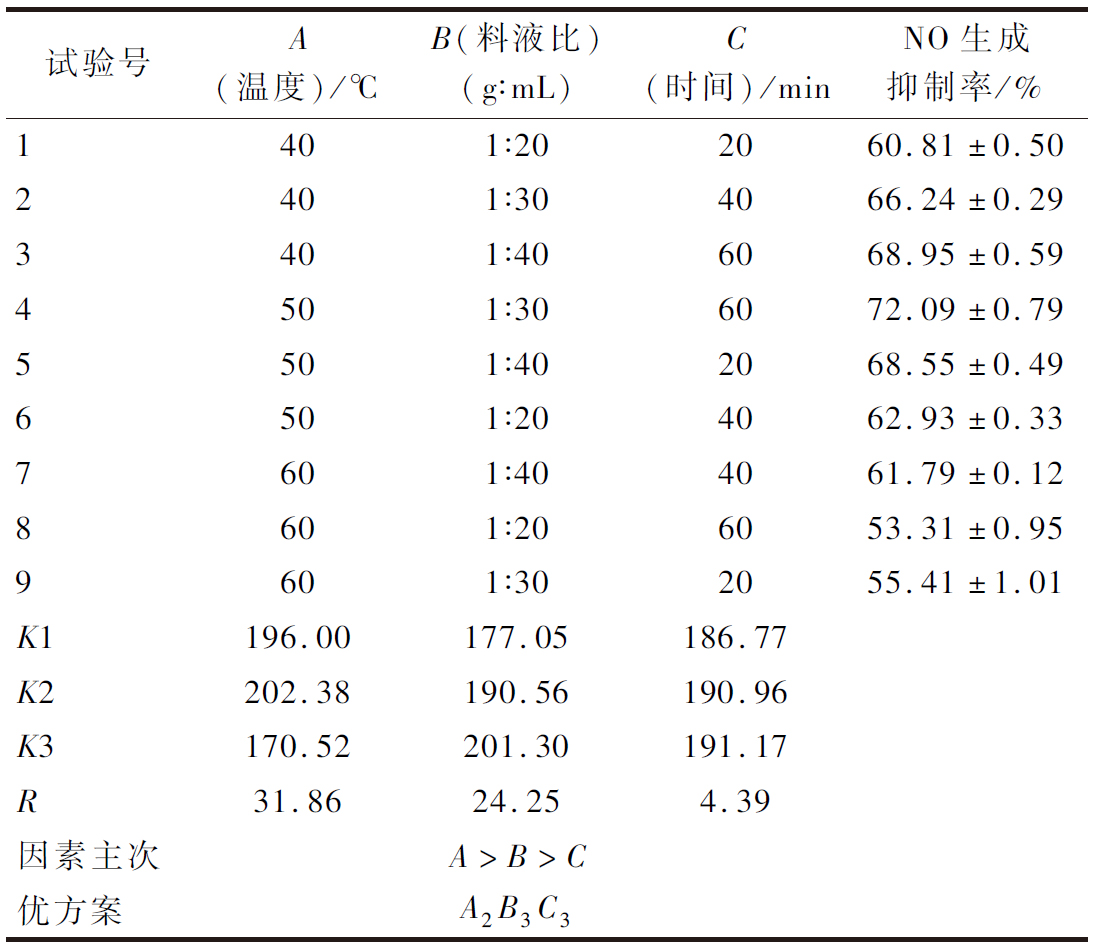
试验号A(温度)/℃B(料液比)(g∶mL)C(时间)/minNO生成抑制率/%1401∶202060.81±0.502401∶304066.24±0.293401∶406068.95±0.594501∶306072.09±0.795501∶402068.55±0.496501∶204062.93±0.337601∶404061.79±0.128601∶206053.31±0.959601∶302055.41±1.01K1196.00177.05186.77K2202.38190.56190.96K3170.52201.30191.17R31.8624.254.39因素主次A>B>C优方案A2B3C3
表3 不同采收期枇杷花抗炎提取物成分分析 单位:μg/g
Table 3 Analysis of anti-inflammatory extract from loquat flowers at different stages

类别采收期白麻苷金丝桃苷芦丁槲皮苷阿福豆苷总量10月176.4±3.7811.3±16.91 266.4±13.3119.9±1.2-2374白沙枇杷花 11月554.6±10.43 780.3±6.92 378.7±37.01 419.2±1.72.9±0.18 135.712月344.4±1.73 221.7±12.12 312.1±22.1935.8±1.3-681410月136.9±1.3653.3±19.41 101.2±21.1--1 891.4大红袍枇杷花11月348.3±4.83 068.0±15.31 921.6±372.21 419.2±1.71.3±0.16 759.412月182.3±34.92 038.0±145.21 437.7±159.0935.8±1.31.1±0.34 594.9
表3 正交试验方差分析
Table 3 Variance analysis of orthogonal test
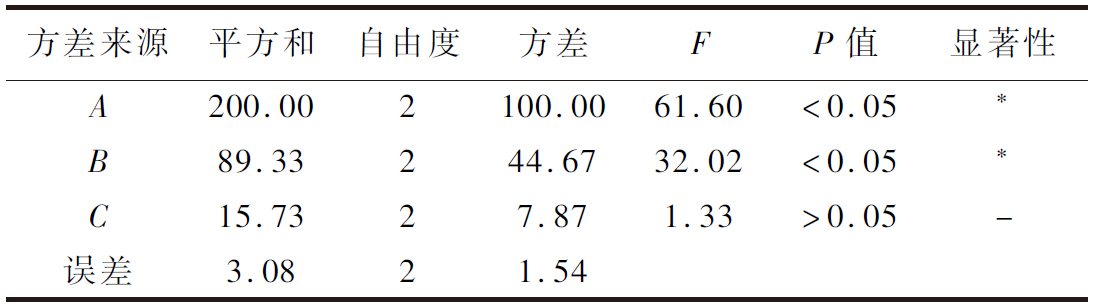
方差来源平方和自由度方差FP值显著性A200.002100.0061.60<0.05∗B89.33244.6732.02<0.05∗C15.7327.871.33>0.05-误差3.0821.54
注:*表明有显著性差异,-表明无显著性差异。
2.7 不同采收期枇杷花抗炎提取物成分分析
不同采收期枇杷花抗炎提取物成分分析如表3所示,3个采收期白沙枇杷花提取物中均检出不同含量的白麻苷、金丝桃苷、芦丁及槲皮苷,但阿福豆苷仅在11月采收期检出,其含量仅为2.9 μg/g;且11月白沙枇杷花提取物中黄酮类物质含量最高,总含量达到8 135.7 μg/g,而10月含量最低。大红袍枇杷花抗炎提取物中黄酮类物质组成与白枇杷花相似,但其10月采收期样品未检出槲皮苷和阿福豆苷;11月大红袍枇杷花抗炎提取物中黄酮类物质含量最高,达到6 759.4 μg/g。同一采收期不同品种枇杷花抗炎提取物中黄酮类物质的含量有较大差异,白沙枇杷花的含量均高于大红袍枇杷花。有研究发现,枇杷花中黄酮类物质含量受种质影响,不同种质间黄酮类物质含量存在显著性差异。此外,枇杷花中黄酮类物质含量与其花期也存在相关性[25-27],枇杷花处于花苞期时黄酮类物质开始累积,黄酮类物质的累积大于生长消耗,呈现稳步上升的趋势,于盛花期时积累达到顶峰,而到末花期黄酮类物质的消耗量高于累积量,则呈现出减少的趋势。试验中11月采收的枇杷花多处于盛花期,因此其提取物中黄酮类物质含量最高。
2.8 不同采收期枇杷花抗炎提取物活性分析
不同采收期枇杷花提取物抗炎活性对比如图7所示,同一采收期白沙枇杷花提取物抗炎活性均高于大红袍,且同一品种11月采收期的抗炎活性较好。实验结果表明,枇杷花提取物抗炎活性与其黄酮含量呈正相关性,黄酮类物质含量越高其抗炎活性越好。吴文明等[28]研究发现天仙果乙酸乙酯提取物总黄酮含量与抗炎活性呈正相关;尉松瑶等[29]从黑籽南瓜中提取黄酮类物质,随着提取物黄酮含量增加,其抗炎活性增强。诸多研究表明黄酮类化合物具有抗炎作用,目前已经有多种黄酮类药物用于治疗急性和慢性炎症。马莹慧等[30]研究发现,长白山红景天黄酮具有较好的抗炎活性,能够显著抑制脂多糖诱导的小鼠巨噬细胞分泌促炎因子,显著提高抗炎性因子的分泌量。实验表明,枇杷花抗炎提取物中主要黄酮类物质为金丝桃苷和芦丁,二者均属于黄酮醇苷类化合物,据报道其具有改善心血管、抗氧化、抗炎等诸多功能。杨莺等[31]研究发现,山楂叶金丝桃苷能够通过调控p38 MAPK/Sirt6/NF-κB信号通路来抗脂多糖诱导的小鼠巨噬细胞炎症反应作用。刘欣[32]的研究表明芦丁则是通过抑制TLR4-NF-κB信号通路中TLR4、TRAF6、p-κB蛋白表达水平来发挥其抗炎作用的。推测金丝桃苷和芦丁对枇杷花提取物的抗炎活性均有较大贡献度,后期将通过实验进一步验证。
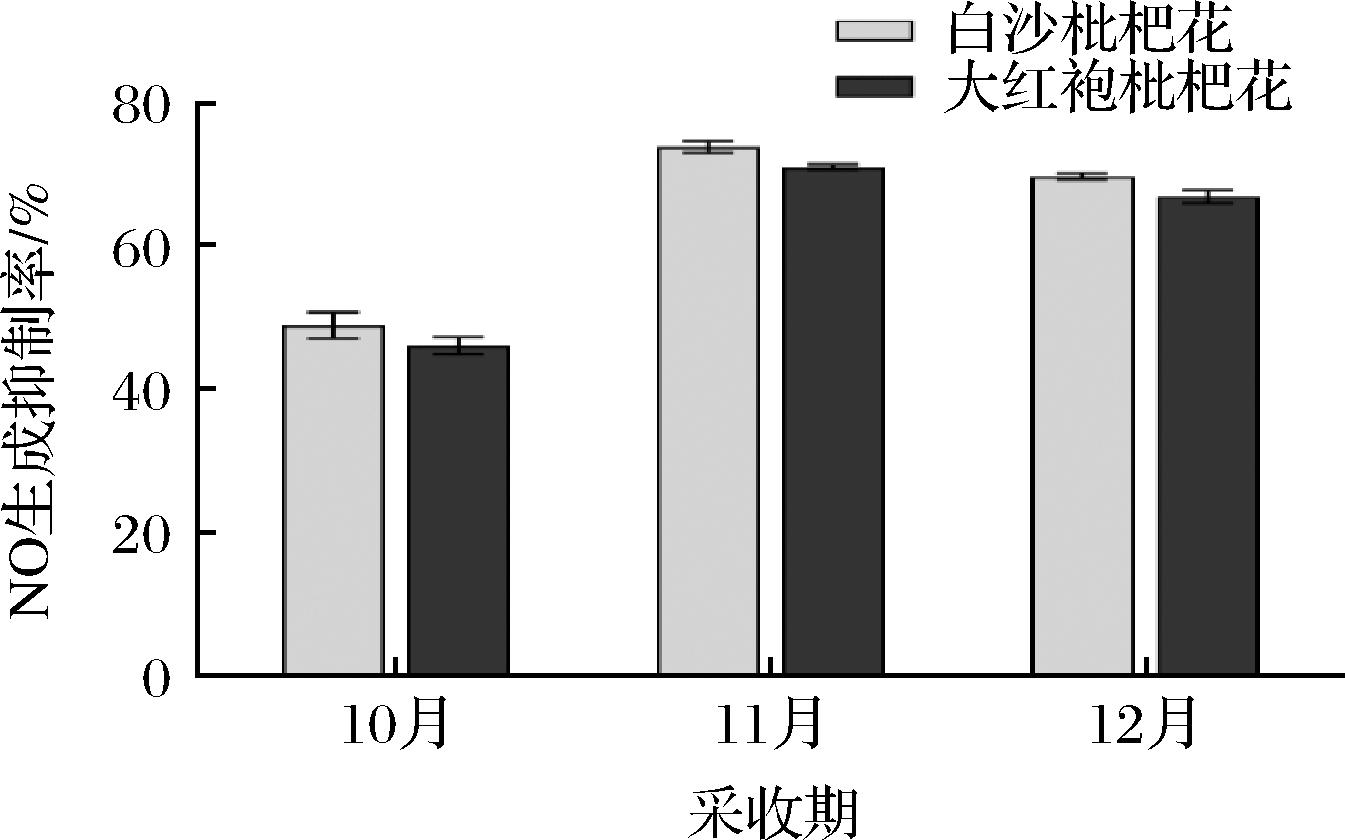
图7 不同采收期枇杷花抗炎提取物活性
Fig.7 Anti-inflammatory activities of the extracts from loquat flowers at different stages
3 结论
本文以抗炎活性为评价指标,优化了枇杷花抗炎活性物质的提取工艺,实验结果表明,在40%乙醇为提取溶剂,料液比1∶40(g∶mL),50 ℃下提取60 min条件下,提取物抗炎活性最佳。成分分析显示该提取物主要成分为金丝桃苷和芦丁。白沙和大红袍2种枇杷花不同采收期抗炎提取物的HPLC分析结果表明,2个品种枇杷花抗炎提取物中黄酮类物质主要为金丝桃苷、芦丁、白麻苷、槲皮苷及阿福豆苷,且11月提取物中黄酮类物质总含量均为最高,尤其是白沙枇杷花,达到8 135.7 μg/g。抗炎活性分析亦表明,11月份白沙枇杷花提取物抗炎活性最佳,提取物抗炎活性与其黄酮类物质存在一定相关性。本实验优化了枇杷花抗炎活性物质提取工艺,发现11月白沙枇杷花是抗炎提取物制备的适宜原料,研究结果可为枇杷花高抗炎提取物制备及高值化利用提供一定的参考,对减少枇杷花资源的浪费,开发高附加值产品具有重要意义。
[1] 应跃跃, 张蕾蕾, 王喜周.枇杷花利用价值和产品的综合开发[J].现代园艺, 2013(8):171-172.
YING Y Y, ZHANG L L, WANG X Z.Utilization value of loquat flowers and comprehensive development of products[J].Xiandai Horticulture, 2013(8):171-172.
[2] 李琪, 张宏, 黄春萍, 等.枇杷花化学成分及抗菌抗肿瘤活性研究[J].西南农业学报, 2014, 27(2):739-742.
LI Q, ZHANG H, HUANG C P, et al.Studies on chemical constituents of flowers of Eriobotrya japonica L. and antibacterial, antineoplastic activity[J].Southwest China Journal of Agricultural Sciences, 2014, 27(2):739-742.
[3] 文卫华. 枇杷疏花疏果技术及对产量品质影响研究[J].湖南林业科技, 2007, 34(6):17-19.
WEN W H.Effects on the production and quality of Eriobotrya japonica by thinning flower and fruit technology[J].Hunan Forestry Science &Technology, 2007, 34(6):17-19.
[4] 解读《关于弯曲乳杆菌等24种“三新食品”的公告》[J].中国食品卫生杂志, 2019, 31(4):312;319;344;384.
Interpretation of “announcement on 24 kinds of three new foods such as Lactobacillus curvatus”[J].Chinese Journal of Food Hygiene, 2019, 31(4):312;319;344;384.
[5] 王翰华, 阮洪生, 陈云.枇杷花化学成分及其药理作用研究进展[J].中成药, 2019, 41(12):2977-2981.
WANG H H, RUAN H S, CHEN Y.Research progress on chemical constituents and pharmacological effects of loquat flowers[J].Chinese Traditional Patent Medicine, 2019, 41(12):2977-2981.
[6] 姜帆, 周丹蓉, 高慧颖, 等.枇杷种质花中黄酮含量分析与评价[J].植物遗传资源学报, 2016, 17(6):1031-1035.
JIANG F, ZHOU D R, GAO H Y, et al.Analysis and evaluation of flavonoid content in flowers of loquat (Eriobotrya japonica (Thunb.) Lindl.) germplasm resources[J].Journal of Plant Genetic Resources, 2016, 17(6):1031-1035.
[7] 郑美瑜, 陆胜民, 陈剑兵, 等.枇杷花总黄酮的提取工艺优化[J].食品与发酵科技, 2009,45(4):52-54.
ZHENG M Y, LU S M, CHEN J B, et al.Study on extraction technology of flavonoids in loquat flowers[J].Food and Fermentation Technology, 2009, 45(4):52-54.
[8] 刘玉明, 李珂娴, 何颖, 等.枇杷花水提液总酚含量的Folin-Ciocalteu法测定[J].时珍国医国药, 2017, 28(4):838-840.
LIU Y M, LI K X, HE Y, et al.Determination of total phenols content in water extract of flowers of Eriobotrya japonica (Thunb.) Lindl.by Folin-Ciocalteu colorimetric method[J].Lishizhen Medicine and Materia Medica Research, 2017, 28(4):838-840.
[9] 闫永芳, 过尘杰, 孙钧, 等.宁海白枇杷花中酚类物质鉴定及含量测定[J].中国食品学报, 2012, 12(4):202-207.
YAN Y F, GUO C J, SUN J, et al.Identification and determination of phenols in loquat flower by HPLC-PAD-MS[J].Journal of Chinese Institute of Food Science and Technology, 2012, 12(4):202-207.
[10] 谢田伟. 枇杷花黄酮与精油的提取及其性质分析研究[D].厦门:集美大学, 2012.
XIE T W.Study on Extraction and property analysis of flavonoids and essential oil from loquat flower[D].Xiamen:Jimei University, 2012.
[11] 蒋际谋, 胡文舜, 姜帆, 等.贵妃枇杷花提取液挥发性成分GC-MS分析[J].福建农业学报, 2013, 28(6):545-551.
JIANG J M, HU W S, JIANG F, et al.Aromatic compounds in essential oil of Guifei loquat flowers[J].Fujian Journal of Agricultural Sciences, 2013, 28(6):545-551.
[12] 黄桂丽, 王毓宁, 马佳佳, 等.枇杷花多酚对脂肪酶的抑制作用[J].江苏农业学报, 2021, 37(1):192-196.
HUANG G L, WANG Y N, MA J J, et al.Inhibitory effect of loquat flowers polyphenolics on lipase activity[J].Jiangsu Journal of Agricultural Sciences, 2021, 37(1):192-196.
[13] 何莲, 张宏, 李琪, 等.枇杷花系统溶剂提取物抑菌作用研究[J].食品科学, 2007, 28(12):109-112.
HE L, ZHANG H, LI Q, et al.Study on bacteriostasis of extracts from flowers of Eriobotrya japonica (Thunb.) Lindl.by systematic solvents[J].Food Science, 2007, 28(12):109-112.
[14] 杨子敬, 饶桂维, 王磊.超声波辅助双水相提取枇杷花总黄酮工艺优化及其抗氧化性[J].食品工业科技, 2021, 42(19):218-225.
YANG Z J, RAO G W, WANG L.Optimization of ultrasonic assisted aqueous two-phase extraction of total flavonoid from loquat flower and its antioxidant activity[J].Science and Technology of Food Industry, 2021, 42(19):218-225.
[15] 芦艳, 鲁周民, 樊美丽.枇杷花不同花期醇提物抗氧化活性的比较[J].现代食品科技, 2013, 29(9):2141-2146.
LU Y, LU Z M, FAN M L.Antioxidant activity of ethanol extracts of loquat flowers at different flowering phases[J].Modern Food Science and Technology, 2013, 29(9):2141-2146.
[16] 吴媛琳, 赵听, 张凯煜, 等.枇杷不同部位主要有效成分含量及抗氧化活性比较[J].西北林学院学报, 2015, 30(1):196-201.
WU Y L, ZHAO T, ZHANG K Y, et al.Main active ingredient contents and the antioxidant activity of different parts of Eriobotray japonica[J].Journal of Northwest Forestry University, 2015, 30(1):196-201.
[17] 姜帆, 高慧颖, 郑少泉.枇杷花茶水提物消炎与促进小肠运动作用的研究[J].福建农业学报, 2016, 31(7):743-746.
JIANG F, GAO H Y, ZHENG S Q.Anti-inflammatory and intestinal movement enhancing effects of water extract from flowers of Eriobotray japonica(Thumb.) Lindl[J].Fujian Journal of Agricultural Sciences, 2016, 31(7):743-746.
[18] 王静波, 杨必坤, 张宏, 等.枇杷花提取物止咳作用研究[J].中草药, 2009, 40(7):1106-1109.
WANG J B, YANG B K, ZHANG H, et al.Study on cough relieving effect of loquat flower extract[J].Chinese Traditional and Herbal Drugs, 2009, 40(7):1106-1109.
[19] 陈晓芳, 张倩, 吴文倩, 等.枇杷花醇提物止咳化痰作用实验研究[J].中成药, 2013, 35(1):167-169.
CHEN X F, ZHANG Q, WU W Q, et al.Experimental study on the antitussive and expectorant effects of alcohol extract from loquat flowers[J].Chinese Traditional Patent Medicine, 2013, 35(1):167-169.
[20] ITO H, KOBAYASHI E, LI S H, et al.Megastigmane glycosides and an acylated triterpenoid from Eriobotrya japonica[J].Journal of Natural Products, 2001, 64(6):737-740.
[21] KIM J S, HARIKRISHNAN R, KIM M C, et al.Enhancement of Eriobotrya japonica extracts on non-specific immune response and disease resistance in kelp grouper Epinephelus bruneus against Vibrio carchariae[J].Fish &Shellfish Immunology, 2011, 31(6):1193-1200.
[22] ITO H, KOBAYASHI E, LI S H, et al.Antitumor activity of compounds isolated from leaves of Eriobotrya japonica[J].Journal of Agricultural and Food Chemistry, 2002, 50(8):2400-2403.
[23] 胡帅. 发芽及热处理对粟谷蛋白抗炎、抗氧化的影响及其活性肽的分离与鉴定[D].南昌:南昌大学, 2020.
HU S.Effects of germination and heat treatment on antioxidant and anti-inflammatory properties of foxtail millet (Setaria italica) proteins and separation and identification of the biaoactive pepertides[D].Nanchang:Nanchang University, 2020.
[24] KETNAWA S, OGAWA Y.Evaluation of protein digestibility of fermented soybeans and changes in biochemical characteristics of digested fractions[J].Journal of Functional Foods, 2019, 52:640-647.
[25] 李琪, 杨必坤, 张晓喻, 等.枇杷花主要有效成分的含量[J].广西植物, 2009, 29(5):698-702.
LI Q, YANG B K, ZHANG X Y, et al.Contents of effective components in flowers of Eriobotrya japonica[J].Guihaia, 2009, 29(5):698-702.
[26] 杨必坤. 枇杷花药材质量标准研究[D].成都:四川师范大学, 2010.
YANG B K.Studies on the quality criterion of flowers of Eriobotrya japonica(Thunb)Lindl[D].Chengdu:Sichuan Normal University, 2010.
[27] 蒋园园. 枇杷成花时间调控的分子机制研究[D].广州:华南农业大学, 2019.
JIANG Y Y.Molecular mechanism study on the loquat flowering time regulation[D].Guangzhou:South China Agricultural University, 2019.
[28] 吴文明, 胡建新, 侯雄军, 等.天仙果总黄酮含量及抗氧化抗炎活性研究[J].今日药学, 2022, 32(11):823-829.
WU W M, HU J X, HOU X J, et al.The total flavonoids contents, antioxidant and anti-inflammatory activities of Ficus beecheyan[J].Pharmacy Today, 2022, 32(11):823-829.
[29] 尉松瑶, 高冷, 高晓晨, 等.响应面法优化提取黑籽南瓜黄酮类化合物及其抗炎活性的研究[J].食品科技, 2022, 47(5):238-245.
YU S Y, GAO L, GAO X C, et al.Extraction opitimization of flavonoids from Cucurbita Ficifolia bouché by response surface methodology and its anti-inflammatory activity[J].Food Science and Technology, 2022,47(5):238-245.
[30] 马莹慧, 熊馨, 李月, 等.长白山红景天黄酮组分的提取工艺及抗炎作用[J].中国兽医杂志, 2021, 57(11):56-61.
MA Y H, XIONG X, LI Y, et al.Extraction process of flavonoids from Rhodiola sachalinensis and its anti-inflammatory effect[J].Chinese Journal of Veterinary Medicine, 2021, 57(11):56-61.
[31] 杨莺, 姚新月, 李海波.山楂叶金丝桃苷对LPS诱导的RAW264.7巨噬细胞炎症反应的抑制作用[J].中国中医基础医学杂志, 2021, 27(6):944-949;1040.
YANG Y,YAO X Y,LI H B.Study on the inhibitory effects of hyperoside on lipopolysaccharides-induced inflammatory response in mouse macrophage RAW264.7[J].Chinese Journal of Basic Medicine in Traditional Chinese Medicine, 2021, 27(6):944-949;1040.
[32] 刘欣. 芦丁在脂多糖诱导的急性肺损伤小鼠体内抗炎作用的PK-PD模型研究[D].沈阳:沈阳农业大学, 2020.
LIU X.Study on PK-PD model of anti-inflammatory effects of rutin in mice with acute lung injury induced by lipopolysaccharide[D].Shenyang:Shenyang Agricultural University, 2020.