食品3D打印技术是一种利用计算机辅助设计建模,制造出各种各样结构的新兴技术[1]。鱼糜营养丰富,将3D打印与传统鱼糜加工技术相结合,个性化创造食品的形状和纹理,可提高鱼糜产品的灵活性、创造性和节能性。从物性学的角度分析,鱼糜具有3D打印性,但使用纯鱼糜3D打印会出现易断丝、易变形等问题[2]。前期研究表明,马铃薯淀粉可以改善鱼糜3D打印效果[3],但是机制尚不清楚。目前研究主要集中优化材料特性以满足3D打印适应性方面,而蛋白质分子结构及分子间作用力的改变对材料3D可打印性的影响鲜有研究。
鱼糜的主要成分肌原纤维蛋白与淀粉都是高分子材料,通过分子间相互作用可形成共混体系。基于共混改性理论,通过控制共混体系的相行为有助于提高产品的质量,开发新的食品结构[4]。研究发现随着多糖比例的升高,肌原纤维蛋白和κ-卡拉胶的相分离现象增强,促进凝胶网络结构形成[5]。屈展平等[6]研究表明,马铃薯淀粉与小麦蛋白共混改性后,氢键强度增加,持水性增大,共混体系呈现出协同增强的效果。
金鲳鱼(Trachinotus ovatus)是我国主要的海水养殖鱼类之一,肉质鲜美,深受广大消费者的喜爱,年产值超过十亿元。目前,市场销售的金鲳鱼产品主要以鲜活产品和冷冻产品为主,其精深加工产品亟待开发。前期研究表明,金鲳鱼鱼糜3D打印产品具有较高的精确性和准确性,可获得理想的成型效果[3]。因此,本研究以金鲳鱼鱼糜和马铃薯淀粉为研究对象,借鉴共混改性理论研究共混体系流变特性、蛋白质结构和分子间作用力的变化规律对鱼糜3D可打印性的影响。本研究为鱼糜产品3D打印的配方设计与开发提供了理论支撑,丰富了蛋白质与多糖共混体系在非加热状态下相互作用的理论研究。
1 材料与方法
1.1 材料与试剂
鲜活金鲳鱼,广东省湛江市湖光市场;马铃薯淀粉,乐昌调味品有限公司;考马斯亮蓝蛋白测定试剂盒,Tris-Maleate缓冲溶液、溴化钾、氯化钠,北京索莱宝科技有限公司。
1.2 仪器与设备
BSA224S-CW电子分析天平,赛多利斯科学仪器(北京)有限公司;T18高速均质机,德国IKA公司;FDU-1100冷冻干燥机,日本东京理化器械株式会社;FOODBOT E1 3D食品打印机,杭州时印科技有限公司;HAAKE MARSIII流变仪,赛默飞世尔科技有限公司;TENSOR27红外光谱仪,德国布鲁克公司;Cary 60 UV-Vis紫外光谱仪,美国安捷伦科技公司;RF-5301PC荧光光谱仪,日本岛津公司。
1.3 实验方法
1.3.1 肌原纤维蛋白的提取
参考XIONG等[7]的方法提取肌原纤维蛋白。称取鱼糜样品添加到Tris-Maleate缓冲溶液A(0.02 mol/L,含0.05 mol/L KCl,pH 7)中,均质,离心(4 ℃,9 110×g,30 min)后除去上清液,向沉淀物中添加Tris-Maleate缓冲溶液B(0.02 mol/L,含0.6 mol/L KCl,pH 7),均质后放置60 min,离心(4 ℃,9 110×g,30 min)。上清液为肌原纤维蛋白溶液。将肌原纤维蛋白冷冻干燥,获得肌原纤维蛋白冻干粉,提取率为17.76%。
1.3.2 共混体系的制备
将肌原纤维蛋白粉与马铃薯淀粉按照质量比为10∶0、9∶1、8∶2、6∶4、4∶6、2∶8进行混合,均质(7 000 r/min,15 min)后测定共混体系的物理化学特性。
1.3.3 流变特性测定
参照潘燕墨等[8]的方法在常温下测定共混体系流变学特性。在线性黏弹性范围内进行动态振荡扫描,频率范围为0.1~10 Hz,记录复合模量(G*)。设置剪切速率范围0.1~100 s-1,测定静态表观黏度随剪切速率的变化规律。
1.3.4 共混体系傅里叶变换红外光谱的采集
参照HOU等[9]的方法,将待测样品进行红外光谱扫描,分辨率4 cm-1,扫描范围4 000~400 cm-1。
1.3.5 共混体系分子间作用力的测定
参考杨天等[10]的方法测定共混体系分子间作用力。首先配制5种试剂:S1(0.05 mol/L NaCl)、S2(0.6 mol/L NaCl)、S3(0.6 mol/L NaCl+1.5 mol/L尿素)、S4(0.6 mol/L NaCl+8 mol/L尿素)和S5(0.6 mol/L NaCl+8 mol/L尿素+0.5 mol/L β-巯基乙醇)。准确称取每份样品各2 g,分别加入以上试剂10 mL,均质后振荡(4 ℃,1 h),离心(10 000 r/min,15 min),取上清液。采用考马斯亮蓝法分别测定溶于S1、S2、S3、S4和S5中的蛋白质含量(mg/mL),并计算离子键含量(S2-S1)、氢键含量(S3-S2)、疏水相互作用(S4-S3)和二硫键含量(S5-S4)。
1.3.6 共混体系紫外可见光谱的测定
采用Tris-Maleate缓冲溶液稀释蛋白质质量浓度至0.5 mg/mL。以缓冲溶液作为空白对照,紫外光谱仪测定240~350 nm范围内样品的紫外吸收光谱,并计算紫外吸收光谱图的二阶导数光谱[11]。
1.3.7 共混体系的荧光光谱扫描
采用Tris-Maleate缓冲溶液稀释蛋白质质量浓度至0.5 mg/mL。以缓冲溶液作为空白对照,将样品在荧光光谱仪中扫描(激发波长295 nm,发射波长300~400 nm,扫描速度10 nm/s,狭缝宽度2.5 nm)。
1.3.8 金鲳鱼鱼糜3D可打印性验证试验
将含有肌原纤维蛋白与淀粉质量比分别为10∶0、9∶1、8∶2、7∶3、6∶4和5∶5的鱼糜进行擂溃(5 min),装入打印注射器,进行3D打印。3D打印模型为空心圆柱体(高40 mm×直径20 mm),参数设置如下:打印速度20 mm/s,收缩速度50 mm/s,收缩长度2 mm,喷嘴直径1.2 mm。采用手持式数字微米仪(精度为0.01 mm)分别测定产品打印结束后0 h和2 h的高度,计算打印精确性和打印稳定性,评估3D打印产品的质量。其计算如公式(1)和公式(2)所示:
3D打印精确性![]()
(1)
3D打印稳定性![]()
(2)
式中:H为模型高度,H0为打印后立即测量的产品高度,H2为放置2 h后测量的产品高度。
1.4 数据处理
本研究生产了3批样品,每批样品进行3次重复测定,结果以平均值±标准差表示。用JMP软件(Pro 2013版)对数据进行方差分析和Tukey多重比较,置信度为95%(P<0.05)。
2 结果与分析
2.1 共混体系3D打印效果分析
鱼糜3D打印效果如图1-A所示。纯鱼糜打印时出现出料不均及断丝现象,放置过程中物料下沉。添加淀粉后,鱼糜的打印流动性和自支撑能力得到有效改善,断丝情况逐渐减缓,在放置过程中倾斜幅度逐渐减小。鱼糜中肌原纤维蛋白与淀粉质量比为6∶4时,3D打印效果最佳。继续增加淀粉含量后,鱼糜的自支撑能力显著减弱,打印结束后产品出现倾斜现象,放置过程中倒塌。
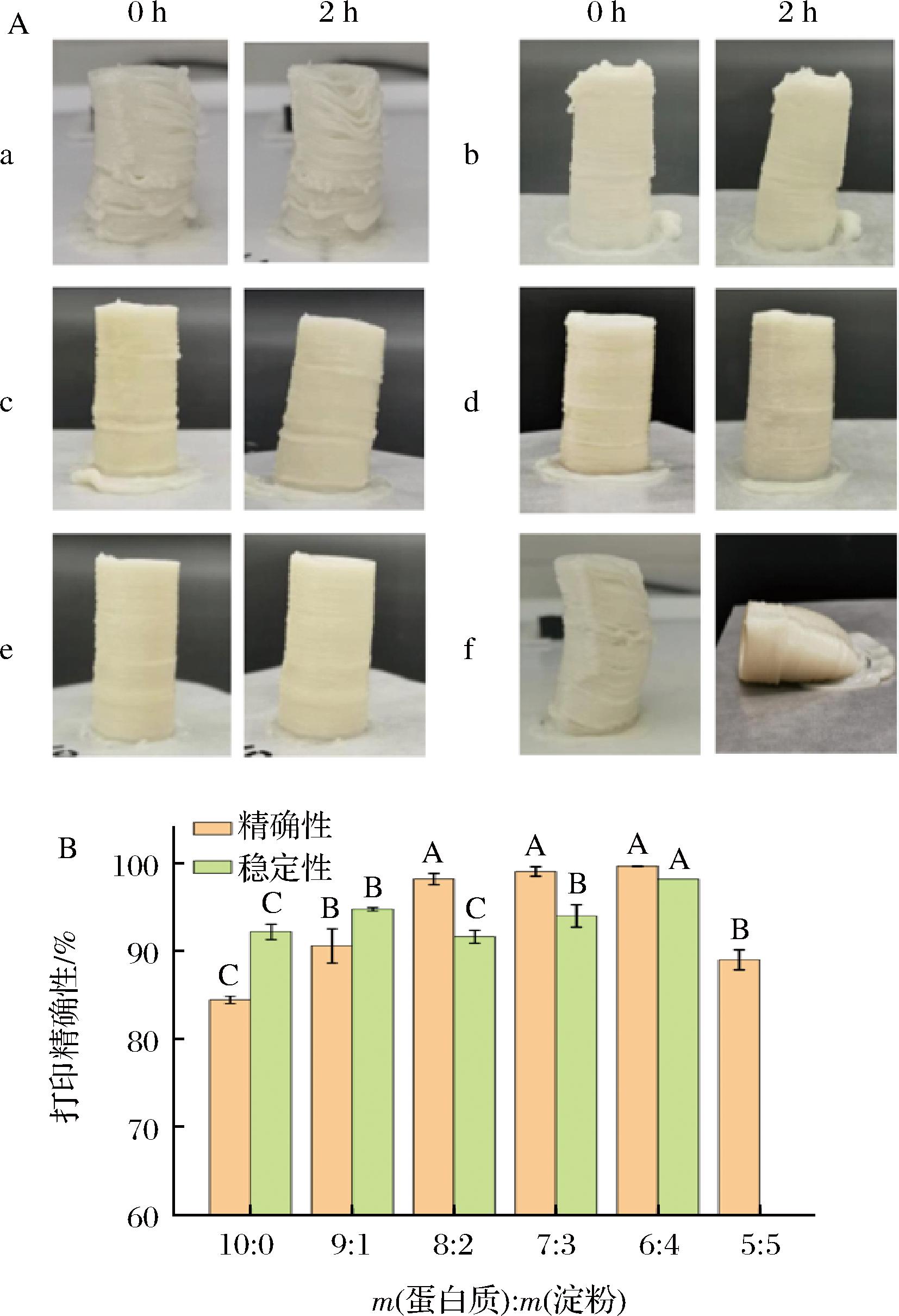
A-鱼糜-淀粉体系在打印后立即拍摄(左)和2 h后(右)拍摄的照片;B-鱼糜3D打印精确性与稳定性变化,其中不同组别分别是鱼糜中含有的肌原纤维蛋白与马铃薯淀粉比例
图1 鱼糜3D打印效果
Fig.1 3D printing effect of surimi
注:图1-A中a、b、c、d、e、f分别代表鱼糜中肌原纤维蛋白与淀粉质量比分别为10∶0、9∶1、8∶2、7∶3、6∶4、5∶5。同一参数不同字母表示平均值之间的显著差异(TukeyHSD,P<0.05)(下同)。
根据产品的精确性和稳定性评价淀粉改善鱼糜3D可打印性的能力(图1-B)。结果表明,添加少量的马铃薯淀粉可以提高鱼糜3D打印精确性和稳定性(P<0.05)。当质量比为6∶4时,打印的稳定性与精确性均达到最大值(P<0.05),分别为99.6%和98.12%。进一步增加淀粉含量,鱼糜无法进行3D打印。当鱼糜含有的肌原纤维蛋白与淀粉质量比为6∶4时,淀粉在鱼糜中的添加量为12%,这与当前研究学者的结论基本一致[2,8,12-13]。目前,关于淀粉改善鱼糜制品特性研究,主要集中在熟制条件下淀粉对鱼糜凝胶特性的影响机制,但是对于非加热状态下,鱼糜与淀粉是否会发生相互作用,这种相互作用如何影响鱼糜的物性学特性及3D打印特性,研究甚少。因此,接下来通过测定肌原纤维蛋白-马铃薯淀粉共混体系的流变特性、蛋白质结构及分子间相互作用阐述淀粉对鱼糜3D可打印性的改善作用。
2.2 共混体系流变特性的变化
流变学特性是判断材料是否具有3D可打印性的重要指标,通过流变学Herschel-Bulkley模型和弱凝胶模型拟合分析共混体系的稠度系数、流动指数以及流变单元之间的链接强度,可定量解析相行为变化过程对共混体系黏弹性的影响规律。
2.2.1 共混体系的表观黏度
物料的表观黏度随剪切速率的变化情况可以反映其剪切稀化特性[14]。如图2-A所示,随着剪切速率的增加,体系表观黏度急剧下降,呈现了剪切稀化现象,表明共混体系是假塑性流体。为进一步量化剪切稀化特性,采用Herschel-Bulkley模型对共混体系表观黏度-剪切速率曲线进行拟合。其计算如公式(3)所示:
(3)

A-表观黏度随剪切速率的变化;B-复合模量随频率的变化;C-样品稠度随含量变化情况;D-样品内部流变单元之间链接强度随含量变化情况
图2 共混体系的流变特性
Fig.2 Rheological characteristics of blend system
式中:ηa是表观黏度,![]() 是剪切速率,s-1;K是稠度系数,Pa·sn;n是流动指数。
是剪切速率,s-1;K是稠度系数,Pa·sn;n是流动指数。
拟合结果如图2-C所示,K值随淀粉添加量的增加而降低,说明加入淀粉对蛋白质的稠度有稀释作用,淀粉颗粒减缓了蛋白质之间的摩擦力,使共混体系在剪切过程中受到的阻力减小,增强了物料的流动挤出能力[12]。仪淑敏等[12]研究也发现增加木薯淀粉浓度,鱼糜的表观黏度下降,流动性增强,与本研究结果相符。
2.2.2 共混体系的复合模量
复合模量(G*)反映了体系的抗压缩变形能力和机械强度,可用于评价3D打印产品的自支撑稳定性[15]。由图2-B中可以看出,G*随着淀粉含量的增加而增加。这表明共混体系具有固态行为和网络结构,符合弱凝胶的结构特点。为了更加直观观察共混体系黏弹性的变化,将振荡频率扫描曲线进行弱凝胶模型拟合。其计算如公式(4)所示:
G*(f)=AFf1/z
(4)
式中:AF为样品内部流变单元之间相互作用强度,Pa·s 1/z;z为样品内部流变单元的数量;f为频率,Hz;G*为样品的复合模量,Pa。
由图2-D中可知,随着淀粉含量的增加,AF逐渐增大,这说明流变单元之间的链接强度逐渐增大(P<0.05),体系的黏弹性增加。马铃薯淀粉中含有可以与鱼肉蛋白酶争夺活性位点的内源性蛋白酶抑制剂,蛋白酶活性消失后减少了鱼肉蛋白的自溶现象,有助于提高鱼糜制品的黏弹性[16]。杨领[13]研究也发现添加木薯淀粉可增加鱼糜的黏弹性,增强3D可打印能力,与本研究结果一致。
综上所述,肌原纤维蛋白与淀粉组成共混体系后,共混体系的剪切稀化能力得到提高,抗压缩变形能力得到增强,从而改善了鱼糜的流动性和支撑性,提升了3D打印能力。
2.3 共混体系的红外光谱图测定结果及分析
傅里叶变换红外光谱图可以提供分子基团的特征振动谱带,具有较高的分辨率[17]。为了研究共混体系分子结构的变化情况,采用傅里叶红外光谱图来进行研究。由图3可以看出,随着淀粉的增加,共混体系出现了5处变化明显的特征条带。1号特征条带在3 410~3 000 cm-1区域,代表了—NH和—OH基团的伸缩振动[9]。其中,在3 400 cm-1附近吸收峰形增宽,吸收值增大。这是由于—NH基团参与蛋白质与淀粉之间的氢键合成而逐渐消失,—OH基团吸收增强。2号特征条带在3 000~2 837 cm-1区域内,代表了—CH2的伸缩振动[18]。3号特征条带在1 760~1 710 cm-1区域,代表了—C![]() O基团的伸缩振动。随着淀粉含量的增加,蛋白质中—C
O基团的伸缩振动。随着淀粉含量的增加,蛋白质中—C![]() O基团与淀粉中—CH2基团发生反应生成氢键。4号特征条带在1 700~1 500 cm-1区域,其中1 700~1 600 cm-1区域代表了酰胺I条带,这是蛋白质二级结构的特征吸收峰。蛋白质的二级结构主要通过非共价键维持,当环境发生变化时,蛋白质分子将重新排列以达到最低能量,维持相对稳定的状态[19]。5号特征条带在1 000~750 cm-1区域内,930 cm-1附近的吸收峰归属为淀粉的非对称环模式[α-1,4糖苷键(C—O—C)]的骨架振动[9],此部分吸收峰随着淀粉含量的增加,吸收峰发生偏移且振动强度逐渐增加。
O基团与淀粉中—CH2基团发生反应生成氢键。4号特征条带在1 700~1 500 cm-1区域,其中1 700~1 600 cm-1区域代表了酰胺I条带,这是蛋白质二级结构的特征吸收峰。蛋白质的二级结构主要通过非共价键维持,当环境发生变化时,蛋白质分子将重新排列以达到最低能量,维持相对稳定的状态[19]。5号特征条带在1 000~750 cm-1区域内,930 cm-1附近的吸收峰归属为淀粉的非对称环模式[α-1,4糖苷键(C—O—C)]的骨架振动[9],此部分吸收峰随着淀粉含量的增加,吸收峰发生偏移且振动强度逐渐增加。
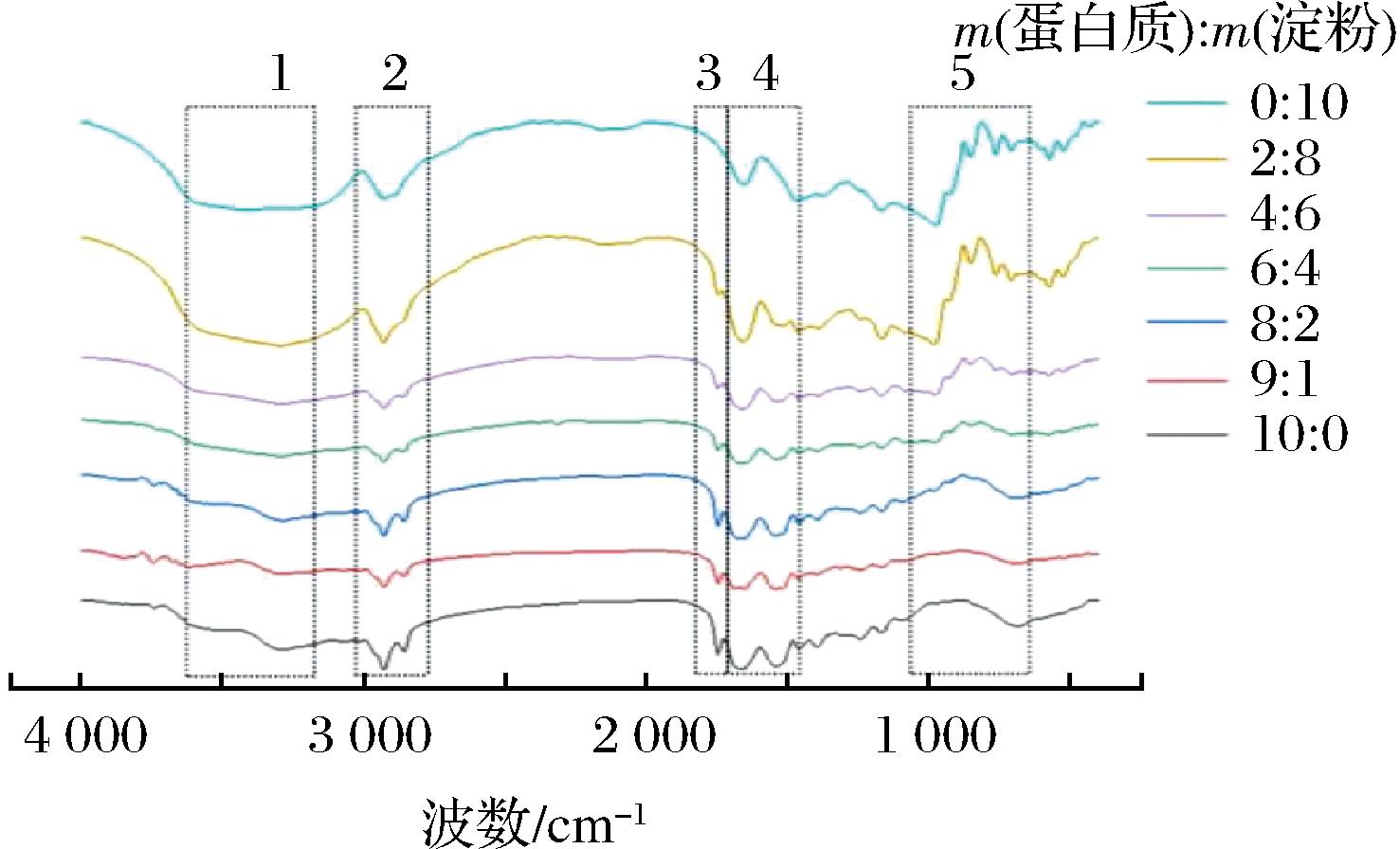
图3 肌原纤维蛋白-马铃薯淀粉共混体系红外光谱图
Fig.3 Infrared spectra of myofibrillar protein-potato starch blend systems
从以上分析可以看出,随着淀粉含量的增加,蛋白质特征峰逐渐减弱,淀粉特征峰逐渐增强。HOU等[9]研究中获得了与本实验类似的红外光谱,且发现吸收峰的峰值强度与淀粉添加量呈正相关。因此,蛋白质与马铃薯淀粉的混合比例对共混体系的分子结构有着显著影响,淀粉促进了分子间氢键生成,蛋白结构逐渐舒展,为蛋白质之间交联提供了可能,对共混体系形成网络结构起到促进作用[18]。
2.4 共混体系的分子间作用力的变化
当环境条件发生变化时,共混体系中高分子聚合物之间的相互作用也随之改变[20],可通过离子键、氢键、疏水相互作用和二硫共价键含量进行表征[21]。如图4所示,随着淀粉含量的增加,共混体系中离子键含量下降,氢键含量增加,疏水相互作用先减小后增大,二硫共价键含量先增加后减少(P<0.05)。当共混体系蛋白质含量的下降时,缓冲溶液中的氯化钠中和了蛋白质所携带的电荷,静电作用随之减小[22],离子键含量减少。加入少量淀粉,淀粉中的羟基与蛋白质中的氨基结合形成了氢键,淀粉与蛋白质争夺水分,导致蛋白质周围环境的极性增加,极性分子含量的增加使蛋白质疏水基团隐藏在内部,促进了二硫共价键的暴露。但是,进一步增加淀粉含量,共混体系中的淀粉发生了沉淀。蛋白质在体系中所占比例显著减小,与淀粉之间的相互作用减弱,蛋白质分子逐渐展开,隐藏于蛋白质内部的氨基酸非极性疏水基团暴露在表面,表面疏水性增加。大量淀粉的介入使蛋白质网络结构松散,聚集程度减小,加速了蛋白质分子结构的破坏,二硫键含量显著降低。王聪[23]向鱼糜中加入醋酸酯淀粉,离子键含量随着淀粉添加量也出现先增加后减少的趋势;周凤超等[24]发现肌原纤维蛋白与改性马铃薯淀粉相互作用时氢键是主要的非共价作用力,对蛋白质结构稳定影响显著。肌原纤维蛋白中加入马铃薯变性淀粉后,可提高共混体系的氢键含量。但是加入过多的淀粉会导致氢键的减少,促进疏水基团的暴露[25],这与本研究的结果一致。
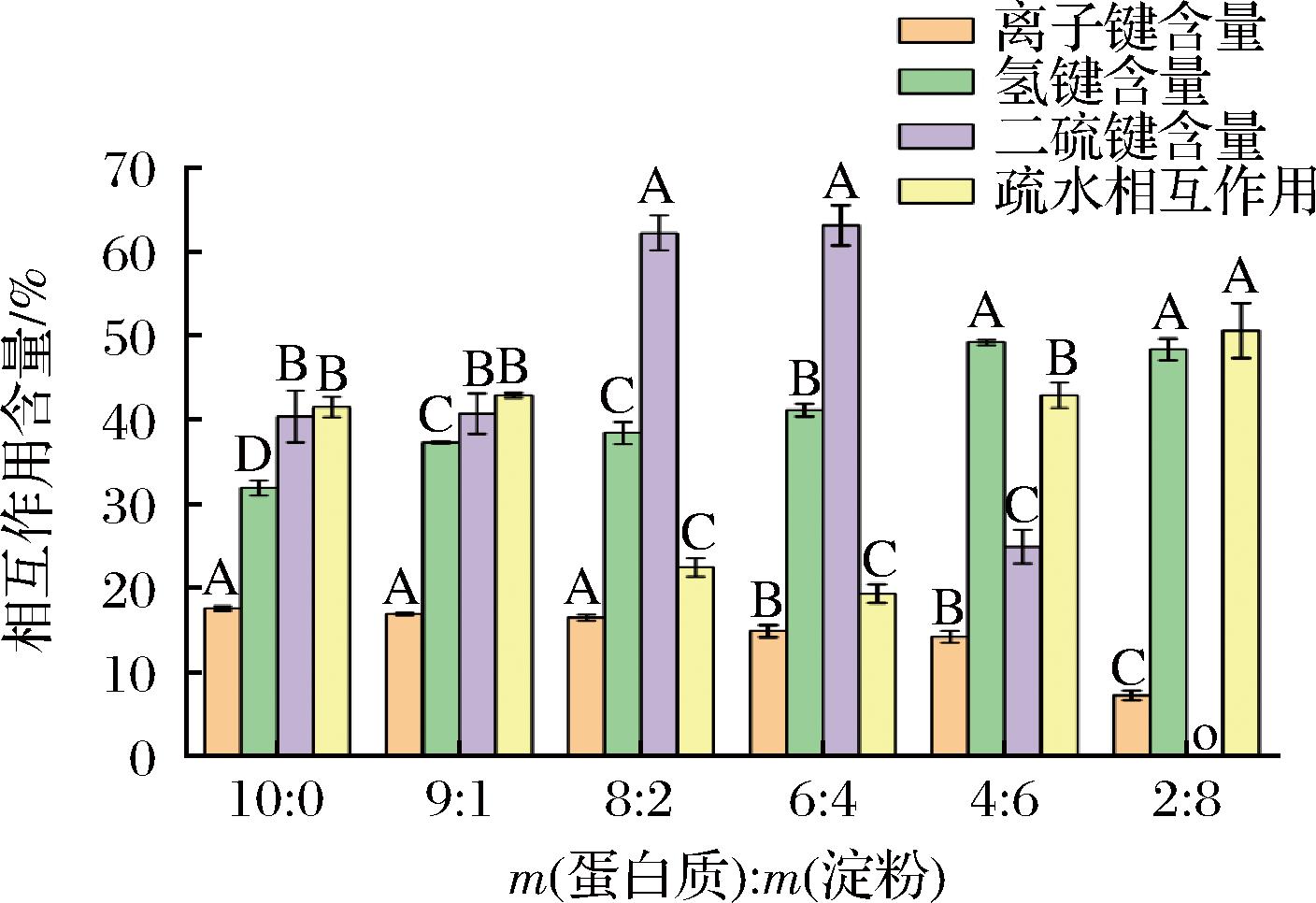
图4 共混体系中肌原纤维蛋白分子间作用力变化
Fig.4 Changes in intermolecular forces of myofibrillar protein in blending systems
2.5 共混体系的紫外光谱测定结果及分析
蛋白质紫外可见光谱反映蛋白质三级结构的变化。肌原纤维蛋白中含有色氨酸、酪氨酸和苯丙氨酸,分别在280、275、259 nm处有紫外特征吸收峰[26],因此可以利用紫外分光光度法来测定这3种氨基酸的吸收图谱(图5-A)。为了更清楚地观察紫外图谱峰形的变化,可对其进行二阶求导计算(图5-B)。共混体系在259 nm和280 nm附近存在特征吸收峰。随着质量比的减少,最大吸收峰的位置先蓝移后红移。在分子间作用力的驱使下,加入淀粉后蛋白质分子之间交联程度变高,特征峰发生蓝移[11]。随着淀粉含量进一步增加,蛋白质中氢键的相互作用逐渐减弱,并且氨基酸的苯环在蛋白质肽链上的发生π-π*转变,使蛋白质中隐藏的疏水基团逐渐暴露出来,增加了体系的疏水相互作用。杨天等[10]研究也发现,向鱼糜中加入高质量浓度的多糖,肌原纤维蛋白紫外吸收峰强度增强,与本研究结果相符。因此,共混体系相行为变化促进了肌原纤维蛋白质中侧链氨基酸局部结构的变化。
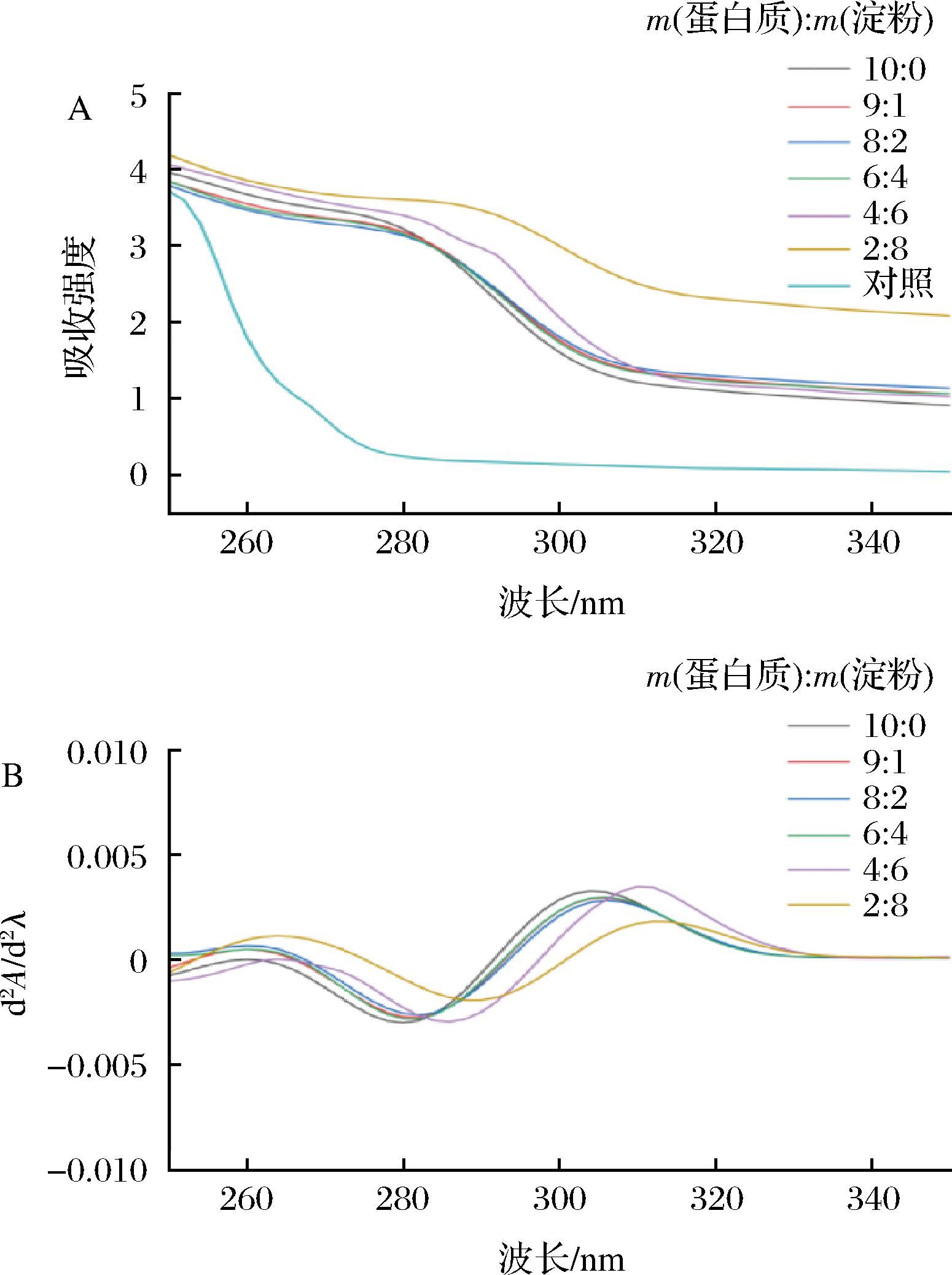
A-紫外吸收光谱;B-二阶导光谱
图5 肌原纤维蛋白-马铃薯淀粉共混体系紫外吸收光谱及其二阶导光谱变化
Fig.5 Changes in the UV absorption spectrum and second-order derivative spectrum of myofibrillar protein-potato starch blend systems
2.6 共混体系的荧光光谱测定结果及分析
蛋白质内源性色氨酸荧光对于周围微环境的极性变化非常敏感,可通过检测峰位变化和荧光强度来监测蛋白质三级结构的变化[27]。对共混体系的荧光光谱进行测定,结果如图6所示,蛋白质中色氨酸残基的最大吸收波长为332.2 nm,表明色氨酸处于极性环境中[28]。随着淀粉含量的增加,荧光强度逐渐减小。当蛋白质与淀粉质量比小于6∶4后,荧光强度增加。这可能是由于加入淀粉后,色氨酸能量转移效率出现差异,导致色氨酸的构像发生了转变[29]。淀粉与肌原纤维蛋白发生静电相互作用,增加了疏水性色氨酸发色团微环境的极性,随着淀粉含量增加,肌原纤维蛋白结构展开,越来越多的色氨酸暴露于表面,从而荧光强度增强。因此,淀粉促进了肌原纤维蛋白三级结构的变化。

图6 肌原纤维蛋白-马铃薯淀粉共混体系荧光光谱变化
Fig.6 Changes in the fluorescence spectrum of myofibrillar protein-potato starch blend systems
3 结论
本研究测定了肌原纤维蛋白-马铃薯淀粉共混体系的流变特性,蛋白质结构和分子间相互作用力。结合鱼糜3D打印效果发现,鱼糜中肌原纤维蛋白与马铃薯淀粉质量比为6∶4时,共混体系离子键含量和疏水相互作用减少,侧链疏水氨基酸构象发生变化,降低了表观黏度(2 818 Pa·s),改善了共混体系的流动能力;共混体系分子间氢键和二硫键含量升高,增加了共混体系网络结构之间链接强度(8 877.2 Pa·s1/z),提高了产品的支撑能力,此时鱼糜3D打印效果最佳(打印精确性和稳定性分别为99.6%和98.12%)。
[1] BHAT Z F, MORTON J D, KUMAR S, et al.3D printing:Development of animal products and special foods[J].Trends in Food Science &Technology, 2021, 118:87-105.
[2] 潘燕墨, 孙钦秀, 刘书成, 等.小麦淀粉改善虾肉糜物料特性及其3D打印适应性[J].食品与发酵工业, 2021, 47(12):63-69.
PAN Y M, SUN Q X, LIU S C, et al.Wheat starch improves the properties of shrimp surimi and its to 3D printability[J].Food and Fermentation Industries, 2021, 47(12):63-69.
[3] LIU Y, SUN Q X, WEI S, et al.LF-NMR as a tool for predicting the 3D printability of surimi-starch systems[J].Food Chemistry, 2022, 374: 131727.
[4] TURGEON S L, BEAULIEU M, SCHMITT C, et al.Protein-polysaccharide interactions:Phase-ordering kinetics, thermodynamic and structural aspects[J].Current Opinion in Colloid &Interface Science, 2003, 8(4-5):401-414.
[5] ZHANG T, XU X Q, JI L, et al.Phase behaviors involved in surimi gel system: Effects of phase separation on gelation of myofibrillar protein and kappa-carrageenan[J].Food Research International, 2017, 100(1):361-368.
[6] 屈展平, 任广跃, 张迎敏, 等.马铃薯淀粉:小麦蛋白共混体系的相互作用及对复合面条性质的影响[J].食品与机械, 2020, 36(1):72-78.
QU Z P, REN G Y, ZHANG Y M, et al.Interaction of potato starch-wheat protein blend system and its effect on the properties of compound noodles[J].Food and Machinery, 2020, 36(1):72-78.
[7] XIONG G Q, CHENG W, YE L X, et al.Effects of konjac glucomannan on physicochemical properties of myofibrillar protein and surimi gels from grass carp (Ctenopharyngodon idella)[J].Food Chemistry, 2009, 116(2):413-418.
[8] 潘燕墨, 黄煜钦, 刘阳, 等.蛋白粉对虾肉糜3D打印成型效果的影响[J].广东海洋大学学报, 2022,42(4):129-137.
PAN Y M, HUANG Y Q, LIU Y, et al.Effects of protein powder on 3D printing properties of shrimp surimi[J].Journal of Guangdong Ocean University, 2022,42(4):129-137.
[9] HOU S W, WEI W, WANG Y, et al.Integrated recognition and quantitative detection of starch in surimi by infrared spectroscopy and spectroscopic imaging[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2019, 215:1-8.
[10] 杨天, 耿文豪, 郑志红, 等.褐藻寡糖对鲢鱼鱼糜稳定性、分子间作用力及肌原纤维蛋白结构的影响[J].肉类研究, 2021, 35(7):1-8.
YANG T, GENG W H, ZHENG Z H, et al.Effects of alginate oligosaccharides on the stability, intermolecular forces and myofibrillar protein structures of silver carp surimi[J].Meat Research, 2021, 35(7):1-8.
[11] TAN L, HONG P Z, YANG P, et al.Correlation between the water solubility and secondary structure of tilapia-soybean protein co-precipitates[J].Molecules, 2019, 24(23):4337.
[12] 仪淑敏, 梁丰, 杨领, 等.木薯淀粉对金线鱼鱼糜3D打印效果的影响[J].水产学报, 2021, 45(7):1111-1120.
YI S M, LIANG F, YANG L, et al.Effect of cassava starch on 3D printing of Nemipterus virgatus surimi[J].Journal of Fisheries of China, 2021, 45(7):1111-1120.
[13] 杨领. TG酶-木薯淀粉对金线鱼鱼糜3D打印特性的影响[D].锦州:渤海大学, 2020.
YANG L.Effects of transglutamianse and cassava starch on 3D printing characteristics of Nemipterus virgatus surimi[D].Jinzhou:Bohai University, 2020.
[14] LIU Y W, YU Y, LIU C S, et al.Rheological and mechanical behavior of milk protein composite gel for extrusion-based 3D food printing[J].LWT-Food Science and Technology, 2019, 102:338-346.
[15] OLIVEIRA S M, FASOLIN L H, VICENTE A A, et al.Printability, microstructure, and flow dynamics of phase-separated edible 3D inks[J].Food Hydrocolloids, 2020, 109:106120.
[16] 叶月华, 钱敏, 刘晓艳, 等.不同外源物质对淡水鱼鱼糜热诱导凝胶特性增效作用的研究进展[J].食品与发酵工业, 2021, 47(12):285-293.
YE Y H, QIAN M, LIU X Y, et al.The enhancement of different exogenous substances on thermal-induced gel properties of fresh water fish surimi[J].Food and Fermentation Industries, 2021, 47(12):285-293.
[17] 宋国胜, 李琳, 胡松青.傅立叶红外光谱应用研究进展[J].现代食品科技, 2010, 26(4):402-405.
SONG G S, LI L, HU S Q.Applied research of Fourier transform infrared spectroscopy[J].Modern Food Science and Technology, 2010, 26(4):402-405.
[18] XU L L, ZHAO Y, XU M S, et al.Changes in physico-chemical properties, microstructure, protein structures and intermolecular force of egg yolk, plasma and granule gels during salting[J].Food Chemistry, 2019, 275:600-609.
[19] 万红兵, 李海鹏, 雷元华, 等.二维红外相关光谱研究熟度对肌原纤维蛋白构象的影响[J].光谱学与光谱分析, 2021, 41(7):2082-2086.
WAN H B, LI H P, LEI Y H, et al.Effect of degree of doneness on conformation of myofibrillar proteins by two-dimensional infrared correlation spectroscopy[J].Spectroscopy and Spectral Analysis, 2021, 41(7):2082-2086.
[20] SCHMITT C, TURGEON S L.Protein/polysaccharide complexes and coacervates in food systems[J].Advances in Colloid and Interface Science, 2011, 167 (1-2):63-70.
[21] LIU Y, SUN Q X, WEI S, et al.Insight into the correlations among rheological behaviour, protein molecular structure and 3D printability during the processing of surimi from golden pompano (Trachinotus ovatus)[J].Food Chemistry, 2022, 371:131046.
[22] 张倩. 大豆蛋白/多糖复合凝胶缓释体系构建与表征[D].无锡:江南大学, 2021.
ZHANG Q.Preparation and characterization of soybean protein polysaccharide composite gels slow-release system[D].Wuxi:Jiangnan University, 2021.
[23] 王聪. 淀粉和亲水胶体对白鲢鱼鱼糜凝胶特性的增效作用研究[D].锦州:渤海大学, 2019.
WANG C.Synergistic effect of starch and hydrocolloid on gel properties of silver carp surimi[D].Jinzhou:Bohai University, 2019.
[24] 周凤超, 林国荣, 汪秀妹, 等.改性马铃薯淀粉对肌原纤维蛋白凝胶特性的影响[J].食品科学, 2020, 41(4):86-95.
ZHOU F C, LIN G R, WANG X M, et al.Influence of modified potato starch on gelation properties of myofibrillar protein[J].Food Science, 2020, 41(4):86-95.
[25] 黄洁. 低水分马铃薯淀粉对鲢鱼糜凝胶特性的影响[D].无锡:江南大学, 2015.
HUANG J.Effects of low-moisture potato starch on the gel properties of silver carp surimi [D].Wuxi:Jiangnan University, 2015.
[26] 王美婧. 短期冷藏过程中乌鳢肌原纤维蛋白变化及其应用研究[D].杭州:浙江工商大学, 2020.
WANG M J.Changes of myofibrillar protein in snakehead during short-term refrigeration and its application[D].Hangzhou:Zhejiang Gongshang University, 2020.
[27] 汪兰, 吴文锦,乔宇, 等.冻藏条件下魔芋葡甘聚糖降解产物对肌原纤维蛋白结构的影响[J].食品科学, 2015, 36(22):244-249.
WANG L, WU W J, QIAO Y, et al.Effect of degraded products of konjac glucomannan on the structure of myofibrillar protein from glass carp meat during frozen storage[J].Food Science, 2015, 36(22):244-249.
[28] SUN Q X, CHEN Q, XIA X F, et al.Effects of ultrasound-assisted freezing at different power levels on the structure and thermal stability of common carp (Cyprinus carpio) proteins[J].Ultrasonics Sonochemistry, 2019, 54:311-320.
[29] ZHANG C, LI X G, WANG H, et al.Ultrasound-assisted immersion freezing reduces the structure and gel property deterioration of myofibrillar protein from chicken breast[J].Ultrasonics Sonochemistry, 2020, 67:105137.