猪肝是生猪屠宰过程中产生的主要副产物之一,它脂肪含量低,平均约2.94%左右,富含蛋白质,平均约22.05%左右,且含有多种维生素、矿物质,其中铁的含量为猪肉的10倍,维生素A含量是猪肉的43倍,是良好的食物营养来源[1]。猪肝蛋白(pork liver protein,PLP)是猪肝里最主要的营养成分,也最具开发价值。但因猪肝蛋白的溶解性、乳化性以及热稳定性等性质欠佳,限制了它在食品工业、化工等行业中的开发及应用[2-3]。
蛋白质的功能性质可以通过物理、化学以及生物学等方法进行改良,化学方法有酸碱改性、糖化、磷酸化、酰化等。酰化改性是一种化学衍生技术,广泛应用于修饰蛋白质的功能性质。酰化反应通过将酰化试剂的酰基转移到氨基酸残基的氨基或者羟基上,增加蛋白质的分子柔性,降低表面张力,来改善蛋白质的功能性质[4]。常用的酰化试剂有乙酸酐、琥珀酸酐、辛二酸酐、马来酸酐、十二烷基琥珀酸酐等。琥珀酰化是将带负电琥珀酰基从琥珀酸酐(succinic anhydride,SA)转移到蛋白质的赖氨酸残基上,以增加蛋白质的净表面电荷和空间位阻的化学反应。相对其他化学改性方法,琥珀酰化更容易对反应过程进行控制。此外,SA经常被用作食品添加剂,作为酱油、清酒、饮料等的调味剂使用,被食品和药物管理机构认定是安全的。由于其对蛋白质电荷及空间的双重改变作用和食品安全性,故比其他化学修饰作用具有更大的优势。CHAROENSUK等[5]研究了SA与蛋白质的质量比对绿豆分离蛋白的N-酰化度和乳化性能的影响,发现改性蛋白的N-酰化度随着SA与蛋白质量比值的增加而增加,在此过程中,蛋白质的等电点会向较低的pH转移,而且适当的酰化改性提高了乳化特性。
乳化剂是能使2种或2种以上互不相溶的组分的混合液体形成稳定的乳状液的一类物质。蛋白质分子中既有亲水基团又有疏水基团,所以可以稳定水相和油相之间的界面,起乳化剂的作用。猪肝蛋白资源丰富、价格低廉,其乳化性能提升后可作为优质乳化剂广泛应用于食品、化工、医药、轻纺、石化等诸多行业。目前,国内外有关猪肝蛋白的改性研究相对较少,康梦瑶等[2]研究了超声波处理对水溶性猪肝蛋白乳化性的影响。陆今明等[3]考察了超声波辅助pH偏移处理对猪肝蛋白结构及乳化特性的影响,但这些方法对猪肝蛋白乳化活性的提升仍然有限。本研究拟考察酰化改性对猪肝蛋白乳化特性的影响与机理,以期为猪肝资源的高值利用提供科学依据、奠定理论基础。
1 材料与方法
1.1 材料与试剂
猪肝,购于永辉超市;透析袋,截留分子质量8 000~14 000 Da,北京怡康盛世生物科技有限公司;琥珀酸酐,上海笛柏生物科技有限公司;氢氧化钠,成都市科隆化学品有限公司。
1.2 仪器与设备
JS39D-250多功能食品绞肉机,浙江苏泊尔股份有限公司;XHF-D内切式匀浆机,宁波新芝生物科技股份有限公司;TGL-16高速冷冻离心机,四川蜀科仪器有限公司;LGJ-10真空冷冻干燥机,北京松源华兴科技有限公司;F-2500荧光分光光度计,日本日立公司。
1.3 实验方法
1.3.1 PLP的提取及琥珀酰化
参考LU等[6]的方法,将猪肝绞成泥状加入5倍体积超纯水,均质后调pH值至11.5±0.05,在4 ℃,10 000×g的条件下离心20 min,浆料分成3层:顶部脂肪和筋膜层、中间蛋白质溶液层、不溶性底层。通过4层纱布过滤去除上层脂肪和筋膜,获得中间层蛋白质溶液。调蛋白质溶液pH值至5.5±0.05,放置10 min后离心20 min(4 ℃,10 000×g)以沉淀提取物,取沉淀加入少量超纯水,调pH值至7.0,放入4 ℃冰箱冷藏备用(72 h内使用)。
将200 mL蛋白溶液(10 mg/mL)调pH值至11.0,分别缓慢添加SA(0.10、0.20、0.30、0.50、0.80 g),室温下磁力搅拌,用 NaOH维持pH值稳定在8.0~9.0。待pH值稳定在8.0±0.5时,反应30 min后冰浴10 min终止反应,并将pH调节至7.0。4 ℃下透析24 h,冷冻干燥后,-20 ℃贮存备用。对照组除不添加SA外,其余操作均与实验组保持一致。
1.3.2 酰化度的测定
1.3.2.1 N-酰化度
参考LU等[6]的方法,取2 mL样品溶液(1%,质量分数)加入2 mL茚三酮(2%,质量分数),沸水浴16 min后,20 ℃水浴冷却。取1 mL反应液加入40 mL碘酸钾(0.2%,质量分数),静置5 min,在570 nm处测吸光值。根据公式(1)计算样品的N-酰化度:
N-酰化度![]()
(1)
式中:A,PLP溶液的吸光值;A0,样品溶液的吸光值。
1.3.2.2 O-酰化度
参考刘金阳[7]的方法,按2∶1∶1的体积比添加2 mol/L NH2OH-HCl溶液、3.5 mol/L NaCl溶液和超纯水配制溶液备用,取2 mL上述溶液于1 mL样品溶液(5 mg/mL),40 ℃水浴2 h,用1.0 mL 3 mol/L HCl溶液终止反应。添加1.0 mL 0.37 mol/L FeCl3进行显色(分散相为0.1 mol/L的HCl溶液)。静置15 min于540 nm处测定吸光值A540。
1.3.3 傅里叶变换红外光谱测定
参考刘冠男等[8]的方法,采用Spectrum100型傅里叶变换红外光谱在室温下测定样品粉末的红外光谱。波长范围设置为400~4 000 cm-1进行32次扫描,分辨率为4 cm-1。
1.3.4 内源荧光光谱的测定
参考KARBASI等[9]的方法,将0.2 mg/mL的样品溶液在295 nm的激发波长下测定内源发射荧光光谱。设置狭缝宽度为5 nm,记录样品在310~390 nm范围内的发射光谱,得到最大荧光强度(Fmax)和最大发射波长(λmax)。
1.3.5 微观结构的观察
将样品粉末均匀的附着在导电黏合剂上并进行喷金处理,使用扫描电子显微镜(scanning electron microscope,SEM)观察酰化改性猪肝蛋白(S-PLP)的微观结构,拍照记录其在不同放大倍数下(1 000×、5 000×)的表面形貌。
1.3.6 乳化特性的测定
取9 mL 2.5 mg/mL样品溶液,加入3 mL植物油,10 000 r/min条件下均质60 s,立即从底部移取50 μL乳液于离心管,加入5 mL SDS溶液(0.1%,质量分数),在500 nm波长处测吸光值A0,静置10 min,重复操作测定A10。根据公式(2)、公式(3)计算乳液的乳化活性指数(emulsifying activity index,EAI)和乳化稳定性(emulsion stability index,ESI):
(2)
(3)
式中:N,稀释倍数;C,蛋白质质量浓度,g/mL;φ,油相比例;A10,乳液静置10 min后的吸光值;A0,新鲜制备乳液的吸光值。
1.3.7 乳液粒径及Zeta电位的测定
取0.1 mL新鲜乳液超纯水稀释50倍,使用Malvern Nano ZS90测定乳液的Zeta电位。取1 mL乳液加入4 mL超纯水,使用Malvern3000粒度分布仪测定乳液的粒径。
1.3.8 吸附蛋白质百分比的测定
参考LU等[6]的方法,移取3 mL蛋白样品溶液(2.5 mg/mL,C0),10 000×g离心30 min,测定上清液中的蛋白质浓度(CS);取3 mL新鲜乳液于离心管中,加速乳脂化,乳清层溶液通过0.45 μm滤膜,测定滤液蛋白质浓度(Cf)。根据公式(4)计算乳液吸附蛋白质(adsorbed protein,AP)百分比:
(4)
1.3.9 表面疏水性的测定
参考刘金阳[7]的方法,使用ANS荧光探针法测定蛋白质表面疏水性。取0.1 g蛋白溶于5 mL 10 mmol/L pH 7.0 PBS溶液,水合1 h。取10、20、30、40、50 μL样品溶液加入4 mL PBS溶液和20 μL 8 mmol/L ANS储液,避光15 min,测定其荧光强度。以浓度和荧光强度为x、y轴,斜率即为样品的表面疏水性指数。
2 结果与分析
2.1 SA添加量对PLP酰化程度的影响
酰化反应是典型的亲核取代反应,主要发生在酸度系数较低、空间位阻较弱的赖氨酸ε-氨基或羟基上。N-酰化度和O-酰化度,分别用来表示PLP游离氨基和羟基被修饰的程度。SA添加量对PLP酰化程度的影响如图1所示,随着PA添加量的增加,S-PLP的N-酰化度和O-酰化度均显著增大,前期—NH2取代速率较大,而O-酰化度增加缓慢,当添加量从0.15 g/g Pro增加到0.40 g/g Pro时,N-酰化度逐渐趋于平缓,O-酰化度开始增加,此时大部分游离—NH2已被酰基取代,反应转变为以取代—OH为主。这是因为ε-NH2在酰化反应中与—OH存在竞争关系,ε-NH2具有更强的活性,所以反应前期主要以氨基取代为主。当赖氨酸侧链上可被修饰的ε-NH2达饱和状态时,—OH开始快速被取代。这一结果与刘金阳[7]研究燕麦蛋白改性的结论一致。KARBASI等[9]研究乙酰接枝对乳清蛋白的影响时也发现N-酰化度随着乙酸酐的增加而逐渐增加,而O-酰化仅在N-酰化发生后显著增加。
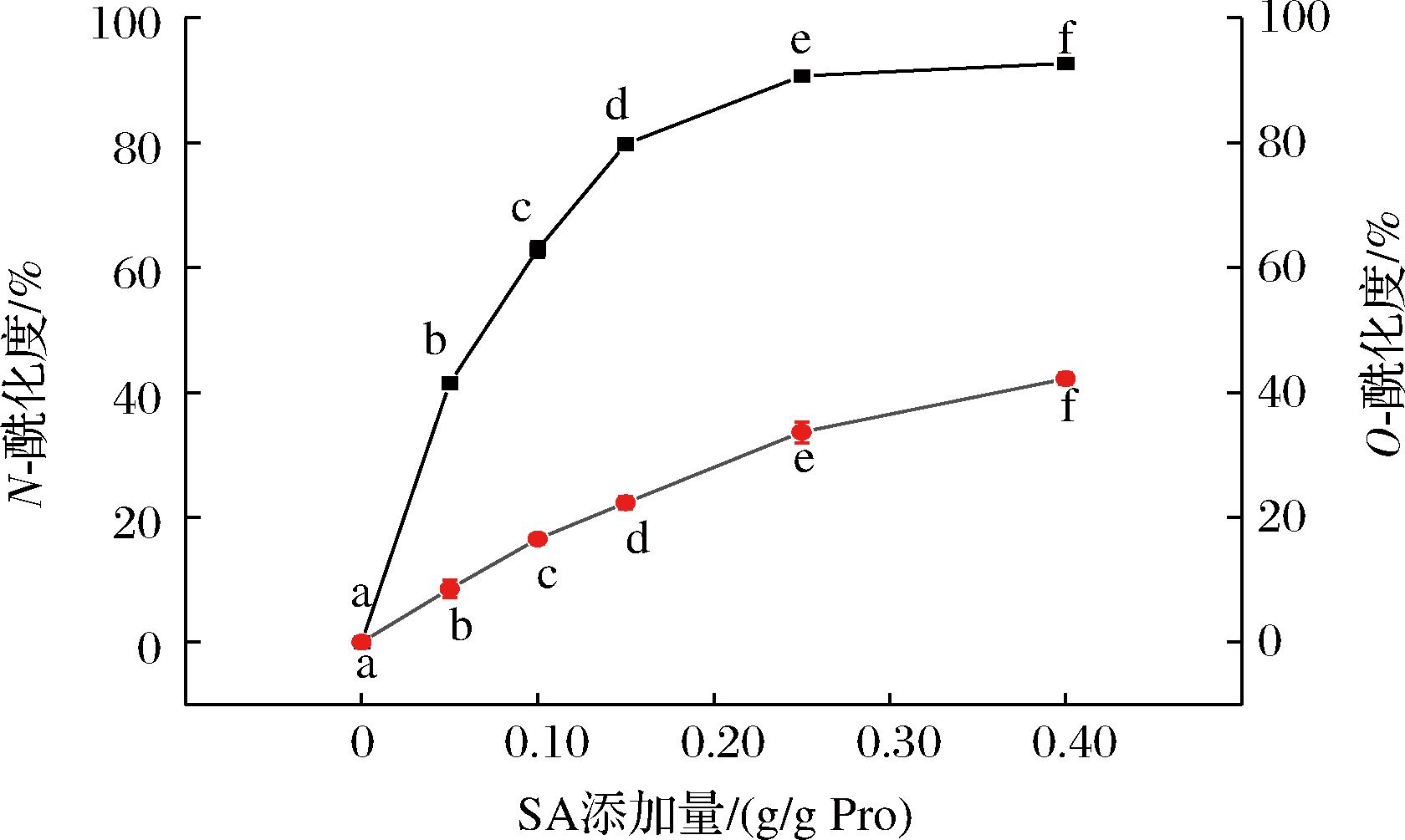
图1 SA添加量对PLP酰化度的影响
Fig.1 Effect of SA addition on acylation degree of PLP
2.2 傅里叶变换红外光谱分析
傅里叶变换红外光谱图(Fourier transform infrared spectroscopy,FTIR)可以反映蛋白质的化学键或基团的变化。由图2可以看出,PLP的FTIR光谱4个主要的特征吸收峰对应的波长发生了改变,条带位移揭示了PLP疏水性的变化。在SA的酰化作用下,1 635、1 537 cm-1处的峰值吸收强度显著增加,这与酰胺I带的C![]() O伸缩和酰胺II带的N—H弯曲有关。此外,C—H反对称伸缩振动和N—H伸缩振动会影响2 924、3 281 cm-1处的条带的变化[10]。以上结果表明,琥珀酰基通过共价键与PLP发生反应达到修饰蛋白的目的。
O伸缩和酰胺II带的N—H弯曲有关。此外,C—H反对称伸缩振动和N—H伸缩振动会影响2 924、3 281 cm-1处的条带的变化[10]。以上结果表明,琥珀酰基通过共价键与PLP发生反应达到修饰蛋白的目的。
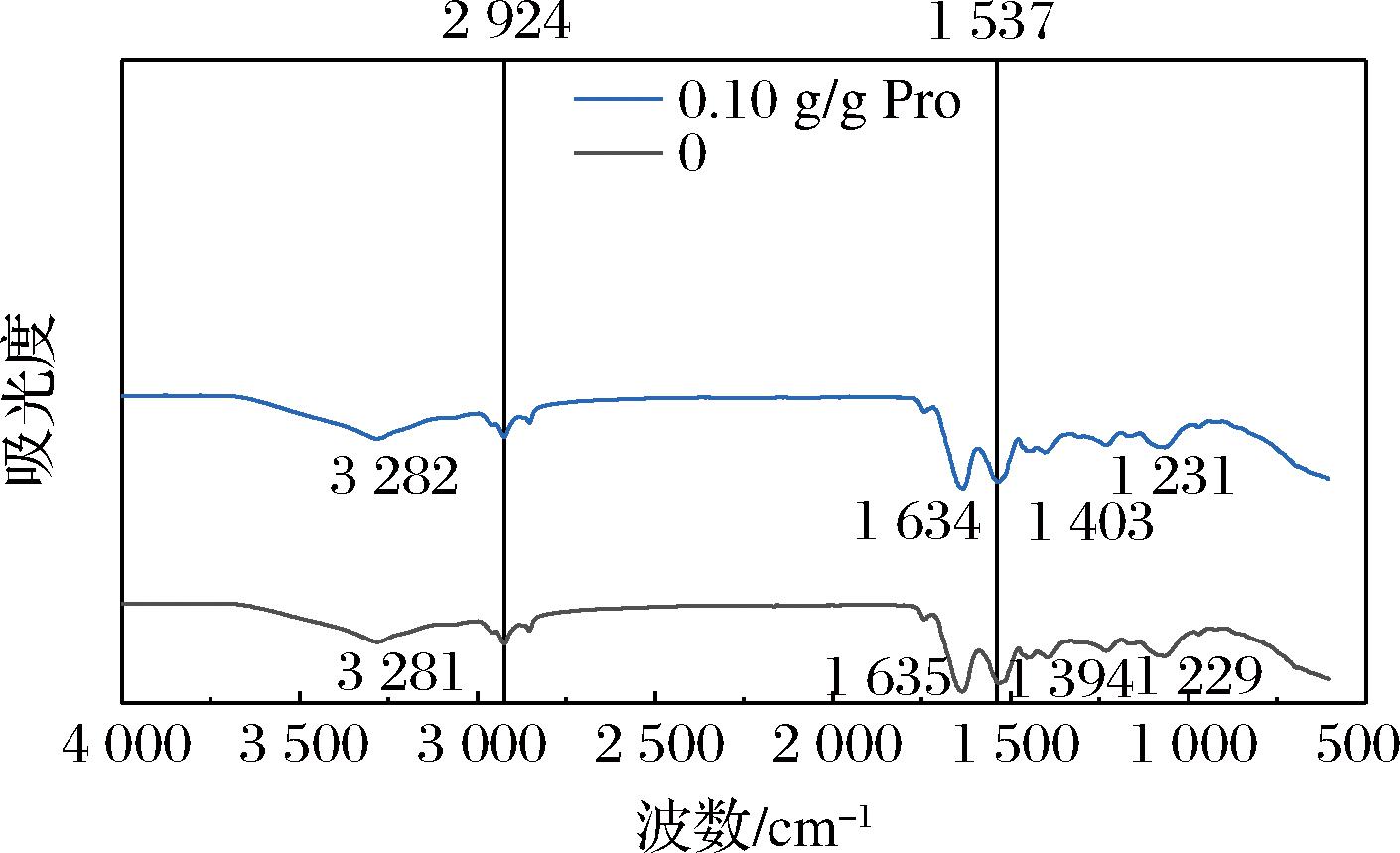
图2 SA对PLP影响的FTIR光谱图
Fig.2 FTIR spectrum of the effect of SA on PLP
针对样品蛋白质谱的酰胺I带(1 700~1 600 cm-1)进行二级结构组分含量变化分析[11],在进行二阶导数和高斯峰拟合后,蛋白质的二级结构各组分组成情况如表1所示,琥珀酰化改性显著改变了PLP的二级结构的组成。PLP经过琥珀酰化改性后β-螺旋、β-转角和无规则卷曲的含量显著增加,α-螺旋含量显著减少,这表明琥珀酰化改性可以导致α-螺旋向β-折叠、β-转角和无规则卷曲的转变,改善了PLP的构象灵活性。琥珀酰化使多肽链展开[12],蛋白质结构松散,氨基酸暴露更多,S-PLP比PLP具有更高的分子柔性,对乳化特性可能会产生明显的改善作用。
表1 SA对猪肝蛋白二级结构各组分的影响
Table 1 Effect of SA on secondary structure components of PLP
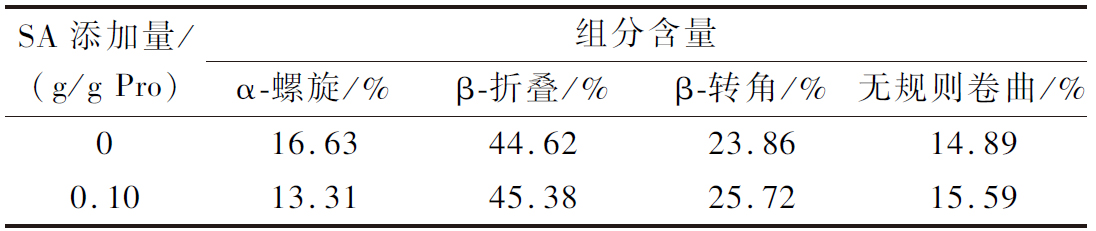
SA添加量/(g/g Pro)组分含量α-螺旋/%β-折叠/%β-转角/%无规则卷曲/%016.6344.6223.8614.890.1013.3145.3825.7215.59
2.3 荧光光谱分析
荧光光谱通常用于研究蛋白质的三级结构变化,荧光光谱主要反映芳香族氨基酸微环境极性的变化。由图3可以看出,与PLP相比S-PLP的荧光强度有所增加,这是由于琥珀酰基的引入使PLP携带更多的负电荷,分子间排斥力增强,最初埋藏在疏水环境中的色氨酸残基逐渐暴露于外部亲水环境,从而增加荧光强度[13]。这有利于蛋白质吸附在油滴表面,进而提高S-PLP稳定乳液的乳化能力。此外,还观察到λmax的增加,琥珀酰化改性后PLP发生红移现象,这说明引入琥珀酰基在一定程度上阻碍了PLP分子内部的疏水相互作用,增加了肽链在蛋白质结构中的延伸。这意味着酰化改性猪肝蛋白可以改善天然猪肝蛋白的疏水性,有助于提高其乳化特性。
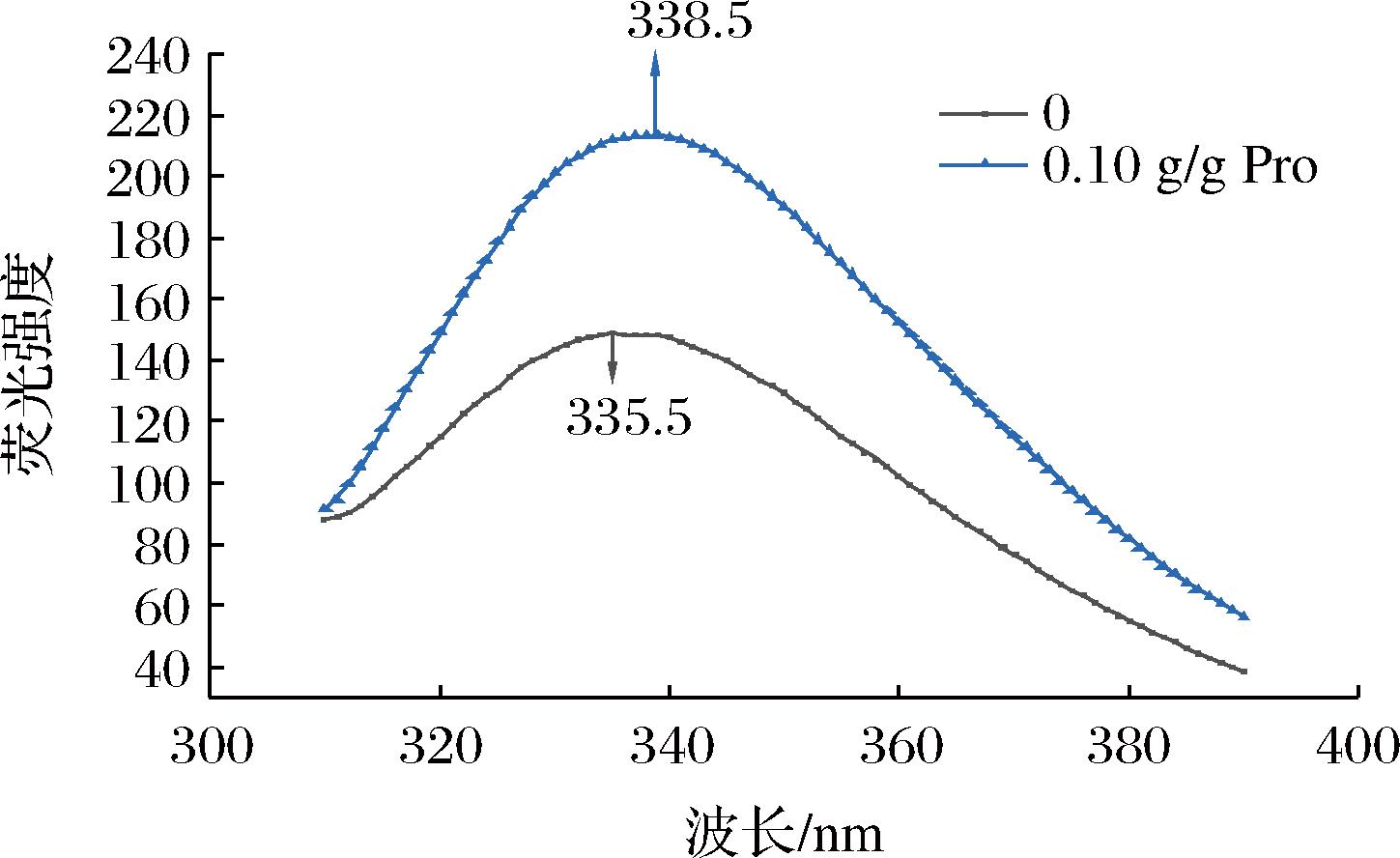
图3 SA对PLP影响的荧光光谱
Fig.3 Fluorescence spectrum of the effect of SA on PLP
2.4 SA对PLP微观结构的影响
SEM观察S-PLP表面形态可以反映其功能性质的改变。不同琥珀酰化程度的猪肝蛋白样品的微观结构如图4所示,PLP呈现出光滑致密的无定形的大片状结构(1 000×),其表面相对光滑和完整(5 000×)。S-PLP总体仍呈现出无规则片状结构(1 000×),但是结构较为细碎。由于琥珀酸酐黏附在猪肝蛋白的表面,使样品表面(5 000×)呈现不规则和斑片状,出现皱缩的聚集颗粒,变得粗糙,这一结果可能归因于S-PLP亲水特性的变化导致聚集体变为细小光滑颗粒的团块。S-PLP表面出现一些细小的孔穴,且数量逐渐增多,说明琥珀酸酐首先与猪肝蛋白表面的赖氨酸残基发生酰化反应,亲核取代反应的程度越彻底,伴随的蛋白结构变化越大。SA添加量为0.25 g/g Pro至0.40 g/g Pro时,猪肝蛋白表面小孔穴数量相近,由图1可知,此时S-PLP的N-酰化度接近,酰化反应转变为以—OH取代为主,进一步证明了琥珀酰基的取代是从猪肝蛋白表面的游离—NH2开始,再到内部逐步进行,这一结果与刘冠男等[8]研究琥珀酰化改性大豆分离蛋白中的结论一致。琥珀酰化改性可能有利于蛋白质的解聚和分散,以及形成更松散的层状结构。这些变化表明S-PLP的表面和水相或油相之间可能存在结合,改性后的蛋白可能会快速吸附到油-水界面,意味着琥珀酰化可以改善猪肝蛋白的乳化特性。
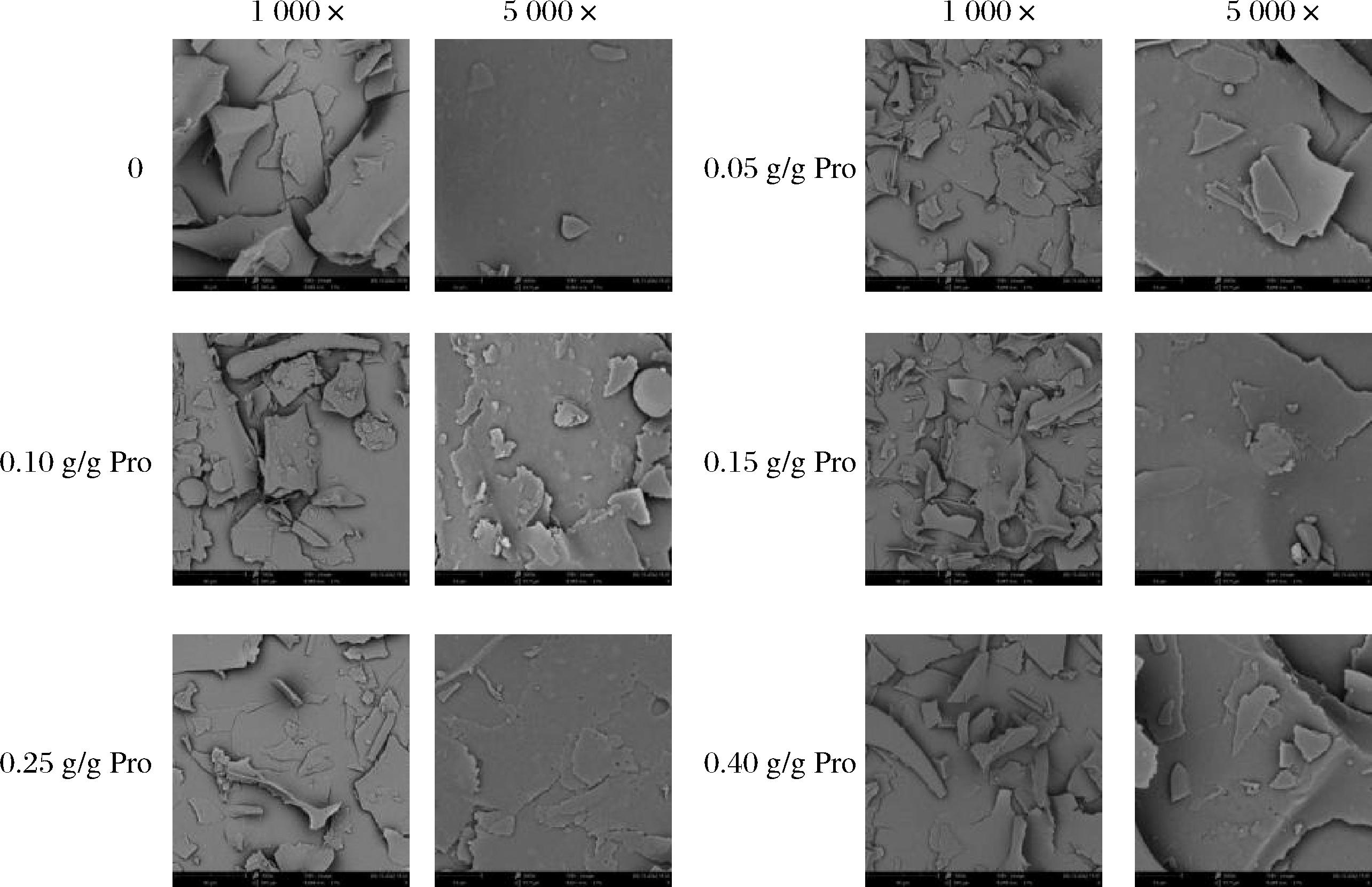
图4 不同琥珀酰化程度的猪肝蛋白样品的微观结构(1 000×、5 000×)
Fig.4 Microstructure of PLP with different degrees of succinylation (1 000×, 5 000×)
2.5 SA添加量对PLP乳化特性的影响
通过测定乳液的乳化活性指数和乳化稳定性来反映琥珀酰化改性对猪肝蛋白乳化特性的影响。由图5可知,琥珀酰化改性显著提高了猪肝蛋白的EAI,随着琥珀酰化程度的增加,EAI先增大后减小,这是因为酰化改性引入大量的琥珀酰基,使包埋于内部的疏水性基团暴露,有利于油滴表面上的蛋白质层形成,导致S-PLP稳定乳液的乳化能力增加。当SA与PLP的质量比达到0.40∶1时,其EAI有所下降,这可能是由于大量琥珀酰基的存在导致分子柔性略微降低,影响EAI[14]。猪肝蛋白的ESI随着琥珀酰化程度的增加先显著降低后略有回升,由于琥珀酰化反应引入了大量带负电的琥珀酰基,增强了表面的电荷密度,排斥作用增强,一定程度上破坏了蛋白质分子之间的作用力,导致在油-水界面形成的蛋白质膜稳定性不高,从而影响乳化稳定性[15]。
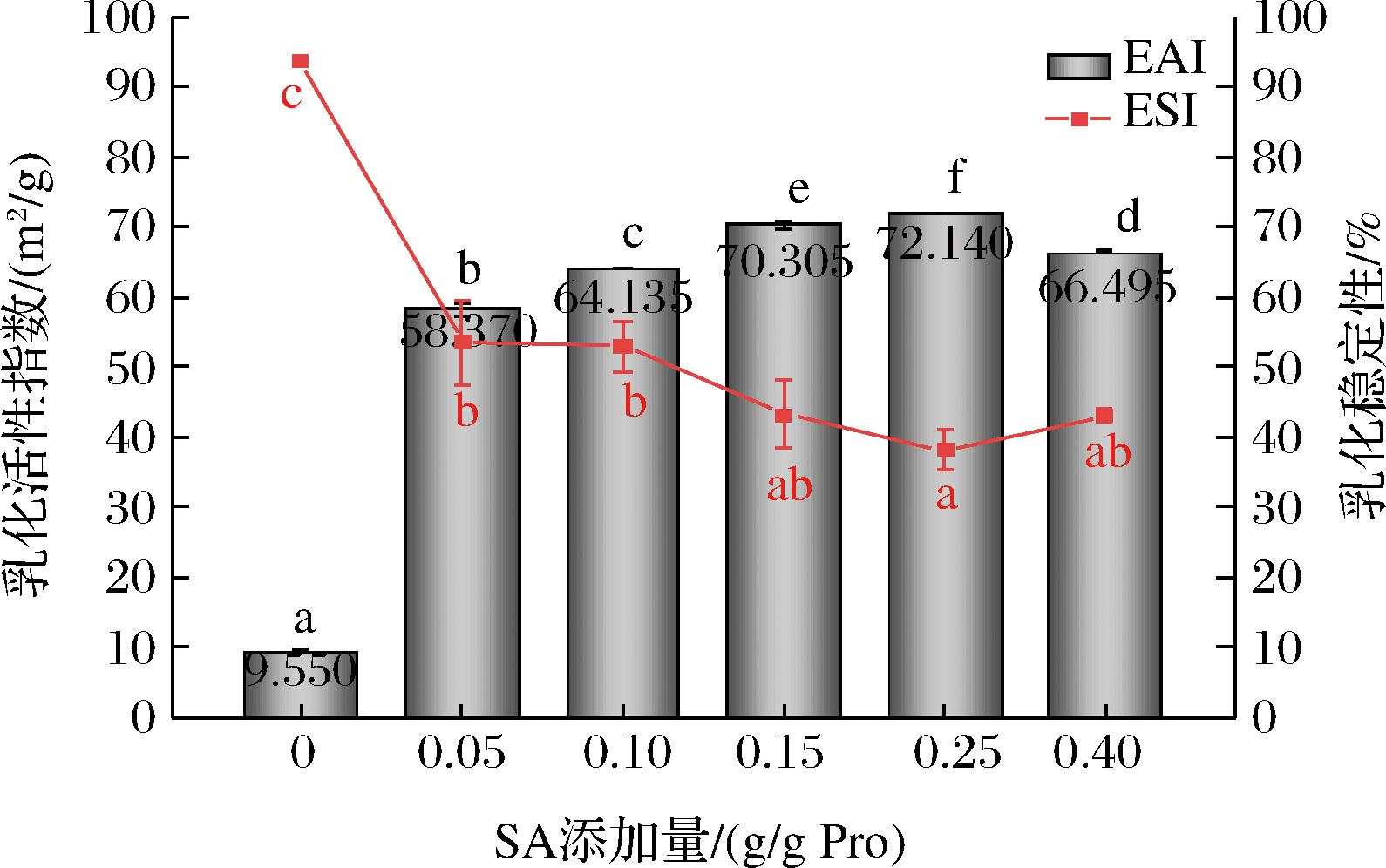
图5 SA添加量对PLP乳化特性的影响
Fig.5 Effect of SA addition on emulsification characteristics of PLP
注:不同小写字母表示差异显著,P<0.05(下同)。
2.6 SA添加量对PLP稳定乳液粒径及Zeta电位的影响
乳液的乳化能力表示其形成稳定小液滴的能力,与乳液液滴的大小及分布情况有关,乳液液滴体积平均直径(d4,3)和表面平均直径(d3,2)影响乳液的乳化活性,低d4,3和d3,2值表示高乳化活性。由图6-a可知,S-PLP乳液的d4,3比PLP乳液粒径显著减小,这与LIAN等[16]的研究结果均一致。随着酰化程度的增加,乳液的液滴d4,3和d3,2均先减小后增大,这一结果很好地解释了上述乳液EAI的变化趋势。在静电排斥较低的情况下,液滴很容易聚集,导致尺寸增大[17]。由图6-b可知,随着琥珀酰化程度的增加,液滴的表面电荷先显著增大后显著减小,SA添加量为0.10 g/g Pro时,Zeta电位的绝对值达到最大,这表明S-PLP能充分地吸附在油滴表面,分散液滴并防止液滴之间的聚集,保持乳液的稳定性[18]。如果蛋白质分子高度带电,分子越来越难以吸附到表面,进一步吸附创造了能量屏障,这可能是SA添加量大于0.10 g/g Pro时,Zeta电位开始降低的原因。随着电位的降低,乳液液滴间排斥力减弱,趋于聚集,这是当SA添加量为0.25 g/g Pro时ESI比0.10 g/g Pro显著降低的原因。
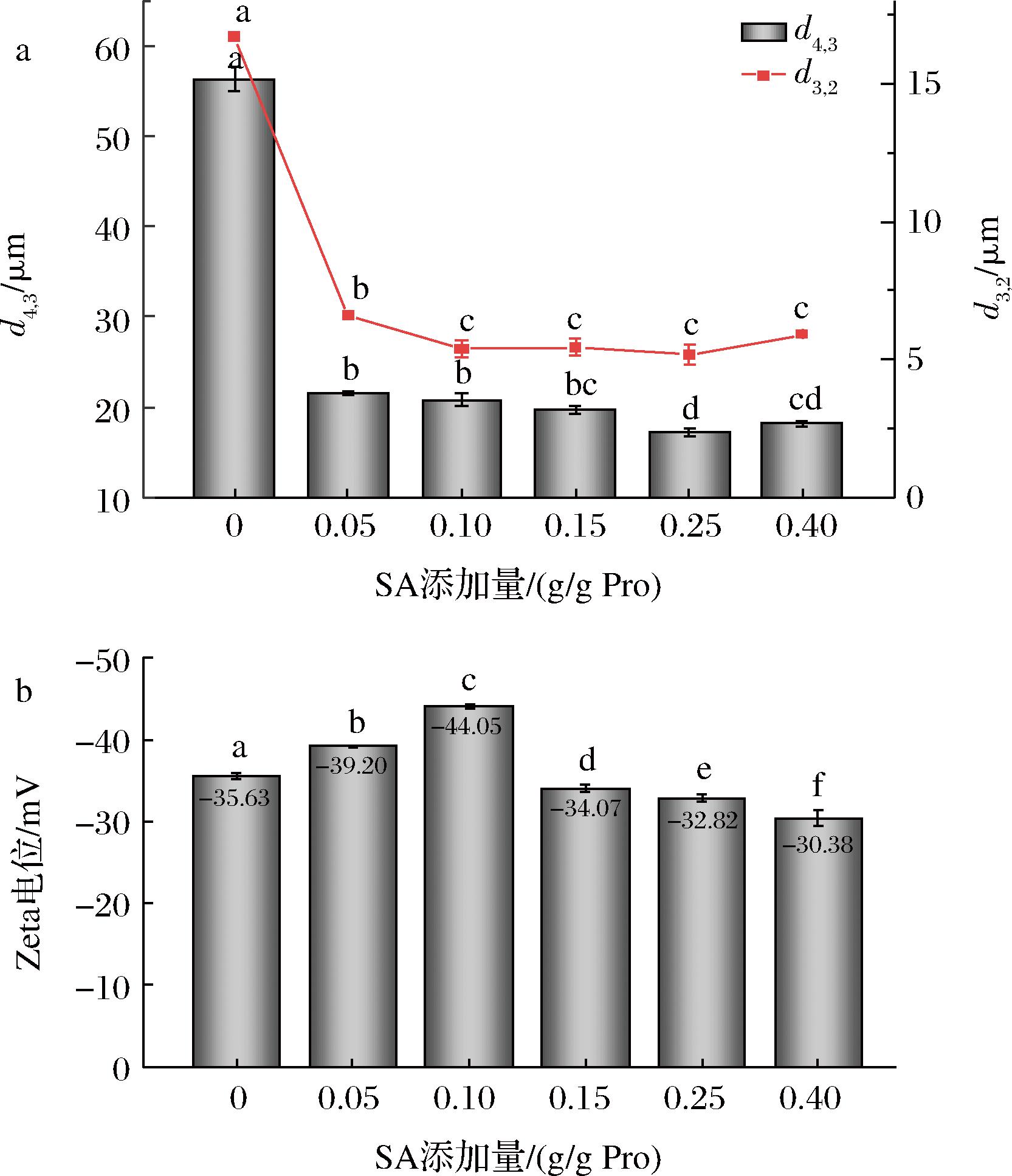
a-乳液粒径;b-乳液Zeta电位
图6 SA添加量对PLP稳定乳液粒径及电位的影响
Fig.6 Effect of SA addition on particle size and Zeta potential of PLP stabilization emulsion
2.7 SA添加量对PLP吸附蛋白质百分比的影响
蛋白质在静电效应和空间位阻效应作用下形成界面蛋白层的薄膜,具有稳定乳液液滴作用,防止液滴聚集、絮凝等现象发生。与PLP相比,S-PLP稳定乳液在油-水界面上表现出更强的吸附能力。此外,AP随酰化程度的增加呈先上升后下降的趋势(图7),这与LIAN等[16]研究结果一致。造成这种变化的主要原因有2个:第一,适度的琥珀酰化导致蛋白质的部分去折叠,增加了蛋白质的柔韧性,促进了蛋白质在油-水界面上的快速吸附和成膜[19];第二,琥珀酰化增加了液滴之间的静电相互作用和空间位阻,这可以使单个蛋白质分子更稳定地驻留在油滴界面,导致AP增加。当SA添加量为0.10 g/g Pro时,AP达到最大值,较高的蛋白质覆盖率有利于防止液滴聚集和形成较小的液滴,保持乳液的稳定性,这与前文乳液的Zeta电位趋势一致。
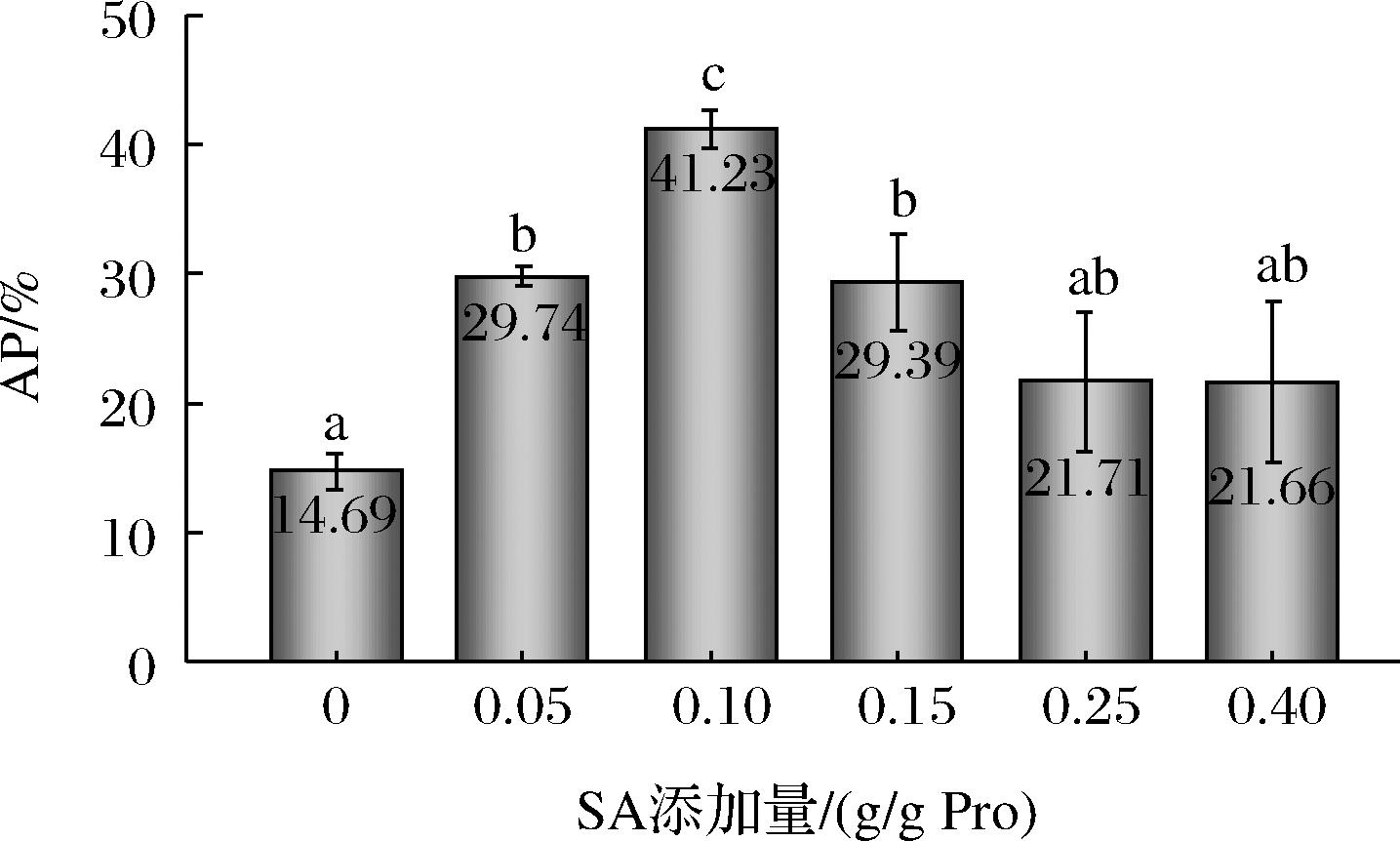
图7 SA添加量对PLP稳定乳液AP的影响
Fig.7 Effect of SA addition on AP of PLP stabilization emulsion
2.8 SA添加量对PLP表面疏水性的影响
蛋白质的表面疏水性(H0)可以反映蛋白质的构象变化,与蛋白质的功能性质密切相关[8]。由图8可知,随着琥珀酰化程度的增加,H0显著下降,这与CHAROENSUK等[5]研究琥珀酰化改性绿豆分离蛋白得出的结论相似。H0的降低可能由2个原因引起:一方面,琥珀酰化反应引起蛋白三级结构的改变,导致表面疏水区域的比例降低;另一方面,琥珀酰基可能增加了PLP表面的电荷密度和电负性。而由荧光光谱图可知,琥珀酰化改性会使最初埋藏在疏水环境中的色氨酸残基逐渐暴露于外部亲水环境,荧光强度增加。因此,H0的降低更大可能是由于琥珀酰基的引入导致蛋白质分子间的静电排斥作用增强,抑制疏水荧光探针ANS与暴露与表面的疏水区域结合,显示出较低的表面疏水性[20]。因此,在制备乳液时,蛋白质的表面疏水性越低越容易与油水界面更好的结合,乳化活性越好。
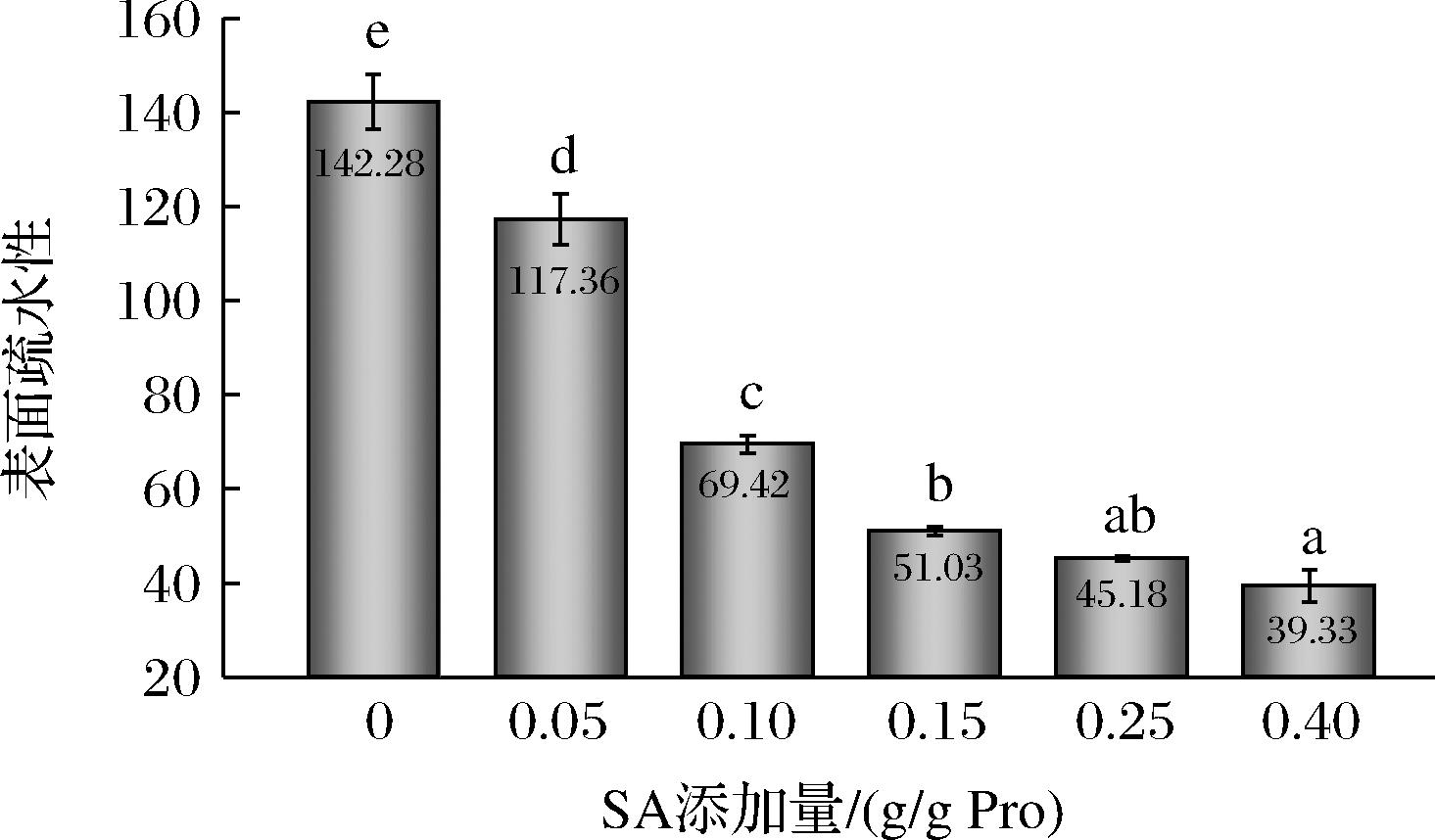
图8 SA添加量对PLP表面疏水性的影响
Fig.8 Effect of SA addition on surface hydrophobicity of PLP
3 结论与讨论
本研究使用SA对PLP进行酰化改性,结果表明,随着SA添加量的增加,猪肝蛋白的酰化程度不断增加,酰化反应前期主要以氨基取代为主,大多数氨基被酰化后,反应转变为取代羟基为主。SA通过共价结合与PLP发生反应,琥珀酰基的引入导致PLP的α-螺旋向β-折叠、β-转角和无规则卷曲转变,荧光强度增强,掩埋在蛋白质内部的色氨酸残基暴露于更加亲水的环境中,微观结构较为细碎,表明PLP的高级结构发生变化,S-PLP具有更高的分子柔性。随着琥珀酰化程度的增加,EAI呈现先增大后减小的趋势,ESI先显著降低后略有回升。这与乳液粒径及表面疏水性的不断减小,乳液Zeta电位值及AP值先增大后减小有关。综合考虑,猪肝蛋白溶液(10 mg/mL)酰化处理时琥珀酸酐的最佳添加量为0.10 g/g Pro,琥珀酰化改性可以显著改善PLP的乳化特性,S-PLP可以作为天然乳化剂在食品工业、化工等行业具有良好的发展前景。
[1] SEONG P N, PARK K M, CHO S H, et al. Characterization of edible pork by-products by means of yield and nutritional composition[J]. Korean Journal for Food Science of Animal Resources, 2014, 34(3):297-306.
[2] 康梦瑶, 丁景, 鲁小川, 等. 超声波处理对水溶性猪肝蛋白乳化特性的影响[J]. 食品与发酵工业, 2020, 46(3):144-151.
KANG M Y, DING J, LU X C, et al. Effect of ultrasonic treatment on emulsification characteristics of water-soluble pig liver protein[J]. Food and Fermentation Industries, 2020, 46(3):144-151.
[3] 陆今明, 彭松林, 杨凯麟, 等. 超声波辅助pH偏移处理对猪肝蛋白结构及乳化特性的影响[J]. 食品研究与开发, 2023, 44(5):89-96.
LU J M, PENG S L, YANG K L, et al. Effect of ultrasound-assisted pH-shifting treatment on the structure and emulsification characteristics of porcine liver protein[J]. Food Research and Development, 2023, 44(5):89-96.
[4] ARYEE A N A, AGYEI D, UDENIGWE C C. Impact of Processing on the Chemistry and Functionality of Food Proteins[M].Amsterdam: Elsevier, 2018:27-45.
[5] CHAROENSUK, BRANNAN, CHANASATTRU, et al. Physicochemical and emulsifying properties of mung bean protein isolate as influenced by succinylation[J]. International Journal of Food Properties, 2018, 21(1):1633-1645.
[6] LU Y Y, PAN D D, XIA Q, et al. Impact of pH-dependent succinylation on the structural features and emulsifying properties of chicken liver protein[J]. Food Chemistry, 2021, 358:129868.
[7] 刘金阳. 燕麦分离蛋白的酰化改性及应用研究[D]. 哈尔滨: 东北农业大学, 2016.
LIU J Y. Research of acylation modification and application of oat protein isolate[D]. Harbin: Northeast Agricultural University, 2016.
[8] 刘冠男, 胡淼, 杜晓倩, 等. 琥珀酰化调控大豆分离蛋白电荷密度对其构象及乳化性的影响[J]. 食品科学, 2022, 43(4):39-45.
LIU G N, HU M, DU X Q, et al. Effect of charge density modification of soy protein isolate by succinylation on its conformation and emulsifying properties[J]. Food Science, 2022, 43(4):39-45.
[9] KARBASI M, ASKARI G, MADADLOU A. Effects of acetyl grafting on the structural and functional properties of whey protein microgels[J]. Food Hydrocolloids, 2021, 112:106443.
[10] PADR S E, MORROS A, MA
S E, MORROS A, MA OSA J, et al. The state of tyrosine and phenylalanine residues in proteins analyzed by fourth-derivative spectrophotometry. Histone H1 and ribonuclease A[J]. European Journal of Biochemistry, 1982, 127(1):117-122.
OSA J, et al. The state of tyrosine and phenylalanine residues in proteins analyzed by fourth-derivative spectrophotometry. Histone H1 and ribonuclease A[J]. European Journal of Biochemistry, 1982, 127(1):117-122.
[11] YE M P, ZHOU R, SHI Y R, et al. Effects of heating on the secondary structure of proteins in milk powders using mid-infrared spectroscopy[J]. Journal of Dairy Science, 2017, 100(1):89-95.
[12] AGARWAL A, PATHERA A K, KAUSHIK R, et al. Succinylation of milk proteins: Influence on micronutrient binding and functional indices[J]. Trends in Food Science &Technology, 2020, 97:254-264.
[13] HE M Y, LI L J, WU C L, et al. Effects of glycation and acylation on the structural characteristics and physicochemical properties of soy protein isolate[J]. Journal of Food Science, 2021, 86(5):1737-1750.
[14] XIA N, LU X X, ZHENG Z, et al. Study on preparation of acylated soy protein and stability of emulsion[J]. Journal of the Science of Food and Agriculture, 2021, 101(12):4959-4968.
[15] MIRMOGHTADAIE L, KADIVAR M, SHAHEDI M. Effects of succinylation and deamidation on functional properties of oat protein isolate[J]. Food Chemistry, 2009, 114(1):127-131.
[16] LIAN Z T, YANG S, CHENG L, et al. Emulsifying properties and oil-water interface properties of succinylated soy protein isolate: Affected by conformational flexibility of the interfacial protein[J]. Food Hydrocolloids, 2023, 136:108224.
[17] JARPA-PARRA M, BAMDAD F, TIAN Z, et al. Impact of pH on molecular structure and surface properties of lentil legumin-like protein and its application as foam stabilizer[J]. Colloids and Surfaces B: Biointerfaces, 2015, 132:45-53.
[18] DAS PURKAYASTHA M, BORAH A K, SAHA S, et al. Effect of maleylation on physicochemical and functional properties of rapeseed protein isolate[J]. Journal of Food Science and Technology, 2016, 53(4):1784-1797.
[19] DELAHAIJE R J B M, WIERENGA P A, GIUSEPPIN M L F, et al. Improved emulsion stability by succinylation of patatin is caused by partial unfolding rather than charge effects[J]. Journal of Colloid and Interface Science, 2014, 430:69-77.
[20] ZHAO C B, ZHANG H, XU X Y, et al. Effect of acetylation and succinylation on physicochemical properties and structural characteristics of oat protein isolate[J]. Process Biochemistry, 2017, 57:117-123.