2型糖尿病(type 2 diabetes mellitus,T2DM)是一种由多种病因引起的以长期高血糖为特征的的慢性代谢性疾病,近年来,随着糖尿病患者数量的剧增,与其相关的并发症也不断增加[1-2]。肝病是糖尿病患者常见的并发症之一。肝脏是人体参与糖代谢的重要器官,持续的高糖环境会促使机体产生氧化应激反应,释放大量炎症因子从而对肝组织造成损伤[3]。肠道菌群是人体最大的微生态系统,参与人体的物质和能量代谢,调节机体的新陈代谢以及能量平衡[4]。肠道菌群的稳定对2型糖尿病合并肝损伤的发生发展起着至关重要的作用[5]。
青钱柳(Cyclocarya paliurus)属胡桃科青钱柳属,又称青钱李、麻柳等,是我国宝贵的中药资源。据《中国中药资源志要》记载,其叶、皮、根均可入药,具有清热解毒、止痛等功效[6-7]。现代研究表明,青钱柳具有的降糖降脂、调节免疫力、抗衰老、抗肿瘤等作用[8-10]。青钱柳为一种药食同源植物,具有药食兼用的功效,被誉为植物界的大熊猫。本研究用冠突散囊菌对青钱柳进行发酵,水浴浸提其发酵物,并建立T2DM合并肝损伤模型,探究青钱柳发酵物是否能有效调节T2DM合并肝损伤大鼠糖脂代谢及肠道菌群的紊乱。
1 材料与方法
1.1 材料
1.1.1 动物
SPF级健康SD大鼠体重约190~210 g,由北京华阜康生物科技股份有限公司提供,许可证号:SCXK(京)2019-0008。本研究中涉及实验动物的处置,遵循陕西中医药大学实验动物伦理委员会的相关规定,符合该伦理委员会制定的相关标准(批准编号:20231107002)。饲养条件:室温24~26 ℃、相对湿度45%~55%,12 h交替光照,自由摄食饮水。
1.1.2 主要药物与试剂
青钱柳发酵物FC制备:参照文献[11],将青钱柳叶按照培养基质量的5%接种冠突散囊菌孢子悬液后渥堆发酵4 d,将发酵后的青钱柳干燥后粉碎,粉末按照1∶25料液比(g∶mL)加入蒸馏水,75 ℃水浴浸提1.5 h,抽滤后浓缩、60 ℃真空干燥至恒重,得青钱柳发酵物FC,密封保存,每次使用前充分溶于蒸馏水。
实验中所用试剂盒包括:A111-1-1总胆固醇(total cholesterol,TC)、A035甘油三酯(triglyceride,TG)、A028低密度脂蛋白(low density lipoprotein-cholesterol,LDL-C)、C009-2-1丙氨酸氨基转移酶(alanine aminotransferase,ALT)及C010-2-1天冬氨酸氨基转移酶(aspartate aminotransferase,AST)等,南京建成生物工程研究所;S0130-1G链脲佐菌素(streptozocin,STZ),Sigma公司;盐酸二甲双胍(规格为0.5 g/片,H20023370),中美上海施贵宝制药有限公司。
1.2 实验方法
1.2.1 动物模型制备及给药
大鼠适应性喂养1周后,随机分为空白组(C组)(n=8)和造模组(M组)(n=32),空白组以基础饲料饲养,造模组以高脂高糖饲料(表1)连续饲养8周后,禁食不禁水12 h,对大鼠一次性腹腔注射35 mg/kg剂量的STZ,空白组大鼠给予相同体积的柠檬酸缓冲液注射。第3天、第7天尾静脉采血测随机血糖≥16.7 mmo1/L者为造模成功。将模型构建成功的大鼠随机分为模型组(M组)、二甲双胍组(P组)、青钱柳发酵物低剂量组(L组)和高剂量组(H组)。剂量组分别按10 mL/kg蒸馏水、75 mg/kg FC和300 mg/kg FC灌胃;P组给予二甲双胍0.2 g/kg、10 mL/kg蒸馏水灌胃;C组和M组以等体积蒸馏水灌胃;1 次/d,干预4周。
表1 大鼠饲料配方
Table 1 Rat feed formula
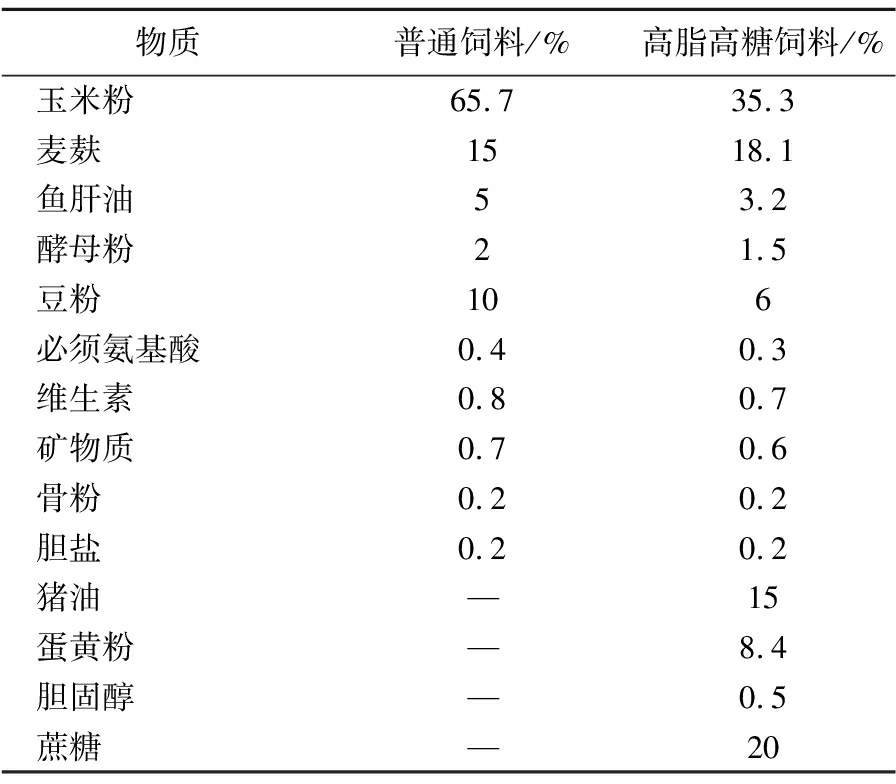
物质普通饲料/%高脂高糖饲料/%玉米粉65.735.3麦麸1518.1鱼肝油53.2酵母粉21.5豆粉106必须氨基酸0.40.3维生素0.80.7矿物质0.70.6骨粉0.20.2胆盐0.20.2猪油—15蛋黄粉—8.4胆固醇—0.5蔗糖—20
注:“—”表示不添加。
1.2.2 空腹血糖及口服葡萄糖耐量实验
实验期间,观察大鼠的精神、活动及饮食情况。每周尾静脉采血,测空腹血糖(fasting blood glucose,FBG)值。末次给药后,禁食不禁水12 h,以2.5 g/kg的剂量灌胃葡萄糖后,分别在灌胃后0、0.5、1、2 h等4个时间点测定血糖值,并计算OGTT时间-血糖的曲线下面积(area under curve,AUC)。
1.2.3 生化指标的检测
末次灌胃后,大鼠禁食不禁水12 h后,10%水合氯醛麻醉,下腔静脉采血,收集血液,4 ℃、3 000 r/min离心15 min分离血清。并按照试剂盒说明书操作步骤进行TG、TC、LDL-C、AST、ALT等指标的检测,并统计分析。
1.2.4 粪便肠道菌群的检测
末次灌胃结束禁食不禁水12 h,对大鼠进行排便刺激,无菌EP管收集粪便。每组随机选出5个样本,用E.Z.N.A.® Soil DNA抽提试剂盒提取样本总DNA,Nano-drop超微量分光光度计检测DNA样品浓度和纯度。以正向引物(5′-ACTCCTACGGGAGCAG-3′)和反向引物(5′-GCACTACHVGGGTWTCTAAT-3′)对样品16S rDNA的V3+V4可变区进行扩增,平均片段长度为420 bp。PCR扩增和测序工作由上海美吉生物医药科技有限公司协助完成。将从Illumina MiSeq PE300平台获取的原始数据通过QIIME v1.9.1软件进行过滤筛选,筛除序列长度<100 bp、碱基模糊或者错配超过2个的序列以及单独碱基重复6个以上的序列。采用vsearch7.1软件对筛选序列进行OTU(Operational Taxonomic Units)聚类分析,在97%的相似度水平下获得操作分类单位(operational taxonomic unit,OTU),RDP classifier贝叶斯算法对OTUs序列进行分类学分析。基于OTU水平,进行Alpha多样性分析、Beta多样性分析、群落组成分析以及标志菌群LefSe分析。
1.3 数据统计分析
实验数据采用平均数±标准差![]() 表示,使用GraphPad Prism8软件进行统计分析并作图,ANOVA及Dunnett′s t检验进行组间差异性比较。P<0.05表示有统计学差异。
表示,使用GraphPad Prism8软件进行统计分析并作图,ANOVA及Dunnett′s t检验进行组间差异性比较。P<0.05表示有统计学差异。
2 结果与分析
2.1 对一般体征及空腹血糖的影响
实验期间,C组大鼠毛发柔顺光亮,动作活跃,精神状况良好。与C组相比,造模后各组大鼠均表现出不同程度的体重减轻,行动迟缓,毛发稀疏少光泽,并伴有多饮多食多尿等现象。糖尿病的典型特征即为多饮多食多尿,体重减轻[12]。各治疗组大鼠症状较M组有所减轻,多饮多食多尿程度降低。
如图1、表2所示,经高脂高糖饲料和STZ诱导后,M组及各给药组的FBG均显著高于C组(P<0.05)。给药第2周后M组大鼠血糖值增长趋于平稳,给药第4周后P组和剂量组大鼠FBG明显下降。与P组比较,H组血糖值稍高,无统计学意义(P>0.05)。
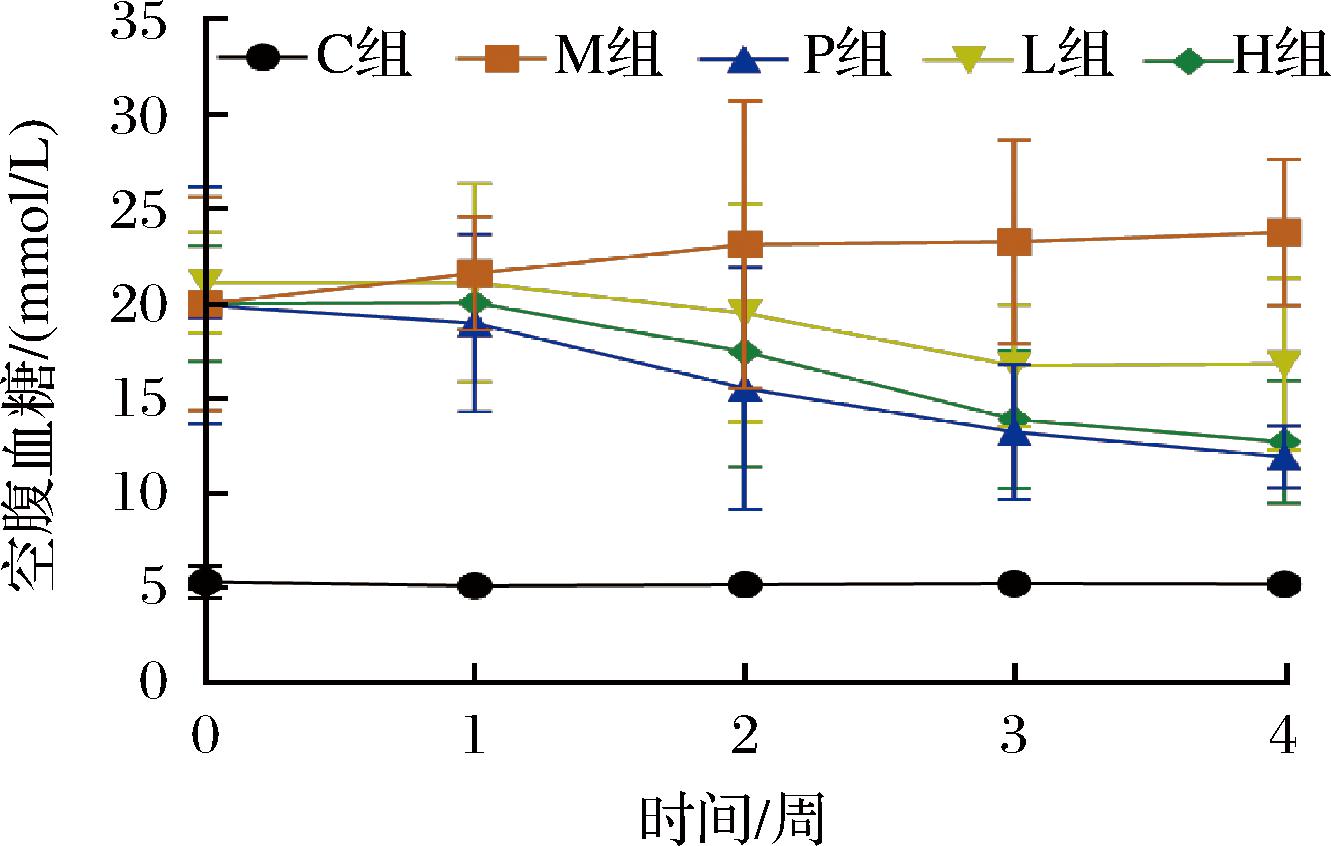
图1 各组大鼠治疗期间空腹血糖波动情况
Fig.1 Fluctuations in fasting blood glucose during treatment in each group
表2 各组大鼠治疗期间空腹血糖的比较![]()
Table 2 Comparison of fasting blood glucose during treatment in each group ![]() n=8)
n=8)

组别0周1周2周3周4周C组5.33±0.86b5.13±0.48b5.18±0.56b5.23±0.41c5.22±0.24cM组19.98±5.64a21.60±2.99a23.12±7.58a23.25±5.37a23.77±3.87aP组19.90±6.26a18.98±4.66a15.52±6.40a13.23±3.57b11.90±1.66bL组21.09±2.66a21.10±5.21a19.50±5.76a16.72±3.22b16.82±4.52bH组19.98±3.05a20.05±1.44a17.45±6.06a13.89±3.66b12.71±3.25b
注:同列中不同小写字母表示存在显著差异(P<0.05)(下同)。
2.2 对糖耐量的影响
如图2所示,灌胃葡萄糖溶液后,各组血糖值在1 h达到顶峰,M组、P组及剂量组的血糖值和AUC均显著高于C组。与M组比较,P组和剂量组的血糖值和AUC均有所下降(P<0.05),与P组比较,剂量组的AUC值偏高,但无明显差异(P>0.05)。
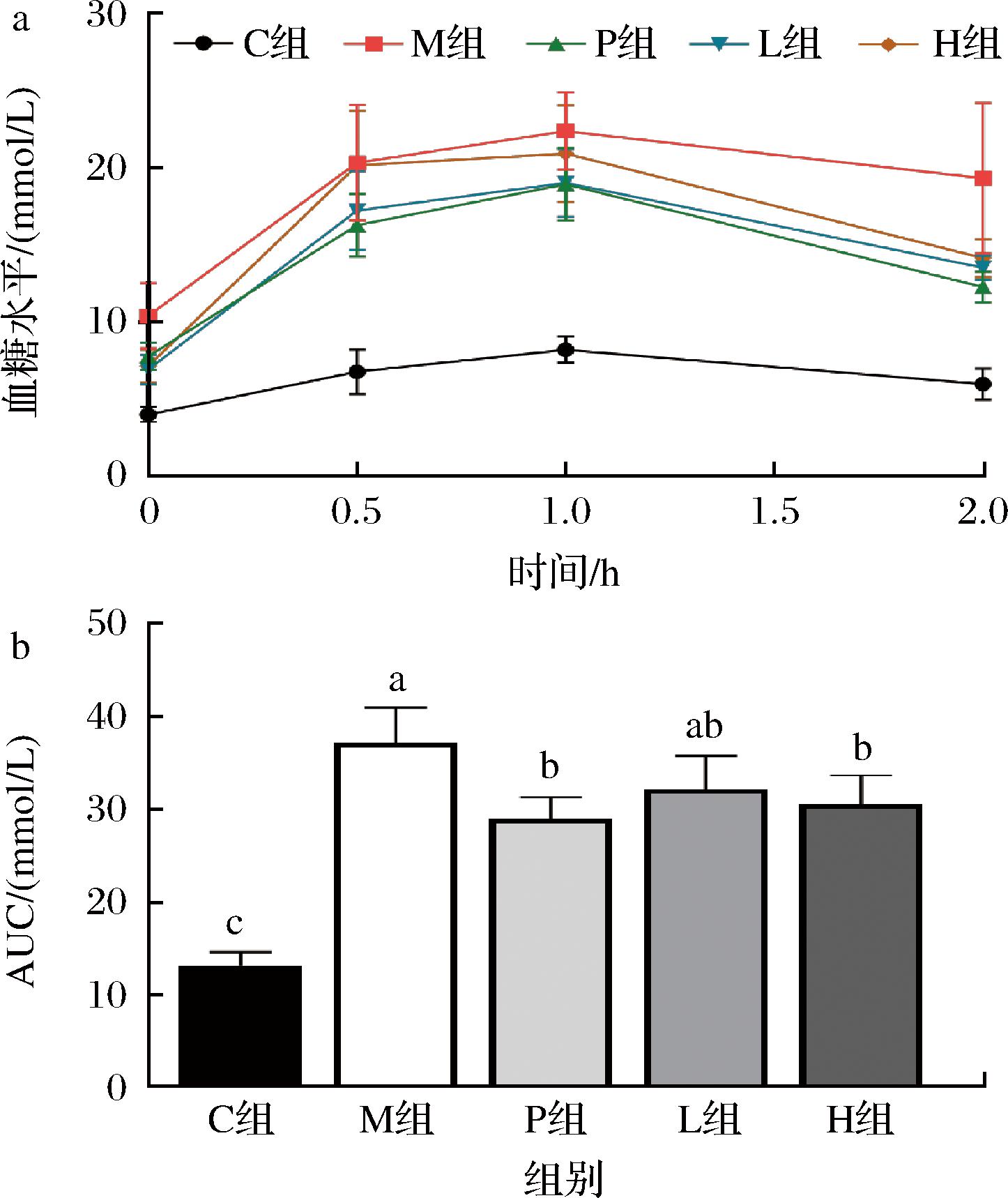
a-OGTT;b-AUC
图2 青钱柳发酵物对各组大鼠葡萄糖耐量和曲线下面积的影响
Fig.2 Effect of Cyclocarya paliurus fermentation on glucose tolerance and area under curve in each group
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.3 对血脂和肝功能水平的影响
如图3所示,与C组比较,M组大鼠血清中相关指标TC、TG、LDL、ALT及AST水平均显著升高(P<0.05)。与M组比较,P组和H组TC、TG、LDL及ALT、AST水平均显著降低(P<0.05);L组TC、TG、LDL、AST水平均显著降低(P<0.05),ALT水平相比M组也有所降低,但无统计学意义(P>0.05)。与P组比较,H组TC、TG、LDL及ALT、AST水平均无显著差异(P>0.05),而L组AST水平显著升高(P<0.05)。

a-TC;b-TG;c-LDL-C;d-AST;e-ALT
图3 青钱柳发酵物对各组大鼠血脂和肝功能指标的影响
Fig.3 Effect of Cyclocarya paliurus fermentation on blood lipid and liver function indexes in each group
2.4 菌群多样性分析
Coverage指数反映了样本的微生物群落覆盖度,覆盖率越高,物种被检测出来的概率越大。如表3所示,每个样本的Coverage指数值均在0.997以上,表明样本的微生物群落覆盖度≥99.7%,可以反映样本中微生物的真实情况。Shannon指数反映样本群落均匀度。Shannon指数在各组间均无显著性差异(P>0.05)。Ace和Chao1指数衡量物种丰度和物种数量的多少。与C组比较,M组、P组和L组Ace指数显著性降低(P<0.05),H组Ace指数也有所下降,但与C组无显著差异(P>0.05);M组和L组Chao1指数与C组相比显著性降低(P<0.05),P组和H组Chao1指数与C组无显著差异(P>0.05)。
表3 肠道菌群α多样性统计表![]()
Table 3 Statistic of gut microbiota α-diversity ![]() n=5)
n=5)
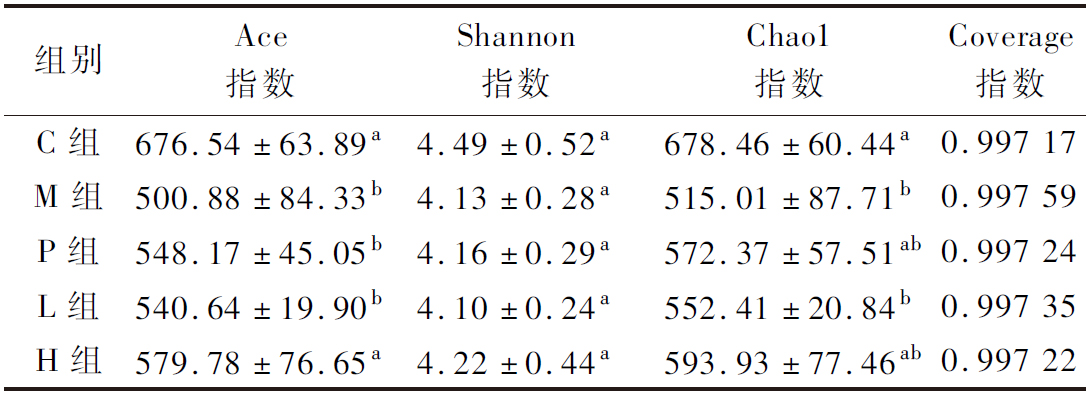
组别Ace指数Shannon指数Chao1指数Coverage指数C组676.54±63.89a4.49±0.52a678.46±60.44a0.997 17M组500.88±84.33b4.13±0.28a515.01±87.71b0.997 59P组548.17±45.05b4.16±0.29a572.37±57.51ab0.997 24L组540.64±19.90b4.10±0.24a552.41±20.84b0.997 35H组579.78±76.65a4.22±0.44a593.93±77.46ab0.997 22
Beta多样性分析用于描述样本间群落结构的相似性及差异性。本研究采用Bray-Curtis距离算法,在OTU水平上对样本进行主坐标分析(principle coordinateanalysis, PCoA),距离越近,表示样本相似性越高。如图4显示,C组与M组沿着PC1水平分布较远,表示二者的菌群结构明显不同。灌胃后,H组菌群分布与M组完全分离,说明H组大鼠的肠道菌群结构与M组相比发生了改变,而与C组有接近的趋势。P组和L组与M组的菌群分布未能分离,表明青钱柳发酵物对T2DM合并肝损伤大鼠肠道菌群有着明显的重塑作用。PC1的贡献度是27.32%,PC2的贡献度是13.47%。
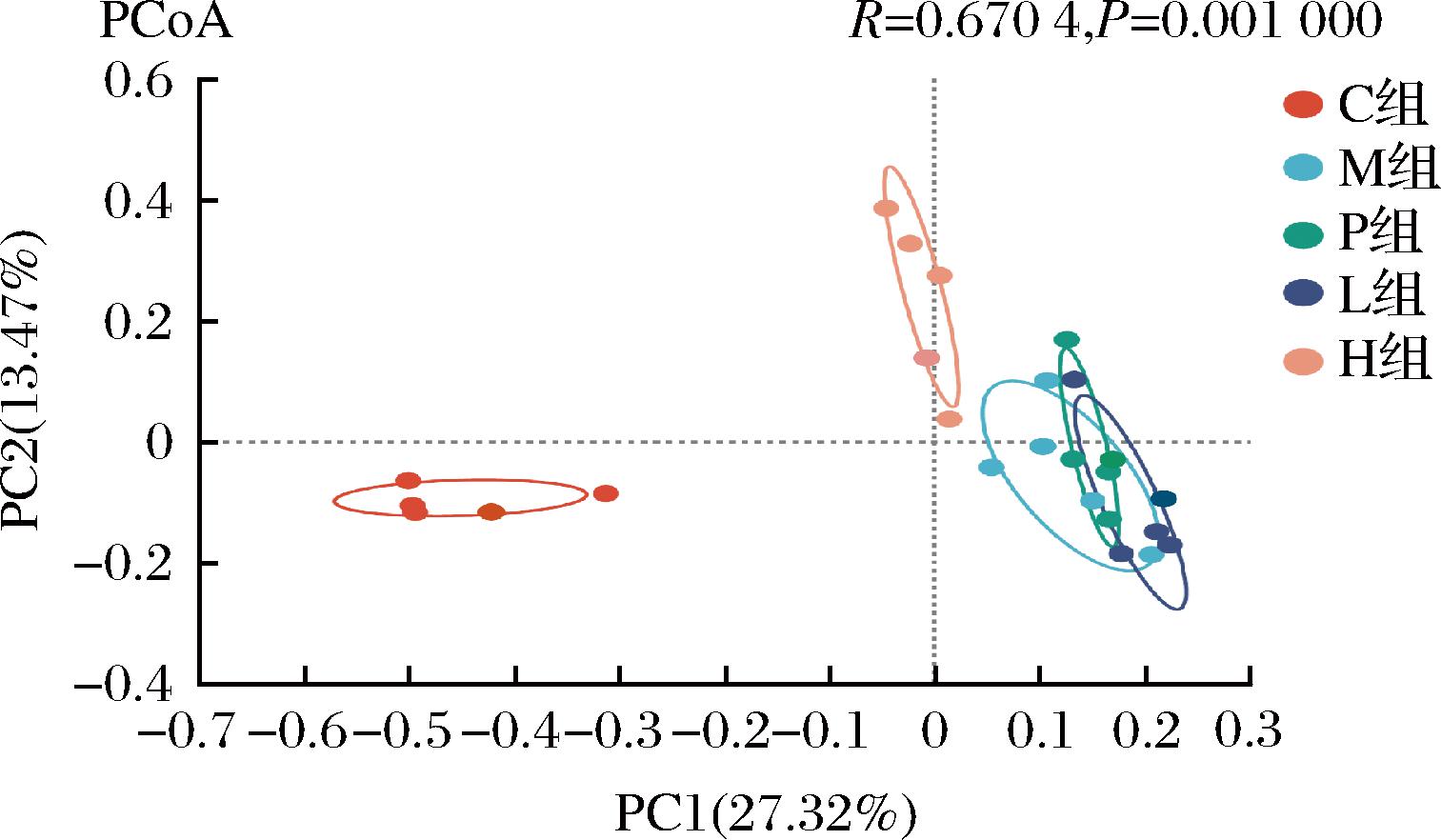
图4 肠道微生物Beta多样性分析
Fig.4 Beta-diversity analysis of gut microbial
2.5 菌群结构分析
将收集的大鼠粪便样本通过16S rDNA高通量测序,并经97%相似度的聚类处理后,共得到1 029个OTUs,主要分布于13个门,194个属。如图5-a所示,在门水平中,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)的丰度总和在各组中均超过了90%,为各组绝对优势菌门。与C组相比,M组Firmicutes丰度显著下降,Bacteroidetes丰度显著上升,F/B比值显著下降(P<0.05)。与M组相比,H组Firmicutes丰度显著上升,Bacteroidetes丰度显著下降,F/B比值显著上升(P<0.05)。P组和L组Firmicutes和Bacteroidete丰度值相比M组有所变化但无显著性差异(P>0.05)。

a-门水平相对丰度;b-属水平相对丰度
图5 各组大鼠肠道菌群物种相对丰度
Fig.5 Relative abundance of gut microbiota in each group
在属分类水平上合并丰度占比小于2%的菌属,结果如图5-b所示,主要包括norank_f__Muribaculaceae、乳杆菌属Lactobacillus、Bacteroides、Prevotella、Lachnospiraceae_NK4A136_group等。与C组相比,M组中Bacteroides、Prevotella、Turicibacter、Escherichia-Shigella的相对丰度显著增加,norank_f__Muribaculaceae、Lactobacillus、Lachnospiraceae_NK4A136_group、NK4A214_group的丰度相对降低。与M组相比,P组增加了norank_f__Muribaculaceae、乳杆菌属Lactobacillus、Bacteroides等的相对丰度,降低Prevotella、unclassified_f__Lachnospiraceae、Escherichia-Shigella、Lachnospiraceae_NK4A136_group的相对丰度。相比较M组,剂量组在不同程度上均增加了样本中norank_f__Muribaculaceae、乳杆菌Lactobacillus的相对丰度,均降低了Turicibacter的相对丰度,其中H组还增加了Lachnospiraceae_NK4A136_group、UCG-005、Christensenellaceae_R-7_group等益生菌的相对丰度。
2.6 LEfSe 多级物种差异判别分析
LEfSe结果如图6显示,C组中富集颤螺旋菌科Oscillospiraceae、消化链球菌科Peptostreptococcaceae以及其下的罗姆布茨菌属Romboutsia、norank_f__Eubacterium_coprostanoligenes_group、梭菌纲某未定名属norank_f__norank_o__Clostridia_UCG-014、UCG-005。相比C组,M组中Turicibacter属和毛螺菌属Lachnospira的线性判别分析(linear discriminant analysis,LDA)值也较高。P组中富集Bacteroidaceae以及其下的Bacteroides、Prevotellaceae_UCG-001。L组中富集Prevotellaceae以及其下的Prevotella、肠杆菌科Enterobacteraceae以及其下的Escherichia-Shigella、Ruminococcus_torques_group瘤胃球菌属Ruminococcus、Tannerellaceae伯克氏菌科以及其下的Parabacteroides狄氏副拟杆菌。H组中富集厚乳杆菌Lactobacillaceae以及其下的乳杆菌属Lactobacillus、Lachnospiraceae_NK4A136_group等。
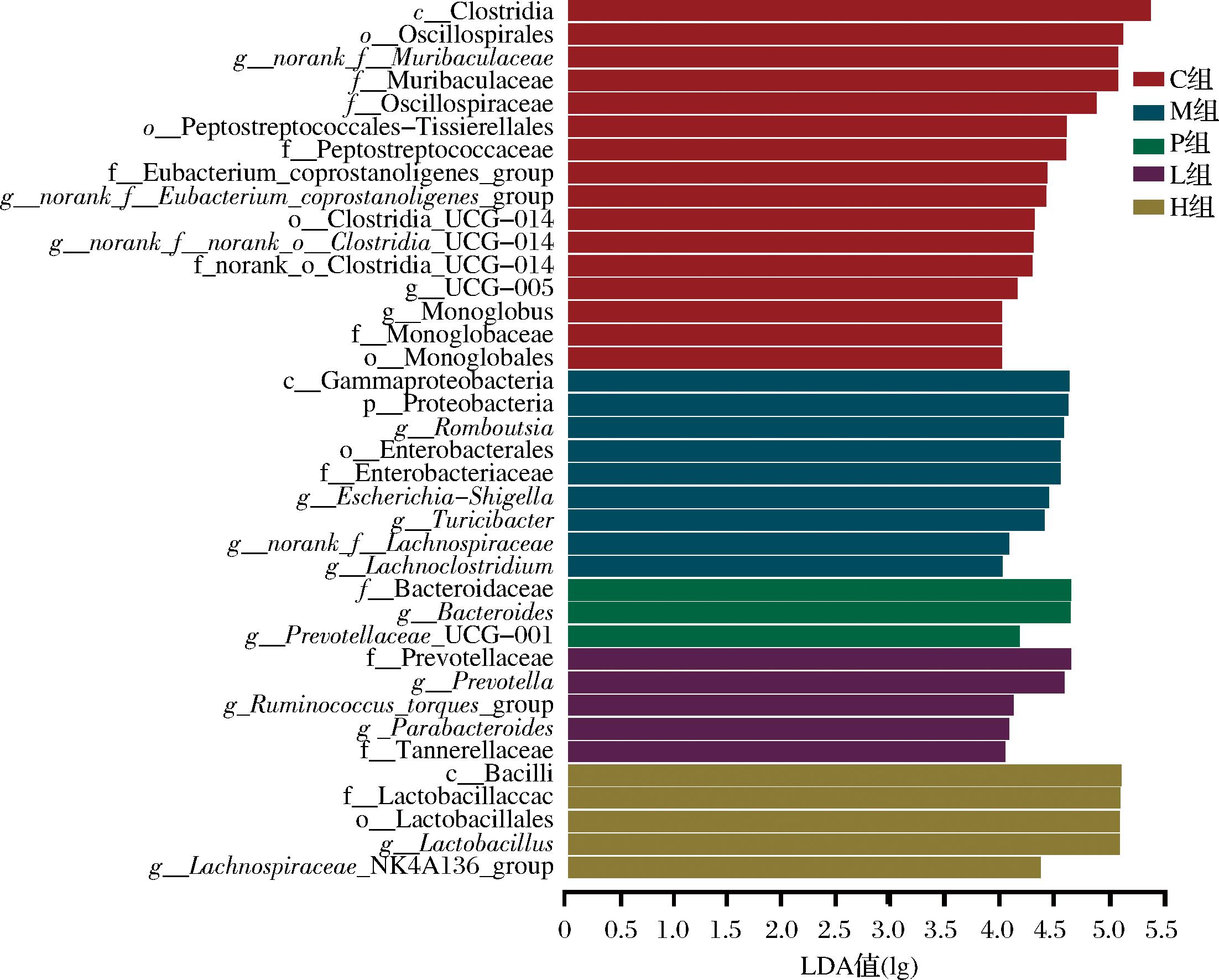
图6 各组大鼠肠道标志菌群的比较
Fig.6 Comparison of intestinal marker flora in each group
3 讨论
随着人们生活质量的提高和生活节奏的加快,2型糖尿病合并肝损伤患者数呈现出明显的增长趋势,其发病机制复杂多样[13-15]。中医认为糖尿病责之肝、脾,目前尚无针对糖尿病致肝损伤的特效药物。青钱柳在我国民间常作茶饮,具降血糖作用。本研究以冠突散囊菌对青钱柳进行发酵,其发酵产物中富含咖啡碱、茶多糖等生物天然活性成分[13-14],这些成分已被证明对糖尿病患者肝、肾及心血管损伤具有潜在的防治作用[15],能有效阻止血糖血脂升高,维持人体的正常代谢。本研究也显示,青钱柳发酵物在降低血糖血脂方面,可起到与二甲双胍相同的作用。血清AST、ALT是肝细胞重要的酶,也是糖尿病合并脂肪肝的相对敏感指标,可反映肝纤维化、肝硬化的发展程度。补充青钱柳发酵物后,AST及ALT水平明显下降,说明青钱柳发酵可有效防治肝损伤的发生。
近年来研究显示,糖尿病患者常伴有肠道菌群紊乱的发生[16-17]。本研究显示,厚壁菌门和拟杆菌门为各组中的优势菌门,厚/拟比值可作为饮食诱导的肠道菌群紊乱的标志[18]。在本研究中,补充青钱柳发酵物后,高剂量组厚壁菌门丰度升高,拟杆菌门丰度降低,厚/拟比值得到上调,抑制了饮食诱导的大鼠肠道菌群紊乱。同时,大鼠肠道中微生物群落的丰富度和多样性均被提高,而肠道菌群多样性的提高可极大的增强大鼠对外界不良环境的抵抗力。
有研究发现,变形菌门Proteobacteria可导致肠道内毒素产量增加从而使肠道免疫功能紊乱,甚至能引起代谢性内毒素血症[19],变形菌门中Enterobacteriaceae肠杆菌科的Escherichia-Shigella可通过穿透上皮细胞致使巨噬细胞凋亡,并释放IL-1β来诱导肠道炎症[20]。本研究结果中显示的Escherichia-Shigella丰度的增加可能会导致大鼠肠道炎症的进一步恶化。Turicibacter菌属的细菌具有致病性生活方式,其丰度的增加是肠道微生物结构紊乱的标志之一[21]。Turicibacter和Escherichia-Shigella均为模型组的标志菌群,在模型组大鼠肠道中的丰度相比正常组显著增加。在补充了青钱柳发酵物后,显著降低了肠道内以上有害菌的丰度。此外,补充青钱柳发酵物还增加了肠道中norank_f__Muribaculaceae、乳杆菌属Lactobacillus、Lachnospiraceae_NK4A136_group、Christensenellaceae_R-7_group等有益菌的相对丰度。Norank_f_Muribaculaceae广泛存在于肠道微生物组中,可消化碳水化合物,引起脂解并提高胰岛素敏感性[22]。Lachnospiracae_NK4A136_group在肠道中富集,可降解非淀粉多糖并产生SCFAs,对血糖调节有积极影响[23]。有研究表明,Christensenellaceae_R-7_group是人类和动物肠道及黏膜中广泛存在的潜在益生菌,可下调促炎细胞因子,改善肠道黏膜屏障功能[24]。乳杆菌属Lactobacillus是一种能调节葡萄糖和脂质代谢的有益细菌,具有降低氧化应激的潜力,是人体肠道菌群中最重要的益生菌[25],并且,LEfSe结果显示,Lactobacillus为高剂量组的标志菌群,表示青钱柳发酵物可以通过提高宿主肠道中有益菌的增值,来调节机体血糖代谢及炎症水平。
综上所述,青钱柳发酵物可以有效降低模型大鼠的血糖值并改善其肝损伤状态,是一种具有降糖保肝活性的天然产物。并且,其在T2DM合并肝损伤大鼠中的作用机制可能与其对肠道中菌群失衡的调节有关。由于其天然的安全性,青钱柳发酵物在治疗T2DM合并肝损方面不失为一种可行疗法。但青钱柳发酵物调节肠道菌群的具体分子作用机制以及究竟是哪种成分具有抗糖活性仍有待深入研究。
[1] NI L P, YU D, WU T F, et al. Gender-specific association between non-alcoholic fatty liver disease and type 2 diabetes mellitus among a middle-aged and elderly Chinese population: An observational study[J]. Medicine, 2021, 100(6): e24743.
[2] 刘林杰, 李慧琼, 徐焱成. Ⅱ型糖尿病合并非酒精性脂肪肝流行状况与危险因素[J]. 公共卫生与预防医学, 2019, 30(3):40-43.
LIU L J, LI H Q, XU Y C. Study on prevalence and risk factors of type 2 diabetes mellitus complicated with nonalcoholic fatty liver disease[J]. Journal of Public Health and Preventive Medicine, 2019, 30(3):40-43.
[3] ZHAO Y Y, XING H C, WANG X M, et al. Management of diabetes mellitus in patients with chronic liver diseases[J]. Journal of Diabetes Research, 2019, 2019:6430486.
[4] NOVAKOVIC M, ROUT A, KINGSLEY T, et al. Role of gut microbiota in cardiovascular diseases[J]. World Journal of Cardiology, 2020, 12(4):110-122.
[5] 马明艳, 陈雪莲, 王淑霞, 等. 肠道微生物与肥胖关系的研究进展[J]. 中国食物与营养, 2023, 29(5):73-76; 80.
MA M Y, CHEN X L, WANG S X, et al. Research advancement on the relationship between intestinal microorganisms and obesity[J]. Food and Nutrition in China, 2023, 29(5):73-76; 80.
[6] 林子欣. 青钱柳化学成分分离、网络药理学和三萜类化合物合成通路研究[D]. 上海: 上海师范大学, 2021.
LIN Z X. Study on separation of chemical components, network pharmacology and synthetic pathways of triterpenoids from Cyclocarya paliurus[D]. Shanghai: Shanghai Normal University, 2021.
[7] 李俊, 梁晓琴, 常燕玲, 等. 青钱柳的化学成分及药理活性研究进展[J]. 广西师范大学学报(自然科学版), 2022, 40(5):227-252.
LI J, LIANG X Q, CHANG Y L, et al. Review on the constituents and pharmacological activities of Cyclocarya paliurus[J]. Journal of Guangxi Normal University (Natural Science Edition), 2022, 40(5):227-252.
[8] 李燕, 蔡儒安, 潘如梨, 等. 青钱柳水提物降血糖及抗发炎功效研究[J]. 中国食品学报, 2021, 21(9):102-109.
LI Y, CAI R A,Pan R L, et al. Studies on hypoglycemic and anti-inflammatory effects of Cyclocarya paliurus extract[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(9):102-109.
[9] 徐若宸, 张鹏, 向明. 青钱柳化学成分及抗代谢性疾病药理作用研究进展[J]. 中草药, 2023, 54(9):2962-2977.
XU R C, ZHANG P, XIANG M. Research progress on chemical constituents and anti-metabolic disease pharmacological effects of Cyclocarya paliurus[J]. Chinese Traditional and Herbal Drugs, 2023, 54(9):2962-2977.
[10] 姚新伟, 赵锦金, 徐德平. 青钱柳多糖降血糖活性成分研究[J]. 食品与发酵工业, 2023, 49(13):165-171.
YAO X W, ZHAO J J, XU D P. Hypoglycemic bioactivity of polysaccharide from Cyclocarya paliurus[J]. Food and Fermentation Industries, 2023, 49(13):165-171.
[11] 寇静, 史琳娜, 马添翼. 冠突散囊菌发酵甘薯茶对高脂血症大鼠脂质代谢和肠道菌群紊乱的调节[J]. 食品与发酵工业, 2023, 49(16):231-239.
KOU J, SHI L N, MA T Y. Effect of sweet potato tea fermented by Eurotium cristatum on lipid metabolism and gut microbiota in hyperlipidemic rats[J]. Food and Fermentation Industries, 2023, 49(16):231-239.
[12] 曹维, 金杜欣, 刘瑞, 等. 食源性黄酮通过肠道菌群调节Ⅱ型糖尿病的作用机制研究进展[J]. 食品与发酵工业, 2024, 50(2):372-378.
CAO W, JIN D X, LIU R, et al. Research progress on the mechanism of food-derived flavonoids regulating type Ⅱ diabetes mellitus via gut microbiota[J]. Food and Fermentation Industries, 2024, 50(2):372-378.
[13] 巢瑾, 罗茜, 李佳莲, 等. 冠突散囊菌发酵青钱柳前后特征风味与挥发性物质的变化[J]. 食品与发酵工业, 2023, 49(9):57-64; 81.
CHAO J, LUO Q, LI J L, et al. Variation of characteristic flavor and volatile substances in Cyclocarya paliurus fermented with Eurotium cristatum[J]. Food and Fermentation Industries, 2023, 49(9):57-64; 81.
[14] 李焱, 林泳峰, 刘文美, 等. 茶多糖研究的现状与发展趋势[J]. 茶叶科学, 2023, 43(4):447-459.
LI Y, LIN Y F, LIU W M, et al. Present status and development trends of research on tea polysaccharides[J]. Journal of Tea Science, 2023, 43(4):447-459.
[15] 金海燕, 沈璐, 苏同生, 等. 茶叶及其活性成分降糖作用的研究进展[J]. 陕西农业科学, 2020, 66(8):81-84.
JIN H Y, SHEN LU,SU T S, et al. Research advance of tea and its active constituents for hypoglycemic action[J]. Shaanxi Journal of Agricultural Sciences, 2020, 66(8):81-84.
[16] 张博荀. 基于“肠道菌群—黏膜屏障” 研究“黄芩—黄连” 药对治疗T2DM的疗效机制及配伍效应[D]. 成都: 成都中医药大学, 2020.
ZHANG B X. Study on the therapeutic mechanism and compatibility effect of scutellaria-coptis herbal couple on T2DM based on the gut microbiota and the intestinal mucosal Barrier[D]. Chengdu: Chengdu University of TCM, 2020.
[17] MA Q T, LI Y Q, LI P F, et al. Research progress in the relationship between type 2 diabetes mellitus and intestinal flora[J]. Biomedicine &Pharmacotherapy, 2019, 117:109138.
[18] ZHANG X, ZHAO Y F, ZHANG M H, et al. Structural changes of gut microbiota during berberine-mediated prevention of obesity and insulin resistance in high-fat diet-fed rats[J]. PLoS One, 2012, 7(8): e42529.
[19] 杨超茅, 张顺宵, 李园园, 等. 六味地黄汤加减联合氯沙坦钾对糖尿病肾病大鼠ACE1/Ang Ⅱ/AT1R轴及肠道菌群的影响[J]. 中国实验方剂学杂志, 2024, 30(6):1-9.
YANG C M, ZHANG S X, LI Y Y, et al. Modified Liuwei dihuangtang combined with losartan potassium regulates ACE1/ang Ⅱ/AT1R axis and intestinal flora in rat model of diabetic kidney disease[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2024, 30(6):1-9.
[20] 王鹏飞. 志贺菌、大肠杆菌和沙门菌CRISPR结构特征生物信息学分析[D]. 郑州: 郑州大学, 2015.
WANG P F. Bioinformatics analysis of crispr structures and Featurein shigella, Escherichia coli and Salmonella[D]. Zhengzhou: Zhengzhou University, 2015.
[21] JIAO N, BAKER S S, NUGENT C A, et al. Gut microbiome may contribute to insulin resistance and systemic inflammation in obese rodents: A meta-analysis[J]. Physiological Genomics, 2018, 50(4):244-254.
[22] HOU D Z, ZHAO Q Y, YOUSAF L, et al. Whole mung bean (Vigna radiata L.) supplementation prevents high-fat diet-induced obesity and disorders in a lipid profile and modulates gut microbiota in mice[J]. European Journal of Nutrition, 2020, 59(8):3617-3634.
[23] WU H G, CHEN Q, LIU J N, et al. Microbiome analysis reveals gut microbiota alteration in mice with the effect of matrine[J]. Microbial Pathogenesis, 2021, 156:104926.
[24] 崔丽军. 粪菌移植联合防风通圣丸对肥胖大鼠肠道菌群-SCFAs-GPR43-胃肠肽通路的影响[D]. 北京: 北京中医药大学, 2021.
CUI L J. Effect of fecal bacteria transplantation combined with Fangfeng Tongsheng Pill on intestinal flora-SCFAs-GPR43-gastrointestinal peptide pathway in obese rats[D]. Beijing: Beijing University of Chinese Medicine, 2021.
[25] 牟菲, 赵娟娟, 纪泽敏, 等. 基于16S rDNA高通量测序技术挖掘影响高脂血症的核心菌群[J]. 中国药物与临床, 2020, 20(5):701-704.
MU F, ZHAO J J, JI Z M, et al. 16S rDNA-based high-throughput sequencing techniques for mining of core flora affecting hyperlipidemia[J]. Chinese Remedies &Clinics, 2020, 20(5):701-704.