胎盘在我国入药已有几千年的历史,在中药中被称为紫河车,《本草纲目》中记载其味甘、咸、温,入肺、肝、肾经,具有益气养血、补肾益精之功效[1]。胎盘中的蛋白质含量和氨基酸种类丰富,且含有甲硫氨酸、异亮氨酸、赖氨酸等人体所必需氨基酸,此外还有铁、钙、碘以及维生素B12等人体所必需的微量元素,经学者对胎盘十年的深入研究发现其含有多种细胞因子[2]。
生物活性肽是由多个氨基酸分子组成的生物活性肽,具有修复组织损伤、抗衰老、增强免疫力、抗癌、护肝等功效等功能[3]。胎盘中的有效成分主要是具有生物活性的肽类物质,LIU等[4]从羊胎盘中提取的活性肽显著降低了肝损伤小鼠的血清氨基转移酶活力,减轻了病理作用,恢复了肝脏抗氧化能力。宁鹏等[5]发现牦牛胎盘肽可显著提高小鼠心肌、肝脏和肾脏中的超氧化物歧化酶和谷胱甘肽过氧化物酶的活力。任海伟等[6]从藏系绵羊胎盘中提取出具有良好的抗氧化活性的寡肽。但国内外对于骆驼胎盘抗氧化活性肽的研究相对较少。
抗氧化肽可能会在生产加工、运输和贮藏的过程中受到温度、酸碱以及金属离子等环境因素的影响,从而使亲核的羧基和巯基发生化学反应,导致其抗氧化活性降低,影响其生物活性利用品质[7],因此需进一步探究其稳定性。本试验通过酶解法从骆驼胎盘中获取抗氧化肽,并研究其最佳提取工艺,再通过温度、酸碱度、金属离子和模拟胃肠消化进一步探究抗氧化肽的稳定性,为骆驼胎盘抗氧化肽在食品和药品的应用提供一定的参考。
1 材料与方法
1.1 材料与试剂
骆驼胎盘,内蒙古骆驼研究院。
木瓜蛋白酶(Cat#G8430)、中性蛋白酶(Cat#Z8031)、风味蛋白酶(Cat#F8270)、碱性蛋白酶(Cat#B8360)、菠萝蛋白酶(Cat#B8290)、复合蛋白酶(Cat.No.C8800),北京索莱宝科技有限公司;猪胃蛋白酶(P7012-250MG)、猪胰蛋白酶(T0303-1G)、脂肪酶(L3126-25G),Sigma公司;猪胆盐(Cat#CB2692-26G),北京酷莱博科技有限公司。
1.2 仪器与设备
JC-HH-S26恒温水浴锅,济南精诚实验仪器有限公司;PL303 SCIENTZ-10 N冷冻干燥机,宁波新芝生物科技股份有限公司;JY88-IIN超声细胞破碎仪,伯乐生命医学产品有限公司;FM200A均浆机,上海弗鲁克流体机械剌造有限公司。
1.3 骆驼胎盘的预处理
将胎盘洗净,除去筋膜、血管、骆驼毛和灰尘等,将洗净后的骆驼胎盘切成细小的碎块,反复冻融3次后于-80 ℃冷冻备用。
骆驼胎盘匀浆的制备:准确称取1.00 g胎盘,与磷酸缓冲液溶液按1∶10体积比混合后于3 000 r/min,组织匀浆10 min,再将匀浆好的胎盘在4 ℃冰浴条件下进行超声处理,超声条件为:10 min,振幅30%,20 Hz,工作5 s间歇5 s。
1.4 骆驼胎盘肽的制备优化
1.4.1 蛋白酶的选择
从木瓜蛋白酶、碱性蛋白酶、中性蛋白酶、风味蛋白酶、复合蛋白酶和菠萝蛋白酶中筛选最适宜的骆驼胎盘水解蛋白酶。取适量超声后的胎盘匀浆分别用6种蛋白酶水解,统一设置酶解条件为:酶添加4 000 U/g,酶解时间2 h,酶解结束后立即沸水浴10 min灭酶,冷却至室温后于4 000 r/min条件下离心20 min,取上清液用于测定骆驼胎盘酶解物的水解度、肽得率及抗氧化能力等并结合酶解液的浑浊度、色泽和气味等感官品质,参考6种酶的适宜pH、温度,综合分析选择水解骆驼胎盘适宜的蛋白酶。
1.4.2 单因素试验
在前期实验基础上,进行单因素试验,统一设定酶添加量:4 000 U/g,酶解时间3 h,酶解温度55 ℃,酶解pH 6.5,分别考察酶添加量(2 000、3 000、4 000、5 000、6 000、7 000 U/g),酶解温度(45、50、60、65、70 ℃),酶解pH(5、5.5、6、6.5、7、7.5),酶解时间(1、2、3、4、5、6 h)对水解度、肽得率以及抗氧化的影响。
1.4.3 响应面优化试验
在单因素试验结果的基础上,依据Box-Behnken中心组合试验设计原理,以水解度为响应值,选取酶添加量、酶解时间、酶解液pH和酶解温度4个因素,进行4因素3水平的组合试验,使用Design-Expert 8.0.6软件进行响应曲面分析。因素水平及编码见表1。
表1 Box-Behnken 设计试验因素水平表
Table 1 Box-Behnken test factors and levels
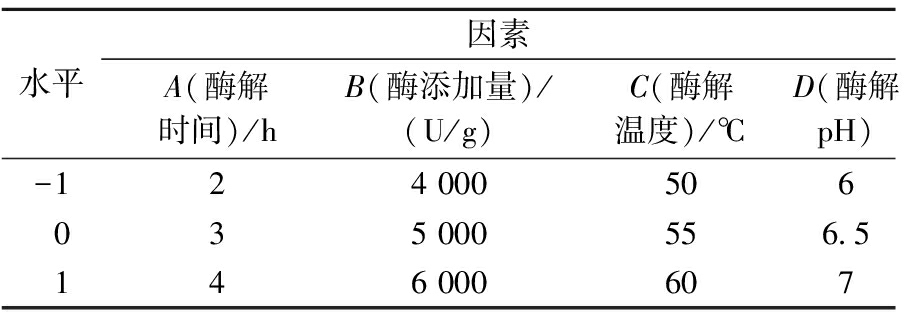
水平因素A(酶解时间)/hB(酶添加量)/(U/g)C(酶解温度)/℃D(酶解pH)-124 000506035 000556.5146 000607
1.5 指标的测定
1.5.1 水解度的测定
水解度(degree of hydrolysis, DH)的测定采用甲醛滴定法,总氮的测定利用凯氏定氮法。DH的计算如公式(1)所示:
(1)
式中:N1为酶解液中氨态氮含量,g;N为胎盘中总氮含量,g。
1.5.2 肽得率的测定
肽得率参考JANG等[8]方法稍作修改,将体积分数5%的三氯乙酸与蛋白酶水解液按料液比1∶1(g∶mL)混合,离心(6 000 r/min,10 min),利用考马斯亮蓝测定上清液中可溶性蛋白,短肽得率的计算如公式(2)所示:
(2)
式中:TCA-NSI为三氯乙酸可溶性氮得率,%;N1为在5%TCA中可溶性蛋白含量,mg;N2为酶解液中可溶性蛋白质含量,mg。
1.6 抗氧化能力的测定
1.6.1 DPPH自由基清除率的测定
参考吴慧琳等[9]的方法,稍作修改,配制质量浓度为2 mg/mL胎盘肽液,以相应浓度的L-谷胱甘肽及丁基羟基甲苯为对照。A0:1 mL DPPH自由基0.2 mol(以95%乙醇溶解)与1 mL蒸馏水混合均匀吸光度;A1:1 mL,0.2 mmol DPPH自由基和1 mL胎盘肽液的混合液吸光度;A2:1 mL无水乙醇和1 mL胎盘肽液的混合液吸光度。充分混匀,室温避光反应30 min,在517 nm处测定A0、A1、A2吸光值。DPPH自由基清除率的计算如公式(3)所示:
DPPH自由基清除率![]()
(3)
1.6.2 ABTS阳离子自由基清除率的测定
参照贾晓燕等[10]的方法并稍作修改。在96孔板中加入100 μL ABTS阳离子自由基工作液和100 μL待测样品,于室温黑暗处放置10 min,后测定734 nm处的吸光度(A1);空白组数据为100 μL ABTS阳离子自由基工作液与100 μL三级水反应后测定(A0);对照组数据为100 μL磷酸缓冲液混合100 μL样待测样品后测定(A2)。ABTS阳离子自由基清除率的计算如公式(4)所示:
ABTS阳离子自由基清除率![]()
(4)
1.7 骆驼胎盘抗氧化肽的稳定性研究
1.7.1 温度对骆驼胎盘抗氧化肽稳定性的影响
参照吴慧琳等[9]对发酵肉抗氧化肽热稳定性验证方法,配制质量浓度为5 mg/mL的骆驼胎盘抗氧化肽溶液,分别放置在4、25、37、65、100 ℃的恒温水浴锅中反应2 h后冷却至室温,分别测定骆驼胎盘抗氧化肽的DPPH自由基和ABTS阳离子自由基清除率。
1.7.2 pH对骆驼胎盘抗氧化肽稳定性的影响
配制质量浓度为5 mg/mL的骆驼胎盘抗氧化肽溶液,用0.5 mol/mL的HCl和NaOH调节溶液的pH值分别至3、5、7、9、11,在25 ℃的恒温水浴锅中反应2 h后冷却至室温,分别测定骆驼胎盘抗氧化肽的DPPH自由基和ABTS阳离子自由基的清除率。
1.7.3 金属离子对骆驼胎盘抗氧化肽稳定性的影响
配制质量浓度为5 mg/mL的胎盘肽溶液,分别添加50、100、150、200、250 μg/mL的CuCl2、MgCl2、KCl,室温振荡,反应2 h后分别测定骆驼胎盘抗氧化肽的DPPH自由基和ABTS阳离子自由基的清除率。
1.7.4 胃-肠道蛋白酶对骆驼胎盘抗氧化肽稳定性的影响
配制质量浓度为5 mg/mL的骆驼胎盘抗氧化肽溶液,用0.5 mol/L HCl调节溶液pH值为2.0,添加胃蛋白酶于37 ℃恒温水浴2 h,沸水浴灭酶,再用0.5 mol/L NaOH调节溶液pH为7.0,添加胰蛋白酶于37 ℃恒温水浴2 h,分别测定未消化、胃蛋白酶消化和胰蛋白酶消化后的DPPH自由基和ABTS阳离子自由基的清除率。
1.8 数据处理
实验均采用3次平行处理,采用SPSS 22.0统计软件进行数据处理,使用2018 64 Bit软件进行绘图。
2 结果与分析
2.1 蛋白酶的筛选
不同的蛋白酶和底物结合的位点有差异,会对酶解产物的结构、水解度、活性等造成不同的影响[11],由图1-a可知,木瓜蛋白酶的水解度最大,为29.67%,显著高于其他蛋白酶(P<0.05),木瓜蛋白酶是一种广泛特异性蛋白酶,主要酶切位点是精氨酸、组氨酸、苯丙氨酸等[12];碱性蛋白酶和复合蛋白酶的水解度分别为24.3%和22.13%。水解度越大,肽得率也越大,木瓜蛋白酶的肽得率最大,为11.70%,其次是碱性蛋白酶为9.81%。
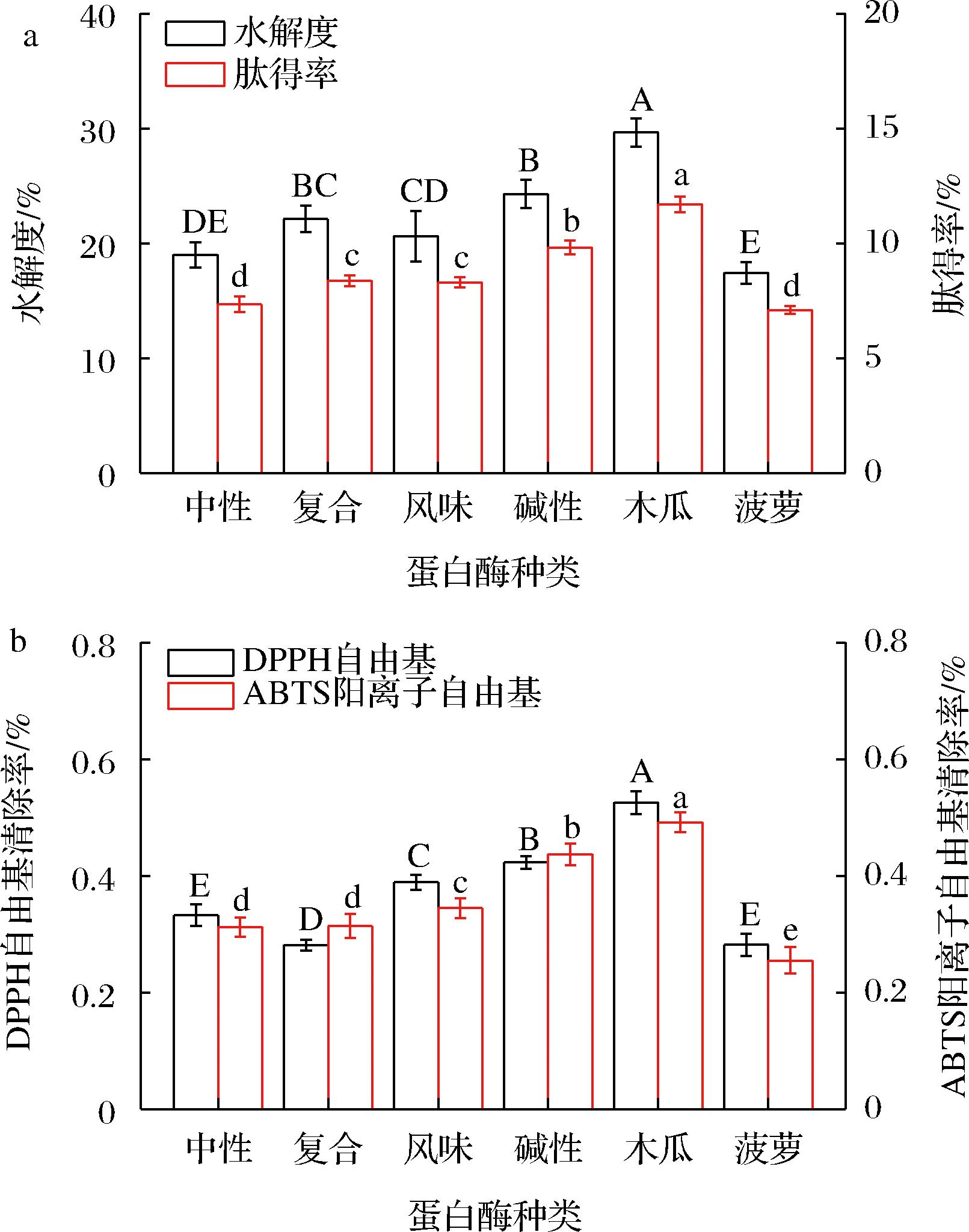
a-水解度和肽得率;b-抗氧化能力
图1 不同酶对骆驼胎盘酶解物水解度、肽得率和抗氧化能力的影响
Fig.1 Effects of different enzymes on hydrolysis degree, peptide yield, and antioxidant capacity of enzymatic hydrolysates from camel placenta
注:图中不同字母代表各组间具有显著差异(P<0.05)(下同)。
由图2-b可知,木瓜蛋白酶处理后的DPPH自由基和ABTS阳离子自由基清除率最大,分别为52%和49%,均显著高于其他蛋白酶(P<0.05),这是因为木瓜蛋白酶作用下的水解度和肽得率最大,抗氧化能力强的氨基酸残基和肽链暴露出来,抗氧化能力随之提高[13]。其次是碱性蛋白酶的DPPH自由基和ABTS阳离子自由基清除率,分别为41%和43%,综合考虑选择木瓜蛋白酶作为后续试验的蛋白酶。
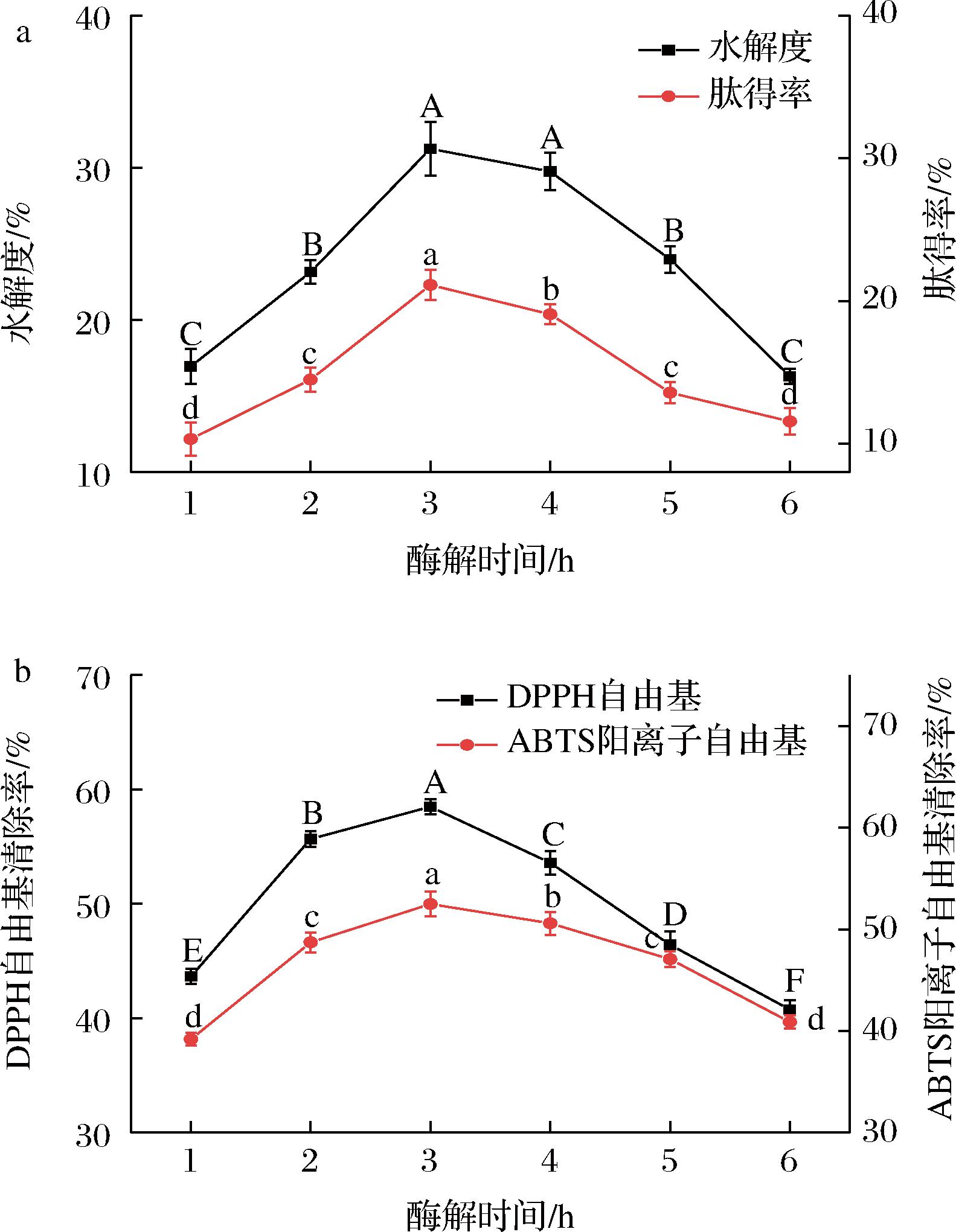
a-水解度和肽得率;b-抗氧化能力
图2 酶解时间对骆驼胎盘抗氧化肽水解度、肽得率和抗氧化能力的影响
Fig.2 Effects of enzymatic hydrolysis time on the hydrolysis degree, peptide yield, and antioxidant capacity of antioxidant peptides from camel placenta
2.2 单因素试验
2.2.1 酶解时间
由图2可知,酶解时间为3 h的水解度和肽得率达到最大,分别为31.25%和21.11%,DPPH自由基和ABTS阳离子自由基清除率达到58.46%、52.48%。酶解时长为4 h,水解度和肽得率开始下降,这可能是因为酶解初始阶段的前3 h内,底物充足,木瓜蛋白酶将骆驼胎盘充分酶解,迅速地将胎盘水解成小肽段,水解度等持续上升,但随酶解时间的延长,底物几乎被蛋白酶水解耗尽,蛋白酶无法与其结合,水解度等降低,但小分子肽段被继续酶解为氨基酸,抗氧化能力减弱[14]。因此,降酶解时间控制在2.5~3.5 h获得的骆驼胎盘抗氧化肽的效果最好。
2.2.2 酶解温度
酶解温度对骆驼胎盘抗氧化肽水解度、肽得率和抗氧化能力的影响如图3所示,酶解温度为55~60 ℃时,水解度最大,为29.74%,此时肽得率为21.59%。温度为55 ℃时,DPPH自由基、ABTS阳离子自由基清除率达到最大值,分别为58.48%和52.47%。温度达到70 ℃时水解度和肽得率最小,分别是20.92%和12.87%,此时DPPH自由基和ABTS阳离子自由基清除率分别减小为40.76%和40.88%。当温度在一定范围内升高,蛋白酶的活力增加,反应速率加快,但温度过高后,酶的活力受到抑制作用,反应速率减缓,因为高温会破坏蛋白酶的结构,使其失活[15]。
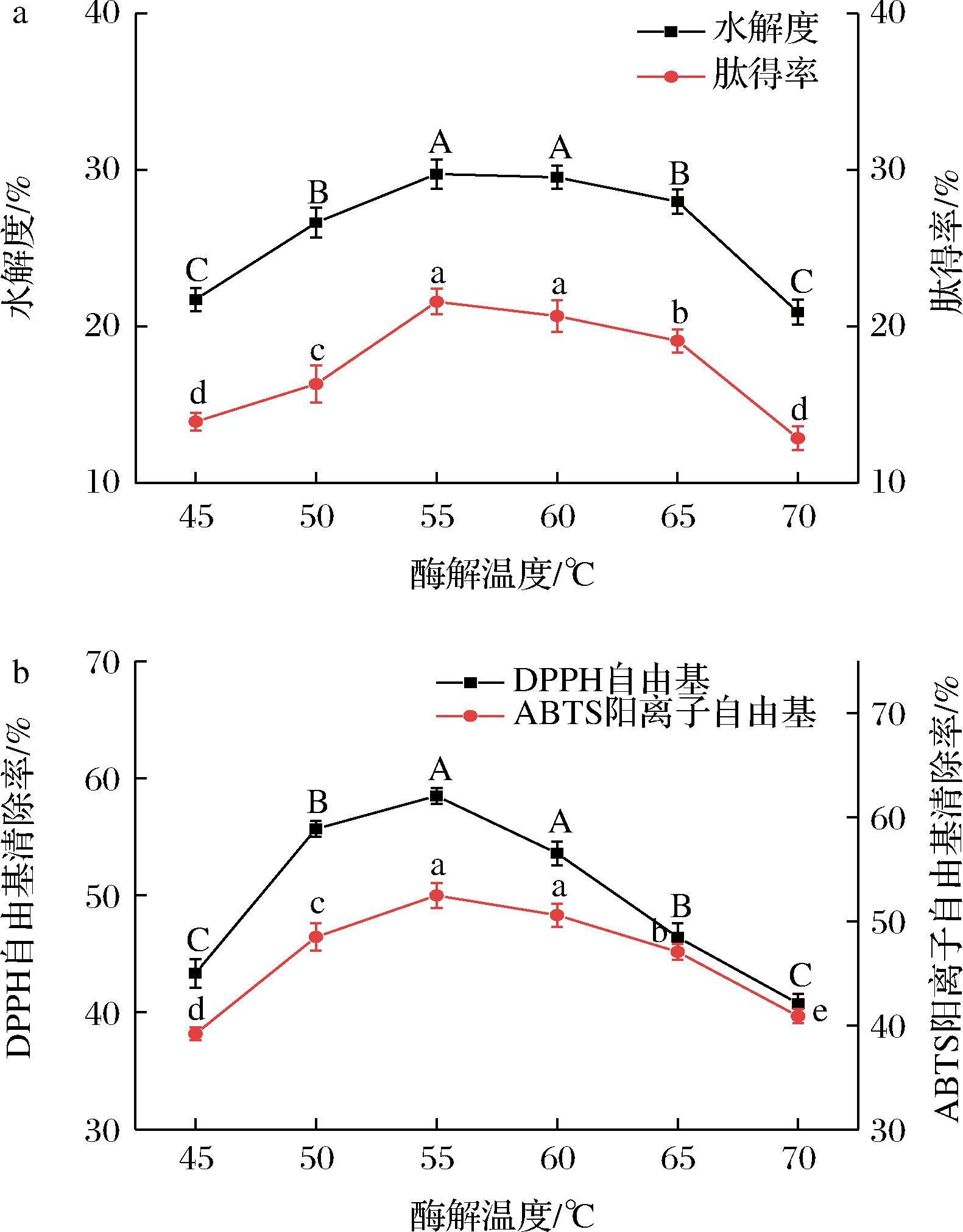
a-水解度和肽得率;b-抗氧化能力
图3 酶解温度对骆驼胎盘抗氧化肽水解度、肽得率和抗氧化能力的影响
Fig.3 Effects of enzymolysis temperature on hydrolysis degree, peptide yield, and antioxidant capacity of antioxidant peptides from camel placenta
2.2.3 酶添加量
如图4所示,水解度、肽得率和抗氧化能力随酶添加量增加呈先增大后减小的趋势,酶添加量为5 000 U/g时,水解度和肽得率达到最大,分别为36.91%和32.24%,显著高于其他组(P<0.05)。加酶量为7 000 U/g时的水解度、肽得率及DPPH自由基和ABTS阳离子自由基清除率下降至最小值。在一定程度上增加酶量,会加快反应速率,但酶量过多时,蛋白酶间会出现竞争性抑制,减慢反应速率[16-17]。因此最适酶添加量为4 000~5 000 U/g。
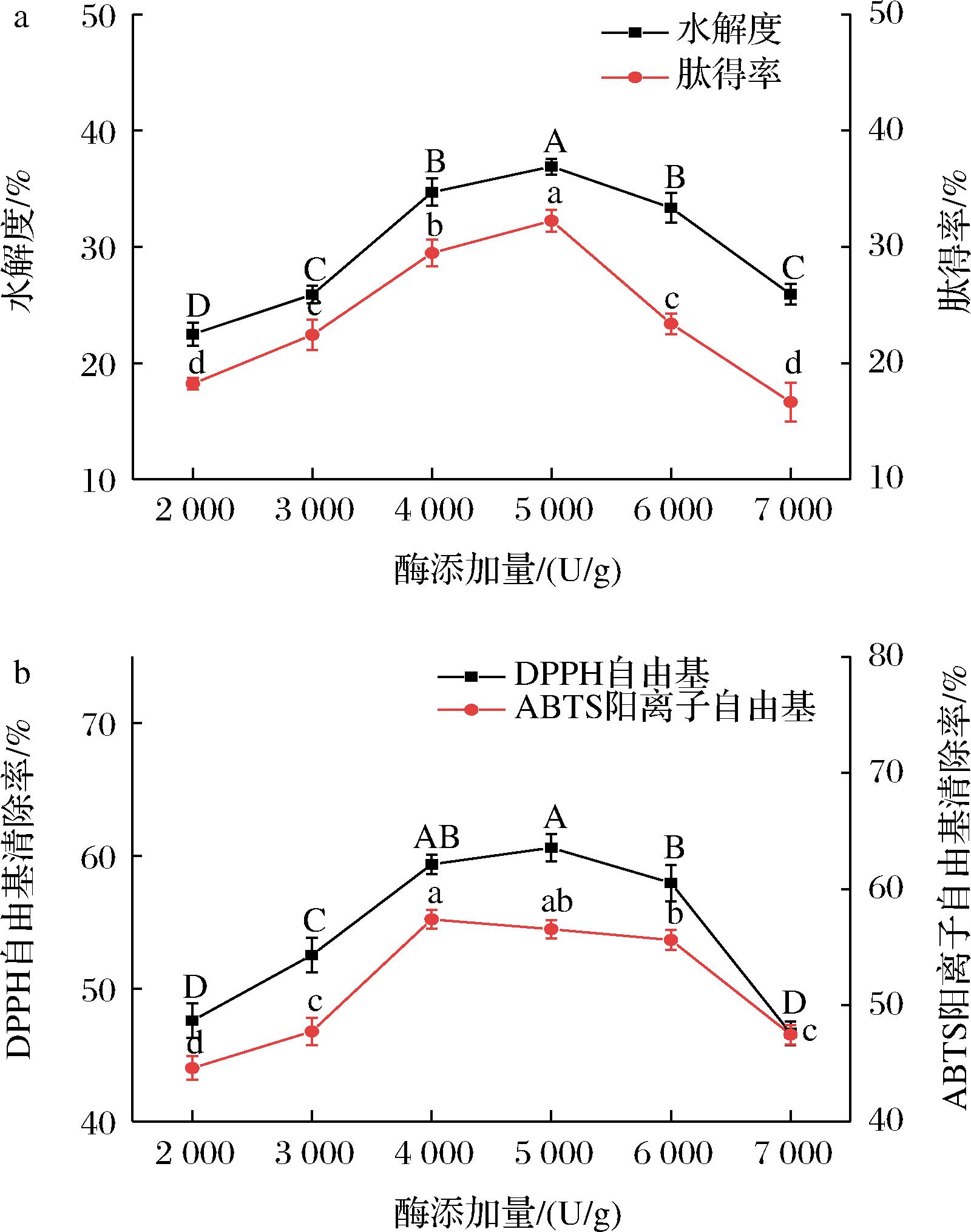
a-水解度和肽得率;b-抗氧化能力
图4 酶添加量对骆驼胎盘抗氧化肽水解度、肽得率和抗氧化能力的影响
Fig.4 Effects of enzyme addition on hydrolysis, peptide yield, and antioxidant capacity of antioxidant peptides from camel placenta
2.2.4 酶解pH
不同pH对骆驼胎盘抗氧化肽水解度、肽得率和抗氧化能力的影响如图5所示,各项指标在pH值为5.0~7.5,呈现先增大后降低的趋势,pH值为6.5时,水解度和肽得率显著高于其他组,分别是29.50%和24.38%,此时的抗氧化能力最强,DPPH自由基和ABTS阳离子自由基清除率分别为48.39%和41.42%;pH值大于6.5后,水解度、肽得率和抗氧化能力开始减小,这可能是木瓜蛋白酶在弱酸性条件下的酶活力较强,催化能力强,加促反应速率,弱碱性对酶的活性中心的构象影响较大,催化状态下降,减慢了反应速率[18]。因此,选择pH值6.5作为制备骆驼胎盘抗氧化肽的最佳酶解pH。
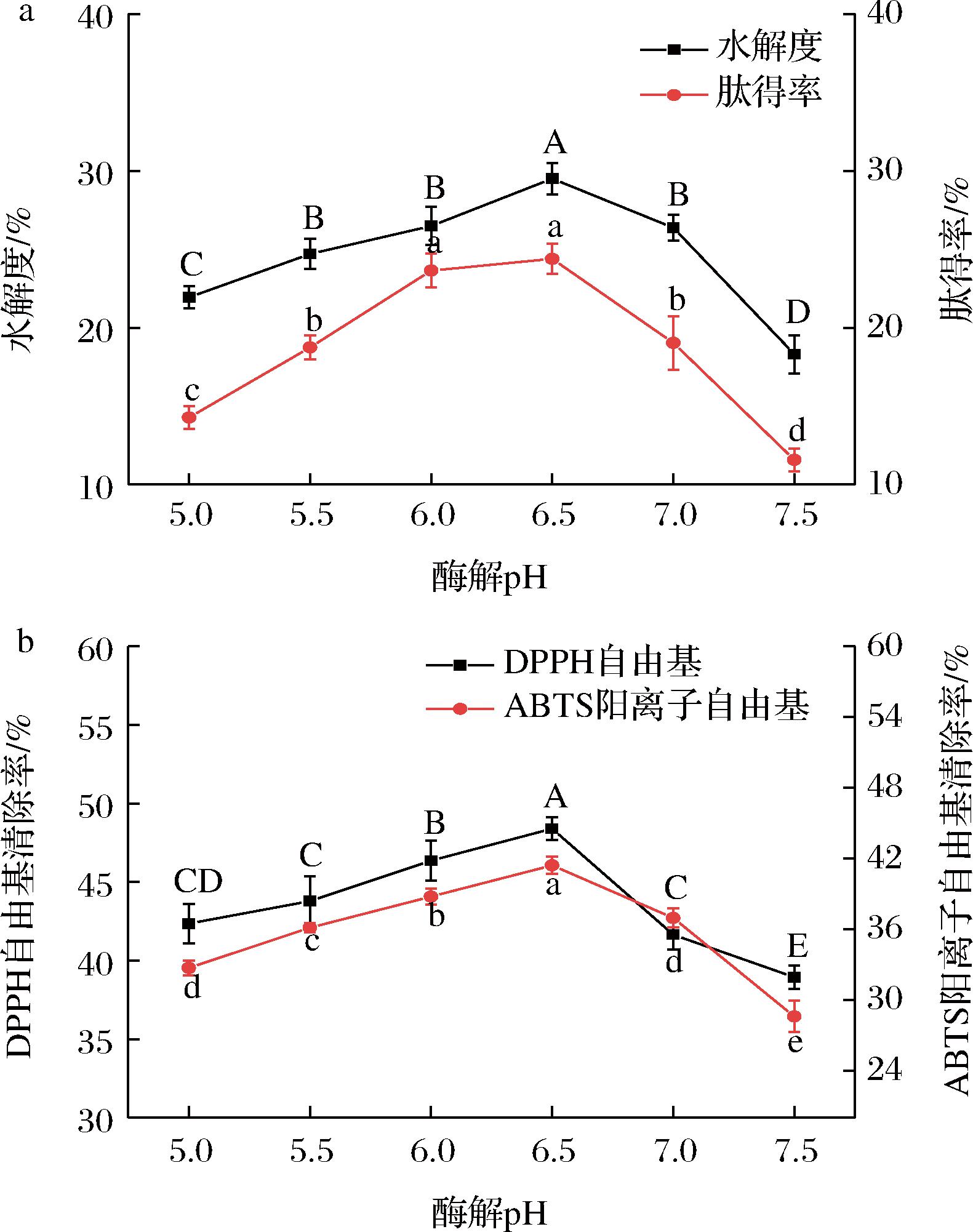
a-水解度和肽得率;b-抗氧化能力
图5 不同pH对骆驼胎盘抗氧化肽水解度、肽得率和抗氧化能力的影响
Fig.5 Effects of enzyme addition on hydrolysis, peptide yield, and antioxidant capacity of antioxidant peptides from camel placenta
2.3 响应面优化试验
在单因素试验的基础上,根据Box-Behnken原理,以水解度为响应值,设计4因素3水平响应曲面分析试验,使用Design Expert 8.0.6.1软件进行数据分析。表2为骆驼胎盘抗氧化肽提取工艺响应曲面实试验设计及结果。
表2 骆驼胎盘抗氧化肽水解度工艺响应曲面实试验设计及结果
Table 2 Experimental design and results of response surface methodology for hydrolysis degree of antioxidant peptide from camel placenta
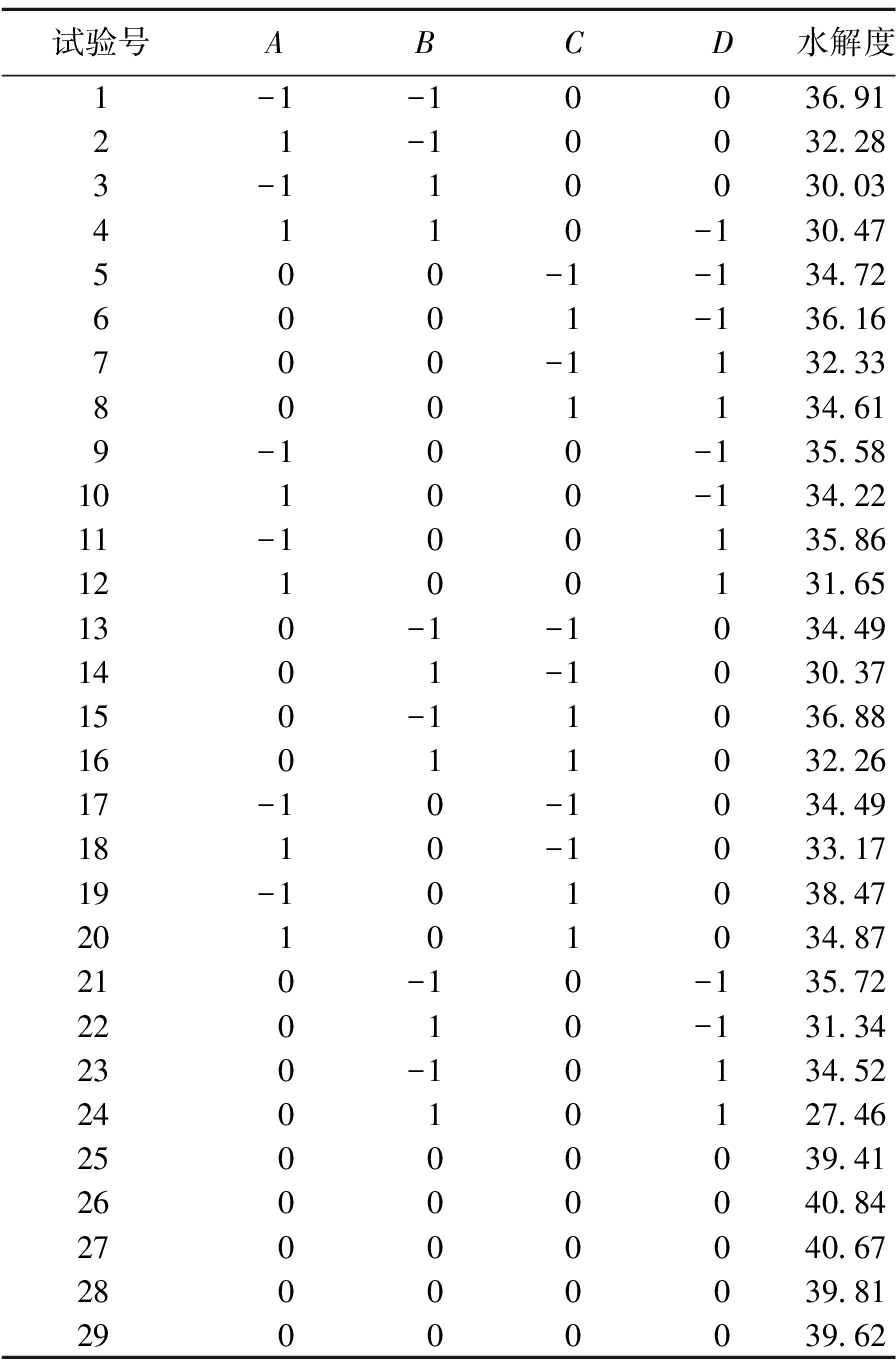
试验号ABC D水解度1-1-10036.9121-10032.283-110030.034110-130.47500-1-134.726001-136.16700-1132.338001134.619-100-135.5810100-134.2211-100135.8612100131.65130-1-1034.491401-1030.37150-11036.8816011032.2617-10-1034.491810-1033.1719-101038.4720101034.87210-10-135.7222010-131.34230-10134.5224010127.4625000039.4126000040.8427000040.6728000039.8129000039.62
2.4 回归模型的方差分析
通过对响应曲面试验结果进行拟合回归分析,得到骆驼胎盘水解度与各因素变量的二次多项回归方程为:Y=40.07-1.31A-2.49B+1.14C-0.94D+1.52AB-0.57AC-0.71AD-0.13BC-0.67BD+0.21CD-2.65A2-4.56B2+-2.18C2-3.26D2。
对二次多项回归模型进行方差分析的结果见表3。模型F=70.52,P<0.000 1,意味该回归模型显著性极高,具有统计学意义。失拟项F=0.72,P=0.695 5>0.05,即失拟项差异不显著,表明可用该回归方程代替试验真实点对实验结果进行分析。决定系数R2=0.986 0,校正决定系数![]() 说明回归模型与实际试验拟合程度较高,可以模拟97.20%的响应值变化,进一步说明模型拟合程度较好,能够用于骆驼胎盘抗氧化肽最佳工艺条件的理论预测。
说明回归模型与实际试验拟合程度较高,可以模拟97.20%的响应值变化,进一步说明模型拟合程度较好,能够用于骆驼胎盘抗氧化肽最佳工艺条件的理论预测。
表3 回归方程方差分析
Table 3 Analysis of variance for the fitted regression model
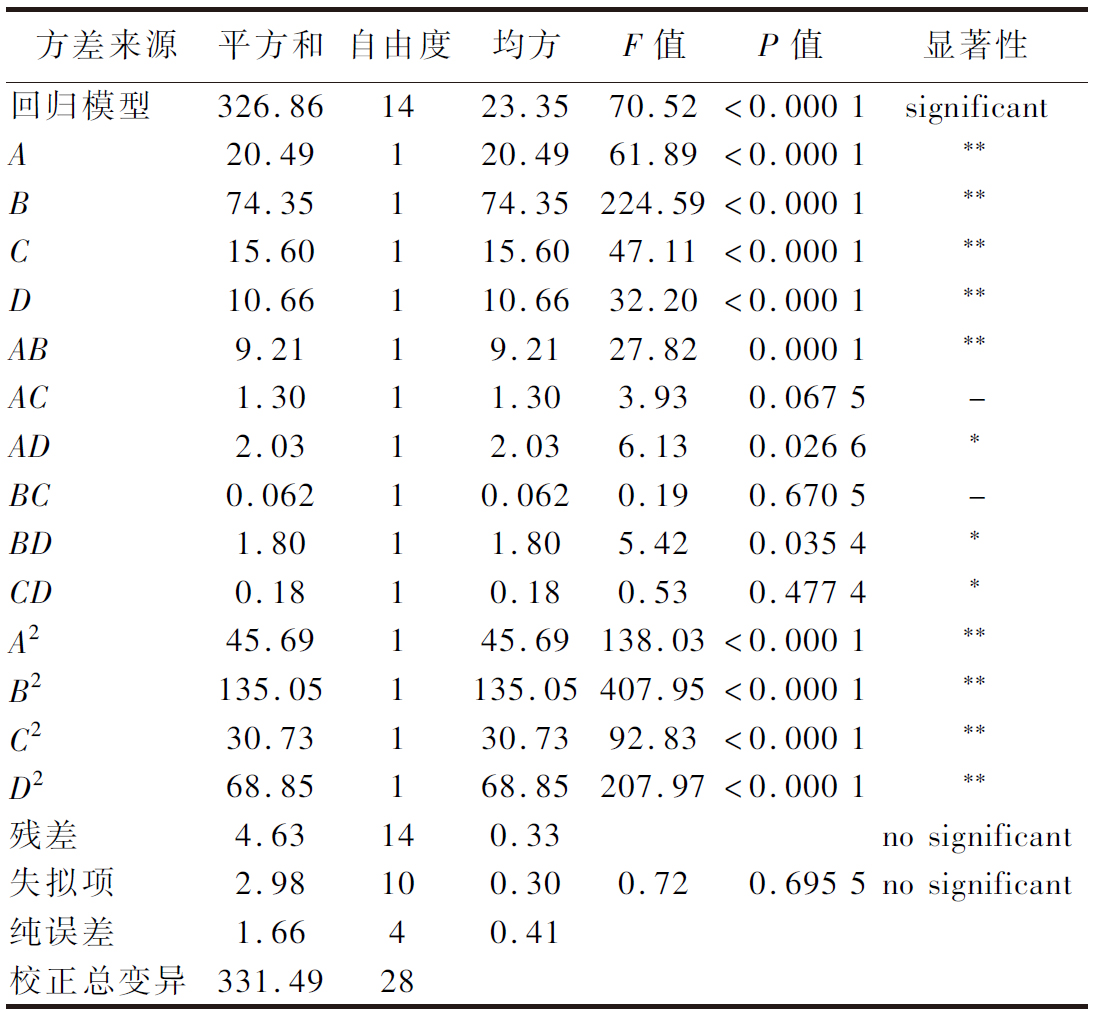
方差来源平方和自由度均方F值P值显著性回归模型326.861423.3570.52<0.000 1significantA 20.49120.4961.89<0.000 1∗∗B 74.35174.35224.59<0.000 1∗∗C 15.60115.6047.11<0.000 1∗∗D10.66110.6632.20<0.000 1∗∗AB9.2119.2127.820.000 1∗∗AC1.3011.303.930.067 5-AD2.0312.036.130.026 6∗BC0.06210.0620.190.670 5-BD1.8011.805.420.035 4∗CD0.1810.180.530.477 4∗A245.69145.69138.03<0.000 1∗∗B2135.051135.05407.95<0.000 1∗∗C230.73130.7392.83<0.000 1∗∗D268.85168.85207.97<0.000 1∗∗残差4.63140.33no significant失拟项2.98100.300.720.695 5no significant纯误差1.6640.41校正总变异331.4928
注:*表示有显著差异(P<0.05);**表示有极显著差异(P<0.01);-表示不存在显著性差异。
由表3可知,模型中A、B、C、D、AB、A2、B2、C2、D2对响应值影响极显著(P<0.01),AD、BD、CD对响应值影响显著(P<0.05)。F检验可以反映回归模型的有效性,F值越高,说明此因素对水解度的影响越显著[19-20],因此,4个因素对水解度的影响顺序为:酶添加量(B)>酶解时间(A)>酶解温度(C)>pH值(D)。
2.5 过程变量的交互作用
响应面图的坡度曲线陡峭,反映了酶解时间(A)、酶添加量(B)、酶解温度(C)、pH值(D)各因素间的交互作用对水解度的影响。通过观察图6中各响应面的陡峭程度及等高线图的疏密程度,可以看出4个因素中酶解时间与酶添加量、酶解时间与pH值、酶添加量与pH值、酶解温度与pH值的交互作用极显著,对水解度影响较大,这与方差分析的结果一致。
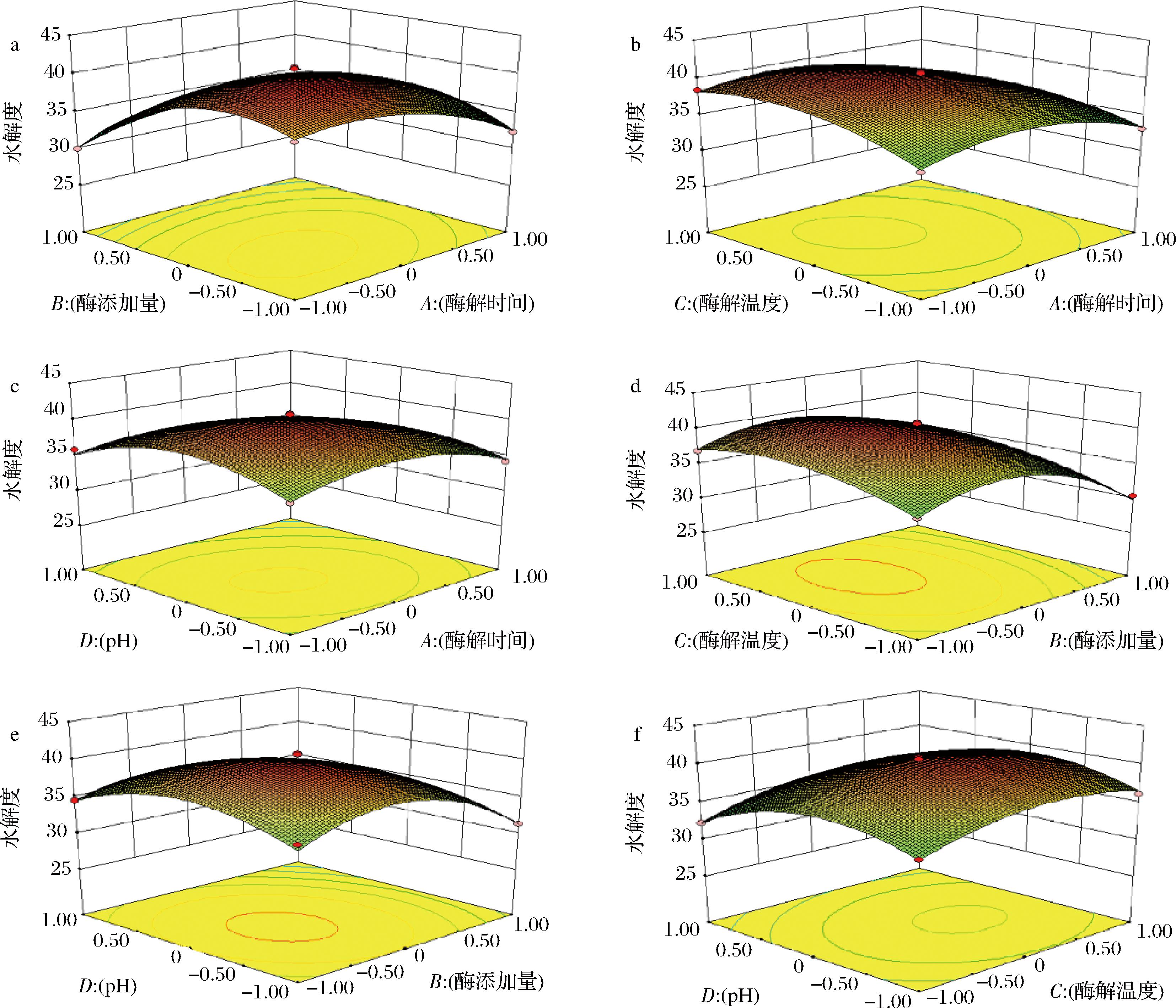
a-酶添加量和酶解时间;b-酶解温度和酶解时间;c-酶解pH和酶解时间;d-酶解温度和酶添加量;e-酶解pH和压力时间;f-酶解pH和酶解温度对骆驼胎盘水解度的影响
图6 过程变量的响应曲面图
Fig.6 Response surface graph of process variables
2.6 骆驼胎盘抗氧化肽最优条件的确定与验证
通过计算分析模型得到理论上的骆驼胎盘抗氧化肽的最水解条件为:酶解时间2.73 h、酶解温度57.25 ℃,酶添加量4 770 U/g,酶解pH 6.24,预测水解度可以达到41.93%。考虑实际操作情况,将优化条件整合为:酶解时间3 h、酶解温度57.5 ℃,酶添加量4 770 U/g,酶解pH 6.3。在此条件下进行3次平行试验进行验证,得到骆驼胎盘水解度为(40.21±2.51)%,与理论预测值较为接近。
2.7 骆驼胎盘抗氧化肽的稳定性研究
2.7.1 不同温度对骆驼胎盘抗氧化肽的影响
不同温度对骆驼胎盘抗氧化肽的影响如图7所示,温度从4 ℃升高至100 ℃,骆驼胎盘抗氧化肽对DPPH自由基、ABTS阳离子自由基的清除能力分别下降8.06%、8.26%,因为高温会破坏多肽链中的化学键,导致多肽结构改变,从而使活性降低[21]。高温会在一定程度上降低骆驼胎盘抗氧化肽的自由基清除能力,但其抗氧化活性依旧较好,这可能是因为经过水解后产物大部分为分子质量很小的肽段,其结构稳定[22]。本研究证明骆驼胎盘抗氧化肽在一定温度范围内具有良好的稳定性。
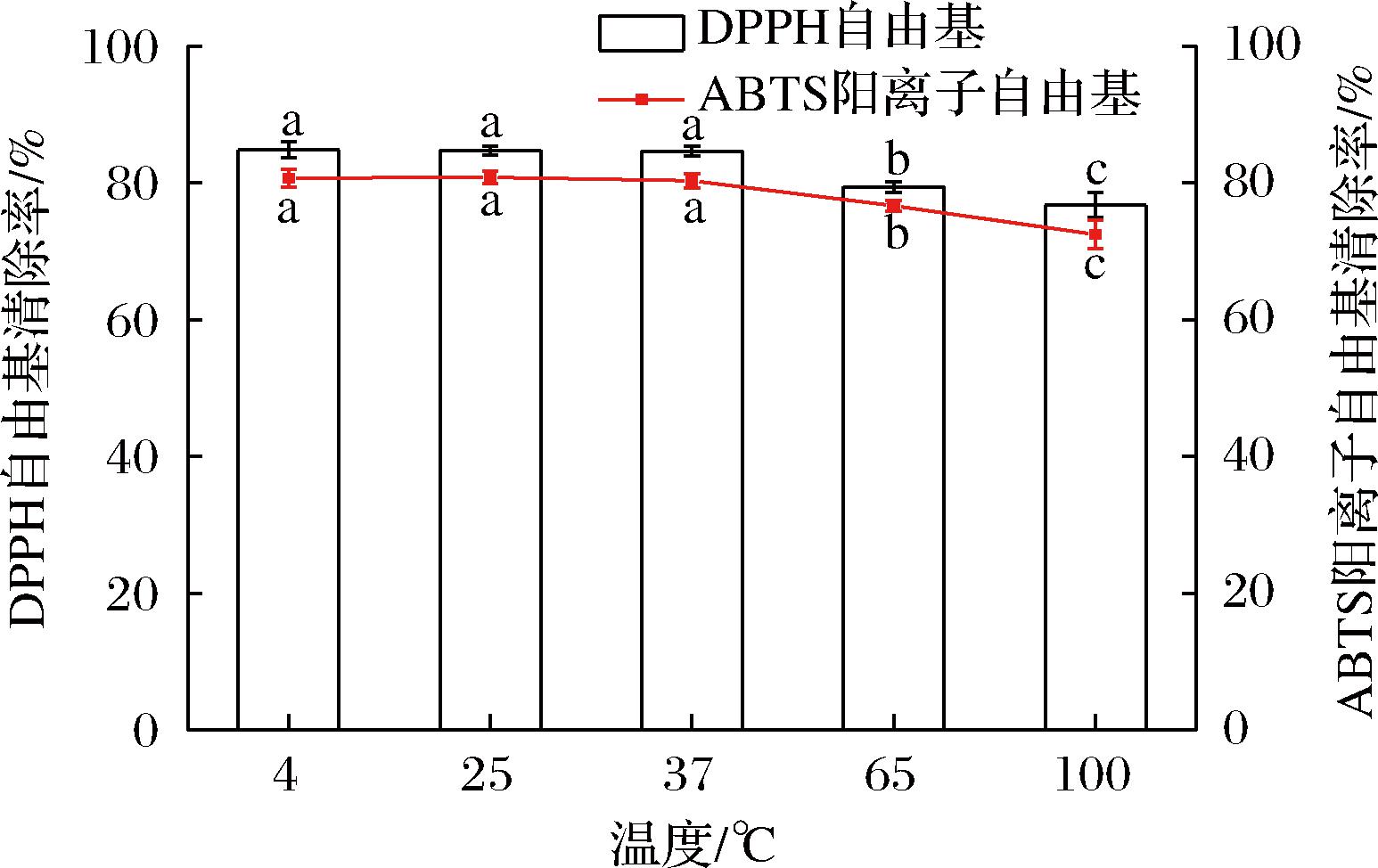
图7 不同温度对骆驼胎盘抗氧化肽的影响
Fig.7 Effect of different temperatures on antioxidant peptides in camel placenta
2.7.2 不同pH对骆驼胎盘抗氧化肽的影响
不同pH值对骆驼胎盘抗氧化肽的影响如图8所示,骆驼胎盘抗氧化肽在弱酸性和中性条件下活性保持较高。pH 7.0的条件下,DPPH自由基清除率最大为86.25%,但pH值增大至11.0时,DPPH自由基和ABTS阳离子自由基清除率显著下降了41.47%和36.37%(P<0.05),原因可能是强碱性条件下,抗氧化能力强的肽段会进一步发生水解,导致其活性降低或丧失[23]。因此,为保证骆驼胎盘抗氧化肽的活性,应考虑在弱酸性和中性环境下加工和贮存。
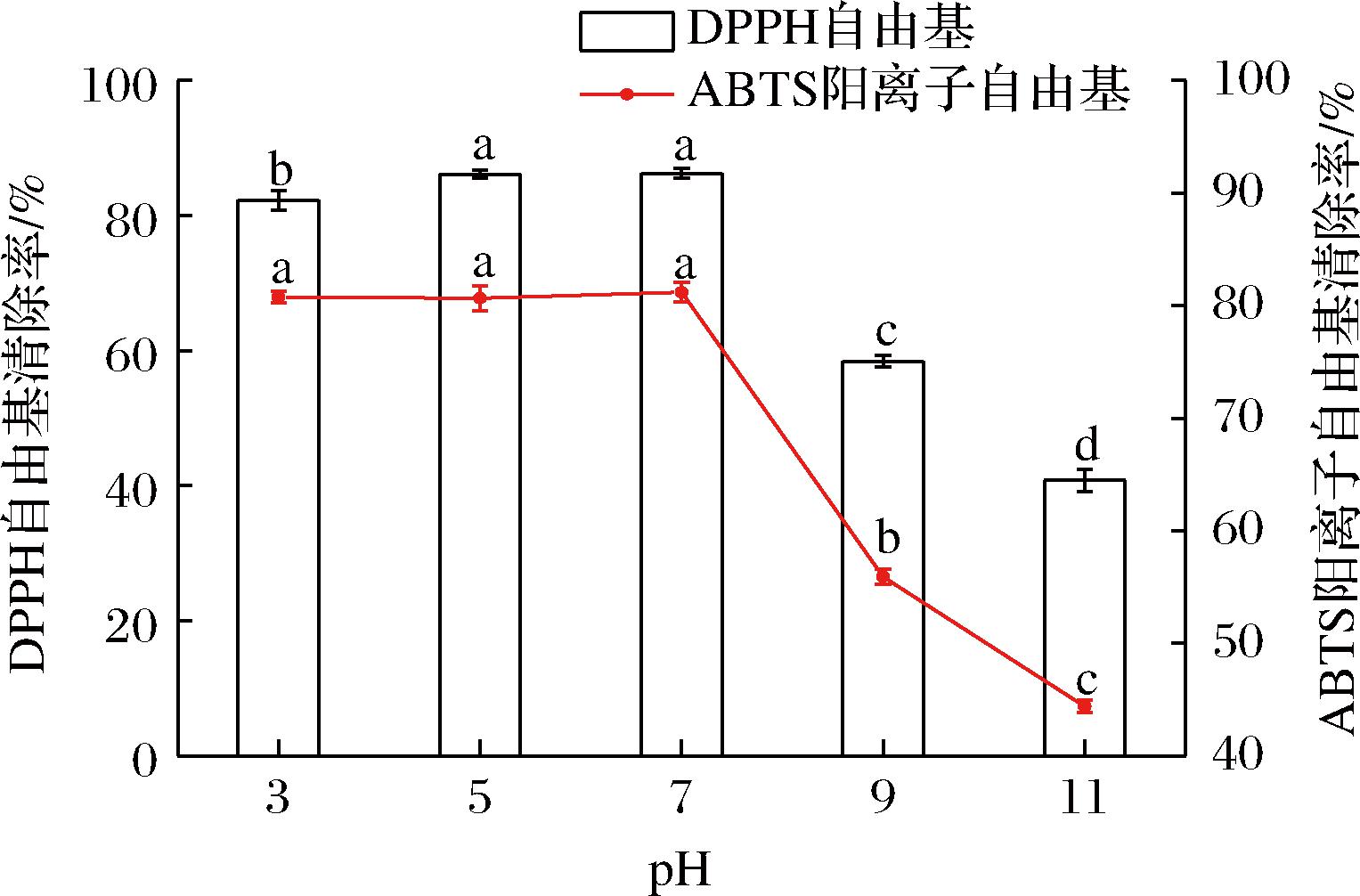
图8 不同pH对骆驼胎盘抗氧化肽的影响
Fig.8 Effects of different pH volues on antioxidant peptides in camel placenta
2.7.3 不同金属离子对骆驼胎盘抗氧化肽的影响
不同金属离子对骆驼胎盘抗氧化肽的影响如图9所示,随着Cu2+、Mg2+和K+浓度的增大,骆驼胎盘抗氧化肽对DPPH自由基、ABTS阳离子自由基的清除能力呈下降趋势。当Cu2+、Mg2+和K+质量浓度大于100 μg/mL时,骆驼胎盘抗氧化肽的抗氧化能力显著降低(P<0.05);相同质量浓度的Cu2+、Mg2+和K+对骆驼胎盘抗氧化肽的抑制效果从大到小依次为Cu2+>Mg2+>K+。有研究发现,抗氧化肽与过渡金属Cu2+等易作用形成配合物,降低对自由基的清除作用、抑制抗氧化活性[24]。因此在对骆驼胎盘抗氧化肽加工、运输和贮藏的过程中,应尽量避免接触金属离子等,以免造成其活性丧失。
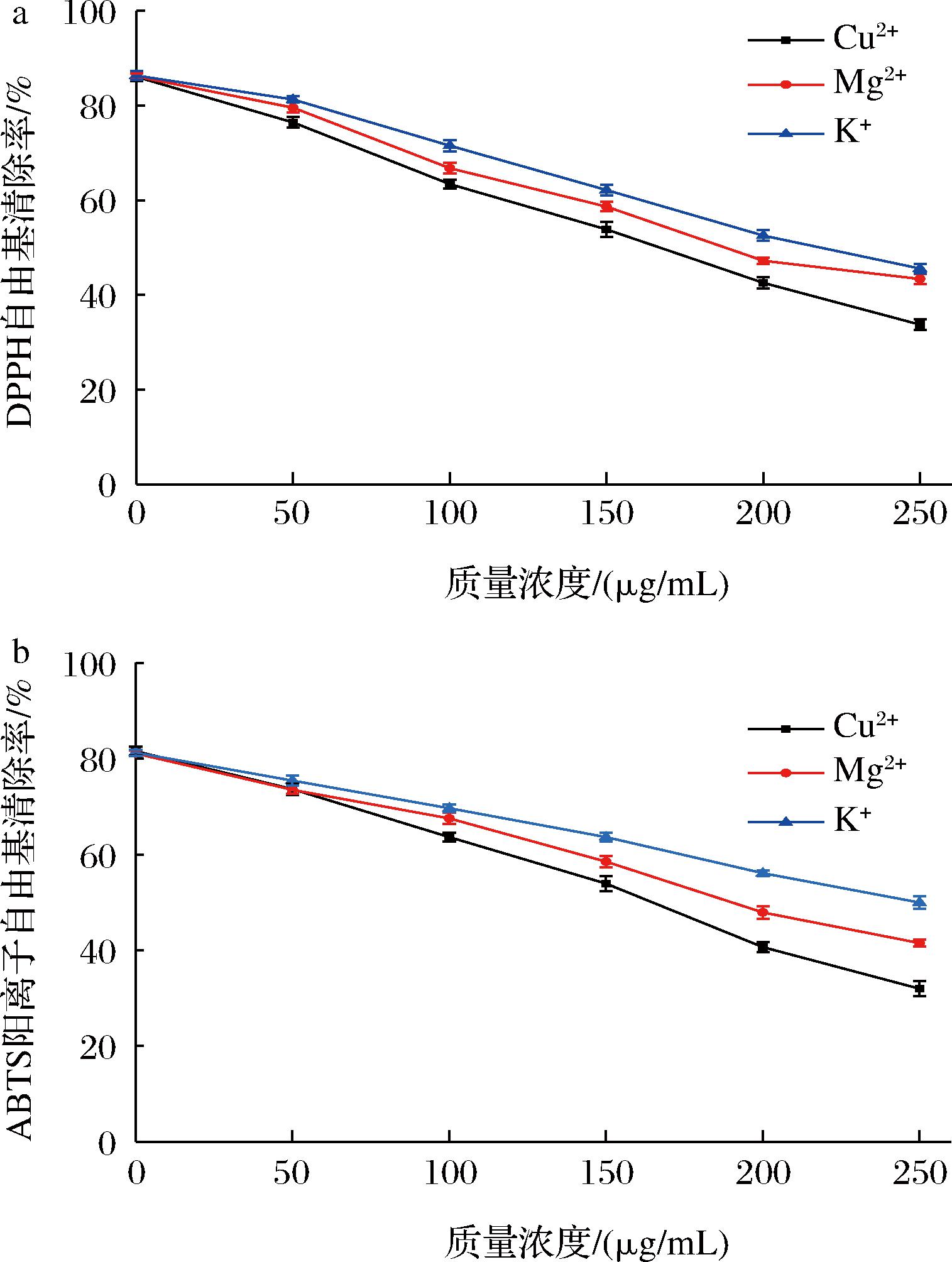
a-DPPH自由基清除率;b-ABTS阳离子自由基清除率
图9 不同金属离子对骆驼胎盘抗氧化肽的影响
Fig.9 Effect of different metal ions on antioxidant peptides in camel placenta
2.7.4 胃-肠蛋白酶对骆驼胎盘抗氧化肽的影响
由图10可知,经过胃蛋白酶消化2 h后,DPPH自由基和ABTS阳离子自由基清除率分别增加4.63%和0.36%,但经过胰蛋白酶消化2 h后,DPPH自由基清除率显著下降至65.43%(P<0.05),由于经过胃蛋白酶作用后抗氧化肽被分解为更小的片段,导致内部一些疏水性基团暴露[25],以致其中的部分疏水性氨基酸可以增强抗氧化能力[26],但胰蛋白酶会将这些肽段裂解,使活性下降[27]。ABTS阳离子自由基清除率在经过胰蛋白酶消化2 h后增加2.2%(P<0.05),这是因为胰蛋白酶能将骆驼胎盘抗氧化肽水解为更多组氨酸、酪氨酸和半胱氨酸[28]等具有较强自由基清除能力的氨基酸,且肠道消化的pH值更有益于骆驼胎盘抗氧化肽活性的保持[29]。该结果与高闪闪[30]对奶羊胎盘抗氧化肽的研究结果一致。
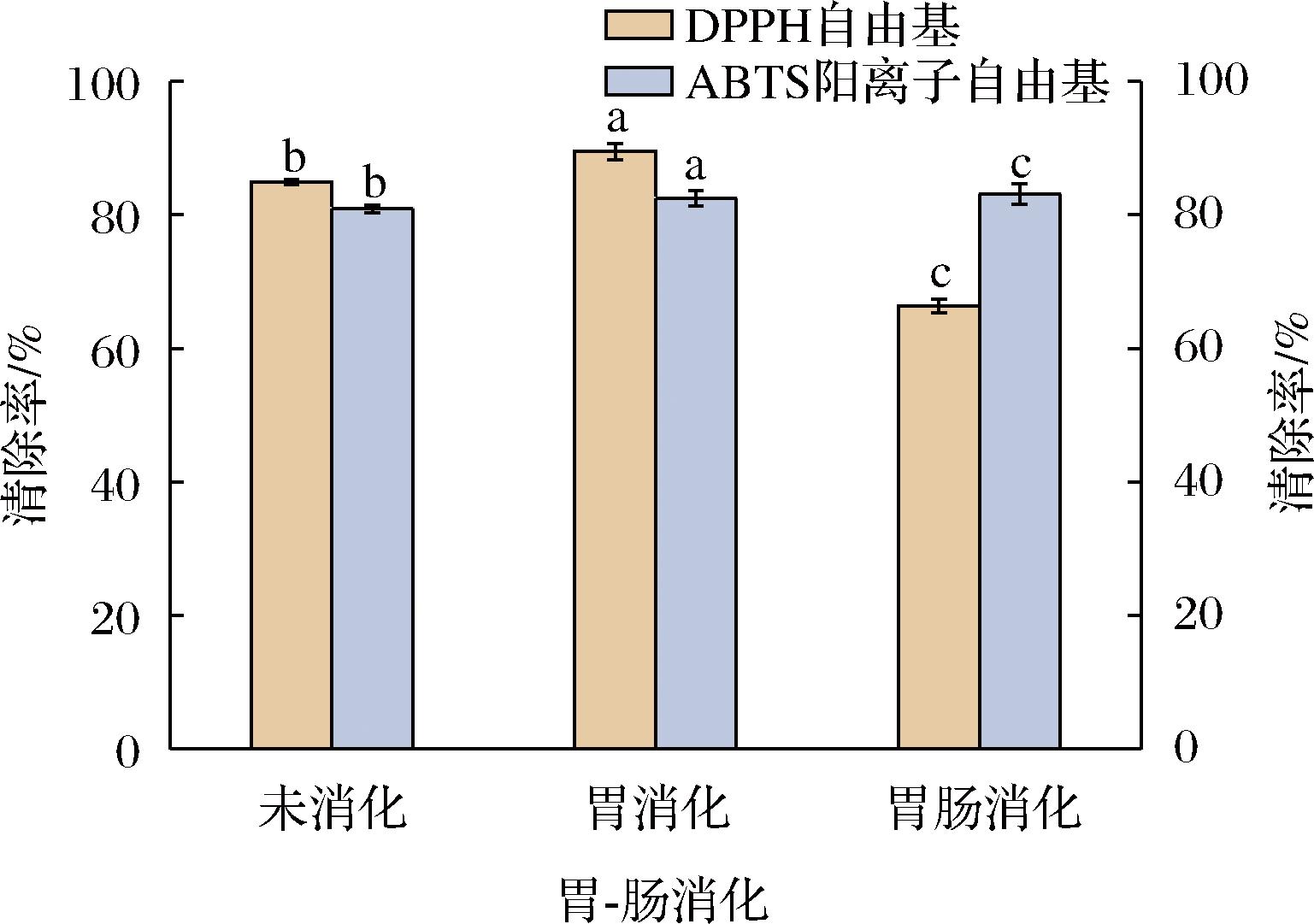
图10 胃-肠蛋白酶对骆驼胎盘抗氧化肽的影响
Fig.10 Effect of gastrointestinal protease on antioxidant peptides in camel placenta
3 结论
本研究以骆驼胎盘为原料,确定了制备骆驼胎盘抗氧化肽的最优条件为:酶解时间3 h,酶解温度57.5 ℃,酶添加量4 770 U/g,酶解pH 6.3。进一步探究其体外抗氧化能力和模拟消化对其活性的影响发现,骆驼胎盘抗氧化肽在弱酸和中性环境中活性较好。但在高温和碱性条件下抗氧化能力显著降低;对Cu2+、Mg2+和K+等金属离子敏感,且随浓度增大,金属离子对其抗氧化活性的抑制作用显著增强。经过胃肠消化后,DPPH自由基清除能力显著降低,但ABTS阳离子自由基清除能力上升2.2%,抗氧化活性先有一定程度的提升,随后下降明显。该研究证实骆驼胎盘抗氧化肽具有潜在的开发价值,可为其在食品和药品加工中的应用提供一定依据。
[1] 苏晔. 胎盘免疫调节因子的生物功能及临床应用进展[J]. 免疫学杂志, 2002, 18(S1):117-119.
SU Y. Bioactivities and clinical application of placenta immunoregulating factor[J]. Immunological Journal, 2002, 18(S1):117-119.
[2] MERKT H, BÖER M, RATH D, et al. The presence of an additional fetal membrane and its function in the newborn guanaco (Lama quanaco⊇)[J]. Theriogenology, 1988, 30(3):437-439.
[3] KUMAR S, PUROHIT G N, PUSHP M K. Retention of placenta in a female camel: A case report[J]. Theriogenology Insight-an International Journal of Reproduction in All Animals, 2016, 6(1):53.
[4] LIU J W, LUO S T, YANG J, et al. The protective effect of sheep placental extract on concanavalin a-induced liver injury in mice[J]. Molecules, 2018, 24(1):28.
[5] 宁鹏, 熊紫嫣, 康明. 牦牛胎盘肽抗氧化作用的研究[J]. 黑龙江畜牧兽医, 2015(4):105-106.
NING P, XIONG Z Y, KANG M. Study on the antioxidant effect of yak placental peptides[J]. Heilongjiang Animal Science and Veterinary Medicine, 2015(4):105-106.
[6] 任海伟, 石菊芬, 王曼琪, 等. 藏绵羊胎盘肽的抗氧化能力及结构表征[J]. 食品与机械, 2020, 36(4):162-169.
REN H W, SHI J F, WANG M Q, et al. Antioxidant capacity of placental peptide from Tibetan sheep and its structural characterization[J]. Food &Machinery, 2020, 36(4):162-169.
[7] LAOSAM P, PANPIPAT W, CHAIJAN M, et al. Molecular structures and in vitro bioactivities of enzymatically produced porcine placenta peptides fractionated by ultrafiltration[J]. Food and Bioprocess Technology, 2022, 15(3):669-682.
[8] JANG A, LEE M. Purification and identification of angiotensin converting enzyme inhibitory peptides from beef hydrolysates[J]. Meat Science, 2005, 69(4):653-661.
[9] 吴慧琳, 李苗云, 朱瑶迪, 等. 酶解发酵酸肉制备抗氧化肽的工艺优化[J]. 现代食品科技, 2020, 36(7):173-183; 297.
WU H L, LI M Y, ZHU Y D, et al. Optimization of enzymatic hydrolysis of fermented acid meat to produce antioxidant peptides[J]. Modern Food Science and Technology, 2020, 36(7):173-183; 297.
[10] 贾晓燕, 胡朋朋, 王佩欣, 等. 覆盆子单宁富集组分消化稳定性及对肠道菌群的调节作用[J]. 食品科学, 2023, 44(9):104-113.
JIA X Y, HU P P, WANG P X, et al. Digestive stability of tannin-enriched fraction of Rubus chingii hu fruits and its regulatory effect on the intestinal microflora[J]. Food Science, 2023, 44(9):104-113.
[11] 王振斌, 刘加友, 陈兵兵, 等. 响应面优化酶法制备芝麻饼粕ACE抑制肽研究[J]. 中国粮油学报, 2015, 30(9):88-93.
WANG Z B, LIU J Y, CHEN B B, et al. The response surface optimizate preparation of sesame dregs′ ace inhibitory peptides with enzyme[J]. Journal of the Chinese Cereals and Oils Association, 2015, 30(9):88-93.
[12] 张丙云, 王聪, 谢言言, 等. 超声波辅助复合酶法制备藏系绵羊胎盘肽的工艺优化[J]. 食品工业科技, 2017, 38(21):130-136.
ZHANG B Y, WANG C, XIE Y Y, et al. Optimization of preparation of Tibetan sheep placenta peptide by ultrasonic-assisted composite enzymatic hydrolysis[J]. Science and Technology of Food Industry, 2017, 38(21):130-136.
[13] 施永清, 王巧巧, 吴丹丽, 等. 响应面试验优化双酶酶解法制备鱼鳞抗菌肽工艺及其抑菌性能分析[J]. 食品科学, 2018, 39(6):155-161.
SHI Y Q, WANG Q Q, WU D L, et al. Optimization of preparation of antimicrobial peptides by two-step enzymatic hydrolysis of fish scales using response surface methodology and antimicrobial activity of purified antimicrobial peptide[J]. Food Science, 2018, 39(6):155-161.
[14] WANG X Q, YU H H, XING R E, et al. Optimization of antioxidative peptides from mackerel (Pneumatophorus japonicus) viscera[J]. PeerJ, 2018, 6: e4373.
[15] CHENG Y M, JIANG X F, XUE Y F, et al. Effect of three different proteases on horsemeat tenderness during postmortem aging[J]. Journal of Food Science and Technology, 2021, 58(7):2528-2537.
[16] HUANG D J, OU B X, PRIOR R L. The chemistry behind antioxidant capacity assays[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6):1841-1856.
[17] 岳阳. 大米抗氧化肽的制备及其抗衰老功能研究[D]. 杭州: 浙江大学, 2021.
YUE Y. Preparation of rice antioxidant peptides and its anti-aging effects[D]. Hangzhou: Zhejiang University, 2021.
[18] 石菊芬. 藏系绵羊胎盘肽的制备及其抗氧化能力研究[D]. 兰州: 兰州理工大学, 2020.
SHI J F. Research on the preparation and antioxidant capacity of placental peptide from Tibetan sheep[D]. Lanzhou: Lanzhou University of Technology, 2020.
[19] SUN C Z, SHAN Y W, TANG X, et al. Effects of enzymatic hydrolysis on physicochemical property and antioxidant activity of mulberry (Morus atropurpurea Roxb.) leaf protein[J]. Food Science &Nutrition, 2021, 9(10):5379-5390.
[20] 周珠法. 响应面法优化木瓜蛋白酶嫩化牛肉工艺[J]. 食品工业科技, 2018, 39(2):86-91; 97.
ZHOU Z F. Optimization of beef tenderizing technology with papain by response surface methodology[J]. Science and Technology of Food Industry, 2018, 39(2):86-91; 97.
[21] LI Y H, JIANG B, ZHANG T, et al. Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate (CPH)[J]. Food Chemistry, 2008, 106(2):444-450.
[22] SCHERER R, GODOY H T. Antioxidant activity index (AAI) by the 2, 2-diphenyl-1-picrylhydrazyl method[J]. Food Chemistry, 2009, 112(3):654-658.
[23] LIU C Y, MA X M, CHE S, et al. The effect of hydrolysis with neutrase on molecular weight, functional properties, and antioxidant activities of Alaska pollock protein isolate[J]. Journal of Ocean University of China, 2018, 17(6):1423-1431.
[24] 孙崇臻. 桑叶抗氧化肽的酶法制备、结构鉴定及免疫活性分析[D]. 广州: 华南理工大学, 2017.
SUN C Z. Enzymatic preparation, structural identification and the immunological activity of antioxidant peptides isolated from mulberry leaf protein[D]. Guangzhou: South China University of Technology, 2017.
[25] 胡炜东, 蔡永敏, 鲁富宽. 响应面法优化油莎豆粕蛋白抗氧化肽制备工艺[J]. 食品工业, 2014, 35(2):105-108.
HU W D, CAI Y M, LU F K. Optimization of preparation processing for antioxidant peptides from Cyperus esculeutus meal protein by response surface methodology[J]. The Food Industry, 2014, 35(2):105-108.
[26] ZHANG S Y, ZHAO Y Q, WANG Y M, et al. Gelatins and antioxidant peptides from Skipjack tuna (Katsuwonus pelamis) skins: Purification, characterization, and cytoprotection on ultraviolet-a injured human skin fibroblasts[J]. Food Bioscience, 2022, 50:102138.
[27] ZHU C Z, ZHANG W G, KANG Z L, et al. Stability of an antioxidant peptide extracted from Jinhua ham[J]. Meat Science, 2014, 96(2):783-789.
[28] 高嘉彤, 王冠, 吕春茂, 等. 榛子肽的体外抗氧化稳定性分析[J]. 现代食品科技, 2023, 39(6):204-211.
GAO J T, WANG G, LYU C M, et al. In vitro antioxidant stability analysis of hazelnut peptides[J]. Modern Food Science and Technology, 2023, 39(6):204-211.
[29] 郑昌亮, 陈梦婷, 汪兰, 等. 鳙鱼肌原纤维蛋白源抗氧化肽的稳定性研究[J]. 食品与发酵工业, 2023, 49(8):43-50.
ZHENG C L, CHEN M T, WANG L, et al. Stability of antioxidant peptides from bighead carp (Aristichthys nobilis) myofibrillar protein[J]. Food and Fermentation Industries, 2023, 49(8):43-50.
[30] 高闪闪. 奶山羊胎盘抗氧化多肽制备及其功能活性研究[D]. 杨凌: 西北农林科技大学, 2017.
GAO S S. Study on Preparation and functional characterization of antioxidant peptides extracted from dairy goat placenta[D]. Yangling: Northwest A &F University, 2017.