酪蛋白胶束(micellar casein,MC)是牛乳中酪蛋白的天然存在形态,是一种纳米级超分子聚集体,其中包含αs1-、αs2-、β-和κ-酪蛋白4种单体。酪蛋白胶束结构独特,内部由αs-、β-酪蛋白及矿物元素组成,形成多个疏水空腔,κ-酪蛋白覆盖在胶束表面形成毛发层,具有较好的亲水性[1]。因此,酪蛋白胶束具有疏水内部和亲水表面,易溶于水,且结构较为稳定。近年来,随着膜分离技术的不断发展,采用膜分离法提取酪蛋白胶束已十分成熟,为酪蛋白胶束在食品及医药行业的应用奠定了原料基础,也使得酪蛋白胶束的应用研究备受关注;其中,酪蛋白胶束对活性分子的负载机理及递送性能研究成为研究热点[2]。研究发现,酪蛋白胶束对多种活性分子具有较高的亲和力,这与其特殊的结构密切相关。酪蛋白胶束与黑米花色苷通过范德华力、氢键相互作用结合,二者结合常数为5.394×104 L/mol[3];与紫薯花色苷通过范德华力、氢键相互作用结合,结合常数高达105 L/mol[4]。本团队前期研究发现,酪蛋白胶束与咖啡酸、咖啡酸苯乙酯均通过疏水相互作用结合,且相较于咖啡酸,酪蛋白胶束对咖啡酸苯乙酯表现出更高的结合亲和力[5];热处理或热-超声联合处理下,酪蛋白胶束与大黄素的结合作用力为疏水性相互作用,结合常数为103~105[6]。
酪蛋白胶束负载可改善活性分子的理化性质及生物活性[7]。ALLAHDAD等[8]以MC为基质对β-胡萝卜素进行负载,二者形成的纳米复合物具有优异的胃肠稳定性、冻干稳定性、贮藏稳定性以及稀释稳定性。MOELLER等[9]研究证明,MC具有负载维生素D的能力,负载后其贮藏稳定性显著提升;复合物经过冷冻干燥和喷雾干燥处理后,维生素D的包封率分别可达76%和80%。本团队研究发现,经酪蛋白胶束负载的咖啡酸、咖啡酸苯乙酯也表现出更高的热稳定性和DPPH自由基清除活性[5]。
大黄素是廖科植物中常见的蒽醌衍生物,具有抗氧化性、抑菌、抗炎的功效[10-13]。但是,游离蒽醌化合物水溶性差,生物利用度较低,因而在制药和食品行业的应用受到限制[14]。研究发现,大黄素与乳蛋白具有自发结合的作用,其中大黄素与β-乳球蛋白之间以静电作用力自发结合,大黄酸和大黄酚均以疏水性相互作用与β-乳球蛋白自发结合,结合常数为103~105[14]。本团队前期研究发现,酪蛋白胶束-大黄素微胶囊的DPPH自由基和ABTS阳离子自由基清除活性均高于游离大黄素的水溶液或乙醇溶液,且经酪蛋白胶束负载可对大黄素进行缓释[6]。由此可见,酪蛋白胶束负载有利于提升大黄素的生物活性。
然而,大多数研究都是以单一酪蛋白作为基质,分析其对大黄素或其衍生物的结合机理。在构建活性分子载体的过程中,为了提升包封性能及产品稳定性,常加入果胶(pectin,P)等天然亲水性多糖[15-16]。本团队研究发现,添加果胶的乳液凝胶稳定性显著提升,可作为大黄素的载体基质[17]。然而,果胶的存在对酪蛋白胶束与大黄素结合机制的影响规律尚不明晰。
本文以果胶-酪蛋白胶束(P-MC)复合物为基质,采用荧光分析法研究了果胶对酪蛋白胶束与大黄素结合机理的影响规律;进而制备了负载大黄素的果胶-酪蛋白胶束复合微胶囊(P-MC@E),采用红外光谱、粒径表征了微胶囊结构;测定了微胶囊的热稳定性及抗氧化活性,评价了体外模拟胃肠环境中微胶囊对大黄素的释放特性。研究结果可为大黄素的负载和递送提供理论依据,为酪蛋白胶束及果胶在活性分子递送中的应用提供参考依据。
1 材料与方法
1.1 材料与试剂
大黄素、果胶、胃蛋白酶(1 500 U/mg)、胰蛋白酶(>2 500 U/mg)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐、1,1-二苯基-2-三硝基苯肼,上海麦克林生化科技有限公司,其他试剂均为分析纯。
酪蛋白胶束,实验室自制。将新鲜牛乳在4 000×g离心脱脂20 min后,过100 kDa的卷式膜浓缩4倍,膜进口压力0.5 MPa,截留液即为酪蛋白胶束浓缩液,经冷冻干燥即得酪蛋白胶束。经测定,样品总蛋白质含量为(82.77±1.32)%(质量分数)。
1.2 仪器与设备
Nicolet iS50 FTIR光谱仪,美国赛默飞世尔科学公司;XD3 X射线多晶衍射仪,北京普析通用仪器有限责任公司;STA 449 F5 TG-DSC热分析仪、STA449F5同步热分析仪,德国耐驰仪器制造有限公司;UV-1780双光束紫外可见分光光度计、RF-5301PC荧光分光光度计,岛津仪器有限公司。
1.3 实验方法
1.3.1 P-MC@E复合物及微胶囊制备
将适量酪蛋白胶束充分溶解在0.05 mol/L pH 6.8的磷酸盐缓冲液中,得终质量浓度为2 g/L的酪蛋白胶束水溶液,过夜水化。将适量大黄素溶于乙醇中,得终浓度为2 mmol/L的大黄素溶液。将适量果胶充分溶解在0.05 mol/L pH 6.8的磷酸盐缓冲液中,得终质量浓度为2 g/L的果胶水溶液,过夜水化。将制备好的果胶溶液与酪蛋白溶液按体积比为0∶10、1∶9、2∶8、3∶7、4∶6、5∶5充分混合;将不同体积的大黄素溶液与10 mL果胶-酪蛋白胶束溶液混合,补充适量乙醇,使总添加量相同,得到大黄素终浓度为0、20、40、60、80、100 μmol/L的混合物。使用涡流混合器将混合物充分混合60 s后分别在25 ℃、37 ℃和45 ℃加热30 min,冷却至室温,制得果胶-酪蛋白胶束@大黄素复合物,分别记为P-MC@E(0/10)、P-MC@E(1/9)、P-MC@E(2/8)、P-MC@E(3/7)、P-MC@E(4/6)、P-MC@E(5/5),用于相互作用机制分析和复合物粒径测定。
在上述方法基础上,将果胶和酪蛋白胶束溶液浓度放大10倍,加入适量大黄素溶液使其浓度为1 000 μmol/L,在25 ℃下热处理30 min后使用喷雾干燥机进行喷雾干燥,制得P-MC@E微胶囊粉末,收集样品用于红外分析、抗氧化性测定和体外模拟消化性评价。
1.3.2 P-MC@E复合物的结合机理分析
参考本团队前期研究方法[6],采用荧光分光光度计在室温下测定上述P-MC@E复合物的荧光光谱,激发波长设定为280 nm,发射光谱采集范围为290~700 nm,激发波长与发射波长狭缝均为5 nm。用Stern-Volmer方程(公式1)计算大黄素对复合体系中酪蛋白胶束的荧光猝灭机理[18-19]。
F0/F=1+Kqτ0[Q]=1+KSV[Q]
(1)
式中:F0、F为加入大黄素前后果胶-酪蛋白胶束混合体系的荧光强度;KSV为大黄素对酪蛋白荧光的猝灭常数,L/mol;Kq为大黄素对酪蛋白荧光的猝灭速率常数,L/(mol·s);τ0为未加大黄素时生物大分子荧光的平均寿命,取10-8 s;[Q]为大黄素的浓度,mol/L。
根据前期研究结果,大黄素对酪蛋白胶束的荧光猝灭为静态猝灭,因此利用双对数方程(公式2)计算酪蛋白胶束与大黄素结合常数Ka及结合位点数n。
(2)
根据Van’t Hoff方程等(公式3、公式4)计算大黄素与果胶-酪蛋白胶束复合物结合过程的热力学参数熵变(ΔS)、焓变(ΔH)、吉布斯自由能变(ΔG)。
(3)
ΔG=ΔH-TΔS
(4)
式中:Ka为大黄素与酪蛋白胶束的结合常数,L/mol;R为理想气体常数,J/(K·mol);T为处理温度,K。
1.3.3 MC与大黄素相互作用的分子对接
参考WANG等[20]的方法,以MC(ID:5 WO2)作为分子对接过程中的受体分子模型,其3D结构模型从PDB数据库中获取;大黄素(CAS:518-82-1)作为配体分子模型,其3D结构模型从PubChem数据库中获取。随后,在Discovery Studio中优化MC与大黄素在pH 6.8条件下的结构模型,并通过CDOCKER-Dock函数分析酪蛋白胶束与大黄素分子间的相互作用。对接结果通过Discovery Studio 2019客户端进行可视化。
1.3.4 P-MC@E复合物粒径测定
使用激光粒度分布仪测定P-MC@E的粒径,使用前仪器进行清洗和校零,水作为分散剂,平衡时间120 s,样品折射率1.35,介质折射率1.33。
1.3.5 P-MC@E微胶囊的傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析
参考本团队方法[5],将微胶囊粉末样品置于衰减全反射(attenuated total reflection,ATR)元件上,设置光谱分辨率为4 cm-1,扫描32次,记录样品在400~4 000 cm-1范围内的红外光谱。
1.3.6 P-MC@E复合物微胶囊的DPPH自由基/ABTS阳离子自由基清除力测定
参考本团队方法[21],将复合物微胶囊样品溶解于0.05 mol/L pH 6.8的磷酸盐缓冲液中,制成浓度为100 μmol/L的复合物溶液。取1 mL复合物溶液与3.5 mL 0.1 mmol/L的DPPH乙醇溶液充分混合,室温下避光静置20 min。采用紫外-可见分光光度计于517 nm处测定混合物的吸光度,记为A1;用等体积乙醇溶液替代DPPH溶液,记为A2;等体积水代替样品溶液,记为A0。用等体积水和乙醇混合溶液调零。样品的DPPH自由基清除率的计算如公式(5)所示:
DPPH自由基清除率![]()
(5)
取0.5 mL复合物溶液与3.5 mL ABTS溶液混合,室温静置6 min,测定734 nm处的吸光度值。样品的ABTS阳离子自由基清除率的计算如公式(6)所示:
ABTS阳离子自由基清除率![]()
(6)
式中:A0为ABTS储备液与磷酸盐缓冲液混合后的吸光度;As为ABTS储备液与复合物溶液混合后的吸光度。
1.3.7 P-MC@E复合物中大黄素的体外模拟消化释放率测定
参考本团队的方法并稍作修改[17],将100 mg样品(或其中所含等量大黄素标品)置于3 mL含有3.2 g/L胃蛋白酶且pH为1.2的模拟胃液中,装于透析袋(1 kDa分子质量)中。将透析袋置于含有150 mL释放介质的烧杯中在37 ℃、100 r/min下振荡2 h;释放介质由75 mL乙醇和75 mL无酶模拟胃液组成。振荡结束后将透析袋中的溶液pH调为7.5,加入3 mL含有10 g/L胰蛋白酶且pH为7.5的模拟肠液。将透析袋置于含有75 mL无酶模拟肠液和75 mL乙醇混合物的烧杯中,并在37 ℃、100 r/min下振荡4 h。在每个特定时间点收集3 mL透析袋外释放介质,并添加等体积新鲜介质。采用紫外-可见分光光度计在430 nm 处测定透析液的吸光值,用同一释放介质中绘制的大黄素标准曲线计算大黄素浓度,进而计算释放率。
1.4 数据统计分析
所有数据至少为3次试验结果,数据以均值±标准偏差表示;采用Origin 9软件作图;采用SPSS 19.0进行单因素方差分析,数据间差异显著分析采用Duncan法,以P<0.05为显著性差异。
2 结果与分析
2.1 大黄素对P-MC体系的荧光猝灭效应
45 ℃下大黄素对MC的荧光猝灭效应见图1,45 ℃下单一MC的最大发射波长为340 nm。随着大黄素添加量的增加,MC的荧光值降低;当大黄素添加量为100 μmol/L时,MC的最大发射波长红移至352 nm。可见,大黄素与MC结合,形成了复合物,且使MC色氨酸、酪氨酸残基的微环境由疏水性向亲水性转变。文献[22]指出,当蛋白质的最大发射波长为335~350 nm时,色氨酸处于疏水微环境;最大发射波长为350~353 nm时,色氨酸暴露于亲水性环境中。也就是说,MC的色氨酸残基处于疏水环境中;大黄素作为疏水性分子,可能与色氨酸残基或与色氨酸邻近的氨基酸残基结合,使其微环境发生改变。

a-果胶与酪蛋白胶束体积比为0∶10;b-果胶与酪蛋白胶束体积比为1∶9;c-果胶与酪蛋白胶束体积比为2∶8;d-果胶与酪蛋白胶束体积比为3∶7;e-果胶与酪蛋白胶束体积比为4∶6;f-果胶与酪蛋白胶束体积比为5∶5
图1 45 ℃下P-MC@E复合物的荧光光谱
Fig.1 Fluorescence spectra of P-MC@E complexes at 45 ℃
注:P-MC@E表示果胶-酪蛋白胶束@大黄素复合物。
当体系中存在果胶时,MC的最大发射波长未发生变化,说明果胶对MC的结构不产生显著影响。添加果胶后,大黄素对MC的荧光猝灭效应与未添加果胶时基本一致,表现为随着大黄素添加量的增加,体系荧光值降低,最大发射波长红移。当大黄素添加量为100 μmol/L时,不同配比P-MC体系的最大发射波长均为352 nm。可见,果胶的存在对大黄素与MC的结合作用不产生显著影响。
利用Stern-Volmer方程计算了猝灭常数(Ksv)和猝灭速率常数(Kq),探讨果胶存在下大黄素对MC内源荧光的猝灭机理[19],结果见表1,大黄素对P-MC体系的Kq值远大于最大散射碰撞猝灭常数值[2.0×1010 L/(mol·s)],表明大黄素对MC内源荧光的猝灭机理均为静态猝灭,形成了稳定性较高的静态复合物[18]。可见,果胶存在下,MC仍可与大黄素形成静态复合物。
表1 不同温度下大黄素与P-MC体系的结合参数
Table 1 Binding parameters of emodin to P-MC composite at different temperatures
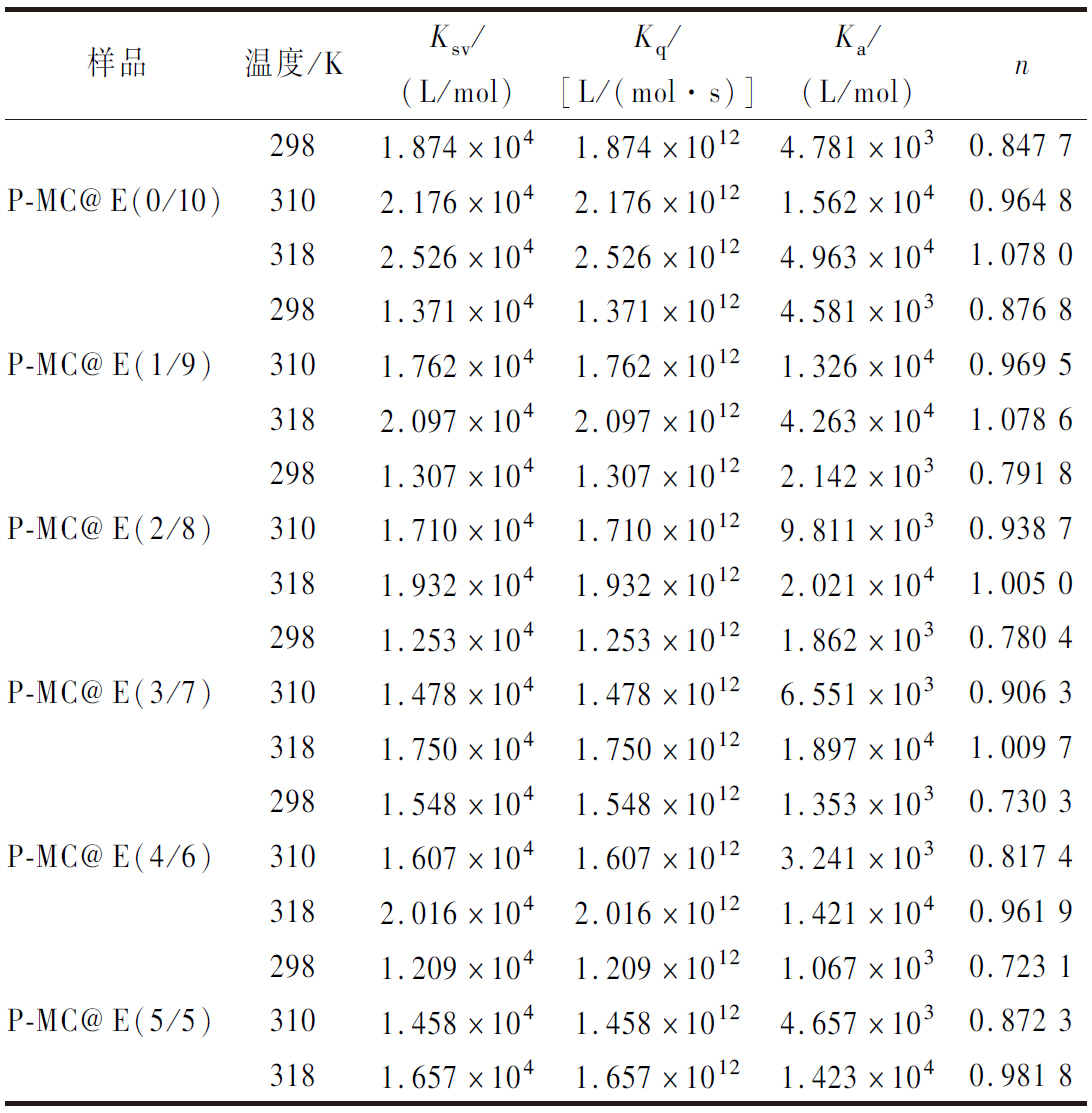
样品温度/KKsv/(L/mol)Kq/[L/(mol·s)]Ka/(L/mol)n2981.874×1041.874×10124.781×1030.847 7P-MC@E(0/10)3102.176×1042.176×10121.562×1040.964 83182.526×1042.526×10124.963×1041.078 02981.371×1041.371×10124.581×1030.876 8P-MC@E(1/9)3101.762×1041.762×10121.326×1040.969 53182.097×1042.097×10124.263×1041.078 62981.307×1041.307×10122.142×1030.791 8P-MC@E(2/8)3101.710×1041.710×10129.811×1030.938 73181.932×1041.932×10122.021×1041.005 02981.253×1041.253×10121.862×1030.780 4P-MC@E(3/7)3101.478×1041.478×10126.551×1030.906 33181.750×1041.750×10121.897×1041.009 72981.548×1041.548×10121.353×1030.730 3P-MC@E(4/6)3101.607×1041.607×10123.241×1030.817 43182.016×1042.016×10121.421×1040.961 92981.209×1041.209×10121.067×1030.723 1P-MC@E(5/5)3101.458×1041.458×10124.657×1030.872 33181.657×1041.657×10121.423×1040.981 8
2.2 大黄素与P-MC体系的结合常数
通过双对数方程计算大黄素与P-MC体系的结合常数(Ka)与结合位点数(n),结果如表1所示,大黄素与单一MC的结合常数大于103,说明MC对大黄素具有较高的亲和力。随着果胶添加量的增大,大黄素与MC的结合常数有所减小,这是因为果胶具有一定的黏度且带有负电荷[23],可与MC产生静电斥力,减缓了大黄素在体系中的扩散速率,阻碍了大黄素与MC的结合。另一方面,添加果胶后,MC浓度降低,影响了其与大黄素的结合。因此,随着果胶添加量的增加,大黄素与MC的Ka逐渐降低。然而,在不同果胶添加量下,大黄素与MC的结合常数均大于103,说明添加果胶后MC依然对大黄素具有较高的亲和力。
随着温度的升高,大黄素与P-MC体系的结合常数逐渐增大,说明结合过程为吸热过程。添加果胶后,大黄素与P-MC体系的结合常数依然随温度的升高而增大,说明果胶不影响大黄素与MC的结合作用,与荧光光谱分析结果一致。就结合位点数而言,MC对大黄素的结合位点数n接近1,且基本不受果胶添加量的影响。
2.3 大黄素与P-MC体系的结合机理
采用Van’t Hoff方程计算大黄素与P-MC体系结合过程的热力学参数,如表2所示,大黄素与P-MC体系结合过程的ΔH为正值,表明结合过程为吸热过程,与Ka分析结果一致;结合过程的ΔS为正值,说明大黄素与P-MC体系结合的主要作用力为疏水作用[18]。据报道,大黄素与乳蛋白具有自发结合的作用,其中大黄素与β-乳球蛋白之间以静电作用力自发结合[14]。可见,大黄素与蛋白质的结合作用受蛋白质结构影响。
表2 大黄素与P-MC体系结合过程的热力学参数
Table 2 Thermodynamic parameters of the binding process for emodin to P-MC composite

样品ΔH/(kJ/mol)ΔS/[J/(mol·K)]ΔG/(kJ/mol)P-MC@E(0/10)95.46±17.57389.70±1.08-24.82±3.11P-MC@E(1/9)91.84±21.24376.97±1.30-24.51±2.98P-MC@E(2/8)86.61±9.50355.00±0.59-22.97±2.98P-MC@E(3/7)93.62±11.71376.03±0.72-22.45±3.01P-MC@E(4/6)99.97±39.34393.00±2.41-21.33±3.04P-MC@E(5/5)103.62±8.31405.19±0.51-21.44±3.27
添加果胶后,大黄素与MC结合过程的ΔH和ΔS先随着果胶添加量在0%~20%增加而降低,之后随着果胶添加量在30%~50%增加而增大。这可能是由于果胶带有负电荷,且具有较大粒径,少量添加后与MC之间形成了一定的静电斥力,使MC分散性变好,有利于大黄素与MC的结合,因此ΔH降低。当果胶添加量过多时,其较大的黏度和粒径阻碍了大黄素的扩散,且其与MC较高的静电斥力不利于大黄素与MC的结合,使得大黄素与MC结合不仅要克服结合过程需要的能量,还要克服静电斥力,因此结合过程的ΔH迅速增大。就ΔS而言,其变化趋势与ΔH一致。然而,结合过程的ΔG均为负值,且随果胶添加量的增加而增大,说明大黄素与P-MC体系结合过程均可自发进行,但自发程度随果胶添加量的增加而降低,与Ka随果胶添加量的变化趋势一致。由此可见,果胶的添加虽然削弱了大黄素与MC的自发结合趋势,使二者结合常数有所降低,但不改变大黄素与MC的结合机理。
最佳构象下,大黄素与MC之间相互作用的分子对接示意图如图2所示,MC共有6个氨基酸残基参与结合大黄素,且全部通过疏水相互作用结合,包括Pro-56(3.99 Å,3.90 Å)、Pro-57(4.85 Å,2.80 Å)、Arg-61(5.21 Å)、Met-85(3.98 Å)、Arg-89(4.58 Å)、Leu-123(5.12 Å)。以上结果表明,疏水相互作用是大黄素与MC结合过程中的主导作用力,与荧光分析结果一致。

图2 大黄素与MC之间的3D对接模型和2D相互作用示意图
Fig.2 3D docking model and 2D interaction schematic between emodin and MC
2.4 P-MC@E复合物粒径
P-MC@E复合物粒径见图3,MC平均粒径为(190.72±6.04) nm,果胶平均粒径为(5 180.66±136.09) nm。当MC与果胶以一定比例混合后,与游离果胶相比,体系粒径迅速降低,形成纳米级混合体系。随着果胶添加量的增大,P-MC体系粒径逐渐增大;当果胶添加量在30%~50%增加时,P-MC体系粒径显著增大至(510.95±15.95) nm(P<0.05)。由此可见,与MC混合后,在静电斥力下果胶结构发生变化,粒径显著降低,形成了稳定的混合体系[23]。

图3 P-MC@E复合物的粒径
Fig.3 Particle size of the P-MC@E complexes
向体系中添加大黄素后,与未添加样品相比,体系粒径未发生显著变化(P>0.05),这是因为大黄素分子质量较小,其添加量较低,与MC形成复合物后对体系粒径影响不大。本团队前期研究发现,结合少量大黄素对MC的粒径影响不大,与本文研究结果一致[6]。然而,就P-MC@E复合物而言,其粒径随果胶添加量在0%~20%增加而变化不大(P>0.05);但其随果胶添加量在30%~50%增加而显著增大(P<0.05),这与大黄素和P-MC体系结合过程的ΔH与ΔS变化趋势一致。可见,P-MC体系粒径对其与大黄素结合过程的ΔH与ΔS具有一定的影响。
2.5 P-MC@E复合物的红外光谱
P-MC@E复合物的红外光谱如图4所示。其中,MC的特征吸收峰出现在1 644 cm-1和1 531 cm-1,分别对应酰胺Ⅰ带和酰胺Ⅱ带[6]。果胶的红外谱图(图4)中,3 000~3 500 cm-1是分子间和分子内氢键吸收峰;1 573 cm-1为羧基吸收峰;1 100 cm-1附近为吡喃型糖的特征吸收峰[24]。大黄素红外谱图中,3 378 cm-1附近为羟基的伸缩振动吸收峰;2 977 cm-1为亚甲基的反对称伸缩振动吸收峰;1 618 cm-1为羰基伸缩振动吸收峰;1 475 cm-1附近为芳香环骨架伸缩振动、C—H弯曲振动以及C—O伸缩振动[25]。复合物中,大黄素的特征峰消失,说明大黄素被结合;果胶在1 573 cm-1处的特征峰消失,证实其结构发生变化,与粒径分析结果一致。随着果胶添加量的增加,MC酰胺Ⅰ带、酰胺Ⅱ带吸收峰位置未发生明显变化,说明复合物仅以物理作用结合,再次证实果胶的添加不影响MC与大黄素的结合作用。
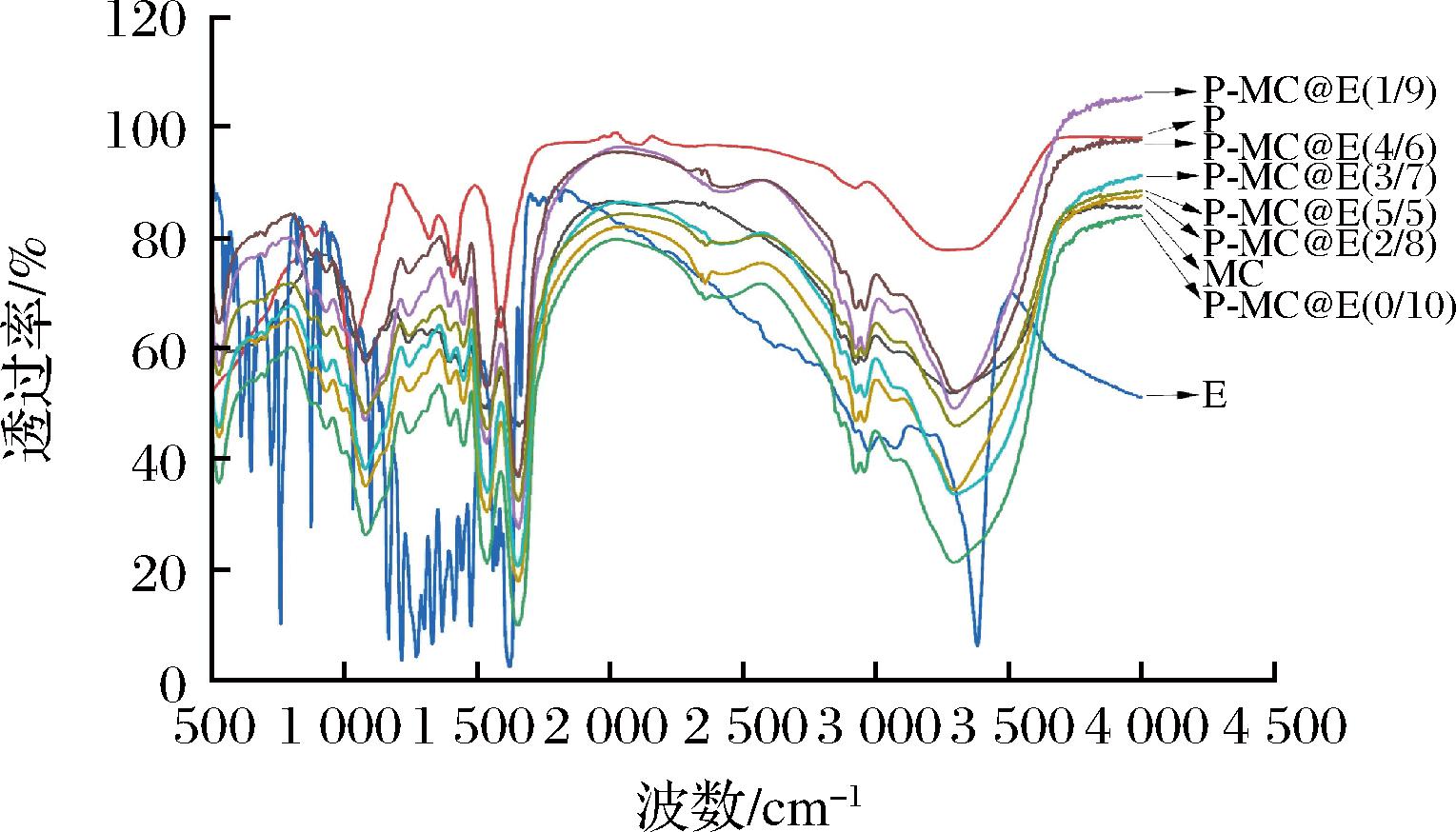
图4 P-MC@E复合物的红外光谱
Fig.4 FTIR spectra of P-MC@E complexes
2.6 P-MC@E复合物的DPPH自由基、ABTS阳离子自由基清除活性
P-MC@E复合物的DPPH自由基、ABTS阳离子自由基清除率如图5所示,游离果胶和MC均具有一定的DPPH自由基清除活性,清除率分别为(37.47±0.48)%、(45.17±1.26)%。游离大黄素水溶液的DPPH自由基清除率为(28.65±0.95)%。P-MC@E复合物的DPPH自由基清除活性高于游离MC、果胶以及大黄素,且随果胶添加量的增加而显著增大(P<0.05)。当果胶添加量达到50%时,复合物的DPPH自由基清除率达到(74.10±3.34)%。由此可见,P-MC@E复合物的形成有利于改善大黄素的DPPH自由基清除活性。
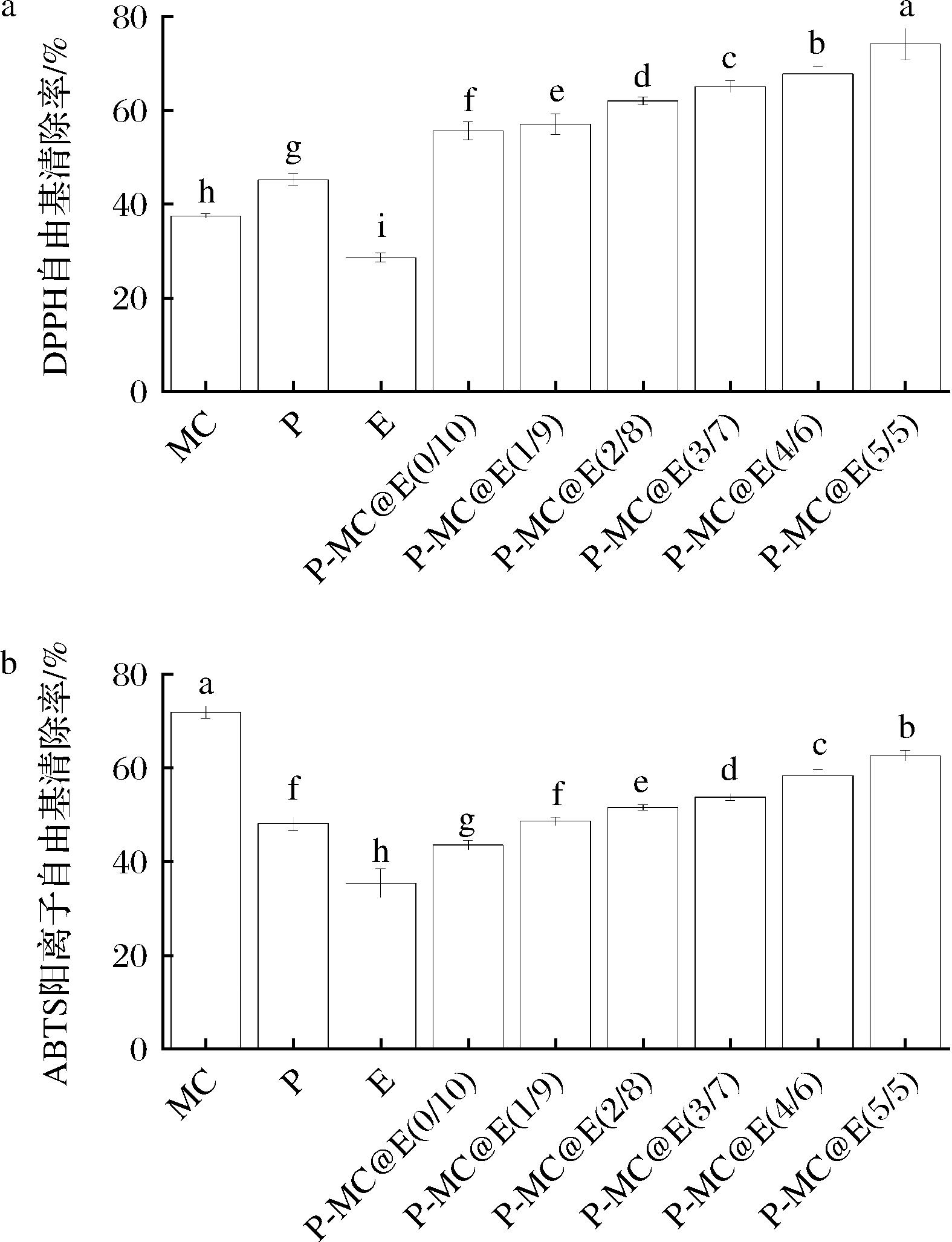
a-DPPH自由基清除率;b-ABTS阳离子自由基清除率
图5 P-MC@E复合物的DPPH自由基和ABTS阳离子自由基清除率
Fig.5 DPPH free radical and ABTS cationic radical scavenging activities of P-MC@E complexes
就ABTS阳离子自由基清除活性而言,游离MC、果胶和大黄素均具有一定的ABTS自由基清除活性,清除率分别为(71.89±1.36)%、(48.13±1.50)%、(35.46±3.08)%。形成P-MC@E复合物后,其ABTS阳离子自由基清除活性随着果胶添加量的增加而显著增大(P<0.05)。复合物的ABTS阳离子自由基清除活性高于游离大黄素,但均低于游离MC。大黄素的结合掩蔽了MC的部分活性基团,使其ABTS阳离子自由基清除活性降低。
本团队前期研究发现,大黄素与MC复合物的DPPH自由基和ABTS阳离子自由基清除活性均高于游离大黄素;MC与咖啡酸、咖啡酸苯乙酯复合物的DPPH自由基、ABTS阳离子自由基清除活性均高于同浓度的游离咖啡酸或咖啡酸苯乙酯,与本研究结果一致[5-6]。
综上所述,与游离大黄素相比,与P-MC形成复合物后其DPPH自由基、ABTS阳离子自由基清除活性得以改善。
2.7 P-MC@E复合物的体外模拟消化
P-MC@E复合物微胶囊中大黄素的胃肠模拟释放曲线如图6所示。在模拟胃液中,游离大黄素消化120 min的累计释放率为(10.17±0.08)%,P-MC@E(0/10)中大黄素的累计释放率为(13.94±0.98)%,说明MC结合改善了大黄素的溶解性和分散性,使其更易于在模拟胃液中释放。然而,添加果胶后,P-MC@E复合物中大黄素的120 min模拟胃液消化累计释放量为2.24%~2.71%,说明果胶有限延缓了大黄素在模拟胃液中的释放。
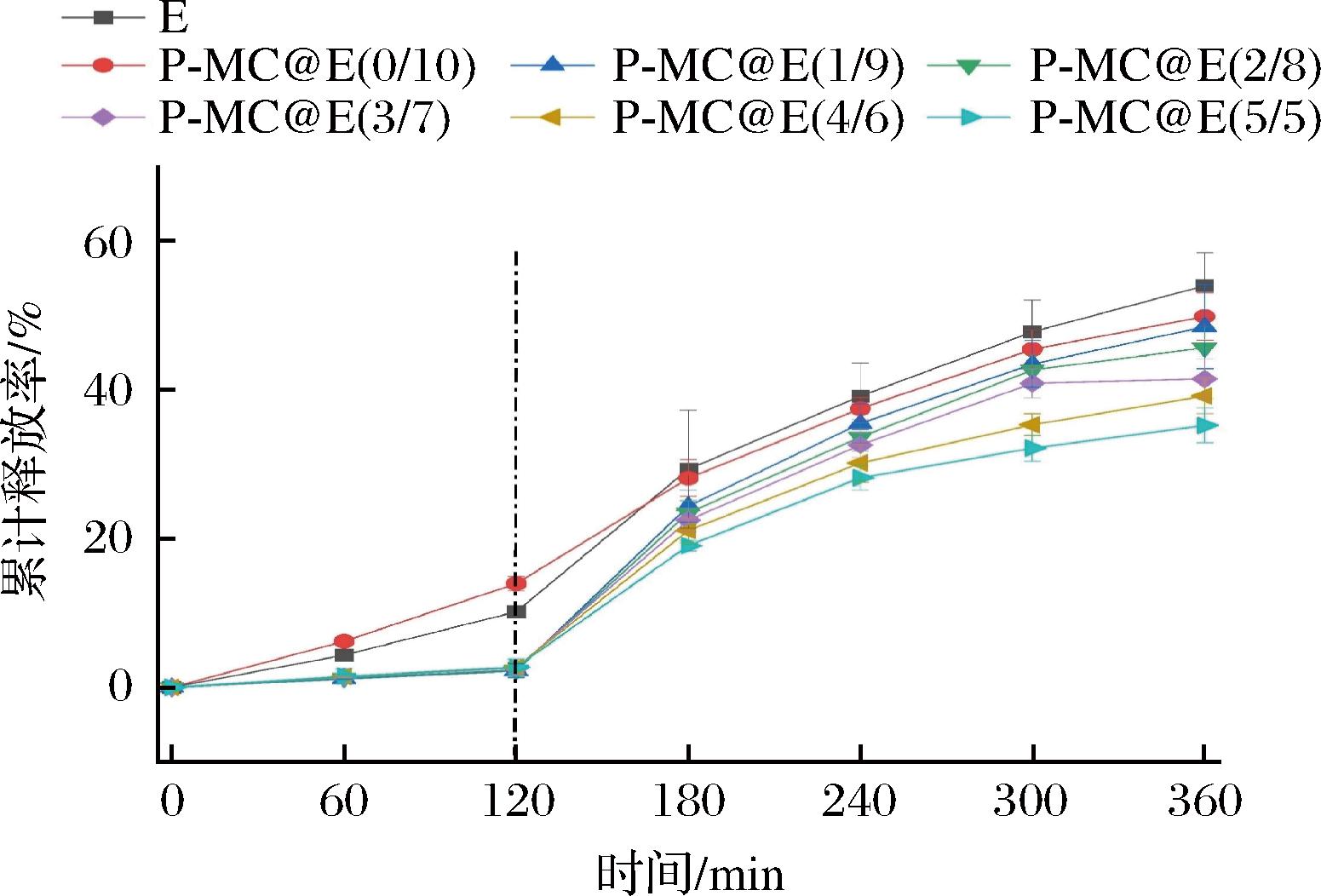
图6 P-MC@E复合物中大黄素的体外模拟释放曲线
Fig.6 Release profiles of emodin from P-MC@E complexes during simulated digestion
模拟肠液消化过程中,游离大黄素的释放量最高,其消化360 min后的累计释放率为(53.97±4.42)%;其次为P-MC@E(0/10),其消化360 min后的累计释放率为(49.83±3.17)%。随着果胶添加量的增加,大黄素的累计释放率降低;其中P-MC@E(5/5)消化360 min后的累计释放率为(35.22±2.32)%。这可能是由于微胶囊样品中,果胶位于微胶囊表面,结合了大黄素的MC位于内部,果胶添加量越多,其外壳越厚,对大黄素的缓释效果越明显。另一方面,果胶具有较高的黏度,其添加量越大,体系黏度越大,阻碍了大黄素的扩散,使其释放减缓[26]。由此可见,P-MC结合可实现大黄素的缓释,有利于提升其生物利用度。
3 结论
大黄素与MC以疏水作用结合,形成静态复合物,且结合过程为吸热和熵增过程。添加果胶后,大黄素与MC的结合作用不发生改变,结合过程仍自发进行,但结合常数有所降低。P-MC@E复合物粒径随着果胶添加量的增加而增大,但显著低于游离果胶粒径。形成P-MC@E复合物后,其DPPH自由基和ABTS阳离子自由基清除活性均高于游离大黄素。胃肠模拟消化试验发现,P-MC@E复合物对大黄素具有缓释作用。综上所述,P-MC体系与大黄素结合有利于改善其抗氧化性,降低其胃肠模拟消化释放率。
[1] SMITH G N, BROK E, CHRISTIANSEN M V, et al.Casein micelles in milk as sticky spheres[J].Soft Matter, 2020, 16(43):9955-9963.
[2] GANDHI S, ROY I.Drug delivery applications of casein nanostructures:A minireview[J].Journal of Drug Delivery Science and Technology, 2021, 66:102843.
[3] 赵焕焦. 黑米花色苷与三种蛋白质相互作用的研究[D].天津:天津科技大学, 2017.
ZHAO H J.Study on the interaction of black rice anthocyanins with three proteins[D].Tianjin:Tianjin University of Science and Technology, 2017.
[4] GONG S X, YANG C Y, ZHANG J H, et al.Study on the interaction mechanism of purple potato anthocyanins with casein and whey protein[J].Food Hydrocolloids, 2021, 111:106223.
[5] QIN J J, YANG M, WANG Y C, et al.Interaction between caffeic acid/caffeic acid phenethyl ester and micellar casein[J].Food Chemistry, 2021, 349:129154.
[6] YANG M, WEI Y M, ASHOKKUMAR M, et al.Effect of ultrasound on binding interaction between emodin and micellar casein and its microencapsulation at various temperatures[J].Ultrasonics Sonochemistry, 2020, 62:104861.
[7] GHAYOUR N, HOSSEINI S M H, ESKANDARI M H, et al.Nanoencapsulation of quercetin and curcumin in casein-based delivery systems[J].Food Hydrocolloids, 2019, 87:394-403.
[8] ALLAHDAD Z, VARIDI M, ZADMARD R, et al.Spectroscopic and docking studies on the interaction between caseins and β-carotene[J].Food Chemistry, 2018, 255:187-196.
[9] MOELLER H, MARTIN D, SCHRADER K, et al.Spray- or freeze-drying of casein micelles loaded with Vitamin D2:Studies on storage stability and in vitro digestibility[J].LWT-Food Science and Technology, 2018, 97:87-93.
[10] BAE U J, SONG M Y, JANG H Y, et al.Emodin isolated from Rheum palmatum prevents cytokine-induced β-cell damage and the development of type 1 diabetes[J].Journal of Functional Foods, 2015, 16:9-19.
[11] 张春玲, 梁超, 王宝爱, 等.大黄素通过调控HMGB1/TLR4/NF-κB信号通路对老年脑出血模型大鼠炎症因子的影响[J].中国免疫学杂志, 2022, 38(24):2992-2996.
ZHANG C L, LIANG C, WANG B A, et al.Emodin regulates HMGB1/TLR4/NF-κB signaling pathway and affects inflammatory factors in rats with cerebral hemorrhage in elderly[J].Chinese Journal of Immunology, 2022, 38(24):2992-2996.
[12] 王帅兵, 熊良伟, 季振南.大黄素对嗜水气单胞菌的抑菌作用及其机制[J].中国兽医杂志, 2023, 59(3):140-146.
WANG S B, XIONG L W, JI Z N.Antibacterial effect and mechanism of emodin on Aeromonas hydrophila[J].Chinese Journal of Veterinary Medicine, 2023, 59(3):140-146.
[13] 郑湘, 吴周全, 符国伟, 等.大黄素对CFA诱导小鼠炎性痛的治疗作用及机制[J].南京医科大学学报(自然科学版), 2022, 42(10):1364-1370;1401.
ZHENG X, WU Z Q, FU G W, et al.Therapeutic effect and mechanism of emodin on CFA induced inflammatory pain in mice[J].Journal of Nanjing Medical University (Natural Sciences), 2022, 42(10):1364-1370;1401.
[14] XU H X, LU Y Q, ZHANG T T, et al.Characterization of binding interactions of anthraquinones and bovine beta-lactoglobulin[J].Food Chemistry, 2019, 281:28-35.
[15] CHANG C, WANG T R, HU Q B, et al.Pectin coating improves physicochemical properties of caseinate/zein nanoparticles as oral delivery vehicles for curcumin[J].Food Hydrocolloids, 2017, 70:143-151.
[16] BI A Q, XU X B, GUO Y, et al.Fabrication of flavour oil high internal phase emulsions by casein/pectin hybrid particles:3D printing performance[J].Food Chemistry, 2022, 371:131349.
[17] 瓦文强, 秦娟娟, 杨敏, 等.酪蛋白胶束乳液凝胶性质及其在大黄素负载中的应用[J].食品与发酵工业, 2023, 49(1):132-139.
WA W W, QIN J J, YANG M, et al.Properties of emulsion gel based on casein micelles and its application in emodin loading[J].Food and Fermentation Industries, 2023, 49(1):132-139.
[18] FENG Y, LYU M Y, LU Y Q, et al.Characterization of binding interactions between selected phenylpropanoid glycosides and trypsin[J].Food Chemistry, 2018, 243:118-124.
[19] JIA J J, GAO X, HAO M H, et al.Comparison of binding interaction between β-lactoglobulin and three common polyphenols using multi-spectroscopy and modeling methods[J].Food Chemistry, 2017, 228:143-151.
[20] WANG Y C, YANG M, QIN J J, et al.Interactions between puerarin/daidzein and micellar casein[J].Journal of Food Biochemistry, 2022, 46(2):e14048.
[21] 曾秋兵, 杨敏, 王裕成, 等.喷雾干燥工艺对胶束态酪蛋白结构及抗氧化性的影响[J].食品与发酵工业, 2020, 46(6):140-147.
ZENG Q B, YANG M, WANG Y C, et al.Effect of spray-drying conditions on the structure and antioxidant activities of micellar casein[J].Food and Fermentation Industries, 2020, 46(6):140-147.
[22] LIU Y, GUO R.pH-dependent structures and properties of casein micelles[J].Biophysical Chemistry, 2008, 136(2-3):67-73.
[23] WUSIGALE, LIANG L, LUO Y C.Casein and pectin:Structures, interactions, and applications[J].Trends in Food Science &Technology, 2020, 97:391-403.
[24] 崔灵敏, 谢笔钧, 孙智达.果胶与莲原花青素复合物理化性质及体外抑菌活性研究[J].食品工业科技, 2020, 41(16):60-66;80.
CUI L M, XIE B J, SUN Z D.Physical and chemical properties of pectin-proanthocyanidin complex and its antibacterial activity in vitro[J].Science and Technology of Food Industry, 2020, 41(16):60-66;80.
[25] 单家明, 孟岩, 李焐仪, 等.FT-IR和HPLC对不同产地大黄药材的鉴别分析[J].井冈山大学学报(自然科学版), 2021, 42(4):96-102.
SHAN J M, MENG Y, LI W Y, et al.Identification and analysis of Rhubarb medicinal materials from different habitats by FT-IR and HPLC[J].Journal of Jinggangshan University (Natural Science), 2021, 42(4):96-102.
[26] LUO Y C, PAN K, ZHONG Q X.Casein/pectin nano complexes as potential oral delivery vehicles[J].International Journal of Pharmaceutics, 2015, 486(1-2):59-68.