白酒作为世界六大蒸馏酒之一,承载着中国人特殊的情怀,其中浓香型白酒占白酒行业70%以上,深受消费者喜爱[1]。浓香型白酒生产核心要素为窖泥中的微生物,水井坊高品质酒体源自600年来不间断生产所驯化的独有微生物菌群——水井坊“一号菌群”。
窖泥中微生物按照对酒体品质的贡献,分为产香微生物和协同微生物;产香微生物中研究较多的是己酸菌类,它们主要以乙醇、乙酸、葡萄糖、D-半乳糖醇、乳酸等为碳源,通过微生物发酵产生己酸,这一类微生物统称为己酸菌,主要包括梭菌属(Clostridium)、芽孢杆菌属(Bacillus)、瘤胃球菌属(Ruminococcus)和巨球型菌属(Megasphaera)等,是白酒发酵系统中的关键功能性微生物[2]。己酸作为合成己酸乙酯的前体,直接影响着浓香型白酒的品质[3]。其中,克氏梭菌(Clostridium kluyveri)被认为是产己酸的模式菌株,1937年首次由Barker从污泥中分离,该菌株主要以乙醇和乙酸为底物合成己酸和丁酸,同时产生少量丁醇和己醇[4]。研究表明,克氏梭菌最适pH值为5.8~6.8,当pH适宜时,克氏梭菌可以合成己酸;当pH>8.0或时,克氏梭菌代谢形成具有臭味的H2S,菌落形态变小,数量剧减;当pH<4.5时,克氏梭菌的生长代谢受到严重抑制[5]。而白酒生产中的某些不规范操作、窖池缺乏养护等原因,窖泥出现一系列“老化”现象:窖泥的含水量、pH值下降、己酸菌等功能菌群的代谢活力受到影响,导致浓香型白酒中风味物质含量、出酒率大幅度降低,造成企业减产[6]。因此,维持窖泥pH稳态对窖池产酒质量有着重要的作用。
传统的窖泥pH稳态理论主要基于甲烷菌属(Methanobacterium),它们在维持窖泥中的![]() 有效磷、铵态氮等主要理化指标稳态平衡中发挥着重要作用[7]。前期水井坊科研所内部研究表明,另一个潜在的pH调节机理可能依赖于窖泥中的酸性脲酶[8],这类酶主要由“一号菌群”中部分细菌分泌,通过降解窖池黄水中的尿素生成碱性的氨,调节窖泥pH值,同时可以减少由尿素和某些酿酒微生物生成的氨基甲酸乙酯(ethyl carbamate,EC)[9],如CUI等[10]将一株酸性脲酶产生菌球形赖氨酸芽抱杆菌(Lysinibacillus sphaericus)MT33加入糟醅中进行固态发酵,检验对白酒中EC的降解能力,结果表明,发酵结束时EC降解率达76.52%,尿素降解率达56.48%。目前,国内外对窖池中酸性脲酶产生菌的研究较少,且还处于实验室阶段,未对维持窖泥pH稳态进行深入研究[11]。
有效磷、铵态氮等主要理化指标稳态平衡中发挥着重要作用[7]。前期水井坊科研所内部研究表明,另一个潜在的pH调节机理可能依赖于窖泥中的酸性脲酶[8],这类酶主要由“一号菌群”中部分细菌分泌,通过降解窖池黄水中的尿素生成碱性的氨,调节窖泥pH值,同时可以减少由尿素和某些酿酒微生物生成的氨基甲酸乙酯(ethyl carbamate,EC)[9],如CUI等[10]将一株酸性脲酶产生菌球形赖氨酸芽抱杆菌(Lysinibacillus sphaericus)MT33加入糟醅中进行固态发酵,检验对白酒中EC的降解能力,结果表明,发酵结束时EC降解率达76.52%,尿素降解率达56.48%。目前,国内外对窖池中酸性脲酶产生菌的研究较少,且还处于实验室阶段,未对维持窖泥pH稳态进行深入研究[11]。
本文从水井坊“一号菌群”窖泥中筛选具有酸性脲酶产生能力的菌株,并采用模拟窖泥固态发酵将筛选菌株与产香克氏梭菌S008进行协同发酵,研究酸性脲酶产生菌对S008产香特性的影响,通过此项研究为下一步对老化窖池进行养护提供生物改良方法。
1 材料与方法
1.1 材料与试剂
窖泥、黄水、曲药等,四川水井坊股份有限公司;尿素、氢氧化钠和盐酸(均为分析纯),上海璧合生化科技有限公司;壬酸甲酯、乙醛、乙缩醛、正丙醇、正丁醇、正己醇、异戊醇、己酸、乙酸乙酯、丁酸乙酯、乳酸乙酯、己酸乙酯(均为色谱纯,纯度>98%),上海源叶生物科技有限公司;厌氧产气包、厌氧培养袋,杭州微生物试剂有限公司;细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司;土壤脲酶测试盒,南京建成生物工程研究所。试验菌株:布氏乳杆菌SJF20220162(简称S162)、科氏葡萄球菌SJF20220163(简称S163)、鲁梅利芽孢杆菌SJF20220164(简称S164)和水原拉梅尔芽孢杆菌SJF20220165(简称S165)由本实验中分离;克氏梭菌SJF20210008(简称S008),由水井坊科研所提供。
培养基配制见表1,不同菌株组合见表2。
表1 培养基的配制方法 单位:g/100 mL
Table 1 Preparation of culture medium
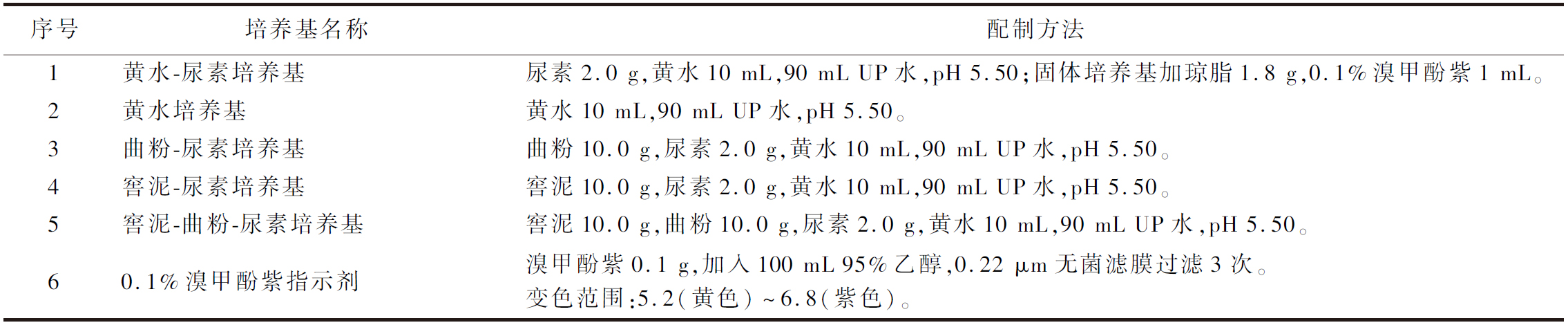
序号培养基名称配制方法1黄水-尿素培养基尿素2.0 g,黄水10 mL,90 mL UP水,pH 5.50;固体培养基加琼脂1.8 g,0.1%溴甲酚紫1 mL。2黄水培养基黄水10 mL,90 mL UP水,pH 5.50。3曲粉-尿素培养基曲粉10.0 g,尿素2.0 g,黄水10 mL,90 mL UP水,pH 5.50。4窖泥-尿素培养基窖泥10.0 g,尿素2.0 g,黄水10 mL,90 mL UP水,pH 5.50。5窖泥-曲粉-尿素培养基窖泥10.0 g,曲粉10.0 g,尿素2.0 g,黄水10 mL,90 mL UP水,pH 5.50。60.1%溴甲酚紫指示剂溴甲酚紫0.1 g,加入100 mL 95%乙醇,0.22 μm无菌滤膜过滤3次。变色范围:5.2(黄色)~6.8(紫色)。
注:尿素先配成溶液,0.22 μm无菌滤膜过滤除菌后,再加入已灭菌的培养基中。
表2 不同菌株组合
Table 2 The combination of different strains

菌株组合菌体溶液体积比备注空白组-S008、S162、S163、S164和S165-单菌发酵S162/S163/S164/S165+S0081∶1协同发酵
注:表中“S008”为水井坊科研所保存的产己酸的克氏梭菌SJF20210008,简称S008;-表示未做配比。
1.2 仪器与设备
SW-CJ-2FD超净工作台,苏州安泰空气技术有限公司;FE28-Meter pH计,上海叶拓科技有限公司;UV-6100分光光度计,上海美普达仪器有限公司;高压蒸汽灭菌锅,日本三洋公司;HZQ-X160隔水式恒温振荡培养箱,苏州培英实验设备有限公司;QP2010 Plus气相色谱-质谱联用仪,美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 酸性脲酶菌株的分离纯化
称取50.0 g窖泥于锥形瓶中,加入质量分数为0.9%无菌生理盐水,混匀,制成窖泥悬浊液,以10%接种量接种入pH值为3.5~6.0的5种培养基中(见表1的1~5)进行富集,富集培养基放入厌氧培养袋中,35 ℃、160 r/min培养7 d。分别取0~7 d的培养液,稀释后选择10-1~10-3涂布在含溴甲酚紫指示剂的黄水-尿素固体培养基上(见表1的1),35 ℃厌氧培养7 d,挑取平板上由黄色变为紫色的菌落,纯化后即为目标菌株(酸性脲酶产生菌)。
1.3.2 酸性脲酶菌的分子鉴定
采用文献[12]提取菌株DNA,以27F、1492R通用引物扩增菌株16S rRNA序列。PCR反应体系为25 μL:Taq 1.1×T3 Super PCR Mix 22 μL,上下引物各1 μL,DNA模板1 μL。PCR反应条件:98 ℃预变性2 min;98 ℃变性10 s;退火温度56 ℃,退火时间10 s,72 ℃延伸20 s,72 ℃终延伸2 min,共30个循环。PCR扩增产物送至派森诺生物科技股份有限公司,测序结果在NCBI中进行比对,确定分离菌株种属。
1.3.3 菌株的生理生化实验
对纯化后的4株菌进行形态特征观察、革兰氏染色镜检和生理生化实验,生理生化实验详细步骤参照《常见细菌系统鉴定手册》。
1.3.4 菌株产脲酶活性测定
采用土壤脲酶活性试剂盒,具体步骤参照使用说明书进行。
靛酚蓝比色法测定原理[13]:脲酶可分解尿素生成NH3,NH3与苯酚-次氯酸钠反应生成靛酚蓝,测定 OD625nm值变化,表征酶活。酶活单位定义:在常压、35 ℃、pH 6.0的条件下,每分钟分解尿素产生1 μmol NH3所需的酶量,为一个酶活力单位(U)。
1.3.5 菌株模拟窖池固态发酵实验
将4株菌及产香菌S008扩大培养15 d,离心得到菌体,调节菌体OD625nm值为0.100±0.003,使菌落数达到107 CFU/mL,得到初始种子液[14]。将初始种子液以不同组合复配后(表2)进行包埋,制作成含复配菌株的凝胶(模拟窖泥),包埋方法参照周霞[15]略作修改:称取1.0 g海藻酸钠,加入50 mL不同组合后的种子液,再加入质量分数为2%的CaCl2溶液50 mL,混匀,静置30 min形成凝胶,将凝胶装入无菌离心管中(体积为50 mL),用电钻在离心管盖子中央钻一个直径0.5 cm小孔,离心管倒置放入容量为20 L、距离罐底2/3处的发酵罐中,加入9 kg糟醅和10 L黄水覆盖,密封,35 ℃发酵室中发酵30 d,设置空白对照(加等量无菌UP水制成的凝胶),平行3组。
1.3.6 菌株对模拟窖泥pH值的影响
取出发酵30 d后的离心管,将离心管内的凝胶(模拟窖泥)3等分(上、中、下部,分别模拟深层窖泥、中间层窖泥和表层窖泥),打碎后,凝胶UP水按1∶3(g∶mL)混匀,即为凝胶溶液,静置后用pH计测定pH值[16],平行3组。
1.3.7 主要挥发性风味物质测定
用气相色谱-质谱联用法测定样品中主要挥发性风味物质,内标法定量,内标为壬酸甲酯(质量浓度为0.738 g/100 mL),以被测成分与内标溶质量浓度比为横坐标,被测成分与内标峰面积比为纵坐标,建立标准曲线,计算待测物的浓度[17]。
样品测定:样品前处理参照李梦婷等[18]略作改进:取1.3.6节凝胶溶液100 mL,加入100 mL无水乙醇,常压蒸馏,收集100 mL馏出液,摇匀。吸取10 mL馏出液,加入100 μL壬酸甲酯溶液,测定挥发性风味物质含量。
色谱-质谱条件:色谱条件:采用DB-WAX 毛细管色谱柱(60 m×250 μm×0.25 μm);载气为氦气(He),流速1.2 mL/min,分流比20∶1;柱初温35 ℃保持5 min后2.5 ℃/min升温至210 ℃,再以10 ℃/min升温至250 ℃,进样口温度230 ℃。质谱条件:电子电离(electron ionization,EI)源;电子能量70 eV;离子源温度230 ℃,扫描模式为全扫描,扫描范围29~550 m/z。
1.4 数据统计处理
系统发育树构建用软件MEGA 11.0,显著性分析用IBM SPSS Statistics 23.0,绘图用Origin 2022。
2 结果与分析
2.1 窖泥中酸性脲酶菌株的分离与鉴定
从窖泥中分离出4株可使黄水-尿素培养基由黄色变为紫色的菌株,其菌落形态(图1)和革兰氏染色(图2)为:S162为草绿色,不透明,短杆状,单个或成对排列;S163为白色,圆球形,不透明,表面光滑,串珠状排列;S164为浅白色,表面潮湿,细杆状,单个或成对排列;S165为白色,边缘呈微波状,长杆状,单个或成对排列。4株菌均为革兰氏阳性菌,其中S162为严格厌氧菌,S163、S164、S165为兼性厌氧菌。
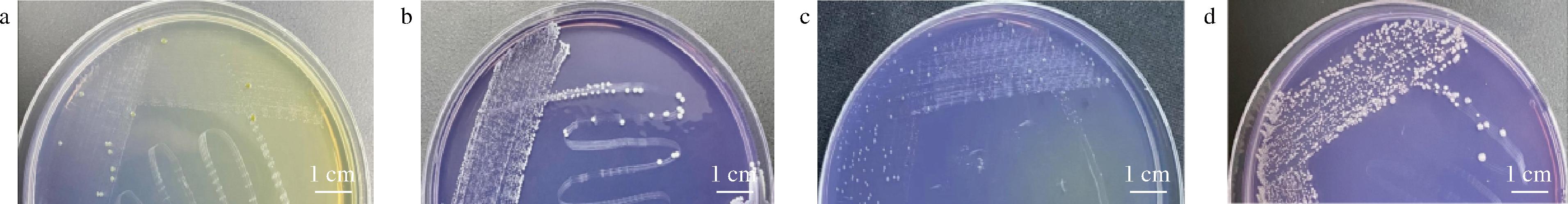
a-S162;b-S163;c-S164;d-S165
图1 菌株在溴甲酚紫-黄水-尿素培养基上的菌落形态
Fig.1 The colony morphology of the strain on yellow water urea medium with bromocresol purple
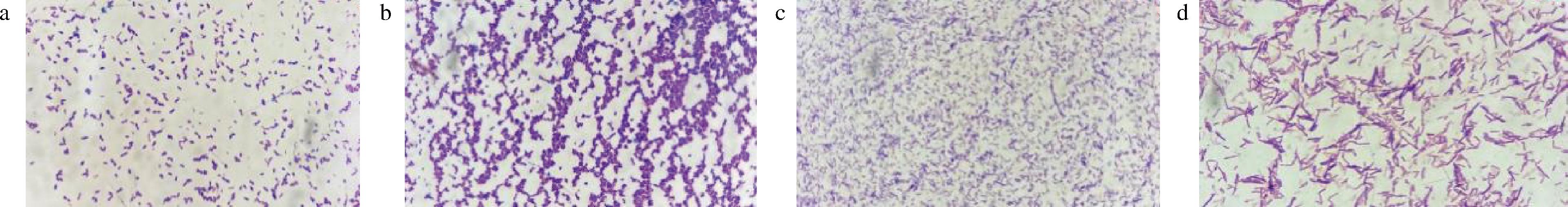
a-S162;b-S163;c-S164;d-S165
图2 革兰氏染色结果(1 000×)
Fig.2 The results of Gram′s stain for four strains(1 000×)
通过PCR扩增,16S rRNA测序,构建系统发育树(图3),鉴定出4株菌分别为布氏乳杆菌(Lactobacillus buchneri,L.buchneri),编号S162;科氏葡萄球菌(Staphylococcus cohnii,S.cohnii),编号S163;鲁梅利芽孢杆菌(Rummeliibacillus pycnus,R.pycnus),编号S164;水原拉梅尔芽孢杆菌(Rummeliibacillus suwonensis, R.suwonensis),编号S165。
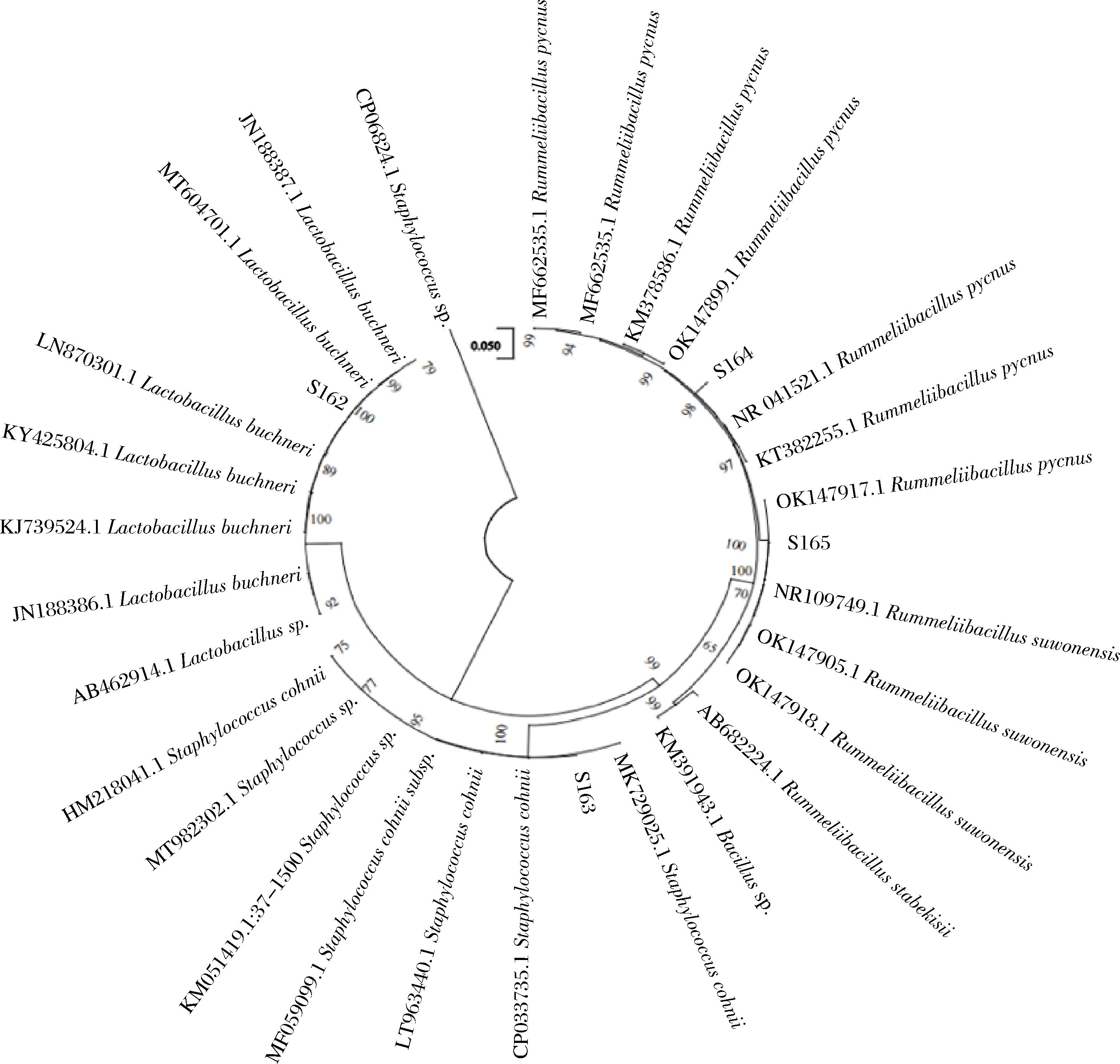
图3 四株菌的16S rRNA系统发育树
Fig.3 The 16S rRNA phylogenetic tree of four strains
4株菌的生理生化实验结果为:接触酶试验、葡萄糖试验均为阳性,硫化氢试验均为阴性,其余结果如表3所示,结合《常见细菌系统鉴定手册》和《伯杰氏细菌鉴定手册》,表明筛选到的4株菌符合酸性脲酶菌的基本特征。
表3 四株酸性脲酶菌株的生理生化实验结果
Table 3 The results of physiological and biochemical experiment of four acid urease producing strains
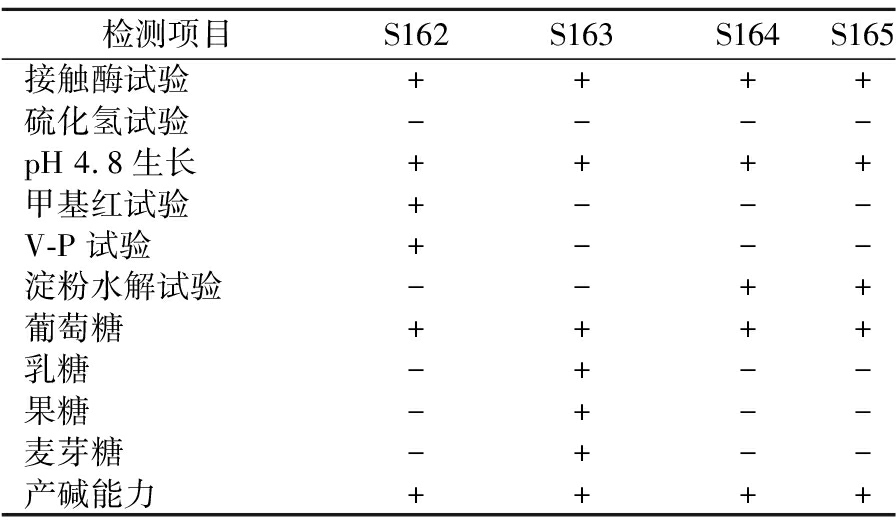
检测项目S162S163S164S165接触酶试验++++硫化氢试验----pH 4.8生长++++甲基红试验+---V-P试验+---淀粉水解试验--++葡萄糖++++乳糖-+--果糖-+--麦芽糖-+--产碱能力++++
注:“+”为阳性;“-”为阴性。
2.2 菌株产脲酶活性的测定
4株菌的脲酶活性,如图4所示,其中S163脲酶活性最高(1.51 U/mL),其余3株菌脲酶活性为0.45~0.98 U/mL。杨广明等[19]从小鼠消化系统中筛选到一株初始酶活为0.63 U/mL的产酸性脲酶普罗威登斯菌(Providencia sp.),优化培养基后提高到0.87 U/mL;YANG等[20]将产酸性脲酶罗伊氏乳杆菌(Lactobacillus reuteri)CICC6124在乳酸乳球菌(Lactococcus lactis)NZ9000中进行重组表达后,脲酶活力达到11.56 U/mL,这是目前食品级酸性脲酶的最高产量。本文4株菌的脲酶活性为0.45~1.51 U/mL,表明产脲酶能力优良,可用于后续实验。
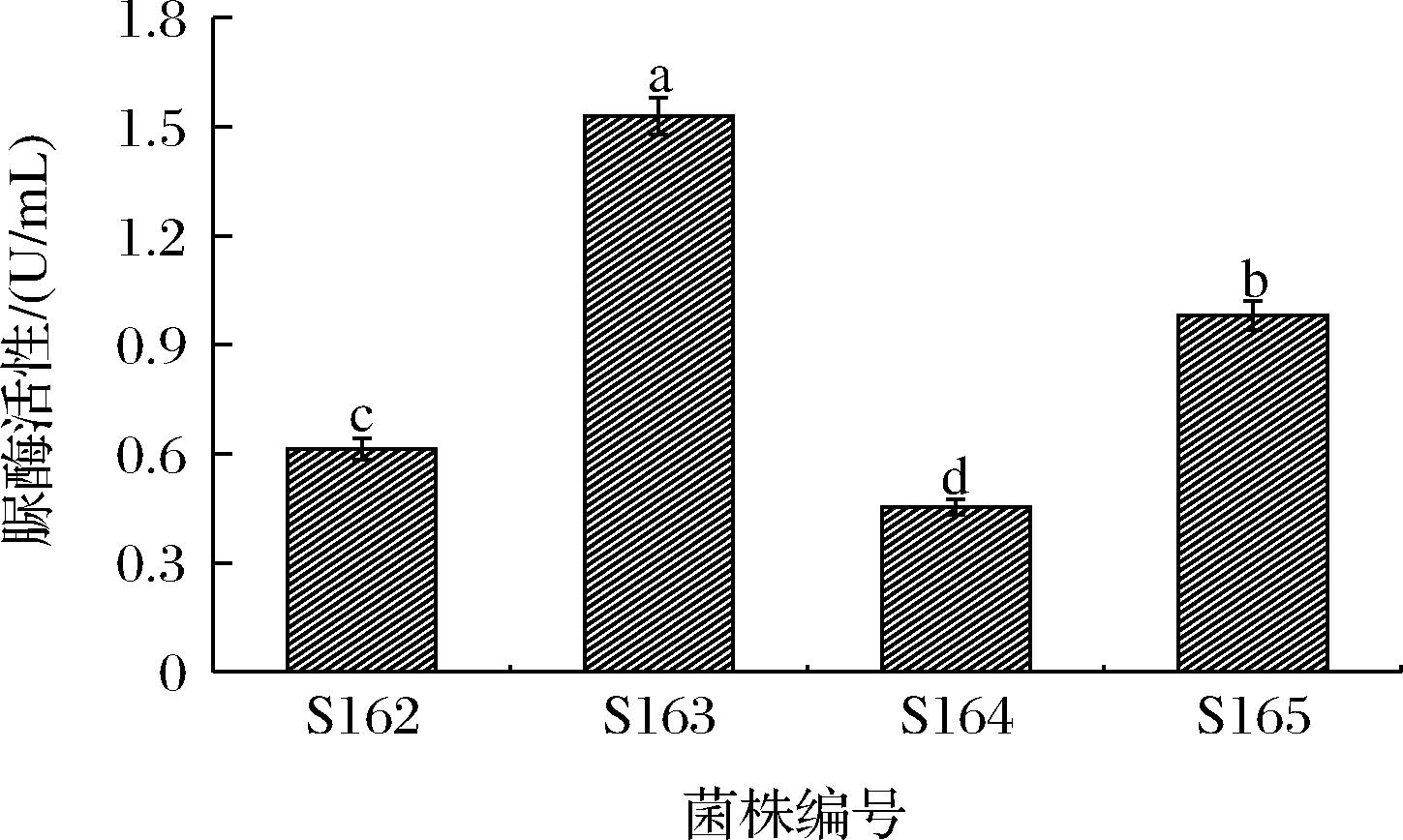
图4 四株菌的脲酶活性测定结果
Fig.4 The determination results of urease activities of four strains
注:不同小写字母表示有显著差异(P<0.05)(下同)。
2.3 菌株对模拟窖泥pH值的影响
窖泥作为微生物栖息的场所,窖泥pH值高低与白酒品质好坏息息相关,适宜pH的窖泥不仅能促进微生物的代谢,还能促进多种风味物质形成,提高白酒的品质[21]。
用pH计测定模拟窖泥上、中、下3个部位的pH值(表4),结果为:上部(模拟深层窖泥)>中部(模拟中层窖泥)>下部(模拟表层窖泥),协同发酵>单菌发酵。其中,S163单菌发酵和协同发酵后pH值均大于其余菌株(P<0.05),说明产碱能力最强;而S164和S165协同发酵后pH值相对较低,原因可能是糟醅中乳酸杆菌在发酵中后期属于强势菌群,数量较多,生长过程中会产生大量乳酸,抑制弱势菌株S164和S165的生长[22],再加上S008产生的酸性物质(己酸、丁酸等)对4株菌的pH值有降低作用,因此产碱能力相对较低。
表4 模拟窖泥在上、中、下层的pH值
Table 4 pH value of upper, middle, and lower layers in pit model
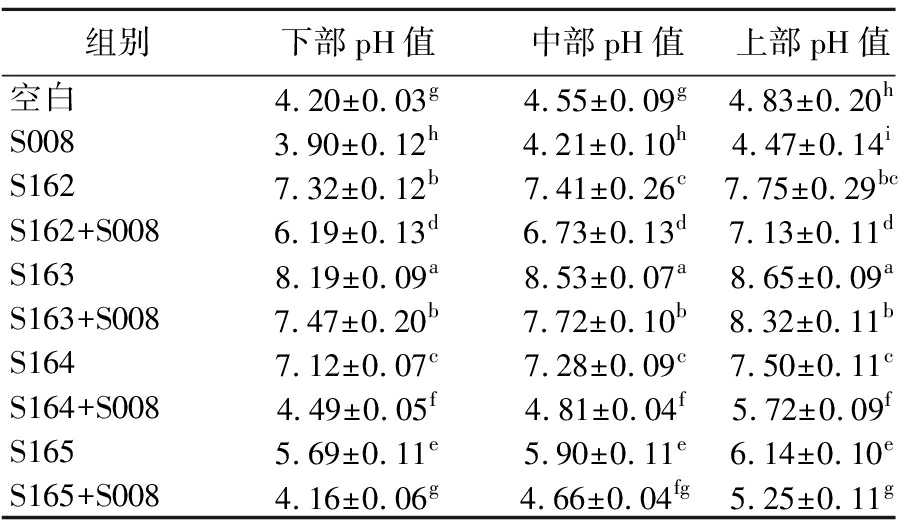
组别下部pH值中部pH值上部pH值空白4.20±0.03g4.55±0.09g4.83±0.20hS0083.90±0.12h4.21±0.10h4.47±0.14iS1627.32±0.12b7.41±0.26c7.75±0.29bcS162+S0086.19±0.13d6.73±0.13d7.13±0.11dS1638.19±0.09a8.53±0.07a8.65±0.09aS163+S0087.47±0.20b7.72±0.10b8.32±0.11bS1647.12±0.07c7.28±0.09c7.50±0.11cS164+S0084.49±0.05f4.81±0.04f5.72±0.09fS1655.69±0.11e5.90±0.11e6.14±0.10eS165+S0084.16±0.06g4.66±0.04fg5.25±0.11g
注:同一列的不同小写字母表示相同部位不同菌株组合之间pH值差异显著(P <0.05)。
2.4 菌株对模拟窖泥中主要挥发性风味物质的影响
2.4.1 醛类物质的测定
白酒中乙醛和乙缩醛占醛类物质的98%左右,起到协调白酒香气、衡量品质优劣和老熟程度的作用。乙醛被酸催化后产物为乙缩醛,乙醛因沸点较低(20.2 ℃),且在基酒贮存过程中呈现逐渐减少的趋势,因此卫生标准中对乙醛和乙缩醛的要求较低[23]。
本文中将4株菌与克氏梭菌S008包埋发酵后,共检测到2种醛类,即乙醛和乙缩醛,且含量相对较低,在0.12~2.50 mg/100 mL。在乙缩醛测定中,协同发酵后S163乙醛含量最高(2.38 mg/100 mL),4株菌与S008协同发酵后乙醛含量是S008单菌发酵的2.06~2.98倍,在乙缩醛含量测定中,协同发酵后S162表现出了较强的产乙缩醛的能力(2.50 mg/100 mL),4株菌与S008协同发酵后乙缩醛含量是S008单菌发酵的1.65~3.12倍。综上所述,S163和S162在产乙醛和乙缩醛能力高于其他2株Rummeliibacillus。具体见图5。
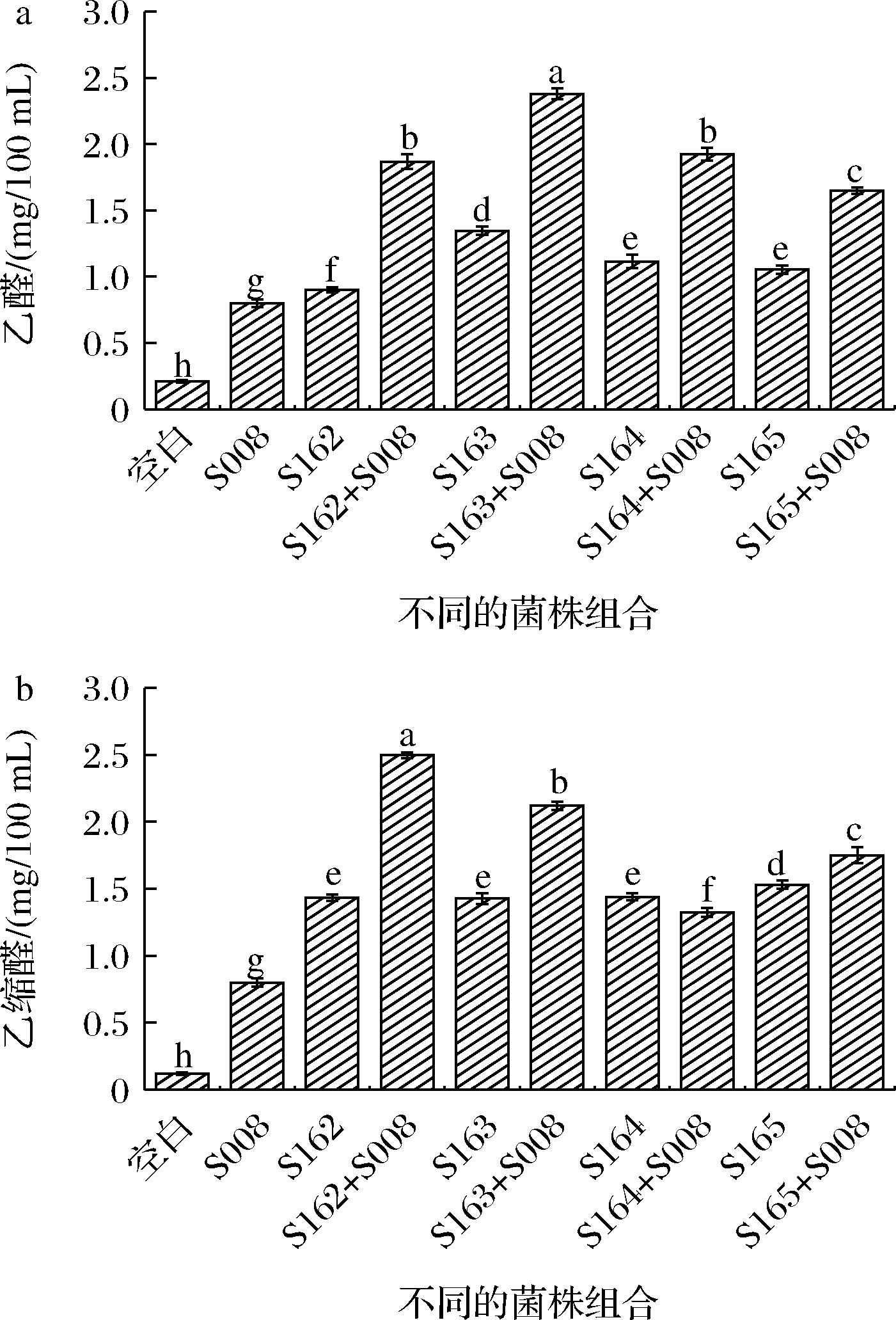
a-乙醛;b-乙缩醛
图5 不同菌株组合中乙醛和乙缩醛的含量变化
Fig.5 Changes of acetaldehyde and acetal content in different strain combinations
2.4.2 高级醇的测定
浓香型白酒中的高级醇主要为正丙醇、正丁醇、异丁醇和异戊醇,在发酵过程中作为酵母的次生代谢物产生。高级醇具有甜味,是浓香白酒中的重要香味成分,但含量过高会使人“上头”,因此在白酒卫生标准中要求严格控制在0.2~1.0 g/mL[24],即(0.2~1.0)×105 mg/100 mL。
本文检测到4种高级醇,如表5所示,高级醇含量单菌发酵后为0.32~9.33 mg/100 mL,协同发酵后为0.36~8.92 mg/100 mL。经计算,协同发酵是S008单菌发酵的1.41~1.97倍、0.92~1.85倍、0.66~1.58倍、1.13~1.69倍。总体来看,协同发酵后对高级醇的提升并不明显,且产生的高级醇含量在白酒卫生标准规定范围内,表明后续运用到窖池中对高级醇的总量影响不大,可以保证浓香白酒品质不受影响。
表5 不同菌株组合后高级醇含量
Table 5 Content of higher alcohol in different strain combinations
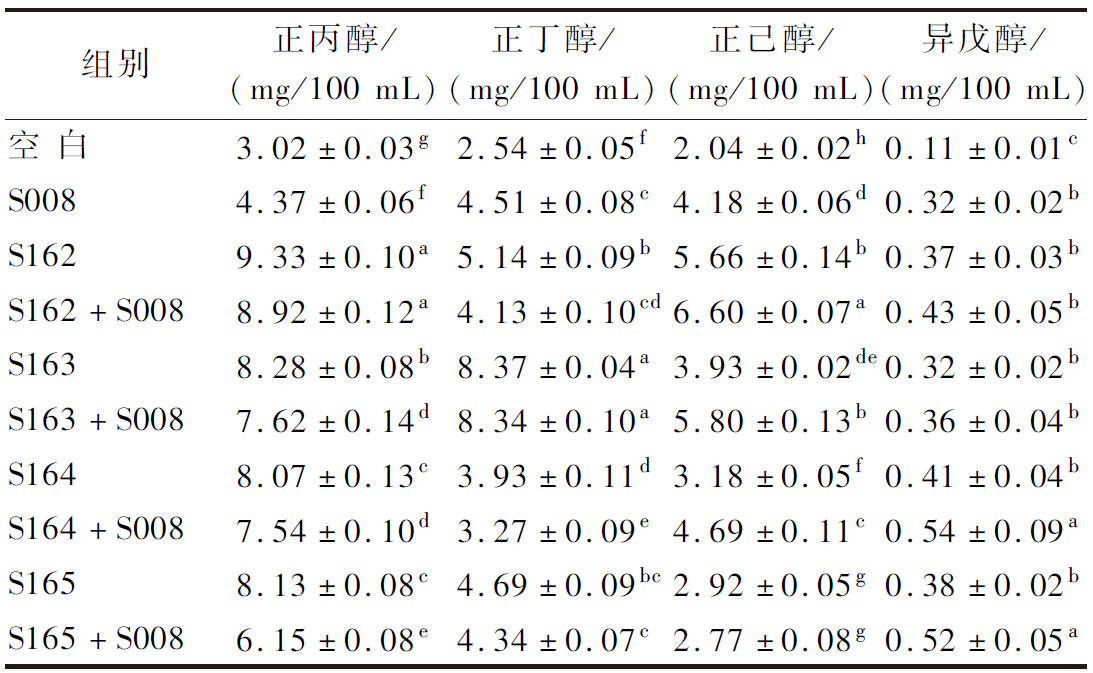
组别正丙醇/(mg/100 mL)正丁醇/(mg/100 mL)正己醇/(mg/100 mL)异戊醇/(mg/100 mL)空 白3.02±0.03g2.54±0.05f2.04±0.02h0.11±0.01cS0084.37±0.06f4.51±0.08c4.18±0.06d0.32±0.02bS1629.33±0.10a5.14±0.09b5.66±0.14b0.37±0.03bS162+S0088.92±0.12a4.13±0.10cd6.60±0.07a0.43±0.05bS1638.28±0.08b8.37±0.04a3.93±0.02de0.32±0.02bS163+S0087.62±0.14d8.34±0.10a5.80±0.13b0.36±0.04bS1648.07±0.13c3.93±0.11d3.18±0.05f0.41±0.04bS164+S0087.54±0.10d3.27±0.09e4.69±0.11c0.54±0.09aS1658.13±0.08c4.69±0.09bc2.92±0.05g0.38±0.02bS165+S0086.15±0.08e4.34±0.07c2.77±0.08g0.52±0.05a
注:同一列的不同小写字母表示同种高级醇在不同菌株组合之间差异显著(P <0.05)。
TANG等[25]发现乳酸菌在发酵后期占主导地位,表明乳酸菌可能在白酒发酵后期发挥了关键作用,为正丙醇合成提供了可能性,使正丙醇含量增加,本文中布氏乳杆菌的产正丙醇含量也相对较高,结果一致。TANG等[25]还指出,合理的发酵时间(30~60 d),可提高白酒中风味成分的多样性,过长发酵时间(>60 d)会带来白酒产量下降、高级醇过度积累等负面影响。因此,本文设置的发酵时间为30 d,控制合适的发酵时间有利于平衡风味成分和提高白酒产量。
2.4.3 己酸含量测定
白酒中的酸类物质(占15%左右)在降低白酒苦味、协调口感、柔和香气等方面贡献巨大,己酸作为浓香型白酒中主体风味物质(己酸乙酯)的前体物质,对白酒的品质有着重要的影响[26]。
将4株菌与S008固态发酵后,结果见图6。己酸含量:协同发酵>单菌发酵,表明多种功能菌混合发酵可以提高白酒中己酸含量,YAN等[27]将C.kluyveri H588和产甲烷菌166混合发酵后己酸含量明显高于单独发酵,表明混合发酵可以通过“种间氢转移”的方式提高己酸产量,与本实验结果一致。
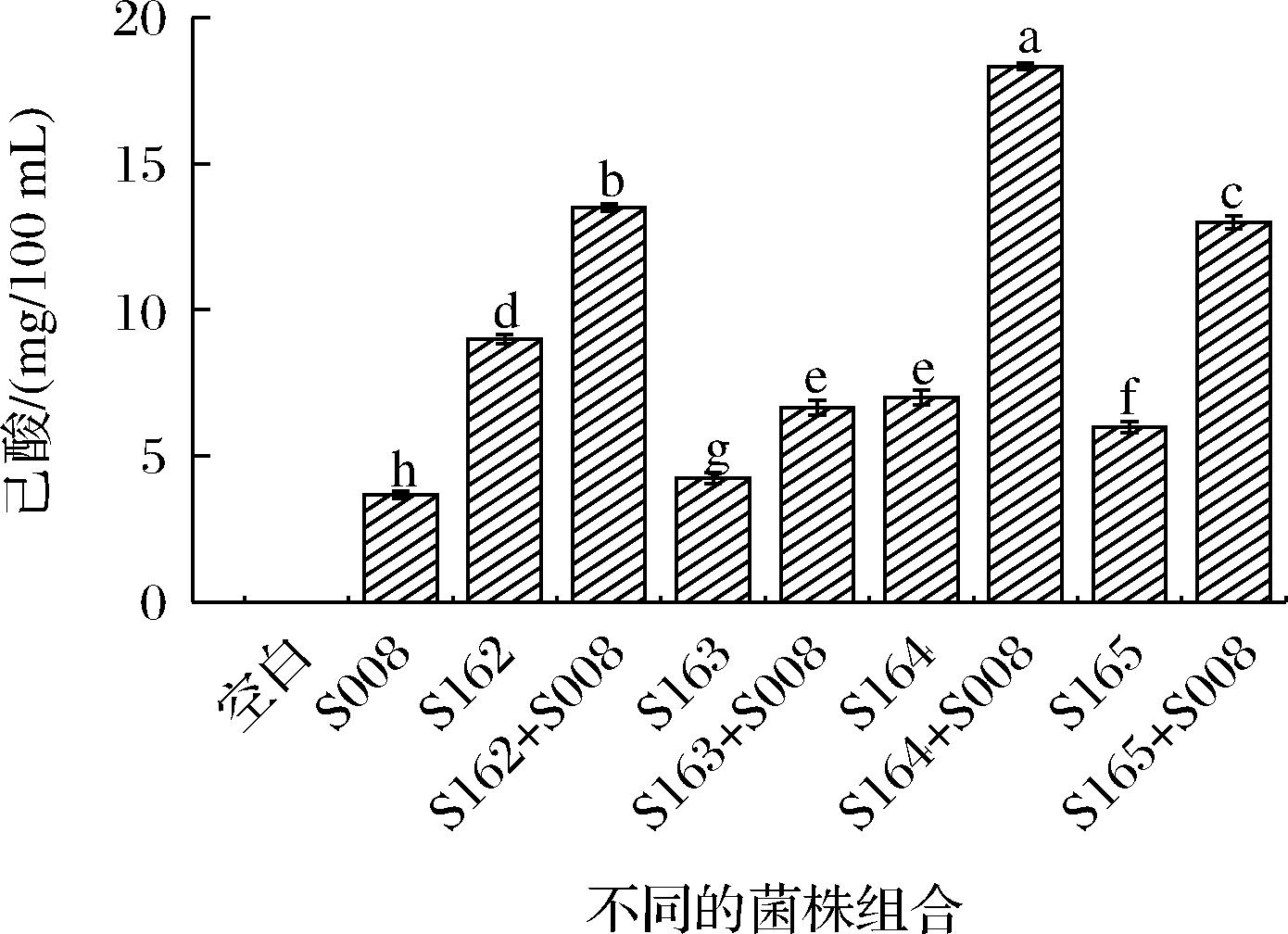
图6 不同菌株组合中己酸的含量变化
Fig.6 Changes of acetal content in different strain combinations
单菌发酵中S162己酸最高(9.00 mg/100 mL),协同发酵中S164最高(18.33 mg/100 mL)。经计算,协同发酵后己酸含量是S008单菌发酵的1.82~5.00倍,且S164协同发酵后含量提升最大。OUDE ELFERINK等[28]发现L.buchneri可以利用环境中的乳酸生成乙酸和丙二醇,而乙酸是克氏梭菌形成己酸的前体物质,因此协同发酵后己酸含量上升;还有研究表明Rummeliibacillus具有产己酸的能力[29],LIU等[30]从窖泥中分离出1株己酸产量高达4.064 g/L的R.suwonensis 3B-1,结合基因组注释,实现4.627 g/L的己酸高产率。本实验的2株Rummeliibacillus己酸产量相对较高,后续可进一步筛选,实现高产己酸的目的。
2.4.4 酯类物质的测定
白酒中酯类物质沸点较低,蒸馏后最容易进入基酒中,具有多种水果香气,是白酒风味的主要组成部分。浓香型白酒中酯类主要是己酸乙酯、乙酸乙酯、丁酸乙酯和乳酸乙酯,占浓香型白酒中总酯的90%以上,简称“四大酯”[31]。
酯类物质协同发酵后如表6所示,4株菌与S008协同发酵产酯能力显著优于单菌发酵(P<0.05),单菌发酵后为0.94~26.00 mg/100 mL,协同发酵后为4.20~30.05 mg/100 mL。经计算,协同发酵后“四大酯”含量是S008单菌发酵的2.66~5.02倍、1.21~4.85倍、1.33~3.31倍、1.27~2.86倍。本实验中协同发酵后己酸乙酯含量整体高于其余3种酯,表明浓香型风味特征突出;S164和S165也表现出了较好的产己酸乙酯的能力,可提高浓香型白酒整体品质。ZHOU等[32]将窖泥中筛选的4株功能菌(水原拉梅尔芽孢杆菌RsM31和RsM42、布氏乳杆菌LbA7和酪丁酸梭菌A6)进行固态发酵,结果表明菌株RsM31、RsM42和LbA7能明显促进己酸乙酯、丁酸乙酯和乙酸乙酯的合成,而乳酸乙酯略有下降,可明显提高浓香型白酒的品质。
表6 不同菌株组合的酯类物质的含量
Table 6 Content of esters in different strain combinations
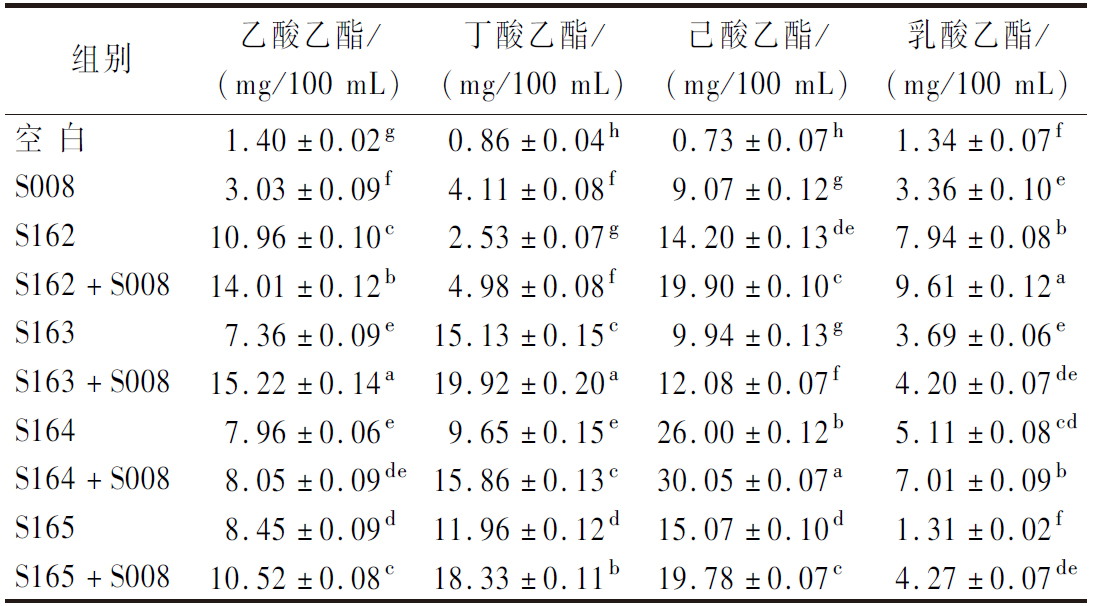
组别乙酸乙酯/(mg/100 mL)丁酸乙酯/(mg/100 mL)己酸乙酯/(mg/100 mL)乳酸乙酯/(mg/100 mL)空 白1.40±0.02g0.86±0.04h0.73±0.07h1.34±0.07fS0083.03±0.09f4.11±0.08f9.07±0.12g3.36±0.10eS16210.96±0.10c2.53±0.07g14.20±0.13de7.94±0.08bS162+S00814.01±0.12b4.98±0.08f19.90±0.10c9.61±0.12aS1637.36±0.09e15.13±0.15c9.94±0.13g3.69±0.06eS163+S00815.22±0.14a19.92±0.20a12.08±0.07f4.20±0.07deS1647.96±0.06e9.65±0.15e26.00±0.12b5.11±0.08cdS164+S0088.05±0.09de15.86±0.13c30.05±0.07a7.01±0.09bS1658.45±0.09d11.96±0.12d15.07±0.10d1.31±0.02fS165+S00810.52±0.08c18.33±0.11b19.78±0.07c4.27±0.07de
注:同一列的不同小写字母表示同种酯类物质在不同菌株组合之间差异显著(P <0.05)。
3 讨论
窖泥是浓香型白酒生产中不可缺少的重要组成成分,窖泥中的微生物群落随着窖池反复发酵过程,不断进行自然选择、驯化、富集,最终形成了稳定且功能多样性的窖泥微生物生态系统,这些微生物群落的种类、数量、群落结构演替及相互作用直接影响浓香型白酒的香气和质量[33]。栖息在窖泥中的微生物,经过续糟配料,在“以窖养糟、以糟养窖”的循环过程中,不断驯化富集,其代谢产物之间相互转化,形成了浓香型白酒独特“窖香”风格[34]。
本实验用于筛选酸性脲酶菌株的培养基营养成分均来自于窖池发酵体系,以保证菌株应用到窖池中不会失活,且筛选到的4株酸性脲酶产生菌与报道的酸性脲酶存在于Lactobacillus、Streptococcus、Lactobacillus、Staphylococcus、Escherichia、Morganella、Lacobacillus reuteri等中[35]相符合,表明筛选结果可靠。现阶段,窖泥养护液通常是以糟醅、黄水、曲粉、优质老窖泥、己酸菌液和其他功能菌液等按一定比例配制而成,对老化后的窖池进行养护,为窖池中多种微生物的生长代谢提供适宜的条件[36]。目前,相关研究中大部分是将克氏梭菌与白酒中主要微生物,如放线菌[37]、甲烷菌[38]等制备成窖泥养护液,而与本文筛选出的酸性脲酶菌株S.cohnii、R.pycnus和R.suwonensis复配的报道几乎没有,且在实际生产过程中还存在窖泥养护液的配制比例、窖池打孔淋窖的方式和方位、运用于新窖池和老窖池的差异等一系列问题[6,39],因此还需进行更加深入、细致的研究。
此外,本文还筛选出了2株酸性脲酶菌株Rummeliibacillus,并将Rummeliibacillus和产香菌S008(厌氧杆菌属)复配后进行固态发酵,利用厌氧菌群利用发酵体系中的乙醇、乙酸、乳酸等底物,增加己酸产量,进而提高浓香白酒品质。相关研究还发现Rummeliibacillus可将硝酸盐还原为亚硝酸盐,耐受毒性能力较强,有很好的应用前景[29]。此外,与其他己酸菌相比,Rummeliibacillus可以利用碳源范围广,易培养,更易产生己酸,未来可通过诱变和代谢工程可以进一步提高菌株己酸的产量[30]。后续有机会可将筛选到的4株酸性脲酶菌与S008制备成窖泥养护液,对老化后的窖池进行养护,提高窖泥品质和原酒质量。
4 结论
本文从水井坊窖泥“一号菌群”中筛选分离出4株酸性脲酶产生菌,经16S rRNA同源性序列比对、生理生化实验,并结合系统发育树,鉴定并命名4株酸性脲酶产生菌分别为:Lactobacillus buchneri S162、Staphylococcus cohnii S163、Rummeliibacillus pycnus S164和Rummeliibacillus suwonensis S165。4株菌的脲酶活性在0.45~1.51 U/mL,将4株菌与产香克氏梭菌S008复配后包埋,模拟窖池固态发酵,结果表明筛选出的4株酸性脲酶产生菌发酵性能较好,包埋后不同程度提高了模拟窖泥pH值及主要挥发性风味物质的含量,具有较好的应用前景。
[1] YAN S B, JIA Y L, ZHANG Q, et al.Bacterial diversity associated with volatile compound accumulation in pit mud of Chinese strong-flavor baijiu pit[J].AMB Express, 2023, 13(1):3.
[2] YUAN S Q, JIN Z Y, ALI A, et al.Caproic acid producing bacteria in Chinese Baijiu brewing[J].Frontiers in Microbiology, 2022, 13:883142.
[3] LUO H, LI T, ZHENG J, et al.Isolation, identification, and fermentation medium optimization of a caproic acid producing Enterococcus casseliflavus strain from pit mud of Chinese strong flavor Baijiu ecosystem[J].Polish Journal of Microbiology, 2022, 71(4):563-575.
[4] BARKER H A, TAHA S M.Clostridium kluyverii, an organism concerned in the formation of caproic acid from ethyl alcohol[J].Journal of bacteriology, 1942, 43(3):347-363.
[5] 姚继承, 殷成浩, 屈光伟, 等.窖池养护的基本原理与实践[J].酿酒科技, 2014(6):74-76;79.
YAO J C, YIN C H, QU G W, et al.The basic principle and practice of pits maintenance[J].Liquor-Making Science &Technology, 2014(6):74-76;79.
[6] 魏云, 李增, 高志远, 等.一种复合型窖泥养护方法的研究及应用[J].酿酒, 2022, 49(4):100-102.
WEI Y, LI Z, GAO Z Y, et al.Research and application of compound cellar mud maintenance method[J].Liquor Making, 2022, 49(4):100-102.
[7] HU X L, DU H, REN C, et al.Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Applied and Environmental microbiology, 2016, 82(8):2506-2515.
[8] ZHANG A N, LIU K, CAO J J, et al.Staphylococcus cohnii HFUTY-08:A novel acid urease-producing strain[J].Annals of Microbiology, 2018, 68(6):365-374.
[9] LIU J, XU Y, NIE Y, et al.Optimization production of acid urease by Enterobacter sp.in an approach to reduce urea in Chinese rice wine[J].Bioprocess and Biosystems Engineering, 2012, 35(4):651-657.
[10] CUI K X, WU Q, XU Y, et al.Biodegradation of ethyl carbamate and urea with Lysinibacillus sphaericus MT33 in Chinese liquor fermentation[J].Journal of Agricultural and Food Chemistry, 2018, 66(6):1583-1590.
[11] 张傲娜. 高产酸性脲酶菌株的筛选及该酶在黄酒中的应用[D].合肥:合肥工业大学, 2018.
ZHANG A N.The Isolation of acid urease producing strain and its application in Chinese rice wine[D].Hefei:Hefei University of Technology, 2018.
[12] REN D Y, ZHU J W, GONG S J, et al.Antimicrobial characteristics of lactic acid bacteria isolated from homemade fermented foods[J].Biomed Research International.2018:5416725.
[13] ZHANG Q, ZHA X H, ZHOU N D, et al.Preparation of crosslinked enzyme aggregates (CLEAs) of acid urease with urethanase activity and their application[J].Journal of basic microbiology, 2016, 56(4):422-431.
[14] 刘青阳, 黄晓宁, 陆玮, 等.中高温大曲中芽孢杆菌多样性及代谢特征研究[J].中国酿造, 2022, 41(7):26-31.
LIU Q Y, HUANG X N, LU W, et al.Diversity and metabolic characteristics of Bacillus strains isolated from medium-high temperature Daqu[J].China Brewing, 2022, 41(7):26-31.
[15] 周霞. 解淀粉芽孢杆菌脲酶基因在枯草芽孢杆菌中的重组表达及尿素降解应用研究[D].无锡:江南大学, 2021.
ZHOU X.Heterologous expression of urease-encoded gene from Bacillus amyloliquefaciens in recombinant Bacillus subtilis and its application in urea degradation[D].Wuxi:Jiangnan University, 2021.
[16] 张会敏, 孟雅静, 王艳丽, 等.浓香型白酒窖池分层分位点池底窖泥pH值、主要有机酸与钙、镁离子之间的相关性分析[J].食品科学, 2020, 41(19):90-97.
ZHANG H M, MENG Y J, WANG Y L, et al.Correlation analysis between pH, major organic acids, calcium and magnesium ions of stratified bottom-pit-mud from Chinese strong-flavor Baijiu pit[J].Food Science, 2020, 41(19):90-97.
[17] AO L, GUO K, DAI X R, et al.Quick classification of strong-aroma types of base Baijiu using potentiometric and voltammetric electronic tongue combined with chemometric techniques[J].Frontiers in Nutrition, 2022, 9:977929.
[18] 李梦婷, 许德富, 敖宗华, 等.整粒高粱投料浓香型白酒糟醅超长发酵及回酒蒸馏研究[J].中国酿造, 2022, 41(6):117-121.
LI M T, XU D F, AO Z H, et al.Super-long fermentation of fermented grain of strong-flavor Baijiu fed with whole sorghum and Baijiu-returning distillation[J].China Brewing, 2022, 41(6):117-121.
[19] 杨广明, 查小红, 田亚平.一种氨基甲酸乙酯与尿素降解酶产生菌的鉴定及酶学特性[J].食品与生物技术学报, 2015, 34(1):7-14.
YANG G M, ZHA X H, TIAN Y P, et al.Identification and enzyme characterization of a urease and urethanase-producing strain[J].Journal of Food Science and Biotechnology, 2015, 34(1):7-14.
[20] YANG Y Q, KANG Z, ZHOU J L, et al.High-level expression and characterization of recombinant acid urease for enzymatic degradation of urea in rice wine[J].Applied Microbiology and Biotechnology, 2015, 99(1):301-308.
[21] WU L T, FAN J Y, CHEN J, et al.Chemotaxis of Clostridium strains isolated from pit mud and its application in Baijiu fermentation[J].Foods, 2022, 11(22):3639.
[22] WANG J L, LU C S, XU Q, et al.Bacterial diversity and lactic acid bacteria with high alcohol tolerance in the fermented grains of soy sauce aroma type baijiu in North China[J].Foods, 2022, 11(12):1794.
[23] 石应国, 杨生智, 吕林杰, 等.固态白酒蒸馏分级冷凝降杂的研究[J].酿酒科技, 2022, 340(10):61-64.
SHI Y G, YANG S Z, LYU L J, et al.Impurity reduction of Baijiu by gradient condensation during solid-state distillation[J].Liquor-Making Science &Technology, 2022, 340(10):61-64.
[24] 范培文, 刘蒲临, 张明春, 等.浓酱兼香型白酒发酵酒醅微生物群落及理化指标对正丙醇产出的影响[J].中国酿造, 2022, 41(7):32-37.
FAN P W, LIU P L, ZHANG M C, et al.Effects of microbial community and physicochemical indexes of fermented grains of strong-sauce-flavor Baijiu on n-propanol production[J].China Brewing, 2022, 41(7):32-37.
[25] TANG J, LIU Y C, LIN B, et al.Effects of ultra-long fermentation time on the microbial community and flavor components of light-flavor Xiaoqu Baijiu based on fermentation tanks[J].World Journal of Microbiology &Biotechnology, 2021, 38(1):3.
[26] WANG G N, SONG X B, ZHU L, et al.A flavoromics strategy for the differentiation of different types of Baijiu according to the non-volatile organic acids[J].Food Chemistry, 2022, 374:131641.
[27] YAN S B, DONG D.Improvement of caproic acid production in a Clostridium kluyveri H068 and Methanogen 166 co-culture fermentation system.AMB Express[J].2018, 25:8(1):175.
[28] OUDE ELFERINK S J W H, KROONEMAN J, GOTTSCHAL J C, et al.Anaerobic conversion of lactic acid to acetic acid and 1, 2-propanediol by Lactobacillus buchneri[J].Applied and Environmental Microbiology, 2001, 67(1):125-132.
[29] 张惠芳, 张婉莹, 周索, 等.赊店老酒窖池中产己酸菌分离鉴定及产酸条件研究[J].现代食品科技, 2023, 39(2):188-196.
ZHANG H F, ZHANG W Y, ZHOU S, et al.Isolation and screening of caproic acid-producing bacteria from Shedian Laojiu cellar and acid production conditions[J].Modern Food Science and Technology, 2023, 39(2):188-196.
[30] LIU C J, DU Y F, ZHENG J, et al.Production of caproic acid by Rummeliibacillus suwonensis 3B-1 isolated from the pit mud of strong-flavor baijiu[J].Journal of Biotechnology.2022, 358(10):33-40.
[31] XU Y Q, ZHAO J R, HUANG H Q, et al.Biodegradation of phthalate esters by Pantoea dispersa BJQ0007 isolated from Baijiu[J].Journal of Food Composition and Analysis, 2022, 105:104201.
[32] ZHOU W, XIA Y, ZHAO Y J, et al.Study on the effect of key genes ME2 and adhE during Luzhou-flavor Baijiu brewing[J].Foods, 2022, 11(5):700.
[33] PU S C, YAN S B.Fungal diversity profiles in pit mud samples from Chinese strong-flavour liquor pit[J].Foods, 2022, 11(22):3544.
[34] XU X H, CHANG Q, SUN W, et al.Analysis of prokaryotic community succession in vertical dimension of Wenwang Chinese strong-flavor Baijiu pit muds and its correlation with physicochemical indexes[J].Science and Technology of Food Industry, 2022, 43, 129-136.
[35] 刘庆涛, 康振, 堵国成.微生物酶法消除黄酒中氨基甲酸乙酯研究进展[J].生物工程学报, 2019, 35(4):567-576.
LIU Q T, KANG Z, DU G C.Advances in microbial enzymatic elimination of ethyl carbamate in Chinese rice wine[J].Chinese Journal of Biotechnology 2019, 35(4):567-576.
[36] 成冬冬, 董灿灿, 韩小龙, 等.浓香型大曲白酒窖池微生物及养护研究进展[J].食品科技, 2022, 47(12):15-19.
CHENG D D, DONG C C, HAN X L, et al.Research progress on microorganism and maintenance of Luzhou-Flavor daqu liquor pit[J].Food Science and Technology, 2022, 47(12):15-19.
[37] CHEN C, YANG H Q, LIU J, et al.Systematic review of Actinomycetes in the Baijiu fermentation microbiome[J].Foods, 2022, 11(22):3551.
[38] TAO Y, WANG X, LI X Z, et al.The functional potential and active populations of the pit mud microbiome for the production of Chinese strong-flavour liquor[J].Microbial Biotechnology, 2017, 10(6):1603-1615.
[39] 海超. 窖泥老化原因浅析及预防措施探讨[J].食品与发酵科技, 2022, 58(1):136-139.
HAI C.Causes analysis and preventive measures of pit mud aging[J].Sichuan Food and Fermentation, 2022, 58(1):136-139.