黄芪作为传统中药材,早在《神农本草经》中就存在使用记载,其含有多糖、皂苷、黄酮等多种有效成分,具有补气固表、利尿消肿、托毒生肌的功效,在中医治疗中得到广泛利用[1]。目前黄芪已被列入《药食同源目录大全》,在医药、食品、保健品等领域有不少以黄芪为成分的产品得到开发利用。且黄芪性温,适宜气血不足、气短乏力、体虚者食用,对于患有慢性肾炎、慢性肝炎、慢性溃疡等慢性炎症的患者被认为可常食,对其症状具有一定的改善作用[2]。
慢性萎缩性胃炎(chronic atrophic gastritis,CAG)则是目前临床高发的消化道疾病,其特点是腺体萎缩消失、黏膜细胞被化生细胞或纤维化所取代。CAG与肠上皮化生(IM病变)、发育不良增生一起被认为是炎症反应向肠型胃癌(gastric cancer,GC)过度的重要步骤之一[3]。而黄芪甲苷(astragaloside Ⅳ)作为黄芪的主要有效成分,可能也具备和黄芪相似的功能。有研究表明,黄芪甲苷可以减少慢性萎缩性胃炎大鼠胃黏膜的病理损伤和萎缩[4]。此外,慢性萎缩性胃炎的形成和发展是个长期的过程,相较于直接使用药物治疗,借助药食同源的基本思想进行预防会是更好的选择。所以以黄芪甲苷为主要成分的保健食品来进行生理调节和预防慢性萎缩性胃炎可能具有一定价值[5]。
网络药理学是近年发展的、基于计算机的预测技术,可快速、高效预测化合物作用于疾病的多个靶点,为探究化合物对疾病的作用提供一定帮助[6]。所以为了探索黄芪甲苷作为保健食品的应用潜力和价值,本研究借助网络药理学技术预测黄芪甲苷对CAG的作用靶点,分析靶点富集的信号通路,来研究黄芪甲苷是否能作为保健食品的有效成分来预防CAG。
1 材料与方法
1.1 实验材料
1.1.1 数据库及软件
PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)、Swiss target prediction数据库(http://www.Swisstargetprediction.ch)、PharmMapper数据库(http://lilab-ecust.cn/pharmmapper/index.html)[7-9]、UniProt数据库(https://www.uniprot.org/)、OMIM数据库(https://www.omim.org/)、Genecards数据库(https://www.genecards.org/)、DisGeneT数据库(https://www.disgenet.org/)、STRING数据库(https://cn.string-db.org/)、RCSB PDB数据库(http://www.rcsb.org/)、Venn 2.1(https://bioinfogp.cnb.csic.es/tools/venny/index.html)、微生信在线平台(http://www.bioinformatics.com.cn/)、Cytoscape、PyMOL、AutoDock Vina、GraphPad Prism 8.0.2。
1.1.2 实验试剂
黄芪甲苷(98%)、1-甲基-3-硝基-1-亚硝基胍(1-methyl-3-nitro-1-nitrosoguanidine,MNNG,95%+)、胎牛血清、PBS(1×pH 7.2~7.4)、青霉素-链霉素溶液(100×),Adamas Life公司;人胃黏膜上皮细胞(human gastric mucosal epithelial cells,GES-1),上海富衡生物科技有限公司; MTT,Beyotime/碧云天公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、IL-6、IL-8、TNF-α、IL-1β、 ELISA检测试剂盒,江苏晶美公司;胰蛋白酶EDTA消化液,Gibco公司;DMEM培养基,Hyclone公司。
1.2 实验方法
1.2.1 收集黄芪甲苷和慢性萎缩性胃炎的目标基因
在PubChem数据库中用黄芪甲苷的CAS号:83207-58-3进行搜索并下载黄芪甲苷的SMILES结构,将其输入Swiss target prediction数据库得到目标基因。用相同的方法在PubChem数据库中下载黄芪甲苷结构的sdf文件,并在PharmMapper数据库以此进行拟合预测。目标蛋白名称由UniProt数据库进行修正。然后将2个数据库获得的数据整合处理,删除重复的基因。慢性萎缩性胃炎的目标基因来自OMIM数据库,GeneCards数据库以及DisGeneT数据库。黄芪甲苷和慢性萎缩性胃炎的交集基因访问Venn 2.1处理后获得。
1.2.2 蛋白质相互作用(protein-protein interaction,PPI)网络的构建
在STRING数据库上对得到的交集基因进行可视化分析。在过滤条件为“Homo sapiens”的情况下,得到了PPI网络。使用Cytoscape软件(版本3.9.1)分析获得的PPI网络数据信息,使用拓扑学方法并根据介数中心性来确定关键蛋白[10]。
1.2.3 GO功能和KEGG途径的分析
用微生信在线平台对交集基因进行富集分析。
1.2.4 分子对接
黄芪甲苷的结构式从PubChem数据库获取,靶蛋白结构从PDB数据库获得。用Pymol和Autodock软件对靶点蛋白进行去水、去配体、加氢、分配电荷处理,通过Autodock Vina软件(版本1.1.2)将黄芪甲苷分子与靶点蛋白对接。
1.2.5 细胞培养和处理
GES-1细胞用DMEM完全培养基(含10%胎牛血清,1%双抗)在5%(体积分数)CO2、37 ℃的培养箱中培养,实验时选取对数生长期的细胞进行实验。
1.2.6 MNNG诱导GES-1损伤细胞模型的建立
将GES-1细胞配制成每毫升5×104个细胞浓度的细胞悬液,按每孔100 μL接种到96孔板中贴壁24 h,吸弃培养基。分别按20、40、80、120、150、200 μmol/L的浓度加入被DMSO溶解并用5%血清的培养基稀释的MNNG,每个浓度设置3个复孔,每孔加样100 μL继续培养24 h后吸弃培养基,用MTT法测定细胞活力。空白对照组细胞存活率设为100%,选择存活率接近60%时MNNG的浓度为造模浓度。
试验共设置8组,分别是正常对照组、模型组、药物治疗组(5、10、20、40、80、160 μmol/L)。细胞接种到96孔板贴壁24 h后,吸弃培养基,正常对照组和模型组每孔加入100 μL培养基,其余各组加入100 μL含对应浓度的黄芪甲苷的培养基,孵育24 h后,吸弃液体,正常对照组每孔加入100 μL培养基,其余各组每孔加入100 μL 80 μmol/L的MNNG,继续培养24 h后,用MTT法测定细胞活力。
1.2.7 细胞炎症因子测定
细胞培养条件及黄芪甲苷处理条件与1.2.6节一致。细胞与20 μmol/L黄芪甲苷孵育并经80 μmol/L MNNG处理后,取上清液按试剂盒说明书测定IL-6、IL-8、TNF-α、IL-1β水平。
1.3 数据分析
使用GraphPad Prism软件分析数据并绘制统计图。单因素方差分析用于比较组间差异,P<0.05表明具有统计学差异。
2 结果与分析
2.1 黄芪甲苷调节慢性萎缩性胃炎潜在靶点的获取
在Swiss target prediction数据库中获得32个黄芪甲苷目标基因,在PharmMapper数据库中获得299个黄芪甲苷目标基因,比较分析去除重复值后获得316个目标基因。在GeneCards数据库中共筛选出453个慢性萎缩性胃炎相关基因,在OMIM数据库中共筛选出124个慢性萎缩性胃炎相关基因,在DisGeneT数据库中共筛选出203个慢性萎缩性胃炎相关基因,比较分析去除重复值后获得670个基因。将黄芪甲苷和慢性萎缩性胃炎的靶点基因输入Venn 2.1,取交集后得到53个共同的基因(图1),即为黄芪甲苷调节慢性萎缩性胃炎潜在基因靶点。
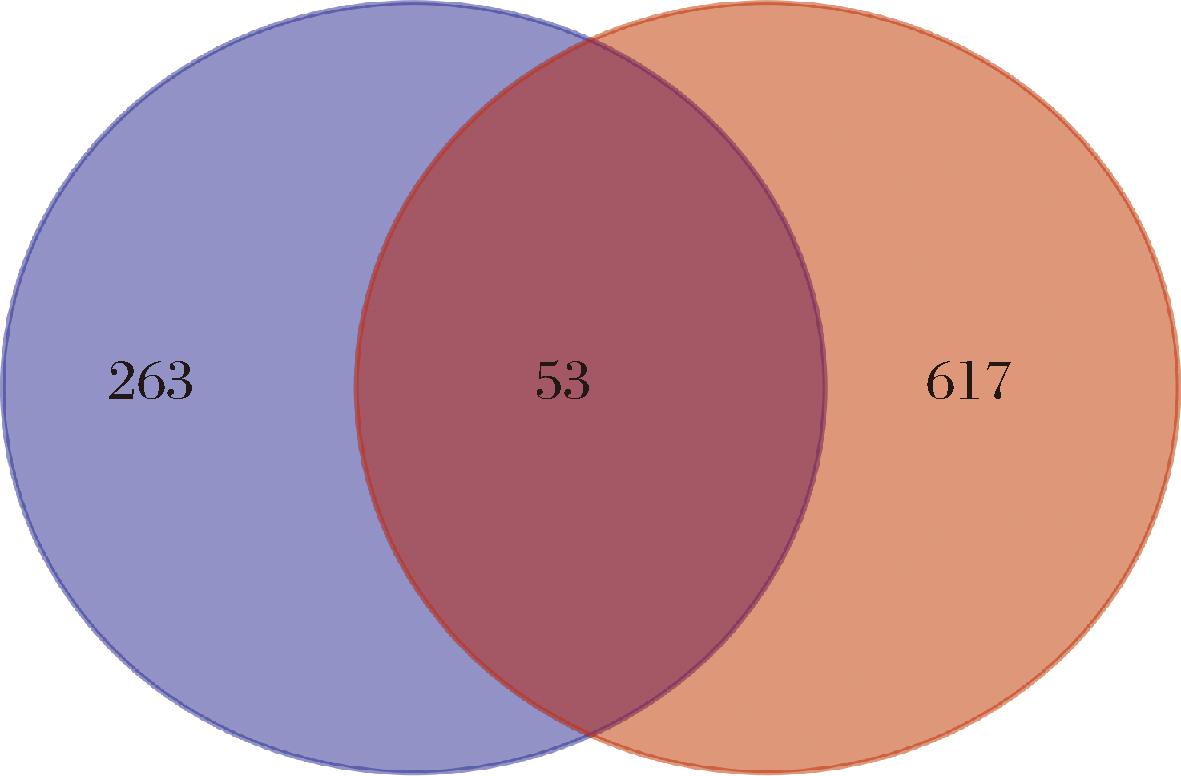
图1 黄芪甲苷治疗慢性萎缩性胃炎潜在靶点的维恩图
Fig.1 Venn diagram of potential targets of astragaloside Ⅳ in the treatment of chronic atrophic gastritis
注:左圈为黄芪甲苷靶点基因,右圈为慢性萎缩性胃炎靶点基因,中间重叠部分为交集基因。
2.2 黄芪甲苷与慢性萎缩性胃炎PPI网络的获取和分析
利用STRING数据库对黄芪甲苷治疗慢性萎缩性胃炎的53个潜在靶点进行可视化分析,置信区间选择高置信区间(0.700)并隐藏网络中孤立的节点,得到PPI网络。该网络显示了53个节点和167条边,代表了靶点之间的相互作用(图2)。PPI 网络富集的P值<1.0×10-16,表明网络中的节点密切相关,即黄芪甲苷治疗慢性萎缩性胃炎的潜在靶点有较高的可信度和相关性。为了进一步筛选网络中的关键基因,使用Cytoscape 3.9.1软件对 PPI 网络的节点度值进行拓扑分析,并根据介数中心性筛选出关键基因,得到的关键基因有SRC、MAPK8、ALB、AKT1、MMP9、ELANE、GSTP1和EGFR(图3)。

图2 黄芪甲苷调节慢性萎缩性胃炎潜在靶点的PPI网络
Fig.2 PPI network of potential targets for the regulation of chronic atrophic gastritis with astragaloside Ⅳ

图3 黄芪甲苷调节慢性萎缩性胃炎的关键基因
Fig.3 Key genes involved in the regulation of chronic atrophic gastritis with astragaloside Ⅳ
注:方框颜色越红代表相应基因节点度值越高,连线代表基因间相互作用。
2.3 黄芪甲苷调节慢性萎缩性胃炎潜在靶点的GO和KEGG富集分析结果
对黄芪甲苷调节慢性萎缩性胃炎的53个潜在靶点进行GO和KEGG富集分析。GO富集分析包括生物过程(biological process,BP)、和细胞组成(cellular component,CC)、分子功能(molecular function,MF)3个部分。通过GO富集分析产生了3 382个GO项目,包括2 947个BPs、129个CCs和306个MFs。根据P值筛选出每个模块的前10个项目,并将其可视化(图4)。BP分析显示,排在前3项的生物过程分别为肌细胞增殖、化学应激和氧化应激。对于CC,囊泡腔、分泌颗粒腔和细胞质囊泡腔是重要的反应部位。MF分析显示,化学引诱剂活性、磷酸酶结合和受体配体活性可能与慢性萎缩性胃炎的发展有关。

图4 黄芪甲苷治疗慢性萎缩性胃炎潜在靶点的GO富集分析
Fig.4 GO enrichment analysis of potential targets for the treatment of chronic atrophic gastritis with astragaloside Ⅳ
KEGG富集分析产生了225个结果。根据P值选出前10项结果,并绘制气泡图(图5)。结果显示,肿瘤中的蛋白聚糖、膀胱癌、松弛素信号通路是黄芪甲苷调节慢性萎缩性胃炎的关键通路。
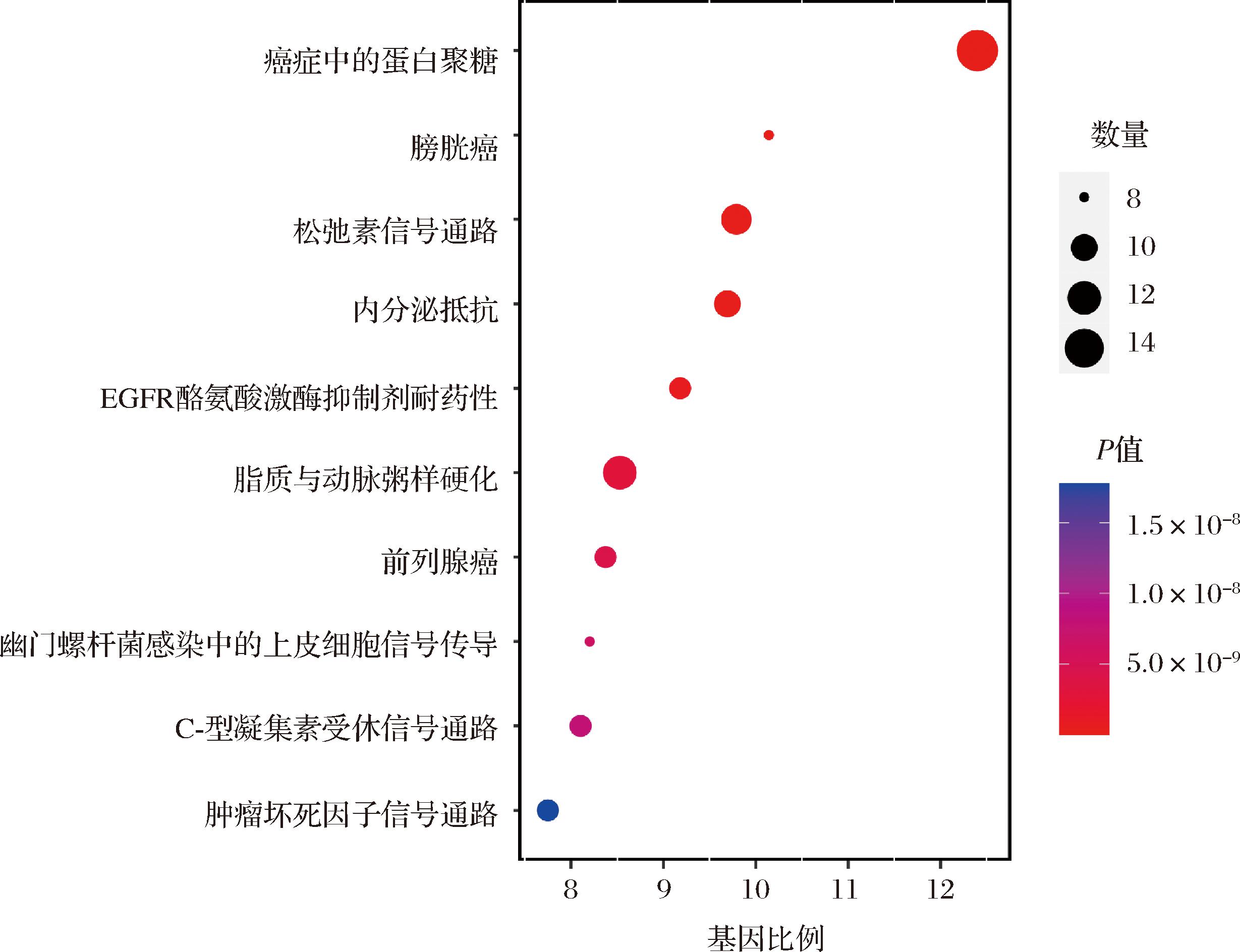
图5 黄芪甲苷治疗慢性萎缩性胃炎潜在靶点的KEGG富集分析
Fig.5 KEGG enrichment analysis of potential targets for the treatment of chronic atrophic gastritis with astragaloside Ⅳ
注:KEGG 富集的前10项结果,不同的P值对应不同的色阶,每项富集的基因数对应于圆圈的大小。
在肿瘤中的蛋白聚糖这一通路中,涉及到VEGFA、FGF2、CASP3、EGFR等15个潜在的靶点。其中潜在的蛋白靶点集中于硫酸软骨素/硫酸皮肤素蛋白多糖,包括EGFR、AKT1、MMP9、MAPK8这4个核心靶点。说明黄芪甲苷可以通过EGFR和Casps来促进细胞凋亡,通过促进AKT1磷酸化形成复合物来促进细胞合成m TOR以及MAPK合成影响P21,从而延长细胞寿命,提高细胞的存活率,并且其药效发挥与抑制肿瘤血管生成有关[11]。在膀胱癌的信号通路中,EGFR能通过形成复合物促进ErbB信号通路的表达影响VEGF信号通路DNA的合成,从而促进VEGF、MMPS、IL-8的表达,引起上皮细胞的增殖和转移间接促进细胞凋亡。而黄芪甲苷的预防作用很有可能就是通过下调了IL-6等相关因子的表达,逆转了这一过程[12]。此外,RXFP能增加不同来源癌症的生长和侵袭潜力,并且也被证明可以促进细胞分化[13]。在RXFP1信号通路中,黄芪甲苷主要是影响下游的靶点MMP9、VEGF、AKT、iNOS来促进细胞凋亡和细胞纤维化。在RXFP3信号通路中,黄芪甲苷通过影响EGFR、SRC来促进MAPK信号通路,并使得P38、JNK、ERK1/2磷酸化AP1来促进基因转录来减弱胃黏膜中的依赖性炎症反应。
2.4 黄芪甲苷与关键靶蛋白的分子对接结果
分子对接的稳定性可以通过结合能的大小来反映,结合能越小,结合二者所需的能量越少,结构越稳定。通常认为,结合能低于-5.0 kJ/mol表示良好的结合活性。结果显示,黄芪甲苷与关键靶蛋白之间均具备良好的结合能力(表1)。具体结合如图6所示。
表1 黄芪甲苷与关键靶蛋白之间的结合能
Table 1 Binding energy between astragaloside Ⅳ and key target proteins

靶蛋白结合能/(kJ/mol)SRC-10.8MAPK8-10.2ALB-9.8AKT1-8.0MMP9-9.9ELANE-7.9GSTP1-9.1EGFR-9.0
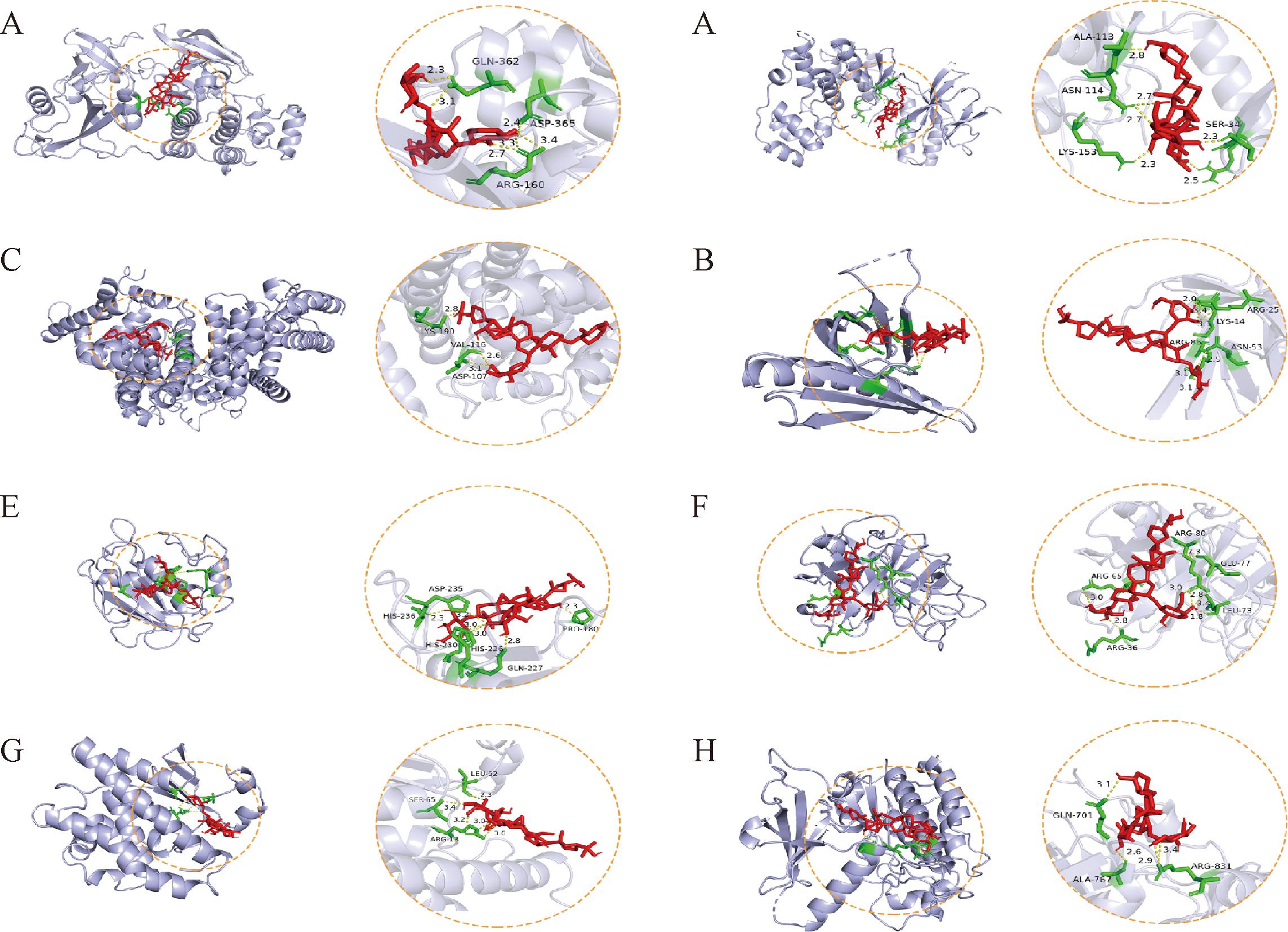
A-黄芪甲苷与SRC分子对接模型;B-黄芪甲苷与MAPK8分子对接模型;C-黄芪甲苷与ALB分子对接模型;D-黄芪甲苷与AKT1分子对接模型;E-黄芪甲苷与MMP9分子对接模型;F-黄芪甲苷与ELANE 分子对接模型;G-黄芪甲苷与GSTP1分子对接模型;H-黄芪甲苷与EGFR分子对接模型
图6 黄芪甲苷与潜在靶蛋白的分子对接图
Fig.6 Molecular docking diagram of astragaloside Ⅳ with potential target proteins
而通过PPI网络、GO和KEGG富集分析以及分子对接,显示这些关键基因都可能在黄芪甲苷预防慢性萎缩性胃炎,改善其症状方面发挥了重要作用。由于慢性萎缩性胃炎是向胃癌发展的过程中的一个阶段,药物对慢性萎缩性胃炎的治疗与胃癌高度相关[14]。在这一过程中,SRC家族激酶的激活已被证实在在一些灵长类动物身上的肿瘤进展和转移中起关键作用[15]。表皮生长因子受体(epidermal growth factor receptor,EGFR)信号通路调节细胞增殖、分化和存活,在食道癌和胃癌中经常表达失调,MAPK8和EGFR被认为与此相关[16]。AKT1基因介导胃癌细胞的增殖和EMT过程,抑制胃癌细胞的恶性表型,可作为治疗慢性萎缩性胃炎的潜在靶点[17]。MMP9基因主要功是降解和重塑细胞外基质,下调其表达可以抑制肿瘤转移,发挥抗肿瘤作用[18]。人类嗜中性粒细胞释放ELANE杀死许多癌细胞类型,同时保留非癌细胞,黄芪甲苷的作用发挥很有可能就是通过上调ELANE蛋白的表达,再以蛋白水解产生CD95死亡结构域对抗癌细胞,减弱肿瘤生长并诱导CD8+T细胞介导的脱靶效应[19]。而代谢基因GSTP1与幽门螺旋杆菌(Helicobocton pyloni)感染导致的慢性萎缩性胃炎有关[20]。
2.5 MNNG对GES-1细胞的存活率的影响
为了探究MNNG对GES-1细胞的存活能力的影响,用浓度20、40、80、120、150、200 μmol/L的MNNG对GES-1细胞进行损伤。结果表明,随着MNNG浓度的增加,细胞活性和增殖能力逐渐降低,并表现出明显的细胞毒性,在80 μmol/L浓度以上,MNNG显著抑制了GES-1细胞活性存活率降到60%以下。所以实验选择80 μmol/L进行后续操作(图7)。
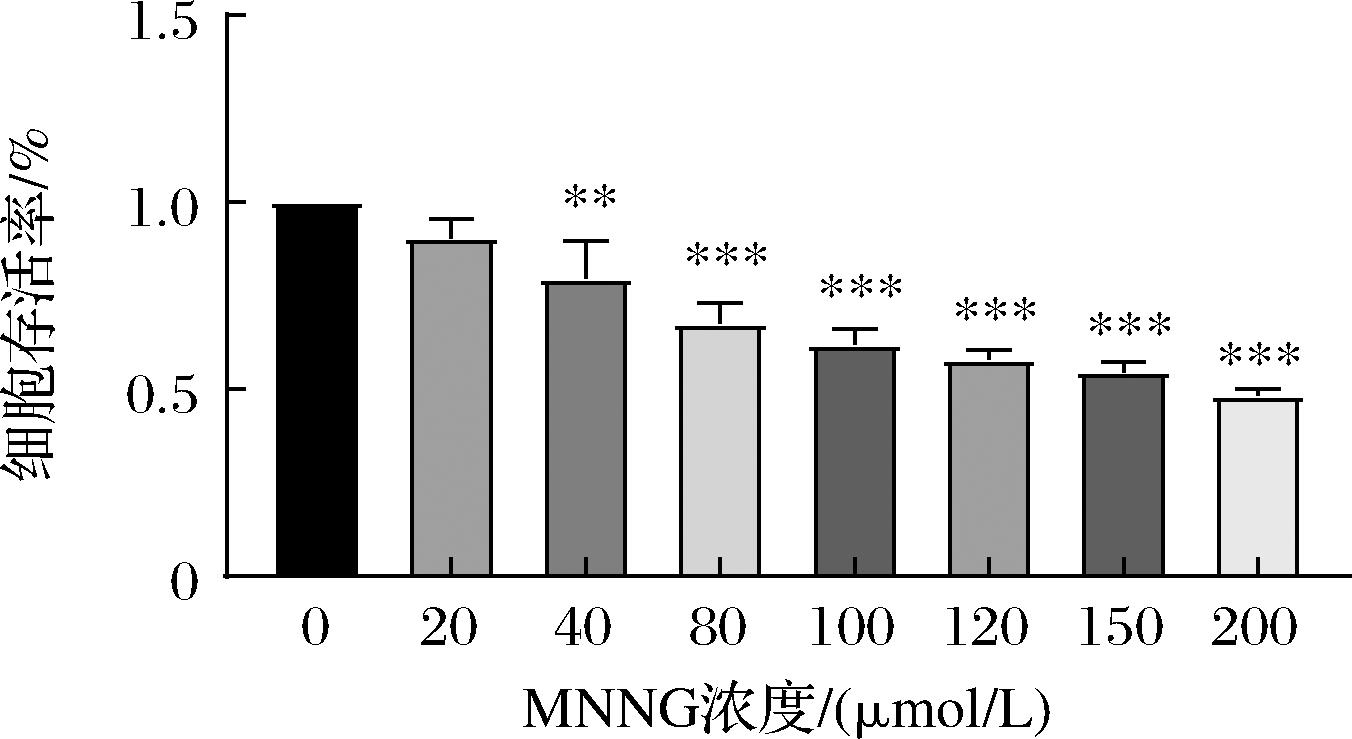
图7 MNNG干预24 h后GES-1的细胞活力
Fig.7 Cell viability of GES-1 after MNNG intervention for 24 h
注:*号代表模型组与药物治疗组的比较,*表示P<0.05,**表示P<0.01,***表示P<0.001。
2.6 黄芪甲苷可改善MNNG对GES-1细胞的存活率的影响
在黄芪甲苷干预后,用MTT比色法检测细胞活力。结果表明,黄芪甲苷可以预防MNNG对GES-1细胞造成的损伤,并在黄芪甲苷的浓度在20 μmol/L时保护效果最佳(图8)。

图8 黄芪甲苷干预后GES-1的细胞活力
Fig.8 Cell viability of GES-1 after intervention with astragaloside Ⅳ
2.7 黄芪甲苷对GES-1细胞分泌的炎症因子的影响
用ELISA试剂盒测定GES-1细胞分泌的上清液发现,正常组与模型组的差异均很显著,且随着给药浓度的增加,GES-1细胞分泌炎症因子量不断下降,呈剂量依赖性,这与之前得到的细胞活力的情况相符合(P<0.05,图9)。

A-白细胞介素-6分泌量;B-白细胞介素-8分泌量;C-白细胞介素-1β分泌量;D-肿瘤坏死因子α分泌量
图9 炎症因子分泌量
Fig.9 Inflammatory factor secretion
注:#号代表模型组与正常组的比较,#表示P<0.05,##表示P<0.01,###表示P<0.001。
萎缩性胃炎有2种类型:一种是以幽门螺杆菌感染患者的胃体为主,另一种是则与自身免疫性有关[21]。而用MNNG诱导GES-1损伤细胞可以用来模拟与自身免疫性相关的慢性萎缩性胃炎模型,并进行初步药筛[22]。通过体外实验,发现黄芪甲苷可以抑制由MNNG诱导引起的细胞数量减少,降低炎症水平。其中IL-1β和TNF-α等炎症细胞因子水平的降低,说明对CAG的症状具有一定的改善[23-24]。
3 讨论
伴随人类对自身健康问题关注,将药食同源的中药材品种加工制成具有保健养生效果的食品、药品甚至日化产品引起国内外相关行业的广泛关注。而黄芪作为中医推崇的补气药在这些领域也得到了广泛应用,多与其他中药配伍应用于多种疾病的保健康复与治疗。目前黄芪提取物多被制成单剂或保健食品,其抗癌、抗衰老、预防感冒以及强身健体等作用得到广泛认可[2]。但是目前在保健食品中,对黄芪成分的开发主要集中在黄芪多糖上,对其他成分的关注较少,且功效不够明确。所以把黄芪甲苷作为研究对象,研究其对萎缩性胃炎的影响,明确黄芪甲苷对肠胃的保护功能,有助于黄芪甲苷在保健食品上的开发。
近年来,网络药理学已经被广泛用于阐明中药或中药复方的分子作用机制。在黄芪甲苷的网络药理学研究中,也有不少对黄芪甲苷在治疗溃疡性结肠炎、糖尿病防治、抗癌等方面的应用价值与潜力的探讨[25-27],但是尚缺乏从药膳同源角度出发,结合中医治未病理念理解黄芪甲苷作为保健食品的综合潜力和价值的研究,尤其是忽略了保健食品对一些慢性疾病的功能。未来应立足于黄芪甲苷为人接受的特点,研究其在保健食品开发中的应用。中草药复方及其提取物对慢性萎缩性胃炎的治疗机制包括:根除幽门螺旋杆菌、抗炎作用、免疫调节、调节胃黏膜细胞增殖、细胞凋亡和自噬水平[28]。而本研究发现黄芪甲苷可以通过降低IL-6、IL-8、TNF-α和IL-1β的水平来发挥抗炎作用。与其他研究过度聚焦于某一特定靶点及其上下游信号通路进行研究的方式不同[29],本研究借助网络药理学研究发现了黄芪甲苷对慢性萎缩性胃炎的调节作用是通过SRC、MAPK8、ALB等多个靶点及其相关信号通路来实现。综上,本研究明确了黄芪甲苷对胃黏膜损伤有辅助保护功能,也为以黄芪甲苷为功能因子的保健食品的研发提供了理论依据。
[1] 赵佳琛, 王艺涵, 金艳, 等.经典名方中黄芪的本草考证[J].中国实验方剂学杂志, 2022, 28(10):337-346.
ZHAO J C, WANG Y H, JIN Y, et al.Herbal textual research on astragali Radix in famous classical formulas[J].Chinese Journal of Experimental Traditional Medical Formulae, 2022, 28(10):337-346.
[2] 宋沁洁, 李国峰, 李咸慰, 等.黄芪药食同源现状分析[J].沈阳药科大学学报, 2023, 40(4):509-517.
SONG Q J,LI G F,LI X W, et al.Analysis of the current situation of astragalus medicine food homologous[J].Journal of Shenyang Pharmaceutical University, 2023, 40(4):509-517.
[3] TAN P, YEOH K G.Genetics and molecular pathogenesis of gastric adenocarcinoma[J].Gastroenterology, 2015, 149(5):1153-1162.e3.
[4] CAI T T, ZHANG C Z, ZHAO Z M, et al.The gastric mucosal protective effects of astragaloside IV in mnng-induced GPL rats[J].Biomedicine &Pharmacotherapy, 2018, 104(1):291-299.
[5] 黄红, 吕静薇, 陈颖, 等.我国中药健康产品管理及市场概况[J].中草药, 2021, 52(3):902-908.
HUANG H, LYU J W, CHEN Y, et al.Management and market general situation of Chinese medicine health products[J].Chinese Traditional and Herbal Drugs, 2021, 52(3):902-908.
[6] 王子怡, 王鑫, 张岱岩, 等.中医药网络药理学:《指南》引领下的新时代发展[J].中国中药杂志, 2022, 47(1):7-17.
WANG Z Y, WANG X, ZHANG D Y, et al.Traditional Chinese medicine network pharmacology:Development in new era under guidance of network pharmacology evaluation method guidance[J].China Journal of Chinese Materia Medica, 2022, 47(1):7-17.
[7] LIU X F, OUYANG S S, YU B, et al.PharmMapper server:A web server for potential drug target identification using pharmacophore mapping approach[J].Nucleic Acids Research, 2010, 38(Web server issue):W609-W614.
[8] WANG X, PAN C X, GONG J Y, et al.Enhancing the enrichment of pharmacophore-based target prediction for the polypharmacological profiles of drugs[J].Journal of Chemical Information and Modeling, 2016, 56(6):1175-1183.
[9] WANG X, SHEN Y H, WANG S W, et al.PharmMapper 2017 update:A web server for potential drug target identification with a comprehensive target pharmacophore database[J].Nucleic Acids Research, 2017, 45(W1):W356-W360.
[10] JOY M P, BROCK A, INGBER D E, et al.High-betweenness proteins in the yeast protein interaction network[J].Journal of Biomedicine and Biotechnology, 2005,2005(2):96-103.
[11] WANG K, LEI L, CAO J Y, et al.Network pharmacology-based prediction of the active compounds and mechanism of Buyang Huanwu Decoction for ischemic stroke[J].Experimental and Therapeutic Medicine, 2021, 22(4):1050.
[12] GOULET C R, CHAMPAGNE A, BERNARD G, et al.Cancer-associated fibroblasts induce epithelial-mesenchymal transition of bladder cancer cells through paracrine IL-6 signalling[J].BMC Cancer, 2019, 19(1):137.
[13] THANASUPAWAT T, GLOGOWSKA A, NIVEDITA-KRISHNAN S, et al.Emerging roles for the relaxin/RXFP1 system in cancer therapy[J].Molecular and Cellular Endocrinology, 2019, 487:85-93.
[14] JIANG J Y, SHEN S X, DONG N N, et al.Correlation between negative expression of pepsinogen C and a series of phenotypic markers of gastric cancer in different gastric diseases[J].Cancer Medicine, 2018, 7(8):4068-4076.
[15] DE F TIMA FERREIRA BORGES DA COSTA J, DE CASTRO SANT′ ANNA C, MUNIZ J A P C, et al.Deregulation of the SRC family tyrosine kinases in gastric carcinogenesis in non-human primates[J].Anticancer Research, 2018, 38(11):6317-6320.
TIMA FERREIRA BORGES DA COSTA J, DE CASTRO SANT′ ANNA C, MUNIZ J A P C, et al.Deregulation of the SRC family tyrosine kinases in gastric carcinogenesis in non-human primates[J].Anticancer Research, 2018, 38(11):6317-6320.
[16] LI W Q, HU N, WANG Z M, et al.Genetic variants in epidermal growth factor receptor pathway genes and risk of esophageal squamous cell carcinoma and gastric cancer in a Chinese population[J].PLoS One, 2013, 8(7):e68999.
[17] DENG T Y, SHEN P, LI A M, et al.CCDC65 as a new potential tumor suppressor induced by metformin inhibits activation of AKT1 via ubiquitination of ENO1 in gastric cancer[J].Theranostics, 2021, 11(16):8112-8128.
[18] DONG Z, GUO S, WANG Y, et al.USP19 enhances MMP2/MMP9-mediated tumorigenesis in gastric cancer[J].OncoTargets and Therapy, 2020, 13:8495-8510.
[19] CUI C, CHAKRABORTY K, TANG X, et al.Neutrophil elastase selectively kills cancer cells and attenuates tumorigenesis[J].Cell, 2021, 184(12):3163-3177.e21.
[20] SANG L, LV Z, SUN L P, et al.Impact of SNP-SNP interactions of DNA repair gene ERCC5 and metabolic gene GSTP1 on gastric cancer/atrophic gastritis risk in a Chinese population[J].World Journal of Gastroenterology, 2018, 24(5):602-612.
[21] LI Y F, XIA R, ZHANG B, et al.Chronic atrophic gastritis:A review[J].Journal of Environmental Pathology, Toxicology and Oncology: Official Organ of the International Society for Environmental Toxicology and Cancer, 2018, 37(3):241-259.
[22] TONG Y L, WANG R L, LIU X, et al.Zuojin pill ameliorates chronic atrophic gastritis induced by MNNG through TGF-β/PI3K/Akt axis[J].Journal of Ethnopharmacology, 2021, 271:113893.
[23] CHEN X, WANG R L, BAO C M, et al.Palmatine ameliorates Helicobacter pylori-induced chronic atrophic gastritis by inhibiting MMP-10 through ADAM17/EGFR[J].European Journal of Pharmacology, 2020, 882:173267.
[24] MACHADO J C, FIGUEIREDO C, CANEDO P, et al.A proinflammatory genetic profile increases the risk for chronic atrophic gastritis and gastric carcinoma[J].Gastroenterology, 2003, 125(2):364-371.
[25] 臧凯宏, 刘丽丽, 吴建军, 等.黄芪甲苷治疗溃疡性结肠炎和肝脏损伤共病的分子机制网络药理学研究[J].中国药物警戒, 2022, 19(11):1196-1201.
ZANG K H, LIU L L, WU J J, et al.Molecular mechanism of astragaloside IV in the treatment of ulcerative colitis and liver injury comorbidity based on network pharmacology[J].Chinese Journal of Pharmacovigilance, 2022, 19(11):1196-1201.
[26] 于乃馨, 李国琼, 李标, 等.基于网络药理学和分子对接探讨黄芪甲苷治疗糖尿病视网膜病变的作用机制[J].中国实验方剂学杂志, 2022, 28(13):209-216.
YU N X, LI G Q, LI B, et al.Mechanism of astragaloside Ⅳ in treating diabetic retinopathy based on network pharmacology and molecular docking[J].Chinese Journal of Experimental Traditional Medical Formulae, 2022, 28(13):209-216.
[27] 罗娇, 熊书, 马强, 等.基于网络药理学和分子对接探讨黄芪甲苷、木香烃内酯的抗乳腺癌机制[J].临床医学研究与实践, 2022, 7(35):1-4.
LUO J, XIONG S, MA Q, et al.Discussion on anti-breast cancer mechanism of astragaloside Ⅳ and costunolide based on network pharmacology and molecular docking[J].Clinical Research and Practice, 2022, 7(35):1-4.
[28] YANG L J, LIU X Y, ZHU J J, et al.Progress in traditional Chinese medicine against chronic gastritis:From chronic non-atrophic gastritis to gastric precancerous lesions[J].Heliyon, 2023, 9(6):e16764.
[29] 赵彩萍, 刘翠玲, 梁爽, 等.黄芪甲苷对脂多糖诱导人胃黏膜上皮细胞GES-1的抗炎作用及机制研究[J].中药新药与临床药理, 2020, 31(8):918-923.
ZHAO C P, LIU C L, LIANG S, et al.Anti- inflammatory effect and mechanism of astragaloside Ⅳ on human gastric mucosa epithelial cells (GES1) induced by LPS[J].Traditional Chinese Drug Research and Clinical Pharmacology, 2020, 31(8):918-923.