黄花菜(Hemerocallis citrina)又名忘忧草、金针菜、柠檬萱草等,隶属于百合目阿福花科萱草属,是一种多年生草本植物,在我国有着悠久的种植历史,栽培广泛。黄花菜在我国已成为地区标志性产业,形成了甘肃庆阳、陕西大荔、湖南祁东、四川渠县、山西大同、河南淮阳六大黄花菜主产区[1]。黄花菜的最佳采收期在每年的6~8月,在花茎抽出约半个月, 没有开花之前的现蕾期,其花蕾是一种广受消费者喜爱的食物,常见的食用加工方法包括晒干、蒸制、腌制等[2-3]。黄花菜富含碳水化合物、蛋白质、脂类、微量元素以及多种生物活性成分,包括黄酮类、蒽醌类、萜类、生物碱类、甾体皂苷类、酚酸类等,是一种兼有食用价值和药用价值的植物[4]。
萜类化合物是由甲戊二羟酸衍生形成的,分子骨架以异戊二烯为基本结构单元的化合物及其衍生物,根据分子中含有五碳单位[(C5H8)n]的数目可分为单萜、倍半萜、二萜、二倍半萜、三萜、四萜和多萜等[5]。萜类化合物是构成植物香精、树脂、色素等的重要成分。萜类化合物在植物应对胁迫反应、吸引授粉昆虫、增强耐热性等方面发挥着重要作用[6]。在黄花菜的花蕾、叶、茎和根部都鉴定出了萜类化合物,包括存在于花蕾的新黄质、紫黄质、叶黄素、13-顺式-叶黄素5, 6-环氧化物、叶黄素5, 6-环氧化物、玉米黄质、β-隐黄质、全反式β-胡萝卜素等类胡萝卜素类化合物[7],存在于根部的具有反式双环的新型二萜hemerocallal A[8]和存在于花蕾、叶、茎部的挥发油组分含氧单萜1, 8-桉叶素[9]等。萜类化合物因具有抗炎抑菌、抗肿瘤等生物活性而受到广泛关注,黄花菜的萜类化合物种类丰富,然而针对大同黄花菜不同器官萜类代谢物的系统研究及优势萜类代谢物未见报道。
近些年来,液相色谱(liquid chromatography, LC)、气相色谱(gas chromatography, GC)和质谱(mass spectrometry, MS)等代谢组学分析方法已广泛应用于植物代谢、响应机制、品种差异鉴定等研究。例如,基于超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry, UPLC-MS/MS)对枇杷不同组织萜类代谢物的鉴定[10];基于非靶代谢组学对多刺绿绒蒿不同器官代谢物进行差异分析[11];基于代谢组学的黑藻铅、锌胁迫下的响应机制研究[12];基于广泛靶向代谢组学技术对不同颜色芝麻成分进行差异分析[13]。本研究利用基于UPLC-MS/MS技术的广靶代谢组学对黄花菜根、茎、叶、花萜类代谢物进行鉴定,首次比较分析不同器官中萜类化合物的分布规律及相对含量差异,为黄花菜各器官萜类化合物生物学功能研究奠定基础,对食品工业和医疗保健具有重要意义。
1 材料与方法
1.1 实验材料与试剂
大同黄花(Hemerocallis citrina cv.‘Datonghuanghua’),2022年8月采集于山西省大同市云州区(北纬40°1′,东经113°39′,海拔1 042 m)。黄花菜的生长条件包括光照、气温、湿度等与外界自然条件一致。选取开花前的现蕾期长势相同的植株,每15株作为一个生物学重复,分别将根、茎、叶、花分离,用蒸馏水清洗,液氮速冻后,干冰运送至北京百迈客生物科技有限公司进行萜类广靶代谢组检测。实验中每个植物器官均取3个生物学重复。
甲醇、乙腈, 美国默克公司; 甲酸, 阿拉丁公司。
1.2 仪器与设备
Scientz-100F型冻干机, 宁波新芝公司; MM 400型研磨仪,德国莱驰公司; Nexera X2型超高效液相色谱,日本岛津公司; Applied Biosystems 6500 QTRAP型串联质谱,美国应用生物系统公司; Agilent SB-C18型色谱柱,美国安捷伦公司; SCAA-104,0.22 μm 孔径微孔滤膜,上海安谱实验公司。
1.3 代谢物提取
将生物样品置于冻干机中进行真空冷冻干燥,然后用研磨机研磨成粉末(30 Hz,1.5 min)。称取100 mg 粉末溶于1.2 mL 70%(体积分数)甲醇提取液中,然后每30 min涡旋1次,每次持续30 s,共涡旋6次。将样品置于4 ℃的冰箱中过夜,12 000 r/min离心3 min后,吸出上清液,用微孔滤膜过滤,贮存在进样瓶中,用于UPLC-MS/MS分析。
1.4 色谱质谱采集条件
液相条件包括以下[14]:色谱柱为Agilent SB-C18 1.8 μm,2.1 mm×100 mm;流动相:A相为超纯水(加入0.1%的甲酸),B相为乙腈(加入0.1%的甲酸);洗脱梯度:0.00 min B相比例为5%,9.00 min内B相比例线性增加到95%,并维持在95% 1 min,10.00~11.10 min,B相比例降为5%,并以5%平衡至14 min;流速0.35 mL/min;柱温40 ℃;进样量4 μL。
质谱条件如下[14]:线性离子阱(linear ion trap, LIT)和三重四极杆(triple quadrupole, QQQ)扫描在三重四极杆-线性离子阱质谱仪,AB6500 QTRAP UPLC/MS/MS系统上获得,该系统配备有离子喷雾接口(ESI Turbo),以正离子和负离子模式运行,由Analyst 1.6.3软件(AB Sciex)控制。ESI源操作参数如下:源温度500 ℃;离子喷雾电压(IS)5 500V(正离子模式)/-4 500V(负离子模式);离子源气体I(GSI)、气体II(GSII)、帘气(CUR)分别设定为55、60、25 psi,碰撞诱导电离参数设置为高。在QQQ和LIT模式下,分别使用10、100 μmol/L聚丙二醇溶液进行仪器调谐和质量数校准。QQQ扫描使用三重四级杆质谱的多反应监测模式(multiple reaction monitoring, MRM),并将碰撞气体(氮气)设置为中等。对每一组特定的MRM离子对进行去簇电压(declustering potential,DP)和碰撞能(collision energy,CE)优化。
1.5 代谢物定性与定量
基于自建数据库(BMK database),根据二级谱信息进行物质定性,分析时去除同位素信号,含钾离子(K+)、钠离子(Na+)、铵根(NH4+)的重复信号,以及本身是其他更大分子质量物质的碎片离子的重复信号。代谢物定量是利用三重四级杆质谱的MRM分析完成。在MRM模式中,四级杆首先筛选目标物质的前体离子(母离子),排除掉其他分子质量物质对应的离子以初步排除干扰;前体离子经碰撞室诱导电离后断裂形成很多碎片离子,碎片离子再通过三重四级杆过滤选择出所需要的一个特征碎片离子,排除非目标离子干扰,使定量更为精确,重复性更好。获得不同样本的代谢物质谱分析数据后,对所有物质质谱峰进行峰面积积分,并对其中同一代谢物在不同样本中的质谱出峰进行积分校正。基于质谱峰面积来估算每个样品中相应代谢物的相对含量。
1.6 数据分析
主成分分析(principal component analysis,PCA)和聚类分析(hierarchical cluster analysis,HCA)的统计分析流程使用R 4.0.3进行。采用T检验计算各化合物的差异显著性P值。采用R语言包ropls进行偏最小二乘判别分析(orthogonal projections to latent structures- discriminant analysis, OPLS-DA)[15]建模,并进行200次置换试验验证模型的可靠性。采用多重交叉验证的方法计算模型的变量重要性投影(variable importance in projection, VIP)值。采用OPLS-DA模型的差异倍数(fold change,FC)、P值和VIP值相结合的方法筛选差异代谢物。筛选标准为FC>1,P<0.05,VIP≥1。
2 结果与分析
2.1 黄花菜不同器官萜类代谢物质谱数据评估
为了评估萜类代谢物质谱数据的质量,对样品之间进行相关性分析从而评估组内样品之间的生物学重复。黄花菜根(Rt)、茎(St)、叶(Lt)、花(Ft),12个样品的相关性分析发现每组3个样品的组间相关性均大于70%(图1-A),表明试验的重复性好。PCA分析发现组内样品聚集在一起,变异较小,表明质谱数据是可靠的。PCA的结果显示第一主成分解释率为40.94%,第二主成分解释率为23.59%。不同器官间的样本在这2个维度上有明显的分离(图1-B),表明黄花菜的根、茎、叶、花不同器官的萜类代谢物存在较大的差异。
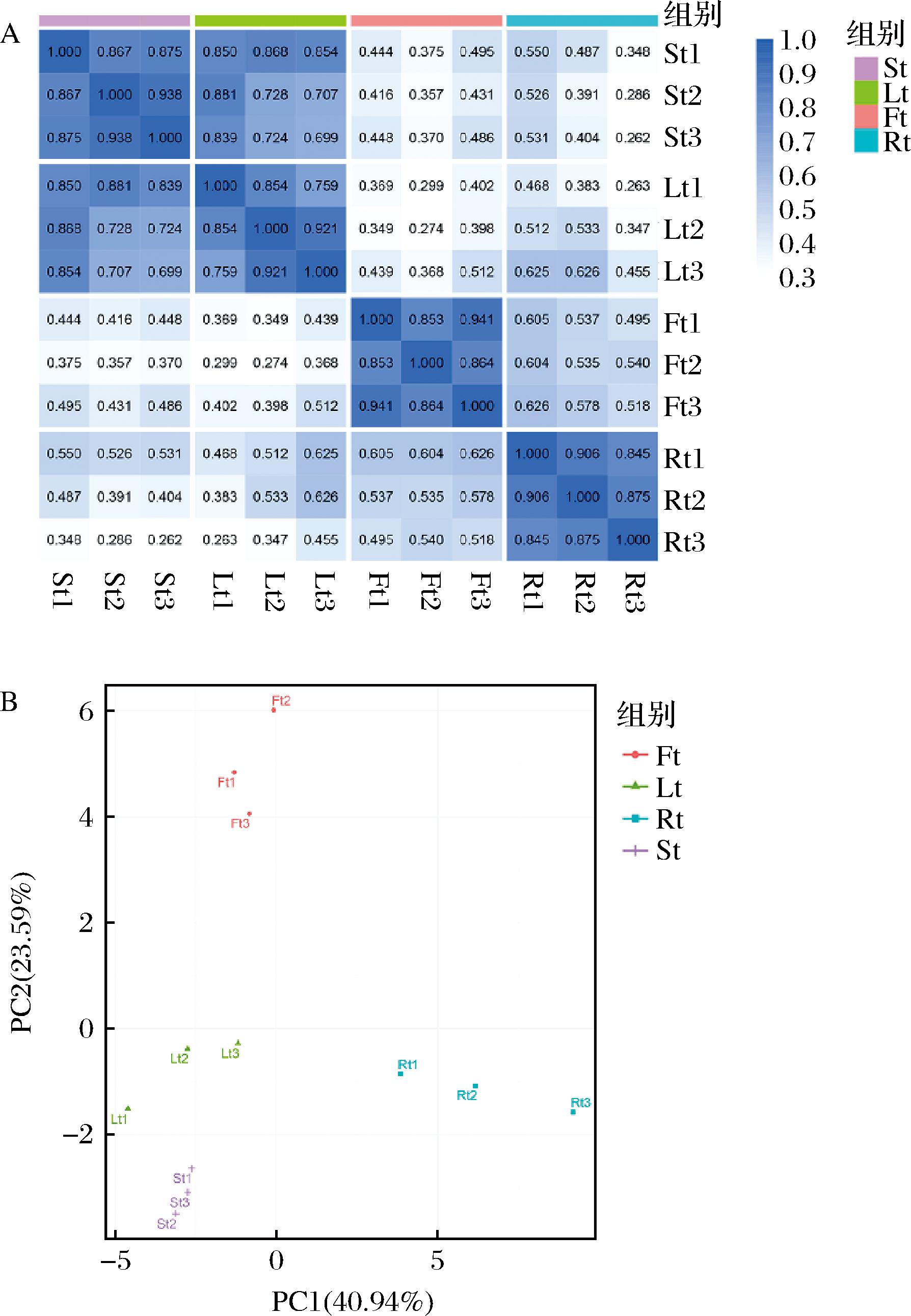
A-样品间相关性图;B-PCA分析
图1 重复相关性评估与PCA图
Fig.1 Repeated correlation assessment and principal component analysis
注:图1-A中将斯皮尔曼等级相关系数r(spearman rank correlation)的平方作为生物学重复相关性的评估指标。r2越接近1,说明2个重复样品相关性越强;图1-B中其中X轴表示第一主成分,Y轴表示第二主成分,坐标轴百分比表示该主成分对样品差异的贡献占比。
2.2 黄花菜不同器官萜类代谢物的总体分析
从黄花根、茎、叶、花中共鉴定出萜类物质43种,其中单萜7种、二萜18种、三萜16种、三萜皂苷2种,各占总萜类数的16.2%、41.9%、37.2%、4.7%(图2-A)。不同器官中的萜类代谢物数量分别为:根42种、茎42种、叶43种、花42种;其中4个器官共有的代谢物41种,占总萜类代谢物种类的95.3%。对数据归一化处理,然后对萜类代谢物和样品进行聚类分析。如图2-B所示,不同器官的3个生物学重复样品分别聚成小类,不同器官间的萜类物质积累量差异明显。
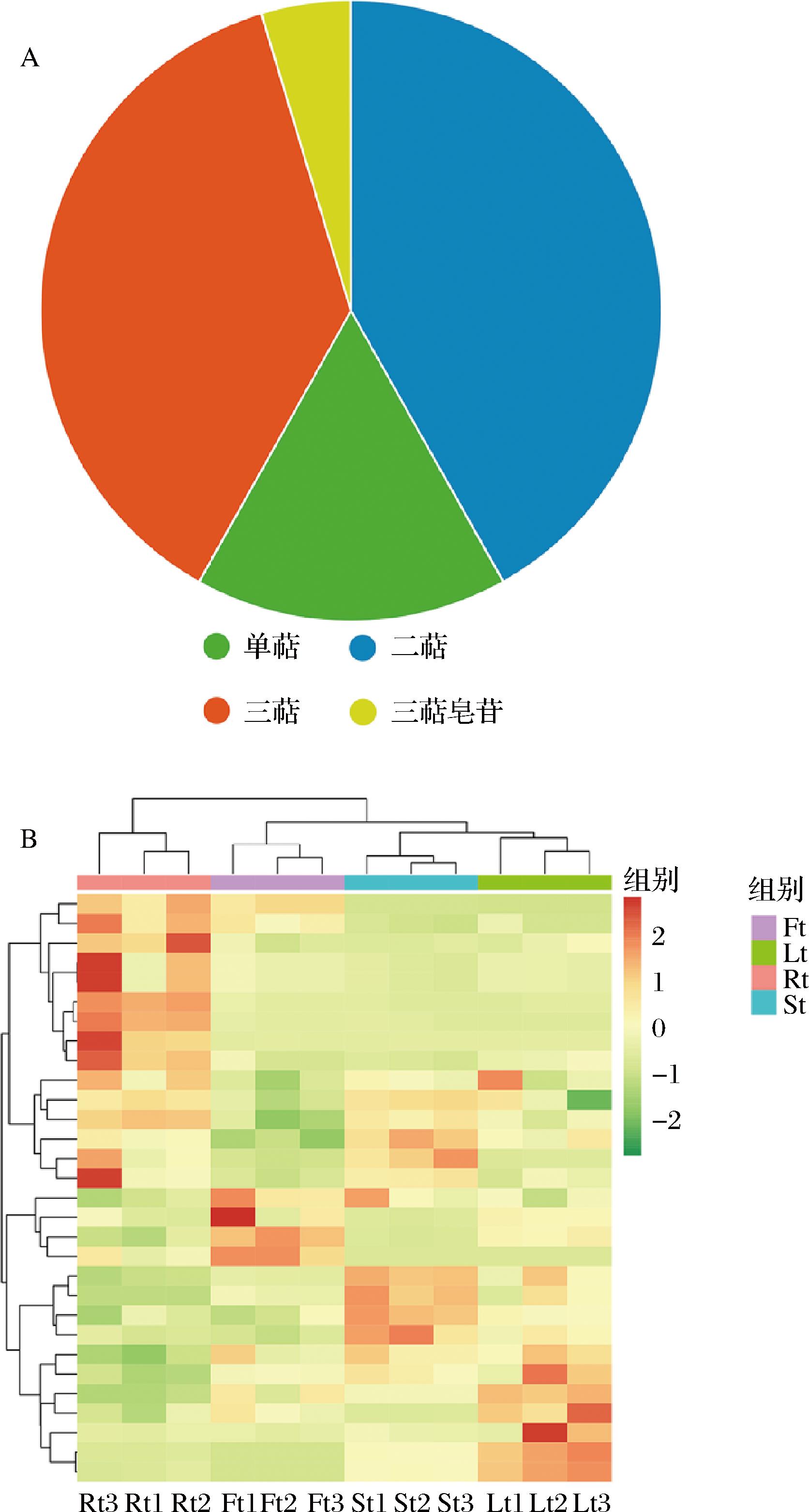
A-萜类分类饼图;B-萜类代谢物聚类热图
图2 萜类物质分类及聚类分析
Fig.2 Classification and cluster analysis of terpenoids
注:图2-A中单萜、二萜、三萜、三萜皂苷各占总萜类数的16.2%、41.9%、37.2%、4.7%;图2-B中各器官的样品分别聚成小类,不同器官间的萜类物质积累量差异明显。
2.3 黄花菜不同差异代谢物分析
为了解黄花菜不同器官之间萜类代谢物的差异情况,对根、茎、叶、花样品采用OPLS-DA进行统计分析,消除无关变量的干扰,从获得的多变量分析OPLS-DA 模型的VIP值,可以初步筛选出不同组织间的差异代谢物,同时结合单变量分析的P值以及差异倍数值来进一步筛选出差异代谢物(FC>1,VIP≥1,P<0.05),并绘制火山图(图3)。
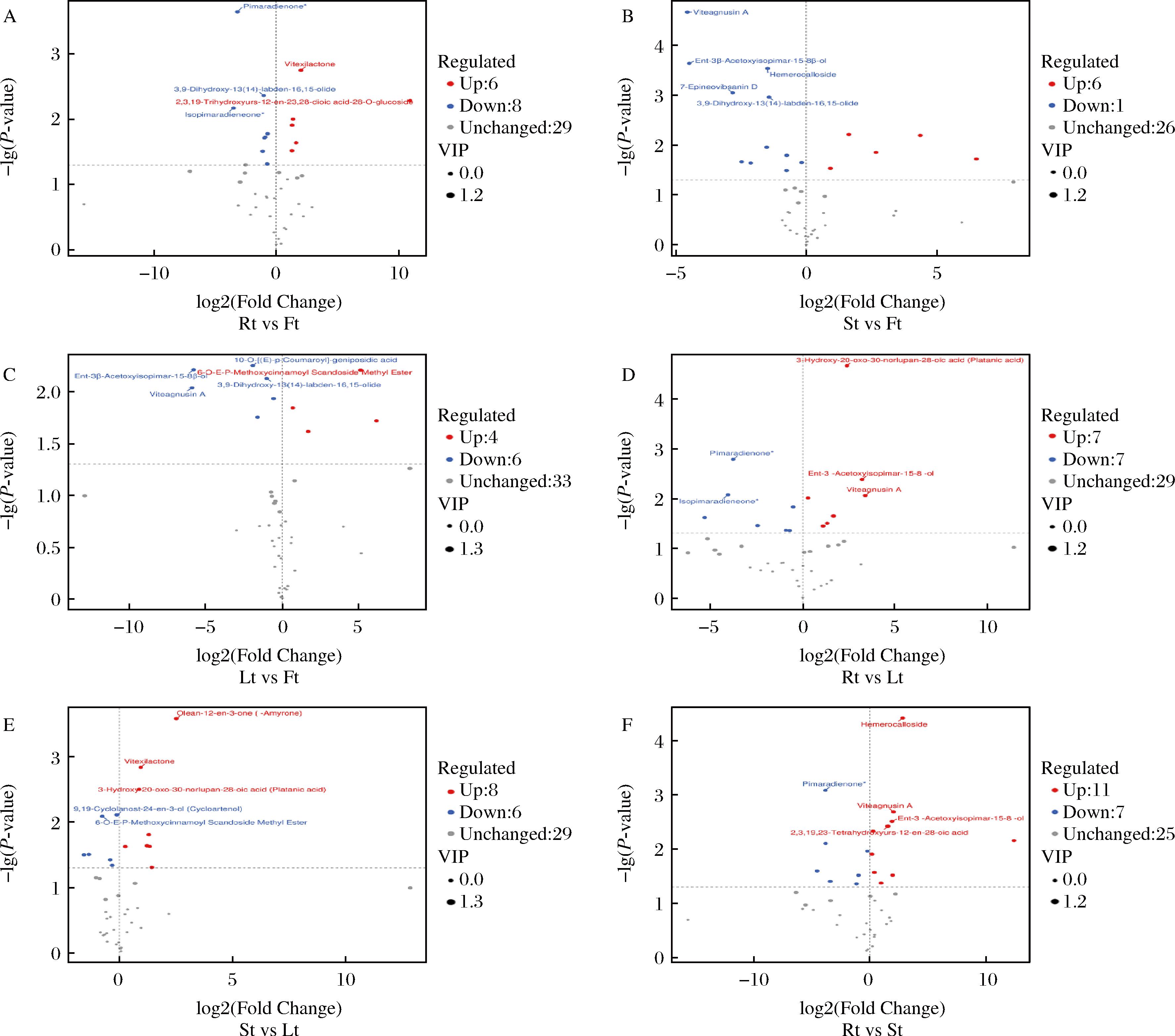
A-根与花的萜类差异代谢物比较;B-茎与花的萜类差异代谢物比较;C-叶与花的萜类差异代谢物比较;D-根与叶的萜类差异代谢物比较;E-茎与叶的萜类差异代谢物比较;F-根与茎的萜类差异代谢物比较。
图3 不同器官萜类差异代谢物火山图
Fig.3 Volcano plots of differential terpenoid metabolites of comparison group of organs
在根和花的差异代谢物分析中,共鉴定出14种差异代谢产物,其中有8种在根中含量较高,均为二萜类物质;其余6种在花中含量较高,包括1种倍萜、2种二萜、2种三萜、1种三萜皂苷。按照P值显著性从高到低排前五的是海松二烯酮、牡荆内酯、3,9-二羟基-13(14)-半日花烯-16,15-内酯、2,3,19-三羟基熊果-12-烯-23,28-二酸-28-O-葡萄糖苷、异海松二烯酮。
茎与花的比较中,共筛选出17种差异代谢产物,其中有11种代谢产物在茎中含量较高,包括2种倍萜、7种二萜、1种三萜、1种三萜皂苷;6种在花中含量较高,包括2种倍萜、1种二萜、3种三萜。按照P值显著性从高到低排前五的是viteagnusin A、对映-3β-乙酰氧基异海松-15-烯-8β-醇、hemerocalloside、7-epineovibsanin D、3,9-二羟基-13(14)-半日花烯-16,15-内酯。
在叶与花的比较中,筛选出10种差异代谢物,其中6种在叶中含量较高,包括3种倍萜、3种二萜;4种在花中含量较高,包括2种倍萜、1种二萜、1种三萜。按照P值显著性从高到低排前五的是10-O-(E)-p-香豆酰基京尼平苷酸、对映-3β-乙酰氧基异海松-15-烯-8β-醇、6-O-E-P-methoxycinnamoyl scandoside methyl ester、3,9-二羟基-13(14)-半日花烯-16,15-内酯、viteagnusin A。
在根与叶的比较中,筛选出14种差异代谢物,其中7种在根中含量较高,包括1种倍萜、5种二萜、1种三萜;7种在叶中含量较高,包括1种倍萜、5种二萜、1种三萜。按照P值显著性从高到低排前五的是3-羟基-20-氧代-30-去甲基羽扇豆烷-28-酸 (platanic acid)、海松二烯酮、对映-3β-乙酰氧基异海松-15-烯-8β-醇、异海松二烯酮、viteagnusin A。
在茎与叶的比较中,筛选出14种差异代谢物,其中6种在茎中含量较高,包括2种倍萜、3种二萜、1种三萜;8种在叶中含量较高,包括1种倍萜、5种二萜、2种三萜。按照P值显著性从高到低排前五的是齐墩果-12-烯-3-酮 (β-香树脂酮)、牡荆内酯、3-羟基-20-氧代-30-去甲基羽扇豆烷-28-酸 (platanic acid)、9,19-环羊毛甾-24-烯-3-醇 (环阿尔廷醇)、6-O-E-P-methoxycinnamoyl scandoside methyl ester。
在根与茎的比较中,筛选出18种差异代谢物,其中7种在根中含量较高,包括1种倍萜、5种二萜、1种三萜;11种在茎中含量较高,包括1种倍萜、6种二萜、3种三萜、1种三萜皂苷。按照P值显著性从高到低排前五的是hemerocalloside、海松二烯酮、viteagnusin A、对映-3β-乙酰氧基异海松-15-烯-8β-醇、2,3,19,23-四羟基熊果-12-烯-28-酸。
2.4 黄花菜不同器官萜类代谢物的相对含量及优势代谢物
黄花菜不同器官43种萜类化合物的相对含量见表1,其中去甲阿江榄仁酸只存在于根和叶中,根中不含2,3,19-三羟基熊果-12-烯-23,28-二酸-28-O-葡萄糖苷,未发现每个器官特有的萜类化合物。图4为依据FC>1,VIP≥1,P<0.05筛选根、茎、叶、花不同器官的优势萜类代谢物的结果展示。异海松二烯酮、海松二烯酮、松香酸、scutebarbolide C、异海松酸在根中的含量高于茎、叶、花。3,9-二羟基-13(14)-半日花烯-16,15-内酯、9,19-环羊毛甾-24-烯-3-醇(环阿尔廷醇)在茎中的含量高于根、叶、花。viteagnusin A、对映-3β-乙酰氧基异海松-15-烯-8β-醇在叶中的含量高于根、茎、花;6-O-E-P-methoxycinnamoyl scandoside methyl ester含量低于根、茎、花。牡荆内酯、7-O-coumaroyl-loganic acid在花中的含量高于根、茎、叶;3,9-二羟基-13(14)-半日花烯-16,15-内酯含量低于根、茎、叶。
表1 黄花菜根、茎、叶、花中萜类代谢产物的具体成分及相对含量
Table 1 Specific components and relative contents of terpenoid metabolites in roots, stems, leaves, and flowers of H.citrina

次生代谢物化合物Q1(Da)Q3(Da)相对含量根茎叶花单萜10-O-(E)-p-香豆酰基京尼平苷酸519.15 163.04 8.69×105±3.93×1051.05×104±9.36×1022.45×104±4.11×1036.48×103±4.03×103phlomuroside389.22 209.15 6.45×104±3.26×1048.64×104±1.86×1042.92×104±2.34×1031.98×104±2.77×1036-O-E-P-methoxycinnamoyl scandoside methyl ester563.18 503.16 3.60×107±9.72×1051.54×105±1.68×1049.16×104±1.19×1043.18×106±4.24×1057-O-coumaroyl-loganic acid521.17 341.11 3.71×105±2.52×1051.25×104±3.44×1031.61×104±1.99×1031.15×106±2.74×1057-O-(4″-O-glucosyl)coumaroyl-loganic acid683.22 341.11 4.82×105±3.23×1058.51×103±2.41×1036.49×103±7.57×1022.08×106±8.78×105α-松油醇155.14 113.13 2.94×105±2.46×1033.05×105±6.20×1032.97×105±7.55×1022.66×105±2.25×104京尼平苷389.14 209.08 3.01×104±7.77×1031.19×105±3.03×1046.48×104±1.48×1042.13×104±1.02×104二萜牡荆内酯377.23 295.23 1.03×107±5.45×1061.35×107±4.40×1052.61×107±1.28×1064.19×107±4.04×106vitexifolin F365.27 365.27 2.06×107±9.36×1052.14×107±7.11×1051.41×107±7.53×1061.27×107±2.31×106脱氢松香酸299.20 299.20 1.49×106±3.25×1052.01×106±1.65×1051.97×106±8.49×1041.96×106±1.23×105hemerocalloside447.22 387.20 1.83×104±7.25×1031.32×105±6.50×1038.64×104±3.54×1044.72×104±3.29×103hemerocallal A299.20 299.20 1.65×106±6.38×1042.01×106±8.02×1042.02×106±1.02×1051.93×106±1.45×105viteagnusin A349.27 293.21 6.28×105±2.12×1052.62×106±6.15×1046.63×106±1.09×1061.11×105±2.61×104对映-16α,17-二羟基-贝壳杉-2-酮321.24 123.08 7.72×104±1.49×1046.29×104±4.05×1036.68×104±2.61×1044.64×104±9.21×103松香酸301.22 301.22 3.53×105±7.37×1041.59×105±5.91×1031.89×105±3.33×1041.63×105±3.25×104scutebarbolide C425.22 365.19 3.09×106±7.78×1042.69×106±1.17×1052.17×106±2.42×1051.59×106±3.97×105对映-3β-乙酰氧基异海松-15-烯-8β-醇349.27 179.14 1.92×106±7.57×1057.28×106±2.70×1051.80×107±2.42×1063.26×105±7.08×104松香酸甲酯315.20 315.20 9.31×104±4.72×1041.09×105±3.68×1032.96×105±7.48×1051.78×105±4.28×10412-羟基松香酸319.22 319.22 3.24×104±1.09×1046.41×104±1.45×1042.92×105±2.49×1053.69×104±1.40×104贝壳杉烯酸301.22 301.22 2.67×105±8.93×1042.37×105±8.72×1042.17×105±4.55×1041.52×105±1.71×104异海松酸301.22 301.22 2.98×105±4.67×1041.53×105±6.95×1031.84×105±1.15×1041.60×105±2.64×1043,9-二羟基-13(14)-半日花烯-16,15-内酯335.22 253.22 2.07×106±1.64×1052.74×106±2.61×1052.07×106±2.72×1051.02×106±2.33×1057-epineovibsanin D463.27 185.11 1.24×105±1.04×1051.02×105±9.97×1033.99×104±2.37×1041.44×104±1.26×104海松二烯酮285.22 285.22 7.05×106±5.06×1054.95×105±1.63×1055.15×105±7.30×1047.81×105±2.92×105异海松二烯酮285.22 285.22 5.34×106±8.09×1053.79×105±1.06×1053.21×105±2.99×1034.75×105±1.86×105三萜9,19-环羊毛甾-24-烯-3-醇 (环阿尔廷醇)427.39 345.32 2.95×105±1.15×1043.37×105±5.31×1033.12×105±2.02×1032.97×105±1.32×1042,3-二羟基羽扇豆-20(29)-烯-28-酸 (麦珠子酸)471.35 471.35 2.55×106±1.73×1064.25×105±1.54×1056.90×105±4.54×1048.07×105±1.03×1052-羟基熊果酸471.35 471.35 2.55×106±1.73×1064.25×105±1.54×1056.90×105±4.54×1048.07×105±1.03×1053-羟基-20-氧代-30-去甲基羽扇豆烷-28-酸457.33 457.33 2.49×106±5.06×1057.18×106±2.13×1041.32×107±5.88×1058.22×106±3.06×1062,3,23-三羟基齐墩果-12-烯-28-酸487.34 487.34 2.50×105±1.29×1052.38×104±2.20×1042.51×104±1.31×1043.21×104±3.12×104去甲阿江榄仁酸471.31 471.31 4.91×105±4.51×1059±06.81×104±4.05×1049±02-甲酰-3-羟基-A(1)-去甲基羽扇豆-20(29)-烯-28-酸469.34 469.34 2.95×105±9.24×1046.00×105±2.29×1054.10×105±1.32×1057.16×105±1.69×10524,30-二羟基-12(13)烯-羽扇豆醇455.35 455.35 2.77×104±2.72×1041.29×105±5.52×1048.19×104±9.84×1041.00×105±6.80×1043-羟基环木菠萝烷-24-烯-26-酸 (异杧果醇酸)455.35 455.35 4.76×104±2.51×1041.30×105±8.81×1047.32×104±9.17×1047.51×104±5.06×104齐墩果-12-烯-3-酮 (β-香树脂酮)425.38 217.19 1.71×104±1.62×1047.81×103±3.77×1034.50×104±2.82×1037.97×104±8.00×1043-羟基熊果-12-烯-28-酸 (3-表熊果酸)455.36 455.36 2.40×105±1.46×1055.11×103±3.32×1038.93×103±2.82×1033.17×105±4.55×1052,3-二羟基-12-熊果烯-28-酸471.35 471.34 2.69×105±8.97×1042.52×104±1.42×1044.92×104±3.99×1041.60×105±3.65×1043-羟基-9,19-环羊毛甾-24-烯-26-酸 (杧果醇酸)455.35 455.35 2.67×104±2.33×1049.63×104±6.82×1046.63×104±8.90×1046.26×104±4.23×1043,19-二羟基熊果-12-烯-28-酸 (坡模酸)471.35 471.35 1.74×106±1.62×1062.44×105±1.59×1053.58×105±6.31×1044.02×105±2.44×1053-羟基羽扇豆-20(29)-烯-28-酸 (白桦脂酸)455.36 455.36 3.87×105±4.82×1051.27×105±7.75×1047.79×104±9.77×1046.70×104±4.15×1042,3,19,23-四羟基熊果-12-烯-28-酸503.34 421.31 6.78×103±2.07×1032.04×104±2.91×1032.59×104±1.08×1041.66×104±3.79×102三萜皂苷2,3,19-三羟基熊果-12-烯-23,28-二酸-28-O-葡萄糖苷679.37 517.32 9±05.13×104±7.48×1032.51×104±1.46×1041.80×104±2.25×103薤白皂苷 G933.49 771.42 5.96×103±2.27×1034.26×103±1.84×1032.90×103±2.56×1034.58×104±3.94×104
注:相对含量9±0代表未检测到。
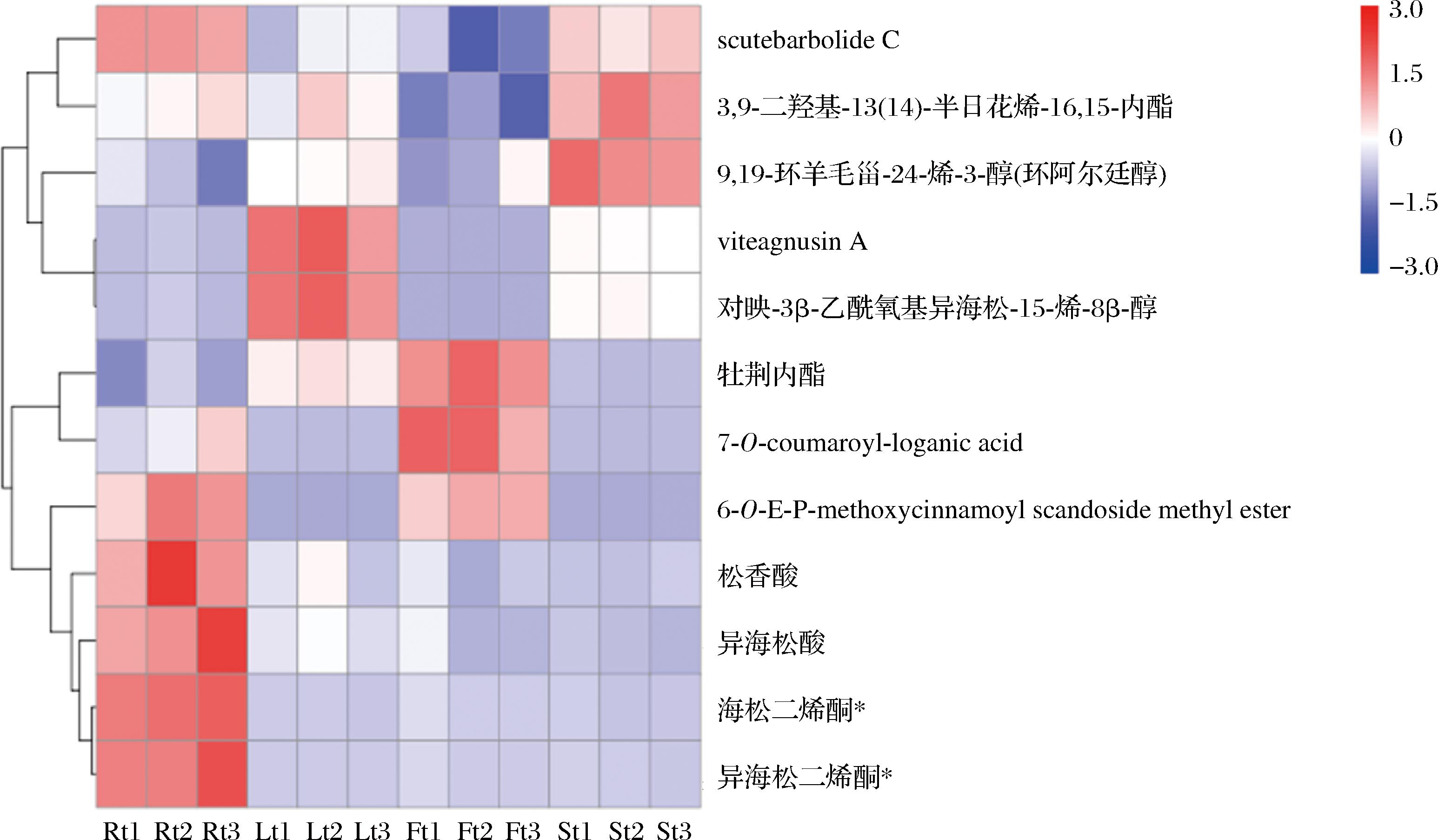
图4 不同器官的优势萜类代谢物热图
Fig.4 Heatmap of dominant terpenoid metabolites in different organs
注:横向为样品名称,Rt1-3、St1-3、Lt1-3、Ft1-3分别代表黄花菜的根、茎、叶、花样品;纵向为代谢物信息,不同颜色为相对含量标准化处理后得到的数值(红色代表高含量,蓝色代表低含量);*表示该物质有同分异构体。
3 结论与讨论
黄花菜作为我国传统的药食同源蔬菜,具有黄酮类、蒽醌类、萜类、生物碱、甾体皂苷和酚酸类等多种生物活性成分,表现出抗氧化、抗肿瘤、抗抑郁、改善睡眠及镇静、抗菌、抗炎和护肝等多种有益功能,在推动产业发展、开发功能性产品方面具有很高的价值[16]。萜类物质是一大类天然生物活性化合物,对植物的生存至关重要,同时也具有对人类有益的生物学和药理学特性[17]。例如,青蒿素和紫杉醇2种萜类物质分别被用作是抗疟疾和癌症的药物[18]。挖掘黄花菜中具有生物活性的化合物是当前的研究热点之一。
在采自台湾东部的黄花菜Hemerocallis disticha的花蕾中,利用YMC Carotenoid C30柱高效液相色谱和紫外光谱技术鉴定出了一系列类胡萝卜素[7],而本研究未鉴定出;在采自广西灵川的黄花菜Hemerocallis fulva根中,利用1H 和13C核磁共振方法鉴定出了一种二萜hemerocallal A[8],而本研究的黄花菜H.citrina在根、茎、叶、花中均有检测到;在采自波兰卢布林的黄花菜H.citrina很多器官中,利用气相色谱-质谱鉴定出了单萜1,8-桉叶素[9],而本研究采自山西大同的同种黄花菜未鉴定出。黄花菜萜类代谢物的组成因器官、品种、种植地以及检测方法而不同。
在本研究中,松香酸和异海松酸在黄花菜根中的含量较高,有研究表明松香酸可能通过调节miR-30a-3p的表达,增强人脐静脉血管内皮细胞的血管生成与细胞迁移[19],还可以用于治疗银屑病[20]。研究还发现松香酸通过抑制肿瘤坏死因子-α和环氧合酶-2的蛋白表达,从而抵抗炎症反应[21]。异海松酸具有抗结核活性,已经被用于由山东省中医药研究院研制的抗痨胶囊[22]。异海松酸也是一种多靶向离子通道调节剂,可降低自发跳动小鼠心房细胞系的兴奋性和心律失常,也是一种混杂离子通道调节剂和抗心房颤动的潜在候选药物[23]。9,19-环羊毛甾-24-烯-3-醇(环阿尔廷醇)在黄花菜茎中的含量较高,它是泡桐花油[24]、荞麦油[25]、广玉兰果实脂肪酸[26]等的重要成分。青叶花椒的叶的二氯甲烷提取物对白血病和乳腺癌细胞具有细胞毒性,而9,19-环羊毛甾-24-烯-3-醇在该提取物含量高达15.1%[27]。蜂胶的抗细菌有效成分中,9,19-环羊毛甾-24-烯-3-醇的丰度最高[28]。viteagnusin A在黄花菜叶中的含量较高,有研究曾在牡荆果实中分离出这种二萜类物质[29]。牡荆内酯在黄花菜的花中的含量较高,其在蔓荆植物中有大量发现,包括圆叶牡荆[30]、三叶蔓荆[31]、穗花牡荆[32]等。牡荆内酯对顺铂所致的大鼠肾毒性具有抗氧化和抗凋亡作用[33]。牡荆内酯也是穗花牡荆果实中重要的抗氧化成分之一[34]。
本研究基于UPLC-MS/MS分析,从黄花的根、茎、叶、花中共鉴定出43种萜类化合物,单萜7种、二萜18种、三萜16种、三萜皂苷2种,不同器官间的萜类物质积累量差异明显。根中的优势萜类代谢物为异海松二烯酮、海松二烯酮、松香酸、scutebarbolide C、异海松酸;茎中的优势萜类代谢物为3,9-二羟基-13(14)-半日花烯-16,15-内酯、9,19-环羊毛甾-24-烯-3-醇(环阿尔廷醇);叶中的优势萜类代谢物为viteagnusin A、对映-3β-乙酰氧基异海松-15-烯-8β-醇;花中的优势萜类代谢物为牡荆内酯、7-O-coumaroyl-loganic acid。本研究首次列举了黄花菜所有萜类化合物在根、茎、叶、花中的相对含量,为黄花菜各器官萜类化合物生物学功能研究奠定基础,对食品工业和医疗保健具有重要意义。
[1] 刘佩冶, 李可昕, 张超凡, 等.黄花菜生物活性成分及功能研究进展[J].食品与发酵工业, 2022, 48(12):330-336.
LIU P Y, LI K X, ZHANG C F, et al.Research progress on bioactive components and functions of daylily[J].Food and Fermentation Industries, 2022, 48(12):330-336.
[2] 张玉梅. 黄花菜的栽培技术与采收加工[J].现代农业, 2015,(5):61.
ZHANG Y M.Cultivation techniques and harvesting and processing of daylily[J].Modern Agriculture, 2015, (5):61.
[3] 赵瑛瑛. 不同产地黄花菜中的营养成分的差别及不同加工过程的影响[J].现代养生(下半月版), 2019(7):38-39.
ZHAO Y Y.Difference of nutritional components in daylily from different producing areas and the influence of different processing processes[J].Health Protection and Promotion, 2019(7):38-39.
[4] 李明玥, 刘宏艳, 肖静, 等.黄花菜的活性成分、生物活性及加工技术研究进展[J].食品工业科技, 2022, 43(19):427-435.
LI M Y, LIU H Y, XIAO J, et al.Research progress on bioactive components, biological activities, and processing technology of daylily (Hemerocallis citrina baroni)[J].Science and Technology of Food Industry, 2022, 43(19):427-435.
[5] 李佳美, 徐伟, 张雪, 等.基于HPLC-MS/MS对枇杷叶水提组分分析及萜类物质的结构鉴定[J].食品工业科技, 2022, 43(1):295-303.
LI J M, XU W, ZHANG X, et al.HPLC-MS/MS analysis of water-extracted components of loquat leaves and structural identification of terpenoids[J].Science and Technology of Food Industry, 2022, 43(1):295-303.
[6] NAGEGOWDA D A, GUPTA P.Advances in biosynthesis, regulation, and metabolic engineering of plant specialized terpenoids[J].Plant Science, 2020, 294:110457.
[7] TAI C Y, CHEN B H.Analysis and stability of carotenoids in the flowers of daylily (Hemerocallis disticha) as affected by various treatments[J].Journal of Agricultural and Food Chemistry, 2000, 48(12):5962-5968.
[8] YANG Z D, CHEN H, LI Y C.A new glycoside and a novel-type diterpene from Hemerocallis fulva (L.)[J].Helvetica Chimica Acta, 2003, 86(10):3305-3309.
[9] SZEWCZYK K, KALEMBA D, MIAZGA-KARSKA M, et al.The essential oil composition of selected Hemerocallis cultivars and their biological activity[J].Open Chemistry, 2019, 17(1):1412-1422.
[10] 陈秀萍, 苏文炳, 蒋际谋, 等.基于UPLC-MS/MS的枇杷不同组织萜类代谢物鉴定[J].果树学报, 2022, 39(11):2099-2112.
CHEN X P, SU W B, JIANG J M, et al.UPLC-MS/MS identification of terpenoid metabolites in different organs of Eriobotrya japonica[J].Journal of Fruit Science, 2022, 39(11):2099-2112.
[11] 丁亚丽. 基于非靶代谢组学多刺绿绒蒿不同器官代谢物差异分析[J].生物资源, 2022, 44(5):476-483.
DING Y L.Analysis of metabolites in different organs of Meconopsis horridula based on untargeted metabolomics[J].Biotic Resources, 2022, 44(5):476-483.
[12] 陈卓, 胡芯, 唐洪玉.黑藻(Hydrilla verticillat)在铅、锌胁迫下的代谢组学研究[J].生态毒理学报, 2022, 17(4):405-416.
CHEN Z, HU X, TANG H Y.Metabolomics study of Hydrilla verticillata under heavy metal stress of lead and zinc[J].Asian Journal of Ecotoxicology, 2022, 17(4):405-416.
[13] SEGLA KOFFI DOSSOU S, XU F T, YOU J, et al.Widely targeted metabolome profiling of different colored sesame (Sesamum indicum L.) seeds provides new insight into their antioxidant activities[J].Food Research International, 2022, 151:110850.
[14] WANG L, ZHANG T, SHEN T, et al.Serum metabolomics for early diagnosis of esophageal squamous cell carcinoma by UHPLC-QTOF/MS[J].Metabolomics, 2016, 12(7):116.
[15] THÉVENOT E A, ROUX A, XU Y, et al.Analysis of the human adult urinary metabolome variations with age, body mass index, and gender by implementing a comprehensive workflow for univariate and OPLS statistical analyses[J].Journal of Proteome Research, 2015, 14(8):3322-3335.
[16] 武珍珍, 洪沙沙, 吕虹瑞, 等.黄花菜保鲜贮藏及后处理加工技术研究进展[J].食品与发酵工业, 2022, 49(22):334-340.
WU Z Z, HONG S S, LYU H R, et al.Research progress in fresh-keeping, storage and post-processing technology of daylily[J].Food and Fermentation Industries, 2023, 49(22):334-340.
[17] SINGH B, SHARMA R A.Plant terpenes:Defense responses, phylogenetic analysis, regulation and clinical applications[J].3 Biotech, 2015, 5(2):129-151.
[18] RADHAKRISHNA S, KUMARI P S.GCMS analysis of total terpenoids from Baliospermum montanum and its antimicrobial activity[J].Iaetsd Journal for Advanced Research in Applied Sciences, 2021, 5(3):94-101.
[19] 吴德虎, 唐慧莉, 陈慧.松香酸通过上调miR-30a-3p表达增强缺氧诱导的HUVECs血管生成[J].浙江中西医结合杂志, 2022, 32(8):710-715.
WU D H, TANG H L, CHEN H.Abietic acid enhances hypoxia-induced angiogenesis in human umbilical vein endothelial cells (HUVECs) by upregulating miR-30a-3p expression[J].Zhejiang Journal of Integrated Traditional Chinese and Western Medicine, 2022, 32(8):710-715.
[20] 刘勇, 闫小宁.基于网络药理学的松香酸治疗银屑病的作用机制研究[J].世界临床药物, 2022, 43(1):19-25.
LIU Y, YAN X N.Mechanism of anti-psoriasis of abietic acid based on network pharmacology[J].World Clinical Drugs, 2022, 43(1):19-25.
[21] TAKAHASHI N, KAWADA T, GOTO T, et al. Abietic acid activates peroxisome proliferator-activated receptor-γ (PPARγ) in RAW264.7 macrophages and 3T3-L1 adipocytes to regulate gene expression involved in inflammation and lipid metabolism[J]. FEBS Letters, 2003, 550(1-3):190-194.
[22] 程立方, 崔秀君.抗痨胶囊中异海松酸的含量测定[J].中国医院药学杂志, 2007, 27(5):702-703.
CHENG L F, CUI X J.Determination of isopimaric acid in antituberculosis capsules[J].Chinese Journal of Hospital Pharmacy, 2007, 27(5):702-703.
[23] SALARI S, SILVERÅ EJNEBY M, BRASK J, et al.Isopimaric acid-a multi-targeting ion channel modulator reducing excitability and arrhythmicity in a spontaneously beating mouse atrial cell line[J].Acta Physiologica, 2018, 222(1):10.1111/apha.
[24] 魏希颖, 张延妮, 白玲玲, 等.泡桐花油的GC-MS分析及抑菌作用研究[J].天然产物研究与开发, 2008, 20(1):87-90.
WEI X Y, ZHANG Y N, BAI L L, et al.Analysis of oil in the Flos paulowniae by GC-MS and study on antibacterial function[J].Natural Product Research and Development, 2008, 20(1):87-90.
[25] 范铮, 宋庆宝, 强根荣, 等.荞麦籽粒石油醚萃取物化学成分的研究[J].林产化工通讯, 2003, 37(5):17-20.
FAN Z, SONG Q B, QIANG G R, et al.Study on chemical constituents of petroleum ether extract from the seed of Fagopyrum esculentum[J].Journal of Chemical Industry of Forest Products (Bimonthly), 2003, 37(5):17-20.
[26] 张倩, 唐娜娜, 于海林, 等.广玉兰果实脂肪酸成分的GC-MS分析[J].河南大学学报(医学版), 2009, 28(2):101-103.
ZHANG Q, TANG N N, YU H L, et al.Analysis of fatty acids from fruit of Magnolia grandifore by GC-MS[J].Journal of Henan University (Medical Science), 2009, 28(2):101-103.
[27] KIM J S, JUN D Y, WOO M H, et al.Chemical composition and antitumor apoptogenic activity of methylene chloride extracts from the leaves of Zanthoxylum schinifolium[J].Journal of Life Science, 2006, 16(3):546-554.
[28] HASAN A E Z, ARTIKA I M, KUSWANDI, et al.Analysis of active components of Trigona spp propolis from pandeglang indonesia[J].Global Journal of Biology, Agriculture &Health Sciences, 2014, 3(1):215-219.
[29] ONO M, YAMASAKI T, KONOSHITA M, et al.Five new diterpenoids, Viteagnusins A:E, from the fruit of Vitex agnus-castus[J].Chemical and Pharmaceutical Bulletin, 2008, 56(11):1621-1624.
[30] ONO M, YAMAMOTO M, YANAKA T, et al.Ten new labdane-type diterpenes from the fruit of Vitex rotundifolia[J].Chemical and Pharmaceutical Bulletin, 2001, 49(1):82-86.
[31] 闫利华, 张启伟, 王智民, 等.三叶蔓荆化学成分研究(Ⅱ)[J].中草药, 2010, 41(10):1622-1624.
YAN L H, ZHANG Q W, WANG Z M, et al. Studies on chemical constituents of Vitex trifoliata (Ⅱ)[J]. Chinese Traditional and Herbal Drugs, 2010, 41(10):1622-1624.
[32] IBRAHIM N A, SHALABY A S, FARAG R S, et al.Phytochemical investigation and hormonal activity of Vitex agnus-castus L.fruits growing in Egypt[J].Jasmr, 2008, 1(1):63-74.
[33] DENIZ G Y, LALOGLU E, ALTUN S, et al.Antioxidant and anti-apoptotic effects of vitexilactone on cisplatin-induced nephrotoxicity in rats[J].Biotechnic &Histochemistry: Official Publication of the Biological Stain Commission, 2020, 95(5):381-388.
[34] ![]() Z, HOHMANN J, FORGO P, et al.Diterpenoids and flavonoids from the fruits of Vitex agnus-castus and antioxidant activity of the fruit extracts and their constituents[J].Phytotherapy Research:PTR, 2007, 21(4):391-394.
Z, HOHMANN J, FORGO P, et al.Diterpenoids and flavonoids from the fruits of Vitex agnus-castus and antioxidant activity of the fruit extracts and their constituents[J].Phytotherapy Research:PTR, 2007, 21(4):391-394.