巴戟天(Morinda officinalis How)是茜草科巴戟天属植物,2020版《中国药典》规定其入药部位为干燥根,记录了其具有补肾阳、强筋骨、祛风湿等作用,可用于风湿痹痛、筋骨萎软、少腹冷痛等症[1]。巴戟天作为药食同源中药材,是我国的四大南药之一[2],广泛分布于广东、广西、福建、海南等地。福建南靖和溪产巴戟天为闽产道地中药材“福九味”之一,是国家农产品地理标志登记保护品种,在民间是一种非常重要的药膳材料,应用极其广泛。目前,巴戟天的研究主要围绕其化学成分、药理作用等方面开展其药效作用机制的研究[3-9],作为药食同源物质,从营养角度评价巴戟天的营养价值及食疗作用的研究较少。
氨基酸作为营养物质之一,参与蛋白质合成、机体新陈代谢,具有提高人体免疫力,影响人们的学习记忆,为人体供能等功能[10-15],其中,赖氨酸、色氨酸、苯丙氨酸、蛋氨酸、苏氨酸、异亮氨酸、亮氨酸和缬氨酸为人体必需氨基酸,必须从食物中摄取以满足人体需要。同时,氨基酸作为中药材发挥药理作用主要物质之一,其营养价值是药食同源类中药材市场价值和竞争力的关键因素[16-18]。联合国粮食和农业组织(Food and Agriculture Organization of the United Nations, FAO)和世界卫生组织(World Health Organization, WHO)提出了蛋白质营养价值的氨基酸模式[19],必需氨基酸组成越接近人体蛋白质的组成,其营养价值越高,因此,可用必需氨基酸比值(amino acid ratio, RAA)来表示食物中氨基酸与模式氨基酸含量的关系,用氨基酸比值系数(ratio coefficient, RC)判断氨基酸是过剩还是缺乏,利用必需氨基酸比值系数分(ratio coefficient score, SRC)可评价蛋白质的营养价值。目前,用于测定氨基酸含量的方法有氨基酸自动分析仪测定法[20]、高效液相色谱法[21]、紫外分光光度法[22]、离子交换色谱法[23]、气相色谱法[24]等。其中,高效液相色谱法可采用多种衍生化试剂,具有灵敏度高、分析时间短的优点,是氨基酸含量测定常用的方法之一。
本研究利用福建漳州本地资源,以不同地区、不同生长年限的巴戟天样品为实验材料,采用柱前衍生-高效液相色谱法测定氨基酸成分及含量,参照FAO/WHO氨基酸标准模式谱,通过RAA、RC、SRC评价其营养价值,并利用系统聚类和主成分分析对其进行分类分析,以期从营养学角度阐释巴戟天的药用和食用价值,为深入开发利用巴戟天提供参考依据。
1 材料与方法
1.1 材料与试剂
16批巴戟天干燥根样品(采集详细信息见表1),经漳州卫生职业学院王小平教授鉴定为茜草科植物巴戟天Morindae officinalis Radix的干燥根(去木心),经粉碎过三号筛得其粉末样品。
表1 巴戟天药材信息
Table 1 Morindae officinalis Radix medicinal information

编号采集地址生长年限/年纬度经度海拔/m采集时间S1平和县长乐镇张坑村524.303 160 19°N116.916 166 28°E3252021年8月25日S2云霄县金坑村2024.064 722°N117.178 056°E190 2021年8月25日S3南靖县蝉山西北4~524.545 120 67°N117.421 621 53°E164 2021年8月20日S4南靖县和溪镇迎富村624.892 692 76°N117.270 241 76°E614 2021年8月20日S5南靖县和溪镇迎富村1024.895 556°N117.271 667°E630 2021年8月21日S6南靖县和溪林坂村624.891 111°N117.228 056°E221 2021年8月28日S7南靖县和溪林坂村824.891 111°N117.228 056°E221 2021年8月28日S8南靖县和溪林坂村624.904 105 89°N117.244 091 31°E429 2021年9月2日S9南靖县和溪林坂村1024.902 222°N117.242 778°E360 2021年9月2日S10南靖县和溪林坂村724.914 768 05°N117.282 133 42°E698 2021年9月2日S11南靖县和溪林坂村1024.902 222°N117.242 778°E360 2021年9月2日S12南靖县和溪林坂村724.914 768 05°N117.282 133 42°E698 2021年9月2日S13南靖县和溪林坂村724.914 768 05°N117.282 133 42°E698 2021年9月2日S14南靖县和溪林坂村724.914 768 05°N117.282 133 42°E698 2021年9月2日S15南靖县和溪林坂村6~724.913 721 23°N117.246 296 59°E311 2021年9月8日S16南靖县和溪林坂村6~724.913 721 23°N117.246 296 59°E311 2021年9月8日
15种氨基酸对照品,中国食品药品检定研究院;异硫氰酸苯酯,阿拉丁试剂(上海)有限公司;三乙胺、无水乙酸钠、冰醋酸、盐酸和正己烷等(分析纯),西陇科学股份有限公司;乙腈、甲醇(色谱纯),Fisher公司。
1.2 仪器与设备
HJ-8集热式磁力搅拌器,常州国华电器有限公司;HWS-28型电热恒温水浴锅,上海一恒科学仪器有限公司;TDZ5-WS离心机,湖南湘仪实验室仪器开发有限公司;UVS-3旋涡混合器,北京优晟联合科技有限公司;FST-T0超纯水系统,上海富诗仪器设备有限公司;PX224ZH/E电子天平(万分之一),奥豪斯仪器(常州)有限公司;梅特勒XSE205DU电子分析天平(十万分之一),梅特勒托利多科技有限公司;KQ-250DE数控超声波清洗器,昆山市超声仪器有限公司;Agilent 1260型高效液相色谱仪,美国Agilent公司;Ultimate Amino Acid色谱柱,月旭科技(上海)有限公司。
1.3 实验方法
1.3.1 供试品溶液制备
精密称取巴戟天粉末0.20 g于玻璃水解管中,加入10 mL 6 mol/L盐酸溶液,密塞,置于140 ℃油浴锅中水解12 h。冷却过滤至蒸发皿中,于100 ℃水浴锅上蒸干,残渣用0.10 mol/L盐酸溶液溶解转移并定容至5 mL,摇匀后,溶液用5 000 r/min,离心10 min,将上清液置于冰箱冷藏备用。
1.3.2 对照品溶液制备
精密称取各氨基酸对照品适量,用0.10 mol/L盐酸溶液配制成L-天冬氨酸、L-谷氨酸、L-丝氨酸、甘氨酸、L-组氨酸、L-精氨酸、L-苏氨酸、L-丙氨酸、L-脯氨酸、L-酪氨酸、L-缬氨酸、L-异亮氨酸、L-亮氨酸、L-苯丙氨酸、L-赖氨酸的质量浓度分别为1.332、0.368、0.263、0.188、0.388、0.435、0.298、0.223、0.988、0.453、0.293、0.328、0.328、0.413、0.365 mg/mL的氨基酸混合对照品储备液。
1.3.3 柱前衍生化方法
分别精密移取供试品溶液、氨基酸混合对照品储备液、空白溶液(0.10 mol/L盐酸溶液)各200 μL,分别加入1 mol/L三乙胺的乙腈溶液和0.10 mol/L PITC乙腈溶液各100 μL,涡旋10 s混匀,于50 ℃水浴中反应45 min,然后加入正己烷0.7 mL,涡旋10 s,静置10 min分层,弃去上层溶液,重复萃取3次,取下层溶液200 μL用超纯水定容至2 mL,再用0.22 μm有机微孔滤膜过滤,取续滤液即得。
1.3.4 色谱条件
Ultimate Amino Acid色谱柱(4.6 mm×250 mm,5 μm);柱温为40 ℃;检测波长254 nm;进样量10 μL;流速为1 mL/min;流动相为0.1 mol/L醋酸钠溶液(pH 6.50)(A)和乙腈(B),梯度洗脱:0~4 min,95% A;4.01~10 min,95%~90% A;10.01~21 min,90% A;21.01~30 min,90%~80% A;30.01~35 min,80% A;35.01~45 min,80%~65% A;45.01~50 min,65%~15% A;50.01~60 min,15%~95% A。
1.4 数据处理
使用Excel对16批漳州巴戟天分析数据进行统计与处理,利用SPSS 22、SIMCA 14.1进行聚类和主成分分析。
根据巴戟天样品中氨基酸的分析检测结果,利用氨基酸比值系数法对巴戟天的营养价值进行评价[25],并根据FAO/WHO给出的氨基酸推荐模式谱,按照公式(1)~公式(6)计算16批漳州巴戟天药材中的必需氨基酸占总氨基酸比例(essential amino acids/total amino acids,EAA/TAA)、必需氨基酸与非必需氨基酸比例(essential amino acids/non-essential amino acids,EAA/NEAA)、药用氨基酸占总氨基酸比例(medicinal amino acids/total amino acids,MAA/TAA)、RAA、RC及SRC。
EAA/TAA的计算如公式(1)所示:
EAA/TAA/%=样品中必需氨基酸含量/样品中氨基酸总含量×100
(1)
EAA/NEAA的计算如公式(2)所示:
EAA/NEAA/%=样品中必需氨基酸含量/样品非必需氨基酸含量×100
(2)
MAA/TAA的计算如公式(3)所示:
MAA/TAA/%=样品中药用氨基酸含量/样品中氨基酸总含量×100
(3)
RAA的计算如公式(4)所示:
RAA=相应氨基酸的EAA占比/模式中氨基酸的相应EAA值占比
(4)
RC的计算如公式(5)所示:
RC=RAA/RAA平均值
(5)
SRC的计算如公式(6)所示:
SRC=100-CV×100
(6)
式中:CV为RC的标准偏差。
2 结果与分析
2.1 实验条件考察
2.1.1 衍生化条件的考察
衍生化试剂用量与反应时间对氨基酸含量测定有很大影响,若反应不完全,氨基酸则无法全部转化为衍生物,导致测定结果不准确[26]。本实验考察了样品在120 ℃下水解10 h后衍生化化反应的条件,比较了不同衍生化试剂用量、不同衍生化反应水浴时间及不同衍生化水浴温度对巴戟天氨基酸总含量的影响。结果表明,最佳的衍生化条件为PITC乙腈溶液与三乙胺乙腈溶液用量均为100 μL,在50 ℃水浴中反应45 min。
2.1.2 供试品溶液提取条件考察
参考文献[27],考察条件为样品在100、120、140 ℃下水解10 h及在120 ℃下分别水解8、10、12 h,再按1.3.3节条件进行衍生化,并按1.3.4节色谱条件进行分析,测得样品中总氨基酸含量分别为38.31、42.72、46.48、44.70、43.98、45.48 mg/g,因此,采用140 ℃油浴水解12 h。
2.1.3 色谱柱考察
色谱柱是色谱分离的核心部件,直接影响色谱分离效果。根据课题组前期试验[27],考察了在相同流动相条件下Ultimate Amino Acid(4.6 mm×250 mm,5 μm)和Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm)色谱柱对氨基酸混合对照品的分离效果。结果表明,Ultimate Amino Acid色谱柱能够将16种氨基酸完全分开,而Agilent ZORBAX SB-C18色谱柱无法实现。因此,选用Ultimate Amino Acid色谱柱作为本试验的色谱柱。
2.2 专属性考察
分别精密吸取混合对照品、供试品及空白溶液各200 μL,分别按照1.3.3节下的衍生化条件进行反应,按1.3.4节下的色谱条件进行测定,结果15种氨基酸色谱峰分离良好,色谱图见图1。
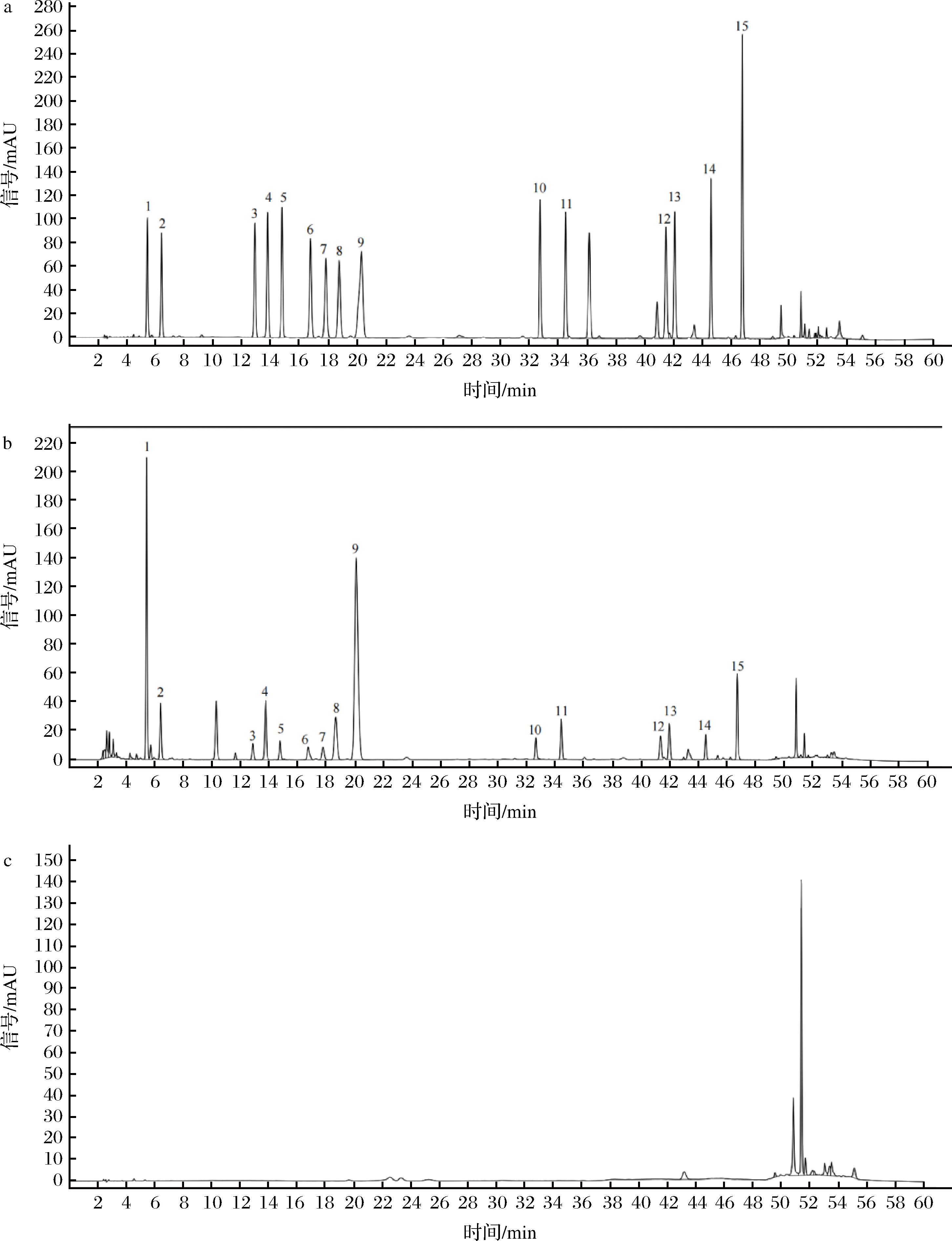
1-L-天冬氨酸(Asp);2-L-谷氨酸(Glu);3-L-丝氨酸(Ser);4-甘氨酸(Gly);5-L-组氨酸(His);6-L-精氨酸(Arg);7-L-苏氨酸(Thr);8-L-丙氨酸(Ala);9-L-脯氨酸(Pro);10-L-酪氨酸(Tyr);11-L-缬氨酸(Val);12-L-异亮氨酸(Ile);13-L-亮氨酸(Leu);14-L-苯丙氨酸(Phe);15-L-赖氨酸(Lys)a-混合对照品色谱图;b-供试品氨基酸色谱图;c-空白溶液色谱图
图1 混合对照品、供试品溶液及空白溶液色谱图
Fig.1 HPLC chromatograms of deriratized solution of mixed reference standard solution, sample and blank solution
2.3 线性关系测定结果
精密量取氨基酸混合对照品储备液0.05、0.10、0.50、0.80、1.00 mL,分别用0.1 mol/L的盐酸溶液定容至1 mL,摇匀,并按1.3.3节进行衍生化,按照1.3.4节色谱条件进行色谱分析。以各氨基酸对照品峰面积(Y)为纵坐标,以进样量(X,μg)为横坐标,绘制标准曲线,计算回归方程。结果如表2所示,各种氨基酸的相关系数均大于0.999 6。L-天冬氨酸、L-谷氨酸、L-丝氨酸、甘氨酸、L-组氨酸、L-精氨酸、L-苏氨酸、L-丙氨酸、L-脯氨酸、L-酪氨酸、L-缬氨酸、L-异亮氨酸、L-亮氨酸、L-苯丙氨酸、L-赖氨酸15种氨基酸的线性范围分别为3.3~66.6、0.9~18.4、0.7~13.1、0.5~9.4、1.0~19.4、1.1~21.8、0.7~14.9、0.6~11.1、2.5~49.4、1.1~22.6、0.7~14.6、0.8~16.4、0.8~16.4、1.0~20.6、0.9~18.3 μg/mL。
表2 十五种氨基酸标准曲线
Table 2 15 kinds of amino acid standard curve
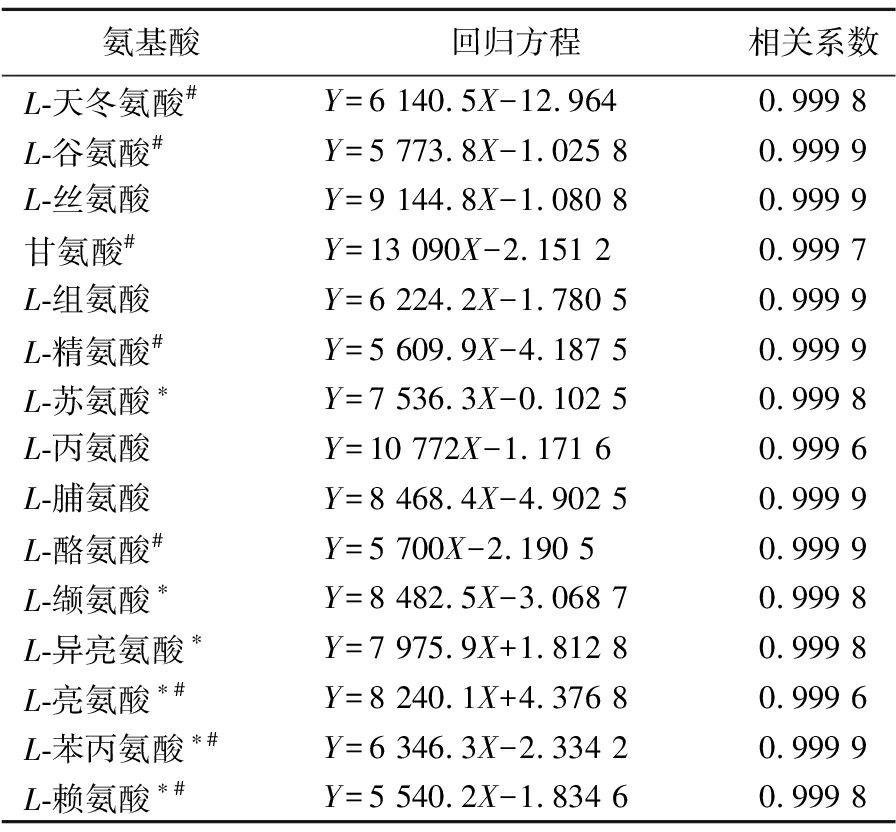
氨基酸回归方程相关系数L-天冬氨酸#Y=6 140.5X-12.9640.999 8L-谷氨酸#Y=5 773.8X-1.025 80.999 9L-丝氨酸Y=9 144.8X-1.080 80.999 9甘氨酸#Y=13 090X-2.151 20.999 7L-组氨酸Y=6 224.2X-1.780 50.999 9L-精氨酸#Y=5 609.9X-4.187 50.999 9L-苏氨酸∗Y=7 536.3X-0.102 50.999 8L-丙氨酸Y=10 772X-1.171 60.999 6L-脯氨酸Y=8 468.4X-4.902 50.999 9L-酪氨酸#Y=5 700X-2.190 50.999 9L-缬氨酸∗Y=8 482.5X-3.068 70.999 8L-异亮氨酸∗Y=7 975.9X+1.812 80.999 8L-亮氨酸∗#Y=8 240.1X+4.376 80.999 6L-苯丙氨酸∗#Y=6 346.3X-2.334 20.999 9L-赖氨酸∗#Y=5 540.2X-1.834 60.999 8
注:*为必需氨基酸,#为药用氨基酸。
2.4 精密度、稳定性、重复性及加样回收率测定结果
2.4.1 精密度试验
精密移取1.3.2节中配制的混合对照品溶液,按照1.3.3节方法进行柱前衍生化,按1.3.4节色谱条件连续进样6次,记录15种氨基酸的峰面积并计算相对标准偏差(relative standard deviation, RSD)。结果显示L-天冬氨酸、L-谷氨酸、L-丝氨酸、甘氨酸、L-组氨酸、L-精氨酸、L-苏氨酸、L-丙氨酸、L-脯氨酸、L-酪氨酸、L-缬氨酸、L-异亮氨酸、L-亮氨酸、L-苯丙氨酸、L-赖氨酸15种氨基酸的峰面积RSD分别为:1.18%、1.17%、0.69%、1.28%、0.56%、1.75%、1.75%、0.99%、1.31%、0.91%、1.14%、1.88%、2.43%、0.95%、0.80%,均小于3%,表明仪器精密度良好。
2.4.2 稳定性试验
精密称取巴戟天样品粉末(S7)0.20 g,按照1.3.1节方法制备成供试品溶液,按照1.3.3节方法进行衍生化,按照1.3.4节色谱条件,分别于0、2、4、8、12、24 h进样分析,记录各氨基酸峰面积,并计算RSD。结果显示,15种氨基酸的RSD分别为2.19%、2.96%、1.93%、0.86%、2.63%、2.15%、2.37%、2.17%、0.33%、2.52%、2.77%、1.69%、2.88%、2.36%、1.82%,均小于3%,表明衍生化后样品在24 h内稳定性良好。
2.4.3 重复性试验
精密称取6份巴戟天样品粉末(S7)0.20 g,按照1.3.1节方法制备成供试品溶液,按照1.3.3节方法进行衍生化,按照1.3.4节色谱条件进行色谱分析。结果显示,15种氨基酸的峰面积RSD分别为2.35%、2.27%、2.74%、2.60%、2.24%、1.79%、2.38%、2.38%、2.64%、2.15%、1.84%、1.01%、2.69%、2.54%、1.60%,均小于3%,表明该方法重复性良好。
2.4.4 加样回收率测定
分别精密称取6份巴戟天样品粉末(S15)0.20 g,精密加入相当含量的氨基酸对照品,分别按1.3.1节和1.3.3节方法制备供试品溶液并进行衍生化,再按1.3.4节方法进行色谱分析,测定并计算各氨基酸相应的含量及回收率。15种氨基酸的平均加样回收率为100%、100%、97%、99%、97%、100%、97%、100%、100%、99%、100%、102%、100%、100%、100%,RSD分别为0.44%、1.33%、2.37%、1.27%、2.14%、2.71%、2.38%、1.79%、0.41%、2.85%、2.55%、2.50%、2.29%、2.78%、1.43%。
2.5 巴戟天样品中氨基酸成分分析
2.5.1 氨基酸总量分析
分别精密称取16批巴戟天样品0.20 g,按照1.3.1节制备成供试品溶液,按照1.3.3节方法进行柱前衍生化处理,再按照1.3.4节色谱条件进样分析(由于样品S1、S2、S11氨基酸含量较小,故进样20 μL,样品S12氨基酸含量较大故进样4 μL),均检测到15种氨基酸,根据各峰面积及氨基酸工作曲线计算样品含量,结果如图2与表3所示。结果表明,通过柱前衍生-高效液相色谱法检测发现,16批巴戟天样品中均未测到色氨酸(在盐酸水解过程中被破坏)与胱氨酸,且蛋氨酸含量也极小,故未进行定量分析;S1的氨基酸总含量最小为17.87 mg/g,S12的氨基酸总量最大为102.15 mg/g;15种氨基酸中,平均含量最低的是丝氨酸,最高的是脯氨酸;16批巴戟天样品中含量最高的氨基酸除S9与S12为天冬氨酸外,其余14个样均为脯氨酸。
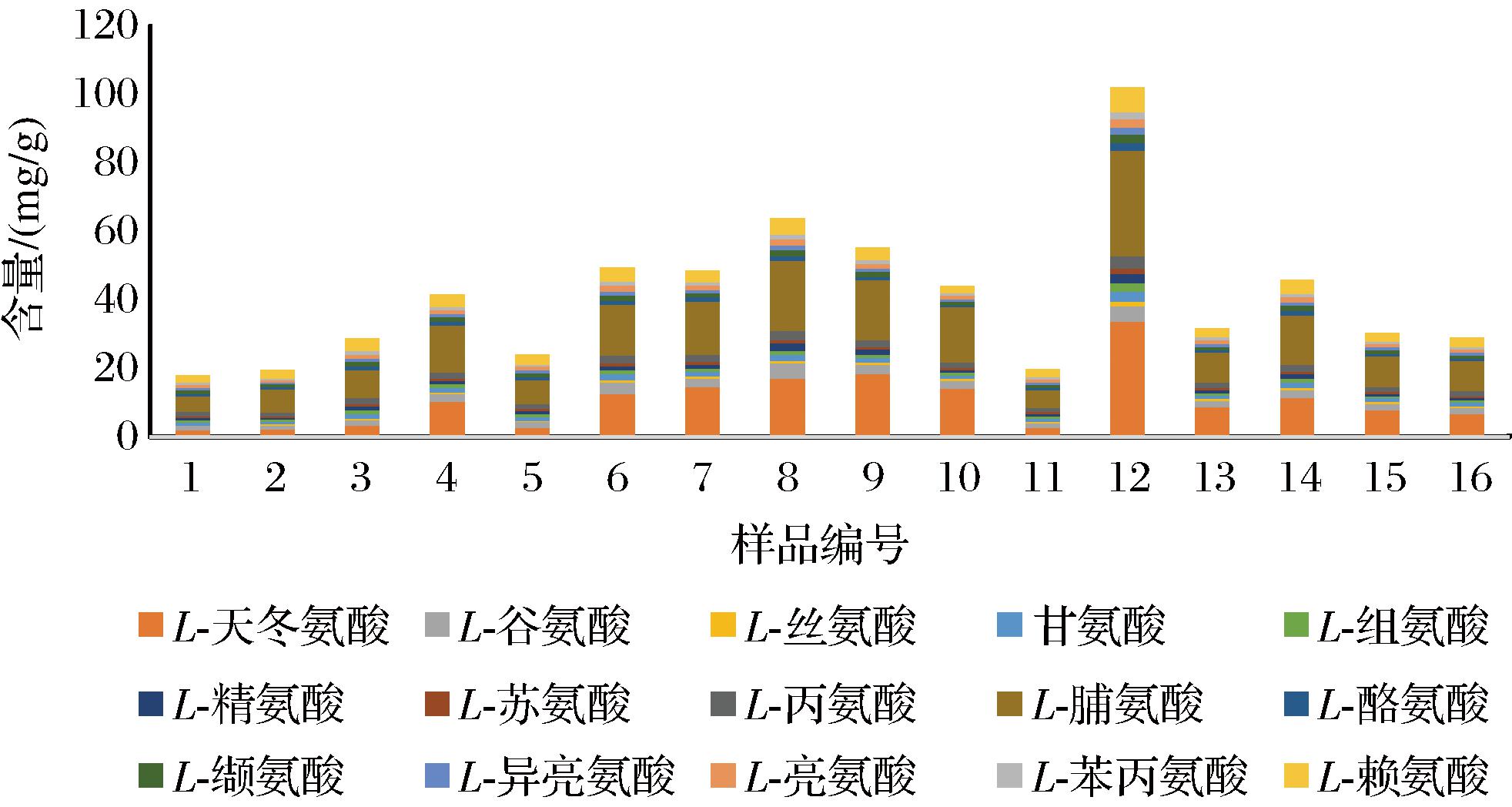
图2 十六批巴戟天氨基酸含量
Fig.2 Amino acid content in 16 batches of Morindae officinalis Radix
表3 十六批巴戟天样品氨基酸种类分析表
Table 3 Analysis table of amino acid types in 16 batches of Morindae officinalis Radix
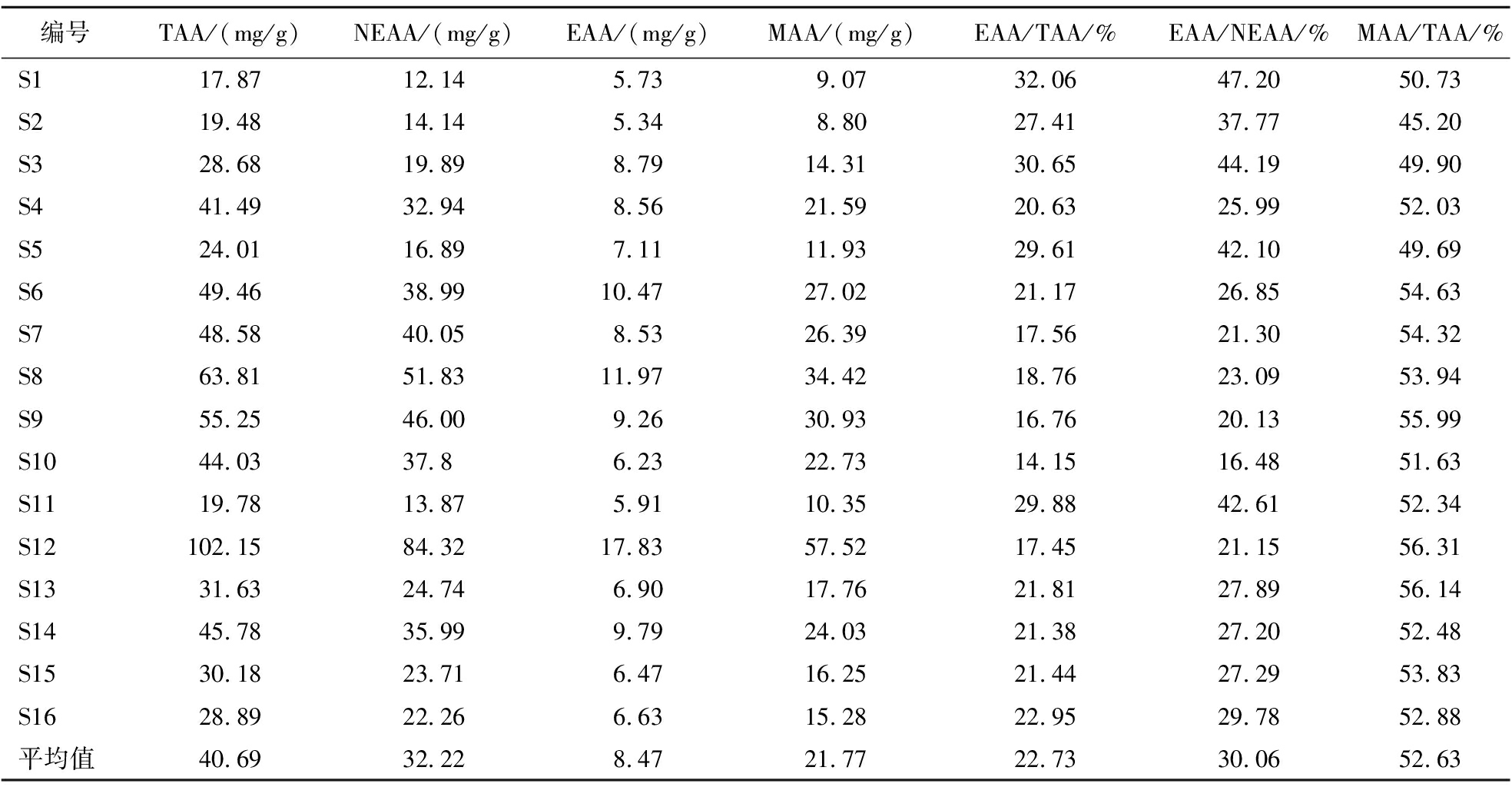
编号TAA/(mg/g)NEAA/(mg/g)EAA/(mg/g)MAA/(mg/g)EAA/TAA/%EAA/NEAA/%MAA/TAA/%S117.8712.145.739.0732.0647.2050.73S219.4814.145.348.8027.4137.7745.20S328.6819.898.7914.3130.6544.1949.90S441.4932.948.5621.5920.6325.9952.03S524.0116.897.1111.9329.6142.1049.69S649.4638.9910.4727.0221.1726.8554.63S748.5840.058.5326.3917.5621.3054.32S863.8151.8311.9734.4218.7623.0953.94S955.2546.009.2630.9316.7620.1355.99S1044.0337.86.2322.7314.1516.4851.63S1119.7813.875.9110.3529.8842.6152.34S12102.1584.3217.8357.5217.4521.1556.31S1331.6324.746.9017.7621.8127.8956.14S1445.7835.999.7924.0321.3827.2052.48S1530.1823.716.4716.2521.4427.2953.83S1628.8922.266.6315.2822.9529.7852.88平均值40.6932.228.4721.7722.7330.0652.63
另外,不同生长年限,不同生长地区的巴戟天样品中氨基酸的含量也有所不同。6~7年生的巴戟天中,S12的氨基酸总量最高,S16的氨基酸总量最低。对比6、7、8年生巴戟天与5、10、20年生巴戟天氨基酸含量,可以得出,6~8年生巴戟天氨基酸含量普遍高于5年生、10年生及20年生样品,其中样品S12氨基酸总含量最高,S1最低。不同采集地中,林坂村采集的S6和S8(均为6年生)、S9(10年生)氨基酸总含量分别高于迎富村相同生长年限的S4(6年生)、S5(10年生);相同生长年限,林坂村采集的S11与S9,S16与S6、S8氨基酸总含量存在较大差异。因此,不同生长年限,不同生长地区,会影响植物体内化学成分的积累,其中,6~8年生的巴戟天氨基酸含量最高。
2.5.2 必需氨基酸含量分析
由图2和表3可知,16批巴戟天样品中均含有6种人体必需氨基酸,总含量为5.34~17.83 mg/g,其中,样品S12的必需氨基酸含量最高;Thr含量最少,Lys含量最高。必需氨基酸占氨基酸总量比例(EAA/TAA)为14.15%~32.06%,平均值为22.73%,必需氨基酸占非必需氨基酸比例(EAA/NEAA)为16.48%~47.20%,平均值为30.06%,与FAO/WHO提出的EAA/TAA为40%和EAA/NEAA为60%的理想蛋白质有一定的差距[19]。虽然S1的TAA最低,EAA很低,但它的EAA/TAA为32.06%,EAA/NEAA为47.20%,最接近FAO和WHO的要求。
2.5.3 药用氨基酸含量分析
巴戟天是一种药食同源中药材,其药用氨基酸的含量是发挥药效的重要因素之一,因此分析巴戟天中MAA的组成及含量,可为巴戟天的质量控制和开发提供依据。由图2可知,16批巴戟天中均含有Asp、Glu、Gly、Arg、Tyr、Leu、Phe、Lys等8种药用氨基酸,其MAA/TAA为45.20%~56.31%,其中,S12的巴戟天药用氨基酸含量最高,达到57.52 mg/g,说明巴戟天中药用氨基酸的含量较为丰富。
在巴戟天中含量最高的4种氨基酸依次是Pro、Asp、Lys和Glu,其中,Asp和Glu为药用氨基酸,能增强肝脏功能,消除疲劳,可用于肝病治疗等[10-12];Lys既是必需氨基酸又是药用氨基酸,具有增强免疫力、解疼痛和炎症等作用[13];它们与巴戟天“归肾、肝经”,补肾阳、增强免疫力等功效密切相关。
2.6 漳州巴戟天必需氨基酸营养价值评价
2.6.1 巴戟天中各种EAA与模式谱比较
为进一步了解巴戟天中氨基酸的营养价值,将所测得的巴戟天中某必需氨基酸EAA/TAA值与FAO/WHO模式谱中相对应的氨基酸值比较,结果如表4所示。16个巴戟天样品中Ile、Leu、Thr、Val、以及Phe+Tyr的EAA/TAA值大多都低于FAO/WHO模式谱中的标准值,基本上接近或高于成人标准值,可以满足成人需要。从单个必需氨基酸含量来看,有15份巴戟天Lys含量高于FAO/WHO模式谱的值,它具有增强免疫力、解疼痛和炎症等作用[13],可用于弥补其他食物缺乏Lys带来的影响;由此可知巴戟天中氨基酸模式与人体蛋白需求有差别,在其发挥药效时需要搭配其他氨基酸丰富的食品食用,以此提高蛋白利用率。
表4 十六批巴戟天必需氨基酸的组成及比较
Table 4 Composition and comparative analysis of essential amino acids in 16 batches of Morindae officinalis Radix
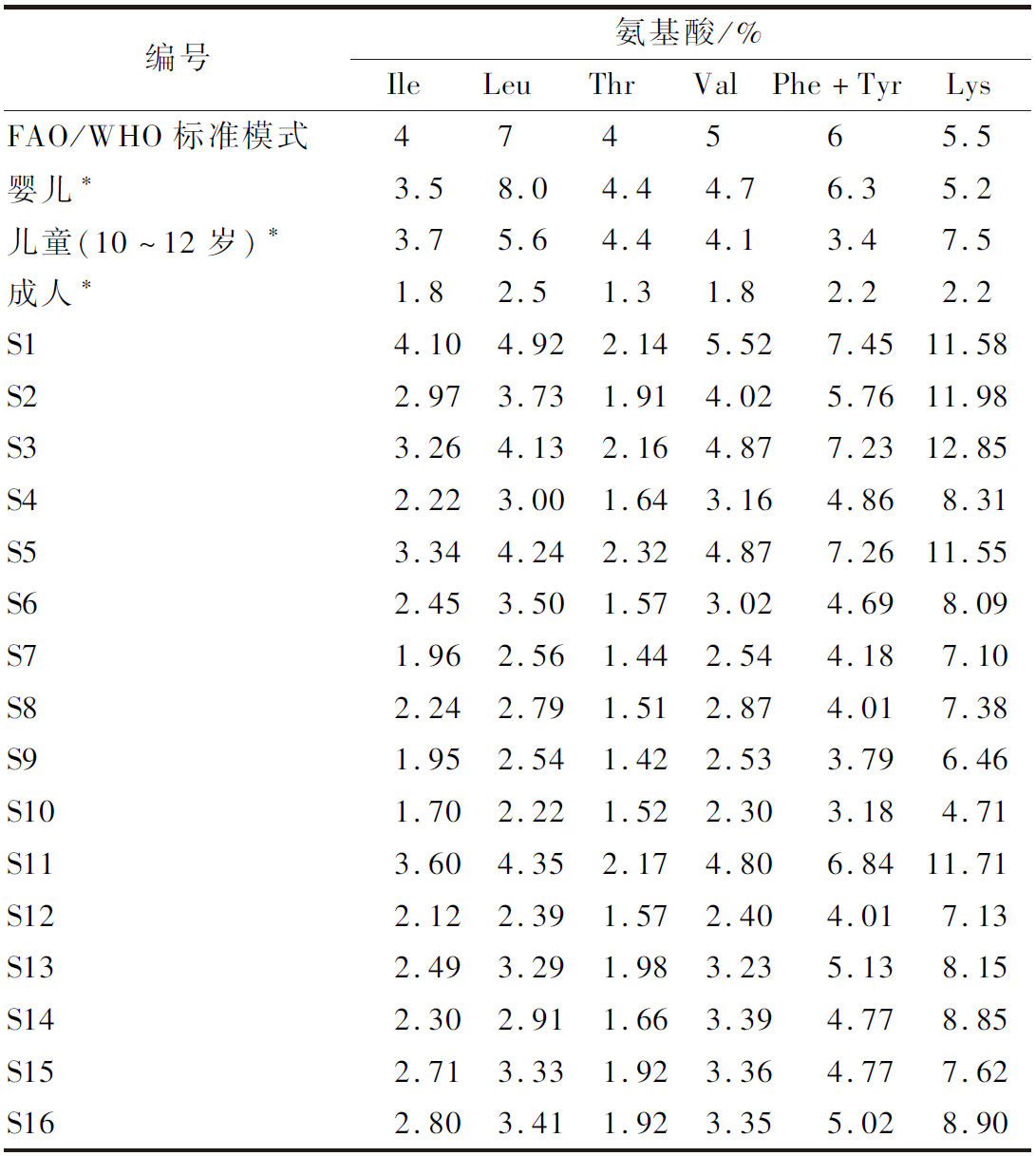
编号氨基酸/%IleLeuThrValPhe+TyrLysFAO/WHO标准模式474565.5婴儿∗3.58.04.44.76.35.2儿童(10~12岁)∗3.75.64.44.13.47.5成人∗1.82.51.31.82.22.2S14.104.922.145.527.4511.58S22.973.731.914.025.7611.98S33.264.132.164.877.2312.85S42.223.001.643.164.868.31S53.344.242.324.877.2611.55S62.453.501.573.024.698.09S71.962.561.442.544.187.10S82.242.791.512.874.017.38S91.952.541.422.533.796.46S101.702.221.522.303.184.71S113.604.352.174.806.8411.71S122.122.391.572.404.017.13S132.493.291.983.235.138.15S142.302.911.663.394.778.85S152.713.331.923.364.777.62S162.803.411.923.355.028.90
注:*为1973年FAO/WHO提出不同年龄段人群对摄入蛋白EAA含量需求参考值。
2.6.2 巴戟天中各种EAA的营养价值
根据巴戟天某必需氨基酸EAA/TAA值与FAO/WHO模式谱中相对应的氨基酸值,计算出RAA、RC、SRC,结果如表5所示。依据氨基酸比值系数法,若RC越接近1则说明该氨基酸的比例与模式中氨基酸比例接近;若RC>1,则说明该氨基酸含量过剩;若RC<1,则说明该氨基酸不足,其中,RC最小的氨基酸则为限制氨基酸。由表5中的RC可得,16批巴戟天中Ile、Leu、Thr以及Val含量相对不足,S10、S12、S13的第一限制氨基酸为Leu,其余样品第一限制氨基酸均为Thr;Phe+Tyr与Lys的RC均大于1.00,说明这3种氨基酸在漳州巴戟天中相对过剩,因此,在食用时,可搭配些富含Leu、Thr或Phe+Tyr和Lys相对缺乏的食物,以提高营养价值。
表5 十六批巴戟天必需氨基酸的RAA、RC、CV和SRC值
Table 5 RAA, RC, CV, and SRC values of essential amino acids in 16 batches of Morindae officinalis Radix

编号RAA/RC氨基酸IleLeuThrValPhe+TyrLysCVSRCS1RAA1.030.70.541.11.242.10.49150.89RC0.920.630.480.991.111.88S2RAA0.740.530.480.80.962.180.66133.87RC0.780.560.50.851.012.29S3RAA0.820.590.540.971.212.340.61738.31RC0.760.550.50.91.122.17S4RAA0.550.430.410.630.811.510.5743.01RC0.770.590.570.871.122.09S5RAA0.840.610.580.971.212.10.53946.13RC0.790.580.550.931.152S6RAA0.610.50.390.60.781.470.53246.85RC0.840.690.540.831.072.02S7RAA0.490.370.360.510.71.290.56843.19RC0.790.590.580.821.132.09S8RAA0.560.40.380.570.671.340.54345.66RC0.860.610.580.881.022.05S9RAA0.490.360.350.510.631.180.52247.79RC0.830.620.60.861.082S10RAA0.430.320.380.460.530.860.38761.31RC0.860.640.770.931.071.73S11RAA0.90.620.540.961.142.130.54745.32RC0.860.590.520.911.092.03S12RAA0.530.340.390.480.671.30.56843.15RC0.860.550.630.781.082.1S13RAA0.620.470.490.650.861.480.49750.31RC0.820.620.650.851.121.95S14RAA0.570.420.410.680.81.610.58940.16RC0.770.560.550.911.062.15S15RAA0.680.480.480.670.81.380.44955.06RC0.910.640.640.91.061.85S16RAA0.70.490.480.670.841.620.5346.98RC0.880.610.60.841.052.03
SRC的大小同样能反映蛋白质的营养价值,CV越大,SRC越小,营养价值就越低;当SRC越接近100,则说明蛋白质与模式越接近。由表5可知,16批漳州巴戟天样品SRC为33.87~61.31,其中,S10的SRC最大,最接近模式,氨基酸组成比例比其他样品更合理些,营养价值较均衡。
2.7 巴戟天氨基酸的相关性和主成分分析
2.7.1 相关性分析
以不同批次巴戟天中的TAA与EAA、MAA、鲜味氨基酸、甜味氨基酸和芳香族氨基酸含量为指标,考察其相关性。结果见表6,各指标间均存在着极显著的高度正相关关系,Pearson相关系数分别为0.939、0.999、0.996、0.997、0.927、0.938、0.916、0.933、0.994、0.998、0.992、0.927、0.991、0.905、0.919。在一定程度上,可说明TAA越高,其他种类的氨基酸含量也会越高;同时,MAA与鲜味氨基酸、甜味氨基酸、芳香氨基酸也存在正相关,因此,可通过中药材的“味”、“气”等性状判断中药材的品质[28]。
表6 十六批巴戟天各类氨基酸相关性分析
Table 6 Correlation analysis of various amino acids in 16 batches of Morindae officinalis Radix
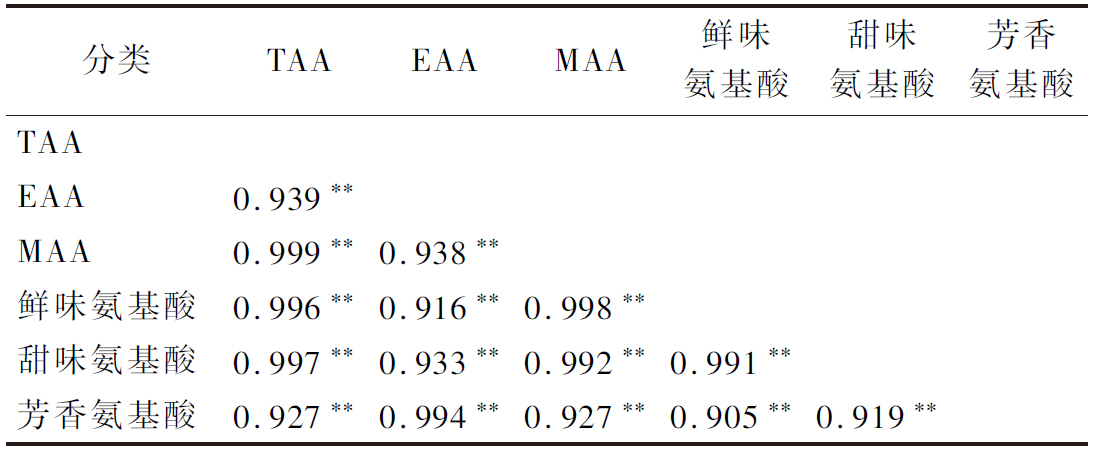
分类TAAEAAMAA鲜味氨基酸甜味氨基酸芳香氨基酸TAAEAA0.939∗∗MAA0.999∗∗0.938∗∗鲜味氨基酸0.996∗∗0.916∗∗0.998∗∗甜味氨基酸0.997∗∗0.933∗∗0.992∗∗0.991∗∗芳香氨基酸0.927∗∗0.994∗∗0.927∗∗0.905∗∗0.919∗∗
注:鲜味氨基酸(Glu、Asp、Phe、Ala、Gly、Tyr);甜味氨基酸(Ala、Gly、Ser、Pro、Thr、His);芳香族氨基酸(Tyr、Phe);相关性为Pearson类型;**P<0.01,相关性极显著。
2.7.2 聚类分析
利用SPSS 22对16批巴戟天样品中的必需氨基酸和药用氨基酸含量进行聚类分析(图3)。当欧式距离为5时,16批巴戟天被分为三类:S12一类,必需氨基酸和药用氨基酸含量最高;S4、S6、S7、S8、S9、S10、S14为一类,必需氨基酸和药用氨基酸含量次之;S1、S2、S3、S5、S11、S13、S15、S16为一类,必需氨基酸和药用氨基酸含量最低,表明各样品中必需氨基酸和药用氨基酸含量有明显差异。
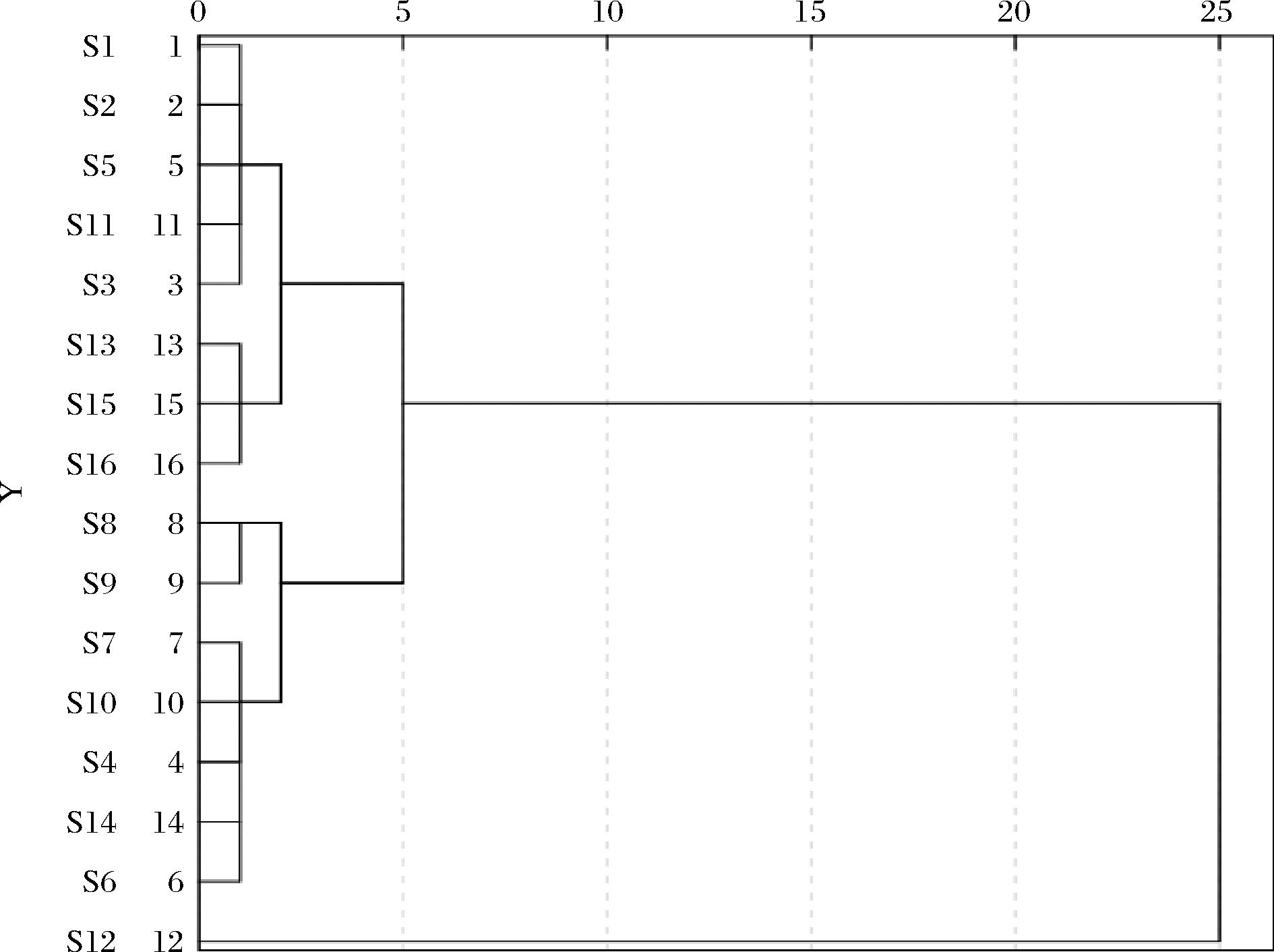
图3 十六批巴戟天样品聚类分析树状图
Fig.3 Hierarchical cluster analysis plot for 16 batches of Morindae officinalis Radix
2.7.3 主成分分析
2.7.3.1 Kaiser-Meyer-Olikin和巴特利球形检验
对16批巴戟天样品中的必需氨基酸和药效氨基酸含量进行Kaiser-Meyer-Olikin(KMO)和巴特利球形检验,结果如表7所示,KMO为0.842,大于0.8且Sig<0.05,非常适合进行主成分分析。
表7 KMO和Bartlett检验
Table 7 KMO and Bartlett test

项目KMO测量取样适当性Bartlett的球形检验近似卡方自由度显著性数值0.842404.499550.000
2.7.3.2 主成分分析
分别将16批巴戟天样品的必需氨基酸和药用氨基酸的含量导入SPSS软件,提取2个主成分(principal component, PC),累计方差贡献率为97.085%,可以反映巴戟天样品中的大量信息,基本上可作为巴戟天品质判断的代表,结果如表8所示。F1的特征值为10.380,特征贡献率为94.360%,F2的特征值为0.300,特征贡献率为2.725。结合表9和图4可知,EAA和MAA与第一主成分均为正相关,相关系数均大于0.9,主要影响因子为Gly、Ile;第二主成分与Asp、Glu、Thr、Leu呈正相关,主要影响因子为Asp、Glu。利用SIMCA 14.1对2个主成分作得分图(图5),16批巴戟天被分为三类:S12一类,S4、S6、S7、S8、S9、S10、S14为一类,S1、S2、S3、S5、S11、S13、S15、S16为一类,分析结果与聚类分析结果一致。
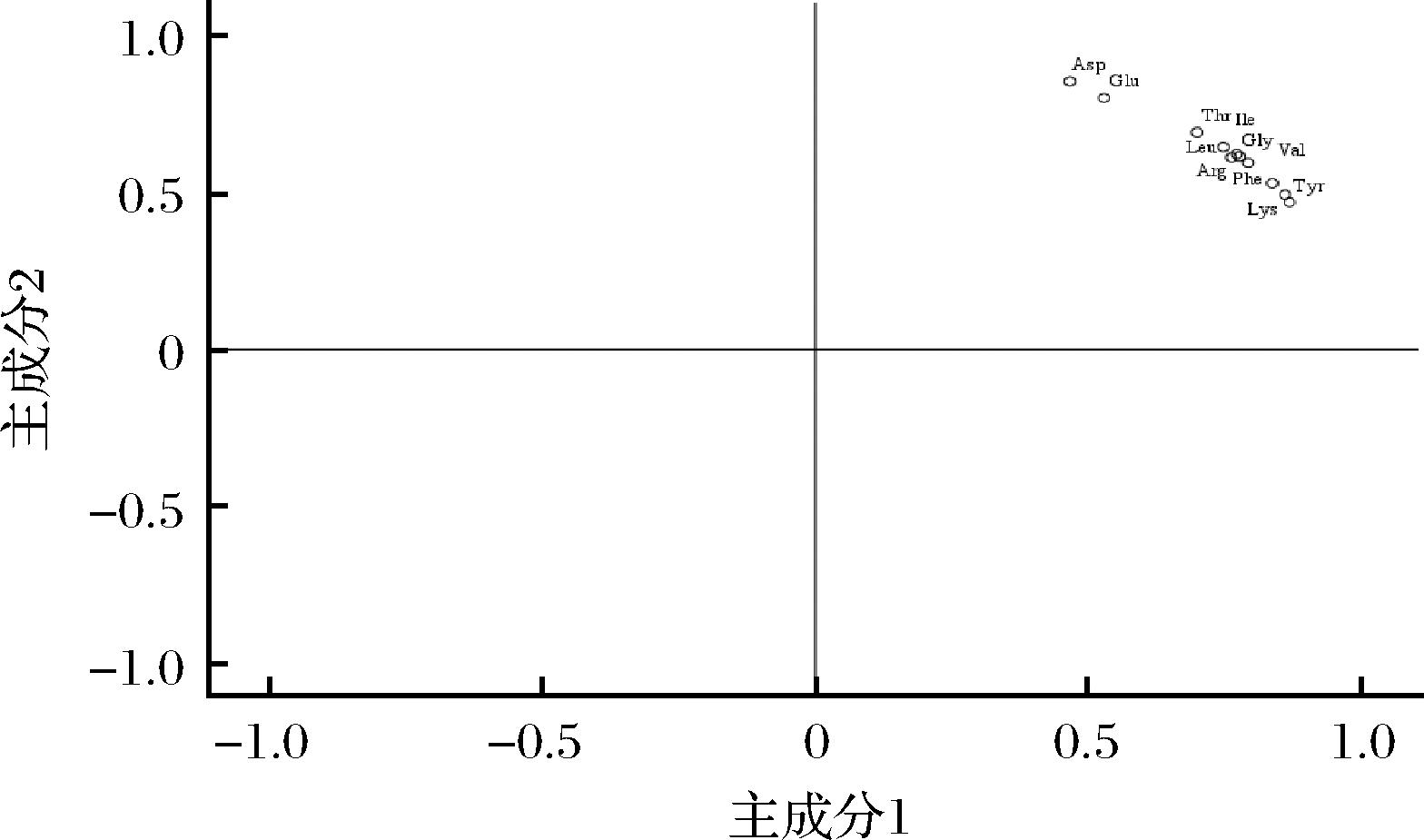
图4 主成分载荷图
Fig.4 Load diagram of principal components
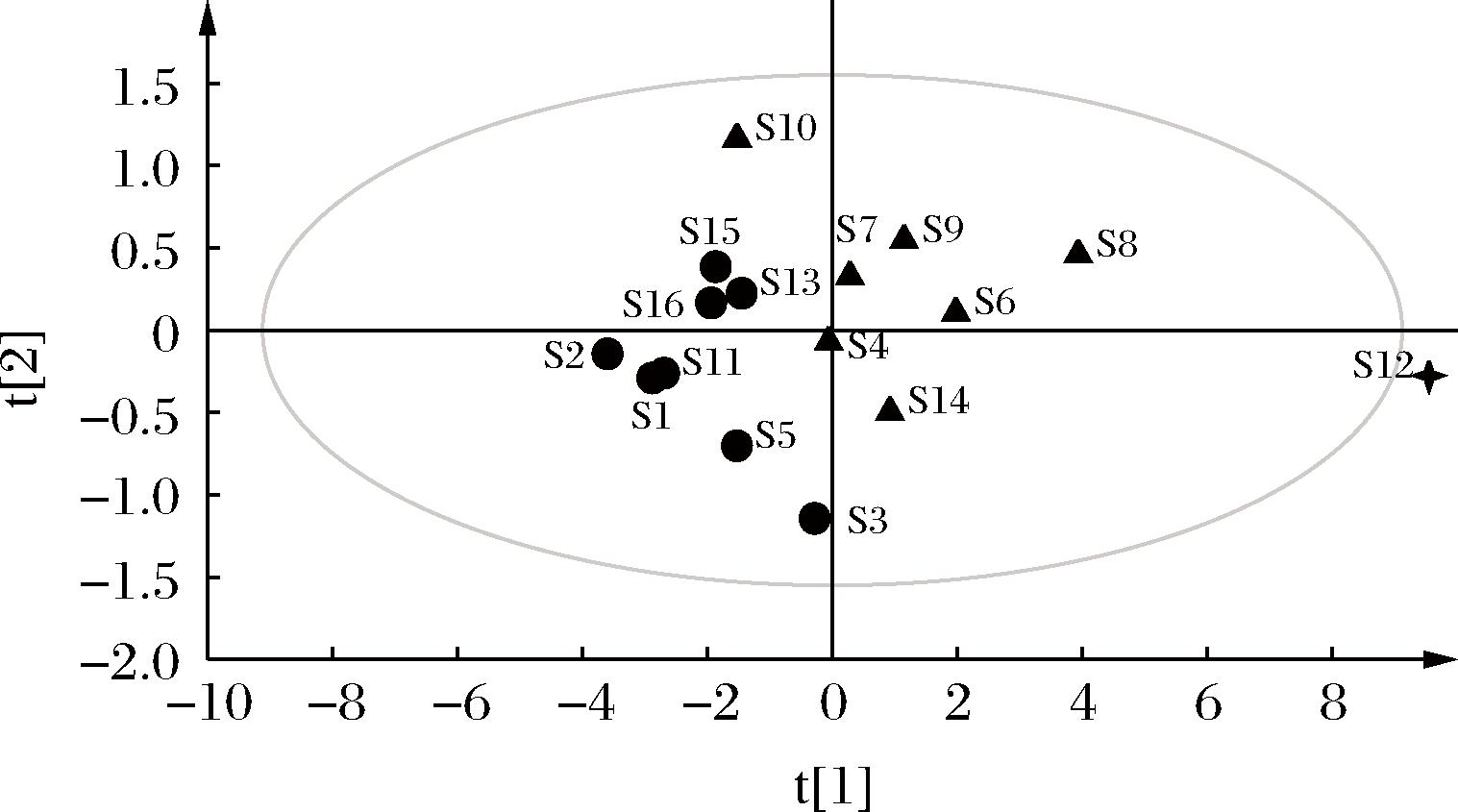
图5 主成分分析得分图
Fig.5 Score scatter plot of PCA
表8 主成分的起始特征值及累积方差贡献率
Table 8 Initial eigen values and cumulative variance contribution of principal components
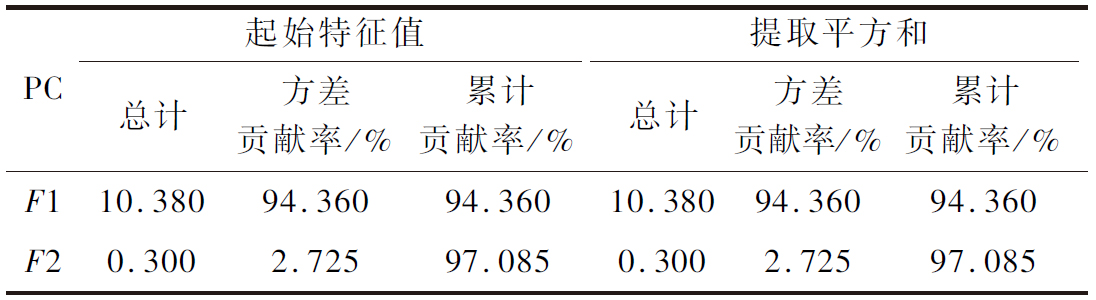
PC起始特征值提取平方和总计方差贡献率/%累计贡献率/%总计方差贡献率/%累计贡献率/%F110.38094.36094.36010.38094.36094.360F20.3002.72597.0850.3002.72597.085
表9 主成分的载荷矩阵
Table 9 Load matrix of principal components
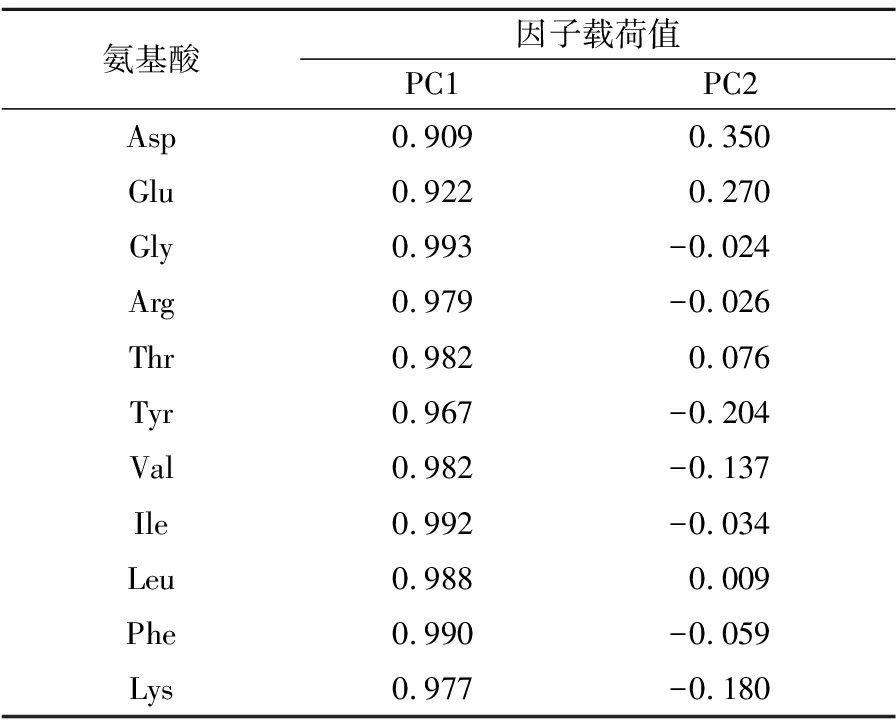
氨基酸因子载荷值PC1PC2Asp0.9090.350Glu0.9220.270Gly0.993-0.024Arg0.979-0.026Thr0.9820.076Tyr0.967-0.204Val0.982-0.137Ile0.992-0.034Leu0.9880.009Phe0.990-0.059Lys0.977-0.180
3 结论与讨论
3.1 结论
本实验采用异硫氰酸苯酯柱前衍生-高效液相色谱法可同时测定巴戟天中15种氨基酸含量,该方法测定准确,精密度、重复性、稳定性良好,可作为巴戟天氨基酸含量测定的方法。
实验结果表明,巴戟天中至少含有15种氨基酸,包括6种必需氨基酸和8种药用氨基酸,其中,Pro、Asp、Lys的含量最高。各样品中MAA较丰富,MAA/TAA占比为45.20%~56.31%,说明巴戟天具有较好的药用价值。虽巴戟天中必需氨基酸含量为14.15%~32.06%,距FAO/WHO标准有一定的差距,Thr、Leu为限制氨基酸,但是,各必需氨基酸均能满足成人标准模式,因此,在开发利用时,可与富含Thr、Leu的物质搭配,提高营养及药用价值。16批漳州巴戟天样品SRC为33.87~61.31,基本上高于西洋参的SRC[29]。通过相关性分析,表明药用氨基酸与鲜味氨基酸、甜味氨基酸、芳香氨基酸也存在正相关,实际应用时,可以通过其“味”、“气”等判断巴戟天药材质量。对各巴戟天样品中的必需氨基酸和药用氨基酸进行聚类分析及主成分分析,结果发现,16批巴戟天可聚为三类:S12一类,氨基酸总含量、必需氨基酸含量、药用氨基酸含量最高;S4、S6、S7、S8、S9、S10、S14为一类,S1、S2、S3、S5、S11、S13、S15、S16为一类。由主成分分析可知,2个主成分的累计方差贡献率为97.085%,反映巴戟天样品中的大量信息,可作为巴戟天品质判断的代表。本实验有助于进一步了解漳州巴戟天中氨基酸组成及营养价值,可为巴戟天的品质分析和资源开发利用提供参考。
3.2 讨论
课题组曾按文中方法分析广东高要、广东德庆、广东云浮、广西梧州及福建永定巴戟天。结果表明,文中16批漳州产巴戟天与这5个地区的巴戟天均含有15种氨基酸,包括6种必需氨基酸和8种药用氨基酸;不同地区氨基酸总量、必需氨基酸含量、药用氨基酸含量有一定的差异,这5个地区TAA为11.29~22.10 mg/g,EAA为4.19~6.46 mg/g,MAA为6.74~11.59 mg/g,均低于漳州巴戟天相应含量的平均值;与FAO/WHO模式谱中相对应的氨基酸值比较,这5个地区巴戟天样品与漳州地区巴戟天一样,RC最小的必需氨基酸是Thr,第一限制氨基酸均为Thr,Lys、Phe+Tyr的RC>1,相对过剩,说明在食用巴戟天时,可搭配富含Thr的食物或Phe+Tyr和Lys相对缺乏的食物,以提高营养价值。
[1] 国家药典委员会. 中华人民共和国药典-一部:2020年版[M].北京:中国医药科技出版社, 2020:83.
National Pharmacopoeia Commission.Pharmacopoeia of the People’s Republic of China (Part Ⅰ)[M].Beijing:China Medical Science Press, 2020:83.
[2] 任薇, 杜建平, 夏能能, 等.南药巴戟天的道地性研究进展[J].按摩与康复医学, 2022, 13(2):76-80.
REN W, DU J P, XIA N N, et al.Research progress on the genuineness of Morinda officinalis Radix[J].Chinese Manipulation and Rehabilitation Medicine, 2022, 13(2):76-80.
[3] 戴胜云, 蒋双慧, 刘杰, 等.2010—2020年巴戟天研究进展[J].中国药事, 2021, 35(1):91-98.
DAI S Y, JIANG S H, LIU J, et al.Research progress of Morinda officinalis how.from 2010 to 2020[J].Chinese Pharmaceutical Affairs, 2021, 35(1):91-98.
[4] 黄清霞, 覃川娴, 何泽源, 等.巴戟天化学成分、药理作用及质量标志物预测分析[J].中华中医药学刊, 2022, 40(7):251-258.
HUANG Q X, QIN C X, HE Z Y, et al.Chemical components and pharmacological action of Bajitian (Radix Morindae officinalis) and predictive analysis on Q-marker[J].Chinese Archives of Traditional Chinese Medicine, 2022, 40(7):251-258.
[5] 黄少杰, 罗志锋, 陶倩, 等.发酵巴戟天中多糖和寡糖降血糖作用研究[J].食品与发酵工业, 2022, 48(7):43-49.
HUANG S J, LUO Z F, TAO Q, et al.Hypoglycemic effect of polysaccharides and oligosaccharides from fermented Morinda officinalis[J].Food and Fermentation Industries, 2022, 48(7):43-49.
[6] 何华红, 伍良涌, 张讷敏, 等.传统南药巴戟天抗抑郁药理研究[J].今日药学, 2023, 33(2):101-105;116.
HE H H, WU L Y, ZHANG N M, et al.A overview of antidepressant pharmacological research on traditional southern medicine Morinda officinalis[J].Pharmacy Today, 2023, 33(2):101-105;116.
[7] 罗欢. 巴戟天抗炎活性成分研究[D].广州:广东药科大学, 2021.
LUO H.Study on the anti-inflammatory constituents of Morinda officinalis how.[D].Guangzhou:Guangdong Pharmaceutical University, 2021.
[8] 彭东, 罗志锋, 陶倩, 等.发酵巴戟天中蒽醌提取及其抗氧化与降血糖活性[J].食品工业科技, 2022, 43(7):214-223.
PENG D, LUO Z F, TAO Q, et al.Extraction of anthraquinone from fermented Morinda officinalis and its antioxidant and hypoglycemic activities[J].Science and Technology of Food Industry, 2022, 43(7):214-223.
[9] 张建花. 巴戟天环烯醚萜苷类成分抗类风湿性关节炎的作用研究[D].佳木斯:佳木斯大学, 2018.
ZHANG J H.Anti-rheumatoid arthritis effects of iridoid glycosides from the root of Morinda officinalis how.[D].Jiamusi:Jiamusi University, 2018.
[10] 贾志鑫, 潘明霞, 刘力榕, 等.基于代谢组学的速效救心丸抗心肌缺血作用机制研究[J].中草药, 2022, 53(15):4719-4729.
JIA Z X, PAN M X, LIU L R, et al.Mechanism of Suxiao Jiuxin pills against myocardial ischemia based on metabolomics[J].Chinese Traditional and Herbal Drugs, 2022, 53(15):4719-4729.
[11] DORNFELD K, MADDEN M, SKILDUM A, et al.Aspartate facilitates mitochondrial function, growth arrest and survival during doxorubicin exposure[J].Cell Cycle, 2015, 14(20):3282-3291.
[12] 赵丽. 蜂王浆中氨基酸含量的测定[J].食品研究与开发, 2014, 35(5):94-96.
ZHAO L.Amino acids composition and nutritional functions analysis of royal jelly[J].Food Research and Development, 2014, 35(5):94-96.
[13] 左家信, 冯家力, 周丽平, 等.湖南产地4种豆类蔬菜中氨基酸组成及营养评价[J].实用预防医学, 2022, 29(2):174-178.
ZUO J X, FENG J L, ZHOU L P, et al.Amino acid composition and nutritional value evaluation of four kinds of legume vegetables produced in Hunan[J].Practical Preventive Medicine, 2022, 29(2):174-178.
[14] 安亚南, 董晓丽, 高玉田.精氨酸对猪和家禽免疫功能的调节作用[J].中国饲料, 2023(11):72-76;81.
AN Y N, DONG X L, GAO Y T.The effect of arginine on immunity function of pigs and poultry[J].China Feed, 2023(11):72-76;81.
[15] 刘艳华, 胡云飞, 杨光.氨基酸类功能食品对力量型运动员运动能力的影响[J].食品研究与开发, 2021, 42(23):229-230.
LIU Y H, HU Y F, YANG G.Effect of amino acid functional foods on athletic ability of strength athletes[J].Food Research and Development, 2021, 42(23):229-230.
[16] 王晓媛, 王彦兵, 陈玉芹, 等.6种石斛属植物氨基酸组成及营养价值评价[J].天然产物研究与开发, 2019, 31(4):601-607.
WANG X Y, WANG Y B, CHEN Y Q, et al.Amino acid composition and nutritional value evaluation of 6 species of Dendrobium[J].Natural Product Research and Development, 2019, 31(4):601-607.
[17] 刘振艳, 宋耀新, 刘洋, 等.黑龙江不同产地北苍术中氨基酸的组成特征及营养评价[J].食品安全质量检测学报, 2023, 14(1):304-314.
LIU Z Y, SONG Y X, LIU Y, et al.Amino acid composition characteristics and nutritional evaluation in Atractylodes chinensis (DC.) Koidz.from different regions of Heilongjiang[J].Journal of Food Safety and Quality, 2023, 14(1):304-314.
[18] 刘振艳, 关宏, 朱金峰, 等.不同品种鲜食梨的氨基酸组成特征及其营养评价[J].食品安全质量检测学报, 2022, 13(11):3541-3548.
LIU Z Y, GUAN H, ZHU J F, et al.Amino acid composition characteristics and nutritional evaluation of different table Pyrus spp.varieties[J].Journal of Food Safety and Quality, 2022, 13(11):3541-3548.
[19] Food and Agriculture Organization of the United Nations/World Health Organization.Energy and protein requirements[C].FAO Nutrition Meeting Report Series.Roma:FAO, 1973.
[20] 杨晓琳, 孙好强, 何昌芬, 等.不同产地山茱萸氨基酸含量分析及其营养价值评价[J].食品安全质量检测学报, 2022, 13(22):7200-7209.
YANG X L, SUN H Q, HE C F, et al.Analysis of amino acid composition and nutritional evaluation of Corni Fructus from different habitats[J].Journal of Food Safety and Quality, 2022, 13(22):7 200-7 209.
[21] 杨欣, 李咏梅, 黎行山, 等.广东道地药材巴戟天中17种氨基酸含量分析研究[J].中医药导报, 2018, 24(22):45-48;73.
YANG X, LI Y M, LI X S, et al.Content analysis of 17 amino acids in a Guangdong geo-authentic crude drug, Bajitian (Morinda officinalis)[J].Guiding Journal of Traditional Chinese Medicine and Pharmacy, 2018, 24(22):45-48;73.
[22] 徐礼生, 孙玥, 柴存宝, 等.紫外分光光度法测定发酵液中L-天冬氨酸[J].基因组学与应用生物学, 2020, 39(4):1692-1697.
XU L S, SUN Y, CHAI C B, et al.Determination of L-aspartic acid in fermentation broth by ultraviolet spectrophotometry[J].Genomics and Applied Biology, 2020, 39(4):1692-1697.
[23] 贺习文, 高勤叶, 黄姣姣, 等.离子交换色谱-茚三酮柱后衍生法同时测定绿茶饮料中39种游离氨基酸[J].饮料工业, 2020, 23(1):35-40.
HE X W, GAO Q Y, HUANG J J, et al.Simultaneous determination of 39 free amino acids in green tea beverages by ion exchange chromatography with ninhydrin post-column derivatization[J].Beverage Industry, 2020, 23(1):35-40.
[24] 汪雨龙, 李晓庆, 李秀娟.液液微萃取/固相微萃取-气相色谱法检测柑橘中16种游离氨基酸[J].食品工业科技, 2023, 44(12):285-292.
WANG Y L, LI X Q, LI X J.Determination of sixteen kinds of free amino acids in citrus by liquid liquid microextraction/solid phase microextraction coupled with gas chromatography[J].Science and Technology of Food Industry, 2023, 44(12):285-292.
[25] 谢丽源, 兰秀华, 唐杰, 等.不同羊肚菌品种氨基酸营养评价及等鲜浓度值差异分析[J].天然产物研究与开发, 2020, 32(6):1023-1029;979.
XIE L Y, LAN X H, TANG J, et al.Nutritional evaluation of different amino acids and difference analysis of equivalent umami concentration in Morchella spp.[J].Natural Product Research and Development, 2020, 32(6):1023-1029;979.
[26] 池小彬. 基于过甲酸氧化法PITC-HPLC对18种氨基酸的测定研究[D].南昌:南昌航空大学, 2017.
CHI X B.Determination of 18 kinds of amino acids by PITC-HPLC based on performic acid oxidization method[D].Nanchang:Nanchang Hangkong University, 2017.
[27] 陈荣珠, 王小平, 高伟城, 等.柱前衍生-HPLC法测定五指毛桃中16种游离氨基酸含量[J].食品工业科技, 2022, 43(17):306-315.
CHEN R Z, WANG X P, GAO W C, et al.Determination of 16 free amino acids of Ficus hirta by pre-column derivatization-high performance liquid chromatography[J].Science and Technology of Food Industry, 2022, 43(17):306-315.
[28] 李明利, 高文雅, 王宏洁, 等.基于“经验-成分-活性-电子感官”的中药饮片质量综合评价体系的探讨[J].中国中药杂志, 2022, 47(8):1995-2007.
LI M L, GAO W Y, WANG H J, et al.Comprehensive evaluation system for quality of Chinese medicinal decoction pieces based on “experience-ingredients-activity-electronic sensing”[J].China Journal of Chinese Materia Medica, 2022, 47(8):1995-2007.
[29] 赵方杰, 廉喜红, 胡小平, 等.不同产地西洋参氨基酸种类及含量分析[J].西北农业学报, 2020, 29(7):1051-1058.
ZHAO F J, LIAN X H, HU X P, et al.Analysis of amino acid type and quantity of American ginseng in different planting areas[J].Acta Agriculturae Boreali-occidentalis Sinica, 2020, 29(7):1051-1058.