罗非鱼以其生长繁殖快和肉质鲜美而闻名,含有多种营养物质,是最受欢迎的鱼类之一,有“21世纪之鱼”的誉称[1]。罗非鱼淡水养殖居多,其自身的腥味制约了预制菜及其加工制品的开发和产业化。目前,为提高罗非鱼附加值,常采用化学法、物理法、生物法、复合脱腥法及天然提取物脱腥法消减罗非鱼腥味[2]。在众多脱腥方法中,天然提取物因其绿色天然的优点在水产品脱腥方面得到广泛应用[3]。大量研究表明,天然提取物中主要以黄酮、酚酸类化合物为主,且有明显的脱除各类异味的作用[4-5]。酵母抽提物是一种天然风味配料,含有氨基酸、核苷酸等多种营养成分,且具有去腥增香的效果[6]。藿香作为一种药食同源物质,其叶中富含铁元素、维生素等营养物质[7],且具有良好的脱腥效果和保健功能。目前,藿香提取物已应用于畜肉类保鲜[8],但关于水产品脱腥报道方面极少。
气相离子迁移谱(gas chromatography ion mobility spectroscopy,GC-IMS)作为一种先进的食品风味分析技术,既包含气相色谱的高分离度,又包含离子迁移谱高灵敏度、低成本的优点[9-10]。与 GC-MS 和电子鼻等技术相比,其具有检测速度快、结果直观、便携性的特点。目前在药物检测、环境污染监测等方面已有研究[10],但在鱼类腥味检测方面极少报道。
该研究采用酵母-藿香复合脱腥剂,通过对感官评分、腥度及三甲胺(trimethylamine,TMA)含量的测试来确定最佳的工艺参数,通过 GC-IMS 分析比较脱腥处理前后罗非鱼肉的挥发性成分变化,根据相对气味活性值(relative odor activity value,ROAV)筛选关键风味物质,采用正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)构建模型,依据变量投影重要性因子(variable importance in projection,VIP)分析罗非鱼挥发性物质中的特征腥味物质,为罗非鱼预制菜研发过程中腥味脱除提供参考。
1 材料与方法
1.1 材料与试剂
罗非鱼,购自湛江市霞山区民享菜市场;酵母抽提物、藿香提取物,购自湛江市沃尔玛超市。
2-丁酮、2-戊酮、2-己酮、2-辛酮、2-壬酮等均为标准品,国药公司。
1.2 仪器与设备
恒温水浴锅,英国 Bibby Scientfic 公司;Flavour Spec®风味分析仪(GC-IMS),德国 G.A.S公司。
1.3 实验方法
1.3.1 样品预处理
将新鲜罗非鱼击杀,清洗干净后切片(3 cm×3 cm×1 cm)。
1.3.2 酵母-藿香复合脱腥液制备
将酵母抽提物和藿香提取物以质量比1∶3混合,溶于100 mL水中,分别配制成1.0、1.5、2.0、2.5、3.0 g/100 mL的复合脱腥液。
1.3.3 脱腥处理
将预处理的罗非鱼片按照料液比1∶3(g∶mL),浸泡30 min进行脱腥处理。
1.3.4 罗非鱼脱腥单因素试验
预处理的罗非鱼肉浸泡于脱腥液中。对脱腥液质量浓度(1.0、1.5、2.0、2.5、3.0 g/100 mL)、料液比(1∶1、1∶2、1∶3、1∶4、1∶5,g∶mL)、脱腥时间(10、20、30、40、50 min)进行单因素试验。
1.3.5 响应面优化脱腥实验
依据单因素试验结果,对脱腥液质量浓度、料液比和浸泡时间进行响应面实验,见表1。
表1 Box-Benhnken试验因素水平表
Table 1 Box-Benhnken test factor level table

水平因素A(脱腥液质量浓度)/(g/100 mL)B(浸泡时间)/minC(料液比)(g∶mL)-11.5201∶202.0301∶312.5401∶4
1.3.6 腥度测定
腥度可以更准确地衡量不同处理方法对鱼肉的影响[11]。腥味评定时环境中应无异味。选10名经过食品感官培训的人员进行评定,重复3次,评分标准见表2。腥度按公式(1)计算:
(1)
表2 腥气、腥味评分标准
Table 2 Scoring standard for fishy smell and taste
程度无腥味一般腥味重腥味分值024
式中:V为腥度;n为总人数;Ai、Bi为评价人员评价的腥气和腥味值。
1.3.7 感官评价
罗非鱼肉隔水蒸熟后,选择8名专业食品感官人员进行感官评价[2,12],总分为100分。评分标准见表3。
表3 感官评分标准
Table 3 Sensory evaluation standard

指标标准评分/分色泽色泽光鲜色泽暗淡色泽不均、无光泽15~208~140~7 气味香气浓郁醇厚香气较弱鱼腥味较浓23~3011~220~10滋味浓郁的鱼鲜味、口感清新鲜味较淡、口感较差鱼腥味明显23~3011~220~10质地质地柔软,鱼肉鲜嫩质地较柔软,表面稍粗糙鱼肉粗糙15~208~140~7
注:总体评分=0.25×色泽+0.25×气味+0.25×滋味+0.25×质地。
1.3.8 TMA的测定
TMA 含量参照GB 5009.179—2016《食品安全国家标准 食品中三甲胺的测定》。
1.3.9 GC-IMS测定
GC-IMS检测参考ZHENG等[13]的方法,稍作修改。取2.0 g样品置于顶空中。
顶空进样条件:在60 ℃条件下,以500 r/min的转速孵育10 min;进样体积为500 μL。
GC条件:色谱柱为MXT-5(15 m×0.53 mm);柱温60 ℃;初始流速为2 mL/min,持续2 min后在23 min内增至100 mL/min。
IMS条件:载体/漂移气为N2(99.999%);IMS柱温45 ℃。
1.3.10 风味物质评价
参考赵改名等[14]的方法,并作修改。其中,贡献最大的组分ROAVstan=100,其余组分按公式(2)计算:
(2)
式中:Ci为某物质的相对含量;Ti为感觉阈值;Cstan和Tstan为贡献最大组分的相对含量和感觉阈值。
1.4 数据分析
采用 Microsoft Excel、Origin 2023、IBM SPSS 23对数据进行有效的整理、绘图、及显著性分析(P<0.05),采用Design Expert 8.0.6进行响应面数据分析;采用 SIMCA 14.1构建 OPLS-DA 模型和 VIP 值分析。
2 结果与分析
2.1 单因素试验结果与分析
图1-A为脱腥液质量浓度对罗非鱼脱腥效果的影响。伴随浓度的增大,感官评分先增大后减小,腥度逐渐降低,三甲胺含量逐渐减小。原因可能是藿香脱腥液浓度较小,散发出的清凉般的木质香气无法掩盖鱼腥味,致使感官效果较差。当质量浓度为2.0 g/100 mL时,感官评分最高,这是因为罗非鱼肉的腥味被脱腥液中的鲜味氨基酸和黄酮等产生的特殊香气掩盖了三甲胺及其氧化产物产生的腥味[7,15]。故选1.5~2.5 g/100 mL进行后续研究。

A-脱腥液质量浓度;B-浸泡时间;C-料液比
图1 脱腥液质量浓度、浸泡时间、料液比对腥度、感官评分及三甲胺含量的影响
Fig.1 Effects of deodorant concentration, soaking time, and material liquid ratio on fishiness, sensory score, and trimethylamine content
注:不同字母表示差异显著(P<0.05)(下同)。
图1-B为浸泡时间对罗非鱼脱腥效果的影响。随着鱼肉在浸泡液中时间的延长,腥度和三甲胺的含量逐渐减小,感官评分先增大后减小,当浸泡30 min时感官评分最高。可能是长时间的浸泡使鱼肉组织松散,致使食用口感变差[16]。研究表明,鱼肉中三甲胺及其氧化产物的含量随着浸泡时间的延长而减少[17]。故选20~40 min进行后续研究。
图1-C为料液比对罗非鱼脱腥效果的影响。随着脱腥液添加量的增加,腥度和三甲胺含量逐渐减小,料液比为1∶3(g∶mL)时感官评分最高。原因可能是脱腥液较少时,罗非鱼肉无法被完全浸泡,脱腥液中的多酚和黄酮无法抑制三甲胺的氧化分解,三甲胺含量较高,导致感官评分较低;料液比过大时,脱腥液的浓郁气息覆盖了鱼香味,致使口味变差,评分降低。故选料液比1∶2~1∶4进行后续研究。
2.2 响应面实验结果与分析
2.2.1 响应面优化实验结果
在单因素试验的基础上,对脱腥条件进行响应面实验,结果见表4。
表4 响应面实验设计及结果
Table 4 Response surface experimental design and results
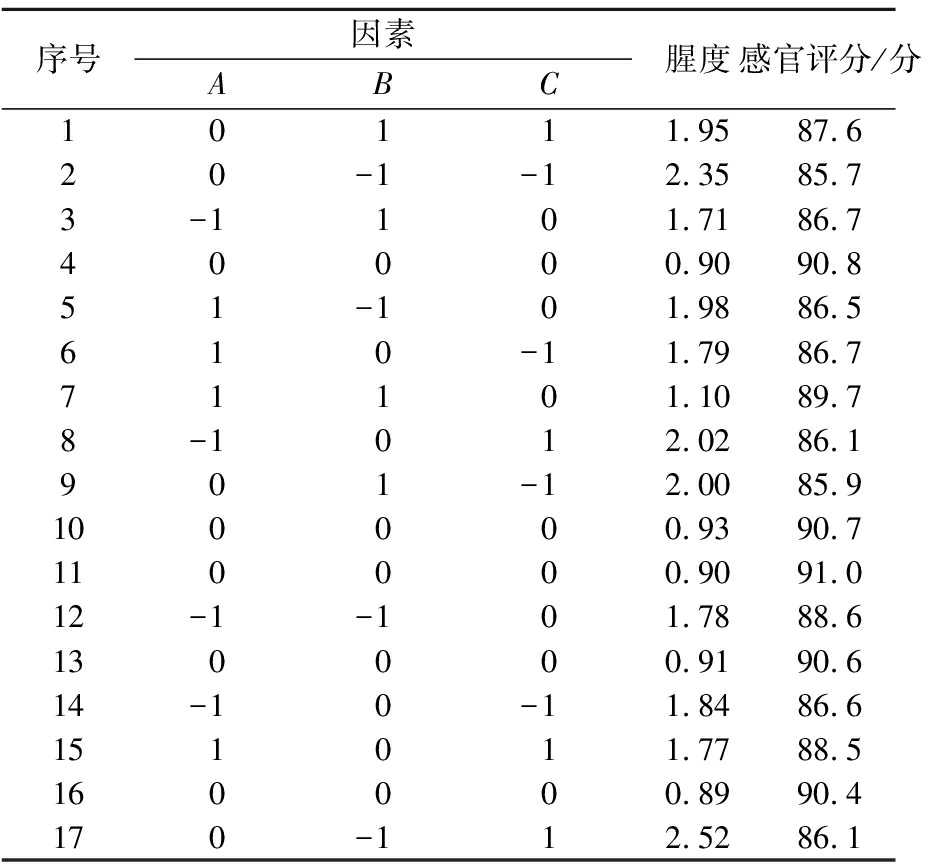
序号因素ABC腥度感官评分/分10111.9587.620-1-12.3585.73-1101.7186.740000.9090.851-101.9886.5610-11.7986.771101.1089.78-1012.0286.1901-12.0085.9100000.9390.7110000.9091.012-1-101.7888.6130000.9190.614-10-11.8486.6151011.7788.5160000.8990.4170-112.5286.1
通过分析,得到了腥度(Y1)和感官评分(Y2)的多元二次回归方程:Y1=0.91-0.089A-0.23B+0.035C-0.20AB-0.050AC-0.055BC+0.19A2+0.54B2+0.76C2;Y2=90.70+0.43A+0.38B+0.42C+1.27AB+0.57AC+0.32BC-1.09A2-1.74B2-2.64C2。
通过方差分析和显著性检验来说明方程的有效性,结果如表5和表6所示。腥度和感官评分模型差异极显著(P<0.01),失拟项不显著(P>0.05),该模型与实验拟合度较高,产生的误差不会影响实验结果,且r2分别为0.999 4和0.990 4,说明所选因素显著影响该模型,故用该模型对脱腥工艺进行优化。
表5 腥度回归模型的方差分析结果
Table 5 Analysis of variance results of fishiness regression model
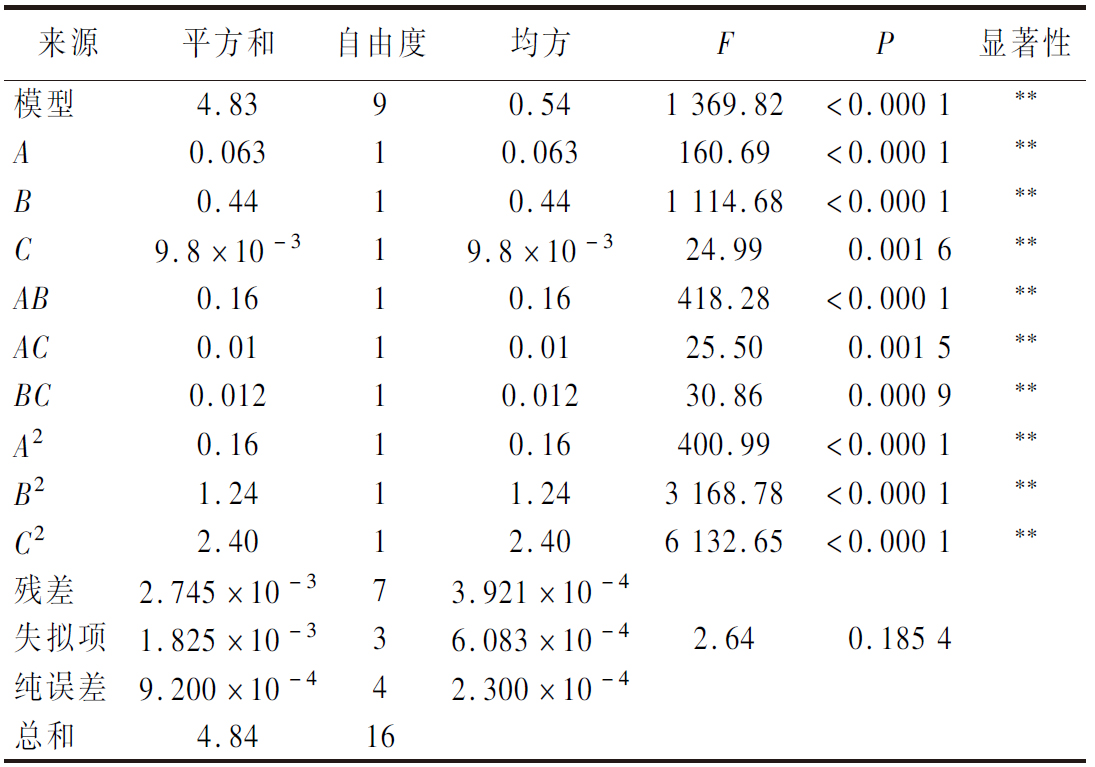
来源平方和自由度均方FP显著性模型4.8390.541 369.82<0.000 1∗∗A0.06310.063160.69<0.000 1∗∗B0.4410.441 114.68<0.000 1∗∗C9.8×10-319.8×10-324.990.001 6∗∗AB0.1610.16418.28<0.000 1∗∗AC0.0110.0125.500.001 5∗∗BC0.01210.01230.860.000 9∗∗A20.1610.16400.99<0.000 1∗∗B21.2411.243 168.78<0.000 1∗∗C22.4012.406 132.65<0.000 1∗∗残差2.745×10-373.921×10-4失拟项1.825×10-336.083×10-42.640.185 4纯误差9.200×10-442.300×10-4总和4.8416
注:*差异显著,P<0.05;**差异极显著,P<0.01(下同)。
表6 感官评分模型的方差分析结果
Table 6 Analysis results of variance of the sensory score regression mode
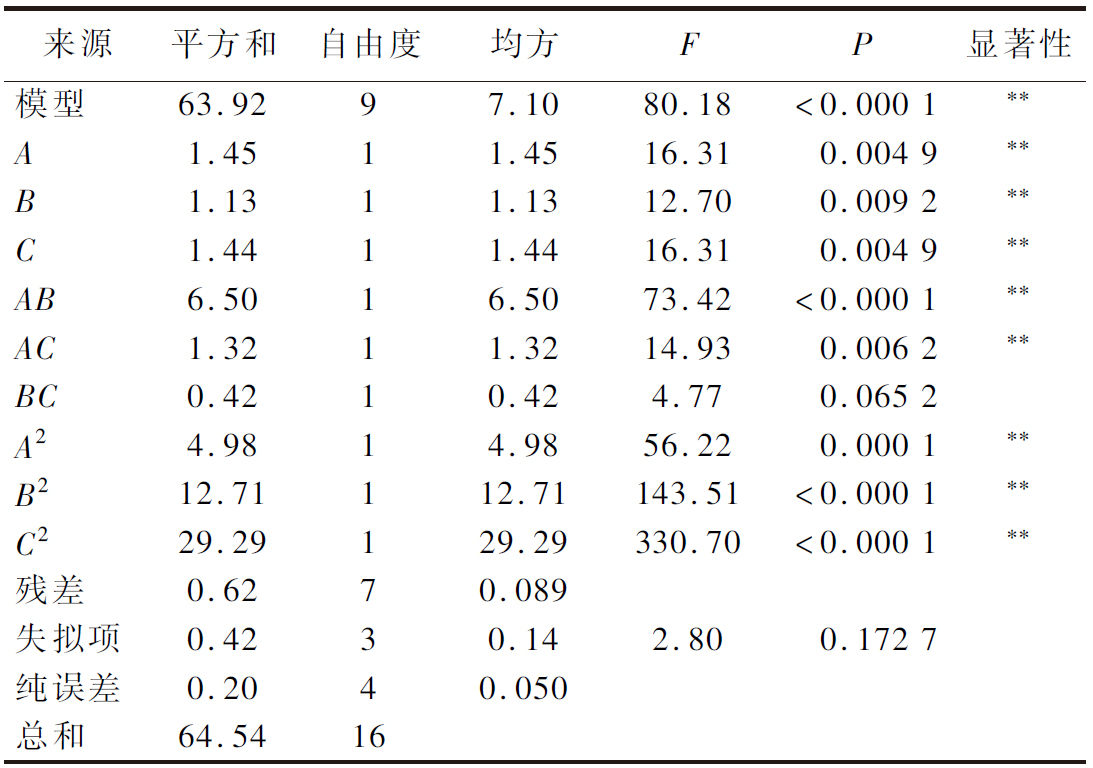
来源平方和自由度均方FP显著性模型63.9297.1080.18<0.000 1∗∗A1.4511.4516.310.004 9∗∗B1.1311.1312.700.009 2∗∗C1.4411.4416.310.004 9∗∗AB6.5016.5073.42<0.000 1∗∗AC1.3211.3214.930.006 2∗∗BC0.4210.424.770.065 2A24.9814.9856.220.000 1∗∗B212.71112.71143.51<0.000 1∗∗C229.29129.29330.70<0.000 1∗∗残差0.6270.089失拟项0.4230.142.800.172 7纯误差0.2040.050总和64.5416
2.2.2 验证实验
经过响应面优化,得出最优的脱腥工艺:脱腥液质量浓度2.1 g/100 mL,料液比1∶3.09(g∶mL),脱腥时间32 min,此条件下的腥度为0.92,感官评分为94.85分。按此工艺进行3次重复实验来验证模型的有效性,得出腥度为0.94,感官评分为94.88分。经检验,发现该模型能够准确反映酵母-藿香复合脱腥液对罗非鱼脱腥的最佳工艺。
2.3 脱腥前后罗非鱼肉挥发性气味GC-IMS结果分析
2.3.1 脱腥前后罗非鱼肉挥发性物质谱图分析
GC-IMS是一种用保留时间和漂移时间来鉴定挥发性化合物的非靶向分析方法[18]。图2是脱腥前后罗非鱼挥发性成分的二维谱图。图中每个点代表一种物质,为了清晰地比较样品之间的差异,选取脱腥前的光谱作为参考,当浓度低于参比物时显示为蓝色,等于参比物时显示为白色,高于参比物时显示为红色[19]。由图2可以直观看出,脱腥前后的样品的挥发性组分在800 s内完成了气相分离,且脱腥前后的挥发性成分有明显差异。
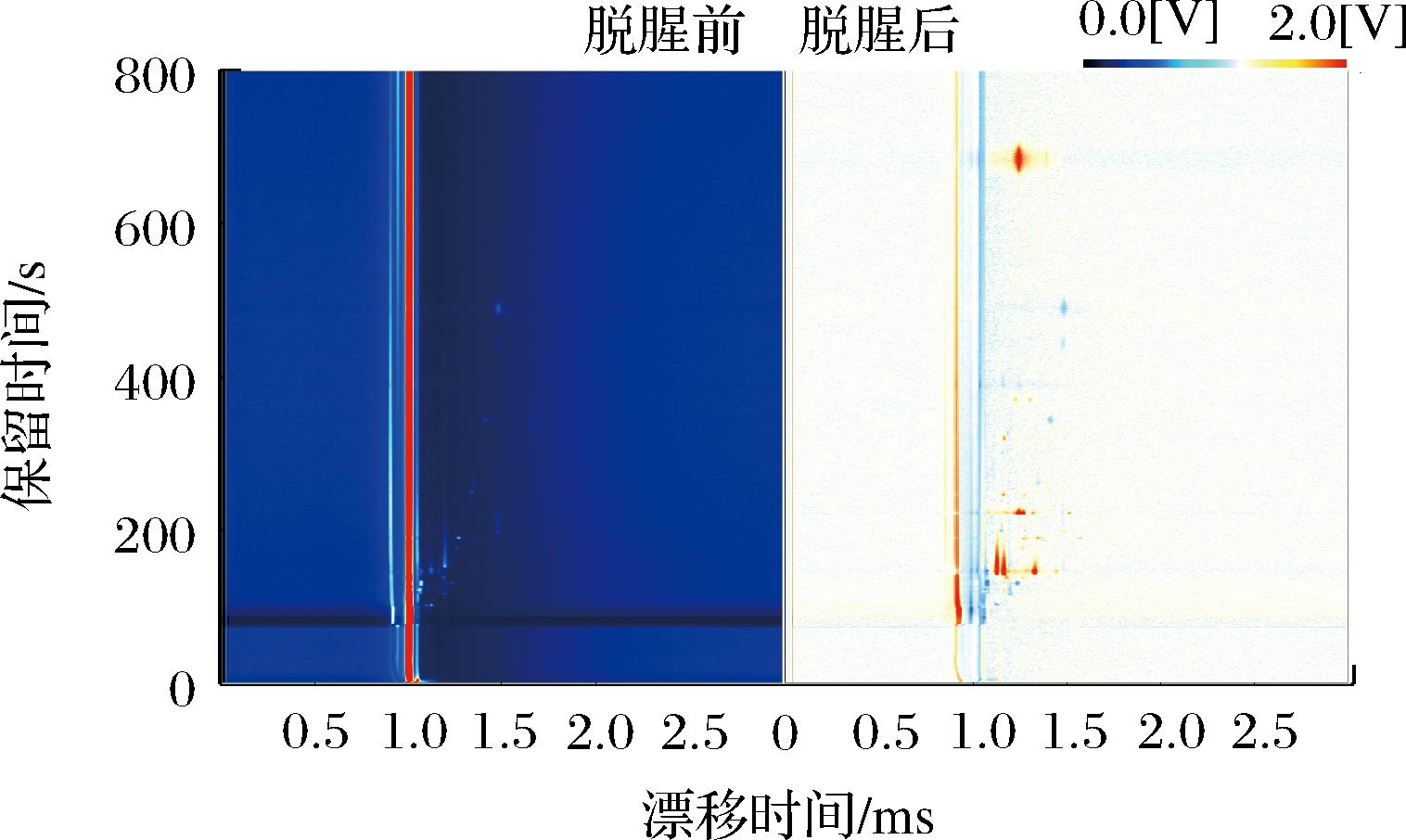
图2 脱腥前后罗非鱼肉挥发性成分二维气相离子迁移谱图
Fig.2 Two dimensional gas phase ion migration spectra of volatile components in Tilapia meat before and after deodorization
2.3.2 脱腥前后罗非鱼肉挥发性物质指纹图谱分析
通过选取谱图中的每一个峰,可以清楚地比较脱腥前后挥发性物质间的差异,结果如图3所示。随着点亮度的变化,样品中的挥发性成分种类及含量也随之变化[14]。从整个图谱可以看出,脱腥前后罗非鱼肉有共同的风味区域,也有各自的特征区域。图3-A为脱腥前的特征区域,有辛醛、壬醛、庚醛、1-辛烯-3-醇等;图3-B为脱腥后的特征区域,有乙酸乙酯、乙酸己酯、丙酸异丁酯等酯类物质。通过比较脱腥前后挥发性化合物,发现辛醛、壬醛、庚醛、1-辛烯-3-醇等物质点亮度逐渐变浅,表示其含量逐渐减少;乙酸己酯、乙酸乙酯等物质点亮度逐渐变深,表示其含量逐渐增加。从图中得知脱腥前后罗非鱼肉挥发性风味物质存在明显差异。

图3 脱腥前后罗非鱼肉的GC-IMS指纹图谱
Fig.3 GC-IMS fingerprint of tilapia meat before and after deodorization
2.3.3 脱腥前后罗非鱼肉挥发性物质分析及关键物质的确定
选用正酮C4~C9作为外标物,通过每种物质的迁移时间在GC-IMS数据库中通过比对确定挥发性组分,结果如表7所示。GC-IMS技术检出22种挥发性物质,其中包括5种醛类、7种醇类、4种酮类、3种酯类、3种其他。其中相对含量最高的为醛类,其次是醇类和酯类。由表7可知,脱腥后醛类物质相对含量显著减少9.82%(P<0.05);醇类物质相对含量显著减少6.23%(P<0.05);酮类和酯类物质相对含量显著增加4.11%和4.59%(P<0.05)。
表7 脱腥前后罗非鱼肉挥发性成分定性分析
Table 7 Qualitative analysis of volatile composition of tilapia meat before and after removal

类别化合物CAS分子式保留指数保留时间/s漂移时间/ms相对含量/%脱腥前脱腥后醛类壬醛C124196C9H18O1108.1551.8511.482 915.25±0.70a11.06±2.93b庚醛C111717C7H14O903.1280.2531.340 710.05±0.19a5.76±2.59b辛醛C124130C8H16O793.2212.471.270 7525.02±1.36a22.86±2.73b2-丁烯醛C123739C4H6O642146.6061.144 830.13±0.01b0.19±0.04a2-己烯醛C505577C6H10O857.8249.2311.513 320.19±0.05b0.94±0.37a合计50.64±2.31a40.82±8.66b醇类3-己烯-1-醇(E)C928972C6H12O858.6249.7491.242 970.08±0.02b1.00±0.29a己醇C626937C6H14O793.3212.5551.568 752.83±2.20b3.11±1.92a2,3-丁二醇C513859C4H10O2793.6212.6741.370 480.15±0.06b0.29±0.07a1-辛烯-3-醇C3391864C8H16O666.4154.371.188 8811.83±0.85a7.67±1.77b正己醇C111273C6H14O520.7113.3791.126 0812.74±1.33a7.36±0.52b1-戊醇C71410C5H12O765.3197.7641.262 423.68±0.58b4.77±1.13a2-糠基硫醇C98022C5H6OS917.3292.2961.349 632.68±0.32b3.56±0.07a合计34.00±5.35a27.77±5.76b酮类2,3-丁二酮C431038C4H6O2603.11351.159 820.32±0.04b0.69±0.14a乙酰氧基丙酮C592201C5H8O3520113.2081.099 724.46±0.54b7.54±1.32a3-辛酮C106683C8H16O987.6360.2621.166 030.27±0.07b0.72±0.21a2-环己烯-1-酮C930687C6H8O903.3280.4391.410 790.43±0.10b0.64±0.24a合计5.48±0.74b9.59±1.90a酯类乙酸乙酯C107448C4H10FO2P810.6221.8031.478 053.61±0.54b5.38±1.39a乙酸己酯C142927C7H14O21007.9385.3311.411 513.94±0.91b6.04±3.29a丙酸异丁酯C540421C10H12O1201.4770.9161.243 20.28±0.06b1.00±0.04a合计7.83±1.51b12.42±4.72a其他1-甲基-2-戊烯C763291C6H12584.8129.8781.198 20.96±0.24b1.38±0.41a3-丁烯腈C109751C4H5N638.4145.4851.235 670.64±0.29b0.85±0.24a4-甲基噻唑C693958C4H5NS793.5212.6061.345 260.45±0.13b0.79±0.13a合计2.05±0.67b3.01±0.71a
注:同行不同字母表示差异显著(P<0.05)。
ROAV法被广泛用于分析关键性风味化合物。ROAV越大,说明该化合物挥发性气味对总体风味贡献度越大[20]。0.1
表8 罗非鱼肉关键风味物质的阈值及ROAV
Table 8 Thresholds and ROAV of key fishy substances in tilapia meat

物质气味描述气味阈值/(μg/kg)ROAV脱腥前脱腥后辛醛草腥、油脂味0.60100.00100壬醛草腥、鱼腥味1.0036.5729.03庚醛鱼腥、油脂味3.008.035.031-辛烯-3-醇土腥味1.5018.9113.39正己醇草腥味5.605.463.44乙酸乙酯甜果香味5.001.732.81乙酸己酯果香味2.004.727.91
2.3.4 脱腥前后罗非鱼肉关键风味成分 OPLS-DA 及 VIP 分析
OPLS-DA 是一种将数据可视化的分析方法,通过数据之间的相关性来量化样品之间的差异程度。将罗非鱼肉 ROAV>1的物质相对含量作为 Y 变量进行 OPLS-DA 建模设计。模型对X和Y矩阵的解释率用R2X和R2Y表示,模型的预测能力用Q2表示,R2和Q2越靠近于1.0,说明模型的拟合性越好。由图4-A可知,R2X=0.953,Q2=0.979,其中R2X=0.953表示该模型可以反映95.3%的数据,且两者都接近于1说明该模型有较好的解释度。图4-A表示脱腥前后罗非鱼肉样品在 OPLS-DA 得分散点图上区分度较好,组内较为聚集,组间存在较好的分离度。OPLS-DA 模型实现了脱腥前后样品挥发性化合物的更好分离,醛醇类化合物聚集在脱腥前样品一侧,酯类物质聚集在脱腥后样品一侧。

A-OPLS-DA得分图;B-置换检验图
图4 脱腥前后罗非鱼肉挥发性物质OPLS-DA得分图和置换检验图
Fig.4 OPLS-DA score plot and permutation test of volatile compounds in tilapia meat before and after deodorization
通过对模型进行200 次交叉置换检验以检测OPLS-DA 模型的可靠性,结果如图4-A所示。图中横坐标为样品的保留度,1.0处的点为原模型的R2和Q2。经过验证后,R2和Q2均小于保留度为1.0的值且模型Q2回归线与横坐标的截距为负数,表示模型无过拟合且稳定可靠。
VIP常用作OPLS-DA模型关键变量分析,VIP值越大,说明贡献率越大。各关键组分的VIP值结果见图5,其中VIP值>1的有辛醛、壬醛、庚醛、1-辛醇-3-醇、正己醇,这五种物质均聚集在脱腥前样品一侧,且5种物质的相对含量在脱腥前挥发性物质中占比较大。结合ROAV及关键风味物质气味描述将上述5种物质确定为关键腥味物质。
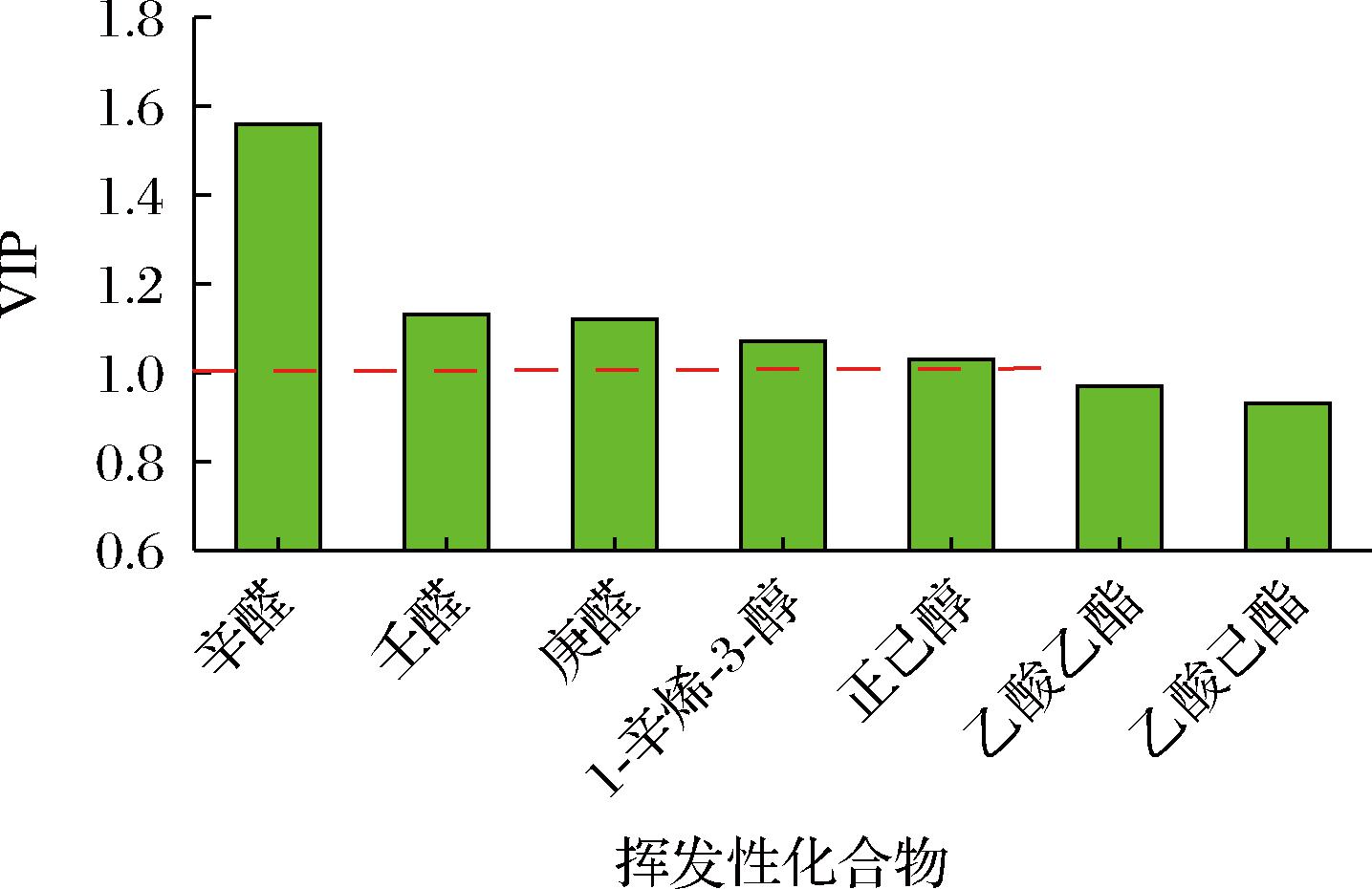
图5 基于 OPLS-DA 模型分析的 VIP 预测值分布图
Fig.5 Distribution of VIP forecast values bas OPLS-DA model analysis
2.4 复合脱腥对罗非鱼关键腥味物质脱除效果的影响
基于表7的实验结果得到复合脱腥对罗非鱼关键腥味物质的脱除效果,结果如图6所示。通过脱腥后,庚醛、壬醛、辛醛、1-辛烯-3-醇、正己醇相对含量均显著降低(P<0.05),分别降低了4.29%、4.19%、2.16%、4.16%、5.38%。醛类物质的产生主要是脂肪氧化或氨基酸发生降解,且阈值相对较低,被认为是鱼肉腥味的主要来源[24];醇类物质是多不饱和脂肪酸被氧化产生,因其感官阈值较低,对罗非鱼腥味贡献较大[25]。脱腥液中的鲜味氨基酸和藿香提取物中的黄酮、酯类等散发的清新香气掩盖了关键腥味物质散发出的鱼腥味和草腥味,致使关键腥味物质相对含量降低。这与吴静等[26]用蒜汁提取液处理罗非鱼后发现辛醛、壬醛、1-辛烯-3-醇等腥味物质含量明显降低这一结果相似。
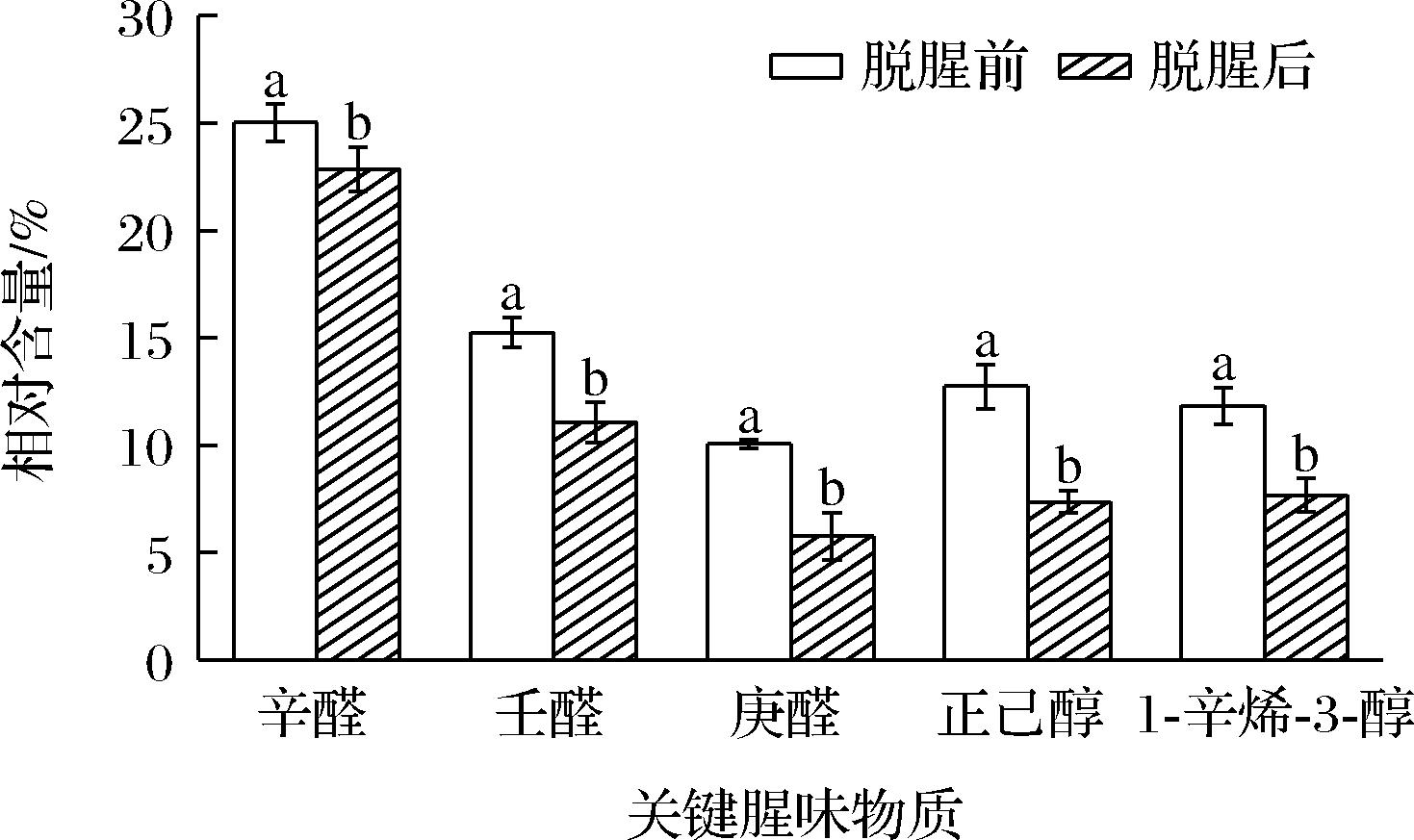
图6 复合脱腥对罗非鱼关键腥味物质脱除效果的影响
Fig.6 Effect of compound deodorization on the removal of key fishy substances in tilapia
3 结论
本实验为探究酵母-藿香复合液对罗非鱼脱腥效果的影响,通过响应面优化脱腥工艺,采用GC-IMS结合OPLS-DA 模型对脱腥前后罗非鱼肉挥发性化合物进行鉴定、区分及总体差异分析。结果表明,在复合脱腥液质量浓度为2.1 g/100 mL,料液比为1∶3.09(g∶mL),浸泡时间为32 min条件下,腥度最低(0.94),感官评分最高(94.88分)。通过GC-IMS共检出22种挥发性物质,以醛醇酯类物质为主。通过脱腥后,醛类和醇类物质相对含量分别减少9.82%和6.23%,酯类物质相对含量增加4.59%。其中,ROAV>1的物质有1-辛烯-3-醇、正己醇、庚醛、壬醛、辛醛、乙酸乙酯、乙酸己酯。OPLS-DA 结合VIP 值筛选出5种关键腥味物质(VIP>1),分别是辛醛、壬醛、庚醛、1-辛烯-3-醇、正己醇,这些物质相互作用对罗非鱼腥味具有重要影响。针对这些腥味特征物质,可为今后罗非鱼预制菜加工过程中腥味的减少提供理论基础。
[1] 罗静, 李敏, 张莹, 等.电子鼻结合GC-MS分析不同干燥方式对罗非鱼片挥发性风味成分的影响[J].南方水产科学, 2022,18(1):135-143.
LUO J, LI M, ZHANG Y, et al.Effect of different drying methods on volatile components of tilapia fillets analyzed by electronic nose combined with GC-MS[J].South China Fisheries Science, 2022,18(1):135-143.
[2] 张海燕, 吴燕燕, 李来好, 等.响应面法优化海鲈鱼片脱腥工艺[J].食品与发酵工业, 2019,45(11):143-149.
ZHANG H Y, WU Y Y, LI L H, et al.Optimized deodorization process of Lateolabrax japonicas fillets by response surface methodology[J].Food and Fermentation Industries, 2019,45(11):143-149.
[3] GUAN W L, REN X C, LI Y J, et al.The beneficial effects of grape seed, sage and oregano extracts on the quality and volatile flavor component of hairtail fish balls during cold storage at 4 ℃[J].LWT, 2019,101:25-31.
[4] HUANG P M, WANG Z R, FENG X Y, et al.Promotion of fishy odor release by phenolic compounds through interactions with myofibrillar protein[J].Food Chemistry, 2022,387:132852.
[5] HUANG P M, WANG Z R, SHI Y, et al.Deodorizing effects of rosemary extract on silver carp (Hypophthalmichthys molitrix) and determination of its deodorizing components[J].Journal of Food Science, 2022,87(2):636-650.
[6] 欧阳伟虹, 胡伟, 周旭静, 等.酵母抽提物对小黄鱼边角料腥味脱除研究[J].食品与生物技术学报, 2020,39(6):76-83.
OUYANG W H, HU W, ZHOU X J, et al.Removal of fishy smell of Polyactis scraps by yeast extract[J].Journal of Food Science and Biotechnology, 2020, 39(6):76-83.
[7] 艾薇, 李悦, 匡建秋.藿香叶黄酮提取工艺优化及其体外抗氧化活性[J].食品工业科技, 2018, 39(22):187-191.
AI W, LI Y, KUANG J Q.Extraction technology of flavonoids from the leaf of Agastacbe rugose(Fisch.et.Mey.) O.Ktze and its antioxidant activities in vitro[J].Science and Technology of Food Industry, 2018, 39(22):187-191.
[8] 卢付青, 唐善虎, 白菊红, 等.藿香提取物对冷却肉保鲜作用的研究[J].食品科技, 2015, 40(10):118-123.
LU F Q, TANG S H, BAI J H, et al. Preservation effect of Agastache rugosa extract on chilled pork[J].Food Science and Technology, 2015, 40(10):118-123.
[9] DUAN S N, TANG X Y, LI W S, et al.Analysis of the differences in volatile organic compounds in different muscles of pork by GC-IMS[J].Molecules, 2023, 28(4):1726.
[10] WANG S Q, CHEN H T, SUN B G.Recent progress in food flavor analysis using gas chromatography-ion mobility spectrometry (GC-IMS)[J].Food Chemistry, 2020, 315:126158.
[11] 邓静, 杨荭, 朱佳倩, 等.水产原料腥味物质的形成及脱腥技术研究进展[J].食品安全质量检测学报, 2019,10(8):2097-2102.
DENG J, YANG H, ZHU J Q, et al.Research progress in the formation and deodorization technology of fishy odor for aquatic raw material[J].Journal of Food Safety &Quality, 2019, 10(8):2097-2102.
[12] 高涛, 罗黄洋, 吴韧, 等.主客观组合权重法在食品感官评价中的应用[J].食品工业科技, 2021,42(18):300-307.
GAO T, LUO H Y, WU R, et al.Application of subjective and objective combination weighting method in food sensory evaluation[J].Science and Technology of Food Industry, 2021,42(18):300-307.
[13] ZHENG X S, JI H W, ZHANG D, et al.The identification of three phospholipid species roles on the aroma formation of hot-air-dried shrimp (Litopenaeus vannamei) by gas chromatography-ion mobility spectrometry and gas chromatography- mass spectrometry[J].Food Research International, 2022, 162:112191.
[14] 赵改名, 王森, 祝超智, 等.基于顶空气相离子迁移色谱对鸭肉腥味特征物质的鉴定[J].食品科学, 2023,44(4):247-255.
ZHAO G M, WANG S, ZHU C Z, et al.Identification of characteristic odorants in duck meat by headspace-gas chromatography-ion mobility spectrometry[J].Food Science, 2023, 44(4):247-255
[15] 任佳怿, 翟营营, 黄晶晶, 等.酵母抽提物滋味成分分析及其复合调味料对鲢鱼风味的影响[J].食品科学, 2020, 41(16):210-217.
REN J Y, ZHAI Y Y, HUANG J J, et al.Analysis of taste components of yeast extract and effect of composite seasoning containing it on the flavor of silver carp[J].Food Science, 2020,41(16):210-217.
[16] DE MENDONÇA SILVA A M, GONÇALVES A A.Effect of aqueous ozone on microbial and physicochemical quality of Nile tilapia processing[J].Journal of Food Processing and Preservation, 2017,41(6):e13298.
[17] 杨睿颖, 朱秋劲, 白晶, 等.肉制品中三甲胺检测方法的应用研究进展[J].食品研究与开发, 2020,41(23):212-219.
YANG R Y, ZHU Q J, BAI J, et al.Recent advances in application of the detection methods of trimethylamine in meat products[J].Food Research and Development, 2020, 41(23):212-219.
[18] FENG H, TIMIRA V, ZHAO J L, et al.Insight into the characterization of volatile compounds in smoke-flavored sea bass (Lateolabrax maculatus) during processing via HS-SPME-GC-MS and HS-GC-IMS[J].Foods, 2022,11(17):2614.
[19] ARCE L, GALLEGOS J, GARRIDO-DELGADO R, et al. Ion mobility spectrometry a versatile analytical tool for metabolomics applications in food science[J]. Current Metabolomics, 2015, 2(4):264-271.
[20] YAO L Y, MO Y F, CHEN D,et al.Characterization of key aroma compounds in Xinjiang dried figs (Ficus carica L.) by GC-MS, GC-olfactometry, odor activity values, and sensory analyses[J].LWT, 2021, 150:111982.
[21] 尹一鸣, 徐永霞, 张朝敏, 等.水产品贮藏期间风味劣变机理的研究进展[J].食品与发酵工业, 2020, 46(14):269-274.
YIN Y M, XU Y X, ZHANG C M, et al.The progress on flavor deterioration mechanism of aquatic products during storage[J].Food and Fermentation Industries, 2020, 46(14):269-274.
[22] GASPARDO B, PROCIDA G, TOSO B, et al.Determination of volatile compounds in San Daniele ham using headspace GC-MS[J].Meat Science, 2008, 80(2):204-209.
[23] XIE Q S, XU B C, XU Y, et al.Effects of different thermal treatment temperatures on volatile flavour compounds of water-boiled salted duck after packaging[J].LWT, 2022, 154:112625.
[24] PAVLIDIS D E, MALLOUCHOS A, ERCOLINI D, et al.A volatilomics approach for off-line discrimination of minced beef and pork meat and their admixture using HS-SPME GC/MS in tandem with multivariate data analysis[J].Meat Science, 2019,151:43-53.
[25] LI Y H, ZHOU W, CAO Y P, et al.Analysis of volatile components of Tilapia enzymolysis solution after different deodorization treatments[J].IOP Conference Series: Earth and Environmental Science, 2020,571(1):012121.
[26] 吴静, 黄卉, 李来好, 等.HS-SPME-GC-MS分析大蒜水提取物对罗非鱼肉腥味的影响[J].食品与发酵工业, 2019,45(14):133-142.
WU J, HUANG H, LI L H, et al. Effects of garlic aqueous extracts on fishy odor of tilapia fillets analyzed by HS-SPME-GC-MS[J]. Food and Fermentation Industries, 2019, 45(14):133-142.