桑葚是多年生木本植物桑树的果实,具有极高的营养和药用价值,已被国家卫生健康委员会列入“药食同源”名录,但其在常温下极难贮藏,易腐烂、变质,采后需及时处理或经加工以延长其货架期[1]。桑葚果酒是桑葚的主要加工产品之一,富含多糖、花青素和黄酮等生物活性物质,长期饮用可起到促进消化、增强免疫力等作用,具有巨大的市场价值[2]。然而,饮用桑葚果酒易出现“上头”现象,并伴有头痛、心悸等不适症状[3],制约其规模化推广销售。有研究表明,果酒中生物胺、杂醇油等物质含量偏高是造成其“上头”的重要原因[4-5]。
生物胺是一类非挥发性的低分子质量含氮有机化合物的总称,广泛存在于泡菜、发酵香肠和葡萄酒等发酵食品中,多通过氨基酸的脱羧反应形成[6]。食品中常见的生物胺主要有:酪胺、苯乙胺、组胺和色胺等单胺,以及腐胺、尸胺、亚精胺和精胺等多胺。适量的生物胺对促进人体生长、增强代谢活力和清除体内自由基等具有积极作用,但当人体从外界摄入过多的生物胺时,会引起血管和动脉的舒张,产生偏头疼、心律不齐、血压异常、腹泻和呕吐等不良反应,甚至对肝脏、心脏和中枢神经系统等造成危害[7]。
发酵果酒的生物胺主要是由微生物的氨基酸脱羧酶催化氨基酸脱羧而成[8]。以往研究表明氨基酸是酿酒过程中生物胺形成的主要原因[9]。而桑葚中富含氨基酸,可为生物胺的形成提供充足的前体物[10]。目前控制食品生物胺的方法主要有物理法、化学法和微生物法,其中利用具有生物胺降解能力且不影响产品品质的微生物是控制发酵食品中生物胺含量最有效的途径。有研究发现,接种合适的非酿酒酵母可显著降低葡萄酒中生物胺的安全风险,有助于改善酒体品质[11-12]。王伟雄[13]发现经Kluyveromyces marxianus YK-29发酵的葡萄酒,其浆果香和水果香显著提高,而腐胺含量降低。WANG等[11]使用Schizosaccharomyces pombe和Lachancea thermotolerans复合发酵葡萄酒,获得的葡萄酒生物胺和氨基甲酸乙酯前体物含量显著降低。目前针对果酒生物胺控制菌株的研究多集中于葡萄酒,尚未有关于发酵菌株控制桑葚果酒生物胺的报道。组胺被认为是对人体危害最大的生物胺,含量偏高会引起血压异常、偏头痛、腹泻和呼吸困难等不良症状[7],国际葡萄和葡萄酒组织(International Organization of Vine and Wine, OIV)建议葡萄酒中组胺含量不超过12 mg/L,而一些欧洲国家更为严格,将葡萄酒中组胺的最大允许值设定为2~10 mg/L[14-15]。据此,可以合理推断控制桑葚果酒中组胺的含量有助于桑葚果酒“上头”问题的解决。本研究从桑葚和自然发酵的桑葚果酒中分离酵母菌株,通过评价分离菌株的组胺降解能力、生物胺合成能力及其对桑葚果酒组胺和品质的影响,以期获得可有效控制桑葚果酒组胺含量,且对其品质无负面影响的酵母菌株,为桑葚果酒组胺的控制提供依据。
1 材料与方法
1.1 材料与试剂
桑葚,采自广东省农业科学院的桑葚种植园;酿酒酵母(Saccharomyces cerevisiae RV002),安琪酵母股份有限公司;鸟氨酸、赖氨酸、精氨酸、酪氨酸、色氨酸、苯丙氨酸、组氨酸、组胺二盐酸盐、胍基丁胺、丹磺酰氯、白藜芦醇、葡萄糖、DPPH和ABTS(纯度≥99%),上海源叶生物科技有限公司;蛋白胨和酵母浸提膏,广东环凯微生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
SPX-250B-Z生化培养箱,上海博讯实业有限公司;SW-CJ-2FD无菌操作台,苏州安康空气技术有限公司;FiveEasy PlusTMFE28型pH计,梅特勒-托利多仪器(上海)有限公司;WF-A2000型榨汁机,美的集团公司;Biofuge Stratos Sorvall高速冷冻离心机,美国Thermo Fisher Scientific公司;LC-20AT高效液相色谱仪、UV1800紫外分光光度计,日本岛津公司;HH-2型数显恒温水浴锅,常州金坛精达仪器制造有限公司。
1.3 培养基
酵母浸出粉胨葡萄糖培养基(YPD)(g/L):酵母膏10,蛋白胨20,葡萄糖20,自然pH,固体培养基加琼脂15,115 ℃灭菌20 min,冷却后加入无水乙醇10%(体积分数);
生物胺合成培养基(g/L):酵母膏10,蛋白胨20,葡萄糖20,自然pH,115 ℃ 20 min灭菌后加入色氨酸、鸟氨酸、赖氨酸、苯丙氨酸、组氨酸、酪氨酸和精氨酸各1,磷酸吡哆醛0.1,无水乙醇10%(体积分数)。
1.4 生物胺降解菌的筛选
1.4.1 酵母菌的分离纯化
称取10 g鲜桑葚或10 mL自然条件下发酵的桑葚果酒放于250 mL锥形瓶中,加入90 mL 0.89%无菌生理盐水后放入摇床上,于30 ℃ 150 r/min培养30 min。取悬浮液进行梯度稀释,分别吸取各梯度菌液100 μL涂布于YPD固体培养基,于30 ℃培养箱中培养3~5 d。观察并挑取菌落形态大小不同的单菌落划线培养3~5 d,接入YPD液体培养基中30 ℃培养24 h。对分离菌株进行编号(XS1~XS50;SJ1~SJ47)并保存(-80 ℃)在甘油管中,用于进一步研究。
1.4.2 酵母菌降解组胺能力评价
根据各菌OD600值取适量体积培养液,4 ℃ 5 000 r/min离心10 min,弃上清液,收集沉淀,用0.05 mol/L的磷酸缓冲液(PBS,pH=6.5)清洗2次,将菌体重悬至含100 mg/L组胺的0.05 mol/L的PBS缓冲液(pH=6.5,乙醇10%(体积分数))中,调整培养液的菌密度OD600=0.8,以不接菌株并含100 mg/L组胺的PBS缓冲液为对照组,置于30 ℃恒温培养箱中培养48 h。培养结束后测定缓冲液中的组胺含量。组胺含量测定参照GB 5009.208—2016《食品中生物胺的测定》。各菌株降解组胺的能力按公式(1)计算:
降解率![]()
(1)
1.4.3 酵母菌合成生物胺能力评价
根据各菌OD600值取适量体积的培养液,4 ℃ 5 000 r/min离心10 min,弃上清液,收集沉淀,用0.05 mol/L的PBS缓冲液(pH=6.5)洗涤2次,然后将菌体重悬至含10%(体积分数)乙醇的生物胺合成培养基中,调整培养液的菌密度OD600=0.8,以不接菌株的培养基为对照组,置于30 ℃恒温培养箱中培养48 h。培养结束后检测培养基中生物胺含量。以实验组与对照组的生物胺含量差值为菌株的生物胺合成能力。
1.5 菌种鉴定
根据组胺降解能力和生物胺合成能力的结果,将获取的菌株送至广州擎科生物科技有限公司进行测序,以ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)为上下游引物,扩展ITS序列对菌株进行鉴定,将测序结果在NCBI数据库的BLAST中进行同源性搜索比对,利用MEGA-X软件的Neighbor-joining构建系统发育树,具体确定菌株种属。
1.6 桑葚果酒的发酵
桑葚果酒发酵工艺参照徐柳青[16]的研究,将桑葚去除杂质后破壁并加热3~4 min 进行杀菌处理,用蔗糖和焦亚硫酸钠来调整桑葚果汁的可溶性固体含量和二氧化硫浓度,使桑葚果汁的可溶性固体含量和二氧化硫浓度分别为22 °Brix和80 mg/L。然后加入0.25 g/L的活性干酵母(S.cerevisiae RV002),同时,在30 ℃下培养筛选的组胺降解酵母菌,直到培养液的OD600值达到4,在4 ℃ 5 000 r/min下离心10 min后,用0.05 mol/L磷酸盐缓冲液(pH=6.5)清洗菌体。根据前期对活化的酿酒酵母和组胺降解酵母的计数结果,将洗过的菌体按S.cerevisiae RV002∶筛选到的组胺降解酵母=1∶1(107 CFU/mL)接种量重新悬浮在桑葚果汁中,与S.cerevisiae RV002在(25±1) ℃下共同发酵的桑葚果酒设置为复合发酵组,处理相同但只接入S.cerevisiae RV002的桑葚果酒设置为对照组。当发酵的桑葚果酒酒精度含量达到11%vol时,将发酵后的果酒在5 100 r/min下离心10 min,上清液贮存在4 ℃,待进一步分析。
1.7 桑葚果酒品质的测定
pH和可滴定酸:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》。
还原糖:参照GB/T 5009.7—2008《食品中还原糖的测定》的3,5-二硝基水杨酸法。
酒精度:参照GB 5009.225—2016《酒中乙醇浓度的测定》。
感官评价:由10人组成感官品评小组对桑葚果酒的外观、香气和滋味进行测评,结果取平均值。感官评分细则参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》并适当修改,具体如表1所示。
表1 感官评分细则
Table 1 Sensory scoring rules

项目评分标准分值/分外观(30分)具有桑葚果酒应有的颜色且有光泽21~30具有桑葚果酒应有的颜色,无明显悬浮物11~20与果酒应有的色泽不符,微浑0~10香气(35分)果香、酒香明显,香气柔协,具有愉悦感26~35果香、酒香淡雅,无异香16~25果香不足或不悦人,或有异香0~15滋味(35分)酒体丰满,口感饱满圆润,回味延绵,具有桑葚果酒独特滋味26~35酒质柔顺,纯正无杂16~25酒体寡淡,口感不协调0~15
总花色苷:采用示差法。将酒样稀释一定倍数,吸取1 mL的稀释液,用pH=1.0的缓冲液(0.2 mol/L KCl-0.2 mol/L HCl)定容至10 mL,在室温下平衡10 min后,测定其在515 nm和700 nm处的吸光值,分别表示为A515、A700;用同样的方法测定样品在pH=4.5缓冲溶液(0.2 mol/L CH3COONa-0.2 mol/L CH3COOH)下的吸光值,总花色苷按公式(2)和公式(3)计算:
A=(A515-A700)pH1.0-(A515-A700)pH4.5
(2)
总花色甘含量![]()
(3)
式中:MW,相对分子质量,以矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside,C3G)计,MW=449.2;DF,稀释倍数;ε,摩尔消光系数,以C3G计,ε=29 600 L/(mol·cm);L,光程,1.0 cm。
白藜芦醇:参照王汗鑫等[17]的方法测定。
总酚、DPPH自由基清除能力和ABTS阳离子自由基清除能力的测定:均参照孔燕等[18]的方法进行测定。
甲醇和高级醇的测定:参照高敏等[19]的方法进行检测。
1.8 数据分析
实验数据运用Excel 2021整理,IBM SPSS Statistics 20的独立样本t检验进行方差分析,Origin 2021作图,每个实验3组平行,结果采用平均值±标准差表示。
2 结果与分析
2.1 酵母菌的分离纯化
经分离纯化得到97株疑似酵母菌(编号为XS1~XS50;SJ1~SJ47)。部分菌株如附图1(https://doi.org/10.13995/j.cnki.11-1802/ts.036830,下同)所示,菌落形态为圆形、乳白色,菌落表面光滑不透明,黏稠,边缘规整,易挑起,菌体为卵圆形或球形,符合《微生物学基础》中对酵母菌的描述。
2.2 酵母菌降解组胺能力分析
将分离纯化获得的97株疑似酵母菌接种到含组胺和10%(体积分数)乙醇的PBS缓冲溶液中,分析其组胺的降解能力。由附表1可知,不同菌株对组胺的降解水平有较大差异(0%~65.32%),67%的分离菌株表现出降解组胺的能力。其中,菌株XS22、SJ9和SJ36具有较强的组胺降解能力,降解率均>50%,表明这3株菌产生的组胺降解酶活力较强[20],因此选用菌株XS22、SJ9和SJ36进行后续实验。
2.3 酵母菌合成生物胺的能力分析
某些微生物可产生氨基酸脱羧酶,将前体氨基酸转化成生物胺[21]。为了评估XS22、SJ9和SJ36这3株菌的应用潜力,进一步分析其合成色胺、β-苯乙胺、腐胺、尸胺、组胺、酪胺、精胺和亚精胺的能力。由附表2可知,菌株XS22和SJ9培养基中均有组胺、色胺和腐胺的产生,说明这2株菌具有合成组氨酸脱羧酶、色氨酸脱羧酶和鸟氨酸脱羧酶的能力,可将前体组氨酸、色氨酸和鸟氨酸转化为相应的生物胺。此外,菌株XS22的培养液中还检出2.88 mg/L的酪胺。在食品常见的8种生物胺中,酪胺的毒性仅次于组胺,过量会使人体肠胃不适、高血压,色胺过量会导致偏头痛、血压异常,腐胺则会增强组胺和酪胺的毒性效应[22]。而在菌株SJ36培养液中未检测出生物胺,表明该菌株没有合成这8种生物胺的能力。据此,可以认为菌株XS22和SJ9不宜作为桑葚果酒组胺控制的发酵菌株,菌株SJ36可作为控制桑葚果酒组胺的潜在发酵菌株。
2.4 分子生物学鉴定
对菌株SJ36进行分子生物学鉴定,以菌株SJ36的DNA为模板,将引物ITS1和ITS4扩增获得的序列在NCBI数据库的BLAST中进行同源性比对,发现菌株SJ36与库德里阿兹威氏毕赤酵母菌VN7Y(Pichia kudriavzevii VN7Y,Accession:MT102790.1)的同源性达100%。同时,经序列多重比对和系统发育树的构建(附图2),发现菌株SJ36与库德里阿兹威氏毕赤酵母菌(P.kudriavzevii)亲缘关系最近,可信度最高。因此,结合菌落形态与分子学鉴定将其鉴定为库德里阿兹威氏毕赤酵母菌,属于安全菌,可用于食品[23]。
2.5 桑葚果酒品质分析
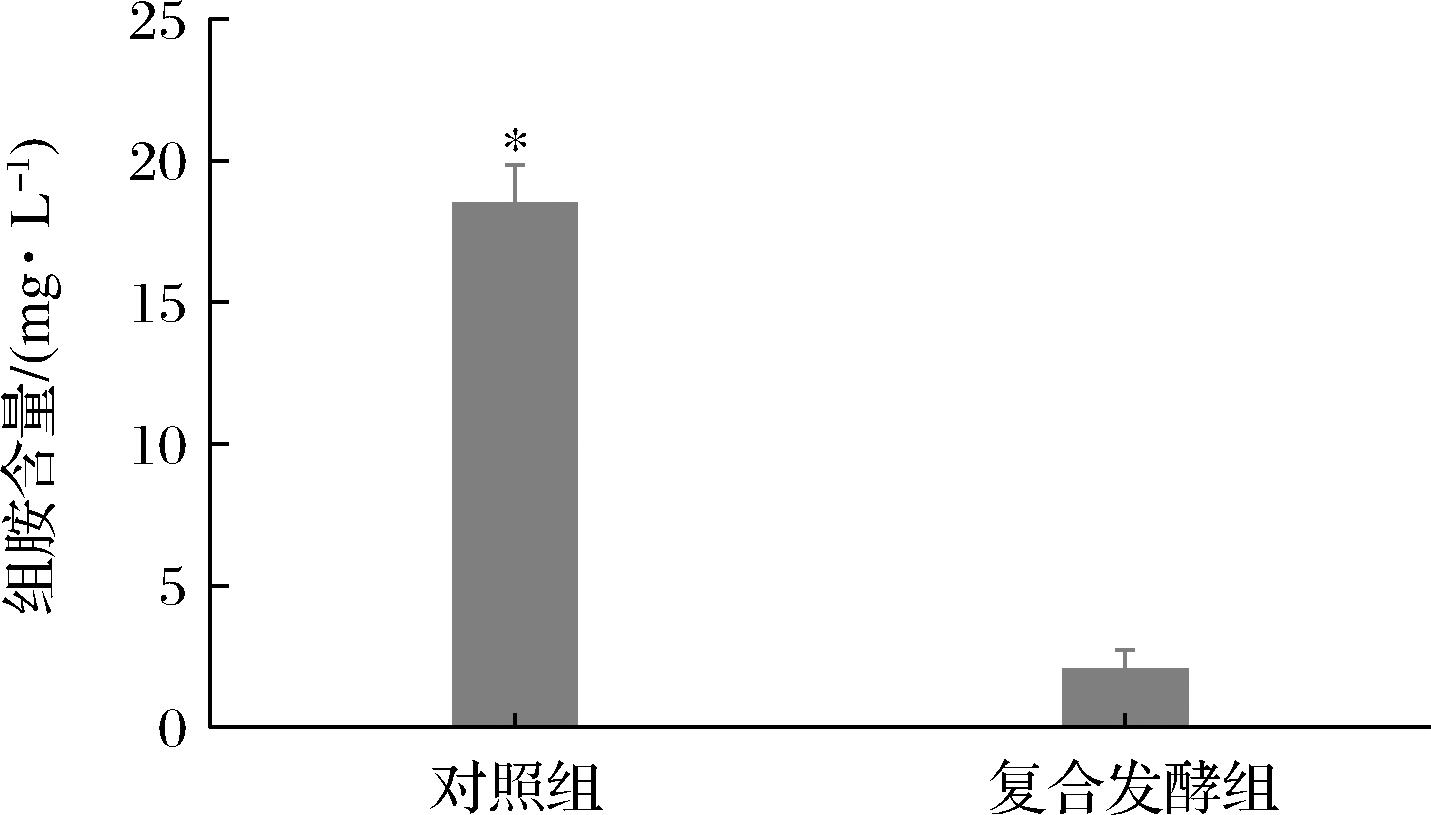
2.5.1 P.kudriavzevii SJ36对桑葚果酒组胺含量的影响
研究表明,非酿酒酵母和酿酒酵母共同发酵可降低酒中生物胺的浓度[11]。如附图3所示,S.cerevisiae RV002单菌发酵的对照组中组胺含量较高(18.48 mg/L),而S.cerevisiae复合P.kudriavzevii SJ36发酵的桑葚果酒中组胺含量显著低于对照组,为2.03 mg/L,表明菌株SJ36可有效降低桑葚果酒中组胺的含量。郭琳洁等[24]也发现经P.kudriavzevii DPUY-J8复合黑曲霉发酵的大酱组胺含量低于黑曲霉单一发酵的大酱,推测这可能是因为P.kudriavzevii DPUY-J8会抑制大酱中具有组胺合成能力微生物的生长。而有研究发现,P.kudriavzevii可产生活性较高的漆酶,其基因组中也含有编码3-磷酸甘油醛脱氢酶的基因,这2种酶被报道具有组胺降解能力[25-26],这可能是P.kudriavzevii SJ36能够有效控制桑葚果酒组胺含量的关键因素之一。
2.5.2 P.kudriavzevii SJ36对桑葚果酒理化指标及感官评价的影响
桑葚果酒的品质是影响消费者接受度的关键因素,不同桑葚果酒的pH值、总酸、还原糖、酒精度和感官评分见附表3。与对照组相比,S.cerevisiae复合P.kudriavzevii SJ36发酵的桑葚果酒中还原糖含量较低,表明复合发酵组的微生物对糖的利用更为彻底。这可能是因为糖是酵母生长代谢最重要的营养物质和能量来源,且P.kudriavzevii对葡萄糖和果糖有较高的利用率[27]。由附表3可知,复合发酵组和对照组的pH值和酒精度没有显著差异,但复合发酵组的可滴定酸含量相对较低。以往研究表明部分P.kudriavzevii具有降酸的能力[27],因此复合发酵组的可滴定酸含量更低。此外,S.cerevisiae复合P.kudriavzevii SJ36发酵的桑葚果酒评分更高,SJ36发酵的桑葚果酒光泽度高,酒香果香浓郁,回味延绵。结合理化指标,认为SJ36是一株可降低酸度并增香型的P.kudriavzevii,适用于桑葚果酒发酵。
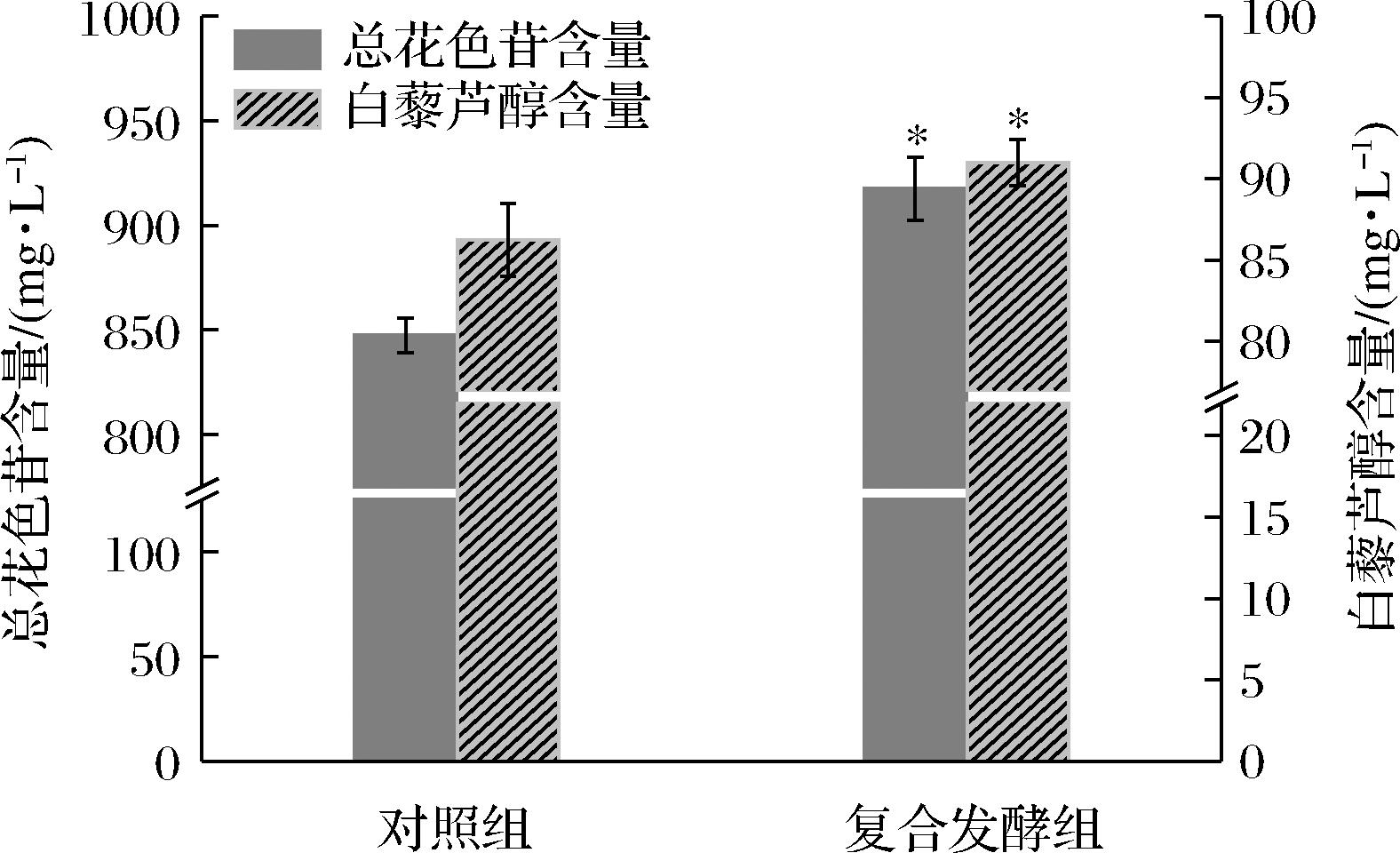
2.5.3 P.kudriavzevii SJ36对桑葚果酒花色苷和白藜芦醇含量的影响
花色苷和白藜芦醇作为桑葚的重要功能活性成分,具有抗氧化、保护神经细胞和心脑血管系统等药理作用[28]。因此,本研究分析了P.kudriavzevii SJ36对桑葚果酒总花色苷和白藜芦醇含量的影响,结果如附图4所示。与对照组相比,S.cerevisiae复合P.kudriavzevii SJ36发酵的桑葚果酒总花色苷和白藜芦醇含量分别提高了8.27%和5.52%。任学梅[29]也发现非酿酒酵母和S.cerevisiae复合发酵可提升葡萄酒的花色苷含量。有报道表明,非酿酒酵母产生的果胶酶有利于花色苷和白藜芦醇在浸渍阶段从葡萄皮中浸出进入发酵液,提高发酵液中花色苷含量[30-31],而ELHALIS等[32]发现P.kudriavzevii会产生较高活力的果胶酶,说明P.kudriavzevii SJ36对桑葚中总花色苷和白藜芦醇的浸出有促进作用。
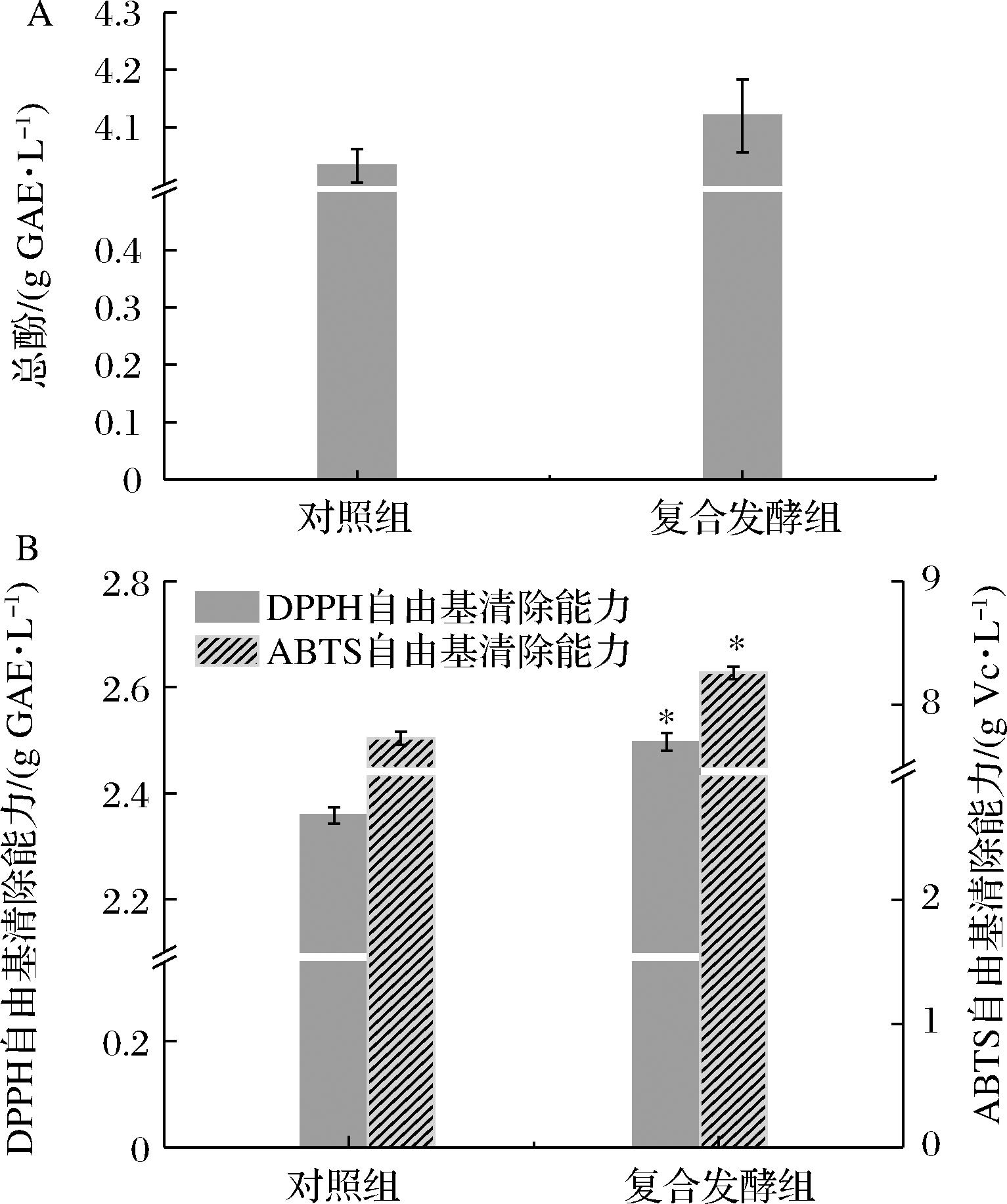
2.5.4 P.kudriavzevii SJ36对桑葚果酒总酚含量和抗氧化能力的影响
多酚对果酒的口感和色泽有着重要作用,是一类具有抗氧化能力的生物活性化合物[33]。不同桑葚果酒的总酚含量见附图5-A,复合发酵组和对照组的总酚含量未呈现显著性差异,但复合发酵组的总酚含量略有提高。这与XU等[34]得到的研究结果类似,与S.cerevisiae发酵的果酒相比,Candida ethanolica与S.cerevisiae复合发酵的果酒中总酚含量略高但无显著差异。然而,Hanseniaspora guilliermondii与S.cerevisiae混合发酵的果酒总酚含量显著低于S.cerevisiae发酵的果酒[34]。这主要是因为不同微生物发酵过程中产生的水解酶活力不同,对从植物基质中释放结合酚的能力也有所差异。此外,由附图5-B可知,S.cerevisiae复合P.kudriavzevii SJ36发酵可显著提升桑葚果酒的DPPH自由基和ABTS自由基阳离子清除能力,其原因可能是P.kudriavzevii SJ36产生的酶能有效促进桑葚细胞壁解聚释放可提升桑葚果酒抗氧化活性的物质,进而提升桑葚果酒的抗氧化能力[18]。
2.5.5 P.kudriavzevii SJ36对桑葚果酒甲醇和高级醇含量的影响
甲醇会麻醉中枢神经系统,损害视觉神经,同时还会引起机体代谢性酸中毒,是果酒发酵时极易产生的副产物,因此,果酒中的甲醇含量是评价其品质的重要指标之一[35]。如附表4所示,S.cerevisiae发酵组甲醇含量为315.25 mg/L,而经S.cerevisiae复合P.kudriavzevii SJ36发酵获得的桑葚果酒甲醇含量为242.76 mg/L,比对照组降低了23.00%。根据GB/T 15037—2006《葡萄酒》中关于甲醇在葡萄酒中的限量规定(白、桃红葡萄酒≤250 mg/L,红葡萄酒≤400 mg/L),可以推断经S.cerevisiae复合P.kudriavzevii SJ36发酵获得的桑葚果酒饮用安全性更好。有研究显示,毕赤酵母是一种甲基营养酵母,需依靠甲醇或其独特的甲醇利用途径来生长繁殖[36]。在桑葚果酒发酵过程中,P.kudriavzevii SJ36会消耗基质中的甲醇来促进其生长,因此复合发酵组的甲醇含量低于对照组。
高级醇俗称杂醇油,主要包括正丙醇、正丁醇、异丁醇和异戊醇等,是构成酒类风味的重要物质[37]。有研究表明,葡萄酒的高级醇含量为300 mg/L时会产生令人愉快的风味,而当含量超过400 mg/L会伴有强烈的刺激性口感,对葡萄酒风味造成负面影响[38]。由附件表4可知,正丙醇、异丁醇和异戊醇是检测到的主要高级醇。对照组的高级醇总含量为438.17 mg/L,而S.cerevisiae复合P.kudriavzevii SJ36发酵的桑葚果酒高级醇总含量为391.42 mg/L,表明复合发酵组的感官品质和饮用舒适度均优于对照组。曲冠颐等[39]发现P.kudriavzevii和S.cerevisiae混合发酵的白酒中高级醇含量显著低于酿酒酵母单菌发酵的白酒。与对照组相比,经S.cerevisiae复合P.kudriavzevii SJ36发酵的桑葚果酒中正丙醇、异丁醇和异戊醇含量分别下降了15.10%、13.83%和10.13%。由此表明,P.kudriavzevii SJ36对桑葚果酒的正丙醇、异丁醇和异戊醇均有较好的调控作用。
3 结论
本研究从桑葚和自然发酵的桑葚果酒中分离出97株潜在的组胺降解酵母菌,分离菌株中有3株菌的组胺降解能力超过50%,其中菌株SJ36的组胺降解能力最强,其组胺降解率为65.32%。此外,菌株SJ36无合成色胺、β-苯乙胺、腐胺、尸胺、组胺、酪胺、精胺和亚精胺的能力。经ITS序列分析和系统进化学分析鉴定筛选菌株为库德里阿兹威氏毕赤酵母菌(P.kudriavzevii)。因此,P.kudriavzevii SJ36被筛选为潜在的桑葚果酒组胺降解菌株。为了进一步评价筛选菌株用于桑葚果酒组胺控制的效果,使用桑葚果酒发酵模型解析P.kudriavzevii SJ36对桑葚果酒组胺、感官评价、总花色苷、白藜芦醇、总酚、抗氧化能力、甲醇和高级醇的影响。与S.cerevisiae单菌发酵的桑葚果酒相比,经P.kudriavzevii SJ36复合S.cerevisiae发酵的桑葚果酒酒香浓郁,酒味柔顺,感官评分为82.51分,组胺、甲醇及高级醇的含量分别下降了89.02%、23.00%和10.67%。此外,复合发酵桑葚果酒的总花色苷、白藜芦醇、总酚含量以及抗氧化能力较S.cerevisiae纯种发酵的桑葚果酒均呈现不同程度的升高,表明P.kudriavzevii SJ36不仅可有效控制桑葚果酒的组胺,而且可提高桑葚果酒的品质,可作为控制桑葚果酒组胺含量的潜在发酵菌株。
[1] WEN M, LIN X, YU Y S, et al.Natamycin treatment reduces the quality changes of postharvest mulberry fruit during storage[J].Journal of Food Biochemistry, 2019,43(8):e12934.
[2] XIONG Q M, LIU J, LIU M, et al.Fouling analysis and permeate quality evaluation of mulberry wine in microfiltration process[J].RSC Advances, 2020, 10(2):655-665.
[3] 黄进. 桑椹果酒中生物胺和杂醇油调控技术研究[D].南昌:江西农业大学, 2011.
HUANG J.Optimization of technological practices on the reduction of biogenic amine and fusel oils in mulberry wines[D].Nanchang:Jiangxi Agricultural University, 2011.
[4] ESPOSITO F, MONTUORI P, SCHETTINO M, et al.Level of biogenic amines in red and white wines, dietary exposure, and histamine-mediated symptoms upon wine ingestion[J].Molecules, 2019, 24(19):3629.
[5] 尹延顺. 糖度对苹果酒风味物质中上头特征成分变化规律的影响[D].济南:齐鲁工业大学, 2021.
YIN Y S.The effect of sugar content on the change law of headache and delirium characteristic components in cider flavor compositions[D].Jinan:Qilu University of Technology, 2021.
[6] VASCONCELOS H, DE ALMEIDA J M M M, MATIAS A, et al.Detection of biogenic amines in several foods with different sample treatments:An overview[J].Trends in Food Science &Technology, 2021, 113:86-96.
[7] W JCIK W,
JCIK W,  UKASIEWICZ M, PUPPEL K.Biogenic amines:Formation, action and toxicity-a review[J].Journal of the Science of Food and Agriculture, 2021, 101(7):2634-2640.
UKASIEWICZ M, PUPPEL K.Biogenic amines:Formation, action and toxicity-a review[J].Journal of the Science of Food and Agriculture, 2021, 101(7):2634-2640.
[8] 杨姗姗, 张凤艳, 蒋万枫, 等.发酵酒中生物胺的研究进展[J].中国酿造, 2022, 41(3):18-23.
YANG S S, ZHANG F Y, JIANG W F, et al.Research progress of biogenic amines in fermented alcoholic drink[J].China Brewing, 2022, 41(3):18-23.
[9] GUO Y Y, YANG Y P, PENG Q, et al.Biogenic amines in wine:A review[J].International Journal of Food Science &Technology, 2015, 50(7):1523-1532.
[10] 杨喆, 陈秋生, 张强, 等.不同品种桑葚与桑叶中氨基酸含量差异研究[J].食品安全质量检测学报, 2018, 9(17):4534-4538.
YANG Z, CHEN Q S, ZHANG Q, et al.Difference of amino acid content between mulberry and mulberry leaves of different varieties[J].Journal of Food Safety &Quality, 2018, 9(17):4534-4538.
[11] WANG B S, TAN F L, CHU R C, et al.The effect of non-Saccharomyces yeasts on biogenic amines in wine[J].Trends in Food Science &Technology, 2021, 116:1029-1040.
[12] 谭凤玲. 非酿酒酵母对葡萄酒生物胺的影响[D].新乡:河南科技学院, 2022.
TAN F L.The effects of non-Saccharomyces yeasts on biogenic amines in wine[D].Xinxiang:Henan Institute of Science and Technology, 2022.
[13] 王伟雄. 基于Kluyveromyces marxianus与酿酒酵母混合发酵葡萄酒动力学分析及质量提升研究[D].乌鲁木齐:新疆农业大学, 2022.
WANG W X.Dynamic analysis and quality improvement of mixed fermentation wine based on Kluyveromyces marxianus and Saccharomyces cerevisiae[D].Urumchi:Xinjiang Agricultural University, 2022.
[14] MARTUSCELLI M, ARFELLI G, MANETTA A C, et al.Biogenic amines content as a measure of the quality of wines of Abruzzo (Italy)[J].Food Chemistry, 2013, 140(3):590-597.
[15] PÉREZ-MAGARI O S, CANO-MOZO E, ALBORS C, et al.Autochthonous Oenococcus oeni strain to avoid histamine formation in red wines:A study in real winemaking conditions[J].American Journal of Enology and Viticulture, 2021, 72(2):170-180.
O S, CANO-MOZO E, ALBORS C, et al.Autochthonous Oenococcus oeni strain to avoid histamine formation in red wines:A study in real winemaking conditions[J].American Journal of Enology and Viticulture, 2021, 72(2):170-180.
[16] 徐青柳. 非酿酒酵母菌株筛选及其与酿酒酵母混合发酵对蓝莓酒品质的影响[D].雅安:四川农业大学, 2021.
XU Q L.Screening of non-Saccharomyces cerevisiae strains and effects of mixed fermentation with Saccharomyces cerevisiae on the quality of blueberry wine[D].Ya′an:Sichuan Agricultural University, 2021.
[17] 王汗鑫, 张通, 张凌峰, 等.不同桑椹品种、物候期及贮藏条件下白藜芦醇的差异研究[J].中国农学通报, 2022, 38(22):55-61.
WANG H X, ZHANG T, ZHANG L F, et al.Study on the difference of resveratrol of mulberry varieties in different phenological periods and storage conditions[J].Chinese Agricultural Science Bulletin,2022, 38(22):55-61.
[18] 孔燕, 杨蕊羽, 张明慧, 等.酵母菌株及陈酿时间对桑葚酒主要理化指标和抗氧化能力的影响[J].食品与发酵工业, 2020, 46(6):67-72.
KONG Y, YANG R Y, ZHANG M H, et al.Effects of yeast strains and aging time on main physicochemical indexes and antioxidant capability of mulberry wines[J].Food and Fermentation Industries, 2020, 46(6):67-72.
[19] 高敏, 曾新安, 于淑娟.荔枝酒中杂醇油含量的测定[J].食品工业科技, 2010, 31(5):356-358.
GAO M, ZENG X A, YU S J.Study on determination of fusel oil content in litchi wine[J].Science and Technology of Food Industry, 2010, 31(5):356-358.
[20] 赵一睿, 桑雪, 毕景然, 等.蜢虾酱中生物胺降解菌的特性及应用[J].大连工业大学学报, 2022, 41(1):1-6.
ZHAO Y R, SANG X, BI J R, et al.Characteristics research and application of biogenic amine degrading bacteria in grasshopper sub shrimp paste[J].Journal of Dalian Polytechnic University, 2022, 41(1):1-6.
[21] ![]() O, ROSZKO M
O, ROSZKO M  , W
, W JCICKI M, et al.Biogenic amines and free amino acids in traditional fermented vegetables-dietary risk evaluation[J].Journal of Agricultural and Food Chemistry, 2020, 68(3):856-868.
JCICKI M, et al.Biogenic amines and free amino acids in traditional fermented vegetables-dietary risk evaluation[J].Journal of Agricultural and Food Chemistry, 2020, 68(3):856-868.
[22] 邓斯予, 曹立民, 隋建新.发酵食品加工与贮藏过程中生物胺的控制研究进展[J].食品安全质量检测学报, 2023, 14(1):156-164.
DENG S Y, CAO L M, SUI J X.Research progress on the control of biogenic amines in the processing and storage of fermented foods[J].Journal of Food Safety &Quality, 2023, 14(1):156-164.
[23] DOUGLASS A P, OFFEI B, BRAUN-GALLEANI S, et al.Population genomics shows no distinction between pathogenic Candida krusei and environmental Pichia kudriavzevii:One species, four names[J].PLoS Pathogens, 2018,14(7):e1007138.
[24] 郭琳洁, 顾金红, 李思怡, 等.黑曲霉DPUM-J2和毕赤酵母DPUY-J8在大酱发酵中的应用[J].食品研究与开发, 2022, 43(18):182-190.
GUO L J, GU J H, LI S Y, et al.Application of Aspergillus niger DPUM-J2 and Pichia kudriavzevii DPUY-J8 in soybean paste fermentation[J].Food Research and Development, 2022, 43(18):182-190.
[25] DELGADO-OSPINA J, TRIBOLETTI S, ALESSANDRIA V, et al.Functional biodiversity of yeasts isolated from Colombian fermented and dry cocoa beans[J].Microorganisms, 2020, 8(7):1086.
[26] 倪秀梅, 杨涛, 方芳.生物胺降解酶研究进展及其应用[J].微生物学通报, 2021,48(11):4398-4411.
NI X M, YANG T, FANG F.Biogenic amines-degrading enzymes and their applications:A review[J].Microbiology China, 2021, 48(11):4398-4411.
[27] 王德培, 胡阳, 焦富.库德里阿兹威氏毕赤酵母在发酵工业中的研究进展[J].酿酒科技, 2021(6):95-101.
WANG D P, HU Y, JIAO F.Research progress in the application of Pichia kudriavzevii in industrial fermentation[J].Liquor-Making Science &Technology, 2021(6):95-101.
[28] 陈诚, 李洪波, 杨欣, 等.中药桑椹活性物质的研究进展[J].中药材, 2010, 33(10):1660-1663.
CHEN C, LI H B, YANG X, et al.Research progress of mulberry active substances in Chinese medicine[J].Journal of Chinese Medicinal Materials, 2010, 33(10):1660-1663.
[29] 任学梅. 高产风味酶非酿酒酵母筛选、鉴定及其在葡萄酒增香酿造中的应用[D].兰州:甘肃农业大学, 2022.
REN X M.Screening and identification of non-Saccharomyces yeast with high yield flavor enzyme and application in wine aroma enhancement brewing[D].Lanzhou:Gansu Agricultural University, 2022.
[30] BENUCCI I, CERRETI M, LIBURDI K, et al.Pre-fermentative cold maceration in presence of non-Saccharomyces strains:Evolution of chromatic characteristics of Sangiovese red wine elaborated by sequential inoculation[J].Food Research International, 2018, 107:257-266.
[31] MARTINS I M, ROBERTO B S, BLUMBERG J B, et al.Enzymatic biotransformation of polyphenolics increases antioxidant activity of red and white grape pomace[J].Food Research International, 2019, 89(Pt 1):533-539.
[32] ELHALIS H, COX J, FRANK D, et al.Microbiological and biochemical performances of six yeast species as potential starter cultures for wet fermentation of coffee beans[J].LWT, 2021, 137:110430.
[33] 李世琦. 猕猴桃酒增香型非酿酒酵母筛选及混菌发酵特性研究[D].杨凌:西北农林科技大学, 2022.
LI S Q.Studies on the screening of non-Saccharomyces cerevisiae and mixed fermentation characteristics in kiwi wine[D].Yangling:Northwest A&F University, 2022.
[34] XU A H, XIAO Y W, HE Z Y, et al.Use of non-Saccharomyces yeast co-fermentation with Saccharomyces cerevisiae to improve the polyphenol and volatile aroma compound contents in Nanfeng tangerine wines[J].Journal of Fungi, 2022, 8(2):128.
[35] 张香, 秦丹, 曾璐, 等.发酵型果酒中甲醇和杂醇油的研究进展[J].中国酿造, 2020, 39(8):17-21.
ZHANG X, QIN D, ZENG L, et al.Research progress on methanol and fusel oil in fermented fruit wine[J].China Brewing, 2020, 39(8):17-21.
[36] LIU L, ZHAO P T, HU C Y, et al.Screening low-methanol and high-aroma produced yeasts for cider fermentation by transcriptive characterization[J].Frontiers in Microbiology, 2022, 13:1042613.
[37] 邹波, 徐玉娟, 肖更生, 等.不同酿酒酵母对骏枣果酒发酵特性的影响[J].食品科学技术学报, 2019, 37(2):63-69.
ZOU B, XU Y J, XIAO G S, et al.Effect of different Saccharomyces cerevisiae on Jun-Jujube wine fermentation characteristics[J].Journal of Food Science and Technology, 2019, 37(2):63-69.
[38] RAPP A, MANDERY H.New progress in wine and wine research[J].Experientia, 1987(42):873-884.
[39] 曲冠颐, 唐洁, 姜健, 等.小曲清香型白酒发酵过程微生物菌群合成高级醇代谢特征[J].食品与发酵工业, 2021, 47(11):32-37.
QU G Y, TANG J, JIANG J, et al.Metabolism characteristics of higher alcohols synthesized by microbiota in the fermentation process of light aroma type Baijiu started by Xiaoqu[J].Food and Fermentation Industries, 2021, 47(11):32-37.