母乳低聚糖(human milk oligosaccharides, HMOs)是母乳中含量仅次于乳糖及脂质的一类低聚糖,不同于经典的线性链的低聚半乳糖(galactooligosaccharides, GOS)和低聚果糖(fructooligosaccharides, FOS),HMOs的支链结构更复杂、种类也更丰富[1]。诸多研究表明,HMOs具有作为益生元调节肠道菌群、预防病原体黏附肠道、调节免疫、抗病毒、预防坏死性小肠结肠炎、促进大脑发育等的作用[2-5]。目前,已经确认结构的HMOs超过200种[6],而2′-岩藻糖基乳糖(2′-fucosyllactose, 2′-FL)和乳糖-N-新四糖(lactose-N-neotetraose, LNnT)是母乳中含量丰度非常高的2种。在婴幼儿喂养研究上,一些奶粉中添加2′-FL和LNnT或更多种的HMOs的临床研究显示,与母乳、普通配方奶粉喂养相比,含2′-FL和LNnT喂养的婴幼儿体内肠道菌群种类与母乳喂养的婴儿一致[7-9],持续喂养后更是观察到粪便中的微生物双歧杆菌数量上升而病原菌种类减少,而普通配方奶粉喂养的婴幼儿患病率增加,并呈现显著性差异[10-12]。可见2′-FL和LNnT在婴幼儿配方乳粉行业具有广阔的应用前景。2016年后,部分高纯单体HMOs分子如2′-FL和LNnT逐步实现了商业化模拟,在国外,2019年德国巴斯夫公司推出的PREBILAC产品是首款2′-FL婴幼儿营养品产品[13-14],当前,我国不少乳企已在相关产品的研发上迅速跟进,故准确测定婴幼儿配方乳粉中2′-FL和LNnT的含量对相关产品的研发和质量控制具有积极意义。
对于2′-FL和LNnT的检测,主要检测方法有HPLC[15]、高效阴离子交换色谱法(high-performance anion-exchange chromatography, HPAEC)[16-17]以及LC-MS/MS[18]。2′-FL是乳糖残基与岩藻糖通过α-1,2糖苷键延伸成岩藻糖基化寡糖,分子结构中无共轭双键,故2′-FL紫外吸收能力弱、荧光性差,用荧光或紫外检测器检测时需要进行衍生,而衍生可能产生异构体、且多数衍生剂存在一定毒害性[19-20]。LNnT则是乳糖残基与N-乙酰氨基乳糖通过β-1,3糖苷键连接成的四糖,分子结构中有N-乙酰葡萄糖胺,存在共轭双键。故对于HPLC法使用荧光或紫外检测器同时检测2′-FL和LNnT时往往较难兼顾。通用型检测器-示差检测器(refractive index detector, RID)也是HPLC常用检测器,但对于基质复杂的婴幼儿配方乳粉而言,其灵敏度较差、抗干扰能力弱,故不建议采用。此外,糖类测定研究中应用广泛的HPAEC常搭配脉冲电化学检测器(pulsed electrochemical detector, PED)使用,其利用不同相对分子质量的低聚糖之间羟基解离度的细微差异对这些化合物进行精确分离[21],具有灵敏度高、线性范围宽等特点,但HPAEC-PED也存在淋洗时间长、定性能力较差、对同分异构体难分离的缺点。故为了克服这些缺点,选择具有灵敏度高、抗干扰能力强和样品定性不依赖保留时间特点的LC-MS/MS法,则是大多数难检测的化合物的方法开发选择,但糖类化合物在离子源脱溶剂过程中往往容易碳化,易导致母离子响应低和稳定性差,这也是LC-MS/MS法建立过程不容忽视的难点。相较于现有的一些LC-MS/MS法,本次研究对象选择为婴幼儿配方乳粉,而非常见文献报道的液态乳、母乳,同时本次研究也对化合物加合离子的选择、正负离子模式的对比以及洗脱条件、线性范围的优化等进行了细致全面的考察和论述,最后用方法学对所建立方法进行了验证。从方法实际应用的角度出发,建立可行的方法同时测定婴幼儿配方乳粉中2′-FL和LNnT的LC-MS/MS方法,以期为婴幼儿配方乳粉中2′-FL和LNnT含量的检测提供参考。
试剂:乙腈、甲酸铵、甲酸(MS级),德国CNW公司;亚铁氰化钾(分析纯),国药试剂;乙酸锌、氢氧化钠(分析纯),天津市科密欧。
标准品:2′-FL(CAS:41263-94-9,纯度99.3%),中国计量科学研究院;LNnT(CAS:13007-32-4,纯度89.5%),中国计量科学研究院;婴幼儿配方奶粉(市售)。
Thermo Endura超高效液相色谱-串联质谱仪(ESI源),美国Thermo Fisher公司;Milli-Q超纯水仪,美国Millipore公司;ME204E电子天平,梅特勒托利多公司;KQ-500DE超声波恒温水浴振荡器,昆山市超声仪器有限公司;ACQUITY UPLC BEH Amide(1.7 μm,2.1 mm×100 mm),美国Waters公司;0.22 μm聚醚砜水相滤膜、2.5 mL聚丙烯注射器,上海安谱公司;聚乙烯巴斯德塑料吸管(3 mL,160 mm),德国CNW公司。
1.3.1 色谱条件
流动相:A:10 mmol/L甲酸铵水溶液(含0.1%甲酸,体积分数);B:乙腈;流速0.6 mL/min,进样量10 μL;梯度洗脱程序见表1。
表1 梯度洗脱程序
Table 1 Gradient elution procedure
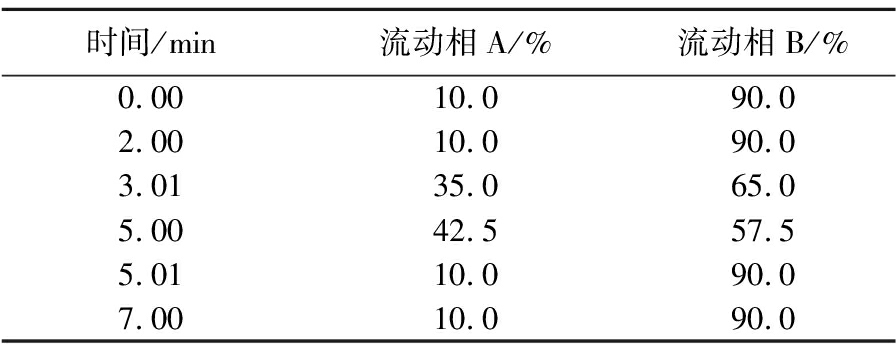
时间/min流动相A/%流动相B/%0.0010.090.02.0010.090.03.0135.065.05.0042.557.55.0110.090.07.0010.090.0
1.3.2 质谱条件
离子源:ESI源;鞘气:氮气(25 Arb);辅助气:氮气(10 Arb);吹扫气:氮气(0 Arb);碰撞气:氩气(1.5 mtor);喷雾电压5 000 V;脱溶剂温度250 ℃;离子传输管温度250 ℃;扫描模式为反应检测扫描模式;驻留时间70 ms。
标准储备溶液:2′-FL、LNnT质量浓度均分别为20、10 mg/mL,均用超纯水配制。
标准混合中间液-A:2′-FL、LNnT质量浓度分别为2、1 μg/mL,用50%乙腈水溶液配制;标准混合中间液-B:2′-FL、LNnT质量浓度分别为200、100 ng/mL,用50%乙腈水溶液配制。
工作溶液:分别取标准混合中间液-B体积0.25、0.5、1.0、2.5 mL、取标准混合中间液-A体积0.5、0.75 mL于10 mL容量瓶中,并用50%乙腈水溶液定容,配成2′-FL质量浓度为5.0、10.0、20.0、50.0、100.0、150.0 ng/mL和LNnT质量浓度为2.5、5.0、10.0、25.0、50.0、75.0 ng/mL的标准工作曲线。
准确称取2 g(精确至0.001 g)试样于烧杯,用50 mL不超过70 ℃的去离子水充分溶解并转移到100 mL容量瓶,冷却至室温后用水定容,取定容后的样液1 mL于100 mL容量瓶中,并加入沉淀剂I(亚铁氰化钾溶液:1.50 g/L)溶液1 mL,摇匀,再加入沉淀剂Ⅱ(乙酸锌溶液:3.00 g/L)溶液1 mL,摇匀后用纯水定容,静置20 min后滤纸过滤,取滤液过0.22 μm聚醚砜水相针式滤器净化,取净化后的样液用50%乙腈水溶液稀释适当倍数(一般为20~30倍)至进样瓶中,待测。
对于糖类的色谱分离,流动相采用水和乙腈进行梯度洗脱能够很好地平衡分析物的溶解性,保证各化合物有合适的分离度和较好的峰形,根据液质正负离子电离模式差异,水相采用10 mmol/L甲酸铵水溶液,含0.1%甲酸(体积分数)或含0.1%氨水(体积分数),有机相为乙腈。水相中加入一定量的甲酸或氨水不仅可与甲酸铵盐形成缓冲体系,还可以促进目标化合物的电离,起到提高离子化效率的作用。
2′-FL、LNnT是聚合长度较短(聚合单糖数分别为3、4)的中性低聚糖,化学结构中都含有强极性的羟基基团,亲水性强、极性大,传统的反向色谱柱难以将其保留,ACQUITY BEH Amide色谱柱担体为亚乙基桥杂化颗粒,键合相为三键键合的酰胺基,该填料稳定、亲水性好、pH适用范围广(pH 2~11),可保留极性极强的化合物,适用于碳水化合物和糖类的分离。故采用Amide柱来同时分离2′-FL、LNnT。
2.3.1 正、负离子模式参数优化
质谱参数优化采用蠕动泵注射质量浓度为1 μg/mL 的标准溶液。电喷雾正离子模式下,流动相水相采用10 mmol/L甲酸铵水溶液(含0.1%甲酸,体积分数),这可为2′-FL、LNnT离子化过程中提供NH4+和H+,以便于形成[M+NH4+]峰或[M+H+]峰,此外,流动相由于过滤、脱气、瓶迁移等因素一般不可避免地会引入一定水平的Na+,故在母离子扫描过程中,发现2′-FL、LNnT也有较强的[M+Na+]峰。负离子模式下,流动相水相采用10 mmol/L甲酸铵水溶液(含0.1%氨水,体积分数),这可为2′-FL、LNnT离子化过程中提供OH-,有助于形成[M-H+]峰。通过反应检测扫描模式优化各个碎片离子的去簇电压和碰撞电压。具体的化合物碎片二级质谱参数见表2。
表2 正、负离子模式下2′-FL、LNnT的质谱参数
Table 2 Mass spectrometry parameters of 2′-FL and LNnT in positive and negative ion modes
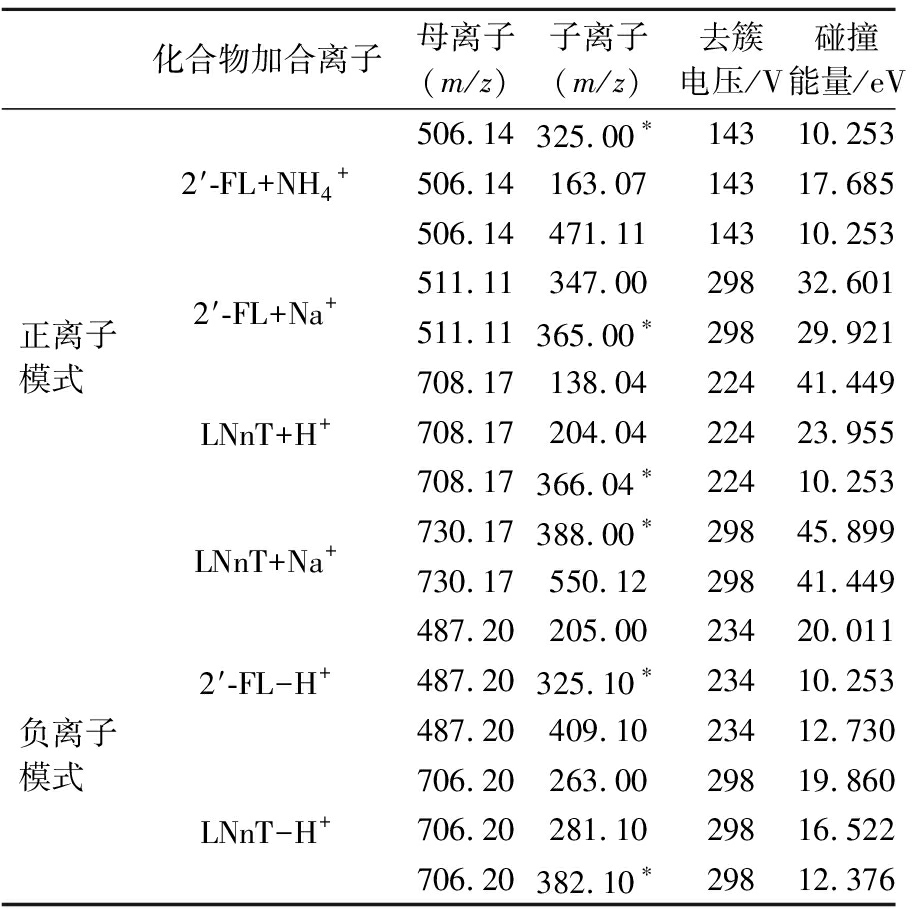
化合物加合离子母离子(m/z)子离子(m/z)去簇电压/V碰撞能量/eV正离子模式 506.14 325.00∗14310.253 2′-FL+NH4+506.14 163.07 14317.685 506.14 471.11 14310.253 2′-FL+Na+511.11 347.00 29832.601 511.11 365.00∗29829.921 708.17 138.04 22441.449 LNnT+H+708.17 204.04 22423.955 708.17 366.04∗22410.253 LNnT+Na+730.17 388.00∗29845.899 730.17 550.12 29841.449负离子模式 487.20 205.00 23420.0112′-FL-H+487.20 325.10∗23410.253487.20 409.10 23412.730706.20 263.00 29819.860LNnT-H+706.20 281.10 29816.522706.20 382.10∗29812.376
注:*为定量离子。
2.3.2 正、负离子模式对比选择
正离子模式下2′-FL响应较大的加合离子峰有[M+NH4+]峰和[M+Na+]峰,LNnT响应较大的加合离子峰有[M+H+]峰和[M+Na+]峰,对质量浓度为100 ng/mL的标准溶液进行连续检测(n=7),考察各加合离子的响应和稳定性(精密度)。对于2′-FL,稳定性上加合离子[M+NH4+]峰和[M+Na+]峰的相对标准偏差(relative standard deviation, RSD)分别为3.5%、2.2%,经方差同质性检验,这2个加合离子间响应的精密度没有显著性差异(F=3.19<F0.05(6,6)=5.82),但由图1知,加合离子[M+NH4+]峰的质谱响应较[M+Na+]峰稍大,故选择[M+NH4+]作为母离子。对于LNnT,[M+H+]峰和[M+Na+]峰的RSD分别为2.5%、4.3%,加合离子[M+H+]峰的质谱响应显著较[M+Na+]峰大太多,故选择[M+H+]作为LNnT的母离子。负离子模式下,2′-FL、LNnT均选择[M-H+]作为母离子峰。确定质谱参数后,建立正、负离子模式下的仪器方法,在固定色谱柱、洗脱条件、进样量等条件一致的情况下,通过对同一质量浓度(100 ng/mL)的2′-FL、LNnT标准溶液进行分析。由图2可知,正离子模式下2′-FL、LNnT的响应均要大于负离子模式,故选择正离子模式进行分析。
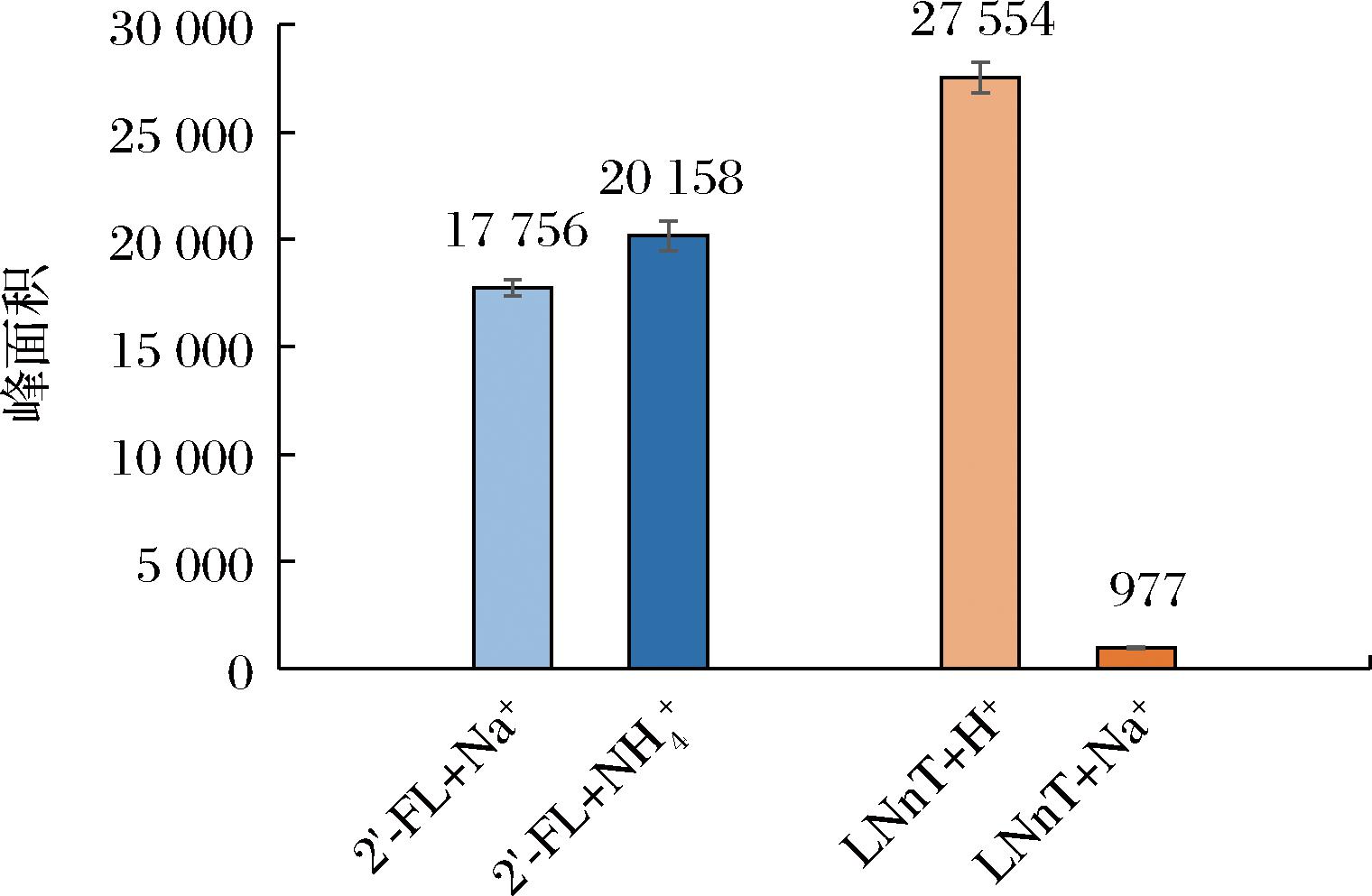
图1 正离子模式下2′-FL和LNnT不同加合离子的响应
Fig.1 Response of different adducted ions of 2′-FL and LNnT in positive ion mode
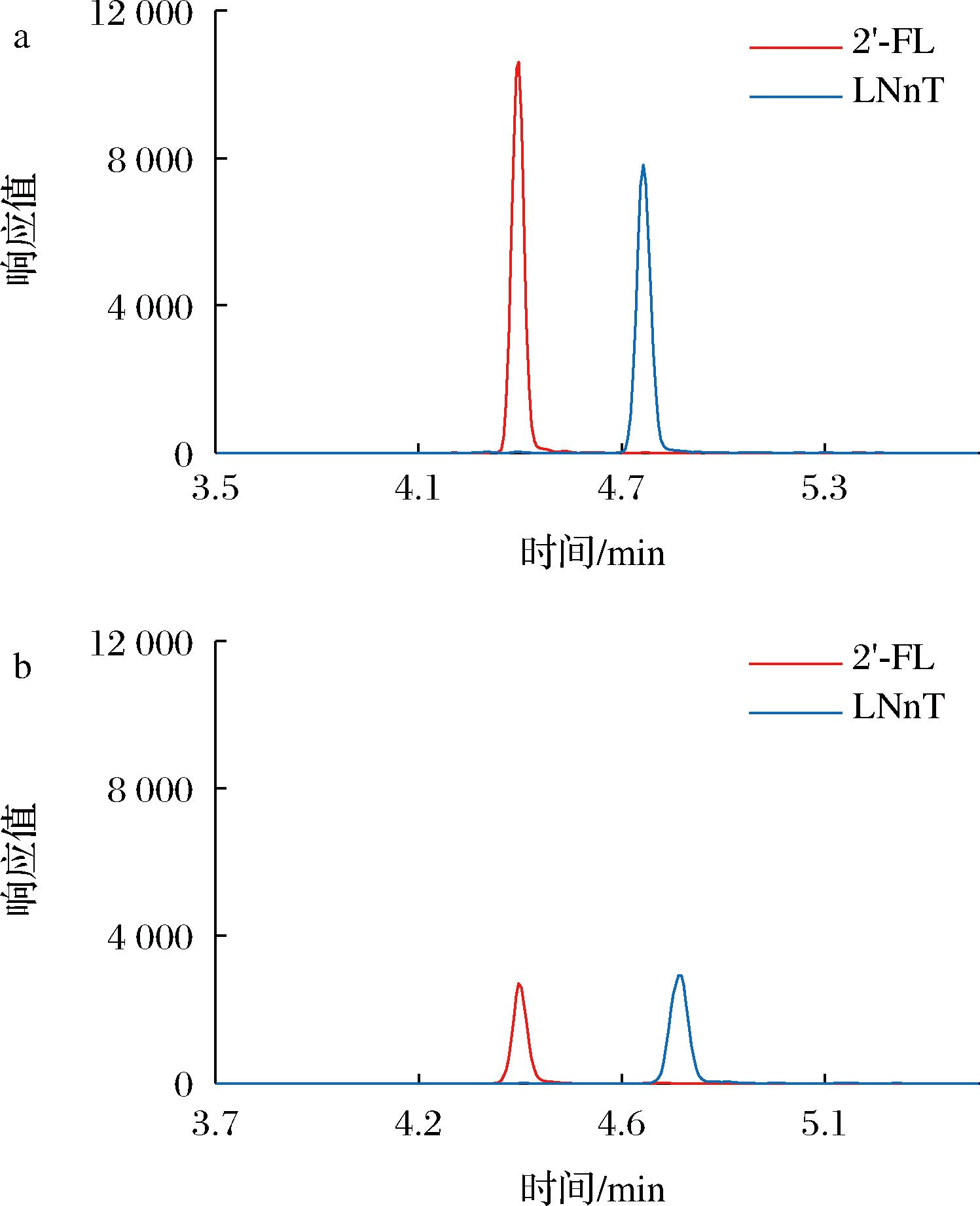
a-正离子模式;b-负离子模式
图2 正、负离子模式下2′-FL、LNnT的分离和响应
Fig.2 Separation and response of 2′-FL and LNnT in positive and negative ion modes
梯度条件的设置既需要考虑提高分离效率也要保障良好的峰形。本研究从“过程水相比例的增加”和“初始水相比例的增加”两方面变化逐步进行考察。过程水相比例的增加考察中(梯度1~梯度4),由图3-a~图3-c可知,在0~5 min洗脱过程中增加水相比例2′-FL、LNnT出峰均有提前,但是效果甚微,且峰形上差别较小。在初始水相比例的增加考察中(梯度5~梯度8),由图3-d~图3-f可知,在初始水相比例从6%增加至10%时,2′-FL、LNnT出峰时间提前很小,而从10%增加至30%(梯度6~梯度8)过程中,2′-FL、LNnT出峰时间提前明显,但梯度7和梯度8条件下2′-FL、LNnT均出现了分叉峰,相较之下梯度条件6较合适,且响应也最大,同时也说明,要加快洗脱提高分离效率通过加大梯度条件中水相比例的措施效果有限。
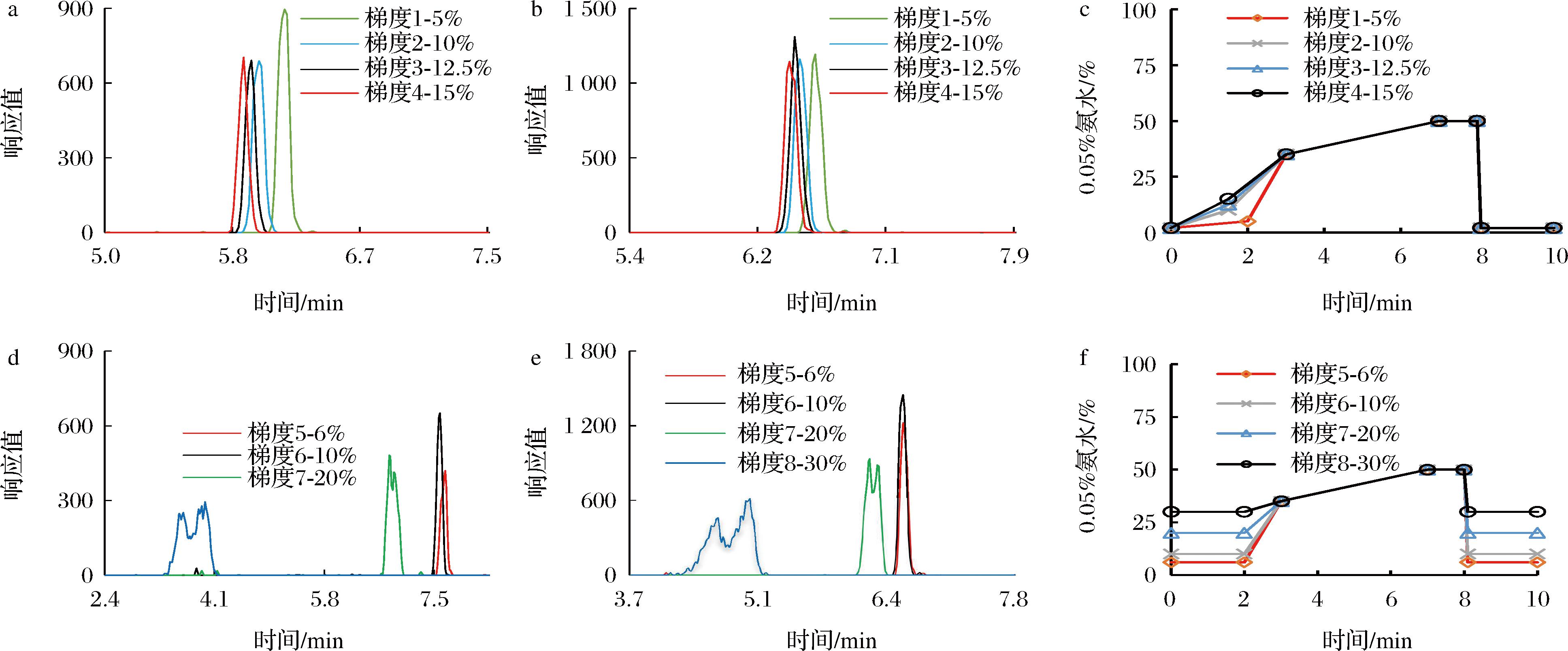
a-过程水相比例增加对2′-FL分离的影响;b-过程水相比例增加对LNnT分离的影响;c-过程水相比例增加洗脱条件;d-初始水相比例增加对2′-FL分离的影响;e-初始水相比例增加对LNnT分离的影响;f-初始水相比例增加洗脱条件
图3 梯度洗脱条件对分离的影响
Fig.3 Effect of gradient elution conditions on separation
对于流速的考察,通过预设4个不同0.3~0.6 mL/min的流速进行,由图4可知,相较于0.3 mL/min的初始流速,0.6 mL/min流速下2′-FL出峰时间提前1.7 min、LNnT出峰时间提前1.85 min,且2′-FL、LNnT的响应也较好,考虑化合物最晚出峰时间和系统平衡所需的最短时间,在流速0.6 mL/min和梯度条件6的基础上进一步优化,最终得到了较佳的分离条件(表1)。
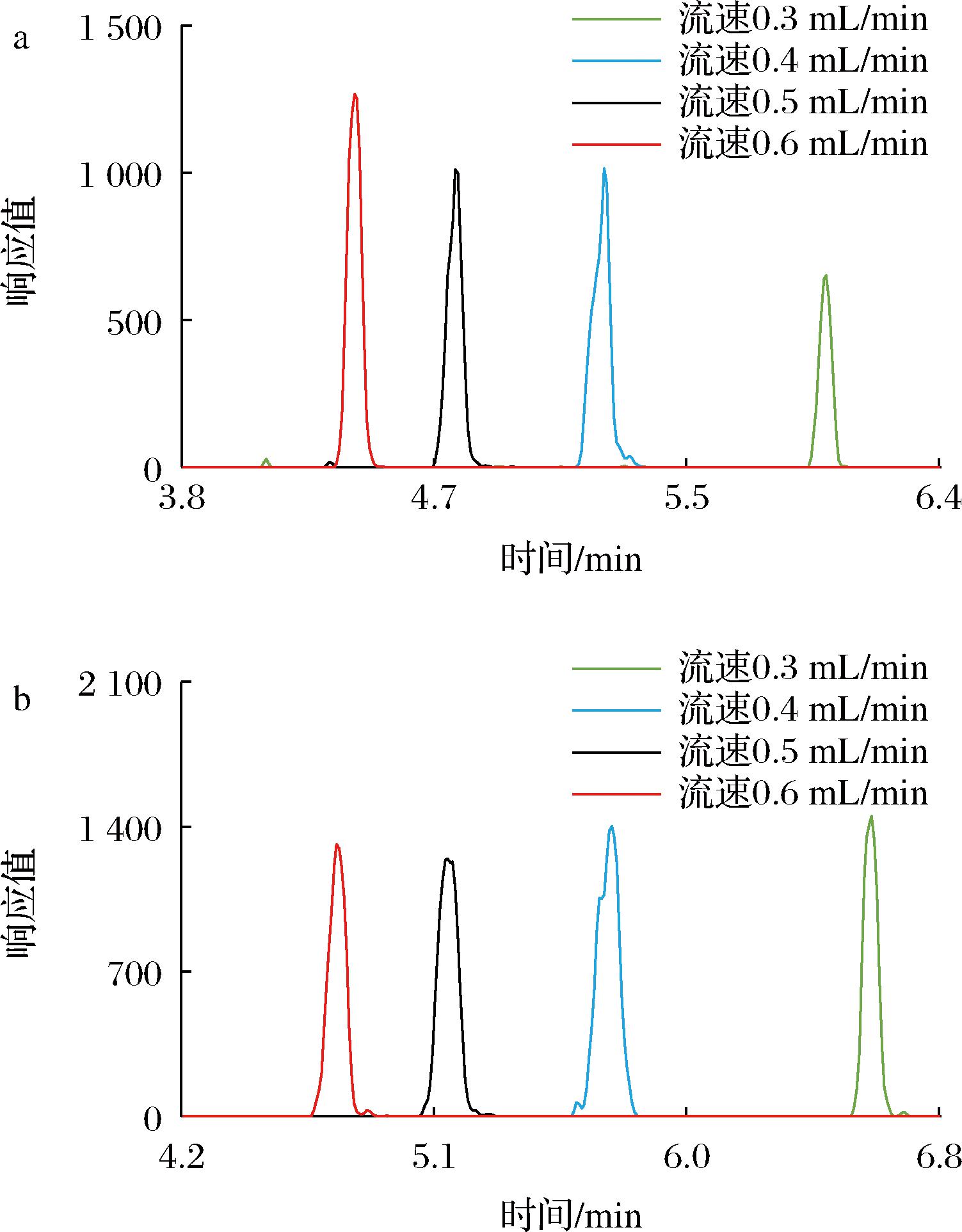
a-流速增加对2′-FL分离的影响;b-流速增加对LNnT分离的影响
图4 流速增加对分离的影响
Fig.4 Effect of increased flow rate on separation
2.5.1 样液基质和进样体积的影响
在色谱柱载量与响应的研究中发现不同样液基质和进样体积会导致2′-FL和LNnT出现分岔峰或肩峰,且色谱柱容易过载、化合物响应变化大。如图5-a和图5-b所示,对于进样纯水基质的样液,在进样量6 μL开始出现不对称肩峰,在10 μL已经出现明显的分叉峰,故纯水基质中进样量不能超过5 μL,考虑实际样品基质存在和色谱柱载量预留下进样量应小于5 μL。对于进样90%乙腈水基质的样液,如图5-c和图5-d所示,在进样量4 μL增加至10 μL过程中,2′-FL和LNnT响应(峰高)并未线性增加,且相对于纯水基质2′-FL和LNnT响应大幅下降,LNnT响应甚至接近基线噪音水平,90%乙腈水基质虽然与流动相梯度条件的初始比例一致,但此基质中乙腈占比过大可能导致了LNnT溶解性降低、离子化效率变差。由此可见,2′-FL和LNnT可能存在溶剂效应,故需要在最终样液稀释过程中选择合适比例的稀释溶剂消除该影响,并确定合适的进样量。
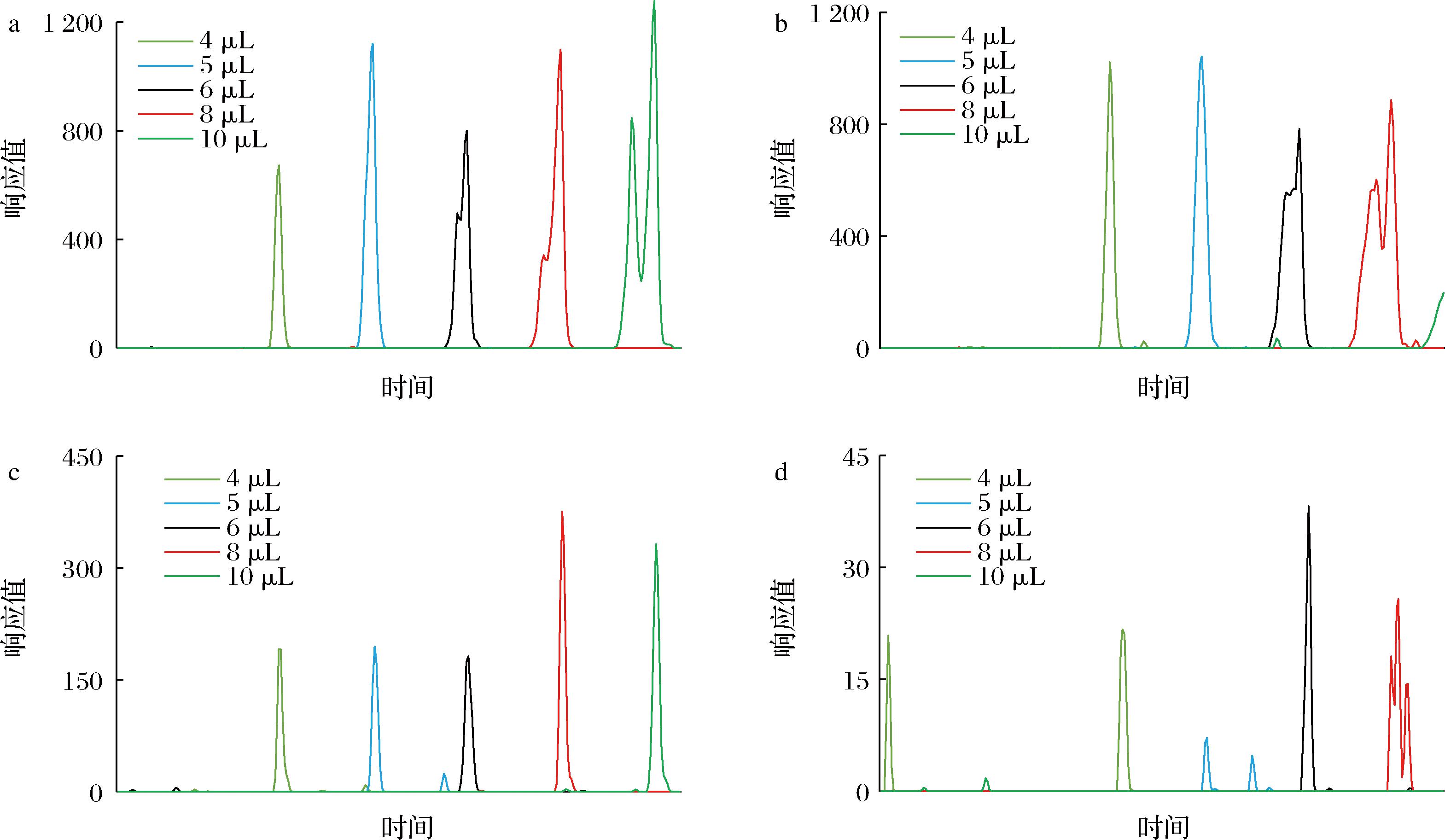
a-纯水基质中不同进样体积的溶剂效应—2′-FL;b-纯水基质中不同进样体积的溶剂效应—LNnT;c-乙腈基质中不同进样体积的溶剂效应—2′-FL;d-乙腈基质中不同进样体积的溶剂效应—LNnT
图5 不同基质中进样体积与2′-FL、LNnT的溶剂效应的关系
Fig.5 Relationship between injection volume and solvent effect of 2′-FL and LNnT in different matrices
2.5.2 溶剂效应的消除与进样体积的确定
在10 μL进样体积下用不同体积分数的乙腈/甲酸铵水溶液(10 mmol/L)将水解定容后的样液统一稀释20倍,以考察不同稀释溶剂的溶剂效应。如图6-a和图6-b所示,在乙腈体积分数为0%、10%时,2′-FL和LNnT的峰均存在分叉,当乙腈体积分数增加到30%时,分叉峰均消失且响应增加,而乙腈体积分数增加到50%时峰形更加对称、响应也达到最高,乙腈体积分数增加到70%时虽然峰形也较好但是响应开始下降,可见2′-FL和LNnT选择50%乙腈甲酸铵水溶液作为稀释溶液最佳。

a-不同稀释溶剂对2′-FL溶剂效应的影响;b-不同稀释溶剂对LNnT溶剂效应的影响;c-不同进样量下2′-FL的响应和保留;d-不同进样量下LNnT的响应和保留
图6 不同稀释溶剂对溶剂效应的影响
Fig.6 Effect of different diluted solvents on solvent effects
确定稀释溶剂后对进样量进行考察,由图6-c和图6-d可知,在50%乙腈甲酸铵水溶液作稀释溶剂下进样50 μL体积时色谱峰峰型依旧良好,可见此时溶剂效应影响已消除,而考虑色谱柱载量预留、色谱系统维护保养等因素,选择10 μL进样体积已满足要求。
合适的工作曲线范围设置是准确定量的前提。如表3所示,本次研究对2′-FL和LNnT分别设置了9个曲线点共计4条工作曲线以考察质量浓度与峰面积之间的关系,结果见图7,对于2′-FL,在质量浓度49.4~988 ng/mL(曲线范围1)变化至4.94~198 ng/mL(曲线范围4)过程中,最小二乘法拟合出的斜率呈增加趋势,截距呈减小趋势,这说明至少在线性范围1~3内工作曲线上限的质量浓度设置过高,而曲线范围4的质量浓度设置是否合理需进一步考察;而对于LNnT,在质量浓度24.1~482 ng/mL(曲线范围1)变化至2.41~96.4 ng/mL(曲线范围4)过程中,斜率有所增加,但线性范围3和线性范围4的斜率相差极小,这说明LNnT工作曲线上限质量浓度的设置可以达到线性范围3的上限点。最后,根据样品中2′-FL和LNnT的含量水平(实际样品中2′-FL的含量水平较LNnT高),在曲线范围4的基础上增加了更多的点进行考察,最终确定2′-FL和LNnT的线性范围分别为5.0~150.0 ng/mL和2.5~75.0 ng/mL,此时线性方程斜率、截距稳定,相关系数均>0.999,工作曲线见图8。
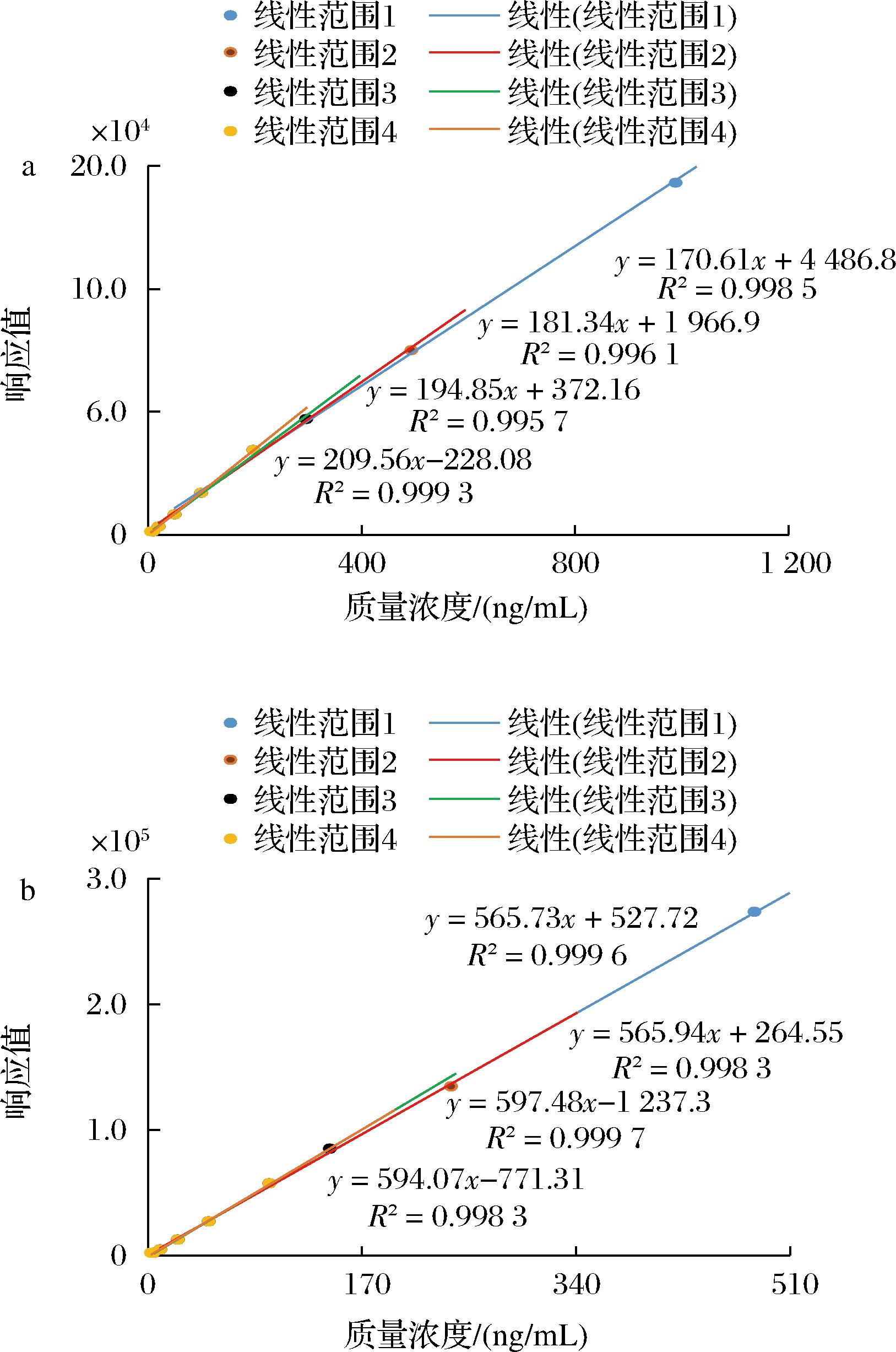
a-线性范围对2′-FL的影响;b-线性范围对LNnT的影响
图7 线性范围对工作曲线斜率、相关系数的影响
Fig.7 The influence of linear range on the slope and correlation coefficient of the working curve
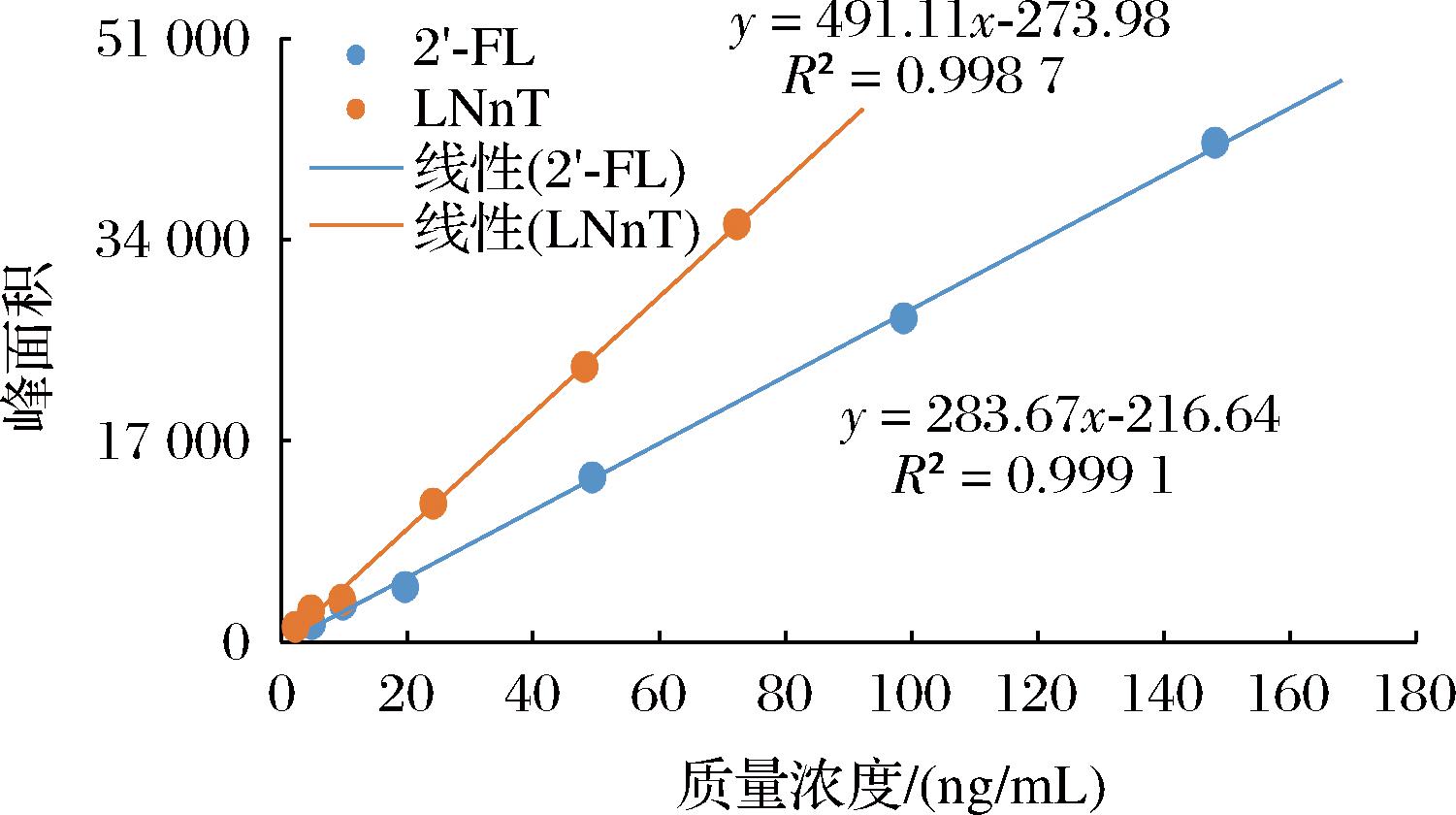
图8 2′-FL和LNnT最终的线性范围以及线性方程
Fig.8 The final linear range of 2′-FL and LNnT and the linear equation
表3 线性范围考察
Table 3 Linear range investigation

曲线点LNnT2′-FL质量浓度/(μg/mL)线性范围1/(AU·min)线性范围2/(AU·min)线性范围3/(AU·min)线性范围4/(AU·min)质量浓度/(μg/mL)线性范围1/(AU·min)线性范围2/(AU·min)线性范围3/(AU·min)线性范围4/(AU·min)STD14.94 ///1 5322.41 ///2 089STD29.88 //1 5761 5764.82 //1 9921 992STD319.8 /3 8453 8453 8459.64 /4 7624 7624 762STD449.4 9 8019 8019 8019 80124.1 12 54812 54812 54812 548STD598.8 20 17320 17320 17320 17348.2 27 09727 09727 09727 097STD6198 41 41241 41241 41241 41296.4 57 10157 10157 10157 101STD7296 56 33056 33056 330/145 84 86384 86384 863/STD8494 89 85089 850//241 134 301134 301//STD9988 171 741///482 273 395///
采用标准曲线比较法对基质效应进行评估。即分别配制相同浓度的婴幼儿配方乳粉的空白基质工作曲线和溶剂工作曲线,在同一定量方法下通过比较2条曲线斜率k的比值来评价基质效应(matrix effect, ME)大小,ME/%=k基质/k溶剂×100,并且当ME>100%、ME<100%分别认定为基质增强和基质抑制,且ME越大或越小时增强或抑制的效应越大,通常当ME为95%~105%时可认为无基质效应。由图9可知,外标法下,2′-FL和LNnT的基质效应分别为97.9%、99.7%,可见比值均接近100%,均可认为无基质效应,故采用溶剂标准曲线可以满足定量要求。
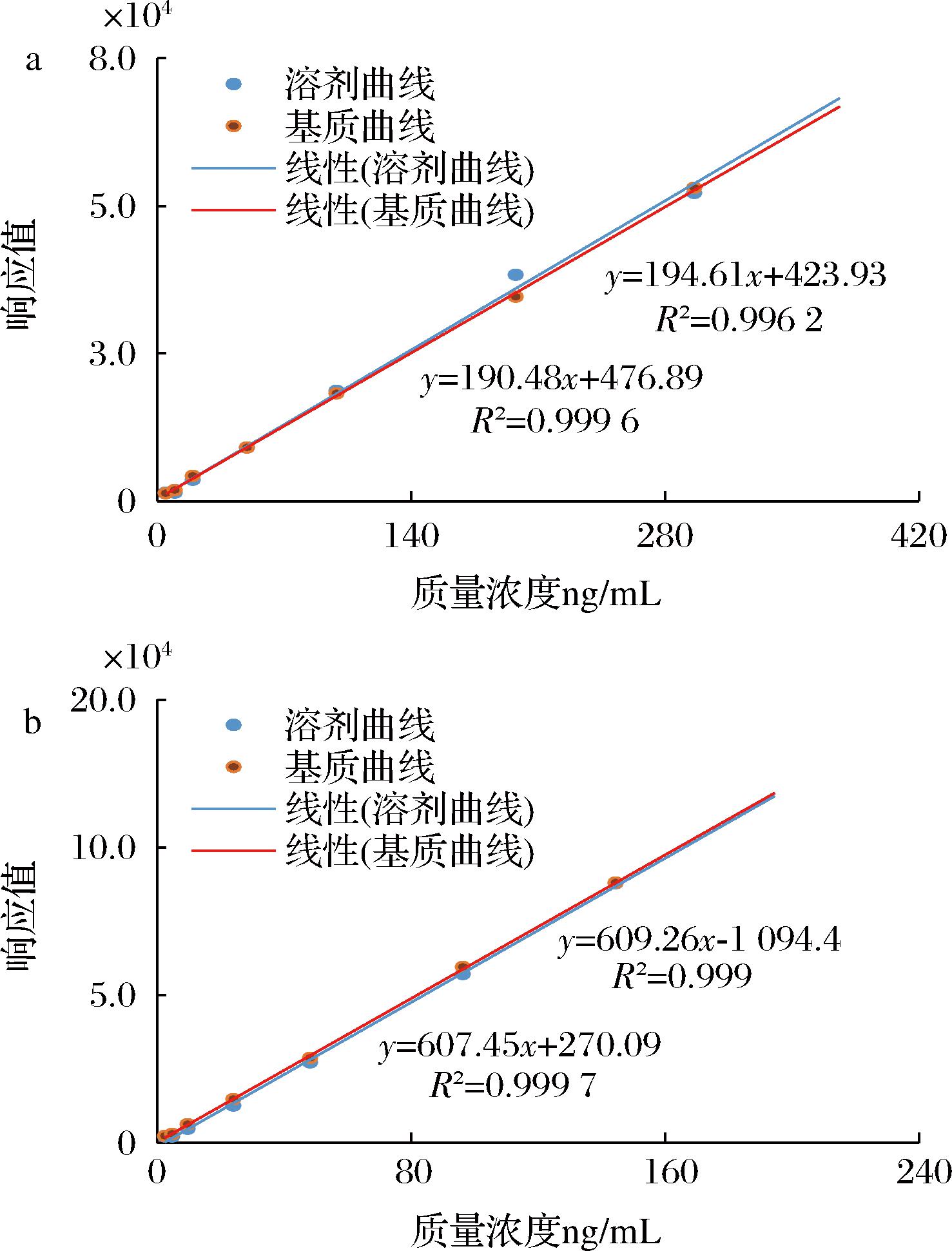
a-2′-FL的基质效应;b-LNnT的基质效应
图9 基质效应
Fig.9 Effects of matrix effects
仪器精密度:对2′-FL和LNnT质量浓度分别为80、40 ng/mL的样液进行连续测定(n=10),结果表明,2′-FL的均值为(81.1±1.93) ng/mL,RSD为2.38%;LNnT的均值为(40.0±0.734) ng/mL,RSD为1.84%。
方法精密度:对一婴幼儿配方乳粉样品进行平行测定(n=7),结果表明,2′-FL均值为(0.845±0.021 7) g/100 g,RSD为2.56%;LNnT均值为(0.398±0.010 1) g/100 g,RSD为2.53%。根据GB/T 27417—2017《合格评定 化学分析方法确认和验证指南》的要求精密度需RSD≤2.7%,由以上数据知均满足标准要求。
在空白基质样品中进行低、中、高三水平的2′-FL、LNnT加标(n=3)以验证方法的正确性。由表4可知,2′-FL平均回收率为102.9%,LNnT平均回收率为101.8%,且2′-FL、LNnT各重复水平的回收率均为95%~105%,均符合GB/T 27417—2017《合格评定 化学分析方法确认和验证指南》要求,说明方法正确性均良好。
表4 2′-FL、LNnT样品加标结果
Table 4 2′-FL、LNnT sample spike results

序号2′-FLLNnT加标量/mg测定质量浓度/(ng/mL)含量/(g/100 g)回收率/%加标量/mg测定质量浓度/(ng/mL)含量/(g/100 g)回收率/%本底/0.767 0 0.011 5 //0.707 10.010 6 /134.907 60.510 0 103.717.287 7 0.247 7 103.229.879 534.593 10.505 3 102.74.819 017.403 8 0.249 4 103.9334.351 30.501 7 102.016.474 4 0.235 5 98.2469.519 61.027 1 104.432.896 4 0.480 9 100.2519.759 069.341 31.024 4 104.19.638 032.869 1 0.480 5 100.1669.669 81.029 3 104.634.147 7 0.499 6 104.17101.621 91.506 6 102.150.240 6 0.740 0 102.8829.638 598.721 51.463 3 99.114.457 050.018 0 0.736 6 102.39102.737 01.523 3 103.249.547 3 0.729 6 101.3均值///102.9///101.8
采用信噪比法评估检出限和定量限。当称样量为2 g时,以3倍信噪比定为检出限、10倍信噪比定为定量限,通过对2′-FL、LNnT样品的不断稀释,在低含量水平(0.3 ng/mL)下上机分析得到信噪比数据,经计算得到2′-FL、LNnT定量限分别为60、45 mg/kg,检出限分别为20、15 mg/kg。
由于本实验室也有探索HPAEC-PED法的建立,故在液质联用法建立后采用同一婴幼儿配方奶粉样品与HPAEC-PED法的比较,由表5可知,总体上2种方法测定结果均较为接近,但相较之下HPAEC-PED法测定结果偏高,特别对于2′-FL,原因是否是离子色谱分离不完全或其他原因导致还需进一步探究。
表5 LC-MS/MS法与HPAEC-PED法之间的比较(n=3)
Table 5 Comparison between LC-MS/MS and HPAEC-PED(n=3)

2′-FLLNnTHPAEC-PED法/(g/100 g)LC-MS/MS法/(g/100 g)相对偏差/%HPAEC-PED法/(g/100 g)LC-MS/MS法/(g/100 g)相对偏差/%1.095±0.0170.965±0.0216.30.252±0.005 30.236±0.004 83.3
本研究建立了婴幼儿配方乳粉中2′-FL和LNnT同时测定的UPLC-MS/MS方法,建立过程对质谱、色谱条件均进行了优化,同时考察了溶剂效应、线性范围、基质效应和方法验证各项参数。
质谱条件优化过程中,对正离子模式下2′-FL和LNnT的不同的加合离子的响应和稳定性进行了分析比较,同时也对比了常规情形下检测糖类采用的负离子模式,结果发现,正离子模式下2′-FL的加合离子峰[M+NH4+]和LNnT的加合离子峰[M+H+]反而响应更好,且流动相水相采用10 mmol/L甲酸铵水溶液(含0.1%甲酸,体积分数)刚好可为2′-FL、LNnT离子化过程中提供丰富的NH4+和H+。色谱条件优化过程中,着重对梯度洗脱条件、流速进行了优化,使得梯度条件能在8 min内完成洗脱,提高了分离效率并保障良好的峰形。溶剂效应考察中,发现2′-FL和LNnT存在严重的溶剂效应,即不同样液基质和进样体积会导致2′-FL和LNnT出现分岔峰或肩峰,且色谱柱容易过载、化合物响应较低,但通过试验发现在稀释20倍的情形下用50%乙腈甲酸铵水溶液作为净化样液的稀释溶剂可消除影响,此时进样50 μL体积的样液依旧有良好的峰形和响应。线性范围考察过程中,发现2′-FL和LNnT曲线上限点质量浓度设置过高时(≥200 ng/mL)响应受抑制,且2′-FL的线性范围较LNnT窄,故工作曲线的设置应严格控制在线性范围内。基质效应考察发现,2′-FL和LNnT均不存在基质效应,方法验证表明,各项精密度、正确度参数均满足国标要求。
2′-FL和LNnT是糖类化合物,在离子源脱溶剂和离子化过程中碳链容易碳化或断裂,易导致母离子响应降低和稳定性变差,这是液质法建立的难点,故设置相对较低的合适的脱溶剂温度和离子传输管温度,对提高化合物响应有显著帮助,此外,本方法定量方式是外标法,对前处理过程和仪器稳定性要求较高,后续研究中若能找到合适的内标化合物,采用内标法进行校正可大大提高方法的准确性和稳定性,但这也需要进一步研究。
[1] 史玉东, 刘梦瑶, 卢卫红. 母乳低聚糖的结构与功能研究进展[J]. 食品安全质量检测学报, 2020, 11(21):7656-7662.
SHI Y D, LIU M Y, LU W H. Research progress in the structure and functional of human milk oligosaccharides[J]. Journal of Food Safety &Quality, 2020, 11(21):7656-7662.
[2] KUNTZ S, RUDLOFF S, KUNZ C. Oligosaccharides from human milk influence growth-related characteristics of intestinally transformed and non-transformed intestinal cells[J]. The British Journal of Nutrition, 2008, 99(3):462-471.
[3] TARRANT I, FINLAY B B. Human milk oligosaccharides: Potential therapeutic aids for allergic diseases[J]. Trends in Immunology, 2023, 44(8):644-661.
[4] BODE L. Human milk oligosaccharides: Every baby needs a sugar Mama[J]. Glycobiology, 2012, 22(9):1147-1162.
[5] CHEN Q X, YANG L, XIANG F Q, et al. 2′-Fucosyllactose modulates the function of intestinal microbiota to reduce intestinal permeability in mice colonized by feces from healthy infants[J/OL]. Food Science and Human Wellness, 2024. http://kns.cnki.net/kcms/detail/10.1750.TS.20230829.1741.006.html.
[6] ZHANG W Y, WANG T, CHEN X X, et al. Absolute quantification of twelve oligosaccharides in human milk using a targeted mass spectrometry-based approach[J]. Carbohydrate Polymers, 2019, 219:328-333.
[7] VANDENPLAS Y, BERGER B, CARNIELLI V P, et al. Human milk oligosaccharides: 2′-fucosyllactose (2′-FL) and lacto-N-neotetraose (LNnT) in infant formula[J]. Nutrients, 2018, 10(9):1161.
[8] REVERRI E J, DEVITT A A, KAJZER J A, et al. Review of the clinical experiences of feeding infants formula containing the human milk oligosaccharide 2′-fucosyllactose[J]. Nutrients, 2018, 10(10):1346.
[9] LI W S, WANG J X, LIN Y Y, et al. How far is it from infant formula to human milk? A look at the human milk oligosaccharides[J]. Trends in Food Science &Technology, 2021, 118:374-387.
[10] LASEKAN J, CHOE Y, DVORETSKIY S, et al. Growth and gastrointestinal tolerance in healthy term infants fed milk-based infant formula supplemented with five human milk oligosaccharides (HMOs): A randomized multicenter trial[J]. Nutrients, 2022, 14(13):2625.
[11] ZHANG B, LI L Q, LIU F T, et al. Human milk oligosaccharides and infant gut microbiota: Molecular structures, utilization strategies and immune function[J]. Carbohydrate Polymers, 2022, 276:118738.
[12] PUCCIO G, ALLIET P, CAJOZZO C, et al. Effects of infant formula with human milk oligosaccharides on growth and morbidity: A randomized multicenter trial[J]. Journal of Pediatric Gastroenterology and Nutrition, 2017, 64(4):624-631.
[13] 徐铮, 李娜, 陈盈利, 等. 人乳寡糖2′-FL和3-FL的生物制备研究进展[J]. 生物工程学报, 2020, 36(12):2767-2778.
XU Z, LI N, CHEN Y L, et al. Recent advances in the bio-production of human milk oligosaccharides 2′-FL and 3-FL[J]. Chinese Journal of Biotechnology, 2020, 36(12):2767-2778.
[14] 杨宝雨, 赵军英, 乔为仓, 等. 母乳低聚糖的研究进展[J]. 中国食品学报, 2021, 21(8):369-390.
YANG B Y, ZHAO J Y, QIAO W C, et al. Research progress of human milk oligosaccharides[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(8):369-390.
[15] CHRISTENSEN A S, SKOV S H, LENDAL S E, et al. Quantifying the human milk oligosaccharides 2′-fucosyllactose and 3-fucosyllactose in different food applications by high-performance liquid chromatography with refractive index detection[J]. Journal of Food Science, 2020, 85(2):332-339.
[16] AUSTIN S, CUANY D, MICHAUD J, et al. Determination of 2′-fucosyllactose and lacto-N-neotetraose in infant formula[J]. Molecules, 2018, 23(10):2650.
[17] THURL S, MÜLLER-WERNER B, SAWATZKI G. Quantification of individual oligosaccharide compounds from human milk using high-pH anion-exchange chromatography[J]. Analytical Biochemistry, 1996, 235(2):202-206.
[18] TAN J, LEE H H, WONG L, et al. Simultaneous determination of neutral and acidic human milk oligosaccharides (HMOs) by liquid chromatography with tandem mass spectrometry (LC-MS/MS)[J]. Applied Food Research, 2022, 2(2):100153.
[19] BAI W D, FANG X D, ZHAO W H, et al. Determination of oligosaccharides and monosaccharides in Hakka rice wine by precolumn derivation high-performance liquid chromatography[J]. Journal of Food and Drug Analysis, 2015, 23(4):645-651.
[20] AUER F, JARVAS G, GUTTMAN A. Recent advances in the analysis of human milk oligosaccharides by liquid phase separation methods[J]. Journal of Chromatography. B, Analytical Technologies in the Biomedical and Life Sciences, 2021, 1162:122497.
[21] 任向楠, 杨晓光, 杨振宇, 等. 人乳中低聚糖的含量及其常用分析方法的研究进展[J]. 中国食品卫生杂志, 2015, 27(2):200-204.
REN X N, YANG X G, YANG Z Y, et al. Advances in content and main analytical methods of oligosaccharides in human milk[J]. Chinese Journal of Food Hygiene, 2015, 27(2):200-204.