蛋白质是有机体的关键组成部分,生物体的各种生命现象都离不开蛋白质,生物体内遗传信息的表达依照中心法则将DNA中的信息通过RNA传递到蛋白质中。蛋白质翻译的重要元件为64种密码子,其中61种密码子对应了生物体内的20种天然氨基酸。在核糖体内合成多肽后,经糖基化、二硫键的形成等反应进行修饰并最终加工为具有一定空间结构的成熟蛋白质[1]。氨基酸作为蛋白质的基本组成单位,在食品、保健、医疗等方面都有着重要的作用[2]。但生物体内的蛋白质只限于20种天然氨基酸组合而成,随着现代科技日新月异的发展,已经难以满足生命科学、日常生产、医疗等领域的应用需求[3]。扩展用于合成蛋白质的氨基酸种类,以获得具有更多功能的蛋白质十分必要,于是,基于非天然氨基酸的蛋白质合成技术应运而生。
相较于天然氨基酸(natural amino acid,Naa),非天然氨基酸(unnatural amino acid,Uaa)本身有许多诸如荧光特性、光敏特性、金属螯合等独特的性质。Uaa的特异性较强,且对蛋白质原始结构的影响小,同时由于Uaa不同于Naa的结构和侧链基团,其参与到蛋白质的形成过程中可以改变蛋白质的pH、温度等理化性质,为蛋白质带来一些新的功能,因此十分适用于对蛋白质进行修饰和改造[4]。
本文总结了如何通过化学及生物的方法获得Uaa[5],并将目标Uaa掺入蛋白质以赋予蛋白质新的功能和特性。最后进一步列举了掺入Uaa后蛋白质的具体应用,并对非天然蛋白质技术未来的发展前景进行了展望。
1 非天然氨基酸的合成
1.1 化学法
通过化学法合成的Uaa主要为Naa的手性异构体—D型氨基酸,主要分为化学拆分剂拆分法及不对称转化法。
利用化学拆分剂拆分获得Uaa即以外消旋的D、L混合氨基酸为底物,与特定手性化学试剂作用生成2种对映异构体,再主要利用两者物理性质的不同进行分离[6],最后再水解去衍生获得需要的D型氨基酸。例如利用二甲马钱子碱将去消旋的乙酰色氨酸转化为二甲马钱子盐,该混合物中D型盐容易从乙醇中分离,L型盐则会留在母液中[7],利用乙醇分离后再将产物转化为所需D-色氨酸。这种方法是目前最成熟最常用的方法,但该方法拆分线路复杂,需要先进行氨基酸的转变,拆分后再进行氨基酸的去转变,并且拆分剂的选择较为盲目,产品还需要多次重结晶增加对映体的纯度,对工艺结晶条件要求苛刻,拆分效率、纯度和成本都难以达到预期[8]。
不对称转化法是使用特定反应前体作为反应底物,添加手性化学试剂发生选择性反应使产物只产生D型氨基酸,或者直接使用单一手性前体物质为原料通过化学反应直接制备D型氨基酸。例如DANG等[9]提出的以α-酮酸为前体,与手性试剂二氢吲哚衍生物结合,选择性的还原亚氨基产生相应α碳,氢解后得到D型氨基酸。IRIEK等[10]报道的利用D-谷氨酰胺为原料合成D-色氨酸。但这种方法所需的手性前体物质或者手性化学试剂不易获得,且合成过程繁琐、耗能高、产物的手性纯度不高。
Uaa的合成目前主要依赖于化学法,但化学法生产Uaa的过程中存在产率不理想、纯度不高、费用高昂[11],同时容易产生排出有毒气体对环境不友好等缺点。目前,急需开发一种绿色、环保、高效且价格低廉的合成方法。
1.2 生物法
近年来,随着代谢工程、酶工程、生物信息学及合成生物学等的高速发展,研究人员渐渐将合成Uaa的方法转向了反应条件温和、绿色环保同时高效的生物法。通过在微生物中构建Uaa的合成途径,并对其进行改造以及重设计以提高Uaa的产量。
目前已报道的Uaa在生物体中的合成路径如图1所示,代谢工程生物法成功构建的基础是对相关Uaa合成途径的了解,Uaa的获得需要重构细胞体内天然的合成路径,为了提高产量还需要同时通过设计改造途径中的关键酶和关键基因、对反应前体以及关键辅因子进行调控、敲除旁路途径中的竞争性路径等改造策略才可以设计出符合需求的Uaa合成工程菌[12]。

图1 目前已知的Uaa生物体合成途径
Fig.1 Currently known Uaa biosynthetic pathways
注:图中红色标注物质为非天然氨基酸。
在宿主细胞的重构中,很多情况下都通过合成路径上的关键酶的引入或对天然酶的改造,在5-氨基乙酰丙酸合成酶的作用下可以将琥珀酰-CoA和甘氨酸转化为5-氨基乙酰丙酸[13],通过筛选引入5-氨基乙酰丙酸合成酶基因可以构建5-氨基乙酰丙酸合成菌株。但该反应中,产物的过量表达会导致琥珀酰-CoA水平降低影响三羧酸循环[14],进而影响到宿主细胞的正常代谢,因此在两者之间还需要寻找一个更为适合的平衡。在对天然酶的改造中最为常用的方法是改变酶的底物偏好性,例如MORA-VILLALOBOS等[15]设计改造了台湾铜绿假单胞菌的一种芳香族氨基酸羧化酶的底物特异性位点,成功将该酶的底物偏好性改造为色氨酸,并成功利用色氨酸合成了5-羟基色氨酸,之后他们还完成了在色氨酸脱羧酶的重组菌株中将5-羟基色氨酸转化为5-羟色胺[16]。
对反应前体物质的调控是增加产物产量的重要方法。天冬氨酸族的氨基酸可以由天冬氨酸作为前体获得,以草酰乙酸为前体物质直接获得天冬氨酸[17]是最简单直接的方法。该族氨基酸的合成中,天冬氨酸的丰富积累是产物含量提高的前提,敲除天冬氨酸氨裂解酶和苹果酸脱氢酶可以减少草酰乙酸流向三羧酸循环以及丙酮酸补充途径从而增加草酰乙酸的含量进而增加天冬氨酸含量[18]。在宿主菌体内引入枯草芽孢杆菌的天冬氨酸脱羧酶,便可以将天冬氨酸脱羧转化为β-丙酮酸[18]。同样在天冬氨酸族反应途径中,α-酮丁酸在大肠杆菌体内参与合成异亮氨酸,阻断α-酮丁酸前体苏氨酸合成的负反馈调节并抑制苏氨酸外排,使苏氨酸含量足够丰富[19],再敲除编码合成异亮氨酸相关途径的关键基因,并引入一种突变改造后来源嗜热放线菌的亮氨酸脱氢酶,在该酶的作用下便可将该途径转向L-2-氨基丁酸的合成[19]。
抑制或阻断竞争性途径及产物下游的其他合成途径,减少代谢能量的分配有助于获得更高目标产物生产能力的工程菌株。在高丝氨酸及其后续衍生物的生产中,由于赖氨酸合成途径的存在导致所需产物产率的低下[20],在敲除庚二酸脱羧酶基因后阻断了赖氨酸途径进而加强了产物的产率[21]。
相较于化学法,生物法反应条件温和、对环境友好、产率相对较理想,有很大的优势[22],在未来会成为Uaa获得的主要手段。
2 非天然氨基酸的掺入
2.1 化学修饰法
科学研究表明很多物质能与蛋白质特定氨基酸残基发生特异性反应,这些侧链残基在蛋白质中的丰度和反应活性是影响这些物质选择性的重要因素[23]。经典的蛋白质化学修饰包括对巯基、醇羟基、胍基、氨基、咪唑基等的修饰,如酰基化、烷基化、氧化还原、酯化等。如图2-A所示,有研究[24]使用苯甲基磺酰氟(C6H5CH2SO2F)和NaSeH依次与枯草杆菌蛋白酶作用后,将其活性位点丝氨酸转变成硒代半胱氨酸,使该蛋白变为一种有着谷胱甘肽过氧化物酶活性的硒蛋白。
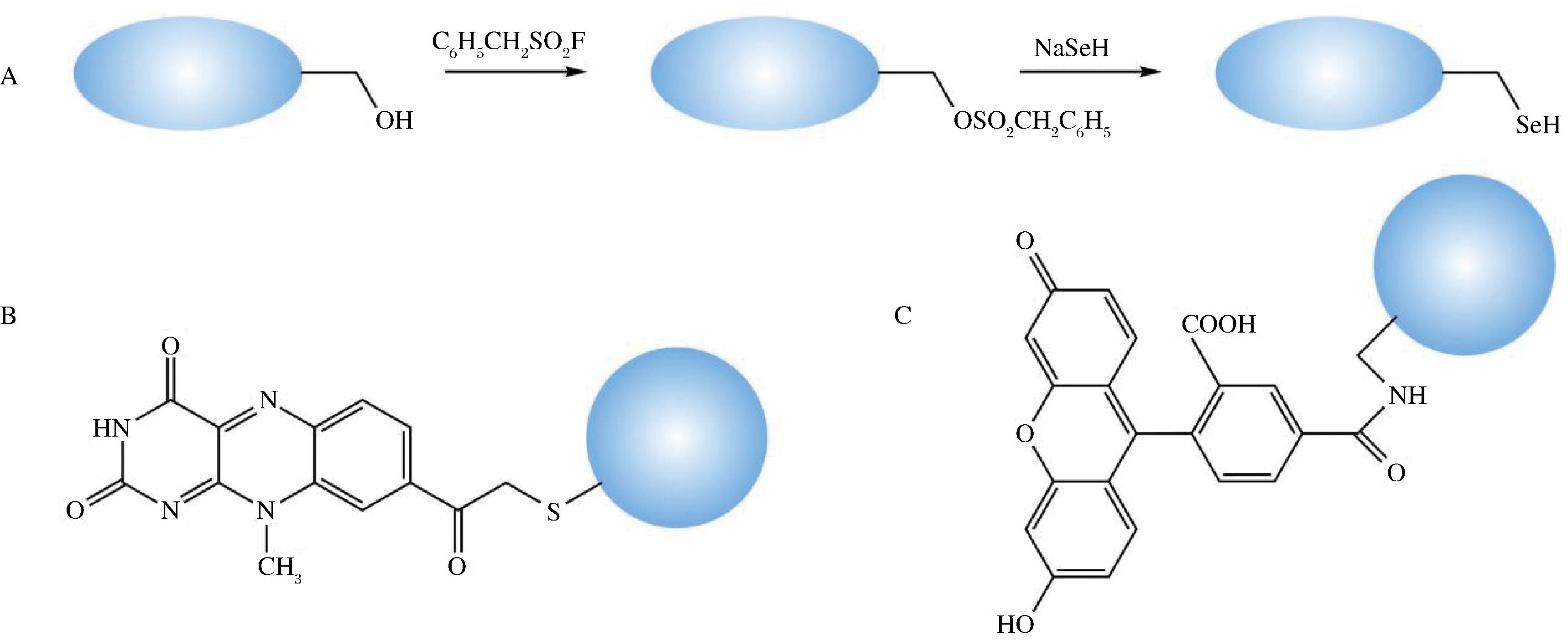
图2 化学修饰法插入实例
Fig.2 Examples of chemical modification method
此外,随着科技的发展使得蛋白质的化学修饰可以引入一些反应活性物质、生物探针和标签等。在20种Naa中,半胱氨酸在蛋白质中丰度较低并且其侧链巯基有着良好的亲和性,这使得它在化学修饰改造蛋白质中有着十分突出的地位,同时基因工程定点突变技术的发展使得研究人员能够在任何特异性位点引入半胱氨酸。例如KAISER等[25]曾利用黄素如8-溴乙酰基-10-甲基异噁嗪共价修饰木瓜蛋白酶活性位点半胱氨酸残基上的巯基,将该酶转化成一种高效的氧化还原酶,如图2-B所示。
WANG等[26]在研究铜催化的相关环加成反应时,将豇豆花叶病毒外壳蛋白在半胱氨酸残基处用叠氮化物或炔烃修饰从而得到标记颗粒,并将荧光分子罗丹明B连接到其外壳蛋白上,如图2-C所示。
化学修饰法是一种十分行之有效的非天然氨基酸插入方法,这种方法在非天然蛋白质的合成中是一种十分简便的方法,但这种方法依赖于蛋白质侧链的特异性,导致这种方法有很大的局限性,同时效率也受到了很大的限制。
2.2 压力插入法
基于筛选压力掺入Uaa其依赖一种或多种特定的天然氨基酸营养缺陷型宿主,将营养缺陷型菌株先在含有一定量Naa的培养基中培养。当相应的Naa消耗完,并且细胞达到适当的生长状态可以表达重组蛋白时,补加与Naa结构和电荷特性类似的Uaa。由于天然氨基酸内源氨酰tRNA合成酶(aminoacyl-tRNA synthetase,aaRS)不能严格区分Naa以及其类似物而存在错氨酰化,在筛选压力的作用下通过诱导型启动子诱导基因的表达使蛋白质翻译依赖于Uaa的可用性,从而将其掺入到蛋白质中,如图3所示。到目前为止,已经约有50种Uaa通过这种方法整合到了蛋白质中[27]。
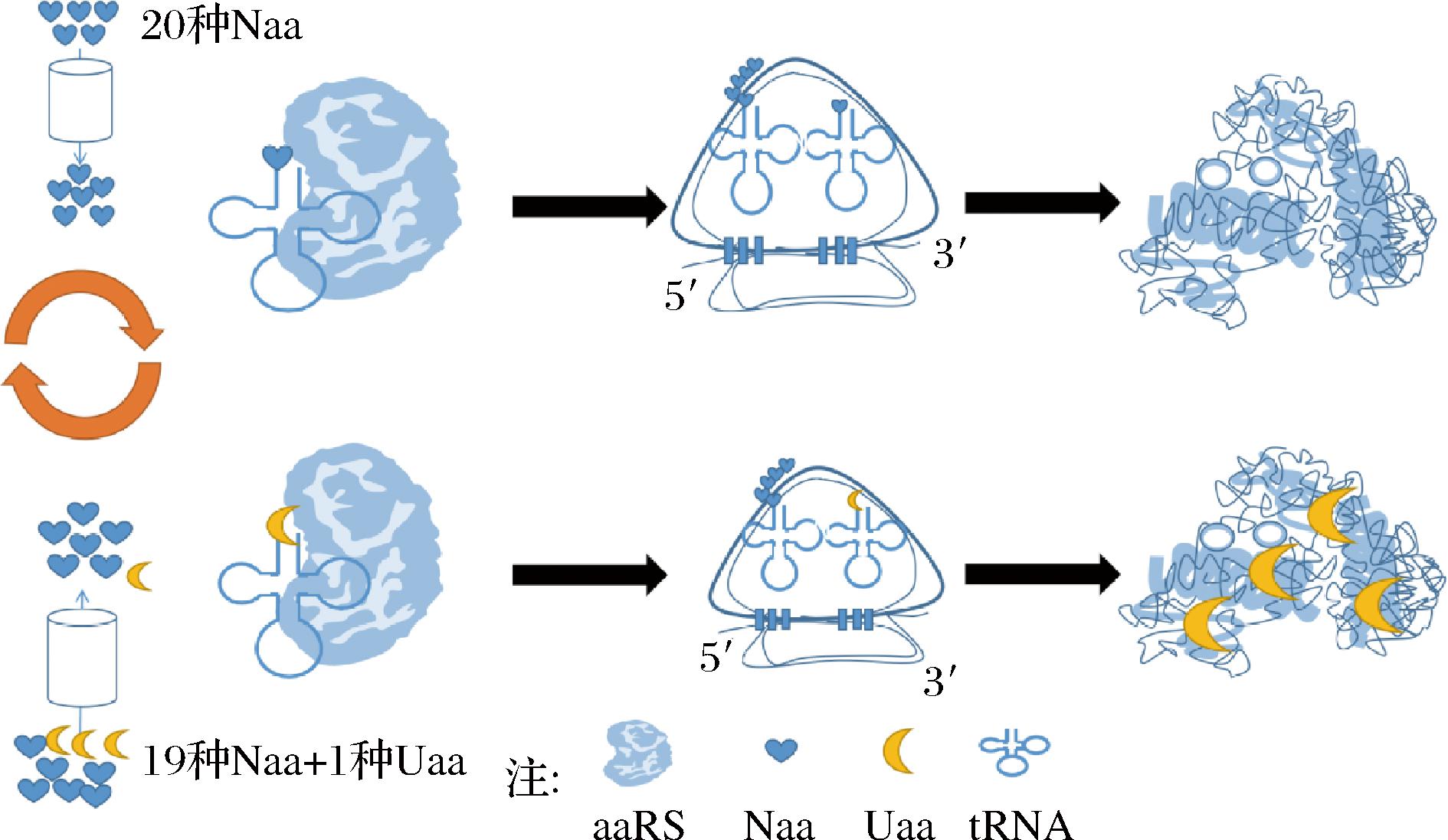
图3 压力插入法
Fig.3 Pressure insertion
改变筛选压力可能会导致蛋白质插入Uaa的位点发生改变,这种情况会导致累积和协同效应,这些效应的产生对某些蛋白质性能的改变更明显于单一位点的改变。但也导致了该方法无法广泛地应用在更精细准确的研究中,同时这种方法需要大量成本高昂的Uaa,这些缺点都导致了这种方法无法实现工业化的应用。
2.3 遗传密码扩展法
通过扩展遗传密码或者开发替代密码的方法,将Uaa掺入到蛋白质中,对此需要有新的密码子和相应互补的反密码子,通过体外和体内的翻译系统将新氨基酸掺入到蛋白质中,该方法重点是创建新的密码子和反密码子的相互作用,包括用于遗传字母ATCG(U)扩增的非天然碱基对系统[28]。
杜方川等[29]率先在前人研究上,利用古生菌属詹氏甲烷球菌(Methanococ-cus jannaschii, Mj)酪氨酰tRNA(tyrosyl-tRNA,tRNATyr)/酪氨酰-tRNA合成酶(tyrosyl-tRNA synthetase,TyrRS)对与大肠杆菌自身tRNAs/aaRSs对正交即MjTyrRS不识别大肠杆菌tRNAs,大肠杆菌aaRSs也不识别MjtRNATyr这一特性,开发出了一种新的Uaa修饰蛋白质方法,如图4所示。在蛋白质的翻译机制中增加新的部件,对目标蛋白质修饰位点的基因进行突变,然后校正MjTyrRS氨酰化特异非天然氨基酸装载到校正反义密码子校正为CUA的MjtRNA(校正![]() 上,氨酰化的校正
上,氨酰化的校正![]() 与目标mRNA突变位点密码子结合,翻译出含有特异非天然氨基酸的蛋白质。
与目标mRNA突变位点密码子结合,翻译出含有特异非天然氨基酸的蛋白质。

图4 基于古生菌属詹氏甲烷球菌的遗传密码扩展法
Fig.4 A genetic code expansion method on the basis of Methanococ-cus jannaschii
除此之外,研究表明在大肠杆菌中创建的吡咯赖氨酸-tRNA合成酶/反义密码子校正为CUA的吡咯赖氨酰tRNA(校正![]() 对系统可用于扩展酿酒酵母的遗传密码。使用这种系统,在酵母蛋白中成功掺入了多种Uaa如Nε-[(2-丙炔氧基)羰基]-L-赖氨酸、Nε-乙酰基-L-赖氨酸,其中掺入的一种光笼氨基酸已被证明可用于控制真核细胞中蛋白质的功能。这种方法将允许越来越多的有用氨基酸同吡咯赖基-tRNA合成酶
对系统可用于扩展酿酒酵母的遗传密码。使用这种系统,在酵母蛋白中成功掺入了多种Uaa如Nε-[(2-丙炔氧基)羰基]-L-赖氨酸、Nε-乙酰基-L-赖氨酸,其中掺入的一种光笼氨基酸已被证明可用于控制真核细胞中蛋白质的功能。这种方法将允许越来越多的有用氨基酸同吡咯赖基-tRNA合成酶![]() 对一起掺入到酵母细胞蛋白质中。这种方法还可以绕过直接在真核宿主中进化合成酶的氨基酸特异性要求将非天然氨基酸转移到哺乳动物细胞蛋白质中[30]。
对一起掺入到酵母细胞蛋白质中。这种方法还可以绕过直接在真核宿主中进化合成酶的氨基酸特异性要求将非天然氨基酸转移到哺乳动物细胞蛋白质中[30]。
扩展遗传密码或者开发替代密码的方法在修饰中采用的Uaa与天然氨基酸结构类似,不仅避免了普通化学修饰中修饰位点选择的被动性,并且最大限度地保证了酶蛋白的结构稳定和活性保留。
3 非天然氨基酸的应用
3.1 酶的改造
在酶催化效率的改造中使用常规方法很多时候效果一般,而Uaa的引入则为此打开了一条新的道路。细菌磷酸三酯酶催化农药对氧磷水解,其催化效率十分高效已经被认为达到了该酶的进化极限,在使用UaaL-(7-羟基香豆素-4-基)乙基甘氨酸或L-(7-甲基香豆素-4-基)乙基甘氨酸取代该酶的309位天然酪氨酸后,这种酶的活性在已经非常高效的情况下仍然增强了8~11倍[31]。而相比之下,从数十万种天然氨基酸突变体中筛选获得提高天然活性的酶显得十分困难且低效。
氟化氨基酸的掺入还可以显著增强酶的热稳定性,借助微生物的培养,获得的对氟苯丙氨酸磷酸酯酶在60 ℃的高温下仍可正常行驶功能而不受任何影响[32],但一般的天然酶在该温度下氢键会发生断裂而失去酶的活性和功能[29]。
3.2 蛋白质动态构象的获取
蛋白质的生理功能以及分子机制等大多体现在其动态结构的变化之中,对于蛋白质的动态分析在研究中自然是十分关键的。核磁共振是一种可以获得蛋白质动力学信息的重要方法,但在超大蛋白体系中,由于谱峰数量多、图像展宽、分辨率低等问题仍然影响蛋白质构象的获取[33],通过将Uaa引入蛋白质的关键位点并观测Uaa的核磁共振标记就可以很好的解决这些问题。
LIU等[34]开发了通过遗传密码扩展将4-三甲基硅基苯丙氨酸(4-trimethylsilyl phenylalanine,TMSiPhe)在特定位点掺入蛋白质中用于检测生物系统中构象变化的方法称为DeSipher方法,利用Uaa TMSiPhe上待观测氢原子在核磁共振中特有的化学位移和灵敏度检测蛋白构象的变化。G蛋白偶联受体(G-protein-coupled receptor,GPCR)是人体中的一类膜受体家族,负责着人体五分之四的跨膜信号转导,能够识别信号刺激,通过G蛋白和抑制蛋白转化为胞内信号,其中GPCR需经过磷酸化并通过不同的磷酸化模式招募并诱导抑制蛋白产生多种构象从而指导不同的功能,但受体是否可以不经过磷酸化直接与配体结合,同时配体直接通过改变受体的构型来对抑制蛋白的功能进行特异性的调控是一直以来难以解决的问题。在应用DeSipher技术后,成功检测到GPCR与不同配体结合后调控下游抑制蛋白的多重构象状态[34],证明了多种配体可以直接与GPCR的跨膜核心作用并在不依赖对相关磷酸化酶的选择下调控改变下游调控蛋白的构象进而介导下游不同的功能[35]。
在大分子质量蛋白中插入Uaa,通过大幅减少蛋白质中可观测信号的数量进而降低信号的分类难度,获得简化后的核磁共振图谱,大大降低了核磁共振在蛋白质特定功能域动态研究的难度。这种方法在日后一定会逐渐发展成熟并成为核磁共振研究中的一种有力手段。
3.3 非天然蛋白质药物
Uaa的出现给生物医药也带来了一份新的可能性,传统医药的开发主要通过筛选现有的化合物库,但很多蛋白质药物很难通过化学合成来获得[27],缺乏对蛋白质药物的设计和改造。Uaa有着特殊的化学基团,这些基团可以给蛋白类药物带来新的空间结构,显著拓展蛋白药物的设计空间[36]。常规药物主要由天然氨基酸通过非共价相互作用发挥疗效,具有结合不够稳定、容易解离而导致药效不理想的局限性,相比之下共价蛋白药物有着更大的治疗潜力。
科学家在开发共价蛋白药物的时候,将一种具有活性的Uaa氟硫酸盐-L-酪氨酸(fluorosulfate-L-tyrosine,FSY)掺入到人程序性细胞死亡蛋白(human programmed cell death protein-1,PD-1)中[37],这种蛋白由T细胞表达可以调节T细胞的活性,在肿瘤细胞中常过表达其受体蛋白细胞程序性死亡配体1(programmed cell death-ligand 1,PD-L1),该受体蛋白与T细胞表面PD-1结合相互作用抑制T细胞活性并引起肿瘤特异性T细胞凋亡,阻断两者的结合便可以有效逆转受阻的抗肿瘤免疫应答。最主要的方法是注射相同结构PD-1蛋白的竞争疗法,FSY具有潜在的生物反应性,在体内和蛋白质中呈现惰性,在蛋白质药物与靶标蛋白结合后,药物上连接的FSY接近靶标蛋白天然残基,并与该残基发生特异性的不可逆共价结合,如图5所示。在免疫人源化小鼠的过程中共价修饰后的PD-1(FSY)比一般的PD-1对于治疗肿瘤细胞有更显著的效果[37]。
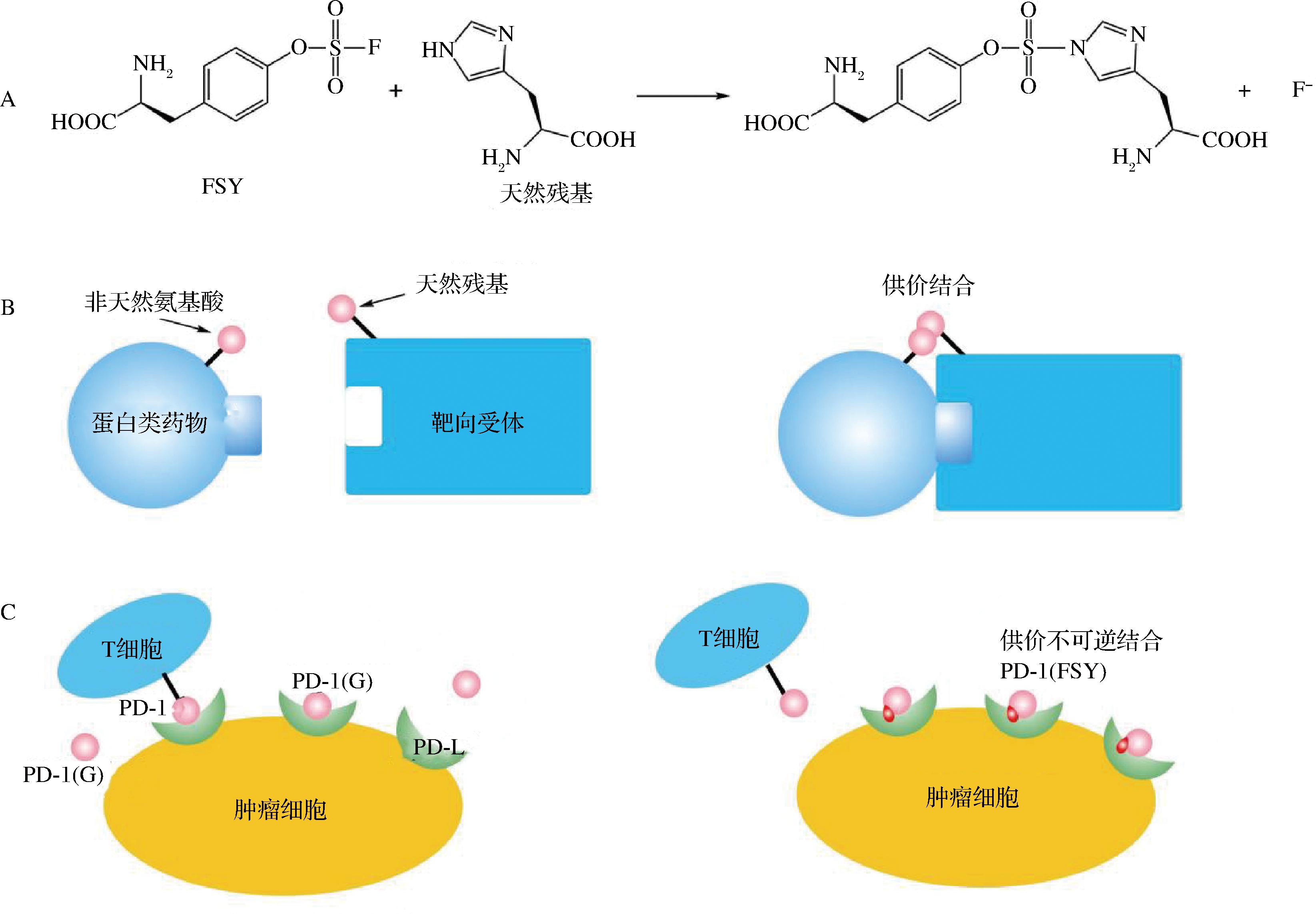
A-FSY与近端组氨酸反应;B-共价蛋白药物原理;C-PD-1非天然氨基酸修饰前后对比
图5 PD-L1共价药物开发原理
Fig.5 Principles of PD-L1 covalent drug development
Uaa引入自体蛋白还可以克服机体的自我耐受性,免疫系统对自身抗原的自我耐受性使得对癌症或慢性退行性疾病的治疗性疫苗生产变得十分困难[38],引入Uaa则是一种简单却有显著效果的方法。
4 结论与展望
对于Uaa的合成目前已经有了很多较为可行的途径,尤其是生物细胞代谢工程的开发有着传统化学合成法所无法企及的优势。同时关于Uaa插入蛋白质的课题一直是研究的热点,目前已经有化学修饰、筛选压力以及遗传密码扩展的技术可以插入Uaa以定向修饰改造蛋白质。由于Uaa区别于Naa的独特的理化性质,Uaa修饰蛋白质可以带来较大的性能改变,有望获得符合期望的高性能蛋白质,进而满足当今科技、工业、医疗等发展的需求。Uaa的插入,对于酶类物质的改造、蛋白药物的开发、生物医疗的发展等都有着前所未有的效果,在不久的未来Uaa及其修饰蛋白一定还会应用到更多的方面,为人类社会的发展做出更大的贡献。
[1] ROS E, TORRES A G, RIBAS DE POUPLANA L.Learning from nature to expand the genetic code[J].Trends in Biotechnology, 2021, 39(5):460-473.
[2] JANG Y S, KIM B, SHIN J H, et al.Bio-based production of C2-C6 platform chemicals[J].Biotechnology and Bioengineering, 2012, 109(10):2437-2459.
[3] LIU C C, SCHULTZ P G.Adding new chemistries to the genetic code[J].Annual Review of Biochemistry, 2010, 79:413-444.
[4] BRUSTAD E M, ARNOLD F H.Optimizing non-natural protein function with directed evolution[J].Current Opinion in Chemical Biology, 2011, 15(2):201-210.
[5] WANG L.Expanding the genetic code[J].Science, 2003, 302(5645):584-585.
[6] 胡建强, 黄志平, 李晶.氨基酸手性拆分研究进展[J].食品与药品,2012, 14(1):60-64.
HU J Q, HUANG Z P, LI J.Research progress on chiral resolution of amino acids[J].Food and Drug,2012, 14(1):60-64.
[7] SHABICA A C, MAX T.Resolution of DL-tryptophan[J].Journal of the American Chemical Society,1949, 71(9):3251.
[8] 吴法浩. 非天然手性氨基酸合成的研究进展[J].生物化工,2020, 6(1):122-125;129.
WU F H.Advances in the synthesis of non-natural chiral amino acids[J].Biological Chemical Engineering,2020, 6(1):122-125;129.
[9] DANG T P, KAGAN H B.The asymmetric synthesis of hydratropic acid and amino-acids by homogeneous catalytic hydrogenation[J].Journal of the Chemical Society D:Chemical Communications,1971(10):481.
[10] IRIE K, ISHIDA A, NAKAMURA T, et al.Syntheses of substituted L- and D-tryptophans[J].Chemical and Pharmaceutical Bulletin,1984, 32(6):2126-2139.
[11] GIESE C, LEPTHIEN S, METZNER L, et al.Intracellular uptake and inhibitory activity of aromatic fluorinated amino acids in human breast cancer cells[J].ChemMedChem,2008, 3(9):1449-1456.
[12] 汤晓玲, 张慧敏, 柳志强, 等.非天然氨基酸细胞工厂的构建与应用[J].生物工程学报,2022, 38(4):1295-1306.
TANG X L, ZHANG H M, LIU Z Q, et al.Construction and application of microbial cell factories for unnatural amino acids[J].Chinese Journal of Biotechnology,2022, 38(4):1295-1306.
[13] ZHANG L L, CHEN J Z, CHEN N, et al.Cloning of two 5-aminolevulinic acid synthase isozymes HemA and HemO from Rhodopseudomonas palustris with favorable characteristics for 5-aminolevulinic acid production[J].Biotechnology Letters,2013, 35(5):763-768.
[14] KIND S, BECKER J, WITTMANN C.Increased lysine production by flux coupling of the tricarboxylic acid cycle and the lysine biosynthetic pathway—Metabolic engineering of the availability of succinyl-CoA in Corynebacterium glutamicum[J].Metabolic Engineering,2013, 15:184-195.
[15] MORA-VILLALOBOS J A, ZENG A P.Protein and pathway engineering for the biosynthesis of 5-hydroxytryptophan in Escherichia coli[J].Engineering in Life Sciences,2017, 17(8):892-899.
[16] MORA-VILLALOBOS J A, ZENG A P.Synthetic pathways and processes for effective production of 5-hydroxytryptophan and serotonin from glucose in Escherichia coli[J].Journal of Biological Engineering,2018, 12:3-15.
[17] DUGAR D, STEPHANOPOULOS G.Relative potential of biosynthetic pathways for biofuels and bio-based products[J].Nature Biotechnology,2011, 29(12):1074-1078.
[18] PIAO X Y, WANG L, LIN B X, et al.Metabolic engineering of Escherichia coli for production of L-aspartate and its derivative β-alanine with high stoichiometric yield[J].Metabolic Engineering,2019, 54:244-254.
[19] XU J M, LI J Q, ZHANG B, et al.Fermentative production of the unnatural amino acid l-2-aminobutyric acid based on metabolic engineering[J].Microbial Cell Factories,2019, 18(1):43.
[20] BRYANT K I, DILGER R N, PARSONS C M, et al.Dietary L-homoserine spares threonine in chicks 1,2[J].The Journal of Nutrition.2009, 139(7):1298-1302.
[21] OOGAI Y, YAMAGUCHI M, KAWADA-MATSUO M, et al.Lysine and threonine biosynthesis from aspartate contributes to Staphylococcus aureus growth in calf serum[J].Applied and Environmental Microbiology,2016, 82(20):6150-6157.
[22] 李珂. 有机溶剂/水两相中酶法合成非天然氨基酸以及甲苯降解菌的筛选、鉴定与降解特性研究[D].武汉:湖北大学,2018.
LI K.Study on the enzymatic synthesis of unnatural amino acids in organic solvent/water phases and screening, identification and degradation characteristics of toluene degrading bacteria[D].Wuhan:HuBei University,2018.
[23] 张春秋, 罗全, 刘俊秋, 等.蛋白质功能化新策略:嵌入非天然氨基酸[J].化学进展,2012, 24(4):577-588.
ZHANG C Q, LUO Q, LIU J Q, et al.New strategies for protein functionalization:Inserting unnatural amino acids into proteins[J].Progress in Chemistry,2012, 24(4):577-588.
[24] LIU J Q, JIANG M S, LUO G M, et al.Conversion of trypsin into a seleniumcontaining enzyme by using chemical mutation[J].Biotechnology Letters,1998, 20(7):693-696.
[25] KAISER E T, LAWRENCE D S.Chemical mutation of enzyme active sites[J].Science,1984, 226(4674):505-511.
[26] WANG Q, CHAN T R, HILGRAF R, et al.Bioconjugation by copper(I)-catalyzed azide-alkyne [3+2] cycloaddition[J].Journal of the American Chemical Society,2003, 125(11):3192-3193.
[27] 刘玉美, 毋彤, 陈振娅, 等.非天然氨基酸及非天然蛋白合成的研究进展[J].生物加工过程,2022, 20(2):182-194.
LIU Y M, WU T, CHEN Z Y, et al.Research progress in synthesis of unnatural amino acids and unnatural proteins[J].Chinese Journal of Bioprocess Engineering,2022, 20(2):182-194.
[28] KIMOTO M, HIRAO I.Genetic code engineering by natural and unnatural base pair systems for the site-specific incorporation of non-standard amino acids into proteins[J].Frontiers in Molecular Biosciences,2022, 9:851646.
[29] 杜方川, 王芬, 神应强, 等.非天然氨基酸修饰蛋白质研究进展[J].杭州师范大学学报(自然科学版),2013, 12(5):437-445.
DU F C, WANG F, SHEN Y Q, et al.Research progress of unnatural amino acid modified proteins[J].Journal of Hangzhou Normal University(Natural Science Edition),2013, 12(5):437-445.
[30] HANCOCK S M, UPRETY R, DEITERS A, et al.Expanding the genetic code of yeast for incorporation of diverse unnatural amino acids via a pyrrolysyl-tRNA synthetase/tRNA pair[J].Journal of the American Chemical Society,2010, 132(42):14819-14824.
[31] UGWUMBA I N, OZAWA K, XU Z Q, et al.Improving a natural enzyme activity through incorporation of unnatural amino acids[J].Journal of the American Chemical Society,2011, 133(2):326-333.
[32] BAKER P J, MONTCLARE J K.Enhanced refoldability and thermoactivity of fluorinated phosphotriesterase[J].Chembiochem,2011, 12(12):1845-1848.
[33] 史朝为, 石攀, 田长麟.非天然氨基酸在蛋白质动态特性核磁共振研究中的应用[J].波谱学杂志,2021,38(4):523-532.
SHI C W, SHI P, TIAN C L.Application of non-natural amino acids in the study of dynamic properties of proteins by NMR[J].Chinese Journal of Magnetic Resonance,2021,38(4):523-532.
[34] LIU Q, HE Q T, LYU X X, et al.DeSiphering receptor core-induced and ligand-dependent conformational changes in arrestin via genetic encoded trimethylsilyl 1H-NMR probe[J].Nature Communications,2020, 11(1):4857.
[35] 贺庆涛. GPCR调控arrestin构象多样性并指导其下游信号转导机制的研究[D]. 济南: 山东大学, 2021.
HE Q T. Study on the mechanism of GPCR regulates the conformation diversity of arrestin and guides its downstream signal transduction[D]. Jinan: Shandong University, 2021.
[36] MA J S.Unnatural amino acids in drug discovery[J].Chimica Oggi-Chemistry Today,2003, 21(6):65-68.
[37] LI Q K, CHEN Q, KLAUSER P C, et al.Developing covalent protein drugs via proximity-enabled reactive therapeutics[J].Cell,2020, 182(1):85-97.
[38] GRÜNEWALD J, HUNT G S, DONG L Q, et al.Mechanistic studies of the immunochemical termination of self-tolerance with unnatural amino acids[J].Proceedings of the National Academy of Sciences of the United States of America,2009, 106(11):4337-4342.