近年来,食源性疾病仍在各国不断暴发,并造成严重后果。食源性致病菌是其主要原因,它可能通过空气、水、土壤传播以及在种植粮食作物、收获、加工、包装、配送和贮存过程中发生[1]。被致病菌污染的食物或水一旦被人类食用,发病率和死亡率都很高[2]。因此,快速和灵敏地及时检测食源性致病菌是减少感染传播、从源头保障食品安全的关键。
在食品微生物学中,细菌细胞在液体或固体培养基上培养能够产生可见菌落[3]。然而,致病菌在食品各类加工过程中会受到外界环境的影响,诱导产生不同的代谢状态。对于活的不可培养(viable but non-culturable, VBNC)状态的细菌,可能会暂时失去在培养基上生长的能力。基于微生物培养的生化分析虽然是致病菌检测的“金标准”,但不得检出VBNC状态的细菌,程序繁琐且耗时、特异性差、不适用于大量样品的检测[4]。依赖聚合酶链反应的分子生物学技术可以检测目标致病菌中的特定基因,并且准确、特异和敏感。然而,由于无法区分活菌和死菌,容易造成假阳性的结果,以及需要熟练的技术人员和精密昂贵的仪器等问题在使用中仍然受限[5]。基于抗原和抗体特异性反应的免疫分析,具有操作简单、准确性高和检测速度快等特点。近些年发展迅速,在食源性致病菌检测领域中发挥着越来越重要的作用。免疫检测技术具有常规分析技术难以比拟的优势,一般不使用贵重的分析仪器,可简化或省去前处理步骤,且易于提供系列商品化的技术产品,还可以检出不可培养的活菌细胞,适合于分析复杂基质中存在的痕量组分,可实现现场、高通量的多重检测,被得到广泛应用[6]。基于此,本文对致病菌潜在的代谢状态、抗体的类型和特点及免疫学检测方法的种类、原理和应用等进行讨论,为食源性致病菌的免疫检测技术的未来发展提供思路。
1 食源性致病菌潜在的代谢状态
食品加工过程中经物理和/或化学处理会对致病菌造成不同程度的损伤,呈现出不同的代谢状态。研究表明,致病菌除正常活的状态,还可能以亚致死损伤、VBNC和休眠3种状态存在,其主要特征见表1。
表1 食源性致病菌潜在的代谢状态
Table 1 Potential metabolic status of foodborne pathogens

代谢状态生物学特征诱因恢复能力参考文献亚致死损伤对基本细胞结构和功能不同程度的的损伤及蛋白质变性;维持代谢活性和致病性;在非选择性培养基上可形成菌落温度、酸碱度、饥饿、渗透压、辐照、干燥、脉冲电场、高静水压、消毒化合物、抗生素、天然抗菌化合物、氧化剂等有/无[8-9]VBNC代谢活性降低,但可检测到,对底物的吸收和利用有所下降;无法在固体培养基上形成菌落;结构完整,但细菌体积、形态和排列等发生一定变化;保留致病性营养、渗透压、氧气压力、酸碱度、温度、水活度、脉冲电场、辐照、高压、防腐剂、消毒剂、生物杀伤剂等有[10-11]休眠小而轻;代谢停止,无法检测到;无繁殖功能营养缺乏、氧气浓度、金属离子、氨基酸、糖类、高热、高酸碱、高渗等有[7,12]
可培养性降低是亚致死损伤细胞导致的结果,这种损伤是暂时的,也可能是永久的[7]。它们通常在选择培养基上无法长出可见菌落,但可以维持代谢活性和致病性。在给定合适的条件下,能够恢复完全的活力并形成菌落[8],因此对食品安全构成巨大的威胁。但若无法修复,细胞可能会进入VBNC状态[9]。
VBNC状态的细菌表现出低的但可以检测到的代谢活性,并能维持膜的完整性和致病性,以低水平表达基因,但无法在固体培养基上形成肉眼可见的菌落[10]。VBNC是一种可逆状态,如果条件合适,细胞可恢复到原始状态[11]。VBNC状态下的细菌会逃避传统的检测方法,从而极易发生漏检,导致假阴性结果,构成潜在的食品安全风险。
有些细菌在一定条件下还会形成休眠状态。芽孢是研究最多的休眠状态之一,对各种加工技术和杀菌剂有很强的抗性,很难直接灭活,这可能对公众健康构成潜在危害[12]。鉴于培养基无法检测大量处于异于正常状态的细胞,微生物培养的“金标准”方法就具有一定的局限性。因此,建立能够检测不同代谢状态下致病菌的方法是非常必要的。
2 抗体的类型和特点
基于免疫反应的检测技术关键在于抗原与生物识别元件之间的高度特异性相互作用。抗体因易于使用和对靶抗原的高亲和力,被认为是细菌检测技术的优选配体[13]。随着科学的不断进步,抗体的类型(表2)不断丰富,使得免疫检测技术更加多元化。
表2 抗体的类型和特点
Table 2 Types and characteristics of antibodies

类型制备流程优点缺点参考文献mAba)免疫动物 b)细胞融合c)筛选鉴定 d)克隆培养特异性强、效价高、少或无交叉反应性、理化性质均一、重复性好、容易纯化和标记制备复杂、成本高、耗时长、组织穿透力差、免疫原性强、易引起免疫排斥反应[14-15] pAba)免疫动物 b)分离血清c)纯化鉴定反应强度大、亲和力和灵敏度相对较高、操作简单、制备周期短、成本低特异性差、有交叉反应、亲和力不同、生产批次差异[16-17]Nba)免疫动物 b)文库构建c)筛选鉴定 d)表达纯化体积小易于获得和表达、稳定性好、特异性强、亲和力高、水溶性好、组织穿透力强、免疫原性弱、人源化简单、易于廉价批量生产来源窄,只能从骆驼科动物身上获得[21-22]
2.1 单克隆抗体(monoclonal antibody,mAb)
免疫测定的首选之一是应用具有一致性和高度特异性的抗体,即使用杂交瘤技术在小鼠中产生的mAb。mAb是一类仅能特异性识别单一抗原表位的抗体。其效价高、特异性强、来源容易、可无限重复生产等[14],在免疫检测技术中应用广泛。但其制备过程繁琐、成本高和周期长等缺点[15],也影响了它的发展。
2.2 多克隆抗体(polyclonal antibody,pAb)
与mAb不同,pAb制备过程没有mAb繁琐,节省了筛选抗体的时间和人力。pAb可以识别更多的抗原表位,从而增加比mAb更好地捕获抗原的机会[16]。但pAb是识别多种抗原表位的不同抗体的混合物。因此,特异性差、易发生交叉反应和出现假阳性等,在免疫检测技术中应用受限[17]。
2.3 基因工程抗体
基因工程抗体是利用重组DNA和蛋白质工程技术产生的新型重组抗体分子,包括抗原结合片段(antigen-binding fragment,Fab)、可变区片段(variable fragment,Fv)、单链抗体(single chain variable fragment,scFv)、单域抗体(single domain antibody,sdAb)及纳米抗体(nanobody,Nb)[18](图1)。1993年,HAMERS-CASTERMAN等[19]首次在骆驼科动物体内发现含有天然缺失轻链和CH1恒定区的重链抗体(heavy chain antibody,HCAb)。克隆HCAb的可变区,可得到一个纳米级sdAb,称为Nb,是目前已知能结合抗原并具有完整功能的最小单位[20]。Nb呈椭圆形,直径为 2.5 nm,长为4 nm,分子质量只有15 kDa,仅为mAb的1/10,具有优于传统抗体的特性[21-22],使得Nb在免疫检测领域具有良好的发展前景。
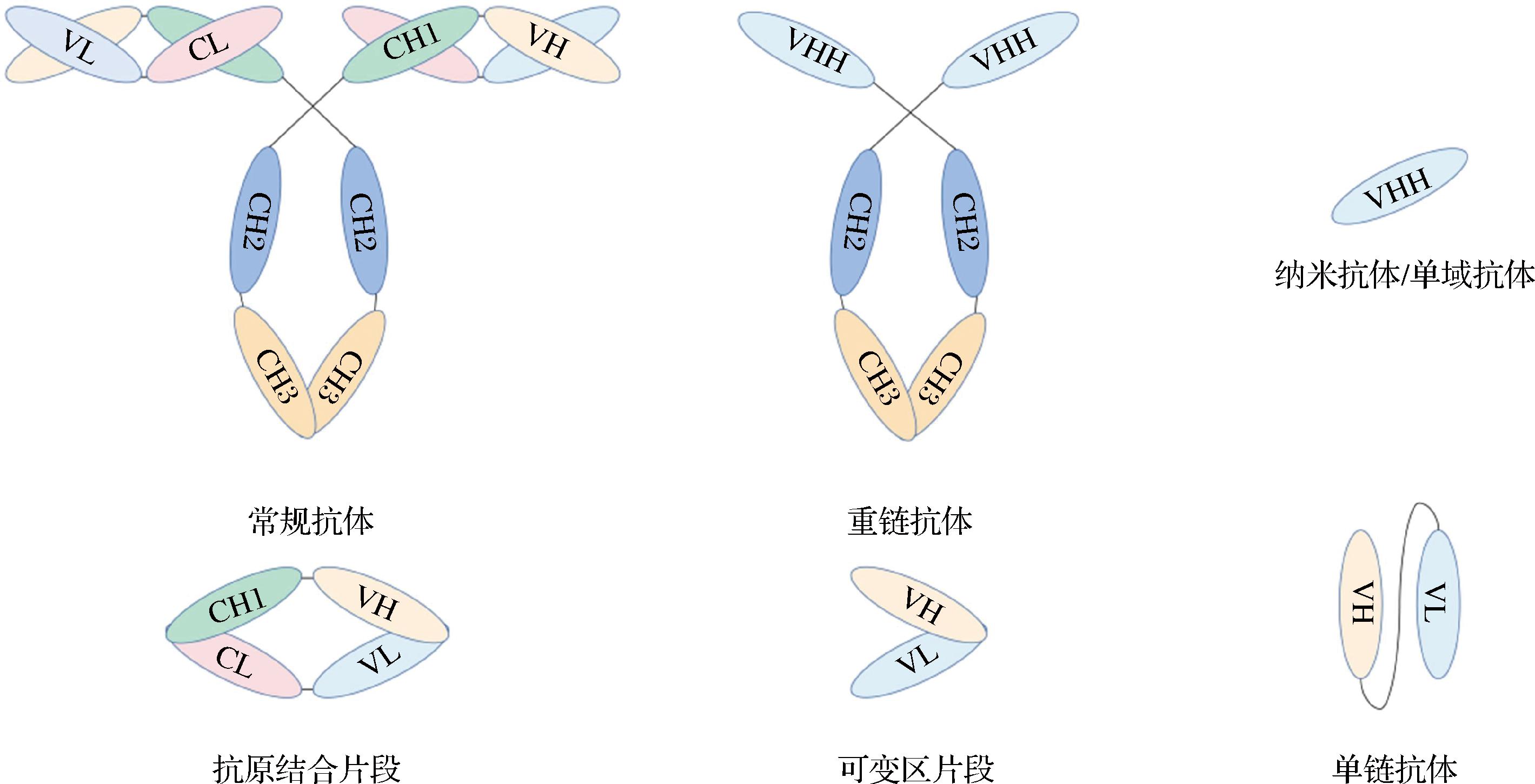
图1 不同基因工程抗体的结构示意图[18]
Fig.1 Structural diagram of different genetically engineered antibodies[18]
尽管使用抗体作为生物识别元件在食源性致病菌的富集和检测方面取得了许多进展,但仍存在一些缺点。例如不同靶细菌之间可能发生交叉反应,抗体易受物理、化学和酶损伤,稳定性差,成本相对较高等。因此需要不断开发新型抗体,以满足免疫检测技术的需要。
3 免疫检测技术
3.1 酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)
ELISA是使用最广泛的免疫检测技术之一,食源性致病菌的检测通常采用夹心ELISA,如图2所示。致病菌首先被捕获抗体捕获,然后通过辣根过氧化物酶(horseradish peroxidase,HRP)偶联抗体作为检测抗体与3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-Tetramethylbiphenyl,TMB)反应,产生可测量的颜色变化[23]。然而,这种基于HRP的比色ELISA的灵敏度相对较低。一般可以通过3种策略来提高检测灵敏度,包括选择一对完全匹配的抗体[24]、设计更灵敏的信号产生分子[25]和提高酶标记物的活性[26]。但对于资源匮乏的地区,比色ELISA无需仪器依旧最为实用。CHEN等[27]建立了基于过氧化氢酶介导的金纳米颗粒(gold nanoparticles,AuNPs)生长的等离子体的夹心ELISA,并使用聚(丙烯酸)涂层的SiO2纳米颗粒作为酶载体,增加酶载量以增强检测信号。通过肉眼可观察到单核细胞增生李斯特菌的检测限(limit of detection,LOD)为8×101 CFU/mL。ELISA操作简单、准确性高、实用性强,但检测结果易受干扰、重复性差、不能同时分析多种成分等[28],未来还需进一步开发能够在污染现场进行快速且可靠的检测方法。
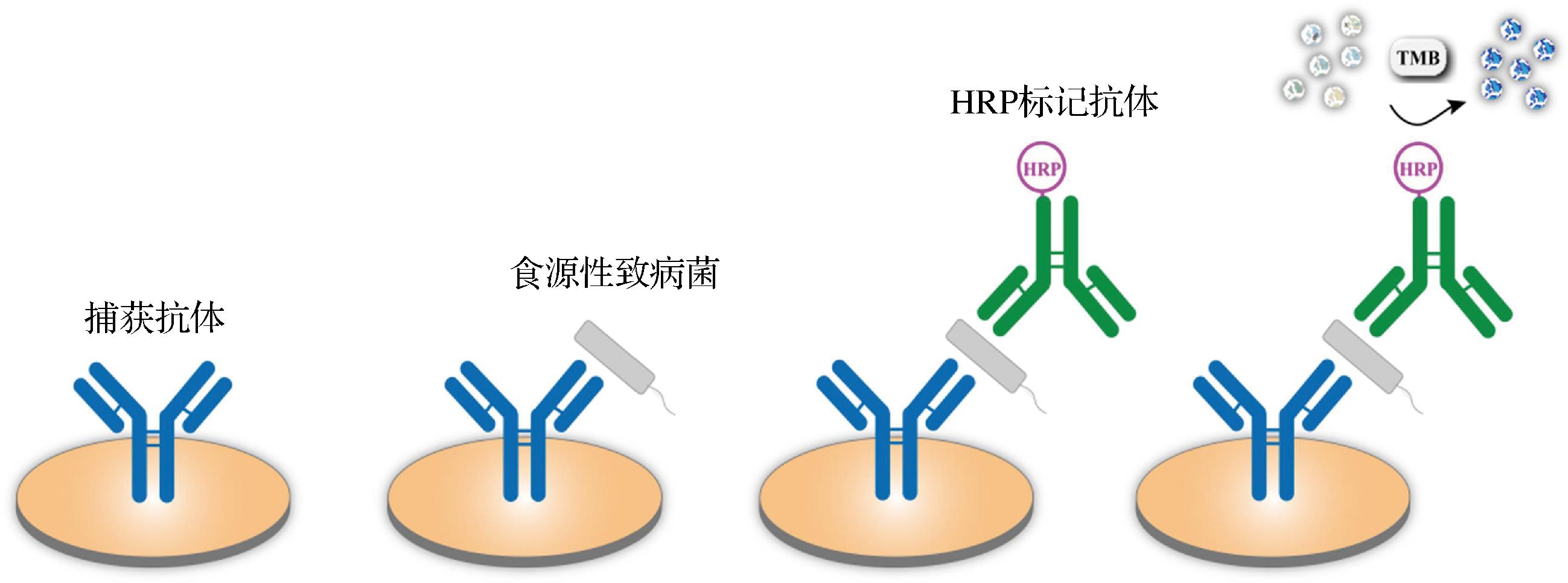
图2 夹心ELISA原理图
Fig.2 Sandwich ELISA schematic diagram
3.2 免疫层析技术(immunochromatographic assay,ICA)
随着检测技术的发展和目前市场的需求,实现高通量、现场快速检测的ICA在食源性致病菌检测领域备受关注,被认为是最有前景的即时检验技术之一。ICA结合了薄层层析原理和免疫识别反应,具有快速、简便、成本低,且不需要专业的人员操作和精密的仪器设备等优点[29]。标记材料是影响检测灵敏度和稳定性的关键,一般可分为两类:颜色型(如AuNPs[30]、磁纳米粒子[31]和彩色乳胶微球[32]等)和荧光型[如荧光微球[33]、量子点[34]、上转换荧光材料[35]和铕(Ⅲ)螯合纳米粒子[36]等]。
食源性致病菌检测通常采用夹心ICA,其基本原理如图3所示,将偶联标记材料的检测抗体吸附于结合垫上,捕获抗体和二抗分别喷涂于检测线(T线)和控制线(C线)。当样品滴加到样品垫上,通过毛细管作用流动至结合垫,如果样品中含有目标致病菌,则会与标记抗体发生免疫反应,形成“标记抗体-致病菌”复合物,进一步流动在T线处被捕获抗体拦截,形成“标记抗体-致病菌-捕获抗体”复合物,从而产生肉眼可见或仪器可检的条带(阳性),反之无条带(阴性),而未被T线拦截的标记抗体被C线捕获,同时也产生条带,用于判断结果的有效性[37]。但夹心ICA存在固有的局限性:一般需要3种抗体,增加了额外的成本[38];由于抗体性质和结合位点不同,抗体配对需要花费额外的时间和精力[39];抗体和纳米材料偶联通常需要有机交联剂,不仅使实验相对复杂和成本昂贵,还会影响抗体的活性[40];标记抗体对外界条件的耐受性也是一个必须考虑的关键问题[41]。HASSAN等[42]建立基于单个抗体的荧光ICA,该分析依赖于氧化石墨烯和量子点之间的非辐射能量转移,用于测定大肠杆菌O157∶H7。与传统的ICA相比,单抗体方法将检测成本降低了60%。并可以通过智能手机读取结果,LOD为57 CFU/mL。研究人员还采用了异硫氰酸荧光素[43]、1,1,2,2-四(4-羧基联苯)乙炔[44]、结晶紫[45]、MoS2/石墨烯二维纳米片[46]等无标记材料,用作致病菌的高效吸附剂,取代捕获抗体,从而绕过目前基于成对抗体的固有限制。
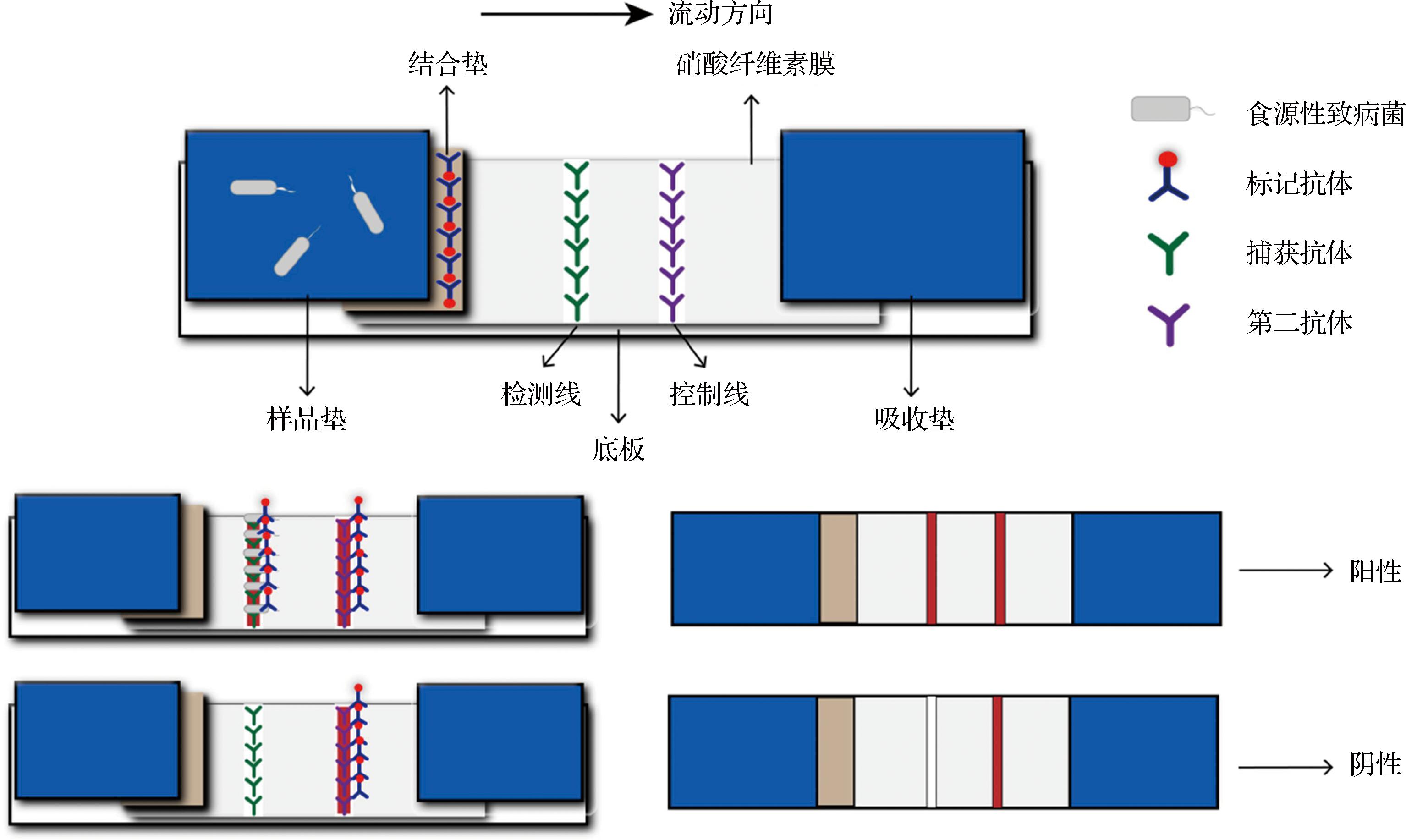
图3 夹心ICA原理图[30]
Fig.3 Sandwich ICA schematic diagram[30]
3.3 免疫磁性分离技术(immunomagnetic separation assay,IMS)
食物中的大分子、微量的目标细菌和非目标菌群的负面影响,通常会降低检测方法的灵敏度和选择性。因此,建立有效的预处理技术对于致病菌的检测至关重要。基于免疫磁性颗粒(immunomagnetic particles,IMPs)的IMS因具有特异性强、分离效率高等显著优点[47],被认为是分离和富集食品中目标致病菌的一种强有力的方法。原理如图4所示,将适量的IMPs添加到样品中,并充分混匀,IMPs上的抗体会与目标致病菌发生特异性结合形成“IMPs-致病菌”复合物。在磁场的作用下,不受其他组分的干扰,可定向移动。然后,将非目标菌群洗脱出去,以达到纯化和浓缩的目的[48]。
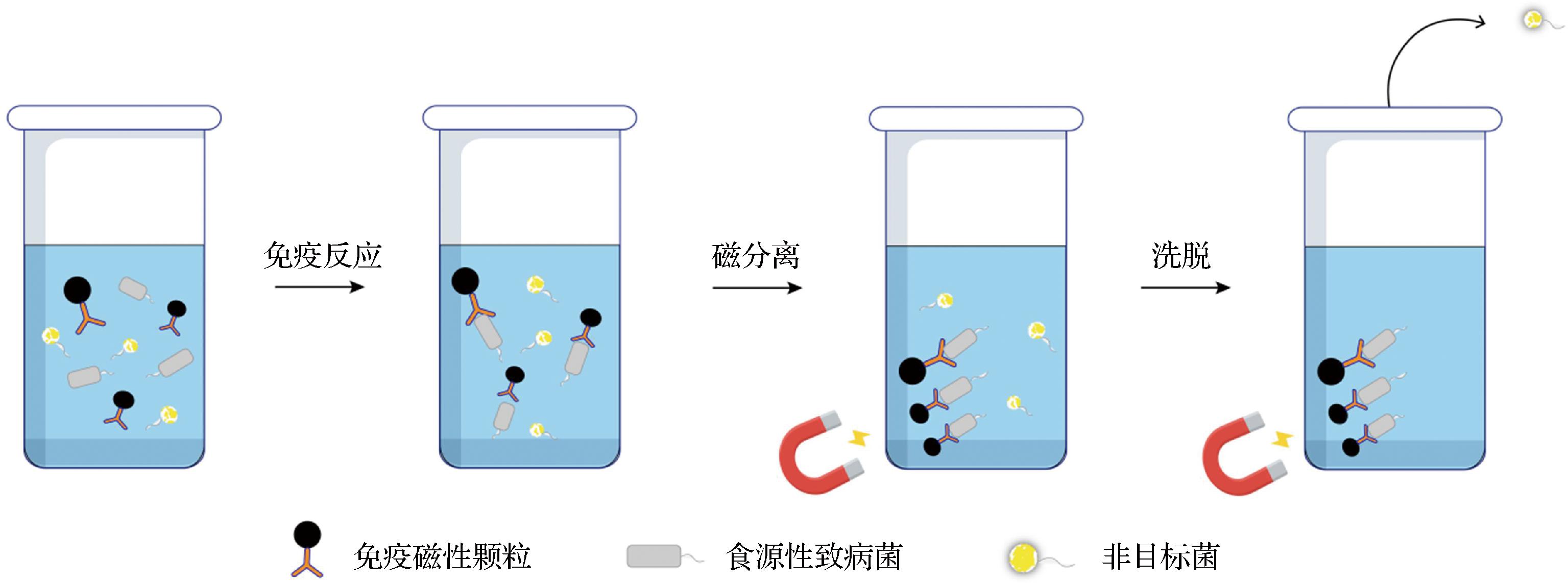
图4 IMS原理图
Fig.4 IMS schematic diagram
为了定量致病菌,评估食品样品的污染程度,IMS会与傅里叶变换红外光谱(Fourier transform infrared,FT-IR)[49]、基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF MS)[50]、石英晶体微天平(quartz crystal microbalance,QCM)[51]、电化学[52]、比色[53]、荧光[54]和化学发光[55]等进行联用。尽管这些方法能够对致病菌进行高度敏感的检测,但它们需要昂贵的设备,因此不能适用于现场检测。BU等[56]基于Ab@Fe3O4微复合材料的IMS、Ap@PtNp微复合材料的信号放大和温度计读数,实现大肠杆菌O157∶H7的定量检测,LOD为14 CFU/mL。这些微复合材料集识别、分离和信号释放等功能于一体,仅使用廉价、简单、实时读取的温度计,实现了快速和高通量的检测。未来还应进一步探索IMS与其他检测方法相结合的可能性,提高IMS与多种检测方法的适应性等。
3.4 免疫荧光技术(immunofluorescence assay,IFA)
近年来,用于检测食源性致病菌的IFA引起研究人员越来越多的兴趣。直接IFA是偶联荧光染料的抗体直接与致病菌反应(图5-A)[57],而间接IFA是抗体与致病菌结合后,荧光染料偶联的二抗与其发生作用(图5-B)[58]。BALAKRISHNAN等[59]使用具有抗pH和光降解等优势的罗丹明荧光染料标记大肠杆菌O157∶H7细胞后,被固定在Protein-A磁珠上的mAb捕获,建立了一种直接检测肉类样品中大肠杆菌O157∶H7的IFA。该方法检测到的最低细菌浓度为(1.2±0.06)×103 CFU/mL,包括样品制备在内的总实验时间仅为1 h。CHO等[60]为了最大限度地提高检测的荧光信号,使用载体蛋白携带大量荧光团,结合IMS浓缩步骤,开发了3种致病菌(大肠杆菌O157∶H7、鼠伤寒沙门氏菌和单核细胞增生李斯特菌)的原位荧光免疫磁多重检测方法。LOD均<5 CFU/mL,并可在2 h内完成检测。但IFA还存在一些问题,如非特异性染色、结果判断和技术复杂等。因此,还需不断地改进IFA的弊端,使其在致病菌的可视化检测中迅速发展。
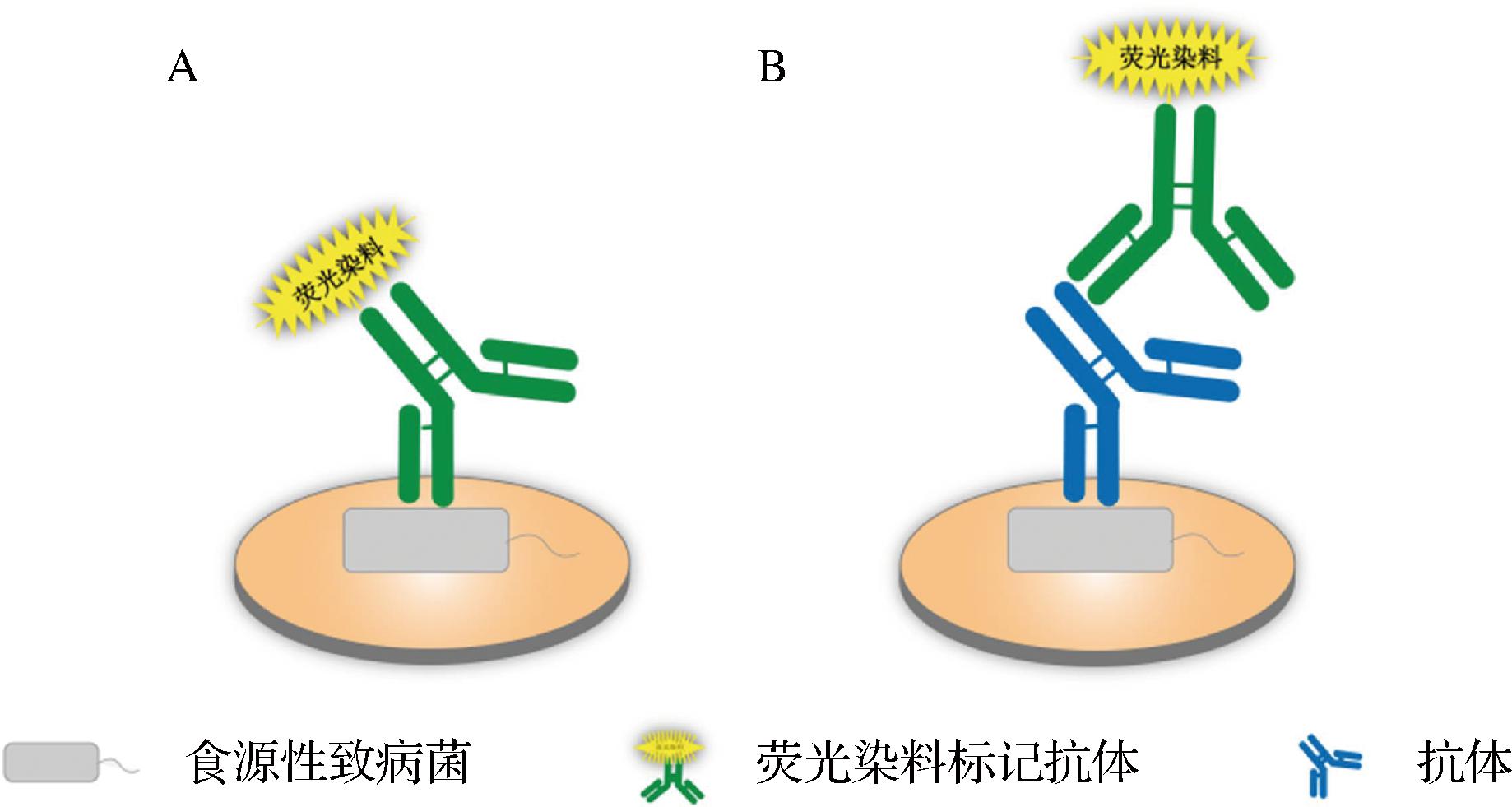
A-直接IFA;B-间接IFA
图5 IFA原理图
Fig.5 IFA schematic diagram
3.5 化学发光免疫技术(chemiluminescence immunoassay,CLIA)
CLIA是一种结合了化学发光分析的高灵敏度和免疫反应的高特异性的新型免疫检测技术。根据标记物的不同可将CLIA分为直接化学发光免疫分析、化学发光酶免疫分析和电化学发光免疫分析。CLIA不需外加光源设备便可读取结果,因此该方法操作简便、稳定性好、线性范围广,已用于多种致病菌的检测[61]。
在化学发光酶免疫分析中,捕获抗体与固相载体偶联以捕获目标致病菌,检测抗体用HRP或碱性磷酸酶(alkaline phosphatase,ALP)标记以催化与化学发光底物鲁米诺或1,2-二氧环乙烷衍生物(1,2-dioxetane derivative,AMPPD)的反应(图6-A)[62-63]。由于发光强度与反应中的酶浓度成正比,酶浓度与致病菌的浓度直接相关,因此可以分析目标致病菌。MAGLIULO等[64]设计了一种新型聚苯乙烯96×4微量滴定板,以此建立了一种简单、多重夹心化学发光酶免疫测定法,用于同时检测大肠杆菌O157∶H7、小肠结肠炎耶尔森菌、鼠伤寒沙门氏菌和单核细胞增生李斯特菌。所有致病菌的定量限为104~105 CFU/mL,该方法的多重分析减少了分析时间、样品和试剂的消耗。
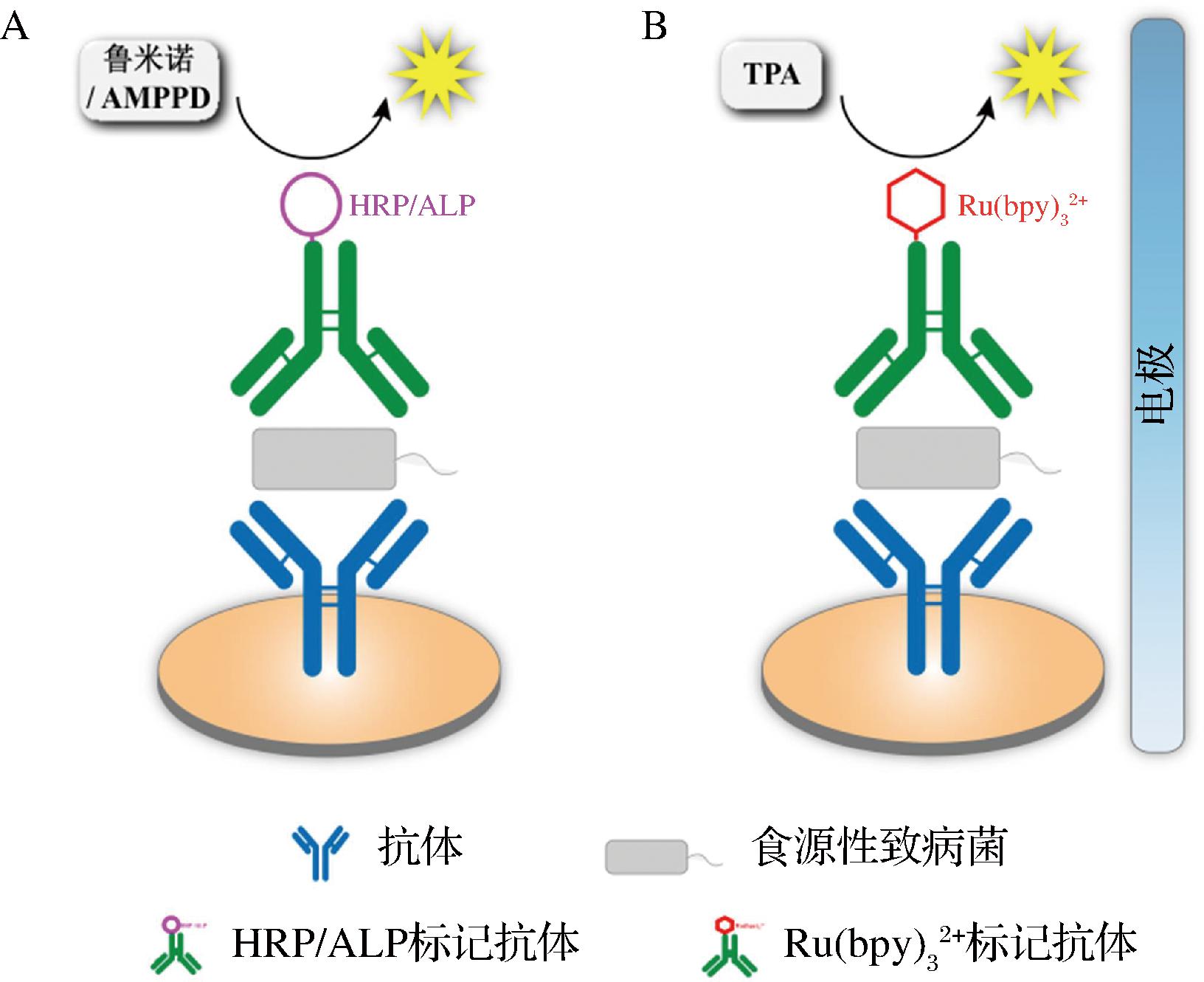
A-化学发光酶免疫分析;B-电化学发光免疫分析
图6 CLIA原理图
Fig.6 CLIA schematic diagram
电化学发光免疫分析一般采用三(2,2′-联吡啶基)钌![]()
![]() 标记抗体,三丙胺(tripropylamine,TPA)作为电子供体,在电极表面因电子转移而发光(图6-B)。其背景信号低、分析速度快、灵敏度高、易于控制等,已成为一个强大的分析平
标记抗体,三丙胺(tripropylamine,TPA)作为电子供体,在电极表面因电子转移而发光(图6-B)。其背景信号低、分析速度快、灵敏度高、易于控制等,已成为一个强大的分析平![]() 作为应用最广泛的电化学发光试剂之一,具有电化学发光效率高、稳定性好、动态范围宽、易于标记生物分子等优点[66]。LI等[67]利用石墨烯量子点纳米复合物在
作为应用最广泛的电化学发光试剂之一,具有电化学发光效率高、稳定性好、动态范围宽、易于标记生物分子等优点[66]。LI等[67]利用石墨烯量子点纳米复合物在![]() 三丙胺测定中放大信号进行电化学发光检测,构建了基于智能手机的便携式大肠杆菌检测系统。该系统表现出良好的线性响应,LOD为5 CFU/mL。通过将纳米复合材料与智能手机集成,拓宽了电化学分析的应用范围。
三丙胺测定中放大信号进行电化学发光检测,构建了基于智能手机的便携式大肠杆菌检测系统。该系统表现出良好的线性响应,LOD为5 CFU/mL。通过将纳米复合材料与智能手机集成,拓宽了电化学分析的应用范围。
3.6 免疫传感器
免疫传感器是将免疫反应的固有特异性与不同检测器的极高灵敏度结合,用于检测抗体和抗原结合形成稳定复合物的分析设备[68],原理如图7所示。当致病菌被固定化的抗体识别后,会产生电学、光学和磁学等变化,通过换能器将其信号转换,加之传输与处理,实现对目标致病菌的检测[69]。免疫传感器允许实时跟踪检测器表面的免疫反应进展,具有灵敏、快速、线性范围广、检出限低等特点[70]。已报道了各种用于检测食源性致病菌的免疫传感器,其中电化学和光学免疫传感器最为常见。
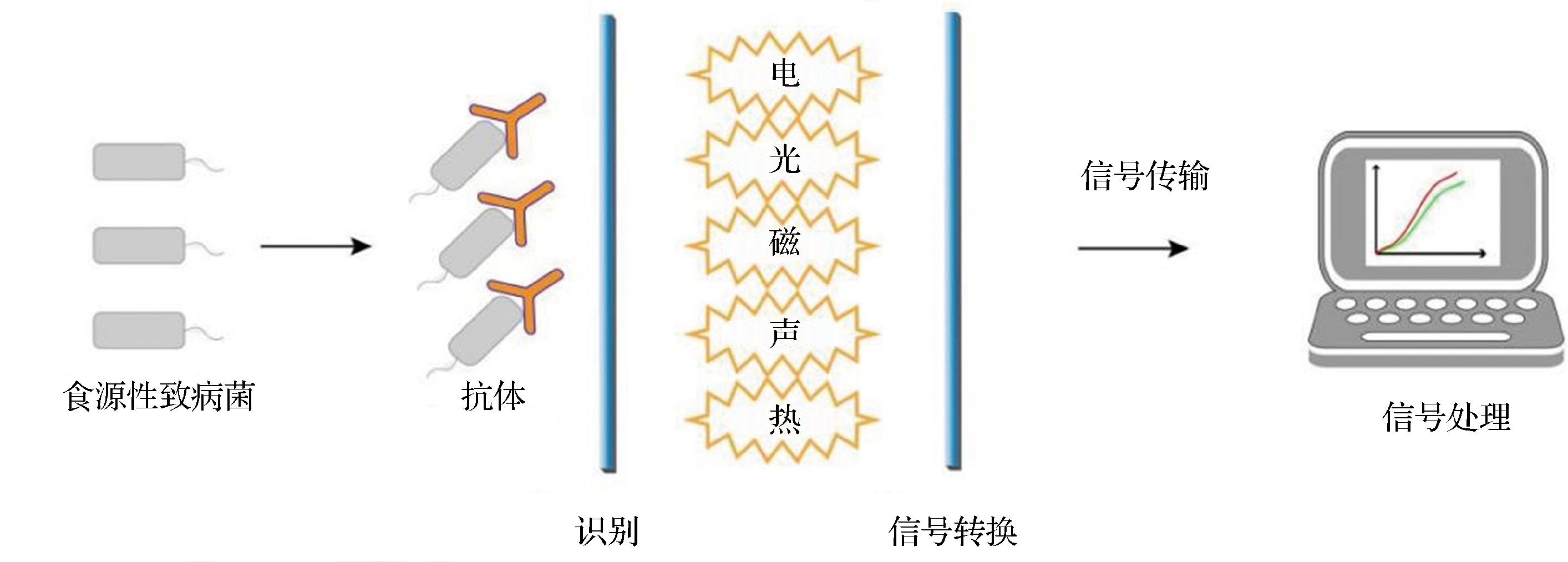
图7 免疫传感器原理图
Fig.7 Immunosensor schematic diagram
电化学免疫传感器是将免疫反应中的生物信号转换成便于测量电化学信号的一种装置。根据输出信号的不同可分为电流法[71]、阻抗法[72]、电导法[73]和电位法[74]。CHORTI等[75]结合滤膜预浓缩和敏感的电化学免疫分析法建立了检测大样本量大肠杆菌ORN 178的流通式电化学免疫传感器,利用脉冲伏安法能够在2 h内检测到低至50 CFU/mL的致病菌。
光学免疫传感器是利用光学材料修饰抗体或抗原,通过光学信号的变化来实现致病菌的检测。目前,光学免疫传感器主要包括比色[5]、荧光[40]、表面等离子体共振(surface plasmon resonance,SPR)[76]和表面增强拉曼散射(surface enhanced Raman scattering,SERS)免疫传感器[77]。基于AuNPs的比色免疫传感器由于其简单性和多功能性一直在分析应用中最普遍。WANG等[78]建立了一种基于硫醇化噬菌体展示纳米抗体诱导的AuNPs聚集的新型比色免疫传感器。根据SPR特性的改变导致可见的颜色变化,该方法可在100 min完成副溶血性弧菌的检测,视觉LOD为104 CFU/mL,定量LOD为103 CFU/mL。免疫传感器的检测效率,因抗体固定化、换能器性能、信号响应和操作参数而异。因此,对于新型材料的制备和多技术的联用,依旧是免疫传感器的突破点。
食源性致病菌的免疫检测技术主要包括上述几种,具体实际应用见表3。
表3 免疫技术在食源性致病菌检测中的应用
Table 3 Application of immunoassays in detection of foodborne pathogen

技术方法/标记材料/联用技术致病菌LOD检测时间食品基质参考文献ELISA抗体-单壁碳纳米管-HRP偶联物ELISA鼠伤寒沙门氏菌直接ELISA:103CFU/mL夹心ELISA:104 CFU/mL-脱脂牛奶和普通牛奶[23]生物素化ELISA(Nb)金黄色葡萄球菌1.4×105 CFU/mL-脱脂牛奶[24]化学发光ELISA(噬菌体介导的双Nb)鼠伤寒沙门氏菌3.63×103CFU/mL-果汁、蜂蜜、牛奶和猪肉[25]抗体-HRP-Cu3(PO4)2纳米花ELISA大肠杆菌O157∶H760 CFU/mL-自来水[26]ICAAuNPs铜绿假单胞菌2.41×104 CFU/mL15 min自来水、橙汁、牛奶和牛肉[30]超顺磁性纳米颗粒肠炎沙门氏菌1.95×105CFU/mL30 min低脂牛奶[31]核壳红SiO2纳米颗粒大肠杆菌O157∶H74.5×105 CFU/mL-猪肉和牛奶[32]荧光微球大肠杆菌O157∶H71.6×103 CFU/ml-牛奶[33]SiO2核-量子点壳纳米复合材料鼠伤寒沙门氏菌定性:103cells/mL定量:5×102cells/mL15 min牛奶[34]上转换发光材料霍乱弧菌O1和O139同时检测105 CFU/mL15 min水[35]铕(Ⅲ)螯合纳米粒子大肠杆菌O157∶H7定性:104 CFU/mL定量:5×102 CFU/mL15 min牛奶、牛肉、猪肉和鸡肉[36]异硫氰酸荧光素大肠杆菌O157∶H7定性:106 cells/mL半定量:105cells/mL-面包、牛奶和果冻[43]1,1,2,2-四(4-羧基联苯)乙炔大肠杆菌O157∶H7105CFU/mL10 min果冻、牛肉和牛奶[44]结晶紫肠炎沙门氏菌80 CFU mL11 min饮用水、番茄和猪肉[45]MoS2/石墨烯二维纳米片肠炎沙门氏菌103/104 CFU/mL10 min饮用水和西瓜汁[46]IMS重组酶聚合酶等温扩增技术沙门氏菌10 CFU/mL30 min牛奶[48]FT-IR活/死的大肠杆菌O157∶H7105CFU/g4 h牛肉[49]MALDI-TOF MS大肠杆菌10 CFU/mL-鱼肉[50]QCM大肠杆菌O157∶H723 CFU/ml4 h牛奶[51]电化学金黄色葡萄球菌1 CFU/mL2 h牛奶[52]比色大肠杆菌O157∶H712 CFU/mL-牛奶、面包和饮用水[53]荧光大肠杆菌O157∶H710 CFU/mL3 h水和牛肉[54]化学发光大肠杆菌O157∶H71.2×103 CFU/mL2 h矿泉水、苹果汁和脱脂牛奶[55]IFA直接IFA大肠杆菌O104∶H4105CFU/mL2 h牛肉[57]间接IFA非可培养状态的霍乱弧菌104cells/400 mL-水[58]CLIA化学发光酶免疫分析(HRP)金黄色葡萄球菌6 CFU/mL50 min苹果汁[62]化学发光酶免疫分析(ALP)金黄色葡萄球菌3.3 CFU/mL75 min牛奶[63]电化学发光免疫分析大肠杆菌O157∶H7143 CFU/mL-苹果汁和自来水[65]免疫传感器电流法热灭活的大肠杆菌250 CFU/ml45 min牛奶和水[71]阻抗法金黄色葡萄球菌3.3 CFU/mL60 min牛奶[72]电导法大肠杆菌O157∶H74.8 CFU/mL30 min脱脂牛奶[73]电位法鼠伤寒沙门氏菌5 cells/mL1 h苹果汁[74]比色金黄色葡萄球菌120 CFU/mL-甘蔗[5]荧光金黄色葡萄球菌85 CFU/mL-奶油糕点[40]SPR沙门氏菌102 CFU/mL60 min奶粉[76]SERS大肠杆菌和肠炎沙门氏菌同时检测10 CFU/mL-牛奶[77]磁弛豫沙门氏菌50 CFU/mL-鸡蛋[79]
注:“-”表示文献未注明。
4 结语
随着人们对健康安全的日益重视,食源性致病菌的检测技术也在不断地深入研究。但分析方法必须克服不同的挑战才能有效地检测致病菌。首先,检测方法必须迅速,以便在必要时作为紧急措施采用。其次,高灵敏度,因为即使是单一菌株的致病菌也会对机体造成致命的威胁。最后,极强的选择性,尤其是在含有蛋白质、脂肪、碳水化合物和其他营养素的复杂食品基质中。因此,在构建一种检测方法时要对检测限、分析时间、方法验证、灵敏度和特异性等进行研究,以及在采用一种新的快速检测方法之前应考虑的附加参数,如设备、操作和成本,这样开发出的食源性致病菌检测方法才具有实用价值。
免疫技术已成功应用于食源性致病菌的检测,并成为目前最常用的检测方法,但还存在一定的局限性。第一,现阶段的免疫检测技术通常需要目标致病菌保持活的状态,以便与抗体结合并产生相应的检测信号。然而,对于不可培养的活菌细胞来说,由于其存活困难或处于休眠状态,很难满足这一要求。因此,需要深入探索对不同代谢状态下致病菌的检测能力以克服这些缺陷。第二,进一步提高检测灵敏度和特异性,消除食品基质效应,扩大样品的适用性,使其能够在不同样品中更准确地检测低浓度的致病菌。第三,朝着更快速和便携化的方向发展,实现更智能化和自动化的检测,加快食品的检测和处理过程,减少人为误差,提高结果的可靠性和一致性。未来,多学科交叉、多种技术联用的趋势,将会产生新的设备或方法,以加强快速检测食源性致病菌的优势。并可以采用简单的工具进行分析,降低实验方法和分析程序的成本,以构建满足便携、高通量、实时、现场检测要求的准确、快速、灵敏、经济高效的食源性致病菌检测技术。
[1] DWIVEDI H P, JAYKUS L A.Detection of pathogens in foods:The current state-of-the-art and future directions[J].Critical Reviews in Microbiology, 2011, 37(1):40-63.
[2] OLIVER S P, JAYARAO B M, ALMEIDA R A.Foodborne pathogens in milk and the dairy farm environment:Food safety and public health implications[J].Foodborne Pathogens and Disease, 2005, 2(2):115-129.
[3] DAVEY H M.Life, death, and in-between:Meanings and methods in microbiology[J].Applied and Environmental Microbiology, 2011, 77(16):5571-5576.
[4] ZHAO Y N, ZENG D X, YAN C, et al.Rapid and accurate detection of Escherichia coli O157∶H7 in beef using microfluidic wax-printed paper-based ELISA[J].The Analyst, 2020, 145(8):3106-3115.
[5] VERDOODT N, BASSO C R, ROSSI B F, et al.Development of a rapid and sensitive immunosensor for the detection of bacteria[J].Food Chemistry, 2017, 221:1792-1796.
[6] DI FEBO T, SCHIRONE M, VISCIANO P, et al.Development of a capture ELISA for rapid detection of Salmonella enterica in food samples[J].Food Analytical Methods, 2019, 12(2):322-330.
[7] KELL D B, KAPRELYANTS A S, WEICHART D H, et al.Viability and activity in readily culturable bacteria:A review and discussion of the practical issues[J].Antonie Van Leeuwenhoek, 1998, 73(2):169-187.
[8] ESPINA L, GARC A-GONZALO D, PAG
A-GONZALO D, PAG N R.Detection of thermal sublethal injury in Escherichia coli via the selective medium plating technique:Mechanisms and improvements[J].Frontiers in Microbiology, 2016, 7:1376.
N R.Detection of thermal sublethal injury in Escherichia coli via the selective medium plating technique:Mechanisms and improvements[J].Frontiers in Microbiology, 2016, 7:1376.
[9] WESCHE A M, GURTLER J B, MARKS B P, et al.Stress, sublethal injury, resuscitation, and virulence of bacterial foodborne pathogens[J].Journal of Food Protection, 2009, 72(5):1121-1138.
[10] AYRAPETYAN M, OLIVER J D.The viable but non-culturable state and its relevance in food safety[J].Current Opinion in Food Science, 2016, 8:127-133.
[11] RAMAMURTHY T, GHOSH A, PAZHANI G P, et al.Current perspectives on viable but non-culturable (VBNC) pathogenic bacteria[J].Frontiers in Public Health, 2014, 2:103.
[12] DING T, LIAO X Y, FENG J S.Stress Responses of Foodborne Pathogens[M].Cham:Springer Nature, 2022.
[13] HOLFORD T R J, DAVIS F, HIGSON S P J.Recent trends in antibody based sensors[J].Biosensors and Bioelectronics, 2012, 34(1):12-24.
[14] PANDEY S.Hybridoma technique for production of monoclonal antibodies[J].International Journal of Pharmaceutical Sciences Review and Research, 2010, 1(2):88-94.
[15] 赵欣悦, 杨晓梅, 孙树阳, 等.纳米抗体的特性及其在免疫检测中的研究进展[J].生命科学, 2021, 33(4):472-478.
ZHAO X Y, YANG X M, SUN S Y, et al.Characteristics of nanobody and its research advances in immunoassay[J].Chinese Bulletin of Life Sciences, 2021, 33(4):472-478.
[16] 陈奇. 单核细胞增生性李斯特菌单克隆抗体、多克隆抗体及单域重链抗体的制备[D].南昌:南昌大学, 2014.
CHEN Q.Preparation of anti-Listeria monocytogenes monoclonal antibody, polyclonal antibodies and single-domain heavy chain antibody[D].Nanchang:Nanchang University, 2014.
[17] BYRNE B, STACK E, GILMARTIN N, et al.Antibody-based sensors:Principles, problems and potential for detection of pathogens and associated toxins[J].Sensors, 2009, 9(6):4407-4445.
[18] HOLLIGER P, HUDSON P J.Engineered antibody fragments and the rise of single domains[J].Nature Biotechnology, 2005, 23(9):1126-1136.
[19] HAMERS-CASTERMAN C, ATARHOUCH T, MUYLDERMANS S, et al.Naturally occurring antibodies devoid of light chains[J].Nature, 1993, 363(6428):446-448.
[20] MUYLDERMANS S.Nanobodies:Natural single-domain antibodies[J].Annual Review of Biochemistry, 2013, 82:775-797.
[21] 严昊, 冯建远, 张子仪, 等.纳米抗体的制备与临床应用研究进展[J].中国畜牧兽医, 2021, 48(2):685-694.
YAN H, FENG J Y, ZHANG Z Y, et al.Progress in preparation and clinical application of nanobody[J].China Animal Husbandry &Veterinary Medicine, 2021, 48(2):685-694.
[22] LI C, TANG Z R, HU Z X, et al.Natural single-domain antibody-nanobody:A novel concept in the antibody field[J].Journal of Biomedical Nanotechnology, 2018, 14(1):1-19.
[23] CHUNGLOK W, WURAGIL D K, OAEW S, et al.Immunoassay based on carbon nanotubes-enhanced ELISA for Salmonella enterica serovar Typhimurium[J].Biosensors and Bioelectronics, 2011, 26(8):3584-3589.
[24] HU Y Z, SUN Y, GU J X, et al.Selection of specific nanobodies to develop an immuno-assay detecting Staphylococcus aureus in milk[J].Food Chemistry, 2021, 353:129481.
[25] ZHANG C, LIU Z L, BAI M F, et al.An ultrasensitive sandwich chemiluminescent enzyme immunoassay based on phage-mediated double-nanobody for detection of Salmonella Typhimurium in food[J].Sensors and Actuators B:Chemical, 2022, 352:131058.
[26] WEI T X, DU D, ZHU M J, et al.An Improved ultrasensitive enzyme-linked immunosorbent assay using Hydrangea-like antibody-enzyme-inorganic three-in-one nanocomposites[J].ACS Applied Materials &Interfaces, 2016, 8(10):6329-6335.
[27] CHEN R, HUANG X L, XU H Y, et al.Plasmonic enzyme-linked immunosorbent assay using nanospherical brushes as a catalase container for colorimetric detection of ultralow concentrations of Listeria monocytogenes[J].ACS Applied Materials &Interfaces, 2015, 7(51):28632-28639.
[28] 范莉. 酶联免疫吸附法在食品检验中的实践应用研究[J].食品安全导刊, 2021(27):135-136.
FAN L.Study on the practical application of enzyme-linked immunosorbent assay in food inspection[J].China Food Safety Magazine, 2021(27):135-136.
[29] GONDHALEKAR C, BIELA E, RAJWA B, et al.Detection of E.coli labeled with metal-conjugated antibodies using lateral-flow assay and laser-induced breakdown spectroscopy[J].Analytical and Bioanalytical Chemistry, 2020, 412(6):1291-1301.
[30] ZENG L, GUO L L, WANG Z X, et al.Gold nanoparticle-based immunochromatographic assay for detection Pseudomonas aeruginosa in water and food samples[J].Food Chemistry:X, 2021, 9:100117.
[31] DUAN M L, HUANG Y M, WU S S, et al.Rapid and sensitive detection of Salmonella enteritidis by a pre-concentrated immunochromatographic assay in a large-volume sample system[J].RSC Advances, 2017, 7(87):55141-55147.
[32] ZHU C J, ZHAO G Y, DOU W C.Core-shell red silica nanoparticles based immunochromatographic assay for detection of Escherichia coli O157∶H7[J].Analytica Chimica Acta, 2018, 1038:97-104.
[33] XIE Q Y, WU Y H, XIONG Q R, et al.Advantages of fluorescent microspheres compared with colloidal gold as a label in immunochromatographic lateral flow assays[J].Biosensors and Bioelectronics, 2014, 54:262-265.
[34] ZHANG B, YANG X S, LIU X X, et al.Polyethyleneimine-interlayered silica-core quantum dot-shell nanocomposites for sensitive detection of Salmonella typhimurium via a lateral flow immunoassay[J].RSC Advances, 2020, 10(5):2483-2489.
[35] HAO M, ZHANG P P, LI B S, et al.Development and evaluation of an up-converting phosphor technology-based lateral flow assay for the rapid, simultaneous detection of Vibrio cholerae serogroups O1 and O139[J].PLoS One, 2017, 12(6):e0179937.
[36] WANG Q, LONG M Y, LV C Y, et al.Lanthanide-labeled fluorescent-nanoparticle immunochromatographic strips enable rapid and quantitative detection of Escherichia coli O157∶H7 in food samples[J].Food Control, 2020, 109:106894.
[37] CHO I H, IRUDAYARAJ J.Lateral-flow enzyme immunoconcentration for rapid detection of Listeria monocytogenes[J].Analytical and Bioanalytical Chemistry, 2013, 405(10):3313-3319.
[38] NGOM B, GUO Y C, WANG X L, et al.Development and application of lateral flow test strip technology for detection of infectious agents and chemical contaminants:A review[J].Analytical and Bioanalytical Chemistry, 2010, 397(3):1113-1135.
[39] ZENG H J, GUO W B, LIANG B B, et al.Self-paired monoclonal antibody lateral flow immunoassay strip for rapid detection of Acidovorax avenae subsp.citrulli[J].Analytical and Bioanalytical Chemistry, 2016, 408(22):6071-6078.
[40] BHARDWAJ N, BHARDWAJ S K, BHATT D, et al.Highly sensitive optical biosensing of Staphylococcus aureus with an antibody/metal-organic framework bioconjugate[J].Analytical Methods, 2019, 11(7):917-923.
[41] CHEN A L, YANG S M.Replacing antibodies with aptamers in lateral flow immunoassay[J].Biosensors and Bioelectronics, 2015, 71:230-242.
[42] HASSAN A H A, BERGUA J F, MORALES-NARVáEZ E, et al.Validity of a single antibody-based lateral flow immunoassay depending on graphene oxide for highly sensitive determination of E.coli O157∶H7 in minced beef and river water[J].Food Chemistry, 2019, 297:124965.
[43] SONG C M, LI J W, LIU J X, et al.Simple sensitive rapid detection of Escherichia coli O157∶H7 in food samples by label-free immunofluorescence strip sensor[J].Talanta, 2016, 156:42-47.
[44] LIU C, FANG S Q, TIAN Y C, et al.An aggregation-induced emission material labeling antigen-based lateral flow immunoassay strip for rapid detection of Escherichia coli O157:H7[J].SLAS Technology, 2021, 26(4):377-383.
[45] BU T, HUANG Q, YAN L Z, et al.Applicability of biological dye tracer in strip biosensor for ultrasensitive detection of pathogenic bacteria[J].Food Chemistry, 2019, 274:816-821.
[46] BU T, WANG J L, HUANG L J, et al.New functional tracer-two-dimensional nanosheet-based immunochromatographic assay for Salmonella enteritidis detection[J].Journal of Agricultural and Food Chemistry, 2019, 67(23):6642-6649.
[47] STEVENS K A, JAYKUS L A.Bacterial separation and concentration from complex sample matrices:A review[J].Critical Reviews in Microbiology, 2004, 30(1):7-24.
[48] KIM T H, PARK J, KIM C J, et al.Fully integrated lab-on-a-disc for nucleic acid analysis of food-borne pathogens[J].Analytical Chemistry, 2014, 86(8):3841-3848.
[49] DAVIS R, IRUDAYARAJ J, REUHS B L, et al.Detection of E.coli O157∶H7 from ground beef using Fourier transform infrared (FT-IR) spectroscopy and chemometrics[J].Journal of Food Science, 2010, 75(6):M340-M346.
[50] CHAI Z L, BI H Y.Capture and identification of bacteria from fish muscle based on immunomagnetic beads and MALDI-TOF MS[J].Food Chemistry:X, 2022, 13:100225.
[51] SHEN Z Q, WANG J F, QIU Z G, et al.QCM immunosensor detection of Escherichia coli O157∶H7 based on beacon immunomagnetic nanoparticles and catalytic growth of colloidal gold[J].Biosensors and Bioelectronics, 2011, 26(7):3376-3381.
[52] ESTEBAN-FERN NDEZ DE
NDEZ DE  VILA B, PEDRERO M, CAMPUZANO S, et al.Sensitive and rapid amperometric magnetoimmunosensor for the determination of Staphylococcus aureus[J].Analytical and Bioanalytical Chemistry, 2012, 403(4):917-925.
VILA B, PEDRERO M, CAMPUZANO S, et al.Sensitive and rapid amperometric magnetoimmunosensor for the determination of Staphylococcus aureus[J].Analytical and Bioanalytical Chemistry, 2012, 403(4):917-925.
[53] WANG S J, XU D P, DING C C, et al.A colorimetric immunoassay for determination of Escherichia coli O157∶H7 based on oxidase-like activity of cobalt-based zeolitic imidazolate framework[J].Mikrochimica Acta, 2020, 187(9):506.
[54] ZHU P X, SHELTON D R, LI S H, et al.Detection of E.coli O157∶H7 by immunomagnetic separation coupled with fluorescence immunoassay[J].Biosensors and Bioelectronics, 2011, 30(1):337-341.
[55] ZHANG Y, TAN C, FEI R H, et al.Sensitive chemiluminescence immunoassay for E.coli O157∶H7 detection with signal dual-amplification using glucose oxidase and laccase[J].Analytical Chemistry, 2014, 86(2):1115-1122.
[56] BU S J, WANG K Y, WANG C Y, et al.Immunoassay for foodborne pathogenic bacteria using magnetic composites Ab@Fe3O4, signal composites Ap@PtNp, and thermometer readings[J].Mikrochimica Acta, 2020, 187(12):679.
[57] BARIZUDDIN S, BALAKRISHNAN B, STRINGER R C, et al.Highly specific and rapid immuno-fluorescent visualization and detection of E.coli O104:H4 with protein-a coated magnetic beads based LST-MUG assay[J].Journal of Microbiological Methods, 2015, 115:27-33.
[58] 李孝权, 王鸣, 易鸿, 等.非可培养状态霍乱弧菌的间接免疫荧光检测[J].中国公共卫生, 2005, 21(12):1437-1438.
LI X Q, WANG M, YI H, et al.Detection of Vibrio cholerae in nonculturable state by indirect immunofluorescent assay[J].China Public Health, 2005, 21(12):1437-1438.
[59] BALAKRISHNAN B, BARIZUDDIN S, WULIJI T, et al.A rapid and highly specific immunofluorescence method to detect Escherichia coli O157:H7 in infected meat samples[J].International Journal of Food Microbiology, 2016, 231:54-62.
[60] CHO I H, MAUER L, IRUDAYARAJ J.In-situ fluorescent immunomagnetic multiplex detection of foodborne pathogens in very low numbers[J].Biosensors and Bioelectronics, 2014, 57:143-148.
[61] 章钢刚, 赖卫华.食源性致病菌免疫学检测方法研究进展[J].食品安全质量检测学报, 2015, 6(9):3414-3419.
ZHANG G G, LAI W H.Research progress of immunological detection methods of foodborne pathogen[J].Journal of Food Safety &Quality, 2015, 6(9):3414-3419.
[62] XIONG J, WANG W W, ZHOU Y L, et al.Ultra-sensitive chemiluminescent detection of Staphylococcus aureus based on competitive binding of Staphylococcus protein A-modified magnetic beads to immunoglobulin G[J].Microchimica Acta, 2016, 183(4):1507-1512.
[63] YANG S J, OUYANG H, SU X X, et al.Dual-recognition detection of Staphylococcus aureus using vancomycin-functionalized magnetic beads as concentration carriers[J].Biosensors and Bioelectronics, 2016, 78:174-180.
[64] MAGLIULO M, SIMONI P, GUARDIGLI M, et al.A rapid multiplexed chemiluminescent immunoassay for the detection of Escherichia coli O157:H7, Yersinia enterocolitica, Salmonella typhimurium, and Listeria monocytogenes pathogen bacteria[J].Journal of Agricultural and Food Chemistry, 2007, 55(13):4933-4939.
[65] LIU D Q, LI T C, HUANG W C, et al.Electrochemiluminescent detection of Escherichia coli O157∶H7 based on Ru(bpy)32+/ZnO nanorod arrays[J].Nanotechnology, 2019, 30(2):025501.
[66] WEI H, WANG E K.Electrochemiluminescence of tris(2,2′-bipyridyl)ruthenium and its applications in bioanalysis:A review[J].Luminescence, 2011, 26(2):77-85.
[67] LI S, LIU J L, CHEN Z T, et al.Electrogenerated chemiluminescence on smartphone with graphene quantum dots nanocomposites for Escherichia coli detection[J].Sensors and Actuators B:Chemical, 2019, 297:126811.
[68] LIN J H, JU H X.Electrochemical and chemiluminescent immunosensors for tumor markers[J].Biosensors and Bioelectronics, 2005, 20(8):1461-1470.
[69] HUANG H, LIU M H, WANG X S, et al.Label-free 3D Ag nanoflower-based electrochemical immunosensor for the detection of Escherichia coli O157:H7 pathogens[J].Nanoscale Research Letters, 2016, 11(1):507.
[70] FELIX F S, ANGNES L.Electrochemical immunosensors-A powerful tool for analytical applications[J].Biosensors and Bioelectronic, 2018, 102:470-478.
[71] LI Y, CHENG P, GONG J H, et al.Amperometric immunosensor for the detection of Escherichia coli O157∶H7 in food specimens[J].Analytical Biochemistry, 2012, 421(1):227-233.
[72] ROUSHANI M, RAHMATI Z, GOLCHIN M, et al.Electrochemical immunosensor for determination of Staphylococcus aureus bacteria by IgY immobilized on glassy carbon electrode with electrodeposited gold nanoparticles[J].Mikrochimica Acta, 2020, 187(10):567.
[73] MUTLAQ S, ALBISS B, AL-NABULSI A A, et al.Conductometric immunosensor for Escherichia coli O157∶H7 detection based on polyaniline/zinc oxide (PANI/ZnO) nanocomposite[J].Polymers, 2021, 13(19):3288.
[74] SILVA N F D, ALMEIDA C M R, MAGALH ES J M C S, et al.Development of a disposable paper-based potentiometric immunosensor for real-time detection of a foodborne pathogen[J].Biosensors and Bioelectronics, 2019, 141:111317.
ES J M C S, et al.Development of a disposable paper-based potentiometric immunosensor for real-time detection of a foodborne pathogen[J].Biosensors and Bioelectronics, 2019, 141:111317.
[75] CHORTI P, KAZI A P, HAQUE A M J, et al.Flow-through electrochemical immunoassay for targeted bacteria detection[J].Sensors and Actuators B:Chemical, 2022, 351:130965.
[76] FARKA Z, JU K T, PASTUCHA M, et al.Enzymatic precipitation enhanced surface plasmon resonance immunosensor for the detection of Salmonella in powdered milk[J].Analytical Chemistry, 2016, 88(23):11830-11836.
K T, PASTUCHA M, et al.Enzymatic precipitation enhanced surface plasmon resonance immunosensor for the detection of Salmonella in powdered milk[J].Analytical Chemistry, 2016, 88(23):11830-11836.
[77] YANG Y, LI G L, WANG P X, et al.Highly sensitive multiplex detection of foodborne pathogens using a SERS immunosensor combined with novel covalent organic frameworks based biologic interference-free Raman tags[J].Talanta, 2022, 243:123369.
[78] WANG P, YU G G, WEI J, et al.A single thiolated-phage displayed nanobody-based biosensor for label-free detection of foodborne pathogen[J].Journal of Hazardous Materials, 2023, 443(Pt A):130157.
[79] 董永贞, 陈瑞, 吴紫荆, 等.铂壳金核纳米酶介导的磁弛豫免疫传感器快速检测食源性沙门氏菌[J].食品科学, 2023, 44(4):337-343.
DONG Y Z, CHEN R, WU Z J, et al.Gold Core@Platinum shell-nanozyme-mediated magnetic relaxation immunosensor for the rapid detection of foodborne Salmonella[J].Food Science, 2023, 44(4):337-343.