β-胡萝卜素是一种天然存在的脂溶性着色剂,广泛存在于水果和蔬菜中[1]。β-胡萝卜素具有多种生物活性,例如抗氧化、抗衰老、抗癌和抗炎等功效[2]。然而,β-胡萝卜素中具有大量的共轭双键,这使得它在食品的生产、贮存或利用过程中易受温度、光或氧气的影响而发生化学降解[3]。为了解决其降解问题,β-胡萝卜素在实际应用中,往往需要被封装在输送系统中,例如水包油乳液,脂质体和乳液凝胶等系统[4-6]。
乳液凝胶通过凝胶化乳液的连续相形成软固体体系,其中油滴被包裹在凝胶网络结构中[7]。乳液凝胶连续相中紧凑的三维网络结构可以抵御对活性物不利的光热环境,为系统中掺入的敏感活性物提供良好的保护[8]。据报道,乳液凝胶可以提高α-生育酚[9]、姜黄素[10]的稳定性。乳液凝胶制备的过程中,蛋白质和多糖基的乳液凝胶因其优异的生物相容性而备受关注。但是蛋白基乳液凝胶往往需要通过高温、强酸强碱等剧烈的交联方式制备,其制备条件的温和性有待提高[11];而多糖基乳液凝胶由于多糖的乳化性能差而导致乳液凝胶的稳定性差,但其交联方法选择较多,其中离子交联法因其前处理少,条件温和以及生物相容性高备受欢迎[12]。相比之下,蛋白-多糖复合乳液凝胶既可以弥补多糖的乳化性能差的问题,又可以弥补蛋白质交联方式温和性不高的问题。有研究指出利用谷氨酰胺转移酶和钙离子双交联分离乳清蛋白和海藻酸钠的乳液凝胶可以提高番茄红素的光化学稳定性以及胃肠道稳定性[13];以酪蛋白胶束和果胶为基质制备乳液凝胶,可以减缓大黄素在胃肠道的释放[6]。由此可见,蛋白-多糖乳液凝胶在包埋、保护以及递送活性物方面具有优异的性能。
螺旋藻分离蛋白(Spirulina isolate protein,SPI)是从蓝藻中分离出来的一种蛋白,具有优异的乳化性[14]。透明质酸(hyaluronic acid,HA)属于糖胺聚糖,具有抗衰老和抗炎等活性,这使得它作为功能性食品成分得到了广泛的应用[15]。另外,由于其高黏弹性和成胶性,HA在构建水凝胶材料中发挥着重要的作用[16]。然而,目前关于SPI-HA乳液凝胶的制备及用于β-胡萝卜素的负载研究鲜有报道。
本文首先以SPI为乳化剂制备了不同油相体积分数的SPI乳液,然后在SPI乳液体系中添加HA制备SPI-HA乳液,探究了不同油相体积分数下2种乳液的光学显微结构及乳液粒径,并以SPI-HA乳液为基质,添加交联剂EDTA-Fe制备不同油相体积分数的乳液凝胶,通过外观以及微观结构选择得到最佳乳液凝胶。之后以β-胡萝卜素为模型活性物,制备包载β-胡萝卜素的乳液凝胶,通过高温保护实验评价了乳液凝胶对β-胡萝卜素的保护效果。
1 材料与方法
1.1 材料与试剂
螺旋藻粉,上海光语生物科技有限公司;透明质酸(分子质量800 000~1 500 000 Da),上海麦克林生化科技有限公司;辛酸/癸酸甘油三酯(caprylic/capric triglyceride,GTCC),广东古莱特新材料有限公司;六水氯化铁(FeCl3·6H2O)、甲苯,上海泰坦科技有限公司;二水乙二胺四乙酸二钠盐(ethylene-diaminetetraacetic acid disodium salt dihydrate,EDTA-2Na),北京伊诺凯科技有限公司;β-胡萝卜素,东京化成工业株式会社;BCA蛋白测定试剂盒,上海碧云天生物技术有限公司。
1.2 仪器与设备
S-4800扫描电子显微镜(scanning electron microscope,SEM),株式会社日立制作所;SpectraMax M2酶标仪,美谷分子仪器(上海)有限公司;SCIENTZ-10N冷冻干燥机,宁波新芝生物科技股份有限公司;T18高速分散机,德国IKA公司;LEICA ICC50显微镜,徕卡股份公司;ME204E电子天平,梅托勒-托利多公司;10 kDa膜分离设备,上海赛普生物科技工程有限公司;DHR-3旋转流变仪,美国TA仪器公司;Nicolet 6700全反射傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR),美国赛默飞世尔科技有限公司;ZetaPALS ζ电位及纳米粒度分析仪,美国布鲁克海文仪器公司;MAZ3000激光衍射粒度分析仪,英国马尔文仪器有限公司。
1.3 实验方法
1.3.1 SPI的制备
以螺旋藻粉为原料,通过反复冻融法制备SPI[17]。通过BCA试剂盒测定SPI的蛋白含量为(88.71±8.04)%。
将螺旋藻粉以质量分数为3%分散于去离子水中并40 ℃下磁力搅拌1 h。然后将分散液放置在-20 ℃下冷冻,35 ℃下水浴融化,反复10次以破碎细胞壁。冻融结束后将分散液于8 000 r/min离心10 min获得上清液。使用超滤膜装置去除10 kDa以下的小分子得到蛋白浓缩液,经冷冻干燥后得到SPI粉末,-20 ℃下贮存备用。
1.3.2 SPI乳液的制备
将SPI粉末分散于去离子水中,磁力搅拌2 h,水化12 h使其充分分散,制备质量分数为5%的SPI分散液作为水相(pH=5.8),与GTCC按照4∶1、3∶2、2∶3和1∶4(体积比)的比例混合,室温条件下,用高速剪切均质机以16 000 r/min的转速乳化2 min,制备油相体积分数分别为20%、40%、60%、80%的SPI乳液。
1.3.3 SPI-HA乳液的制备
将HA粉末添加到不同油相体积分数的SPI乳液中,磁力搅拌2 h,水化12 h使其充分分散,其中HA在水相中的最终质量分数为1%。室温条件下,用高速剪切均质机以16 000 r/min的转速乳化2 min,制备油相的体积分数分别为20%、40%、60%的SPI-HA乳液。
1.3.4 SPI、HA、SPI-HA分散液zeta电位测试
将HA粉末添加到SPI分散液中,磁力搅拌2 h,水化12 h使其充分分散以制备SPI-HA分散液。将 SPI、HA、SPI-HA分散液样品中SPI和HA稀释至质量分数为1%,然后使用zeta电位分析仪测定。
1.3.5 乳液光学显微镜及粒径测试
使用去离子水稀释乳液,采用光学显微镜观察乳液液滴;采用激光衍射粒度分析仪测定乳液液滴的粒径,设置分析条件:颗粒折射率1.45,颗粒吸收率0.001,分散剂(水)折射率1.33,激光遮光度1.5%左右。
1.3.6 乳液凝胶的制备
乳液凝胶的制备参考TIAN等[12]的方法,并稍作修改。将FeCl3·6H2O和EDTA-2Na以2∶1的摩尔比溶解在去离子水中形成0.4 mmol/L的交联剂EDTA-Fe。300 mg油相体积分数为20%、40%和60%的SPI-HA乳液分别添加60、45、30 μL的EDTA-Fe。将混合物在600 r/min下搅拌1 min以制备不同油相体积分数的乳液凝胶,将其分别记为H-20%、H-40%、H-60%。
1.3.7 乳液凝胶的微观结构
以甲苯为油相,其他条件均与1.3.2节、1.3.3节和1.3.5节的方法相同。制备的乳液凝胶样品冷冻干燥后,在3.0 kV加速电压下,用扫描电子显微镜对乳液凝胶的微观结构进行表征。
1.3.8 FTIR测量
利用FTIR光谱获得SPI-HA乳液和乳液凝胶的分子相互作用的信息。红外光谱以4 cm-1的分辨率测量,平均扫描32次,扫描范围600~4 000 cm-1。
1.3.9 流变测试
利用DHR-3旋转流变仪对油相体积分数为60%的SPI乳液、SPI-HA乳液和乳液凝胶的流变性能进行了表征。实验参数设定为:温度25 ℃,平板20 mm,间隙1 mm。应变扫描:频率固定为1 Hz、应力变化范围0.1%~100%;频率扫描:应力选定处于线性黏弹区为0.5%、角频率变化范围0.1~50 rad/s;剪切速率0.01~100 s-1。
1.3.10 β-胡萝卜素的包封
将1 mg/mL β-胡萝卜素溶于GTCC中,磁力搅拌6 h至β-胡萝卜素完全溶解。将含有β-胡萝卜素的GTCC作为油相并按照上述1.3.2节,1.3.3节和1.3.5节方法制备油相体积分数为60%的乳液凝胶。
1.3.11 β-胡萝卜素的高温保护
活性物的高温保护参考了LU等[18]的方法,并稍作修改。将空白GTCC油相、乳液凝胶置于70 ℃水浴锅中分别加热2、4、6、8 h,向热处理后的乳液凝胶体系中添加40 μL浓度为10 mol/L的NaOH溶液破坏结构之后加入5 mL乙醇与正己烷混合液破乳并萃取(乙醇与正己烷的体积比为2∶3)。将分散液在7 000 r/min下离心5 min,取上清液,使用酶标仪测定上清液在450 nm处的吸光度。β-胡萝卜素的保留率通过公式(1)进行计算:
保留率![]()
(1)
式中,At,t时测定的β-胡萝卜素吸光度;A0,时间0 h时测定的β-胡萝卜素吸光度。
1.4 数据统计分析
所有实验重复3次,数据以平均值±标准偏差表示。采用Origin 9软件作图。
2 结果与分析
2.1 SPI和SPI-HA乳液的光学显微结构及粒径分析
在水相SPI质量分数为5%,pH值为5.8的条件下制备不同油相体积分数下的SPI乳液和SPI-HA乳液。如图1-a所示,SPI乳液出现乳析现象,并且油相体积分数越高,乳析程度越低;但是当油相体积分数达到80%时,油相析出,这可能是由于乳化剂不足以覆盖界面时,低覆盖率下的乳液液滴会絮凝并导致不规则界面的形成,导致油水相分离,这表明该浓度下的SPI无法乳化过高比例的油相[19]。因此后续实验不再考虑该油相体积分数。当HA引入到SPI乳液中,乳液并未出现乳析现象(图1-b),针对这一现象本文对SPI、HA、SPI-HA分散液的电位进行测定,发现HA的引入将SPI分散液的电位绝对值从(24.54±1.14) mV提高到(39.47±0.64) mV(表1),有研究表明,HA可以通过提高蛋白的电位绝对值从而增加了水油界面乳化剂的静电斥力和空间位阻,并在一定程度下阻止乳液液滴絮凝和乳析现象的发生[20]。对油相体积分数为20%~60%的乳液进行光学显微镜观察(如图1-c),乳液液滴外观均呈现球形,当HA引入到乳液中,乳液液滴粒径很明显的下降。以油相体积分数为60%的SPI乳液和SPI-HA乳液为例,乳液粒径从(22.30±1.13) μm减小到(4.58±0.08) μm (表2),这是由于HA的加入使分子位阻增大,同时HA之间的静电斥力会降低乳液粒径[20]。随着油相体积分数的增加,SPI乳液和SPI-HA乳液粒径均无明显变化,这可能是由于当乳化剂含量高于完全包裹界面所需的临界含量时,液滴大小受油相分数的影响变小。
表1 SPI、HA、SPI-HA分散液的zeta电位分析
Table 1 Zeta potential analysis of SPI, HA, and SPI-HA dispersions

分散液电位/mVSPI-24.54±1.14HA-49.83±2.26SPI-HA-39.47±0.64
表2 不同油相体积分数(20%、40%、60%)的SPI乳液和SPI-HA乳液的粒径分析
Table 2 Droplets size analysis of SPI emulsions and SPI-HA emulsions with various oil phase volume fractions (20%, 40%, 60%)

油相体积分数/%SPI乳液D4,3/μmSPI-HA乳液D4,3/μm2021.46±0.266.67±0.234021.70±0.455.41±0.166022.30±1.134.58±0.08

a-不同油相体积分数(20%、40%、60%和80%)的SPI乳液外观图;b-SPI-HA乳液外观图;c-SPI乳液和SPI-HA乳液光学显微镜图
图1 乳液的外观图和光学显微镜图
Fig.1 Appearance and optical micrograph of emulsions
2.2 乳液凝胶的制备
图2为乳液凝胶的制备示意图,首先制备SPI乳液,添加HA之后再均质制备SPI-HA乳液,最后添加交联剂EDTA-Fe,通过简单搅拌即可得乳液凝胶,交联机理为EDTA-Fe中的Fe3+与HA和SPI上的羧基进行离子交联形成配位键,从而形成三维网络结构[12]。下面本文对乳液凝胶的制备进行了相应的实验表征。
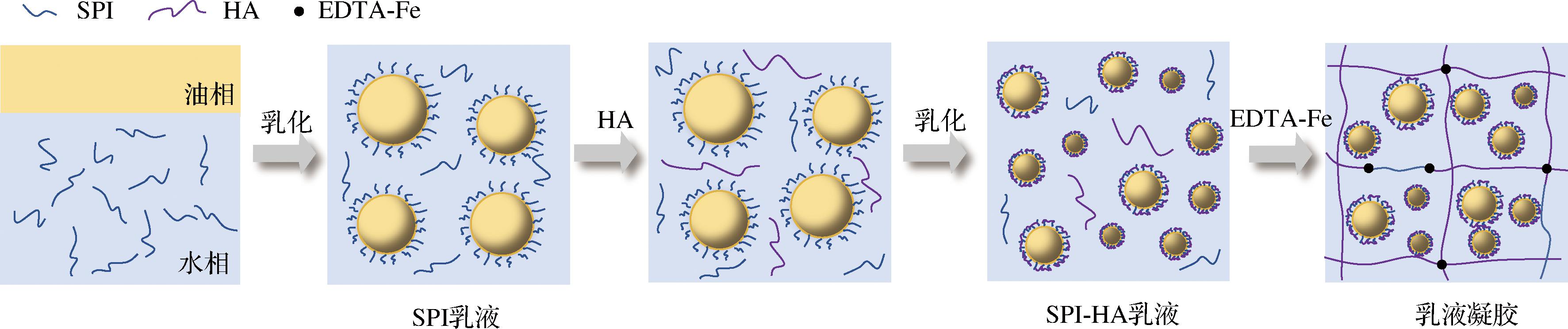
图2 乳液凝胶制备示意图
Fig.2 Schematic of the preparation of the emulsion hydrogels
本文首先通过外观图来证明乳液凝胶的成功制备。如图3所示,油相体积分数为20%和40%的SPI-HA乳液呈现倒置流动的状态,当添加交联剂之后,其流动性均变差。其中油相体积分数为40%的乳液凝胶倒置完全不流动,这是由于加入的交联剂形成的凝胶网络限制了乳液的流动,这从外观上证明了乳液凝胶的成功制备。与此同时,本文发现油相体积分数为60%制备的SPI-HA乳液和乳液凝胶均倒置不流动,这是由于油相体积增加导致油滴数量增多,产生了强大的范德华力等非共价作用从而增加了体系黏度[21]。

图3 不同油相体积分数(20%、40%、60%)制备的SPI-HA乳液和乳液凝胶的小瓶倒置图
Fig.3 Inverted vial diagram of SPI-HA emulsions and emulsion hydrogels with various oil phase volume fractions (20%, 40%, 60%)
图4为不同油相体积分数的乳液和乳液凝胶的红外光谱,证明了配位键的形成,很明显由图4-b看出乳液凝胶在1 740 cm-1下出现了新的峰,有研究指出这个新的峰代表Fe3+与来自EDTA和HA以及SPI中的羧基络合之后产生的峰[12]。这表明EDTA-Fe成功交联连续相中的HA和SPI并形成凝胶网络结构。
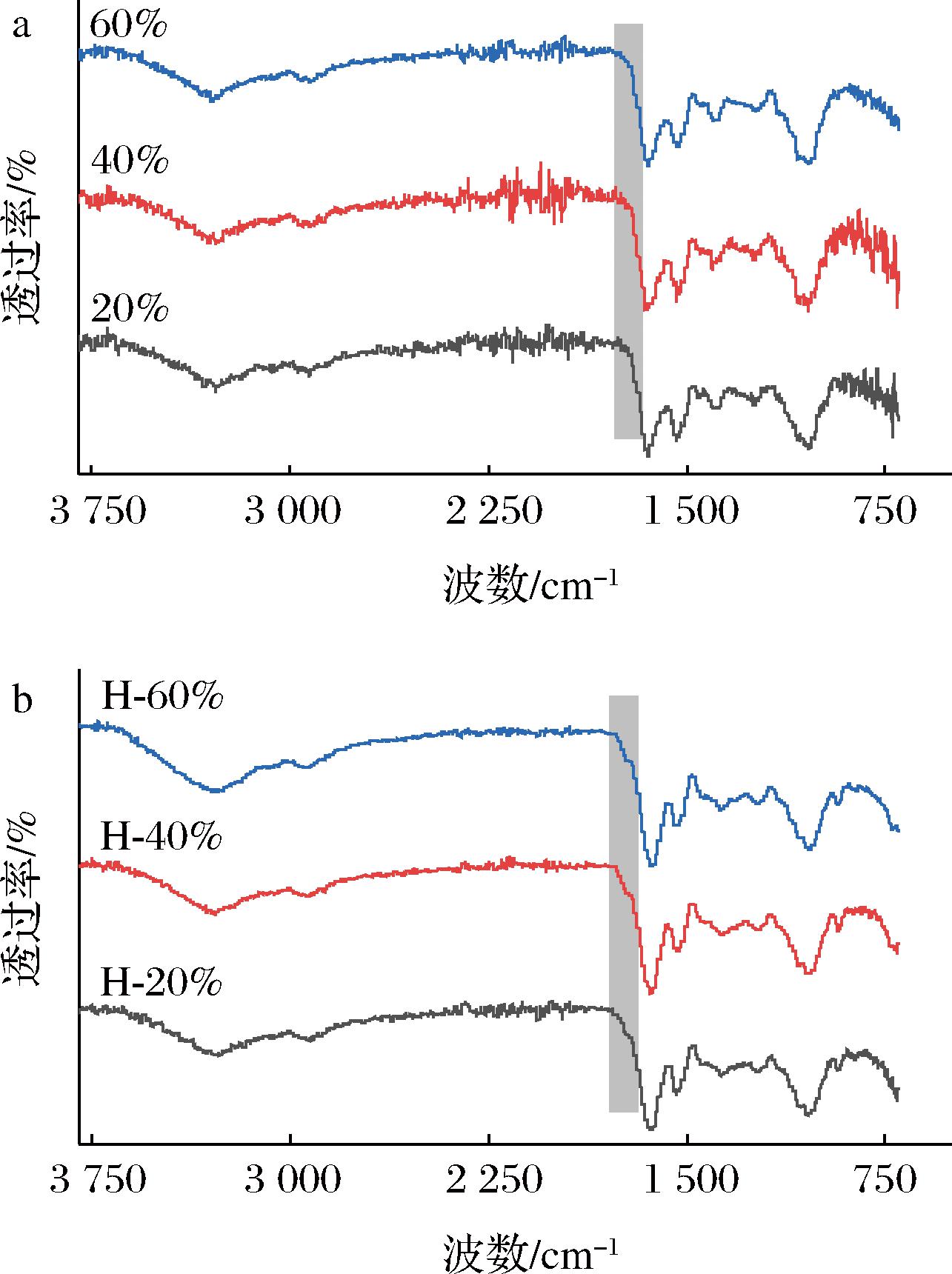
a-不同油相体积分数(20%、40%、60%)制备的SPI-HA乳液红外图;b-乳液凝胶红外图
图4 SPI-HA乳液和乳液凝胶的红外图
Fig.4 The FTIR of SPI-HA emulsions and emulsion hydrogels
为了进一步探究乳液凝胶的形成,本文使用甲苯为油相探究了不同油相体积分数对乳液凝胶微观结构的影响。由图5可以看出,所有样品均呈现三维网络结构,这证明了乳液凝胶的成功制备。当油相体积分数为20%时,乳液黏度低且水相远远高于油相体积导致油滴数量少,从而形成的乳液凝胶结构孔径更大且不规则,这与上述的外观图一致。当油相体积分数增加到60%,乳液凝胶结构更为致密且均一。随着油相体积分数的增加,更多的油滴紧密排列在凝胶网络中,制备得到的乳液凝胶结构也会更加致密[22]。致密的结构将有利于活性物的保护,而更高的油相体积分数将有利于包载更多的活性物,基于以上实验结果,本文选定油相体积分数为60%乳液凝胶进行后续的β-胡萝卜素缓释实验。

a-H-20%;b-H-40%;c-H-60%电镜图
图5 乳液凝胶的电镜图
Fig.5 SEM of emulsion hydrogels
为了更好地研究HA和交联剂对乳液的影响,在进行活性物包载实验之前,本文对油相体积分数为60%的SPI乳液、SPI-HA乳液和乳液凝胶进行了流变测试,其中G′为储存模量,反映样品结构的弹性行为,G″为损耗模量,反映样品结构的黏性特性,G′=G″代表屈服应力值,该值越高代表材料越稳定[23]。由图6-a和图6-b可以得到所有样品的G′都高于G″,说明所有样品均具有类弹性固体性质。由图6-c得到所有样品的表观黏度均随着剪切速率的升高而减小,这是由于乳液内部的结构被破坏,流动阻力降低,从而使表观黏度降低[24]。SPI-HA乳液的屈服应力值,G′,G″和表观黏度均高于SPI乳液,这是由于较小粒径的乳液液滴具有更高的比表面积,可增加油滴与连续相间的相互作用力[8]。交联剂加入后的乳液凝胶具有最高的屈服应力值,G′,G″和表观黏度,这是由于在乳液连续相中形成的凝胶网络结构使乳液的力学性能得到极大的增强[13]。
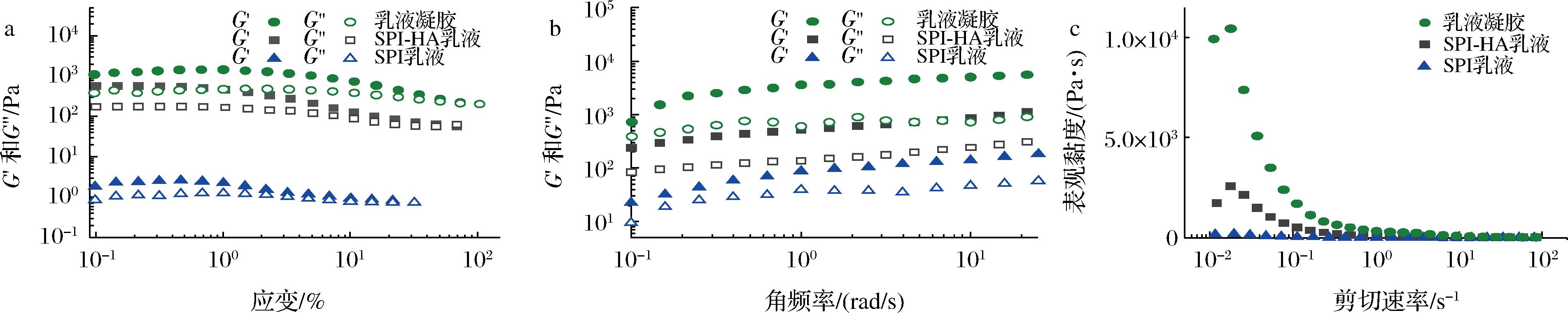
a-SPI乳液,SPI-HA乳液和乳液凝胶的应力扫描;b-频率扫描;c-表观黏度
图6 乳液和乳液凝胶的流变性能
Fig.6 Rheological properties of emulsions and emulsion hydrogels
2.3 β-胡萝卜素的包封及保护
基于以上工作,本文使用油相体积分数为60%乳液凝胶对β-胡萝卜素进行包载。如图7-a所示,从外观和显微镜图可以看出来包载β-胡萝卜素的SPI乳液液滴呈现球形,并且添加HA之后乳液液滴粒径依然大幅降低。包载β-胡萝卜素后的SPI乳液和SPI-HA乳液粒径为(27.77±1.23) μm和(6.15±0.15) μm,粒径与未包载活性物的乳液相比均呈现轻微增大的趋势(图7-b)。

a-SPI乳液和SPI-HA乳液外观图,光学显微镜图;b-SPI乳液和SPI-HA乳液粒径分布
图7 乳液外观图、光学显微镜图和粒径分布
Fig.7 Appearance, optical micrographs, and droplets size distribution of emulsion
对乳液凝胶包埋体系中β-胡萝卜素的热稳定性进行分析。由图8可知,相较与空白组,乳液凝胶对β-胡萝卜素的保留率提升十分显著,样品加热8 h后β-胡萝卜素的保留率可达(78.83±2.75)%,对比空白组β-胡萝卜素保留率提高了59%以上。基于以上关于微观结构以及流变的结果分析,乳液凝胶中SPI良好的乳化性、HA的高黏度以及添加交联剂之后形成的凝胶网络结构降低了热穿透和传递效率,同时也限制了自由基和氧气扩散到液滴,从而能够有效提升高温状态下β-胡萝卜素的稳定性[25]。
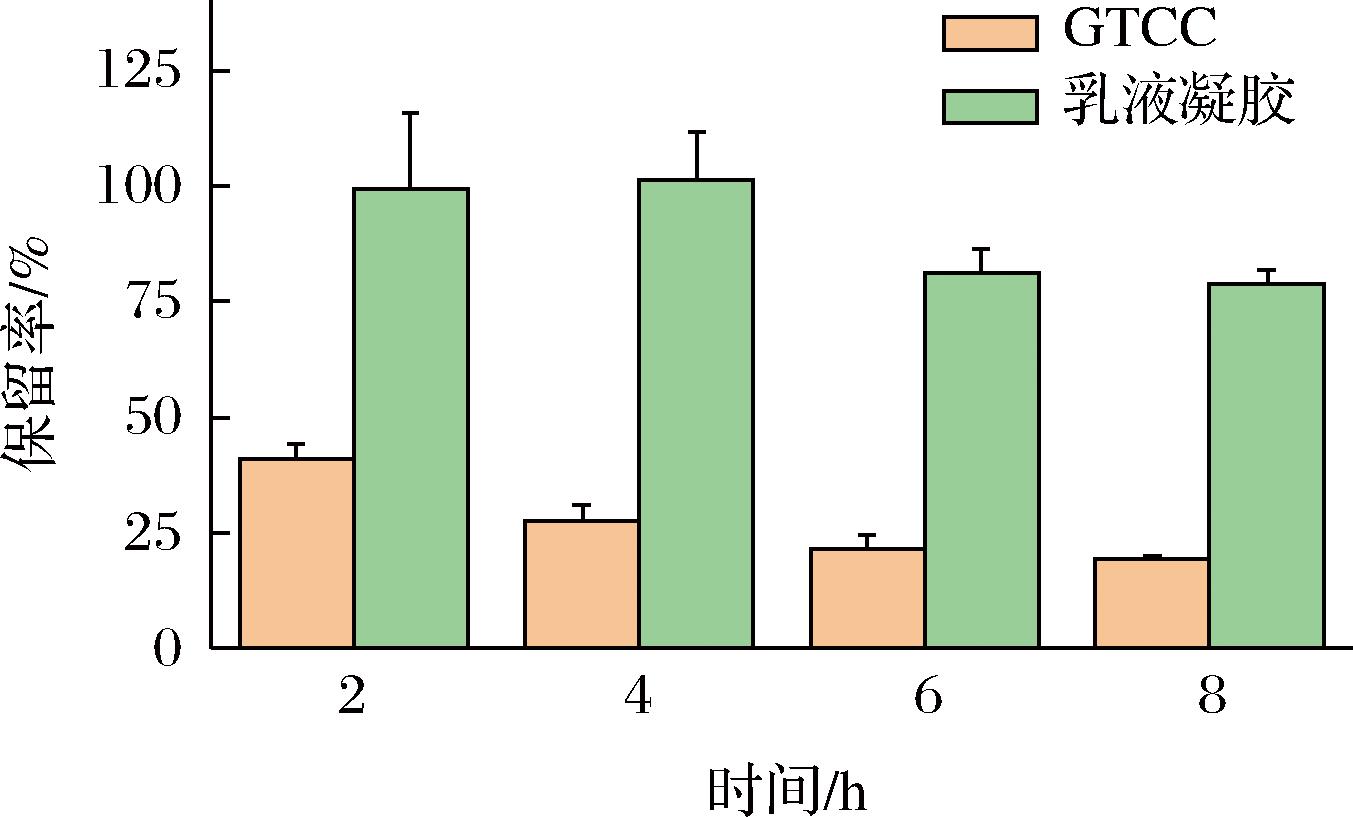
图8 β-胡萝卜素的热稳定性分析
Fig.8 Thermal stability analysis of β-carotene
3 讨论与结论
HA作为一种天然多糖,可以显著降低SPI乳液的粒径。随着油相体积分数的增加,乳液体系黏度不断增加,乳液凝胶体系的网络结构越来越致密均匀。当油相体积分数在60%时,HA和EDTA-Fe的引入导致所形成的SPI-HA乳液和乳液凝胶体系的G′及表观黏度均得到提高,而这些性质的改变有利于提高乳液凝胶体系对 β-胡萝卜素高温下的保护。β-胡萝卜素经乳液凝胶包载后,在高温下的保留率得到大大提升。综上所述,SPI-HA乳液凝胶制备简单,可以有效对β-胡萝卜素提供保护。
[1] BHATT T, PATEL K.Carotenoids:Potent to prevent diseases review[J].Natural Products and Bioprospecting, 2020, 10(3):109-117.
[2] 李超, 贾炳玉, 高民, 等.β-胡萝卜素的生物学作用及其机理[J].动物营养学报, 2018, 30(8):2931-2937.
LI C, JIA B Y, GAO M, et al.Biological functions and its mechanisms of β-carotene[J].Chinese Journal of Animal Nutrition, 2018, 30(8):2931-2937.
[3] 郭静, 孙晓琳, 潘思轶.环境因素对β-胡萝卜素复合纳米粒子稳定性的影响[J].食品科学, 2022, 43(16):90-97.
GUO J, SUN X L, PAN S Y.Effect of environmental conditions on the stability of β-carotene nanoparticles[J].Food Science, 2022, 43(16):90-97.
[4] ROOHINEJAD S, OEY I, WEN J Y, et al.Formulation of oil-in-water β-carotene microemulsions:Effect of oil type and fatty acid chain length[J].Food Chemistry, 2015, 174:270-278.
[5] TAN C, ZHANG Y T, ABBAS S, et al.Modulation of the carotenoid bioaccessibility through liposomal encapsulation[J].Colloids and Surfaces B:Biointerfaces, 2014, 123:692-700.
[6] 瓦文强, 秦娟娟, 杨敏, 等.酪蛋白胶束乳液凝胶性质及其在大黄素负载中的应用[J].食品与发酵工业, 2023, 49(1):132-139.
WA W Q, QIN J J, YANG M, et al.Properties of emulsion gel based on casein micelles and its application in emodin loading[J].Food and Fermentation Industries, 2023, 49(1):132-139.
[7] DICKINSON E.Emulsion gels:The structuring of soft solids with protein-stabilized oil droplets[J].Food Hydrocolloids, 2012, 28(1):224-241.
[8] 刁小琴, 李曦, 孙薇婷, 等.乳液凝胶的构建及应用研究进展[J].食品安全质量检测学报, 2022, 13(4):1036-1043.
DIAO X Q, LI X, SUN W T, et al.Research progress in the fabrication and application of emulsion gels[J].Journal of Food Safety and Quality, 2022, 13(4):1036-1043.
[9] LIANG L, LEUNG SOK LINE V, REMONDETTO G E, et al.In vitro release of α-tocopherol from emulsion-loaded β-lactoglobulin gels[J].International Dairy Journal, 2010, 20(3):176-181.
[10] GEREMIAS-ANDRADE I M, SOUKI N P D B G, MORAES I C F, et al.Rheological and mechanical characterization of curcumin-loaded emulsion-filled gels produced with whey protein isolate and xanthan gum[J].LWT, 2017, 86:166-173.
[11] TANG Z Q, HE H C, ZHU L, et al.A general protein unfolding-chemical coupling strategy for pure protein hydrogels with mechanically strong and multifunctional properties[J].Advanced science, 2022, 9(5):e2102557.
[12] TIAN R, QIU X Y, YUAN P Y, et al.Fabrication of self-healing hydrogels with on-demand antimicrobial activity and sustained biomolecule release for infected skin regeneration[J].ACS Applied Materials &Interfaces, 2018, 10(20):17018-17027.
[13] LIU F G, LIANG X P, YAN J, et al.Tailoring the properties of double-crosslinked emulsion gels using structural design principles:Physical characteristics, stability, and delivery of lycopene[J].Biomaterials, 2022, 280:121265.
[14] BÖCKER L, BERTSCH P, WENNER D, et al.Effect of Arthrospira platensis microalgae protein purification on emulsification mechanism and efficiency[J].Journal of Colloid and Interface Science, 2021, 584:344-353.
[15] CHEN S, HAN Y, H WANG Y Q, et al.Zein-hyaluronic acid binary complex as a delivery vehicle of quercetagetin:Fabrication, structural characterization, physicochemical stability and in vitro release property[J].Food Chemistry, 2019, 276:322-332.
[16] KOV CS A N, VARGA N, JUH
CS A N, VARGA N, JUH SZ
SZ  , et al.Serum protein-hyaluronic acid complex nanocarriers:Structural characterisation and encapsulation possibilities[J].Carbohydrate Polymers, 2021, 251:117047.
, et al.Serum protein-hyaluronic acid complex nanocarriers:Structural characterisation and encapsulation possibilities[J].Carbohydrate Polymers, 2021, 251:117047.
[17] DING J J, LI Y X, WANG Q B, et al.Pickering high internal phase emulsions with excellent UV protection property stabilized by Spirulina protein isolate nanoparticles[J].Food Hydrocolloids, 2023, 137:108369.
[18] LU Y, MAO L K, CUI M N, et al.Effect of the solid fat content on properties of emulsion gels and stability of β-carotene[J].Journal of Agricultural and Food Chemistry, 2019, 67(23):6466-6475.
[19] GOMES A, COSTA A L R, CUNHA R L.Impact of oil type and WPI/Tween 80 ratio at the oil-water interface:Adsorption, interfacial rheology and emulsion features[J].Colloids and Surfaces. B, Biointerfaces,2018, 164:272-280.
[20] WANG N Z, ZHAO X, JIANG Y Q, et al.Enhancing the stability of oil-in-water emulsions by non-covalent interaction between whey protein isolate and hyaluronic acid[J].International Journal of Biological Macromolecules, 2023, 225:1085-1095.
[21] 吴彤, 冯进, 黄午阳, 等.牛蒡果胶多糖/玉米醇溶蛋白复合颗粒稳定的Pickering乳液构建及对姜黄素的递送功效[J].食品科学, 2023, 44(14):37-46.
WU T, FENG J, HUANG W Y, et al.Fabrication of Pickering emulsions stabilized by burdock rhamnogalacturonan I (RG-1)-type pectin/zein composite particles and their utilization for the delivery of curcumin[J].Food Science, 2023, 44(14):37-46.
[22] 王小庆, 任健.不同油相比例对黑豆分离蛋白乳液凝胶特性的影响[J].中国油脂, 2018, 43(1):103-106.
WANG X Q, REN J.Influences of oil volume fraction on properties of black bean protein isolate emulsion gel[J].China Oils and Fats, 2018, 43(1):103-106.
[23] KIM H S, MASON T G.Advances and challenges in the rheology of concentrated emulsions and nanoemulsions[J].Advances in Colloid and Interface Science, 2017, 247:397-412.
[24] LIU H, XU X M, GUO SH D.Rheological, texture and sensory properties of low-fat mayonnaise with different fat mimetics[J].LWT-Food Science and Technology, 2007, 40(6):946-954.
[25] 吕静雯, 曹杨, 刘潇, 等.卵磷脂对乳清分离蛋白乳液性质和乳液凝胶结构特性及其所负载β-胡萝卜素的影响[J].食品安全质量检测学报, 2023, 14(7):164-172.
LYU J W, CAO Y, LIU X, et al.Effects of lecithin on the emulsion properties, emulsion gel structure characteristics and its loaded β-carotene of whey isolate protein[J].Journal of Food Safety &Quality, 2023, 14(7):164-172.