脂质代谢是生物体内重要且复杂的生化反应,即脂肪在生物内体被消化吸收及合成与分解的过程。正常的脂质代谢能为机体提供所需的物质,保证正常的生理功能运转,对于生命活动具有重要意义。随着生活水平的不断提高,我们的膳食结构中包含了越来越多高热量的食物,这是导致脂质代谢发生异常的主要原因之一。积极预防和控制住脂质代谢紊乱,有利于其他代谢疾病的防治,利于我们的生命健康。
在脂质代谢的过程中,脂肪的消化在各种酶及胆汁酸作用下,水解为甘油、脂肪酸等。脂类被消化后,中链、短链脂肪酸在乳化后即可被吸收入静脉血;长链脂肪酸与载脂蛋白、胆固醇等结合成乳糜微粒,经淋巴入血。吸收后的代谢过程主要包括甘油三酯、磷脂、胆固醇、血浆脂蛋白四类脂类物质的代谢,整个代谢过程受胰岛素和胰高血糖素、饮食营养、生化酶活性等复杂而精密的调控[1],因而脂类物质在体内消化吸收、合成分解及运转任何一个环节异常都称为脂质代谢异常。脂代谢异常通常包括高胆固醇、高甘油三酯、低密度脂蛋白升高,高密度脂蛋白降低,严重时可以引起脂肪肝、高血脂、动脉粥样硬化等疾病的发生。
近年来,大量研究发现肠道生态系统与脂质代谢、体重增加和相关健康问题有着紧密的联系。肠道菌群(gut microbiota, GM)控制着摄入食物的处理方式,影响人体能量营养物质的代谢过程,在脂质代谢途径上,肠道菌群及代谢产物从脂肪的吸收分解效率、相关酶活性、激素分泌等方面来影响其代谢水平。茶是一种广泛流行的健康饮料,其抗肥胖作用部分也来源于调节肠道菌群。茶叶活性成分对机体的肠道微生态有直接作用,可以调节菌群稳态,间接影响脂质代谢,预防和治疗肥胖及相关的代谢疾病。本文综述了近年来茶叶活性成分通过调节肠道微生态的生物学功能来影响脂质代谢的作用,为相关研究提供最新的理论参考。
1 茶叶活性成分与肠道菌群相互作用调节脂质代谢
近年来,肠道微生态系统是人体四大微生态中最为主要、复杂的系统,其核心由正常的肠道菌群构成。肠道微生物量约占人体微生物总量的80%,一个健康成年人的肠道中有超过100万亿个微生物,种类数量多达400~500种,特定的微生物在机体内占据着特定的生态位,影响肝脏和肌肉细胞的能量状态,以及脂肪组织中脂质的积累,从而影响我们的健康状况[2]。
近年来,肠道微生物与宿主代谢之间的联系引起了研究者的广泛关注,随着基因组分析技术的发展,研究人员可以更清晰地了解肠道菌群的组成,更全面地了解饮茶对肠道菌群的调节作用,并从肠道菌群的角度解读茶与脂质代谢的关系。目前,茶叶中已知的化学成分有700多种,它们不仅影响着茶色、香、味的形成,对茶叶的营养、健康功效也发挥着重要作用,其中能作用于肠道菌群并影响脂质代谢的成分主要包括茶多酚、茶多糖、茶色素、咖啡碱等。
1.1 茶多酚与肠道菌群相互作用影响脂质代谢
茶多酚(tea polyphenols,TP)是茶叶中多酚类化合物的总成,是茶叶中最丰富的功能成分。在调节脂肪代谢方面,茶多酚能抑制脂肪酶活性,从而达到降血脂功效[3];可以上调生热基因表达和线粒体生物发生,减少脂肪细胞脂质聚集抑制脂肪生成[4]。在近研究中,研究者发现茶多酚能与肠道菌群相互作用,茶多酚能直接调节肠道氧化还原状态和菌群组丰度[5],也能被肠道微生物进一步转化,作用于机体脂质代谢过程。
WANG等[6]研究发现,饲喂高脂肪饮食的小鼠出现明显的肠道菌群紊乱,小鼠肠道微生物结构和多样性发生改变,厚壁菌门(Firmicutes)/拟杆菌门(Bacteroidetes)值(F/B值)显著升高。拟杆菌可以通过促进棕色脂肪中的支链氨基酸分解来抑制肥胖,厚壁菌则会通过调节脂肪酸流入和脂肪的生成来参与脂质代谢。当肠内处于厚壁菌门多于拟杆菌门状态时,易导致机体能更有效吸收食物中的热量从而导致脂肪积累形成肥胖。经茶多酚调节后小鼠肠道微生物的丰度和多样性显著提高,也逆转了高脂肪饮食导致的F/B值过高。LI等[7]的研究结果表明,茶多酚降低了高脂肪饮食小鼠肠道中梭状芽孢杆菌(可分解碳水化合物产生各种有机酸)的相对丰度,增加了厚壁细菌的相对丰度。ZHOU等[8]发现茶多酚能够改善大鼠肠道微生物三羧酸循环和尿素循环,从而提高大鼠的能量转化效率,有助于降低血糖和胆固醇水平。儿茶素在改变肠道菌群的过程中,促进肠道嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila,Akk)的生长和双歧杆菌(Bifidobacterium)的丰度。Akk菌及双歧杆菌都属于益生菌,其中双歧杆菌在肠道内能促进营养物质的吸收,产生乳酸、乙酸、丙酸等,增强肠道蠕动;Akk菌通过与几种确定的脂质代谢物质直接相互作用来影响宿主的脂质平衡,包括改变内毒素水平、短链脂肪酸生成及增加脂肪组织中的脂肪酸氧化[9]。模拟茶多酚胃肠消化的体外实验表明,茶多酚在小肠中能被直接吸收的部分不到20%[10],但经消化道消化后,茶多酚可以被微生物进一步代谢转化,一部分进入血液参与人体代谢,一部分排出体外。肠道菌群的存在增强了机体分解和吸收茶多酚的能力,提高了茶叶活性物质参与调控代谢的比率[11]。
茶多酚作为茶叶中具有多种保健功能的物质之一,可作为功效成分运用到多个领域。茶叶多酚类物质与肠道菌群的相互作用是其在体内发挥的降脂作用中的重要途径,经微生物分解后,能更大程度地参与到机体内多项代谢途径,因此明确茶多酚与肠道菌群间的作用关系对其发挥健康功效的研究具有指导意义。
1.2 茶多糖调节肠道菌群影响脂质代谢
茶多糖(tea polysaccharides,TPS)是茶叶中一类具有生理活性的复合多糖,由糖类、果胶、蛋白质等组成,其在不同茶叶原料中含量有所不同,同种茶类老叶含量高于嫩叶[12]。茶多糖具有多种生物活性,如抗氧化[13]、降血糖[14]、抗肥胖[15]、免疫调节[16]等作用。在发挥抗肥胖的作用中,茶多糖可通过调节肠道菌群紊乱、改善菌群结构组成,维护肠道屏障功能,影响脂质代谢[17]。利用高通量测序手段,研究者发现利用茶多糖干预可以显著调节高脂膳食小鼠肠道微生物的多样性和菌群的整体结构,中剂量和高剂量茶多糖干预后的模型小鼠与正常膳食小鼠具有相似肠道微生物组成。李祎等[18]发现茶多糖的摄入可显著降低F/B值的值,上调多种有益菌属的丰度。茶多糖调节的有益菌属包括拟杆菌属、普氏菌属(Prevotella)、瘤胃球菌属(Ruminococcaceae)等,这些有益菌属通过促进高血脂症大鼠结肠中丙酸、丁酸和总短链脂肪酸(short chain fatty acids,SCFAs)含量增加,影响肠道屏障功能和糖异生等代谢,抑制胆固醇积累和脂肪的合成,达到调节血脂的作用。研究证明,茶多糖在逆转高脂饮食诱导的肠道菌属F/B值改变的同时,可通过靶向肠道Akk菌[19],参与调节脂肪产热功能、抑制肥胖,改善糖代谢[20]。
茶多糖具有抑制肥胖、高脂血症、改善肠道屏障的功能,多项研究发现茶多糖干预能显著减轻高脂肪饮食喂养大鼠的肠道微生物群失调。据此,茶多糖具有作为治疗肥胖和肠道菌群失调的益生元制剂的潜力。
1.3 咖啡碱调节肠道菌群影响脂质代谢
咖啡碱是茶叶生物碱中的主要成分,约占茶叶干重的2%~5%,咖啡碱能对肠道菌群丰度和均匀度产生影响,进而影响脂质代谢[21]。咖啡碱能够促进黏液真杆菌(Eubacterium limosum)、双歧杆菌和普拉梭菌(Faecalibacterium prausnitzii)等菌属的生长[22],这与机体内SCFAs的代谢密切相关,SCFAs与G蛋白偶联受体43(G protein-coupled receptor 43, GPR43)结合能影响胰岛素的分泌,还可使脂肪细胞凋亡,降低脂肪堆积。研究表明,用高咖啡碱的茶叶干预高脂饮食的小鼠后,普拉梭菌丰度显著增加,该菌是一种产生丁酸的细菌,对人体能量代谢有积极影响,并具有抗炎作用,同时咖啡碱的摄入也影响着拟杆菌的数量[23],有利于肠道分解复杂的糖类、蛋白质和脂质。
1.4 茶多酚与肠道菌群相互作用影响脂质代谢
茶色素是茶多酚及其聚集物在发酵过程中,经多酚氧化酶和过氧化物酶作用后产生的具有生物活性的氧化产物。茶黄素、茶红素、茶褐素三类天然色素均属于茶色素,且均可调节肠道菌群物种丰度、多样性以及菌群的结构,起到抑制肥胖的功效[24]。茶褐素提取物可增加代谢性疾病患者肠道菌群的丰度,靶向上调可产生SCFAs的细菌,包括普氏菌和拟杆菌,帮助分解蛋白质和碳水化合物,改善胰岛素抵抗,显著降低高血糖、胰岛素抵抗和血脂水平[25]。蒋慧颖等[26]通过高通量测序发现茶黄素、茶红素、茶褐素喂养肥胖小鼠后,大鼠肠道内容物肠道菌群丰度及多样性的降低,表现在F/B值降低,乳杆菌(Lactobacillus)、Akk菌和毛螺菌(Lachnospira)相对丰度回升,抑制了肥胖小鼠体重的增长。
2 茶叶活性成分与肠道菌群相互作用影响脂质代谢的途径
茶叶活性成分对肠道菌群的调节,以及肠道菌群产生的茶叶成分分解残留物,是茶叶发挥抗肥胖作用,调节脂质代谢的重要因素,作用途径主要包括:(1)茶叶成分通过调节肠道菌群结构对脂质积累产生影响;(2)茶叶成分作用于肠道菌群促进胆汁酸释放来调节宿主的脂质代谢;(3)肠道菌群通过分解茶叶成分产生短链脂肪酸影响脂质代谢。
2.1 茶叶活性成分通过调节肠道菌群组成结构影响脂质代谢
肠道菌群是一个极复杂和动态的微生物生态系统,具有高度的学科特异性,研究发现肥胖受试者的胃肠道微生物群与瘦人受试者不同[27]。肠道菌群可以影响能量吸收和储存,肠道菌群失调可能通过多种机制参与人体内的脂质代谢,包括破坏能量稳态、脂质合成和贮存[28]。
研究发现肥胖人群肠道中厚壁菌门丰度较高,拟杆菌门丰度较低[29]。当菌群状态处于F/B值较高时,会导致身体从食物中吸收更多的热量,且更容易将热量转化为脂肪积累在皮下。临床调查发现,喝茶会影响肠道微生物组β多样性和菌群丰度,这有助于降低患代谢综合征的风险[30]。研究发现,茶叶中多种活性成分均能改善高脂饮食诱导的肥胖小鼠肠道中F/B失调的情况,不同程度上增加有益菌的丰度,改变梭状芽胞杆菌丰度,该菌属能够分解碳水化合物产生各种有机酸包括乙酸、丙酸、丁酸等,进而通过SCFAs代谢参与脂质调节,并减轻肥胖状况。使Akk菌水平显著降低,该菌对调节肠道屏障功能至关重要,同时能减少高脂肪饮食引起的代谢紊乱,改善了脂肪积累[31]。
YUAN等[32]研究发现黑茶得摄入能显著逆转高脂饮食小鼠肠道F/B值的增加和高脂饮食相关菌群(如瘤胃球菌、毛螺菌和罗斯氏菌的相对丰度,这些菌群能够增强对碳水化合物的分解效率,主要产物中都包含乙酸,可以促进体内脂肪酸的氧化,从头抑制肝脏脂肪的合成,减少脂肪沉积,改善高脂引起的肠道微生物疾病。茶褐素干预可改善代谢综合征小鼠梭菌目细菌和厚壁菌门细菌的丰度,改善多发性硬化症小鼠肝脏、空肠和脂肪组织的生理功能[33]。LIU等[34]利用qPCR分析方法,发现绿茶提取物可以降低肥胖小鼠大肠中F/B值。红茶能调节高脂饮食大鼠肠道菌群,可逆转大鼠肠道菌群丰度及多样性降低的现象,抑制大鼠体重增长、降低Lee′s指数和脂肪重量、改善脂肪细胞结构且增多细胞数量。黄茶提高了高脂饮食大鼠肠道微生物的多样性,改善了肠道微生物的结构组成,降低了F/B值,同时还能促进与肠道屏障相关的有益菌的增殖,改善高脂饮食大鼠的代谢途径[35]。
因此,茶可以通过调节肠道优势菌群的多样性和丰度,益生菌的增长如双歧杆菌的增多,会使得其代谢产物醋酸和乳酸增加,起到调节肠道pH值的作用,促进肠道蠕动,同时一定程度上抑制致病菌的生长,维护肠道微生态的平衡,达到改善脂质代谢的目的。
2.2 茶叶活性成分——肠道菌群——胆汁酸——脂质代谢途径
胆汁酸是参与脂类物质消化的主要成分,肠道菌群通过影响胆汁酸组成和胆汁酸受体信号来调节宿主的脂质代谢。研究发现,茶多酚、咖啡碱的摄入可增加肠道内梭状芽孢杆菌、拟杆菌、双歧杆菌和乳杆菌的丰度,这些肠道细菌能够通过7α-脱羟基酶将初级胆汁酸转化为次级胆汁酸[36],帮助肠道中膳食脂肪乳化成更小的脂肪颗粒,使脂肪酶将甘油三酯分解成脂肪酸。
胆汁酸还可以通过与多种胆汁酸受体包括法尼酯X受体(farnesoid X receptor, FXR)、G蛋白偶联受体5(G protein-coupled receptor, TGR-5)等相互作用,作为参与代谢途径的重要信号分子,参与脂质代谢过程。FXR的激活与维持正常的甘油三酯水平、胆固醇水平和肠道微生物群与心血管疾病风险的调节因素有关[37]。G蛋白偶联受体(G protein-coupled receptors,GPCR)的激活会导致肠道激素-胰高血糖素样肽(glucagon-like peptide,GLP-1)的产生增加,进而促进胰岛素分泌和食欲调节,促进甲状腺激素分泌增加能量消耗。
此外,茶叶活性物质在肠道中还可以通过与胆汁酸结合来影响肠道菌群的功能。茶叶提取物的胆汁酸结合量为17.92%~43.55%,其中茶多酚是与胆汁酸结合能力最强的活性物质,多糖也具有一定结合胆汁酸的能力。普洱茶能显著降低受试者肠道菌群的胆盐水解酶(bile salt hydrolase, BSH)的活性[38],使回肠中结合型胆汁酸水平升高,进而作用于FXR-小肠成纤维细胞生长因子(fibroblast growth factor, FGF)途径和肝脏FXR-小异二聚体配体(small heterodimer partner, SHP)途径调节胆汁酸合成代谢[39](图1),从而降低肝脏胆固醇,达到改善血脂和肝脂稳态的结果。
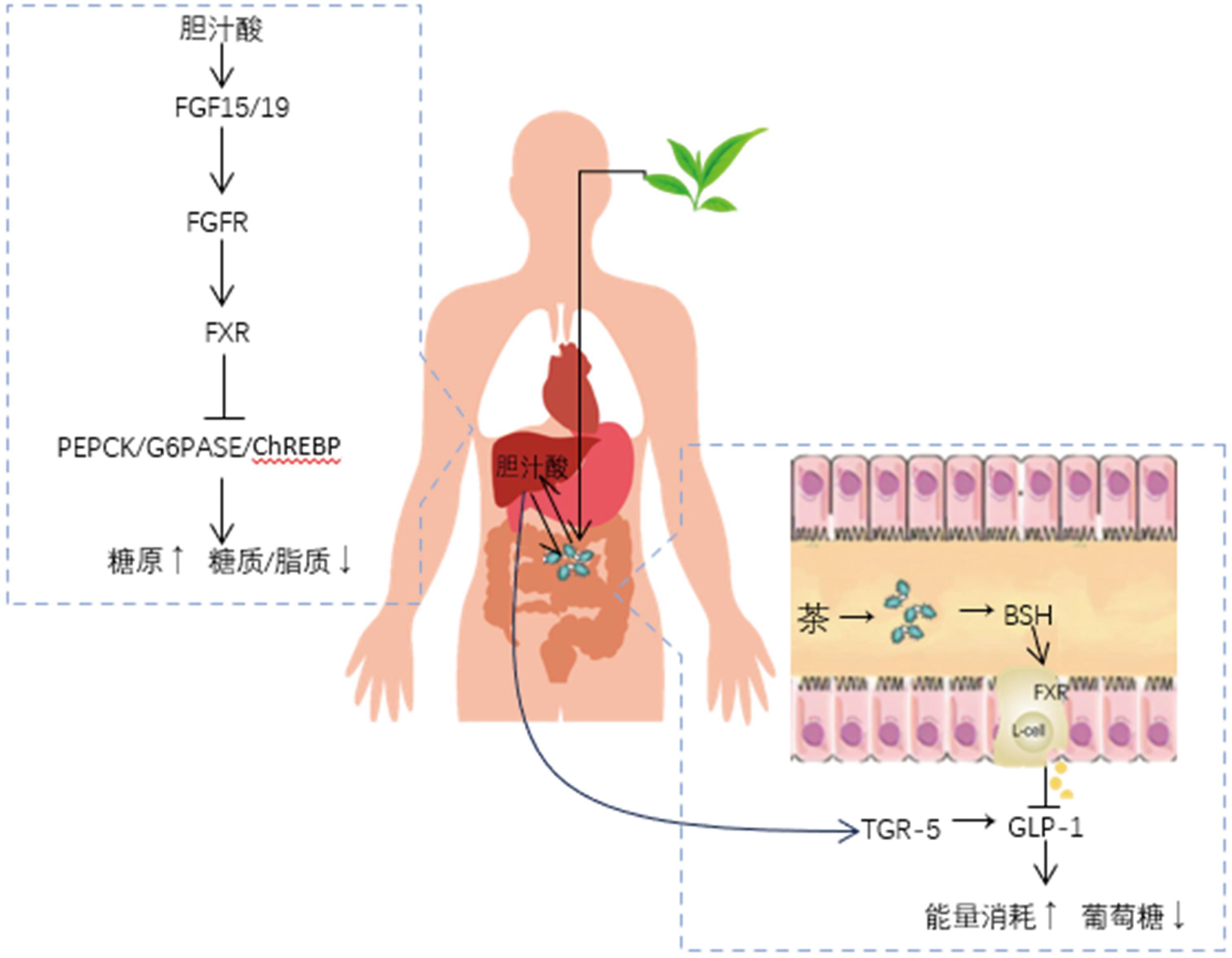
图1 茶叶活性成通过肠道菌群参与胆汁酸代谢影响脂质代谢
Fig.1 Tea bioactive substances affect lipid metabolism by participating in bile acid metabolism through gut microbiota
注:→表示激活或促进;⊥表示抑制;↑表示上调或增加;↓表示下调或减少;PEPCK:磷酸烯醇式丙酮酸羧化酶;G6PASE:葡萄糖-6-磷酸酶;ChREBP: 碳水化合物反应元件结合蛋白。
2.3 肠道菌群—茶叶成分—短链脂肪酸—脂质代谢途径
肠道微生物群可以将茶叶中的多糖物质及膳食纤维转化为SCFAs,主要包括乙酸、丙酸和丁酸等[40]。其中,乙酸可以通过增加能量消耗和脂质氧化以及促进脂肪分解对宿主的能量代谢产生有益影响;丙酸具有降低胆固醇,减少脂肪储存的特性;丁酸通过作用于GPCR来促进脂肪酸氧化并增加能量消耗,促进肠道上皮细胞的生长和功能的完善,且对肠道细胞的生长提供能量。
茶及其活性成分经过微生物分解产生的SCFAs参与机体内分泌、神经、免疫信号调节,共同作用于脂质代谢(图2)。SCFAs与肠道血流相互作用及肠道-脑内分泌轴的调节,丙酸与乙酸能刺激肽YY(peptide YY, PYY)和GLP-1的释放,增加肠道蠕动,有助于维持正常的肠功能,改善肠道环境[41],同时乙酸通过作用于下丘脑及迷走神经,调节食欲激素水平来控制食欲。在此途径上,肠道菌群产生的活性代谢物如5-羟色胺(5-hydroxytryptamine, 5-HT)也参与调节食欲及焦虑等生理和心理状态[42]。研究发现,茶多糖在肥胖发生过程中调控肠道菌群相关代谢物,调控SCFA-GPCR信号通路,改善肠道屏障功能同时减轻了高脂肪饮食喂养大鼠的肠道微生物群失调[43]。SCFAs可以抑制体内脂肪的堆积,SCFAs能够激活脂肪细胞因子的表达,促进脂肪消耗,抑制脂蛋白脂酶(lipoprotein lipase,LPL)的表达,调节甘油三酯循环,避免脂肪在血液中堆积。在免疫信号调节方面,丙酸和丁酸通过抑制白细胞介素-6(interleukin-6,IL-6)、白细胞介素-8(interleukin-8,IL-8)、肿瘤坏死因子(tumor necrosis factor,TNF-α)等炎症因子的表达来减轻低度炎症,调节肠道通透性,进而改善肥胖[44]。例如茶叶中的咖啡碱可以降低高脂饮食饲喂的小鼠白色脂肪组织的脂肪细胞大小,并改善内脏脂肪组织炎症[45]。
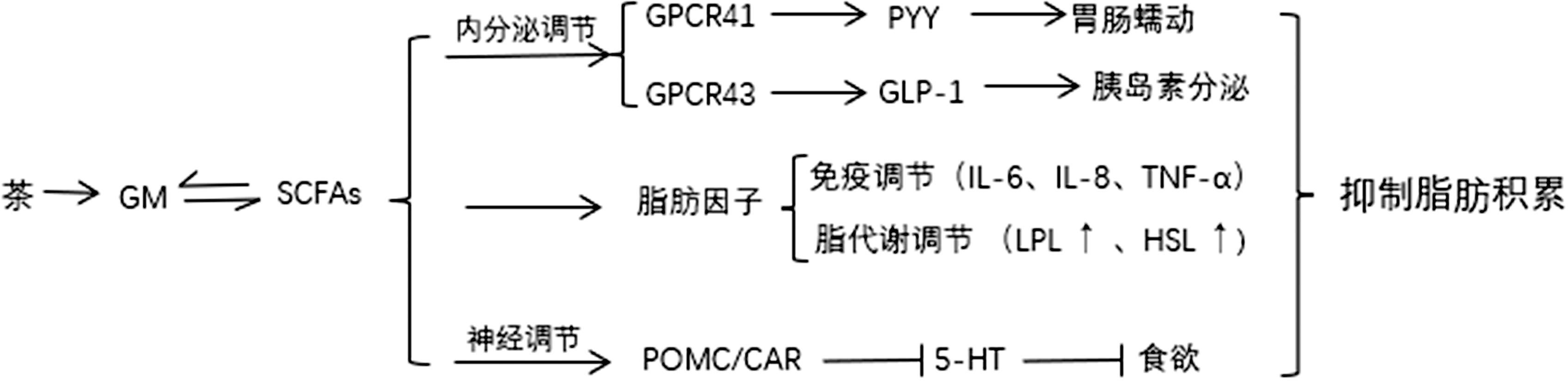
图2 肠道菌群通过分解茶叶成分产生短链脂肪酸影响脂质代谢
Fig.2 Gut microbiota affects lipid metabolism by decomposing tea components to produce short-chain fatty acids
注:→表示激活或促进;⊥表示抑制;↑表示上调或增加;↓表示下调或减少;HSL: 激素敏感脂肪酶;POMC:阿片促黑色素原;CAR:嵌合抗原受体。
综上,茶叶活性成分与肠道菌群之间存在多种相互作用,通过改善肠道菌群结构,调节微生物群代谢途径来影响脂质合成和贮存(表1)。然而茶叶成分与肠道菌群间的作用是双向的,其作用途径间也存在着交叉和联系,共同来调节肠道功能稳态,参与内体脂质代谢。
表1 茶叶活性成分调节肠道菌群的途径分类
Table 1 Pathway classification of tea active ingredients regulating gut microbiota
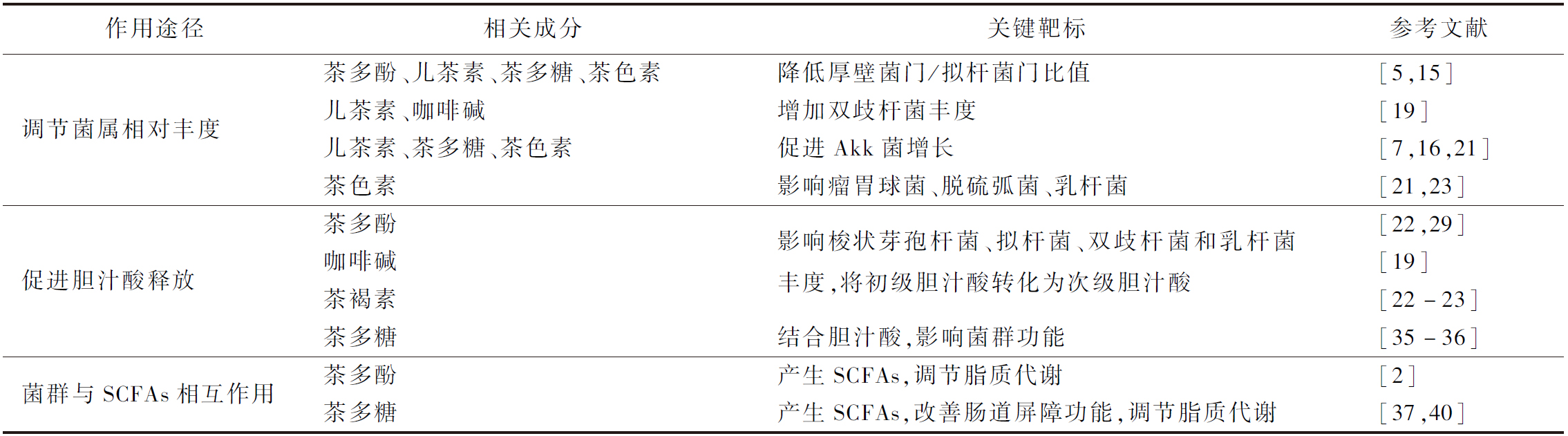
作用途径相关成分关键靶标参考文献调节菌属相对丰度茶多酚、儿茶素、茶多糖、茶色素降低厚壁菌门/拟杆菌门比值[5,15]儿茶素、咖啡碱增加双歧杆菌丰度[19]儿茶素、茶多糖、茶色素促进Akk菌增长[7,16,21]茶色素影响瘤胃球菌、脱硫弧菌、乳杆菌[21,23]促进胆汁酸释放茶多酚[22,29]咖啡碱影响梭状芽孢杆菌、拟杆菌、双歧杆菌和乳杆菌丰度,将初级胆汁酸转化为次级胆汁酸[19]茶褐素[22-23]茶多糖结合胆汁酸,影响菌群功能[35-36]菌群与SCFAs相互作用茶多酚产生SCFAs,调节脂质代谢[2]茶多糖产生SCFAs,改善肠道屏障功能,调节脂质代谢[37,40]
3 展望
茶叶从起源至今广为传播,除文化属性、饮用价值外,其丰富的内含物质让茶叶还具备了营养价值、保健及药用价值。随着科学技术的发展,茶叶的功效成分及其作用机制不断被挖掘,对指导人们科学饮茶、科学用茶具有积极意义。
肠道微生态系统是人体四大微生态中最为主要、复杂的系统,其稳态与人体的健康情况息息相关。饮食对机体的肠道微生态调节有直接作用,是驱动肠道菌群结构和代谢变化的主要因素,可以调节菌群稳态,修复受损的肠道黏膜屏障,间接影响脂质代谢。茶叶中功能物质在体内可特异性调节肠道菌群,其作用机制包括调节菌属相对丰度、多样性,参与生物代谢调节,菌群与代谢产物相互作用等方面,来改善肠道稳态,从而预防和治疗肥胖。众多新近研究显示,在与肠道菌群相互作用的茶叶成分中,调节菌属相对丰度的成分种类最多,可同时调节多种微生物的数量,最突出的作用靶标为调节F/B值,增加益生菌的种类及数量,其次为参与微生物代谢途径。除与肠道菌群相作用之外,还有众多的活性物质发挥作用的机制及参与代谢的途径还尚未明确,仍需我们继续探索,进一步研究茶叶成分的健康功效,可对疾病的预防和治疗能提供新的思路,且对茶的利用、茶产业的发展发挥积极的推动作用。
[1] ZECHNER R, ZIMMERMANN R, EICHMANN T O, et al.FAT SIGNALS—Lipases and lipolysis in lipid metabolism and signaling[J].Cell Metabolism, 2012, 15(3):279-291.
[2] CORBIN K D, CARNERO E A, DIRKS B, et al.Host-diet-gut microbiome interactions influence human energy balance:A randomized clinical trial[J].Nature Communications, 2023, 14(1):3161.
[3] 满子意, 凤怡, 吴祥庭.儿茶素单体EGC对胰脂肪酶的抑制作用及其机理研究[J].茶叶科学, 2022, 42(6):863-874.
MAN Z Y, FENG Y, WU X T.Inhibitory effect of catechin monomer EGC on pancreatic lipase and mechanism[J].Journal of Tea Science, 2022, 42(6):863-874.
[4] MI Y S, LIU X, TIAN H Y, et al.EGCG stimulates the recruitment of brite adipocytes, suppresses adipogenesis and counteracts TNF-α-triggered insulin resistance in adipocytes[J].Food &Function, 2018, 9(6):3374-3386.
[5] WU Z H, HUANG S M, LI T T, et al.Gut microbiota from green tea polyphenol-dosed mice improves intestinal epithelial homeostasis and ameliorates experimental colitis[J].Microbiome, 2021, 9(1):184.
[6] WANG L, ZENG B H, LIU Z W, et al.Green tea polyphenols modulate colonic microbiota diversity and lipid metabolism in high-fat diet treated HFA mice[J].Journal of Food Science, 2018, 83(3):864-873.
[7] LI J, CHEN C F, YANG H, et al.Tea polyphenols regulate gut microbiota dysbiosis induced by antibiotic in mice[J].Food Research International, 2021, 141:110153.
[8] ZHOU F, LI Y L, ZHANG X, et al.Polyphenols from Fu brick tea reduce obesity via modulation of gut microbiota and gut microbiota-related intestinal oxidative stress and barrier function[J].Journal of Agricultural and Food Chemistry, 2021, 69(48):14530-14543.
[9] HASANI A, EBRAHIMZADEH S, HEMMATI F, et al.The role of Akkermansia muciniphila in obesity, diabetes and atherosclerosis[J].Journal of Medical Microbiology, 2021, 70(10).DOI:10.1099/jmm.0.001435.
[10] ANNUNZIATA G, MAISTO M, SCHISANO C, et al.Colon bioaccessibility and antioxidant activity of white, green and black tea polyphenols extract after in vitro simulated gastrointestinal digestion[J].Nutrients, 2018, 10(11):1711.
[11] ZHAO Y, ZHANG X.Interactions of tea polyphenols with intestinal microbiota and their implication for anti-obesity[J].Journal of the Science of Food and Agriculture, 2020, 100(3):897-903.
[12] FAN Y M, ZHOU X F, HUANG G L.Preparation, structure, and properties of tea polysaccharide[J].Chemical Biology &Drug Design, 2022, 99(1):75-82.
[13] FAN M H, ZHU J X, QIAN Y L, et al.Effect of purity of tea polysaccharides on its antioxidant and hypoglycemic activities[J].Journal of Food Biochemistry, 2020, 44(8):e13277.
[14] LIU D, GAO H, TANG W, et al.Plant non-starch polysaccharides that inhibit key enzymes linked to type 2 diabetes mellitus[J].Annals of the New York Academy of Sciences, 2017, 1401(1):28-36.
[15] 欧阳建, 周方, 卢丹敏, 等.茶多糖调控肥胖作用研究进展[J].茶叶科学, 2020, 40(5):565-575.
OUYANG J, ZHOU F, LU D M, et al.Research progress of tea polysaccharides in regulating obesity[J].Journal of Tea Science, 2020, 40(5):565-575.
[16] CHEN G J, BAI Y X, ZENG Z Q, et al.Structural characterization and immunostimulatory activity of heteropolysaccharides from Fuzhuan brick tea[J].Journal of Agricultural and Food Chemistry, 2021, 69(4):1368-1378.
[17] WANG Y, LI T, LIU Y Y, et al.Heimao tea polysaccharides ameliorate obesity by enhancing gut microbiota-dependent adipocytes thermogenesis in mice fed with high fat diet[J].Food &Function, 2022, 13(24):13014-13027.
[18] 李祎, 毛彦, 黄丽, 等.六堡茶多糖对高脂血症大鼠结肠微生态的影响[J].大众科技, 2023, 25(2):99-104.
LI Y, MAO Y, HUANG L, et al.Effect of Liubao tea polysaccharide on colonic microecology in hyperlipidemia rats[J].Popular Science and Technology, 2023, 25(2):99-104.
[19] 杜海平. 肠AKK菌介导茯砖茶多糖调控脂肪产热功能的研究[D].西安:陕西师范大学,2020.
DU H P.The study of intestinal AKK bacteria mediating the regulation of fat thermogenesis by Fu brick tea polysaccharide[D].Xi′an:Shaanxi Normal University, 2020.
[20] HANHINEVA K, TÖRRÖNEN R, BONDIA-PONS I, et al.Impact of dietary polyphenols on carbohydrate metabolism[J].International Journal of Molecular Sciences, 2010, 11(4):1365-1402.
[21] BROTHERS H M, MARCHALANT Y, WENK G L.Caffeine attenuates lipopolysaccharide-induced neuroinflammation[J].Neuroscience Letters, 2010, 480(2):97-100.
[22] NEHLIG A.Effects of coffee on the gastro-intestinal tract:A narrative review and literature update[J].Nutrients, 2022, 14(2):399.
[23] DAI A N, HOFFMAN K, XU A A, et al.The association between caffeine intake and the colonic mucosa-associated gut microbiota in humans—A preliminary investigation[J].Nutrients, 2023, 15(7):1747.
[24] LI H Y, HUANG S Y, XIONG R G, et al.Anti-obesity effect of theabrownin from dark tea in C57BL/6 J mice fed a high-fat diet by metabolic profiles through gut microbiota using untargeted metabolomics[J].Foods, 2022, 11(19):3000.
[25] YUE S J, SHAN B, PENG C X, et al.Theabrownin-targeted regulation of intestinal microorganisms to improve glucose and lipid metabolism in Goto-Kakizaki rats[J].Food &Function, 2022, 13(4):1921-1940.
[26] 蒋慧颖, 马玉仙, 曾文治, 等.茶黄素、茶红素与茶褐素对高脂饮食大鼠肠道菌群的影响[J].食品工业科技, 2018, 39(20):274-279;351.
JIANG H Y, MA Y X, ZENG W Z, et al.Effects of theaflavins, thearubicins and theafocins on intestinal flora in rats fed with high-fat diet[J].Science and Technology of Food Industry, 2018, 39(20):274-279;351.
[27] VALLIANOU N, STRATIGOU T, CHRISTODOULATOS G S, et al.Understanding the role of the gut microbiome and microbial metabolites in obesity and obesity-associated metabolic disorders:Current evidence and perspectives[J].Current Obesity Reports, 2019, 8(3):317-332.
[28] LIU B N, LIU X T, LIANG Z H, et al.Gut microbiota in obesity[J].World Journal of Gastroenterology, 2021, 27(25):3837-3850.
[29] B CKHED F, DING H, WANG T, et al.The gut microbiota as an environmental factor that regulates fat storage[J].Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44):15718-15723.
CKHED F, DING H, WANG T, et al.The gut microbiota as an environmental factor that regulates fat storage[J].Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44):15718-15723.
[30] WANG L, SHU X O, CAI H, et al.Tea consumption and gut microbiome in older Chinese adults[J].The Journal of Nutrition, 2023, 153(1):293-300.
[31] BLANCO C.The influence of the gut microbiome on obesity[J].Journal of the American Association of Nurse Practitioners, 2020, 32(7):504-510.
[32] YUAN Y, HE J L, TANG M, et al.Preventive effect of Ya′an Tibetan tea on obesity in rats fed with a hypercaloric high-fat diet revealed by gut microbiology and metabolomics studies[J].Food Research International, 2023, 165:112520.
[33] HOU Y, ZHANG Z F, CUI Y S, et al.Pu-erh tea and theabrownin ameliorate metabolic syndrome in mice via potential microbiota-gut-liver-brain interactions[J].Food Research International, 2022, 162(Pt B):112176.
[34] LIU X L, HU G S, WANG A H, et al.Black tea reduces diet-induced obesity in mice via modulation of gut microbiota and gene expression in host tissues[J].Nutrients, 2022, 14(8):1635.
[35] 欧阳建. 岳阳黄茶对高脂饮食大鼠肠道屏障和肠道菌群的影响[D].长沙:湖南农业大学, 2021.
OUYANG J.Effect of Yueyang yellow tea on intestinal barrier and intestinal flora in rats with high-fat diet[D].Changsha:Hunan Agricultural University, 2021.
[36] 仇振明, 王文学.肠道菌群及其代谢物与溃疡性结肠炎的研究进展[J].微生物学免疫学进展, 2023, 51(3):89-95.
QIU Z M, WANG W X.Research progress of gut microbiota and its metabolites in ulcerative colitis[J].Progress in Microbiology-Immunology, 2023, 51(3):89-95.
[37] CHIANG J Y L, FERRELL J M.Discovery of farnesoid X receptor and its role in bile acid metabolism[J].Molecular and Cellular Endocrinology, 2022, 548:111618.
[38] HUANG F J, ZHENG X J, MA X H, et al.Theabrownin from Pu-erh tea attenuates hypercholesterolemia via modulation of gut microbiota and bile acid metabolism[J].Nature Communications, 2019, 10(1):4971.
[39] KATAFUCHI T, MAKISHIMA M.Molecular basis of bile acid-FXR-FGF15/19 signaling axis[J].International Journal of Molecular Sciences, 2022, 23(11):6046.
[40] HU T, WU P, ZHAN J F, et al.Influencing factors on the physicochemical characteristics of tea polysaccharides[J].Molecules, 2021, 26(11):3457.
[41] LI C R, ZHOU K, XIAO N Q, et al.The effect of qiweibaizhu powder crude polysaccharide on antibiotic-associated diarrhea mice is associated with restoring intestinal mucosal bacteria[J].Frontiers in Nutrition, 2022, 9:952647.
[42] WIJDEVELD M, NIEUWDORP M, IJZERMAN R.The interaction between microbiome and host central nervous system:The gut-brain axis as a potential new therapeutic target in the treatment of obesity and cardiometabolic disease[J].Expert Opinion on Therapeutic Targets, 2020, 24(7):639-653.
[43] ZHU M Z, OUYANG J, ZHOU F, et al.Polysaccharides from Fu brick tea ameliorate obesity by modulating gut microbiota and gut microbiota-related short chain fatty acid and amino acid metabolism[J].The Journal of Nutritional Biochemistry, 2023, 118:109356.
[44] DALILE B, VAN OUDENHOVE L, VERVLIET B, et al.The role of short-chain fatty acids in microbiota-gut-brain communication[J].Nature Reviews.Gastroenterology &Hepatology, 2019, 16(8):461-478.
[45] 陈立. 咖啡因通过调节ChREBP介导的脂肪从头合成对NAFLD的作用机制研究[D].汕头:汕头大学, 2022.
CHEN L.Study on the mechanism of caffeine on NAFLD by regulating ChREBP-mediated de novo lipogenesis[D].Shantou:Shantou University, 2022.