黄曲霉毒素是由黄曲霉菌和寄生曲霉菌产生的次级代谢产物[1],主要包括黄曲霉毒素B1(aflatoxin B1,AFB1)、黄曲霉毒素B2(aflatoxin B2,AFB2)、黄曲霉毒素M1(aflatoxin M1,AFM1)、黄曲霉毒素M2(aflatoxin M2,AFM2)、黄曲霉毒素G1(aflatoxin G1,AFG1)和黄曲霉毒素G2(aflatoxin G2,AFG2)6种类型。AFM1是AFB1的羟基化代谢产物[2],具有剧烈的致畸性、致癌性和免疫毒性,机体过量摄入会导致急性肝损伤甚至死亡[3],世界卫生组织和国际癌症研究机构将其划分为Ⅰ类致癌物[4-6]。AFM1主要分布于动物乳汁及其乳制品中,高温难以将其破坏[7-8],最终会随着产品流入市场,危害公众健康。与乳制品相关的安全问题已经引起全球关注。多数国家都制定法律法规严格限制乳制品中AFM1的含量。我国GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》规定在食品和乳品中AFM1最大允许含量需低于0.5 μg/kg[9],而欧盟限制鲜乳中AFM1含量需低于0.05 μg/kg[10]。因此,开发快速便捷的AFM1筛查方法,对于保障乳制品安全具有重要意义。
目前,已经开发了多种检测AFM1的仪器分析方法,包括薄层色谱法(thin-layer chromatography,TLC)[11]、HPLC[12]和超高效液相色谱仪串联质谱法(ultra high performance liquid chromatograph tandem mass spectrometry,UPLC-MS/MS)[13]。虽然这些方法灵敏度高、准确性强、重现性好,但是设备庞大,费用昂贵,携带不便,并且需要专业的人员操作才能实现高精度检测[14-15]。免疫分析方法主要依赖抗原-抗体特异性结合,与仪器法相比,具有操作简单、成本低、高通量和读数更直观等优势,可以与仪器法互补应用于真菌毒素的方法检测[16]。
抗体是免疫分析方法的核心元件,制备高质量的抗体对方法的灵敏度至关重要。近年来,随着分子生物工程和表面展示技术的发展,抗体生产逐步从传统抗体转向基因工程抗体。纳米抗体(nanobody,Nb)来自重链抗体的可变区域,仅由一个结构域组成,是目前已知最小的抗原结合单位。与传统抗体相比,Nb更易于制备和生产,通过基因克隆技术即可扩增获得Nb的全部基因,并且易于表达和生产,在原核表达系统中产量高达10 mg/L[17]。此外,Nb具有更长的CDR3结构域,可以形成一个独特的凸环,能够延伸到抗原分子构象裂隙凹槽中,识别与传统抗体的重链可变区(variable of heavy chain,VH)无法到达或隐藏的抗原位点;Nb在FR2结构域具有亲水性残基取代,比VH更易溶解且不易发生自身聚集[18-19]。这些优势使得Nb在食品安全检测领域受到广泛的关注,迄今为止,大量研究成功分离得到抗原特异性Nb,并应用于真菌毒素的免疫检测[20-21]。然而,关于抗AFM1纳米抗体的报道较少,CAI等[22]和TANG等[23]均采用抗独特型纳米抗体VHH-C4建立免疫分析方法实现对乳制品中AFM1的监测。该抗体分离自抗AFM1单克隆抗体免疫文库,主要识别单克隆抗体的抗原决定簇,可以替代黄曲霉毒素作为抗原使用,目前还没有研究报道特异性识别AFM1小分子的Nb。本课题组前期构建了双峰驼源AFM1免疫Nb文库,并从中筛选获得抗AFM1纳米抗体M6,本研究旨在探究Nb-M6理化性质,并且基于Nb-M6开发icELISA方法检测乳制品中的AFM1,以期为乳品安全监测提供快速批量筛查技术和新型材料元件。
1 材料与方法
1.1 材料与试剂
AFM1标准品,美国Sigma公司;AFM1-BSA,加拿大Immunechem公司;抗AFM1单克隆抗体(mAb 1E6),Abnova公司;DON、ZEN、AFB1、AFB2、AFG1、AFG2、AFM2标准品、AFM1免疫亲和柱,青岛普瑞邦公司;辣根过氧化物酶标记的抗His标签兔单克隆抗体(anti-His Tag IgG/HRP),成都阿帕克公司;大肠杆菌Top10F′感受态细胞,翌圣生物科技有限公司;鸡卵白蛋白(ovalbumin,OVA),上海生工生物工程有限公司;氨苄青霉素(ampicillin,Amp)、卡那霉素(kanamycin,Kana)、琼脂粉、3,3,5,5-四甲基联苯胺(3, 3, 5, 5-tetramethylbenzidine,TMB),北京索莱宝公司;快速质粒小提试剂盒,天根生化科技有限公司;Anti-rat IgG/HRP,英国Abcam公司;胰蛋白胨和酵母提取物,英国OXOID公司;甲醇、乙腈(色谱纯),美国Thermo Fisher Scientific公司;其他试剂均为国产分析纯。
1.2 仪器与设备
LC 20A高效液相色谱仪、DSC 60A差示扫描量热仪,日本岛津公司;AKTA PURE蛋白纯化仪,Cytiva公司;Multiskan FC酶标仪,美国Thermo公司;Mini-PROTEAN®Tetra电泳仪、Gene Pulser Xcell电穿孔仪,美国BIO-RAD公司;ED Octet R 96分子相互作用仪,ForteBio公司。
1.3 实验方法
1.3.1 Nb-M6的表达、纯化与鉴定
参照CAI等[22]对Nb-M6进行表达:使用质粒小提试剂盒提取pComb3XSS-M6/TG1质粒;取2 μL质粒与100 μL大肠杆菌Top10F’感受态细胞轻柔混匀,冰上静置30 min;42 ℃热激转化90 s,迅速转移至冰上静置5 min;缓慢加入1 mL预热的2YT液体培养基,37 ℃ 250 r/min复苏培养1 h,取复苏菌液涂布于2YT-Amp固体培养基;次日,挑取单个克隆进行DNA测序。将测序正确的单个克隆接种于SB-Amp液体培养基,培养至对数期(OD600=0.6~0.8)时加入终浓度为1 mmol/L的IPTG溶液,37 ℃ 250 r/min振摇培养过夜;4 ℃ 10 000 r/min离心菌液15 min,弃上清液,使用细胞裂解液X-Tractor重悬裂解沉淀细胞,提取大肠杆菌周质蛋白;使用0.01 mol/L pH 7.4的PBS缓冲液透析蛋白,10 000×g离心20 min,收集上清液,过Ni-NTA琼脂糖填充柱纯化Nb-M6,并用12% SDS-PAGE鉴定。
1.3.2 抗AFM1抗体的亲和力分析
采用生物膜干涉技术(biol-ayer interferometry,BLI)测定Nb-M6与AFM1-BSA的结合动力学曲线。在黑色微孔板中添加200 μL PBST(含0.02%吐温-20)活化Ni-NTA传感器探针600 s;将Nb-M6(2 μg/mL)固化于Ni-NTA传感器探针;探针置于PBST中平衡90 s;随后在微孔板中分别加入不同浓度的AFM1-BSA(12.5、25、50、100 nmol/L),运行程序Association 120 s使得抗原抗体发生相互作用;运行程序Dissociation 180 s解离。结束运行程序后,将测量数据拟合到1∶1结合模型中。
1.3.3 抗AFM1抗体的热稳定性分析
将Nb-M6和mAb-1E6分别稀释至0.1和1 μg/mL,进行如下加热处理:a)4、25、37、50、60、70、80、90 ℃加热处理10 min,以探究随着温度不断升高抗体残留活性的变化趋势;b)85 ℃加热处理0、10、20、30、40、50、60 min,进一步探究高温热处理条件下抗体残留活性的变化趋势;c)37 ℃加热处理0、10、20、30、40、50、60 min,以探究随着孵育时间不断延长抗体残余活性的变化趋势。待抗体恢复至室温后,参照1.3.2节间接非竞争ELISA评估抗AFM1抗体的热稳定性。未经热处理的抗体的活性为100%,根据公式(1)计算抗体经不同热处理后的残留活性,以抗体残留活性(%)为纵坐标,以加热温度(℃)/加热时间(min)为横坐标,使用Origin pro 9.5绘制热稳定性曲线。
抗体残留活性![]()
(1)
式中:A1为经热处理抗体的吸光度;A2为未经热处理抗体的吸光度。
为进一步衡量抗体的结构热稳定性,使用差示扫描量热仪(differential scanning calorimetry,DSC)测定蛋白熔解温度(melting temperature,Tm),即抗体蛋白半数变性温度。稀释Nb-M6和mAb-1E6至0.5 mg/mL,加入铝制坩埚,以空坩埚为参照。设定扫描温度范围为20~90 ℃,升温速率为1 ℃/min,重复检测3次。收集数据,使用Instruments nanoAnalyze进行分析。
1.3.4 Nb-icELISA方法的建立
使用0.05 mol/L pH 9.6的碳酸盐缓冲液稀释AFM1-BSA至0.5 μg/mL,每孔100 μL包被于酶标板,4 ℃过夜;0.01% PBST洗板3次,每孔加入300 μL 5%脱脂乳,37 ℃封闭1 h;0.01% PBST洗板3次,每孔加入50 μL系列稀释的AFM1标准品(0、0.01、0.025、0.05、0.1、0.25、0.5、1、2.5、5和10 ng/mL)和等量Nb-M6,37 ℃竞争反应1 h;0.01% PBST洗板4次,每孔加入100 μL anti-His Tag IgG/HRP,37 ℃孵育1 h;0.01% PBST洗板5次,每孔加入100 μL TMB,37 ℃避光显色7 min;立即加入50 μL 1 mol/L HCl终止反应。结合率的计算如公式(2)所示,以结合率(%)为纵坐标,以AFM1标准品的质量浓度(ng/mL)为横坐标,使用Origin pro 9.5进行logistic四参数拟合,绘制竞争抑制曲线。
结合率![]()
(2)
式中:B为添加AFM1标准品孔的吸光度;B0为不添加AFM1标准品孔的吸光度。
1.3.5 Nb-icELISA反应条件的优化
采用棋盘滴定法确定抗原AFM1-BSA和Nb-M6的最佳工作浓度。随后优化其他反应参数,包括封闭剂(5%脱脂乳、5%BSA和5%OVA,质量分数)、封闭时间(1 h和2 h)、甲醇添加量(5%、10%、20%、40%、60%和80%,体积分数)、pH值(5.0、6.0、7.0、7.4、8.0、9.0)和离子强度(5、10、20、40、60、80 mmol/L)。最后,以优化后的ELISA参数作为最佳反应条件,绘制Nb-icELISA竞争抑制标准曲线,根据最低检测限(limit of detection,LOD)和半数抑制浓度(half maximal inhibitory concentration,IC50)评估Nb-icELISA的灵敏度。
1.3.6 Nb-icELISA的特异性分析
配制系列(0、3.13、6.25、12.5、25、50和100 ng/mL)稀释的AFM2、AFB1、AFB2、AFG1、AFG2、DON和ZEN标准品溶液用于替代AFM1进行Nb-icELISA,分别绘制不同真菌毒素的竞争抑制曲线,反应交叉率(cross reactivity,CR)的计算如公式(3)所示:
(3)
1.3.7 样品加标回收的测定
从内蒙古呼和浩特市当地超市随机购买牛奶、酸奶和奶粉样品共计9份,同时进行Nb-icELISA和HPLC测定,评估所开发的Nb-icELISA的准确性和精密度。称取10 g牛奶、酸奶和奶粉溶液(超纯水配制质量浓度为0.01 g/L),分别添加AFM1标准品至终质量浓度为0.4、0.5和0.8 ng/mL,涡旋混匀3 min,于6 000 r/min离心10 min后去除乳脂肪层,收集中间层清液用于Nb-icELISA分析,采用1.3.4节建立的标准曲线计算加标回收率。
HPLC检测参考GB 5009.24—2016《食品安全国家标准 食品中黄曲霉毒素M族的测定》进行[24]。具体操作如下:分别称取4 g牛奶、酸奶和奶粉溶液,添加10 mL甲醇涡旋振荡3 min;4 ℃,6 000 r/min离心10 min,上清液与PBS(pH 7.4)按1∶8(体积比)均匀混合;混合液以1滴/s的流速过AFM1免疫亲和柱;10 mL超纯水平衡柱体2次;2 mL甲醇重力洗脱柱体,收集洗脱液;将洗脱液置于50 ℃下氮吹至近干,1 mL流动相复溶,过0.22 μm有机滤膜后用于HPLC测定。色谱条件:流动相为V(水)∶V(甲醇)∶V(乙腈)=70∶15∶15,流速为1 mL/min;上样量为50 μL;柱温箱温度保持为40 ℃;荧光激发波长和发射波长分别设置为360 nm和430 nm。
2 结果与分析
2.1 Nb-M6的表达、纯化与鉴定
本实验室前期构建了针对AFM1的噬菌体展示免疫纳米抗体文库,并从中淘选得到一株AFM1特异性噬菌体克隆(图1-A),命名为M6,经phage-ELISA测定,phage-M6的IC50为1.553 ng/mL(图1-B)。提取phage-M6噬菌体质粒,并经热激转化至大肠杆菌Top10F’细胞进行诱导表达,使用Ni-NTA琼脂糖填充柱纯化得到抗体蛋白Nb-M6。SDS-PAGE鉴定结果(图1-C)显示,泳道1仅有1条15 ku的目标蛋白条带,表明Nb-M6独立表达,纯化效果良好。经Nanodrop 1 000 定量,得出Nb-M6的表达量约为27.5 mg/L。

A-Nb-M6的氨基酸序列;B-phage灵敏度;C-SDS-PAGE鉴定(M-预染蛋白Marker;泳道1-纯化后的Nb-M6)
图1 Nb-M6的氨基酸序列、phage灵敏度和SDS-PAGE鉴定
Fig.1 Amino acid sequences, sensitivity of phage, and SDS-PAGE analysis of Nb-M6
2.2 Nb-M6的亲和力
靶标的免疫测定取决于抗原-抗体反应,因此,其灵敏度受到抗体亲和力的显著影响。为评估Nb-M6与AFM1-BSA的结合亲和力,使用BLI对抗原-抗体的结合过程进行实时监测,测定抗原抗体的结合速率常数(kon)和解离速率常数(koff),并通过公式KD=koff/kon计算得到平衡解离常数(equilibrium binding,KD)。KD可表征抗体亲和力强弱,是指抗体能够识别和结合的最低抗原浓度,KD值越小抗体的亲和力越强。通常情况下,从免疫文库中分离得到的纳米抗体的平衡解离常数KD在nmol/L~pmol/L范围内[25]。表1显示了动力学结合所测得的数据,经计算得到Nb-M6的KD值为15.6 nmol/L。
表1 Nb-M6的动力学参数
Table 1 Binding kinetic of Nb-M6
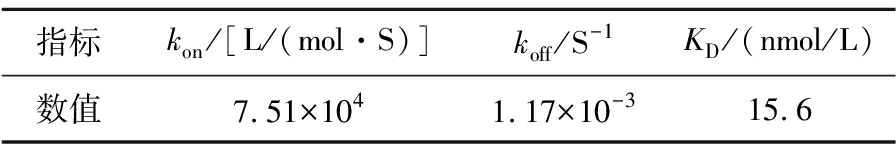
指标kon/[L/(mol·S)]koff/S-1KD/(nmol/L)数值7.51×1041.17×10-315.6
2.3 抗AFM1抗体的热稳定性
抗体对温度的耐受性是其发挥功能的关键因素,良好的热稳定性使抗体的结构更为紧凑,蛋白酶切位点不易暴露。当Nb被用作免疫分析试剂时,热稳定性在提高产品稳定性和延长保质期方面发挥重要作用,并且有助于在恶劣环境情况下开展检测。本研究以mAb-1E6作为对照,评估了Nb-M6热展开后的热稳定性。将2种抗体分别在连续加热的温度下孵育10 min,Nb-M6和mAb-1E6的结合能力均随着温度的升高而下降(图2-A);经70 ℃热处理10 min后,Nb-M6保留约40%的结合活性,而mAb-1E6完全失去活性;当温度持续升高至90 ℃时,Nb-M6仍然可以与抗原相互作用,约保留20%的结合活性。为了进一步验证Nb-M6的对高温的热稳定性,我们观察到经 85 ℃热处理10 min后,mAb-1E6的抗原结合能力完全丧失,而Nb-M6仍保留了约35%的结合活性,并且随着热处理时间延长至60 min,仍保留约15%的结合活性(图2-B)。此外,在ELISA常用孵育温度(37 ℃)下,Nb-M6的活性变化较小,经37 ℃热处理60 min后仍保留90%的抗体活性,而mAb-1E6的活性下降趋势较为明显,直至60 min活性残余55%(图2-C)。
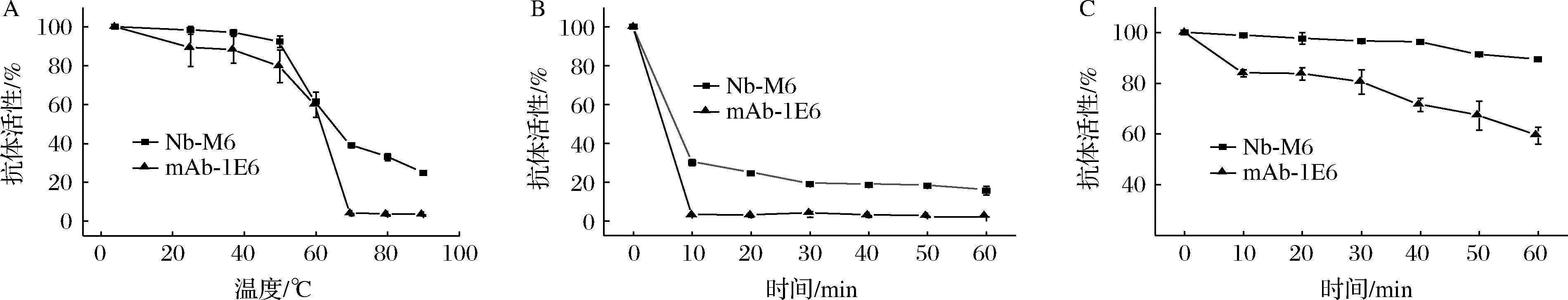
A-不同温度热处理10 min;B-85 ℃热处理不同时间;C-37 ℃热处理不同时间
图2 Nb-M6和mAb-1E6的热稳定性分析
Fig.2 Thermal stability of Nb-M6 and mAb-1E6
抗体的热稳定性也可以用Tm来表征,Tm值越高,抗体越稳定。如图3所示,使用DSC测量2种抗AFM1抗体的Tm,mAb-1E6存在2个变性温度,即Tm1(44.7 ℃)和Tm2(54.9 ℃),分别对应CH2,CH3与Fab结构域的变性。这可能是由于单克隆抗体受热后发生氨基酸化学修饰或折叠中间体的聚集,导致热变性失去抗原结合能力[26-28]。而Nb分子量小,仅由一个可变区结构域组成,因此Nb-M6仅有一个Tm温度值,为64.3 ℃,明显高于mAb-1E6。这可能与Nb在FR1(Cys23)和FR3(Cys104)结构域之间存在一个天然的二硫键有关(图1-A),该二硫键会稳固Nb的构象,增加其结构的稳定性,使得Nb能够承受高温和恶劣的极端环境。
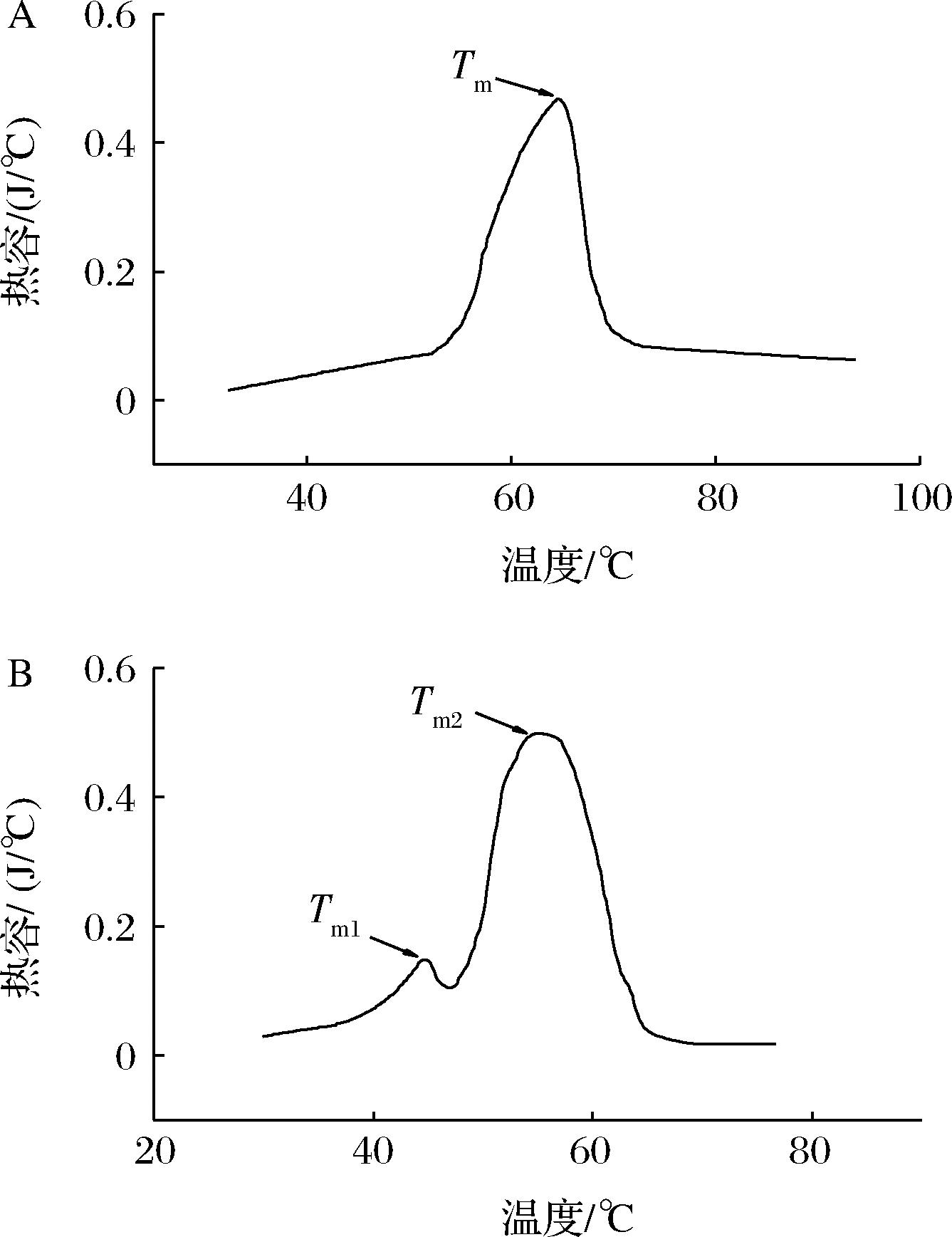
A-Nb-M6;B-mAb-1E6
图3 Nb-M6和mAb-1E6的DSC分析
Fig.3 DSC scans of Nb-M6 and mAb-1E6
2.4 Nb-icELISA方法的建立
2.4.1 反应体系的优化
棋盘滴定法确定了AFM1-BSA的包被质量浓度(0.5 μg/mL)和Nb-M6的最佳工作质量浓度(0.1 μg/mL)。ELISA检测需要合适的阻断溶剂将未包被的空白位点填满,以减少非特异性吸附。为此,本研究比较了不同封闭剂溶液和封闭时间的影响,结果表明使用5%质量分数的脱脂乳封闭1 h,IC50值达到最低,反应的灵敏度最高(图4-A和图4-B)。由于AFM1是亲脂性小分子,通常使用甲醇溶液制备AFM1标准品溶液,但是过量的甲醇可能会干扰抗原-抗体之间的相互作用。图4-C表明,当甲醇添加量低于40%(体积分数)时,竞争抑制曲线未受到影响;当甲醇添加量增加至60%~80%(体积分数)时,反应灵敏度受到显著影响,IC50值明显增大。因此,选择具有最低IC50值时的甲醇添加量为适宜添加量,即添加10%体积分数的甲醇溶液用于下一步试验。此外,极端的pH值可能会破坏Nb的结构,且离子强度会影响反应体系中的电荷分布。根据图4-D可知,当反应体系为偏酸性或碱性环境时,抗原-抗体的结合能力明显减弱,反应的灵敏度下降;控制反应体系处于中性时,即pH为7.0~8.0,抗原-抗体结合能力最强,在pH值为7.4时观察到最低的IC50值。同时,在离子强度为20 mmol/L时,Nb-icELISA表现出最佳性能(图4-E)。综上所述,选择以5%质量分数的脱脂乳为封闭剂、封闭时间为1 h、10%体积分数的甲醇溶液、pH值7.4、离子强度20 mmol/L作为最佳反应体系。
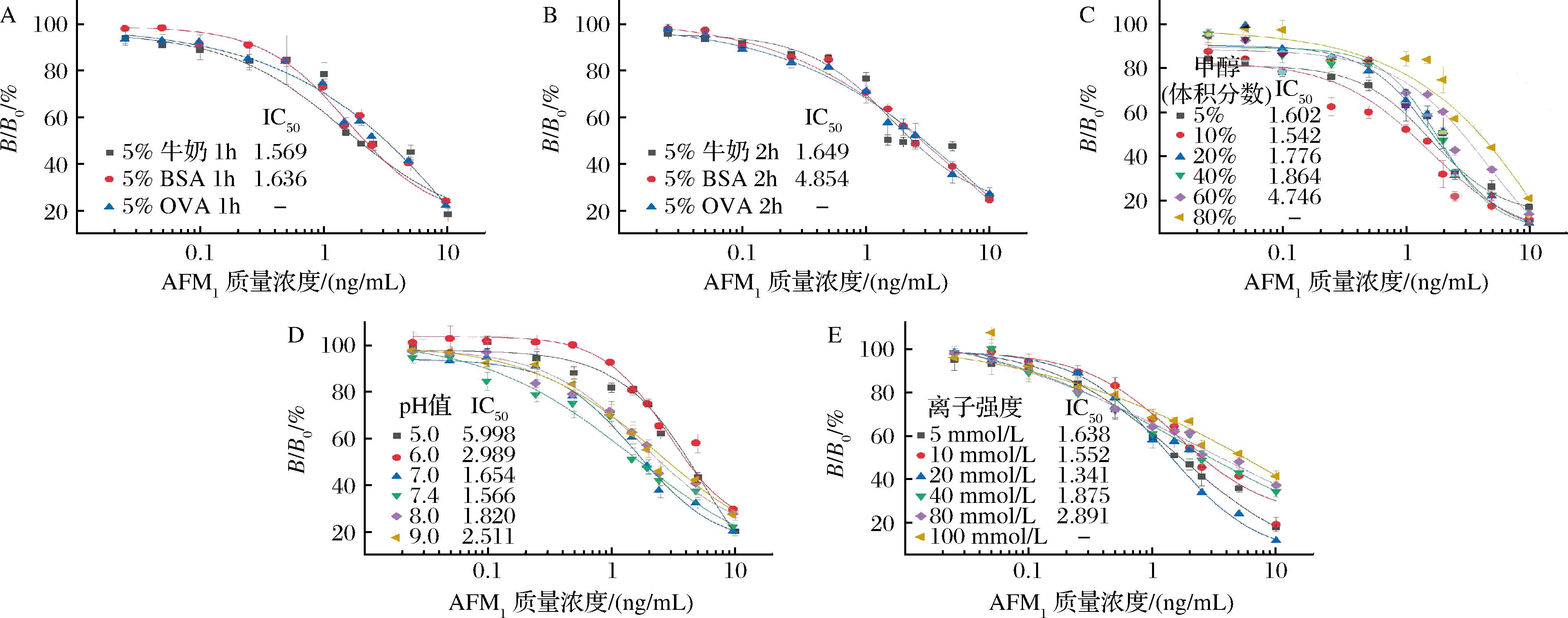
A-不同封闭剂封闭1 h;B-不同封闭剂封闭2 h;C-甲醇添加量的影响;D-pH值的影响;E-离子强度的影响
图4 Nb-icELISA反应参数的优化
Fig.4 Optimization parameters on the performance of Nb-icELISA
2.4.2 标准曲线的建立
基于最佳工作条件,建立Nb-icELISA检测方法,绘制竞争抑制标准曲线(图5)。Nb-icELISA的线性检测范围(IC20~IC80)为0.428~5.246 ng/mL,IC50为1.498 ng/mL,LOD为0.111 ng/mL。
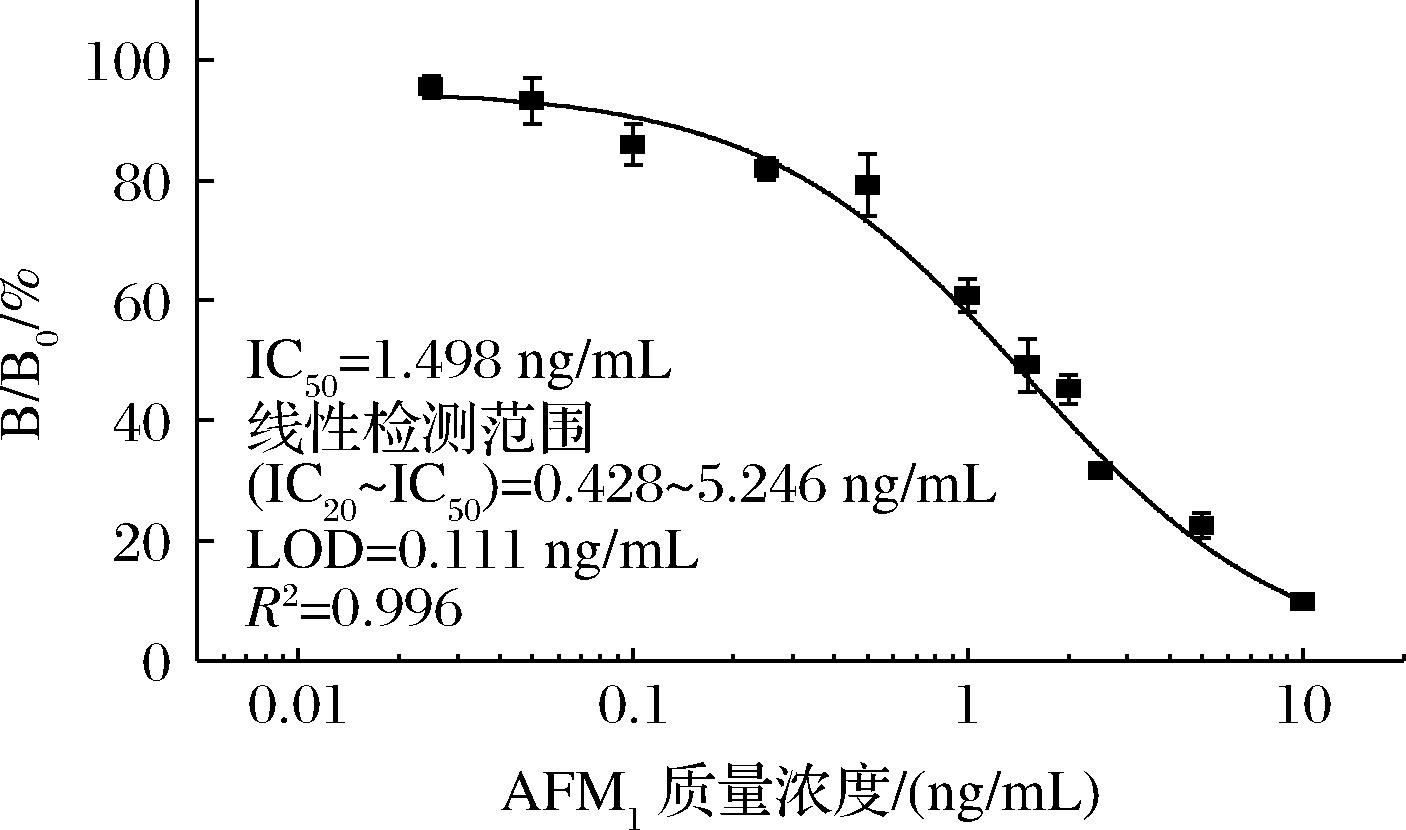
图5 Nb-icELISA检测AFM1的竞争抑制标准曲线
Fig.5 Standard indirect competitive inhibition curve of Nb-icELSIA for AFM1
2.5 特异性分析
通过测定Nb-M6与AFM1及其结构类似物AFM2、AFB1、AFB2、AFG1和AFG2以及DON和ZEN的交叉反应性,以评估Nb-icELISA针对AFM1的特异性。如图6所示,Nb-M6仅与AFM2具有轻微交叉,CR为5.3%,与其他真菌毒素的CR均可忽略不计(<0.1%),表明Nb-icELISA对AFM1具有很强的特异性。
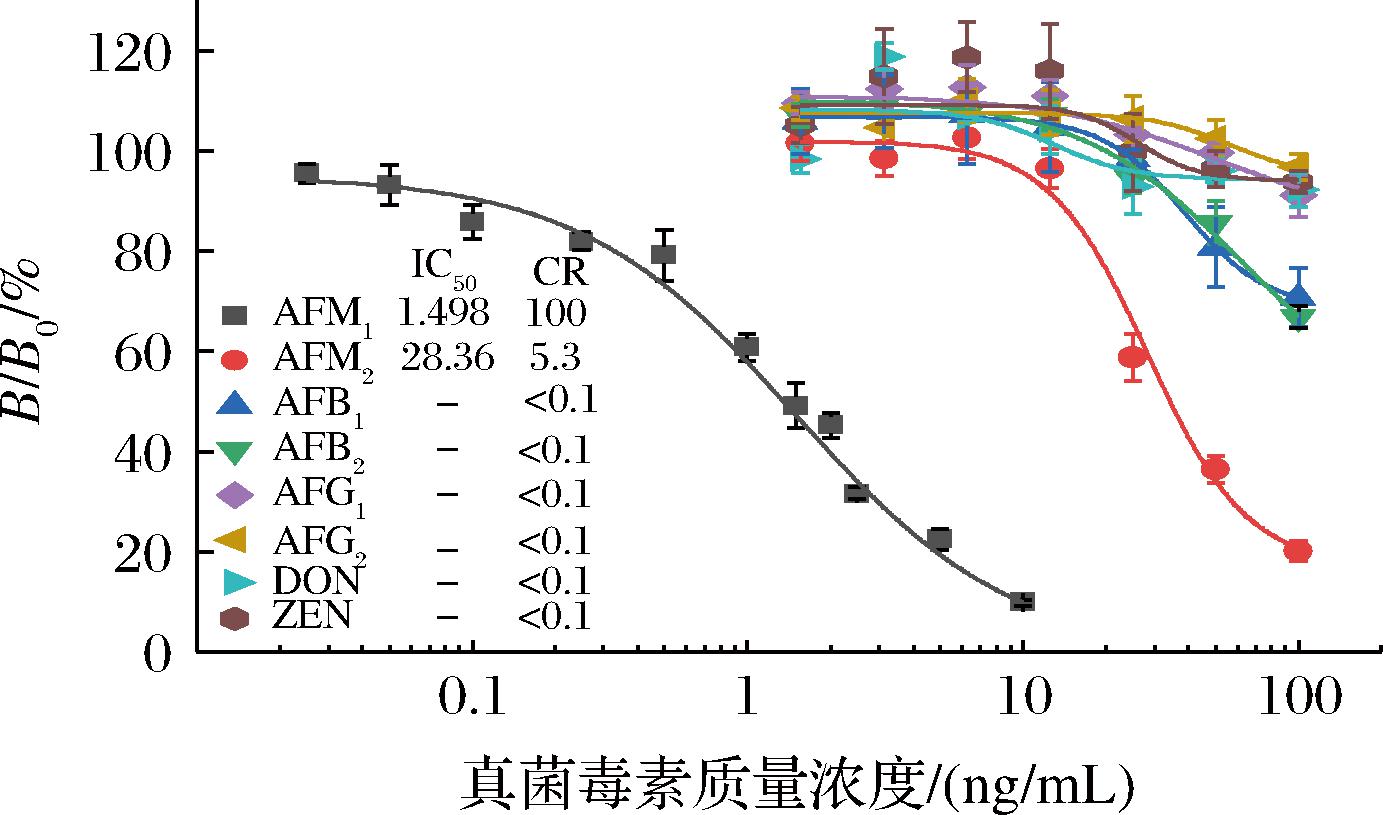
图6 不同真菌毒素的交叉反应
Fig.6 Cross-reactivity toward different mycotoxins
2.6 准确性分析
基质效应是影响抗原-抗体相互作用的另一个重要因素,通过适当稀释样品提取液或添加少量BSA均可使得基质效应最小化。为了评估Nb-icELISA的基质效应,选择牛奶、奶粉和酸奶作为代表性样品,以确定基质对Nb-icELISA的影响。结果如图7所示,牛奶和奶粉样品经离心后取中间层清液直接用于稀释AFM1标准品,IC50分别为1.539 ng/mL和1.685 ng/mL,LOD分别为0.149 ng/mL和0.188 ng/mL,线性检测范围分别为0.286~8.272 ng/mL和0.432~6.574 ng/mL,与无基质组的竞争抑制曲线基本吻合,基质效应可忽略;而酸奶样品需要使用PBS(含1%质量浓度的BSA)稀释样品提取液2倍后方可去除基质效应,IC50为1.531 ng/mL,LOD为0.271 ng/mL,线性检测范围为0.436~4.496 ng/mL。
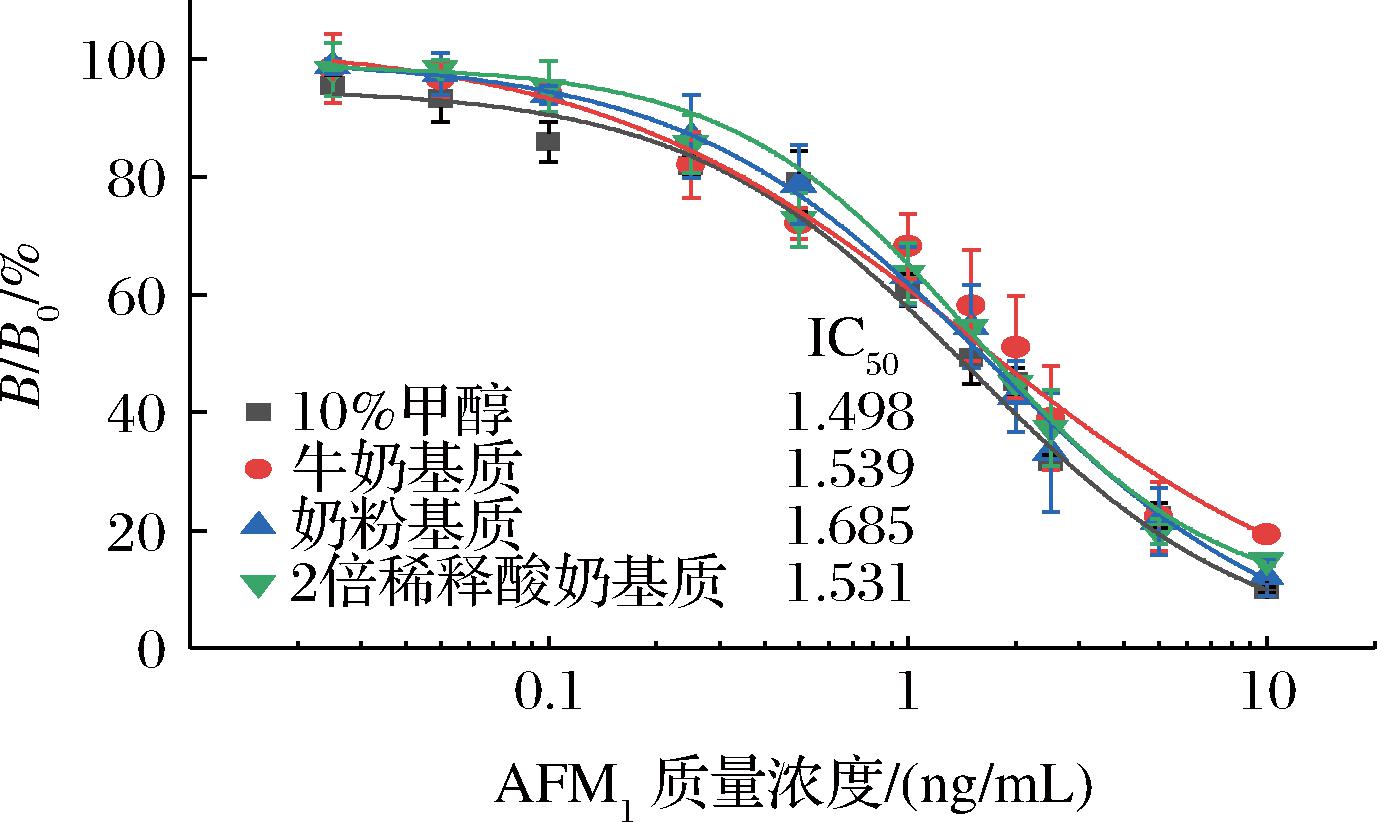
图7 样品基质对Nb-icELISA的影响
Fig.7 Effect of sample matrix on Nb-icELISA performances
为评估Nb-icELISA的精确性,分别在牛奶、奶粉和酸奶样品中添加AFM1标准品至终质量浓度为0.4、0.5和0.8 ng/mL(ng/g),同时使用Nb-icELISA和HPLC进行测定,每组样品重复测定3次。加标回收结果如表2所示,Nb-icELISA的平均回收率为89.8%~104.1%,HPLC的平均回收率为102.3%~109.2%。2种检测方法的结果趋于一致,表明Nb-icELISA几乎不受样品基质影响,可应用于实际样品的检测。
表2 Nb-icELISA和HPLC分析AFM1加标样品
Table 2 Recoveries of AFM1 from the spiked samples by Nb-icELISA and HPLC
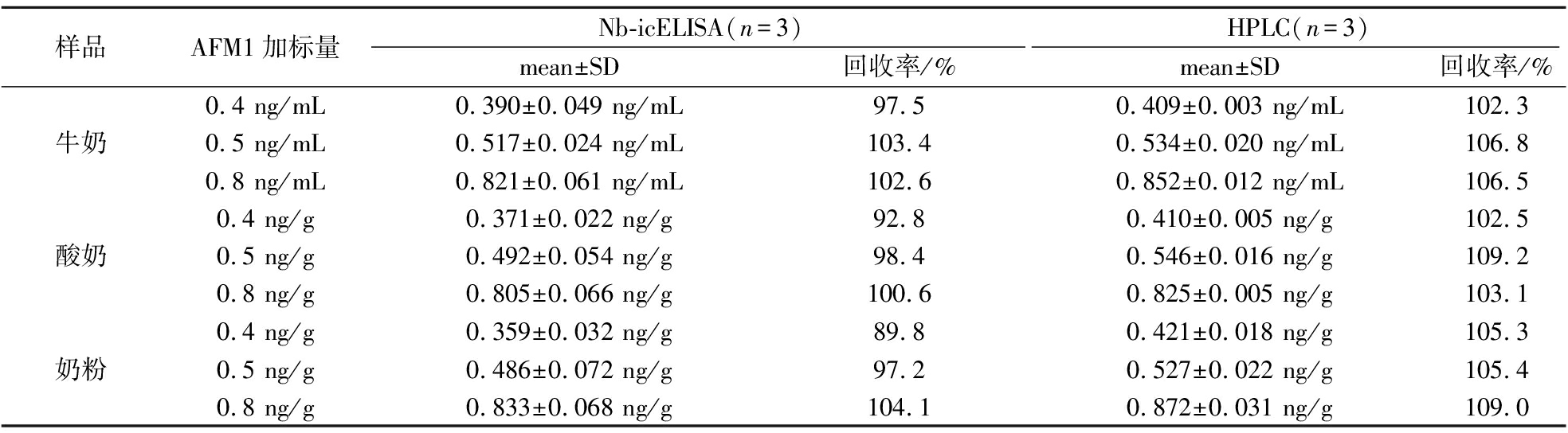
样品AFM1加标量Nb-icELISA(n=3)HPLC(n=3)mean±SD回收率/%mean±SD回收率/%0.4 ng/mL0.390±0.049 ng/mL97.50.409±0.003 ng/mL102.3牛奶0.5 ng/mL0.517±0.024 ng/mL103.40.534±0.020 ng/mL106.80.8 ng/mL0.821±0.061 ng/mL102.60.852±0.012 ng/mL106.50.4 ng/g0.371±0.022 ng/g92.80.410±0.005 ng/g102.5酸奶0.5 ng/g0.492±0.054 ng/g98.40.546±0.016 ng/g109.20.8 ng/g0.805±0.066 ng/g100.60.825±0.005 ng/g103.10.4 ng/g0.359±0.032 ng/g89.80.421±0.018 ng/g105.3奶粉0.5 ng/g0.486±0.072 ng/g97.20.527±0.022 ng/g105.40.8 ng/g0.833±0.068 ng/g104.10.872±0.031 ng/g109.0
3 结论
本研究首次报道了AFM1特异性纳米抗体Nb-M6,开发和生产的成本低、产量高,并且Nb-M6具有亲和力强、热稳定性良好等优势,研究结果为AFM1的免疫学检测提供了新的核心试剂。利用Nb-M6开发Nb-icELISA免疫测定法,IC50为1.498 ng/mL,线性范围为0.428~5.246 ng/mL,加标回收验证该方法具有良好的精密度,该方法满足乳制品中AFM1的定量检测,具有一定的应用价值。
[1] BATTACONE G, NUDDA A, PALOMBA M, et al.The transfer of aflatoxin M1 in milk of ewes fed diet naturally contaminated by aflatoxins and effect of inclusion of dried yeast culture in the diet[J].Journal of Dairy Science, 2009, 92(10):4997-5004.
[2] SABINO M, PURCHIO A, MILANEZ T V.Aflatoxins B1, M1 and aflatoxicol in tissues and urine of calves receiving aflatoxin[J].Food Additives and Contaminants, 1995, 12(3):467-472.
[3] WU H Y, GAO Y N, LI S L, et al.Lactoferrin alleviated AFM1-induced apoptosis in intestinal NCM 460 cells through the autophagy pathway[J].Foods, 2021, 11(1):23.
[4] UMAYA S R, VIJAYALAKSHMI Y C, SEJIAN V.Exploration of plant products and phytochemicals against aflatoxin toxicity in broiler chicken production:Present status[J].Toxicon, 2021, 200:55-68.
[5] OSTRY V, MALIR F, TOMAN J, et al.Mycotoxins as human carcinogens-the IARC monographs classification[J].Mycotoxin Research, 2017, 33(1):65-73.
[6] DU B B, SU X O, YANG K H, et al.Antibody-free colorimetric detection of total aflatoxins in rice based on a simple two-step chromogenic reaction[J].Analytical Chemistry, 2016, 88(7):3775-3780.
[7] SASAN M N A, ALI H, TAYEBE G.The occurrence and risk assessment of aflatoxin M1 in cheeses samples from Hamadan, Iran[J].Iranian Journal of Pharmaceutical Research:IJPR, 2020, 19(4):44-50.
[8] NEJAD A S M, HESHMATI A, GHIASVAND T.The occurrence and risk assessment of exposure to aflatoxin M1 in ultra-high temperature and pasteurized milk in Hamadan province of Iran[J].Osong Public Health and Research Perspectives, 2019, 10(4):228-233.
[9] QIE Z W, LIU Q Q, YAN W L, et al.Universal and ultrasensitive immunochromatographic assay by using an antigen as a bifunctional element and antialbumin antibody on a test line[J].Analytical Chemistry, 2019, 91(15):9530-9537.
[10] VAZ A, CABRAL SILVA A C, RODRIGUES P, et al.Detection methods for aflatoxin M1 in dairy products[J].Microorganisms, 2020, 8(2):246.
[11] SHUNDO L, SABINO M.Aflatoxin M1 in milk by immunoaffinity column cleanup with TLC/HPLC determination[J].Brazilian Journal of Microbiology, 2006, 37(2):164-167.
[12] SHUIB N S, MAKAHLEH A, SALHIMI S M, et al.Determination of aflatoxin M1 in milk and dairy products using high performance liquid chromatography-fluorescence with post column photochemical derivatization[J].Journal of Chromatography A, 2017, 1510:51-56.
[13] CHEN M B, LIU X Z, YANG S, et al.HPLC-MS/MS method for the simultaneous determination of aflatoxins in blood:Toxicokinetics of aflatoxin B1 and aflatoxin M1 in rats[J].Journal of Analytical Science and Technology, 2022, 13(1):27.
[14] NGUYEN T, FLINT S, PALMER J.Control of aflatoxin M1 in milk by novel methods:A review[J].Food Chemistry, 2020, 311:125984.
[15] DANESH N M, BOSTAN H B, ABNOUS K, et al.Ultrasensitive detection of aflatoxin B1 and its major metabolite aflatoxin M1 using aptasensors:A review[J].TrAC Trends in Analytical Chemistry, 2018, 99:117-128.
[16] WANG X, NIESSNER R, TANG D P, et al.Nanoparticle-based immunosensors and immunoassays for aflatoxins[J].Analytica Chimica Acta, 2016, 912:10-23.
[17] ARBABI-GHAHROUDI M.Camelid single-domain antibodies:Promises and challenges as lifesaving treatments[J].International Journal of Molecular Sciences, 2022, 23(9):5009.
[18] YU X Y, XU Q L, WU Y, et al.Nanobodies derived from Camelids represent versatile biomolecules for biomedical applications[J].Biomaterials Science, 2020, 8(13):3559-3573.
[19] VU K B, GHAHROUDI M A, WYNS L, et al.Comparison of llama VH sequences from conventional and heavy chain antibodies[J].Molecular Immunology, 1997, 34(16-17):1121-1131.
[20] ZHAO F C, TIAN Y, SHEN Q, et al.A novel nanobody and mimotope based immunoassay for rapid analysis of aflatoxin B1[J].Talanta, 2019, 195:55-61.
[21] LIU X, WEN Y P, WANG W J, et al.Nanobody-based electrochemical competitive immunosensor for the detection of AFB1 through AFB1-HCR as signal amplifier[J].Mikrochimica Acta, 2020, 187(6):352.
[22] CAI C, ZHANG Q, NIDIAYE S, et al.Development of a specific anti-idiotypic nanobody for monitoring aflatoxin M1 in milk and dairy products[J].Microchemical Journal, 2021, 167:106326.
[23] TANG X Q, CATANANTE G, HUANG X R, et al.Screen-printed electrochemical immunosensor based on a novel nanobody for analyzing aflatoxin M1 in milk[J].Food Chemistry, 2022, 383:132598.
[24] LI G M, LIU C, ZHANG X C, et al.Highly photoluminescent carbon dots-based immunosensors for ultrasensitive detection of aflatoxin M1 residues in milk[J].Food Chemistry, 2021, 355:129443.
[25] FRIDY P C, LI Y Y, KEEGAN S, et al.A robust pipeline for rapid production of versatile nanobody repertoires[J].Nature Methods, 2014, 11(12):1253-1260.
[26] KLIBANOV A M.Stabilization of enzymes against thermal inactivation[J].Advances in Applied Microbiology, 1983, 29:1-28.
[27] KAUR H.Stability testing in monoclonal antibodies[J].Critical Reviews in Biotechnology, 2021, 41(5):692-714.
[28] MAITY H, O′Dell C, SRIVASTAVA A, et al.Effects of arginine on photostability and thermal stability of IgG1 monoclonal antibodies[J].Current Pharmaceutical Biotechnology, 2009, 10(8):761-766.