睡眠是人体维持正常生存的必要环节,随着生活节奏的加快,人们生活压力不断增加,失眠成为越来越多人的困扰,由失眠催生出的催眠行业近年来迅猛发展,中国的睡眠经济整体市场规模已经从2016年的2 616.3亿元增至2020年的3 778.6亿元,四年间增幅达到了44.42%[1]。失眠的主要内在因素是脑神经过度兴奋,这主要是神经递质系统分泌异常导致[2]。调查发现不同年龄段均存在失眠情况:2021年老年人睡眠障碍患病率高达46%[3]。中国40~65岁女性群体的失眠障碍率为46.87%[4]。失眠会危害人的心理与生理健康,对大脑形成不可逆转的伤害,对大脑海马区的认知功能和记忆功能造成损伤,产生错误记忆影响人们正确执行对认知要求高的任务[5],引起氧化应激,诱导海马神经元坏死,增加患痴呆或痴呆发病的几率[6-7]。目前解决失眠的途径主要有3种:膳食疗法[8]、行为疗法[9]、药物疗法[10]。但这3种方法各有缺点:膳食只能通过饮食调节身体,效果最微;当今人们生活节奏快,行为疗法耗时太长;使用药物会导致身体出现成瘾性和其他副作用,对身体危害极大[11]。功能食品无毒副作用,效果好,适合特定人群,缓解了人们对治疗失眠药物的担忧。扁舵鲣鱼低聚肽是通过鲣鱼分离提纯的一类富含2~20个氨基酸小分子肽的天然多肽产物,早有研究证明其具有良好的降尿酸、抗疲劳、抗高血压、抗氧化和神经保护作用等活性[12-13]。据《2022年中国渔业统计年鉴》[14]统计:扁舵鲣鱼是金枪鱼种类中捕捞量最大的种群,其味腥肉硬的特点导致利用率极低,主要用来加工成罐头、饲料和调味品,其附加值与捕捞量反差极大。扁舵鲣鱼的洄游特性使其富含优质蛋白、多不饱和脂肪酸和维生素等营养成分、氨基酸分布均衡,其中含有的组氨酸二肽等小分子肽非常容易被吸收,可以通过血脑屏障到达大脑,修复或保护大脑损伤细胞或屏障[15],且相对于其他金枪鱼而言价格便宜,性价比较高[16]。因此扁舵鲣鱼低聚肽是一类非常适合用于功能食品开发的原料。
海马神经元HT-22细胞简称为HT-22细胞,是通过来源于小鼠海马神经元组织的HT-4细胞系亚克隆的永生化小鼠海马细胞系,具有和小鼠海马神经元相同的功能性胆碱能特性,可以分泌5-HT、乙酰胆碱、胆碱[17]。关于扁舵鲣鱼低聚肽对HT-22细胞的保护作用的文献较少。本研究利用HT-22细胞作为体外睡眠模型[18],皮质酮和谷氨酸作为造模剂从氧化应激和神经损伤两方面探究扁舵鲣鱼低聚肽对HT-22损伤细胞的保护作用,通过测定细胞内氧化还原相关酶及神经递质释放相关酶的水平,体外模拟失眠对海马神经元细胞造成损伤时扁舵鲣鱼低聚肽的保护作用,以期为扁舵鲣鱼低聚肽在开发抗失眠肽等高值产品上提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
扁舵鲣鱼低聚肽[主要成分:总氮(以N计)14.7 g/100 g、低聚肽(以干基计)83.8 g/100 g、相对分子质量<1 000 Da肽所占比例92.5%。其他均符合国家相关标准要求],肇庆兴亿海洋生物工程有限公司;小鼠海马神经元HT-22细胞、0.25%胰蛋白酶,上海研抗生物科技有限公司;地西泮,广东省湛江市广东医科大学附属医院;胎牛血清,美国ZETA;小鼠胆碱试剂盒、小鼠5-HT试剂盒,上海纪宁实业有限公司;青霉素-链霉素溶液、DAPI染色液、BCA蛋白质浓度测定试剂盒、活性氧(reactive oxygen species,ROS)检测试剂盒,碧云天生物技术研究所;噻唑蓝(methyl thiazolyl tetrazolium,MTT)、皮质酮,上海源叶生物科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO),赛国生物科技有限责任公司;L-谷氨酸,上海麦克林生化科技有限公司;中性红染色液(0.33%),北京索莱宝科技有限公司;小鼠乙酰胆碱(acetylcholine,ACh)试剂盒,上海通蔚生物科技有限公司;乳酸脱氢酶(lactic dehydrogenase,LDH)试剂盒、还原性谷胱甘肽(glutathione,GSH)含量试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、乙酰胆碱酯酶(acetylcholin esterase,AChE)试剂盒,苏州格锐思生物科技有限公司。
1.2 仪器与设备
SW-CJ-2FD超净工作台,苏州净化设备有限公司;MCO-175细胞CO2培养箱,SANYO日本;Varioskan全自动酶标仪,赛默飞世尔科技有限公司;DMI4000B 倒置荧光显微镜,徕卡显微系统有限公司。
1.3 实验方法
1.3.1 扁舵鲣鱼低聚肽对细胞毒性
1.3.1.1 细胞培养及分组
将购买的HT-22细胞培养至细胞密度达70%~90%时进行传代培养,细胞培养液为含10%胎牛血清和1%青霉素-链霉素溶液的DMEM培养液,培养在37 ℃,含5% CO2,相对湿度90%的培养箱,当细胞生长至对数期后对细胞进行实验[19]。
将对数期细胞接种到96孔培养板上,接种密度为5×103 cells/mL,接种体积为0.1 mL,培养24 h后进行分组:空白组为不含细胞的培养液,对照组细胞不作任何处理,ATP组分为6组,分别在细胞中加入含终质量浓度为10、20、40、80、160、320 μg/mL ATP的细胞培养液。细胞分组完成后再分别培养6、12、24、48 h。
1.3.1.2 MTT法测细胞活力实验
通过MTT法[19]测定细胞活力:每孔各加20 μL质量浓度为5 g/L的MTT溶液,培养箱继续培养4 h,弃上清液,每孔各加150 μL的DMSO,室温避光振荡15 min,于570 nm下测定吸光度,不同ATP浓度和时间培养的细胞活力的计算如公式(1)所示:
细胞活力![]()
(1)
1.3.1.3 细胞形态观察
通过中性红染色实验观察细胞形态:将0.33%中性红溶液用蒸馏水溶解至0.1%,过滤使用。细胞按1.3.1.1节培养后每孔吸去培养液,加40 μL的0.1%的中性红溶液染色10 min,小心吸去染液,用PBS洗3次,通过显微镜观察细胞形态并拍照。
1.3.2 ATP对皮质酮和谷氨酸诱导细胞损伤的影响
1.3.2.1 皮质酮造模浓度筛选
根据柳丽等[20]方法有改动,取对数生长期的细胞接种到96孔板中,接种密度为5×103 cells/mL,接种体积为0.1 mL,培养24 h后进行分组:空白组为不含细胞的细胞培养液;对照组(Control)细胞不作任何处理;模型组(Model)分为8组,分别在细胞中加入含终浓度为0.5、0.6、0.7、0.8、0.9、1.0、1.5、2.0 mmol/L皮质酮的细胞培养液。通过MTT测细胞活力,步骤同1.3.1.2节通过IC50确定细胞造模浓度。
1.3.2.2 谷氨酸造模浓度筛选
根据高宁辛等[21]方法有改动,取对数生长期的细胞接种到96孔板中,接种密度为5×103 cells/mL,接种体积为0.1 mL,培养24 h后进行分组:空白组为不含细胞的培养液,Control细胞不作任何处理,Model组分为8组,分别在细胞中加入含终浓度为10、11、12、13、14、15、16、17 mmol/L谷氨酸的细胞培养液。分组完成后培养24 h,通过MTT法测细胞活力,步骤同1.3.1.2节通过IC50确定细胞造模浓度。
1.3.2.3 ATP对皮质酮和谷氨酸诱导损伤细胞存活率影响
造模剂浓度确定后,取对数生长期的细胞接种到96孔板中,接种密度为5×103 cells/mL,接种体积为0.1 mL,培养24 h后进行分组:空白组为不含细胞的培养液;Control组细胞不作任何处理;Model组分为2组:一组在细胞中加入终浓度为15 mmol/L谷氨酸的细胞培养液,另一组在细胞中加入终浓度为0.9 mmol/L皮质酮的细胞培养液;样品组分为6组:其中3组为终浓度0.9 mmol/L皮质酮干预的ATP高(HP)、中(MP)、低(LP)剂量组,另外3组为终浓度15 mmol/L谷氨酸干预的ATP高(HP)、中(MP)、低(LP)剂量组。阳性组(AC)分为2组:一组是细胞中加入混合皮质酮和地西泮(终浓度为皮质酮0.9 mmol/L,地西泮25 μg/mL)的细胞培养液,另一组加入混合谷氨酸和地西泮(终浓度为谷氨酸15.0 mmol/L,地西泮25 μg/mL)的细胞培养液。分组完成后培养24 h,通过MTT进行细胞活力测定和细胞DAPI染色观察。
通过MTT测定细胞活力,步骤同1.3.1.2节。
DAPI是一种荧光染色剂,可以通过荧光染色观察细胞核破裂情况,将细胞提前固定再染色,则可显著观察到细胞核情况[22]。通过DAPI染色液观察细胞核:吸去孔板内细胞上清液,加100 μL多聚甲醛固定液固定细胞,15 min后吸去固定液,PBS清洗3次,弃洗液,加40 μL DAPI染液(覆盖底部)染色3 min,弃染液,用PBS清洗3次后在荧光显微镜下观察细胞并拍照。
1.3.3 细胞5-HT、乙酰胆碱、乙酰胆碱酯酶、胆碱水平测定
取对数生长期的HT-22细胞接种于6孔板中,接种密度为2×105 cells/mL,接种体积为2.5 mL,培养24 h后进行分组再培养24 h,分组情况:空白组为不含细胞的细胞培养液;对照组(Control)细胞不作任何处理;模型组(Model)为在细胞中加入含终浓度为0.9 mmol/L皮质酮的细胞培养液;阳性组(AC)在细胞中加入含终质量浓度为25 μg/mL的地西泮和0.9 mmol/L的皮质酮的细胞培养液;样品组为终浓度0.9 mmol/L皮质酮干预的ATP高(HP)、中(MP)、低(LP)剂量组。参照小鼠5-HT、小鼠乙酰胆碱、乙酰胆碱酯酶、胆碱和BCA试剂盒说明书对细胞上清液及细胞内蛋白含量进行定量测定。
1.3.4 细胞LDH水平测定
取对数生长期的HT-22细胞接种于6孔板中,接种密度为2×105 cells/mL,接种体积为2.5 mL,培养24 h后进行分组再培养24 h,分组情况:空白组为不含细胞的细胞培养液;对照组(Control)细胞不作任何处理;模型组(Model)为在细胞中加入含终浓度为15 mmol/L谷氨酸的细胞培养液;阳性组(AC)在细胞中加入含终质量浓度为25 μg/mL的地西泮和15 mmol/L的谷氨酸的细胞培养液;样品组为终浓度15.0 mmol/L谷氨酸干预的ATP高(HP)、中(MP)、低(LP)剂量组。参照LDH和BCA试剂盒说明书对细胞上清液及细胞内蛋白含量进行LDH定量测定。
1.3.5 细胞GSH、GSH-Px、MDA、SOD含量测定
取对数生长期的HT-22细胞接种于6孔板中,接种密度为2×105 cells/mL,接种体积为2.5 mL,培养24 h后进行分组培养24 h,分组同1.3.4节。参照GSH、GSH-Px、MDA、SOD和BCA试剂盒说明书对细胞内蛋白含量进行定量测定。
1.3.6 细胞ROS测定
取对数生长期的HT-22细胞接种于6孔板中,接种密度为2×105 cells/mL,接种体积为2.5 mL,培养24 h后进行分组,分组同1.3.4节。继续培养24 h后将6孔板细胞消化到离心管中,用PBS清洗3次,用无血清培养基稀释ROS试剂盒中的荧光探针(Med Chem Express, DCFH-DA)至终浓度为10 μmol/L,每孔加DCFH-DA稀释液300 μL,培养箱继续孵育20 min,每5 min振荡1次,孵育结束后用PBS清洗3次,将细胞悬液一部分均匀铺到96孔板中,铺板密度为2×104 cells/mL,用酶标仪测定荧光强度;另一部分细胞悬液均匀铺到24孔板中,通过倒置荧光显微镜观察细胞并在200倍镜下拍照。
1.4 数据计算与分析
使用Origin 2023软件和GraphPad prism 9软件对数据进行差异性分析、处理和作图,实验数据均重复3次,采用单因素(ANOVA)分析,P<0.05表示数据具有显著性差异,具有统计学意义。
2 结果与分析
2.1 ATP对HT-22细胞的毒性反应
根据SILLAPACHAIYAPORN等[23]的研究发现,生物提取物对HT-22细胞的存活率存在相对性,当浓度太高或太低时细胞的存活率都会受影响,对细胞存在细胞毒性,为了消除提取物毒性的干扰,仅选择对细胞生长没有显著影响的提取物浓度来评估其对诱导剂诱导的HT-22细胞的保护作用。如图1所示,通过中性红染色观察细胞形态结合细胞活力的测定可以发现ATP在培养细胞6 h和48 h时,细胞触角淡化或缩短,细胞体变圆,细胞数量较少,细胞间连接减少呈分散状,其中培养6 h的细胞活力均显著高于对照组,培养48 h的细胞活力均显著低于对照组;在培养12 h时10、20、40、80、160 μg/mL的ATP对HT-22细胞均无毒性反应,320 μg/mL的ATP会显著增强HT-22细胞的生殖能力使细胞数量增多。观察细胞形态发现培养12 h和24 h细胞对比6 h和48 h培养HT-22细胞体较大,细胞核清晰可见,细胞触角伸展较长,细胞数量较多。对比发现24 h培养时间的细胞数量比12 h多,其中培养24 h的10、20、40 μg/mL质量浓度的ATP对细胞活力及细胞形态的影响最小,因此后续选择培养时间为24 h,培养质量浓度为10 μg/mL(LP组)、20 μg/mL(MP组)、40 μg/mL(HP组)。
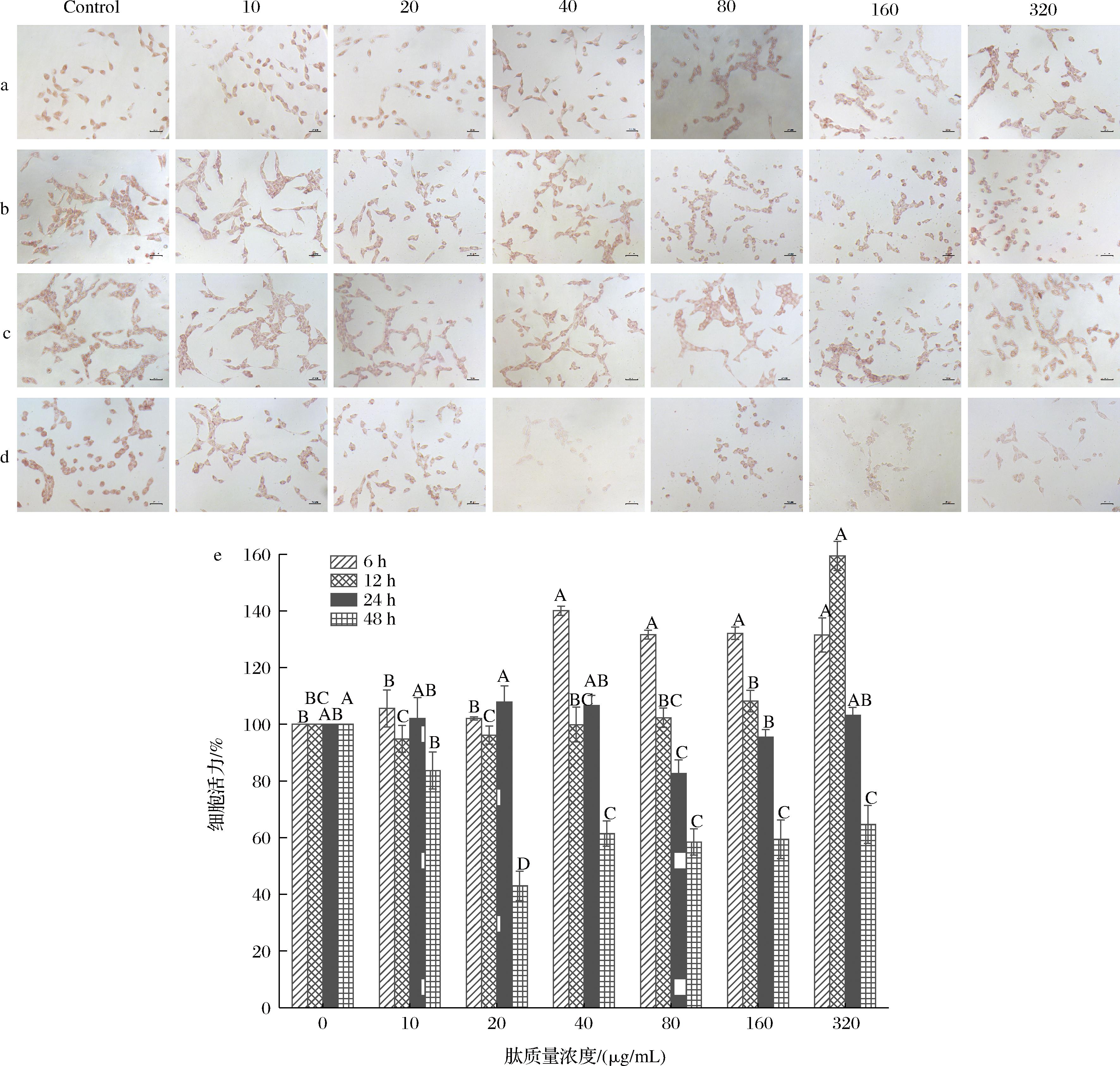
a-培养6 h;b-培养12 h;c-培养24 h;d-培养48 h;e-不同时间不同浓度ATP培养HT-22细胞活力值
图1 扁舵鲣鱼低聚肽不同浓度和时间对HT-22细胞作用
Fig.1 Cytotoxic effect of ATP at different time concentrations on HT-22 cells
注:不同字母表示显著性差异(P<0.05,n=3)(下同)。
2.2 皮质酮与谷氨酸诱导HT-22细胞损伤及ATP的保护作用
2.2.1 皮质酮造模浓度筛选
根据高珊[24]的研究可知浓度约0.8 mmol/L的皮质酮可降低HT-22细胞活力至50%左右,且皮质酮会浓度依赖性地降低HT-22细胞活性,对HT-22细胞造成不同程度的凋亡。周泓妍等[25]研究发现造模剂浓度过低会导致细胞损伤程度不够,无法研究后续提取物保护活性;浓度过高会导致细胞出现不可逆转的损伤,难以被修复,因此选择细胞活力在50%~60%的造模浓度最为合适。由图2-a可知在皮质酮作用浓度为0.5~2 mmol/L,HT-22细胞活力随着皮质酮浓度增大而减小,细胞活力下降至50%时皮质酮造模浓度为0.9~1.0 mmol/L,图2-b通过线性拟合发现皮质酮的IC50为0.94 mmol/L,表明HT-22细胞活力随皮质酮造模浓度变化的趋势和数值均符合IC50拟合规律,通过皮质酮造模浓度筛选结果再结合取整原则确定后续细胞实验中皮质酮造模浓度为0.9 mmol/L。
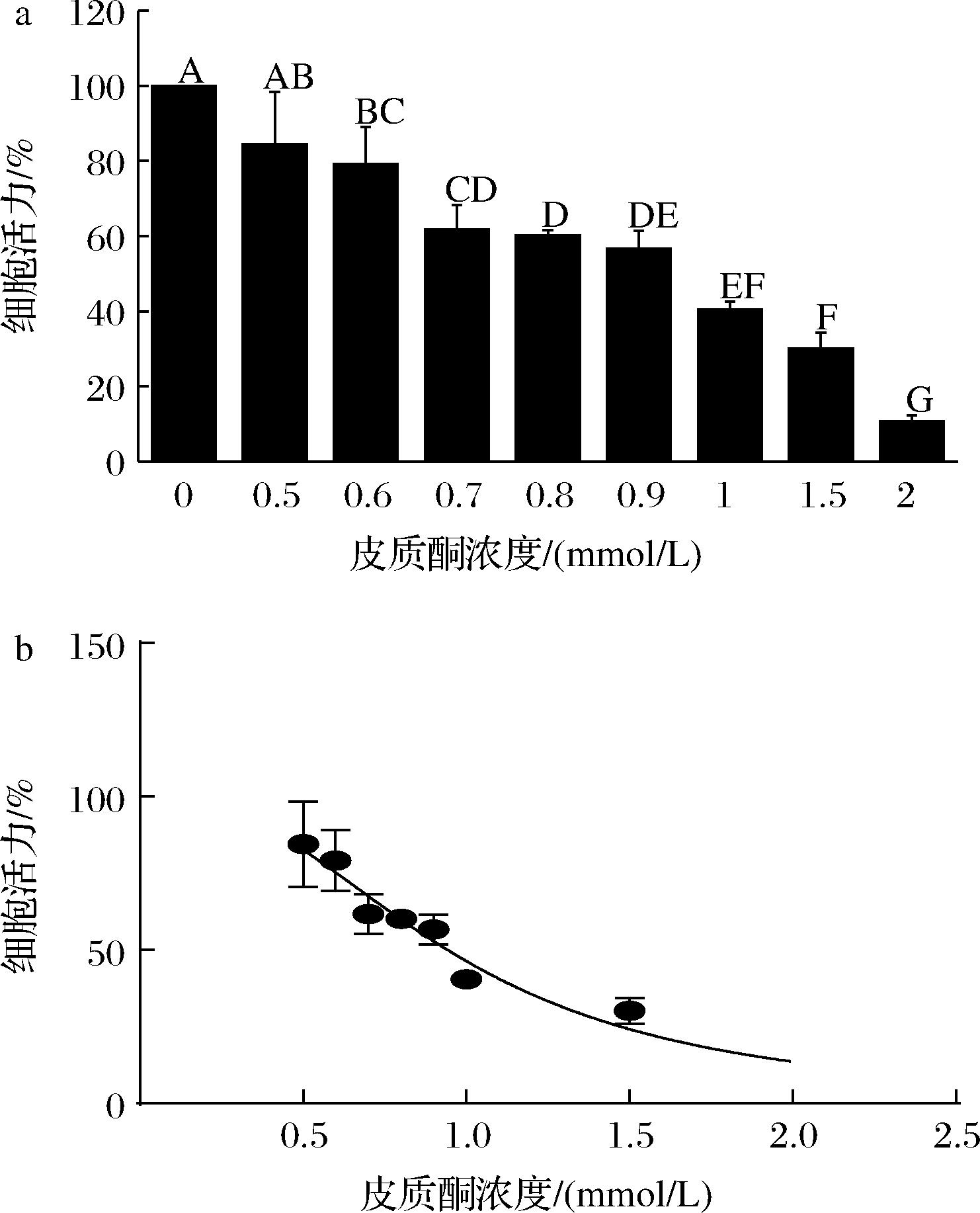
a-皮质酮不同浓度对HT-22细胞活力值;b-皮质酮IC50值
图2 皮质酮不同浓度对HT-22细胞活力影响
Fig.2 Effect of different corticosterone concentrations on HT-22 cells viability
2.2.2 谷氨酸造模浓度筛选
谷氨酸是大脑中一种最丰富的神经递质,可以调节神经可塑性,对学习和记忆非常重要,但谷氨酸过度积累会诱发神经毒性导致失眠,严重可引起神经退行性疾病[26]。参考高宁辛等[21]研究可知,使用谷氨酸诱导HT-22细胞损伤时,损伤程度达50%时的谷氨酸浓度处于10~20 mmol/L。由图3-a可知谷氨酸浓度为10~17 mmol/L时浓度与HT-22细胞活力成反比,谷氨酸浓度越高,细胞活力越低,谷氨酸对HT-22细胞的损伤与浓度呈剂量依赖性。由图3-b可知,细胞活力值线性拟合谷氨酸的IC50值为15.10 mmol/L,发现与MTT法测定的活力值基本吻合,均约为15 mmol/L,则本研究结果与高宁辛等[21]研究结果基本一致。通过谷氨酸造模浓度筛选结果并根据取整原则将谷氨酸造模浓度定为15.0 mmol/L。
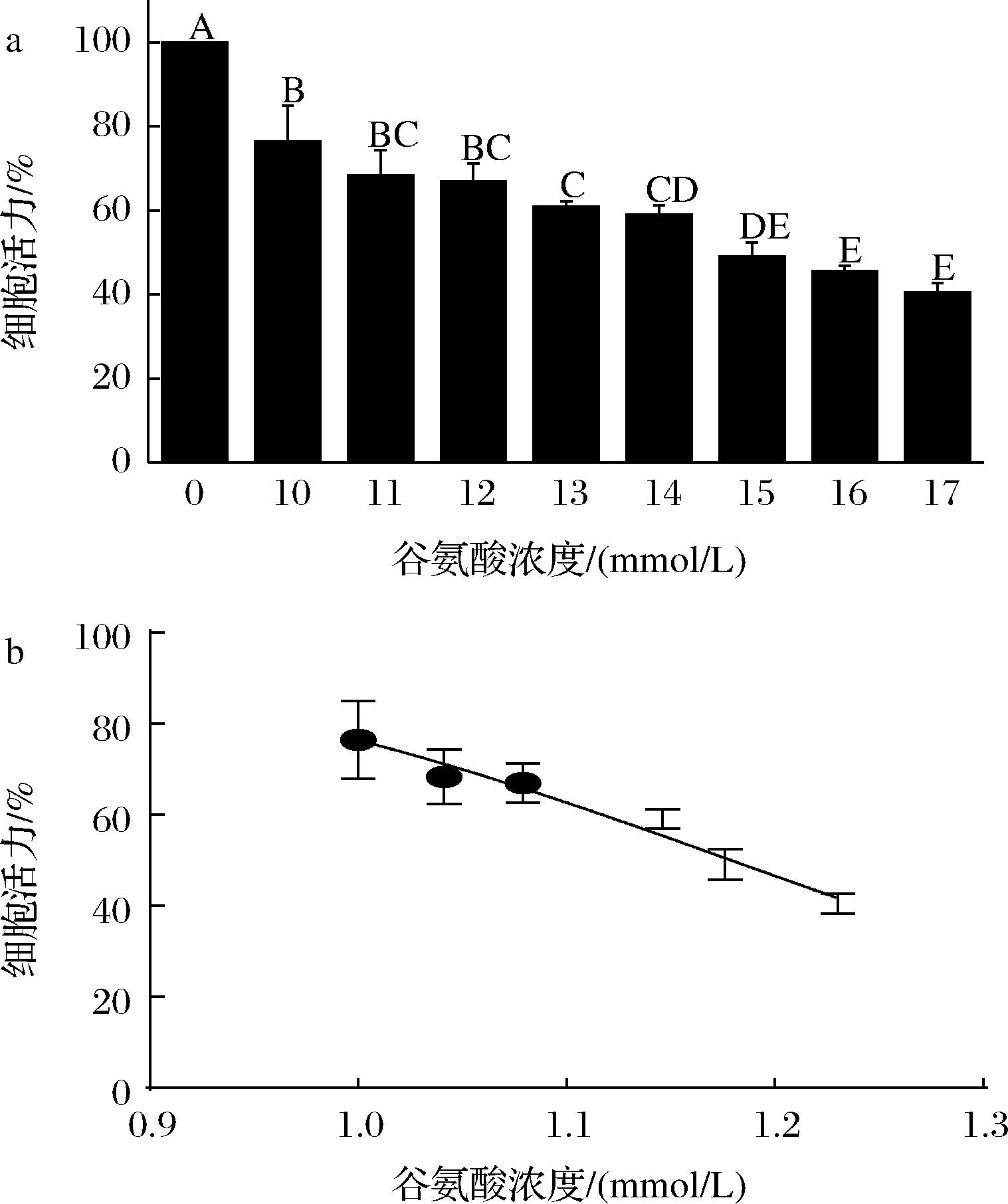
a-谷氨酸不同浓度对HT-22细胞活力值;b-谷氨酸IC50值
图3 谷氨酸不同浓度对HT-22细胞活力影响
Fig.3 Effect of different glutamic acid concentrations on HT-22 cells viability
2.2.3 ATP对皮质酮与谷氨酸诱导损伤细胞保护作用
通过文献可知扁舵鲣鱼低聚肽具有非常强的活性,能体外抑制肝癌细胞活性[27],分子质量较小的肽活性也较高,由图4-a可知,在皮质酮和谷氨酸造模浓度下添加ATP培养的HT-22细胞的存活率均显著高于Model组细胞存活率,其中皮质酮模型中的ATP对HT-22细胞的保护作用均强于AC组,谷氨酸诱导损伤HT-22细胞中20、40 μg/mL的ATP干预对细胞保护作用略强于AC组。由图4-b~图4-c发现皮质酮Model组和谷氨酸Model组中细胞核数量比Control组下降明显,但细胞核基本完好,证明皮质酮和谷氨酸造模浓度未损害细胞核,细胞的核功能基本完好,可进行神经递质调节释放等活动。2种模型中的AC、LP、MP、HP组细胞数量均显著多于Model组,表明ATP和地西泮均能阻止皮质酮和谷氨酸引起的细胞凋亡。
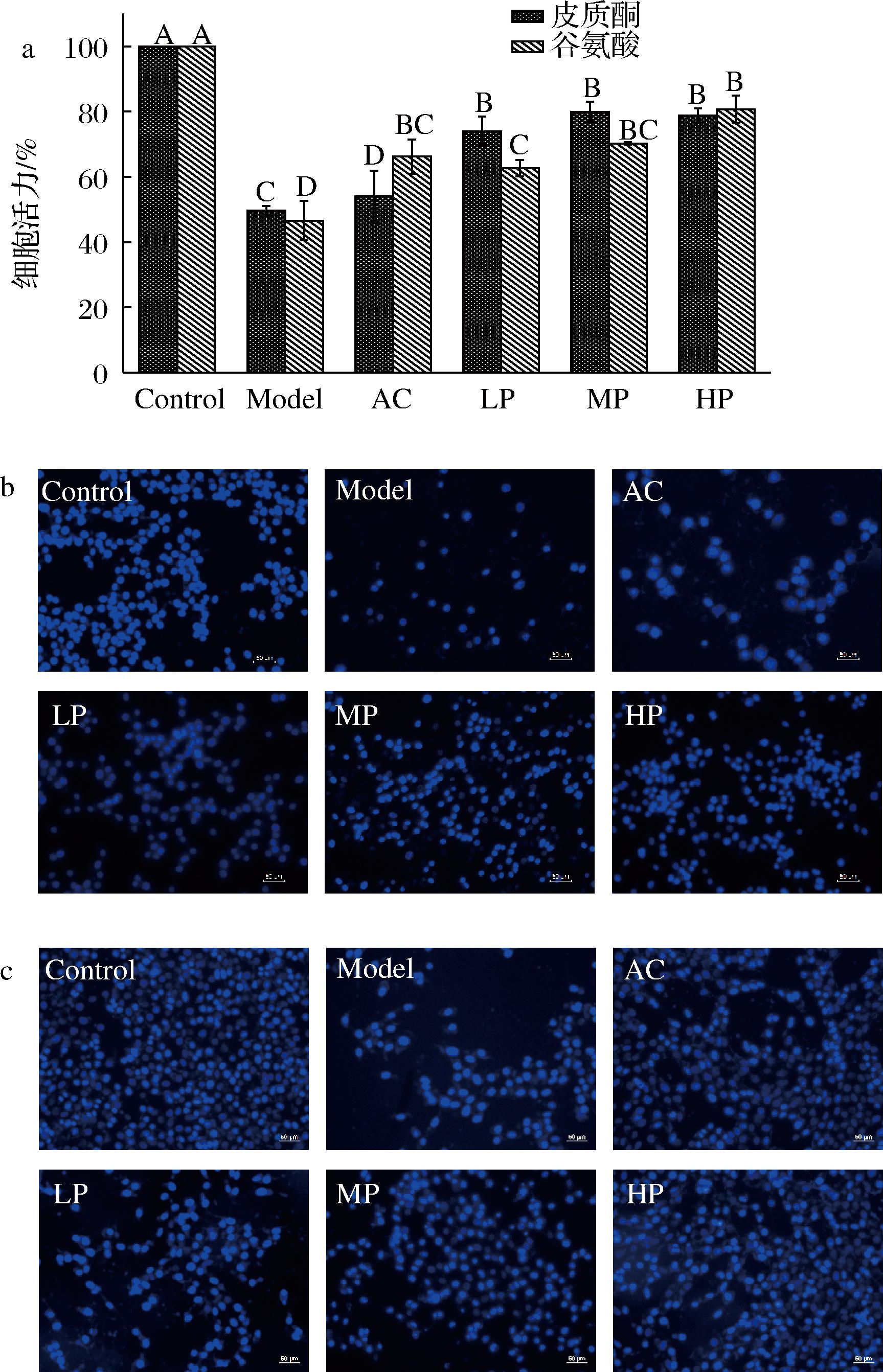
a-ATP保护皮质酮和谷氨酸诱导损伤细胞活力值;b-皮质酮诱导细胞损伤荧光图;c-谷氨酸诱导细胞损伤荧光图
图4 ATP对皮质酮及谷氨酸诱导HT-22细胞保护作用
Fig.4 Protective effect of ATP on HT-22 cells induced by corticosterone and glutamic acid
2.3 ATP对皮质酮诱导损伤HT-22细胞5-HT、乙酰胆碱、乙酰胆碱酯酶、胆碱水平影响
5-HT是一类抑制性神经递质,是开启睡眠的钥匙[28],乙酰胆碱是一类兴奋性神经递质,神经递质浓度过高会导致神经过度兴奋从而引起失眠。MISHIMA等[29]研究发现,部分肽可通过延缓易释放囊泡的再填充来调节由于被电极抑制神经递质释放的海马神经元细胞的神经递质释放量使其趋于正常。由图5可知,皮质酮诱导损伤的细胞5-HT、胆碱和乙酰胆碱酯酶活性均显著低于对照组,而乙酰胆碱水平远高于对照组。但在ATP和地西泮干预下HT-22损伤细胞5-HT、胆碱、AChE、ACh水平均有不同程度的提升,且5-HT、胆碱、ACh含量与对照组无显著差异。由图5-a和图5-b可知ATP可以调节由皮质酮引起的神经递质的失调并具有显著性(P>0.05)。乙酰胆碱酯酶是分解乙酰胆碱的分解酶,而胆碱是乙酰胆碱经过乙酰胆碱酯酶特异性分解后的产物之一。由图5-c、图5-d发现皮质酮造模后HT-22细胞内乙酰胆碱酯酶活性降低,胆碱含量降低,表明皮质酮造模会降低乙酰胆碱酯酶活性从而导致乙酰胆碱大量积累,神经兴奋性大大提高,产物之一胆碱含量降低,而ATP可以修复由皮质酮诱导引发的乙酰胆碱酯酶活性降低,使乙酰胆碱被正常降解,恢复胆碱含量为对照组水平,神经元兴奋下降至正常水平。
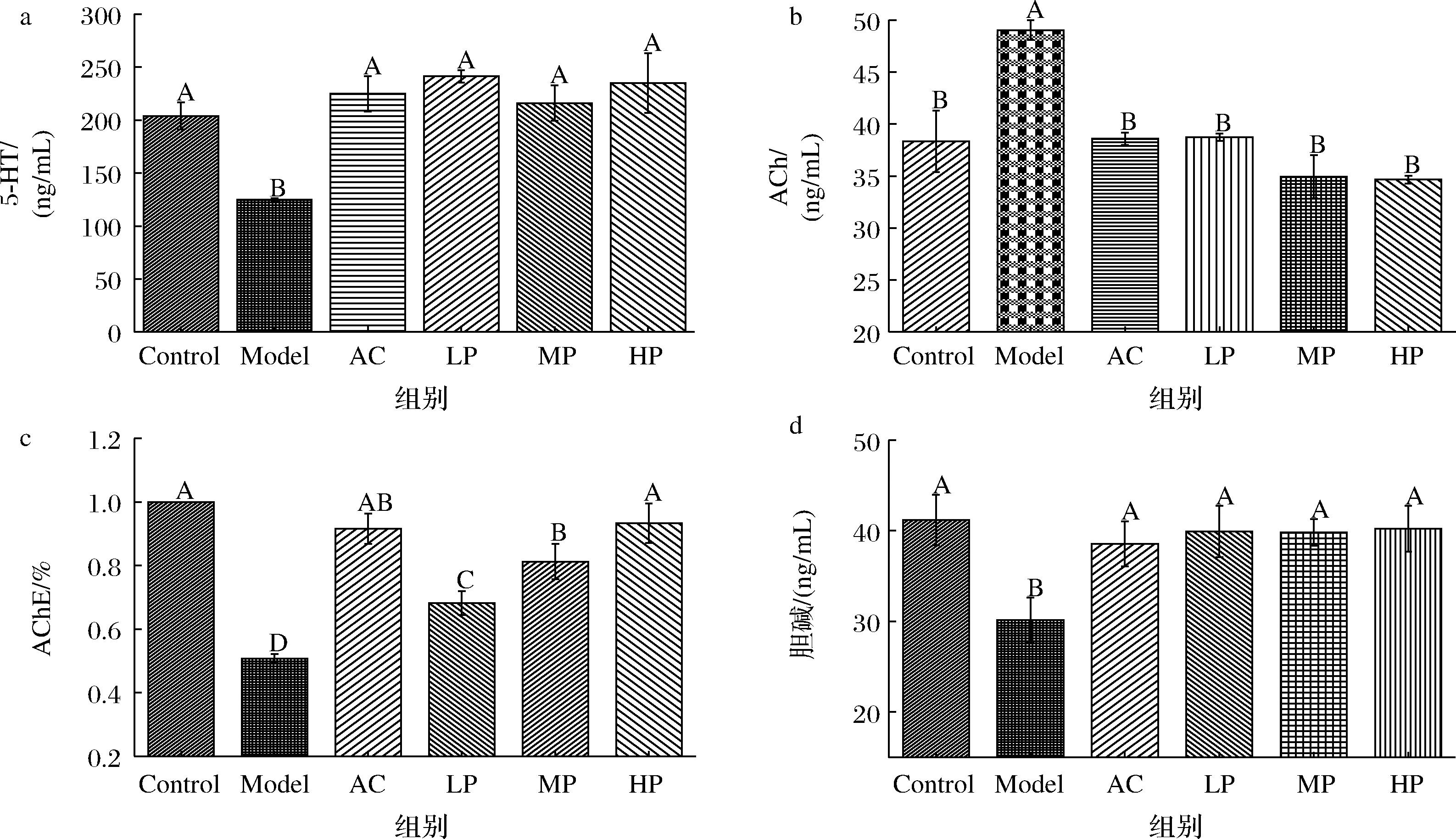
a-5-HT;b-ACh;c-AChE;d-胆碱
图5 ATP对谷氨酸诱导HT-22细胞5-HT、ACh、AChE、胆碱释放影响
Fig.5 Effect of ATP on that release of 5-HT, ACh, AChE, and choline in glutamic acid model HT-22cells
2.4 ATP对谷氨酸诱导损伤HT-22细胞LDH影响
LDH是细胞内才存在的一种胞内酶,细胞破裂或细胞膜通透性增加时,细胞内的LDH会释放到细胞外,因此通过测定细胞内外LDH含量可以评估细胞损伤程度[30]。由图6可知,谷氨酸诱导细胞损伤后Model组细胞上清液LDH水平对比对照组显著升高,而细胞内LDH水平急速下降,均具有显著性(P>0.05)。ATP和地西泮干预后细胞上清液中LDH谷氨酸诱导损伤HT-22细胞中上清液中的LDH漏出率可以恢复到与对照组相同水平,细胞内的LDH含量也与对照无显著性差异。因此可以确定损伤细胞上清液中的LDH主要来自活细胞的细胞膜破裂漏出,谷氨酸诱导损伤细胞会增大细胞膜的通透性,导致胞内酶LDH漏出,而ATP可以有效阻止谷氨酸对HT-22细胞膜的刺激,维持细胞膜的通透性。

a-LDH漏出;b-细胞内LDH水平
图6 ATP对谷氨酸诱导HT-22细胞内外LDH水平影响
Fig.6 ATP affect LDH activity in HT-22 cells induce by glutamic acid
2.5 ATP对谷氨酸诱导损伤HT-22细胞GSH、GSH-Px、SOD、MDA的影响
GSH是一类几乎存在身体每一个细胞里的低分子肽,可以通过其他酶系共同抑制或终止脂质过氧化反应;GSH-Px广泛存在于机体组织中,可以催化GSH发生过氧化反应,从而清除细胞在呼吸代谢过程中产生的过氧化物和羟自由基等氧化产物,以此减轻细胞的过氧化;SOD是一类具有超强抗氧化能力的酶,可以消除细胞内由于氧化应激产生的自由基等有害物质;MDA是评价细胞氧化损伤中脂质过氧化的指标,可反应细胞脂质过氧化的程度[31-32]。有文献证实鲣鱼鱼肉酶解物与蛋白源肽均可显著提升经H2O2诱导的HepG2细胞内抗氧化酶系的活性[13]。由图7发现,谷氨酸诱导损伤细胞会导致细胞的GSH、GSH-Px和SOD水平急剧下降,MDA含量则显著上升,而经过AC组和ATP干预后细胞内GSH、GSH-Px、SOD水平均比模型组显著提高,MDA均比模型组显著降低,表明ATP能显著逆转谷氨酸对细胞造成的一系列抗氧化物酶系活力的损伤。

a-GSH;b-GSH-Px;c-SOD;d-MDA
图7 ATP作用谷氨酸诱导HT-22细胞抗氧化物酶系活力
Fig.7 Activity of antioxidant enzyme system in HT-22 cells induced by glutamic acid under action of ATP
2.6 ATP对谷氨酸诱导损伤HT-22细胞ROS影响
ROS是体内一类含氧化合物的统称,这些化合物在细胞信号传导和调节体内平衡起到重要作用,线粒体是其产生的主要来源,正常组织会通过平衡ROS的生成和消除来维持细胞内氧化还原稳态,但过量的ROS具有很强的氧化能力,会导致细胞大分子产生大量氧化应激产物从而死亡[33],有研究指出过量谷氨酸刺激会导致神经元细胞产生并积累大量ROS从而引发[19]。谷氨酸升高后会激活NMDA、AMPA和红藻氨酸等离子受体,由于这些受体位于钙(Ca2+)可渗透离子通道,因此会导致细胞内Ca2+过载,ROS产生和线粒体膜去极化,随后诱导线粒体自噬的过度激活最终引起神经元死亡[34]。由图8-a可知,Model组细胞积累了大量ROS,图8-b中Model组细胞荧光强度最强,与测得的ROS规律一致,ATP干预组均可以减少细胞中由过量谷氨酸引起的ROS积累,且效果均比AC组要好。因此可知ATP可以调节ROS积累以维持细胞的氧化还原稳态平衡,是良好的ROS消除剂。
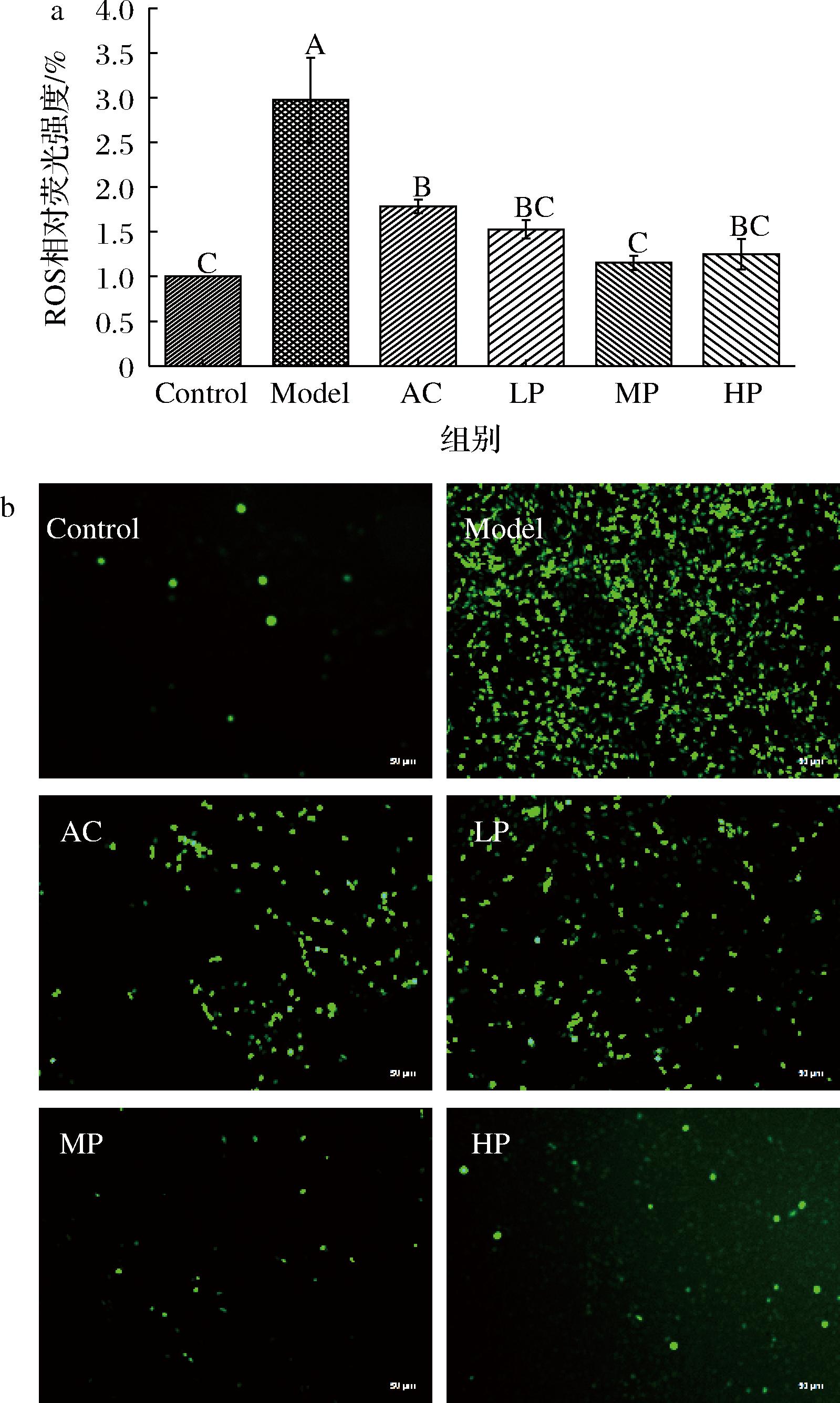
a-ROS水平;b-HT-22细胞ROS荧光图
图8 ATP对谷氨酸诱导HT-22细胞ROS水平影响
Fig.8 Effect of ATP on glutamic acid-induced ROS in HT-22cells
3 结论与讨论
扁舵鲣鱼低聚肽是以2~20个氨基酸组成的小分子肽为主,通过扁舵鲣鱼提取出的天然提取肽,可以深入大脑的血脑屏障发挥作用,具有许多非常强的活性如抗氧化抗炎等。本研究通过HT-22细胞体外模拟大脑海马神经元从而探究扁舵鲣鱼低聚肽促睡眠活性:通过0.9 mmol/L皮质酮和15.0 mmol/L谷氨酸建立HT-22细胞体外失眠模型模拟失眠导致的焦虑、神经递质失调、大脑海马区记忆功能紊乱和氧化应激危害等。结果表明,扁舵鲣鱼低聚肽可以抑制皮质酮和谷氨酸诱导产生的细胞凋亡;可以通过升高5-HT和胆碱水平、AChE活性;降低ACh水平来调节皮质酮诱导损伤HT-22细胞中神经递质分泌异常问题,还可以通过增强细胞抗氧化能力来减少胞内酶的泄露和氧化应激产生的有害产物:扁舵鲣鱼低聚肽可以显著提高细胞内GSH和GSH-Px、SOD酶活性,减少MDA产生和ROS的积累。因此扁舵鲣鱼低聚肽可以有效缓解皮质酮和谷氨酸诱导的损伤HT-22细胞的神经递质分泌系统和氧化应激系统紊乱,具有体外抗失眠活性,目前关于扁舵鲣鱼低聚肽在失眠方面的研究较少,与HT-22细胞相关的实验也鲜少报道。本论文可以为扁舵鲣鱼低聚肽抗失眠产品开发提供理论依据。
[1] 郑新钰. “失眠的消费者”催生睡眠经济新蓝海[N].中国城市报, 2023-04-10(0).
ZHENG X Y.“Insomnia consumer” promotes a new blue sea of sleep economy[N].China City Daily, 2023-04-10(0).
[2] NISHINO S. Encyclopedia of Sleep and Circadian Rhythms[M]. Amsterdam: Elsevier, 2013:395-406.
[3] 王振杰, 赵蔓, 陈婷蔚, 等.中国老年人睡眠障碍患病率的Meta分析[J].中国全科医学, 2022, 25(16):2036-2043.
WANG Z J, ZHAO M, CHEN T W, et al.Sleep disturbance prevalence rate among Chinese older people:A meta-analysis[J].Chinese General Practice, 2022, 25(16):2036-2043.
[4] 梁晓仙, 丁晓云, 金运钦, 等.中国40~65岁女性人群失眠症状流行特征的Meta分析[J].中国预防医学杂志, 2021, 22(9):670-679.
LIANG X X, DING X Y, JIN Y Q, et al.A The prevalence of insomnia symptoms in Chinese women aged 40-65 years:A meta-analysis[J].Chinese Preventive Medicine, 2021, 22(9):670-679.
[5] MALLOGGI S, CONTE F, DE ROSA O, et al.Insomnia symptoms affect false memories production[J].Sleep Medicine, 2022, 100:S145.
[6] OLONODE E T, ADERIBIGBE A O, ADEOLUWA O A, et al.Morin hydrate mitigates rapid eye movement sleep deprivation-induced neurobehavioural impairments and loss of viable neurons in the hippocampus of mice[J].Behavioural Brain Research, 2019, 356:518-525.
[7] SHI L, CHEN S J, MA M Y, et al.Sleep disturbances increase the risk of dementia:A systematic review and meta-analysis[J].Sleep Medicine Reviews, 2018, 40:4-16.
[8] 孙伏嘉. 药食同源饮食对心脾两虚型不寐患者的影响[D].哈尔滨:黑龙江中医药大学, 2017.
SUN F J.The homology of medicine and food affects the quality of life petients the heart and spleen two deficiency insomnia[D].Harbin:Heilongjiang University of Chinese Medicine, 2017.
[9] LOWE H, HADDOCK G, MULLIGAN L D, et al.Does exercise improve sleep for adults with insomnia? A systematic review with quality appraisal[J].Clinical Psychology Review, 2019, 68:1-12.
[10] RIEMANN D, BAGLIONI C, BASSETTI C, et al.European guideline for the diagnosis and treatment of insomnia[J].Journal of Sleep Research, 2017, 26(6):675-700.
[11] HINTZE J P, EDINGER J D.Hypnotic discontinuation in chronic insomnia[J].Sleep Medicine Clinics, 2022, 17(3):523-530.
[12] DING D, DU B W, ZHANG C, et al.Isolation and identification of an antioxidant collagen peptide from skipjack tuna (Katsuwonus pelamis) bone[J].RSC Advances, 2019, 9(46):27032-27041.
[13] 王辉. 富含鹅肌肽的鲣鱼抗氧化肽的制备及活性研究[D].广州:华南理工大学, 2021.
WANG H.Study on the preparation and activity of skipjack antioxidant peptides rich in anserine[D].Guangzhou:South China University of Technology, 2021.
[14] 刘新中. 2022中国渔业统计年鉴[M].北京:中国农业出版社, 2022.
LIU X Z.China Fishery Statistics Yearbook 2022[M].Beijing:China Agricultural Press, 2022.
[15] 王西汐, 李雯晖, 张健, 等.组氨酸二肽及其功能性研究进展[J].食品研究与开发, 2022, 43(7):213-218.
WANG X X, LI W H, ZHANG J, et al.Progress in investigations of histidine dipeptide and its functions[J].Food Research and Development, 2022, 43(7):213-218.
[16] GRAHAM J B, KOEHRN F J, DICKSON K A.Distribution and relative proportions of red muscle in scombrid fishes:Consequences of body size and relationships to locomotion and endothermy[J].Canadian Journal of Zoology, 1983, 61(9):2087-2096.
[17] LIU J, LI L X, SUO W Z.HT22 hippocampal neuronal cell line possesses functional cholinergic properties[J].Life Sciences, 2009, 84(9-10):267-271.
[18] XU J, LI Q, XU C Y, et al.Obstructive sleep apnea aggravates neuroinflammation and pyroptosis in early brain injury following subarachnoid hemorrhage via ASC/HIF-1α pathway[J].Neural Regeneration Research, 2022, 17(11):2537-2543.
[19] FU Y, KOO M W L.EGCG protects HT-22 cells against glutamate-induced oxidative stress[J].Neurotoxicity Research, 2006, 10(1):23-30.
[20] 柳丽, 季凯琳, 徐海玲, 等.雷公藤甲素对皮质酮诱导小鼠海马神经元细胞损伤的保护作用[J].医学研究生学报, 2021, 34(11):1138-1143.
LIU L, JI K L, XU H L, et al.Protective effect of triptolide on corticosterone-induced hippocamp neuron injury in mice[J].Journal of Medical Postgraduates, 2021, 34 (11):1138-1143.
[21] 高宁辛, 马宇昕, 田素民, 等.淫羊藿苷通过调节PGRN表达减轻L-谷氨酸诱导的HT22细胞损伤[J].神经解剖学杂志, 2017, 33(6):679-684.
GAO N X, MA Y X, TIAN S M, et al.ICA reduces damage of HT22 cell induced by L-Glu through regulating expression of PGRN[J].Chinese Journal of Neuroanatomy, 2017, 33(6):679-684.
[22] 赵磊. 沙棘多糖对脂多糖诱导仔猪小肠上皮细胞炎性损伤的保护机制[D].长春:吉林农业大学, 2021.
ZHAO L.The protective mechanism of Hippophae rhamnoides polysaccharides on the inflammatory damage of intestinal porcine epithelial cells induced-by lipopolysaccharide in piglets[D].Changchun:Jilin Agricultural University, 2021.
[23] SILLAPACHAIYAPORN C, MONGKOLPOBSIN K, CHUCHAW-ANKUL S, et al.Neuroprotective effects of ergosterol against TNF-α-induced HT-22 hippocampal cell injury[J].Biomedicine &Pharmacotherapy, 2022, 154:113596.
[24] 高珊. Itaconate通过上调Menin抑制皮质酮诱导HT22细胞坏死性凋亡[D].衡阳:南华大学, 2021.
GAO S.Itaconate inhibits corticosterone-induced necroptosis by upregulating Menin in HT22 cells[D].Hengyang: University of South China, 2021.
[25] 周泓妍, 郑怡, 王海东, 等.南、北五味子蛋白抗氧化活性和对HepG2细胞氧化应激损伤的修复作用[J].食品与发酵工业, 2024,50(7):51-60.
ZHOU H Y, ZHENG Y, WANG H D, et al.Antioxidant activity of Schisandrae sphenantherae and Schisandrae chinensis protein on HepG2 cells[J].Food and Fermentation Industries, 2024,50(7):51-60.
[26] MONGKOLPOBSIN K, SILLAPACHAIYAPORN C, NILKHET S, et al.Stigmasterol isolated from Azadirachta indica flowers attenuated glutamate-induced neurotoxicity via downregulation of the Cdk5/p35/p25 signaling pathway in the HT-22 cells[J].Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2023, 113:154728.
[27] 吉薇, 刘扬, 龙慧静.扁舵鲣鱼低聚肽化学组成及其对人体肝癌细胞的抑制作用[J].广东农业科学, 2019, 46(10):123-131.
JI W, LIU Y, LONG H J.Chemical composition of oligopeptide derived from Auxis thazard protein and its inhibition effect on human liver cancer cells[J].Guangdong Agricultural Sciences, 2019, 46(10):123-131.
[28] ZAMORE Z, VEASEY S C.Neural consequences of chronic sleep disruption[J].Trends in Neurosciences, 2022, 45(9):678-691.
[29] MISHIMA T, FUJIWARA T, AKAGAWA K.Reduction of neurotransmitter release by the exogenous H3 domain peptide of HPC-1/syntaxin 1A in cultured rat hippocampal neurons[J].Neuroscience Letters, 2002, 329(3):273-276.
[30] 江婷. 基于Nrf2/HO-1信号通路探讨天麻素对谷氨酸诱导的HT-22细胞铁死亡的保护作用[D].合肥:安徽中医药大学, 2020.
JANG T.Gastrodin protects glutamate-induced ferroptosis in HT-22 cells through Nrf2/HO-1 signaling pathway[D].Hefei:Anhui University of Chinese Medicine, 2020.
[31] JIN M C, YOO J M, SOK D E, et al.Neuroprotective effect of N-acyl 5-hydroxytryptamines on glutamate-induced cytotoxicity in HT-22 cells[J].Neurochemical Research, 2014, 39(12):2440-2451.
[32] 周静. 异水飞蓟宾活化NRF2/ARE信号缓解Aβ_(25-35)诱导的HT-22细胞氧化应激损伤[D].芜湖:皖南医学院, 2017.
ZHOU J.Activation of NRF2/ARE by Isosilybin alleviates Aβ25-35-induced oxidative stress injury in HT-22 cells[D].Wuhu:Wannan Medical College, 2017.
[33] CERNA D, LI H Y, FLAHERTY S, et al.Inhibition of nicotinamide phosphoribosyltransferase (NAMPT) activity by small molecule GMX1778 regulates reactive oxygen species (ROS)-mediated cytotoxicity in a p53- and nicotinic acid phosphoribosyltransferase1 (NAPRT1)-dependent manner[J].The Journal of Biological Chemistry, 2012, 287(26):22408-22417.
[34] MAO L M, MATHUR N, SHAN K, et al.Roles of metabotropic glutamate receptor 8 in neuropsychiatric and neurological disorders[J].International Review of Neurobiology, 2023, 168:349-366.