研究者发现乳酸菌发酵可提高水果营养品质、益生特性及风味[1-2]。当利用植物乳杆菌、干酪乳杆菌和嗜酸乳杆菌发酵腰果苹果汁后发现维生素C和酚类代谢产物含量明显提高[3]。再如乳酸菌发酵石榴汁提高了醇类、酮类及萜烯类挥发性成分进而改善了其风味[4]。乳酸菌发酵还可提高水果益生特性,张澜等[5]研究一株植物乳杆菌P17发酵桑葚汁对小鼠便秘症状的影响,发现其具有一定的润肠通便功能。
新疆杏品种多样然而在收获后容易快速衰老与腐败,贮存寿命较短,杏制品主要以浓缩杏酱的形式进行贸易[6-10]。新疆杏具有酸度低糖度高的特性,据研究表明,新疆南疆杏总糖含量是华北杏的2.23倍,果糖含量是华北杏品种的7.85倍[11-12]。有研究表明杏可以作为益生菌生长的理想作用基质[13],但目前缺乏发酵杏的专用菌种或菌株,需要积极筛选特定乳酸菌填补这一空白。新疆传统奶疙瘩是牛乳通过自然发酵而成的,营养价值高,乳酸菌作为其中优势菌群不仅种类丰富[14],且益生特性强[15-16],可作为菌种筛选的重要资源之一。
本研究从新疆昌吉传统奶疙瘩中分离出7株乳酸菌并对其进行生理生化及分子生物学鉴定,同时测定生长活性、安全性及耐糖耐酸性,并接种到新疆特色杏酱中,以活菌数、总酸、总酚、总黄酮、果糖、葡萄糖、可溶性固形物、感官品质、菌株碳源利用能力等为指标进行分析,以期筛选出具有发酵新疆特色杏酱潜力的乳酸菌,为工业化生产发酵型新疆杏酱及其衍生产品提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
本试验所用15份传统奶疙瘩分别采自新疆昌吉地区牧民人家,是由牧民家经过传统手工生产,将牛乳自然发酵后再去水形成的固体乳制品。采样后立即放入有冰袋的恒温保鲜盒运输回试验室于0~4 ℃条件下保藏;杏酱,新疆中粮屯河番茄有限公司提供,其原料主要是新疆产赛买提杏、小白杏、黑叶杏及油杏。
1.1.2 培养基
MRS固体培养基、MRS肉汤培养基、胰蛋白胨水培养基,青岛高科技工业园海博生物科技有限公司;MH琼脂,广东中山百微生物科技有限公司。
1.1.3 试剂
细菌微量生化鉴定管,青岛高科技工业园海博生物科技有限公司;血琼脂培养基、药物敏感纸片,常德比克曼生物科技有限公司;福林酚、果糖标准品、葡萄糖标准品,北京索莱宝科技有限公司;没食子酸、芦丁,上海源叶生物科技有限公司;API50 CHL乳酸菌属鉴定盒,上海华微泰达科技有限公司;其他试剂,南京化学试剂有限公司。
1.2 仪器与设备
恒温振荡器、恒温培养箱,上海一恒科学仪器有限公司;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;CF1524R台式高速冷冻型离心机,北京科博赛尔科技有限公司;尼康E200光学显微镜,日本Nikon公司;Agilent 1260高效液相色谱仪,美国Agilent公司。
1.3 实验方法
1.3.1 菌株分离、纯化
样品前处理:将粉碎好的奶疙瘩样品与无菌水按1∶9比例称放于100 mL三角瓶中,在恒温摇床中于30 ℃条件下振荡3 h。将振荡后样品进行梯度稀释,在7个试管中各加入9 mL蒸馏水,按梯度稀释后,取10-5、10-6、10-7、10-8这4个稀释度的悬液100 μL分别均匀涂布于不同MRS琼脂培养基上,在37 ℃条件下恒温培养24 h。
1.3.2 菌株初步鉴定
通过形态学观察、革兰氏染色、过氧化氢试验等初步鉴定,筛选出革兰氏染色阳性、过氧化氢酶试验阴性菌株于-40 ℃超低温冰箱甘油保藏,以便进行后续试验。
明胶液化试验:挑取培养24 h后乳酸菌少许,以较大量点种于平板培养基。于20~22 ℃培养7~14 d。每天观察结果,在观察结果前先置4 ℃冰箱内30 min,如确定被液化,即为试验阳性。否则为阴性。吲哚试验:将筛选菌株接种于蛋白胨水培养基中,37 ℃恒温培养24 h,加入乙醚和吲哚试剂,液层变为玫瑰色则为阳性,否则为阴性。
1.3.3 菌株生长特性分析
参照焦媛媛等[17]的方法略做修改,将初步鉴定所保藏的菌种连续活化2次后,以3%的接种量接入MRS肉汤中,于30 ℃恒温培养箱中培养。在0、1、2、3、4、6、8、10、12、14、16、18、20、22、24 h分别取样,于600 nm波长下测定发酵液的OD值,以没有接菌的培养基为空白,每组重复3次,取平均值。
1.3.4 菌株的分子生物学鉴定
将所筛菌种送往北京博迈德基因技术有限公司进行16S rDNA序列测定。
1.3.5 安全性测定
药敏试验:参照《CLSI抗菌药物敏感性试验标准》中的纸片扩散法进行操作[18-19],分别取100 μL菌液涂布于MRS固体培养基上,待菌液被培养基完全吸收后,将药敏纸片放于培养基上,静置15 min后,倒置放于37 ℃培养箱中培养20 h,测量并记录各药敏纸片的抑菌圈直径大小。参照《传统发酵食品中乳酸菌的安全性评估》方法进行结果判定。具体标准如表2所示。
溶血性试验:将活化好的菌株接种到哥伦比亚血琼脂培养基于37 ℃培养24 h,观察是否有溶血现象。
1.3.6 菌株耐受性测定
利用盐酸配制pH值为3、4、5;利用葡萄糖调节可溶性固形物至30、35、40 Brix°的MRS液体培养基,随后分装至试管[20],并高压蒸汽灭菌15 min;在无菌条件下向每支试管中加入1 mL的菌液,并于37 ℃培养24 h;以未加菌液并灭过菌的pH值分别为3、4、5;可溶性固形物分别为30、35、40 Brix°的MRS液体培养基做空白对照,测定菌悬液在600 nm下的OD值。
1.3.7 乳酸菌发酵杏酱性能分析
1.3.7.1 菌悬液的制备
分别将筛选出菌株接种至灭菌后的MRS液体培养基,37 ℃条件下恒温培养3代至活菌数达到8.0 lg CFU/mL以上。
1.3.7.2 乳酸菌发酵杏酱的制备
将4 ℃贮存的杏酱放至室温后,将制备好的菌悬液按照2%接种量接种至杏酱中,在恒温培养箱中于37 ℃培养48 h,测定发酵前后及过程中各项指标。
1.3.7.3 杏酱理化指标及营养物质的测定
参考GB/T12456—2008《食品中总酸的测定》方法测定总酸。杏酱总酚含量测定采用福林酚比色法,具体参照戴志伟等[21]方法进行测定,以没食子酸做标准曲线:Y=0.011 4X+0.013 3,R2=0.998 9;总黄酮含量的测定采用Al(NO3)3-NaNO2比色法进行测定,具体参照胡航伟等[22]方法,以芦丁做标准曲线:Y=0.002 2X+0.000 3,R2=0.999 3。果糖、葡萄糖含量具体参照邵齐[23]的方法,样品经10 000 r/min低温离心10 min后,将上清液过0.22 μm水系滤膜,取滤液进行测定。色谱条件:Aminex HPX-87H色谱柱;流动相为5 mmol/L的硫酸水溶液;流速0.5 mL/min;柱温35 ℃;紫外检测器波长210 nm;手动进样量20 μL。可溶性固形物含量使用阿贝折光仪进行测定。
1.3.7.4 杏酱活菌数的测定
采用GB 4789.35—2016《食品安全国家标准食品微生物学检验 乳酸菌检验》方法测定杏酱发酵过程中乳酸菌活菌数。
1.3.7.5 杏酱感官评分
为进行发酵杏酱感官评价,结合中华人民共和国国家标准GB/T 22474—2008《果酱》,由15名经过严格感官评价培训的老师与学生组成感官评定小组,对发酵杏酱滋味、香气、色泽、组织状态4个方面进行感官评价,评分标准如表1所示。
表1 发酵杏酱感官评分标准
Table 1 Sensory scoring criteria
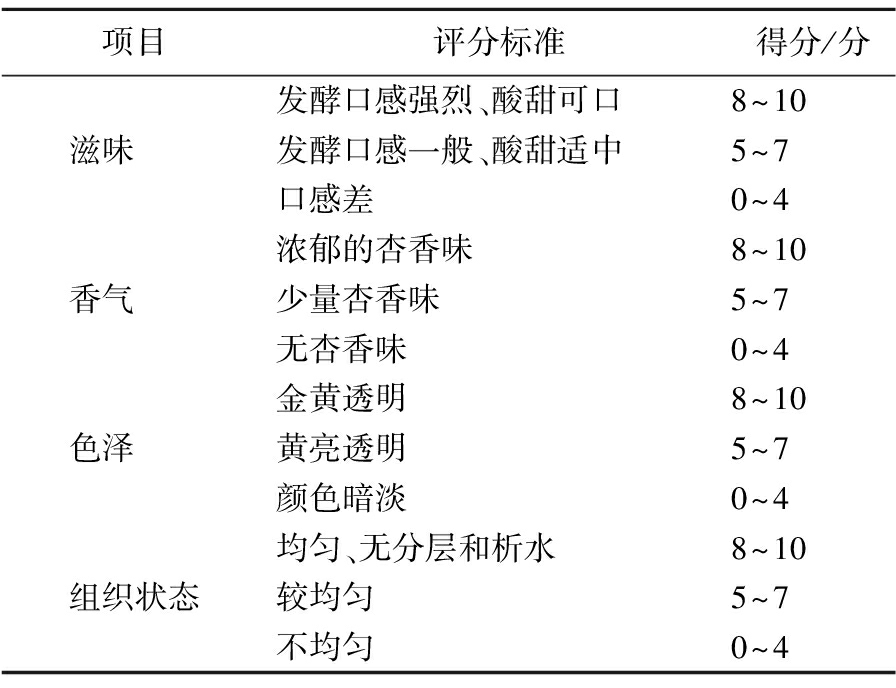
项目评分标准得分/分发酵口感强烈、酸甜可口8~10滋味 发酵口感一般、酸甜适中5~7口感差0~4浓郁的杏香味8~10香气 少量杏香味5~7无杏香味0~4金黄透明8~10色泽 黄亮透明5~7颜色暗淡0~4均匀、无分层和析水8~10组织状态较均匀5~7不均匀0~4
1.3.7.6 菌株碳源能力测试
使用API50CH试剂条分析菌株的碳水化合物及其衍生物的利用能力[24]。首先取-40 ℃冻存的菌液,在MRS液体培养基中连续活化2次后接种于MRS固体培养基,使用棉拭子从固体培养基上收集对数生长期的菌株,加入2 mL悬浮液中制备成高浓度菌悬液,再往5 mL悬浮液中加入高浓度菌悬液制备成2 McF的菌悬液,将其接种于50 CHL培养基安瓿。吸取120 μL的菌悬液分别接种到试剂条的50个微管中,将试剂条放入基板内并添加适量水制造湿室,而后放入培养箱培养(30 ℃),于24 h和48 h时判读试纸条颜色,并根据说明书标示的每一方格的碳源类型记录该菌对碳源的利用能力。
1.4 数据处理
采用SPSS 27对数据进行单因素方差分析(one way-ANOVA)、邓肯(Duncan)多重比较法分析,P<0.05,差异显著。采用Origin 2022、GraphPad Prism 8软件进行作图。所有测试和分析均重复3次。
2 结果与分析
2.1 菌株的初筛及生理生化结果
从15份奶疙瘩中共筛选出15株疑似乳酸菌,其中7株有明显乳酸菌特征的菌株且符合革兰氏染色阳性、过氧化氢试验阴性、明胶液化试验阴性及吲哚试验阴性,其编号如表2所示。
表2 七株菌编号及生理生化结果
Table 2 Seven strain numbers and physiological-biochemical results
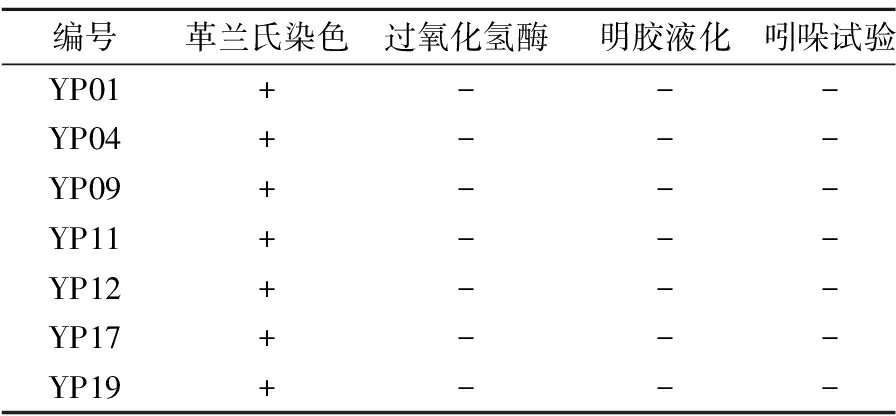
编号革兰氏染色过氧化氢酶明胶液化吲哚试验YP01+---YP04+---YP09+---YP11+---YP12+---YP17+---YP19+---
注:“+”表示阳性;“-”表示阴性(下同)。
2.2 菌株16S rDNA分子生物学鉴定结果
经16S rDNA序列测定对7株菌进行种属鉴定,用NCBI数据库对其进行BLAST同源性比对分析并构建系统发育树。如图1所示,可确定YP01为罗伊氏乳杆菌(Lactobacillus reuteri),YP04、YP09、YP17和YP19均为魏斯氏菌(Weissella confusa),YP11和YP12均为植物乳杆菌(Lactiplantibacillus plantarum)。

图1 基于16S rDNA 的7株菌系统发育树
Fig.1 Phylogenetic tree of seven strains based on 16S rDNA
2.3 七株乳酸菌的生长曲线
如图2所示,菌株YP01、YP04、YP09、YP17停滞期较短且在较短时间内进入对数期;菌株YP11、YP12停滞期较长;菌株YP19停滞期较短但生长速率与其他乳酸菌相比较低;然而7株菌株均有明显的停滞期、对数期和稳定期,生长性能良好。
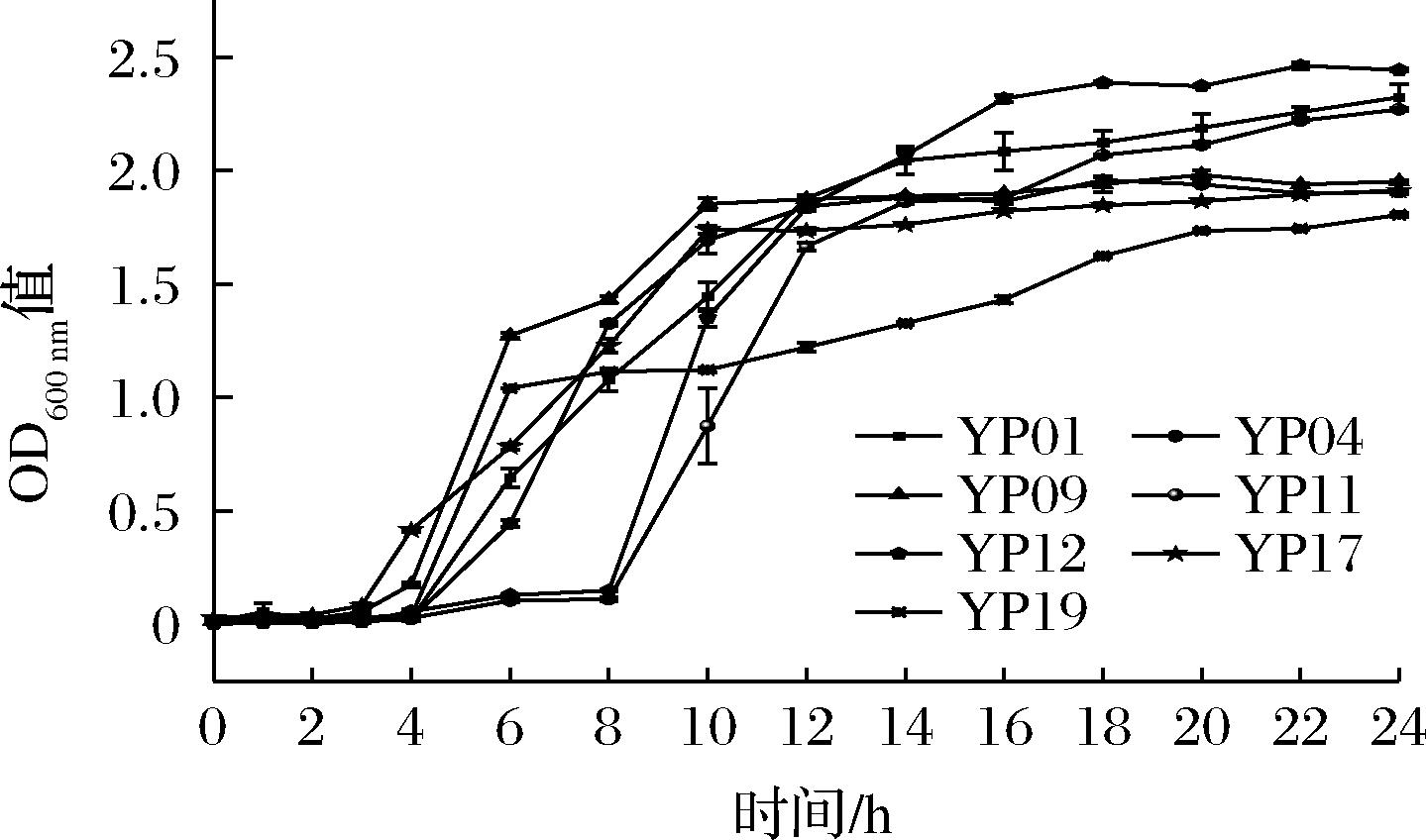
图2 七株乳酸菌生长曲线
Fig.2 Growth curve of seven lactic acid bacteria
2.4 七株乳酸菌安全性分析
2.4.1 溶血性试验结果
如图3所示,自左往右依次为菌株YP01、YP04、YP09、YP11、YP12、YP17、YP19的溶血性情况,菌株YP01、YP04、YP09、YP17、YP19均无溶血现象,菌株YP11、YP12均出现α溶血圈,表明会引起红细胞聚集及溶血现象的发生,具有一定的致病性,因此菌株YP11、YP12不可用来发酵杏酱。
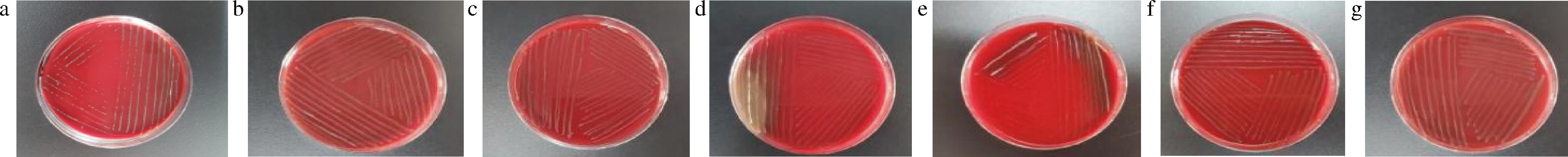
a-YP01;b-YP04;c-YP09;d-YP11;e-YP12;f-YP17;g-YP19
图3 七株乳酸菌溶血性试验结果
Fig.3 Experimental results of hemolysis of seven lactic acid bacteria
2.4.2 抗生素药敏试验结果
检测抗生素药物敏感性作为评价益生菌安全性标准之一,常被应用到研究当中。通过药敏纸片法对7株菌进行9种抗生素药物敏感性评估试验,结果如表3所示,菌株YP01、YP04、YP09、YP17至少对7种抗生素具有不同程度的敏感性,菌株YP11、YP12、YP19至少对3种抗生素具有耐受性。7株乳酸菌药敏试验结果见表4。
表3 本试验所选取的9种抗生素及其判别标准
Table 3 Nine antibiotics used in this experiment and their concentrations
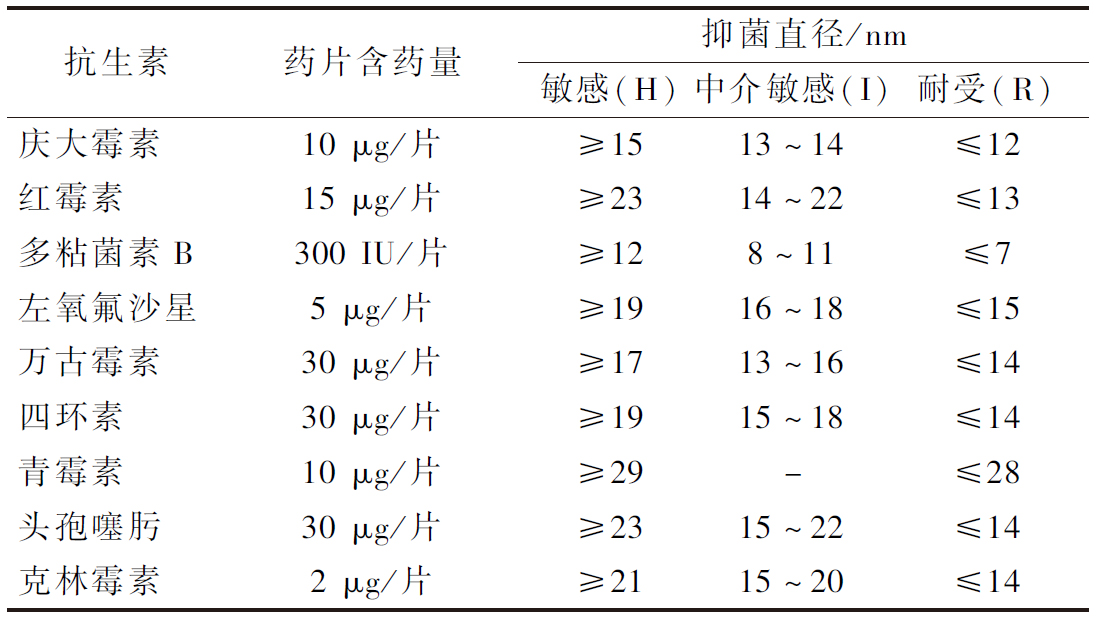
抗生素药片含药量抑菌直径/nm敏感(H)中介敏感(I)耐受(R)庆大霉素10 μg/片≥1513~14≤12红霉素15 μg/片≥2314~22≤13多粘菌素B300 IU/片≥128~11≤7左氧氟沙星5 μg/片≥1916~18≤15万古霉素30 μg/片≥1713~16≤14四环素30 μg/片≥1915~18≤14青霉素10 μg/片≥29-≤28头孢噻肟30 μg/片≥2315~22≤14克林霉素2 μg/片≥2115~20≤14
表4 七株乳酸菌药敏试验结果
Table 4 Hemolytic test results of seven lactic acid bacteria
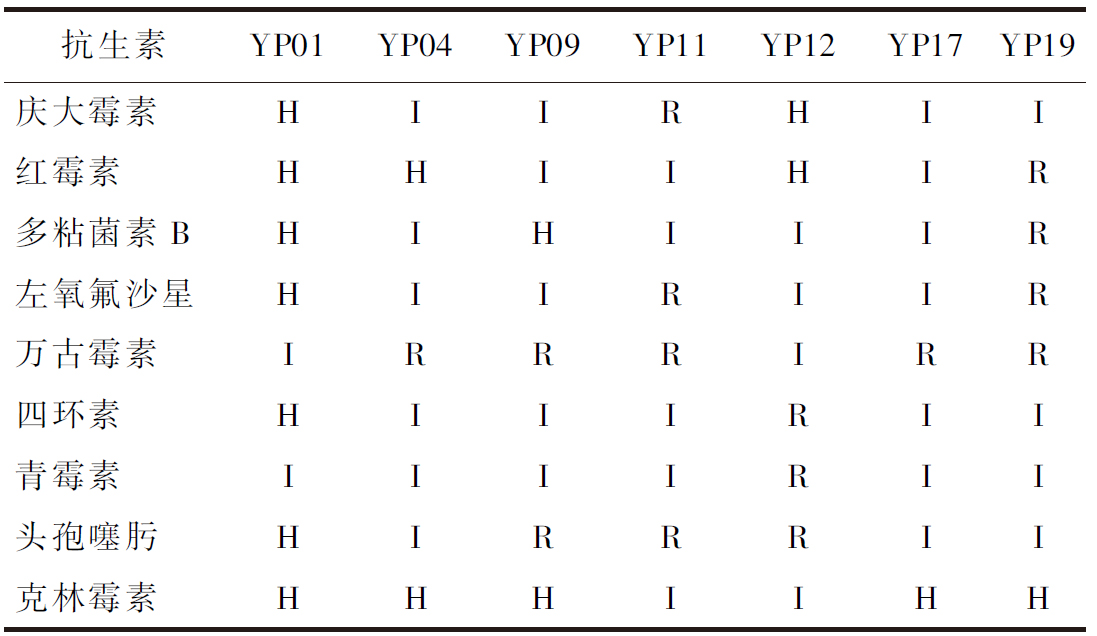
抗生素YP01YP04YP09YP11YP12YP17YP19庆大霉素HIIRHII红霉素HHIIHIR多粘菌素BHIHIIIR左氧氟沙星HIIRIIR万古霉素IRRRIRR四环素HIIIRII青霉素IIIIRII头孢噻肟HIRRRII克林霉素HHHIIHH
2.5 菌株耐受性分析
在溶血性及药敏试验结果基础上,对具有一定安全性的YP01、YP04、YP09、YP17菌株进行高可溶性固形物(30 Brix°、35 Brix°、40 Brix°)、高酸(pH 3、pH 4、pH 5)耐受性分析,以未接种菌株的高可溶性固形物、高酸培养基为空白对照。结果表明,同一菌株在不同条件下生长活性存在极显著差异(P<0.01),不同菌株在相同条件下也存在极显著差异(P<0.01);菌株YP17在pH值为3培养基中无法生长;而菌株YP01、YP04在高可溶性固形物、高酸培养基中培养24 h 后的OD值明显高于其他菌株,表明这2株菌适应高可溶性固形物、高酸培养基能力较强。具体见表5。
表5 四株乳酸菌在高可溶性固形物、高酸培养基中培养24 h后的OD值
Table 5 OD value of four lactic acid bacteria cultured in high sugar and high acid medium for 24 hours
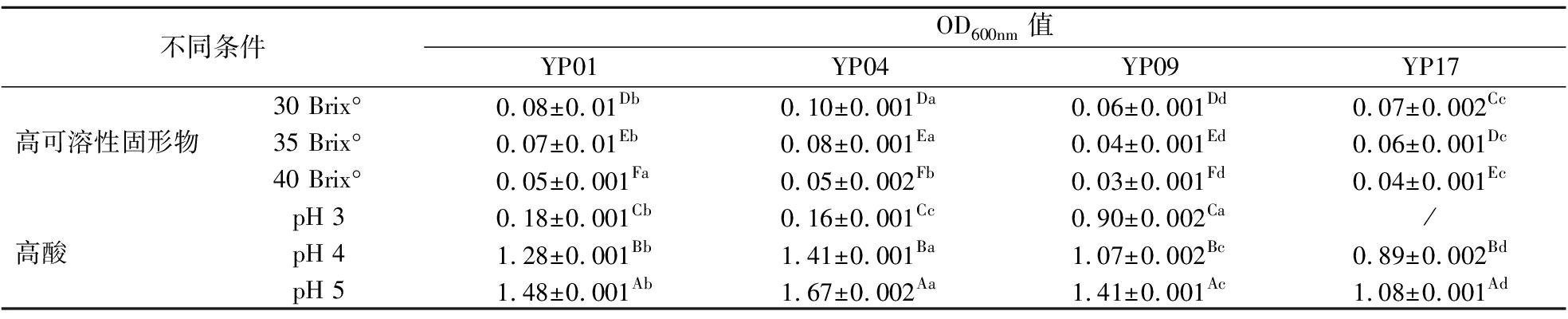
不同条件OD600nm值YP01YP04YP09YP1730 Brix°0.08±0.01Db0.10±0.001Da0.06±0.001Dd0.07±0.002Cc高可溶性固形物35 Brix°0.07±0.01Eb0.08±0.001Ea0.04±0.001Ed0.06±0.001Dc40 Brix°0.05±0.001Fa0.05±0.002Fb0.03±0.001Fd0.04±0.001EcpH 30.18±0.001Cb0.16±0.001Cc0.90±0.002Ca/高酸 pH 41.28±0.001Bb1.41±0.001Ba1.07±0.002Bc0.89±0.002BdpH 51.48±0.001Ab1.67±0.002Aa1.41±0.001Ac1.08±0.001Ad
注:大写字母表示纵列数据之间的显著性;小写字母表示横列数据之间的显著性(P<0.05);“/”表示菌株在此条件下不生长。
2.6 乳酸菌在杏酱中发酵性能分析
2.6.1 杏酱中理化指标测定
4株菌发酵杏酱前后理化指标具体情况如表6所示。
表6 四种乳酸菌发酵杏酱后基本指标变化
Table 6 Changes of four lactic acid bacteria in basic indicators after fermentation of apricot jam
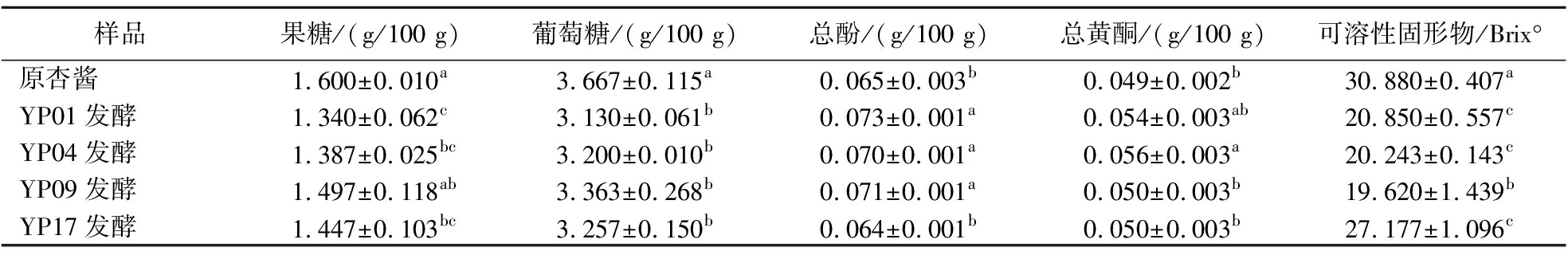
样品果糖/(g/100 g)葡萄糖/(g/100 g)总酚/(g/100 g)总黄酮/(g/100 g)可溶性固形物/Brix°原杏酱1.600±0.010a3.667±0.115a0.065±0.003b0.049±0.002b30.880±0.407aYP01发酵1.340±0.062c3.130±0.061b0.073±0.001a0.054±0.003ab20.850±0.557cYP04发酵1.387±0.025bc3.200±0.010b0.070±0.001a0.056±0.003a20.243±0.143cYP09发酵1.497±0.118ab3.363±0.268b0.071±0.001a0.050±0.003b19.620±1.439bYP17发酵1.447±0.103bc3.257±0.150b0.064±0.001b0.050±0.003b27.177±1.096c
注:小写字母表示纵列数据之间的显著性(P<0.05)。
由表6可知,YP01、YP04、YP09发酵后果糖含量与原杏酱之间存在显著差异(P<0.05),原杏酱果糖含量为1.600 g/100 g,其中菌株YP01发酵后杏酱中果糖含量降至1.340 g/100 g,菌株YP04发酵后杏酱中的果糖含量降至1.387 g/100 g,菌株YP17发酵后杏酱中果糖含量降至1.447 g/100 g;YP01、YP04、YP09、YP17发酵后葡萄糖含量与原杏酱之间存在显著差异(P<0.05),原杏酱葡萄糖含量为3.667 g/100 g,菌株YP01发酵后杏酱中葡萄糖含量降至3.130 g/100 g,菌株YP04发酵后杏酱中的葡萄糖含量降至3.200 g/100 g。发酵杏酱总酚与总黄酮的变化呈上升趋势,菌株YP01、YP04、YP09发酵后总酚含量与原杏酱之间差异显著(P<0.05);菌株YP04发酵后总黄酮含量与原杏酱之间差异显著(P<0.05);菌株YP01、YP04、YP09、YP17发酵后可溶性固形物含量均下降且与原杏酱之间存在极显著差异(P<0.01)。以上结果表明4株乳酸菌可以不同程度利用杏酱营养成分完成发酵。
2.6.2 活菌数与杏酱总酸变化
由图4可知,4株菌在发酵杏酱的过程中活菌数均发生变化,菌株YP01发酵后杏酱菌落总数为6.240 lg CFU/mL;菌株YP04发酵后杏酱菌落总数为6.343 lg CFU/mL;菌株YP09发酵后杏酱菌落总数为6.010 lg CFU/mL;菌株YP17发酵后杏酱菌落总数为5.853 lg CFU/mL。其中菌株YP01在发酵12~24 h内活菌数由8.743 lg CFU/mL上升至8.823 lg CFU/mL,后呈下降趋势;其余3株菌在12~48 h内活菌数呈下降趋势;菌株YP01、YP04发酵后的杏酱在36 h内活菌数保持在7.00 lg CFU/mL以上,而菌株YP09、YP17发酵后的杏酱活菌数在36 h之后均下降至7.00 lg CFU/mL以下;菌株YP01与菌株YP04在发酵12 h、24 h与48 h时活菌数与其他2株菌具有显著差异。此结果表明菌株YP01与YP04在杏酱中生长能力较强。由图4可知,48 h内4株乳酸菌发酵后杏酱总酸均呈上升趋势。菌株YP01发酵杏酱后总酸含量高达3.320 g/L,菌株YP04发酵杏酱后总酸含量高达2.900 g/L。且2株菌发酵后杏酱总酸均高于菌株YP09与YP17,菌株YP09与YP17发酵杏酱总酸含量在24 h后趋近平缓。以上结果说明菌株YP01及菌株YP04对杏酱基质中营养物质利用度较大。

a-活菌数;b-总酸含量
图4 四株乳酸菌发酵杏酱活菌数与总酸变化
Fig.4 Changes in the number of live bacteria and total acid of apricot jam in apricot sauce fermentation by four lactic acid bacteria
2.6.3 感官评价
由接受过专业训练的15名感官评价员进行感官评价,结果如图5所示,菌株YP01发酵杏酱后感官品质最高,其中滋味、组织状态及色泽达8分以上,菌株YP01发酵后杏酱口感酸甜、具有浓郁杏香味且色泽鲜亮;菌株YP04发酵后色泽强于菌株YP09和YP17两组;而未发酵杏酱感官品质低于其余所有发酵组,这表明乳酸菌发酵影响杏酱感官品质。
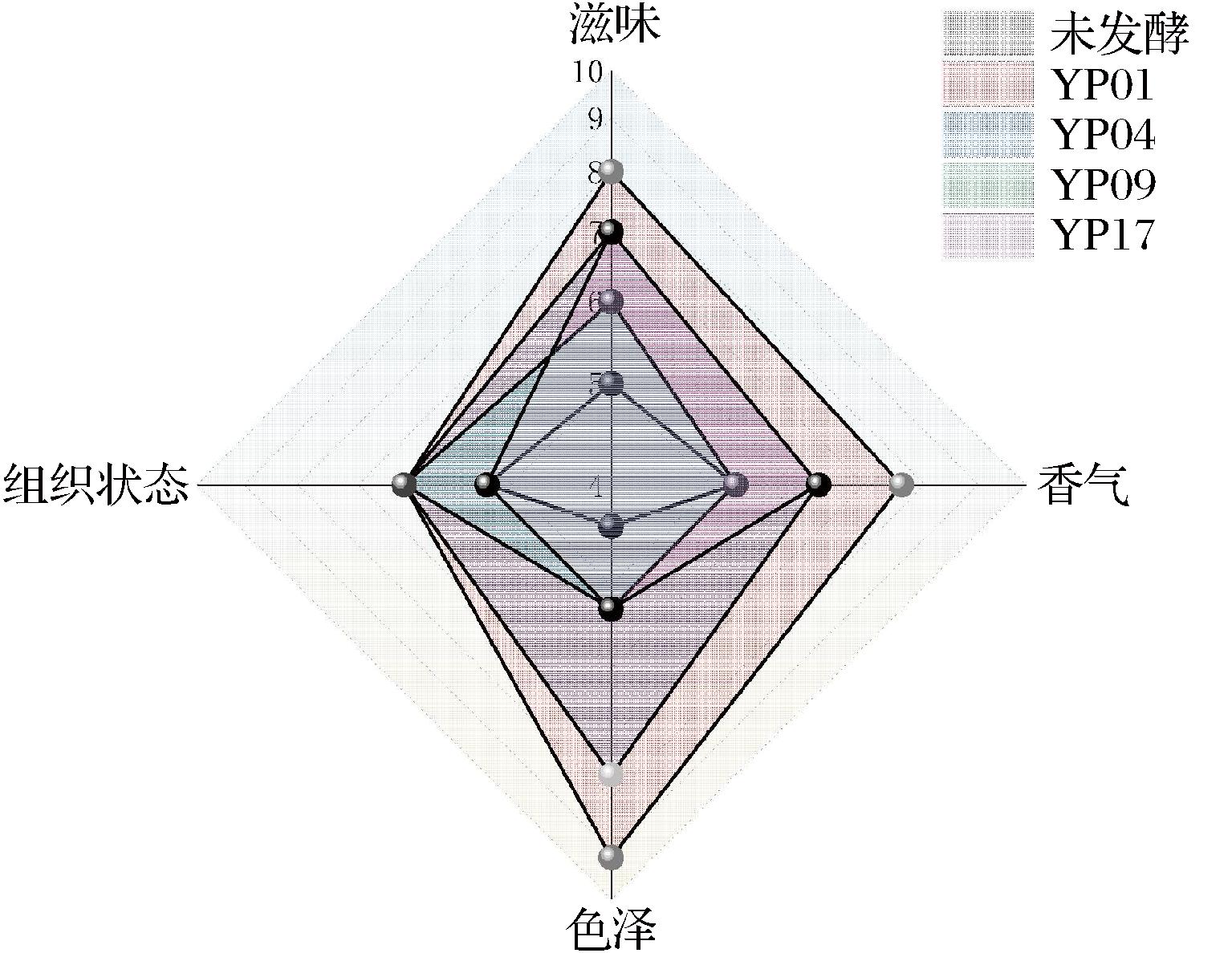
图5 感官雷达图
Fig.5 Sensory evaluation diagram
2.7 菌株碳源利用能力测定
本文在完成初步筛选、安全性筛选及耐受性筛选及发酵杏酱性能分析后,确定菌株YP01与YP04具有发酵杏酱潜力,于此同时也利用API 50CH试纸条对YP01、YP04菌株可利用碳源类型进行测试,结果如表7所示。
表7 YP01、YP04菌株碳源利用情况
Table 7 Carbon source utilization of YP01 and YP04

YP01菌株YP04菌株碳源利用度碳源利用度碳源利用度碳源利用度空白组-七叶灵柠檬酸铁+空白组-七叶灵柠檬酸铁+丙三醇-水杨苷+丙三醇-水杨苷+赤藻糖醇-D-纤维二糖+赤藻糖醇-D-纤维二糖+D-阿拉伯糖-D-麦芽糖(+)D-阿拉伯糖-D-麦芽糖(+)L-阿拉伯糖+D-乳糖+L-阿拉伯糖+D-乳糖+D-核糖+D-密二糖+D-核糖+D-密二糖+D-木糖+D-蔗糖(+)D-木糖+D-蔗糖(+)L-木糖-D-海藻糖-L-木糖-D-海藻糖-D-核糖醇-菊粉-D-核糖醇-菊粉-甲基-3-D吡喃木糖苷-D-松三糖-甲基-3-D吡喃木糖苷-D-松三糖-D-半乳糖+D-棉子糖+D-半乳糖+D-棉子糖+D-葡萄糖+淀粉-D-葡萄糖+淀粉-D-果糖+糖原-D-果糖+糖原-D-甘露糖+木糖醇-D-甘露糖+木糖醇-L-山梨糖 -D-龙胆二糖(+)L-山梨糖 -D-龙胆二糖(+)L-鼠李糖-D-土伦糖-L-鼠李糖-D-土伦糖-卫矛醇-D-来苏糖-卫矛醇-D-来苏糖-肌醇-D-塔格糖-肌醇-D-塔格糖-甘露醇-D-岩藻糖-甘露醇-D-岩藻糖-山梨醇-L-岩藻糖-山梨醇-L-岩藻糖-甲基-α-D-吡喃甘露糖苷-D-阿拉伯醇-甲基-a-D-吡喃甘露糖苷-D-阿拉伯醇-甲基-α-D-吡喃葡萄糖苷-L-阿拉伯醇-甲基-α-D-吡喃葡萄糖苷-L-阿拉伯醇-N-乙酰葡萄糖胺+葡萄糖酸钾(+)N-乙酰葡萄糖胺+葡萄糖酸钾(+)苦杏仁苷+2-酮基葡萄糖酸钾(+)苦杏仁苷+2-酮基葡萄糖酸钾(+)熊果苷+5-酮基葡萄糖酸钾-熊果苷+5-酮基葡萄糖酸钾-
注:“(+)”表示弱阳性。
由表7可知,罗伊氏乳杆菌YP01与魏斯氏菌YP04均能利用核糖、木糖、阿拉伯糖等五碳糖及常见碳源,表明2株菌均有较强的碳源利用能力,可以充分利用杏酱中大部分碳源。
3 结论与讨论
新疆奶疙瘩作为传统手工发酵奶制品,近年来其丰富的微生物资源得到不断开发与利用[25-26]。本研究从新疆昌吉15份奶疙瘩中筛选出1株罗伊氏乳杆菌YP01、4株魏斯氏菌YP04、YP09、YP17和YP19、2株植物乳杆菌YP11和YP12,且7株乳酸菌具有明显的生长周期。
抗生素敏感性与溶血性常被视为自然发酵食品源乳酸菌安全性评价重要检测指标[27],通过安全性试验发现,本研究所筛7株菌对抗生素产生不同的表型耐药性,但同种属间差异不大,这有可能是抗生素在畜牧行业中的滥用所导致的[28]。罗伊氏乳杆菌YP01与魏斯氏菌YP04在高可溶性固形物与高酸培养基中表现出较高的活力,表明以上2株菌在杏酱中的发酵潜力较强,这与PERRICONE等[29]在研究中的发现一致。魏斯氏菌作为异型发酵乳酸菌,其发酵食品后风味变化常被研究[30]。分析4株乳酸菌发酵杏酱前后果糖、葡萄糖含量变化得出菌株YP01、YP04发酵杏酱果糖及葡萄糖代谢率较大。4株乳酸菌发酵杏酱后总酚、总黄酮含量均呈上升趋势,这可能是由于发酵过程中酶的代谢作用致使总酚与总黄酮含量升高,与近年来相关研究一致[31]。可溶性固形物含量呈下降趋势是由于在发酵过程中乳酸菌会将部分碳水化合物转化为乳酸以便其在发酵基质中生长代谢[32]。菌株YP01与YP04在发酵杏酱过程中的生长量与产酸量高于其他两株菌,表明在杏酱中长势良好,生长活性未受环境变化影响。菌株YP01、YP04、YP09、YP17均为异型发酵菌株,而菌株YP01、YP04发酵后杏酱感官品质优于其他组,本研究将对菌株发酵代谢组学进行更深一步研究。
综上所述,罗伊氏乳杆菌YP01和魏斯氏菌YP04最具发酵杏酱潜能。在后期将深入研究2株菌的协同或拮抗作用,分析2株菌共同发酵杏酱的可能性及2株菌发酵杏酱后风味物质和营养物质等方面的差异,积极探究不同菌株发酵杏酱动力学,控制与优化发酵条件,开发利用发酵杏酱及其衍生产品,与商业菌株进行对比研究,为保护新疆优良微生物资源做出贡献。
[1] SZUTOWSKA J.Functional properties of lactic acid bacteria in fermented fruit and vegetable juices:A systematic literature review[J].European Food Research and Technology, 2020, 246(3):357-372.
[2] 王银, 田真, 杨晨晨, 等.基于顶空气相色谱-离子迁移谱对乳杆菌及产香酵母发酵红枣汁的香气成分分析[J].食品与发酵工业, 2022, 48(3):266-272.
WANG Y, TIAN Z, YANG C C, et al.Volatile components analysis of Lactobacillus sp.or Zygosaccharomyces spp.fermented jujube juices based on headspace gas chromatography-ion mobility spectrometry[J].Food and Fermentation Industries, 2022, 48(3):266-272.
[3] KAPRASOB R, KERDCHOECHUEN O, LAOHAKUNJIT N, et al.Fermentation-based biotransformation of bioactive phenolics and volatile compounds from cashew apple juice by select lactic acid bacteria[J].Process Biochemistry, 2017, 59(Part B):141-149.
[4] DI CAGNO R, FILANNINO P, GOBBETTI M.Lactic acid fermentation drives the optimal volatile flavor-aroma profile of pomegranate juice[J].International Journal of Food Microbiology, 2017, 248:56-62.
[5] 张澜, 李晨, 张波, 等.发酵桑葚汁的新型菌种筛选及润肠通便功能研究[J].中国食品学报, 2022, 22(9):123-135.
ZHANG L, LI C, ZHANG B, et al.Studies on strain screening, quality analysis and laxative function of fermented mulberry juice with new probiotics[J] Journal of Chinese Institute of Food Science and Technology, 2022, 22(9):123-135.
[6] 范新光. 杏果实采后品质特性及近冰温冷藏技术研究[D].北京:中国农业大学, 2018.
FAN X G.Analysis of apricot postharvest quality and study of near freezing temperature storage on apricot[D].Beijing:China Agricultural University, 2018.
[7] 骆灵静. 树上干杏系列产品的开发[D].石河子:石河子大学, 2020.
LUO L J.Development of dry apricot products[D].Shihezi:Shihezi University, 2020.
[8] SU C Y, ZHENG X C, ZHANG D D, et al.Investigation of sugars, organic acids, phenolic compounds, antioxidant activity and the aroma fingerprint of small white apricots grown in Xinjiang[J].Journal of Food Science, 2020, 85(12):4300-4311.
[9] ZHAO C, SUN J K, PU X L, et al.Volatile compounds analysis and biomarkers identification of four native apricot (Prunus azmeniaca L.) cultivars grown in Xinjiang region of China[J].Foods, 2022, 11(15):2297.
[10] 程曦. 振动胁迫对杏果实采后后熟软化影响的研究[D].乌鲁木齐:新疆农业大学, 2015.
CHENG X.Effects of vibration stress on the softening of postharvest apricot fruits[D].Urumqi:Xinjiang Agricultural University, 2015.
[11] 张君萍, 高疆生, 李疆, 等.新疆杏与华北杏果实主要营养成分比较分析[J].新疆农业科学, 2006,43(2):140-144.
ZHANG J P, GAO J S, LI J, et al.Comparison analysis on main nutritive component of Xinjiang apricot and north China apricot[J].Xinjiang Agricultural Sciences, 2006,43(2):140-144.
[12] 张杰. 新疆杏浆中果酸的提取及其抗皮肤衰老性能研究[D].无锡:江南大学, 2012.
ZHANG J.Study on extraction and anti-aging activity of alpha hydroxy acids from Xinjiang apricot pulp[D].Wuxi:Jiangnan University, 2012.
[13] BUJNA E, FARKAS N A, TRAN A M, et al.Lactic acid fermentation of apricot juice by mono- and mixed cultures of probiotic Lactobacillus and Bifidobacterium strains[J].Food Science and Biotechnology, 2017, 27(2):547-554.
[14] SHI Y J, CUI X Y, GU S S, et al.Antioxidative and probiotic activities of lactic acid bacteria isolated from traditional artisanal milk cheese from northeast China[J].Probiotics and Antimicrobial Proteins, 2019, 11(4):1086-1099.
[15] AZAT R, LIU Y, LI W, et al.Probiotic properties of lactic acid bacteria isolated from traditionally fermented Xinjiang cheese[J].Journal of Zhejiang University - Science B, 2016, 17(8):597-609.
[16] 刘俊峰, 尹雪, 郭雪峰.新疆阿勒泰地区酸奶疙瘩中乳酸菌的分离和鉴定[J].中国酿造, 2017, 36(9):116-119.
LIU J F, YIN X, GUO X F.Isolation and identification of lactic acid bacteria in yogurt pimple from Aletai prefecture of Xinjiang[J].China Brewing, 2017, 36(9):116-119.
[17] 焦媛媛, 杜丽平, 孙文, 等.优良梨汁发酵乳酸菌的筛选与发酵性能分析[J].食品科学, 2019, 40(2):141-145.
JIAO Y Y, DU L P, SUN W, et al.Screening and fermentation characteristics of lactic acid bacteria for fermentation of pear juice[J].Food Science, 2019, 40(2):141-145.
[18] RODRIGUES N P A, GARCIA E F, DE SOUZA E L.Selection of lactic acid bacteria with promising probiotic aptitudes from fruit and ability to survive in different food matrices[J].Brazilian Journal of Microbiology, 2021, 52(4):2257-2269.
[19] 林凯, 蔡婷, 徐顾榕, 等.有机白萝卜表皮附生乳酸菌抗生素耐药性分析[J].食品科学, 2015, 36(11):145-149.
LIN K, CAI T, XU G R, et al.Antibiotic resistance of epibiotic lactic acid bacteria on the surface of organic white radish[J].Food Science, 2015, 36(11):145-149.
[20] SUN J K, ZHAO C, PU X L, et al.Flavor and functional analysis of lactobacillus plantarum fermented apricot juice[J].Fermentation, 2022, 8(10):533.
[21] 戴志伟, 张玥, 伊力夏提·艾热提, 等.四种乳酸菌发酵西梅浆的特性研究[J].食品与发酵工业, 2021, 47(15):220-227.
DAI Z W, ZHANG Y, YILIXIATI·A R T, et al.Characteristics of prunes pulp fermented by lactic acid bacteria[J].Food and Fermentation Industries, 2021, 47(15):220-227.
[22] 胡航伟, 高翠娟, 孙杰, 等.乳酸菌发酵蜜桃果酱制作过程中理化性质和关键香气成分演化研究[J].食品安全质量检测学报, 2022, 13(9):2745-2754.
HU H W, GAO C J, SUN J, et al.Study on evolution of physicochemical properties and key aroma components in honey peach jam with lactic acid bacteria fermentation[J].Journal of Food Safety and Quality, 2022, 13(9):2745-2754.
[23] 邵齐. 乳酸菌发酵果蔬浆加工及藏期间品质的变化研究[D].南昌:南昌大学,2018.
SHAO Q.Study on the changes of the quality of vegetable pulp fermented by Lactobacillus during processing and storage[D].Nanchang:Nanchang University,2018.
[24] 蔡文超. 植物源乳酸菌的筛选及其在红枣汁发酵中代谢产物的研究[D].石河子:石河子大学, 2022.
CAI W C.Screening of plant-derived lactic acid bacteria and their metabolites during the fermentation of jujube juice[D].Shihezi:Shihezi University, 2022.
[25] 王进. 新疆奶疙瘩细菌多样性与风味解析及菌株的应用[D].上海:上海海洋大学, 2021.
WANG J.Analysis of bacterial diversity and flavor and application of strains in Xinjiang cheese[D].Shanghai:Shanghai Ocean University, 2021.
[26] ZHU L, ZENG C L, YANG S, et al.Diversity and specificity of the bacterial community in Chinese horse milk cheese[J].Microbiology Open, 2020, 9(8):e1066.
[27] 朱昊伟. 食品用乳酸菌风险管控及对策研究[D].石家庄:河北经贸大学, 2019.
ZHU H W.Risk Control and control measure of lactic acid bacteria for foods[D].Shijiazhuang:University of Business &Economics in Hebei, 2019.
[28] 黄晓棠. 5株乳酸菌分离株的安全性及益生特性研究[D].保定:河北农业大学, 2020.
HUANG X T.Research on safety and probiotics properties of 5 isolate of lactic acid bacteria[D].Baoding:Hebei Agricultural University, 2020.
[29] PERRICONE M, CORBO M R, SINIGAGLIA M, et al.Viability of Lactobacillus reuteri in fruit juices[J].Journal of Functional Foods, 2014, 10:421-426.
[30] 张楠笛, 祝林, 许琴, 等.食窦魏斯氏菌协同植物乳杆菌改善四川泡菜风味[J].食品科学, 2020, 41(14):102-108.
ZHANG N D, ZHU L, XU Q, et al.Improvement of the flavor of Sichuan pickle by co-fermentation with Weissella cibaria and Lactobacillus plantarum[J].Food Science, 2020, 41(14):102-108.
[31] 李欣洁, 吕欣然, 杨雨帆, 等.不同益生菌发酵对黑胡萝卜汁感官品质和营养品质的影响[J].食品与发酵工业, 2023, 49(10):24-31.
LI X J, LYU X R, YANG Y F, et al.Effects of different probiotics fermentation on sensory quality and nutritional quality of black carrot juice[J].Food and Fermentation Industries, 2023, 49(10):24-31.
[32] CHEN C, LU Y Q, YU H Y, et al.Influence of 4 lactic acid bacteria on the flavor profile of fermented apple juice[J].Food Bioscience, 2019, 27:30-36.