萝卜硫苷(glucoraphanin,GRP)是西兰花中最丰富的硫代葡萄糖苷之一,可经黑芥子酶或肠道细菌的水解产生具有更高生物活性的萝卜硫素(sulforaphane,SFN)。研究表明,SFN通过抑制NF-κB和激活Nrf2信号通路发挥抗炎、抗氧化的功效[1-2]。人体没有黑芥子酶,GRP的水解主要靠肠道细菌的作用,然而人体对GRP的代谢能力并不高,且存在显著个体差异。一些乳酸菌例如植物乳杆菌、肠膜明串珠菌被报道能够分解GRP产SFN等代谢物[3]。COCETTA等[4]通过体外实验证实了罗伊氏乳杆菌、嗜酸乳杆菌以及草药提取物的组合物能够减轻炎症应激引起的肠道屏障功能障碍。
结肠炎是一种慢性、特发性的炎症性肠病,始于直肠,并延伸到结肠近端。目前,结肠炎的治疗主要是药物治疗,病情严重时可能需要手术治疗,但术后仍需要服用相关药物预防复发。研究表明,膳食西兰花或西兰花芽能够减轻结肠炎小鼠表观病症如体重损失、便血等现象,通过调节小鼠肠道菌群缓解结肠炎[5-7]。前期从健康成人粪便中分离得到具有较高GRP代谢能力的长双歧杆菌CCFM1206,发现其发酵产物中含有SFN、萝卜硫素-N-乙酰半胱氨酸(sulforaphane-cysteine,SFN-Cys)以及芥酸等物质,长双歧杆菌CCFM1206(109CFU/d)联合富含GRP的西兰花种子水提物(broccoli seed extract,BSE)(370 mg/kg体重)可以促进GRP转化为SFN,达到缓解小鼠结肠炎的效果[8]。
除长双歧杆菌CCFM1206外,一些益生菌也能缓解结肠炎,但不同菌株缓解结肠炎所需活菌数不同,有效剂量通常为108~1010 CFU,例如干酪乳杆菌DN-114001(108 CFU)、短乳杆菌K65(109 CFU)、长双歧杆菌HY8004(1010 CFU)均被报道能够改善结肠炎[9-11]。CHEN等[12]探究了不同活菌数短双歧杆菌CCFM683(具有产共轭脂肪酸能力)对缓解小鼠结肠炎的影响,发现109 CFU剂量以上的短双歧杆菌CCFM683才能显著增加结肠中共轭脂肪酸水平,从而缓解小鼠结肠炎。
因此,本文研究了不同剂量的长双歧杆菌CCFM1206联合西兰花种子水提物对小鼠肠内SFN水平的调控作用,并通过构建右旋糖酐硫酸酯钠(dextran sulfate sodium,DSS)诱导的结肠炎小鼠模型明确长双歧杆菌调控肠内SFN水平缓解结肠炎的效果,为开发功能性膳食制剂提供参考。
1 材料与方法
1.1 材料与试剂
实验菌株:长双歧杆菌CCFM1206,分离自健康成人粪便,保藏于江南大学食品微生物菌种保藏中心。
实验动物:SPF级雄性C57BL/6 J小鼠[6周龄,(18±2) g],北京维通利华实验动物技术有限公司。
主要试剂:BSE,赣州华汉生物科技有限公司;SFN标准品(纯度99%)、SFN-NAC标准品(纯度98%),Med Chem Express(上海)有限公司;DSS(分子质量为36~50 kDa),西格玛奥德里奇(Sigma-Aldrich)(上海)贸易有限公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、还原型谷胱甘肽(reduced glutathione,GSH)、髓过氧化物酶(myeloperoxidase,MPO)试剂盒,南京建成生物工程研究所;小鼠TNF-α、IL-1β和IL-6酶联免疫吸附测定试剂盒,美国R&D System有限公司。
1.2 仪器与设备
Thermo HFU 586 Basic冰箱、Multiscan Go多功能酶标仪,赛默飞(Thermo)世尔科技(中国)有限公司;高通量组织研磨仪,宁波新芝生物科技股份有限公司;5424R高速离心机,艾本德(Eppendorf)(上海)国际贸易有限公司;Pannoramic MIDI数字切片扫描仪,匈牙利3D-Histech有限公司;荧光定量PCR仪,伯乐(Bio-Rad)生命医学产品(上海)有限公司;超高效液相质谱UHPLC Q-Exactive-MS,沃特世(Waters)科技(上海)有限公司。
1.3 实验方法
1.3.1 长双歧杆菌CCFM1206菌液的制备
长双歧杆菌CCFM1206在MRS培养基中活化3代后,8 000×g离心15 min,取其上清液,生理盐水洗涤2~3次,离心得菌泥并重悬于已灭菌的30%(体积分数)甘油溶液,计数后置于-80 ℃冰箱贮存待用。灌胃前将菌液取出,用无菌生理盐水清洗2~3次,用9 g/L生理盐水重悬并稀释至活菌数为5×108、5×109和5×1010 CFU/mL 3个梯度。
1.3.2 BSE溶液和不同质量浓度复合物的配制
用9 g/L生理盐水溶解并稀释BSE,配制成200 mg/kg的BSE溶液。用9 g/L生理盐水溶解并稀释长双歧杆菌CCFM1206和BSE,配制成如表1中200 mg/kg BSE和不同活菌数长双歧杆菌CCFM1206的复合物。
表1 动物实验方案
Table 1 Animal experimental design

组别每日灌胃(0.2 mL)1~7 d8~14 d空白组 生理盐水自由饮水自由饮水模型组 生理盐水自由饮水2.5% DSS溶液BSE组 200 mg/kg BSE溶液自由饮水2.5% DSS溶液低剂量组200 mg/kg BSE溶液和5×108 CFU/mL长双歧杆菌复合物自由饮水2.5% DSS溶液中剂量组200 mg/kg BSE溶液和5×109 CFU/mL长双歧杆菌复合物自由饮水2.5% DSS溶液高剂量组200 mg/kg BSE溶液和5×1010 CFU/mL长双歧杆菌复合物自由饮水2.5% DSS溶液
1.3.3 动物实验设计
48只C57BL/6 J小鼠[雄性,(18±2) g]饲养于江南大学实验动物中心SPF级屏障设施(温度21~25 ℃,湿度20%~60%,光照/暗循环12 h)。适应1周后,小鼠随机分为10组(每组8只)(表1)。
实验期间,空白组小鼠可自由饮水,造模期间(8~14 d),除空白组外其他组小鼠自由饮用25 g/LDSS溶液。此外,每组小鼠都可以自由进食。每天测定小鼠体重、食物和水的摄入量。干预2周后,第15天处死小鼠,收集小鼠粪便、组织标本和结肠内容物用于后续研究。本动物实验方案经江南大学实验动物管理与动物福利伦理委员会批准(JN.No20220915c1281030[339])。
1.3.4 小鼠体重、DAI指数、结肠长度的测定
DSS造模期间,每日定时对小鼠进行灌胃和称重,收集小鼠粪便,观察粪便性状和便血情况并记录。
疾病活动指数(disease activity index,DAI)是根据体重变化率、粪便性状和便血情况综合评分。DAI指数评分标准参考MA等[13]研究,DAI=体重变化评分(0~4分)+粪便性状评分(0~4分)+便血情况评分(0~4分),总分为12分。体重变化率的计算如公式(1)所示:
体重变化率![]()
(1)
小鼠处死后,取小鼠完整结肠进行拍照并测量,记录小鼠结肠长度。
1.3.5 小鼠结肠组织病理学分析
取新鲜的结肠片段,浸泡于多聚甲醛中进行固定,并用石蜡包埋。石蜡切成切片,脱蜡,再水合,参考NAKAMURA等[14]的实验方法进行苏木精-伊红(hematoxylin &eosin,H&E)染色和制片,观察结肠组织病理损伤。在每张切片上随机选取3个区域进行组织学评分。
1.3.6 小鼠结肠炎症因子和氧化水平测定
收集所有小鼠的结肠组织,按1∶9(g∶mL)的料液比加入9 g/L生理盐水,置于高通量组织研磨仪中进行均质,组织匀浆以12 000×g、4 ℃离心15 min,得到上清液以测定炎症细胞因子和氧化应激水平。结肠炎症因子包括IL-6、IL-1β和TNF-α,氧化应激水平指标包括MDA、GSH、SOD和MPO,根据试剂盒说明书测定。
1.3.7 定量逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)分析
小鼠结肠组织按试剂盒说明书提取总RNA并反转成cDNA,用于测定小鼠结肠紧密连接蛋白(Claudin-1、Occludin、ZO-1)、炎症相关基因(NF-κB、Iκ-Bα)和抗氧化相关基因(Nrf2、NQO1)的mRNA转录水平。引物的基因序列如表2所示。
表2 基因引物序列
Table 2 Gene sequences of primers

基因正向引物(5′-3′)反向引物(5′-3′)OccludinCCGGCCGCCAAGGTTCGCTGATGTCACTGGT-CACCTAClaudin-1GGCTTCTCTGGGATGGATCGCCCCAGCAGGATGC-CAATTAZO-1GCCTTGAACTTTGACCTCTGCGAAATCGTGCTGATGT-GCCANF-κBCGCCCCTTATCGACCACCCCTTCTCCCAA-GAGTCGTCCAIκ-BαACCAACCAGCCAGAAATCGTCACAGGCAAGGTG-TAGAGGGNrf2CCTCCGCTGCCATCAGTCAGTTCGGCTGGGACTCGTGT-TCANQO1GGCGAAGCTTATGGTCG-GCAGAAGAGCACTCGGC-CTCGAGTTTTCTAGCTTT-GATCTGGTGAPDHAGGTCGGTGTGAACGGATTTGGGGGTCGTTGATGGCAA-CA
1.3.8 结肠组织免疫组化分析
免疫组化分析参考GUO等[15]的研究。结肠切片与一抗抗体孵育60 min,一抗抗体包括Claudin-1、Occludin、ZO-1,接着是与二抗和链霉亲和素-生物素过氧化物酶孵化120 min。最后,用光学显微镜在3,3′-四盐酸二氨基联苯胺下测量棕色部分。每张载玻片随机选取3个区域,并使用ImageJ软件计算平均密度。
1.3.9 小鼠粪便中SFN与SFN-NAC含量的测定
粪便样品经冻干后称重,记录重量。将冻干粪便样品置于1.5 mL离心管,用甲醇去除结肠内容物中蛋白质。蒸发和浓缩后,样品在80%甲醇中重新溶解,并通过ValueLab过滤器过滤用于UHPLC-MS分析,利用SFN、SFN-NAC进行定性和定量,具体测定方法参照本课题组之前的研究[8]。
1.4 数据统计与分析
使用SPSS 22.0进行统计分析,使用Origin 9.0进行可视化绘图。数据以平均值±标准误差(mean±standard error,SEM)表示。单因素方差分析(analysis of variance,ANOVA)使用Tukey多重检验,P<0.05表明两组以上差异有统计学意义。
2 结果与分析
2.1 不同活菌数长双歧杆菌CCFM1206对健康小鼠体内SFN含量的影响
GRP经肠道细菌代谢产生SFN,而SFN在宿主体内通过巯基酸途径进一步生成SFN-NAC,因此一些人群实验通常以SFN-NAC作为GRP的标志代谢物[16-17]。摄入200 mg/kg BSE和不同活菌数(108、109、1010CFU)长双歧杆菌CCFM1206后小鼠体内SFN、SFN-NAC的含量如表3所示:仅摄入200 mg/kg BSE时,小鼠粪便中SFN和SFN-NAC总量为30.84 μmol/g;补充108CFU长双歧杆菌CCFM1206后,小鼠粪便中SFN和SFN-NAC总量为35.25 μmol/g,无明显增长;补充109和1010 CFU长双歧杆菌CCFM1206后,小鼠粪便中SFN和SFN-NAC总量分别为45.48和49.32 μmol/g,均显著增加(P<0.05),约为仅摄入200 mg/kg BSE的1.5~1.6倍。综上所述,补充109 CFU以上长双歧杆菌CCFM1206可进一步促进小鼠体内GRP转化为SFN。
表3 不同活菌数长双歧杆菌CCFM1206对健康小鼠体内SFN含量的影响
Table 3 Effects of B.longum CCFM1206 with different viable counts on SFN levels in healthy mice
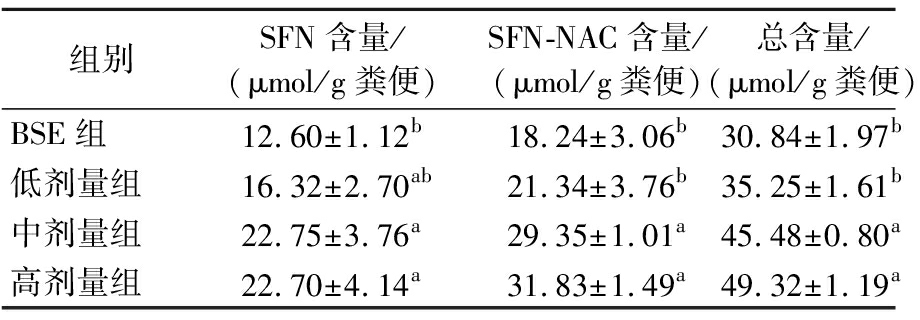
组别SFN含量/(μmol/g粪便)SFN-NAC含量/(μmol/g粪便)总含量/(μmol/g粪便)BSE组12.60±1.12b18.24±3.06b30.84±1.97b低剂量组16.32±2.70ab21.34±3.76b35.25±1.61b中剂量组22.75±3.76a29.35±1.01a45.48±0.80a高剂量组22.70±4.14a31.83±1.49a49.32±1.19a
注:不同小写字母表示不同组间存在显著差异(P<0.05)(下同)。
2.2 不同活菌数长双歧杆菌CCFM1206对小鼠结肠炎表观炎症的影响
为探究BSE和不同活菌数长双歧杆菌CCFM1206对小鼠结肠炎的效果,分析了典型的结肠炎症状,如体重减轻、结肠变短、粪便标本僵硬和便血等(图1)。与空白组相比,模型组小鼠在DSS诱导下体重下降、DAI指数升高、结肠变短、组织病理学评分提高(P<0.05)。观察小鼠结肠切片,模型组小鼠存在组织水肿、炎性细胞浸润、隐窝破坏与杯状细胞消失等现象。与模型组相比,摄入200 mg/kg BSE对小鼠表观病症缓解效果显著,补充108CFU长双歧杆菌CCFM1206与仅摄入200 mg/kg BSE无异。与BSE组和低剂量组相比,补充109和1010 CFU长双歧杆菌CCFM1206在体重和结肠长度上无显著性差异,而DAI指数和组织病理学评分则显著降低(P<0.05),且2组小鼠结肠组织完整,形态与空白组相似。上述结果表明,摄入200 mg/kg BSE能有效缓解小鼠结肠炎表观炎症,补充长双歧杆菌CCFM1206效果更佳。

A-小鼠体重;B-DAI指数;C-结肠长度;D-组织病理学评分;E-H&E染色切片
图1 不同活菌数长双歧杆菌CCFM1206对小鼠体重、DAI指数、结肠长度、组织病理学评分以及H&E染色切片的影响
Fig.1 Effects of B.longum CCFM1206 with different viable counts on body weight change, DAI score, colon length, histological score, and H&E sections in mice
注:不同小写字母表示不同组间存在显著差异(P<0.05)(下同)。
2.3 不同活菌数长双歧杆菌CCFM1206对小鼠肠道炎症的影响
结肠炎通常导致结肠促炎因子如TNF-α、IL-6和IL-1β含量的增加[18],各组小鼠结肠中炎症因子水平如图2所示。与空白组相比,模型组小鼠结肠中促炎因子IL-6、IL-1β、TNF-α水平显著上升。与模型组相比,摄入200 mg/kg BSE组小鼠结肠中促炎因子IL-6、IL-1β、TNF-α水平显著降低(P<0.05),补充不同活菌数的长双歧杆菌CCFM1206与仅摄入200 mg/kg BSE无显著差异,可能原因是小鼠肠内SFN含量已达缓解结肠炎的最低起效量,继续补充长双歧杆菌效果提升不明显。上述结果表明,摄入200 mg/kg BSE和补充长双歧杆菌CCFM1206均能有效缓解小鼠结肠炎症反应。

A-IL-6;B-IL-1β;C-TNF-α
图2 不同活菌数长双歧杆菌CCFM1206对小鼠结肠炎症因子水平的影响
Fig.2 Effects of B.longum CCFM1206 with different viable counts on colonic inflammatory cytokines in mice
2.4 不同活菌数长双歧杆菌CCFM1206对小鼠氧化应激的影响
结肠炎的发生和发展在一定程度上是由氧化应激导致,MDA、GSH、SOD和MPO是与氧化应激相关的物质或酶[19]。MPO活力上调和MDA含量增加可能导致结肠炎的恶性发展,而高水平的SOD和GSH则有助于防止结肠炎的氧化损伤[20]。通过测定MDA、GSH、SOD、MPO的含量或活力,评估结肠氧化应激水平(图3)。结果显示,与空白组相比,模型组小鼠的MDA含量、MPO活力显著提高,而GSH和SOD活力显著降低(P<0.05)。与模型组相比,摄入200 mg/kg BSE的小鼠MDA含量、MPO活力显著降低,GSH和SOD活力显著提高(P<0.05),补充108、109和1010 CFU长双歧杆菌与BSE组无显著差异。由此可见,200 mg/kg BSE与补充不同活菌数长双歧杆菌CCFM1206均能有效改善小鼠结肠氧化应激水平。

A-MDA;B-GSH;C-SOD;D-MPO
图3 不同活菌数长双歧杆菌CCFM1206对小鼠结肠氧化应激水平的影响
Fig.3 Effects of B.longum CCFM1206 with different viable counts on colonic oxidative stress levels in mice
2.5 不同活菌数长双歧杆菌CCFM1206对小鼠肠道屏障的影响
Claudin-1、Occludin和ZO-1是主要的结肠紧密连接蛋白,具有维持肠道上皮细胞的完整性和肠屏障功能,其含量减少表明肠屏障被破坏,是结肠炎常见的病理特征[21]。通过测定各组小鼠结肠3种紧密连接蛋白的转录和表达水平,评估摄入200 mg/kg BSE和不同活菌数长双歧杆菌对小鼠肠道屏障的作用(图4)。模型组小鼠Claudin-1、Occludin和ZO-1蛋白的mRNA转录水平均显著低于空白组(P<0.05)。与模型组相比,摄入200 mg/kg BSE显著增强了Claudin-1、Occludin以及ZO-1蛋白的转录水平(P<0.05),补充不同活菌数的长双歧杆菌CCFM1206在Claudin-1、Occludin蛋白的转录水平与仅摄入200 mg/kg BSE无异,而补充1010CFU长双歧杆菌CCFM1206可显著提高ZO-1蛋白的转录水平。
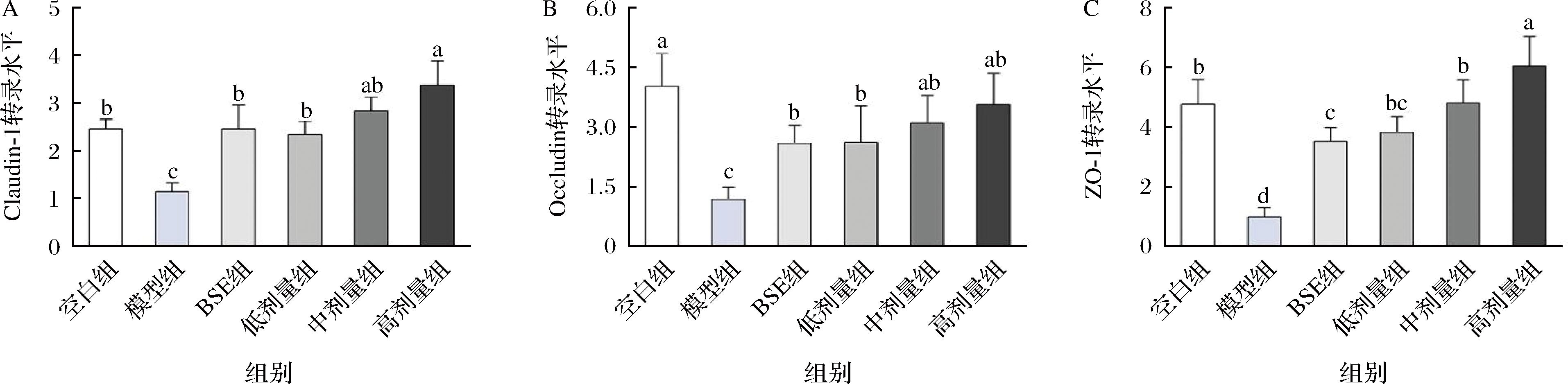
A-Claudin-1;B-Occludin;C-ZO-1
图4 不同活菌数长双歧杆菌CCFM1206对小鼠紧密连接蛋白转录水平的影响
Fig.4 Effects of B.longum CCFM1206 with different viable counts on the transcription of tight-junction proteins in mice
免疫组化分析(图5)也呈现相似结果。与空白组相比,模型组小鼠Claudin-1、Occludin和ZO-1蛋白的平均密度显著降低(P<0.05);与模型组相比,BSE组小鼠紧密连接蛋白的平均密度显著增加(P<0.05),且补充109 CFU和1010 CFU长双歧杆菌CCFM1206可显著提高Occludin蛋白平均密度。上述结果表明,摄入200 mg/kg BSE和补充不同活菌长双歧杆菌均能有效保护小鼠肠道屏障,且补充109 CFU剂量以上长双歧杆菌效果更佳。COCETTA等[4]将2×109 CFU/mL的罗伊氏乳杆菌和嗜酸乳杆菌与中草药提取物联合应用于Caco-2细胞的体外炎症实验,发现该组合能够促进紧密连接蛋白Occludin和ZO-1蛋白的表达,有助于减轻肠道屏障功能障碍。本研究中长双歧杆菌CCFM1206与200 mg/kg BSE的组合也为膳食缓解肠道屏障功能障碍提供了一种可能。

A-免疫组化染色切片;B-平均密度
图5 不同活菌数长双歧杆菌CCFM1206对小鼠紧密连接蛋白表达水平的影响
Fig.5 Effects of B.longum CCFM1206 with different viable counts on the expression of tight-junction proteins in mice
2.6 不同活菌数长双歧杆菌CCFM1206对Nrf2和NF-κB信号通路的影响
SFN是Nrf2信号通路的激活剂,能上调NQO1、HO-1、SOD等Ⅱ相酶以及抗氧化酶的酶活力,发挥抗氧化功能。SFN也能抑制NF-κB信号通路,减少TNF-α、IL-6、iNOS等炎症介质的分泌,对炎症相关疾病起到预防作用。为探究200 mg/kg BSE和长双歧杆菌CCFM1206缓解结肠炎的机制,测定了结肠炎相关基因的mRNA转录水平(图6)。与空白组相比,模型组中NF-κB的mRNA相对表达量显著上调,而Iκ-Bα、NQO1和Nrf2的mRNA相对表达量显著下降(P<0.05)。BSE组Iκ-Bα、NQO1和Nrf2的转录水平显著高于模型组,而NF-κB转录水平明显更低(P<0.05)。补充109 CFU和1010 CFU长双歧杆菌CCFM1206后NQO1和Nrf2的转录水平上显著高于BSE组,而Iκ-Bα和NF-κB的转录水平与BSE组无显著差异。

A-Nrf2;B-NQO1;C-NF-κB;D-Iκ-Bα
图6 不同活菌数长双歧杆菌CCFM1206对Nrf2和NF-κB信号通路转录水平的影响
Fig.6 Effects of B.longum CCFM1206 with different viable counts on the transcription level of Nrf2 and NF-κB signal pathways
上述结果表明,200 mg/kg BSE和在此基础上补充不同活菌数长双歧杆菌CCFM1206均能有效激活Nrf2通路,并抑制NF-κB信号通路,从而缓解结肠炎,且补充109 CFU剂量以上长双歧杆菌效果更佳。推测可能原因是中、高剂量组小鼠体内代谢产生了更多的SFN和SFN-NAC。SFN可导致Nrf2从Keap1中解离,并转位到细胞核中,在细胞核中Nrf2与抗氧化反应元件(ARE)应答基因结合,调节其他基因的表达(如NQO1)[22]。SFN-NAC可以磷酸化细胞外信号调节激酶1/2(ERK1/2),磷酸化后的ERK1/2可以转移到细胞核,抑制NF-κB信号通路[23]。此外,Nrf2和NF-κB两者之间也存在相互作用,Nrf2除了通过调控氧化还原抑制炎症外,也被证明可抑制NF-κB信号通路相关促炎细胞因子基因的转录上调而发挥作用[24]。因此,更多的SFN和SFN-NAC有助于上调Nrf2通路和抑制NF-κB通路,从而改善DSS诱导的结肠炎。
2.7 不同活菌数长双歧杆菌CCFM1206对缓解小鼠结肠炎效果差异的比较与分析
将200 mg/kg BSE与不同活菌数长双歧杆菌CCFM1206组合,比较各组间在与结肠炎相关指标以及SFN代谢水平上的差异(表4)。200 mg/kg BSE与109 CFU、1010 CFU长双歧杆菌CCFM1206组合在一些指标上的效果明显更佳,例如SFN水平显著高于BSE组和低剂量组(P<0.05),在激活Nrf2和抑制NF-κB信号通路方面显著优于BSE组和低剂量组(P<0.05)。而在减轻小鼠结肠炎表观症状、抑制结肠炎症和氧化应激反应以及促进紧密连接蛋白的转录与表达方面,200 mg/kg BSE和不同活菌数长双歧杆菌CCFM1206组合与仅摄入200 mg/kg BSE差异不大,原因可能是小鼠体内SFN水平已达缓解结肠炎的最低起效量。
表4 200 mg/kg和不同活菌数长双歧杆菌CCFM1206组间的主要指标结果与显著性
Table 4 Results and significance of the main parameters among groups of 200 mg/kg BSE and B.longum CCFM1206 with different viable counts

指标BSE组低剂量组中剂量组高剂量组表观症状体重减轻率/%7.95±1.63a9.56±1.46a7.50±1.25a7.83±2.87aDAI指数5.75±0.52a5.73±0.32a4.83±0.27a4.68±0.26a组织病理评分5.65±0.39a5.61±0.32a4.75±0.38a4.53±0.36a结肠长度/cm6.33±0.21a6.35±0.37a6.57±0.48a6.62±0.22a炎症因子IL-6/(pg/mg蛋白)7.04±0.96a7.07±1.11a6.52±0.90a6.30±0.54aTNF-α/(pg/mg蛋白)49.17±3.96a47.88±2.28ab44.61±2.17bc41.24±2.32cIL-1β/(pg/mg蛋白)5.90±0.41a5.80±0.41ab5.22±0.40ab5.00±0.51b氧化应激MDA/(nmol/mg蛋白)1.09±0.18a1.09±0.18a1.09±0.18a1.09±0.18aGSH/(U/mg蛋白)0.30±0.04a0.30±0.03a0.31±0.02a0.31±0.02aSOD/(U/mg蛋白)24.66±1.39a25.89±1.58a27.75±1.76a27.40±2.00aMPO/(U/mg蛋白)1.27±0.30a1.26±0.29a1.13±0.28a1.05±0.15a紧密连接蛋白Claudin-1转录水平2.46±0.50a2.33±0.29a2.83±0.29ab3.38±0.51bOccludin转录水平2.59±0.45a2.62±0.92a3.10±0.69a3.57±0.78aZO-1转录水平3.52±0.46a3.81±0.54ab4.80±0.77b6.03±0.99c信号通路Nrf2转录水平3.26±1.00a3.17±1.04a4.51±1.80b4.75±2.57bNQO1转录水平2.47±0.63a2.38±0.99a3.55±0.64b3.86±1.46bNF-κB转录水平0.44±0.17a0.39±0.23a0.36±0.18a0.34±0.15aIκ-Bα转录水平4.16±0.91a3.99±0.97a5.04±0.64b5.51±0.71b代谢物含量SFN含量/(μmol/g粪便)12.60±1.12a 16.32±2.70ab22.75±3.76b 22.70±4.14b SFN-NAC含量/(μmol/g粪便)18.24±3.06a21.34±3.76a29.35±1.01b31.83±1.49b总含量/(μmol/g粪便)30.84±1.97a35.25±1.61a45.48±0.80b49.32±1.19b
3 结论与讨论
本文研究了在摄入200 mg/kg BSE情况下,补充不同活菌数长双歧杆菌CCFM1206对小鼠体内SFN代谢的影响,评估了其对DSS诱导的结肠炎的缓解效果。结果显示,补充109 CFU剂量以上的长双歧杆菌CCFM1206能够促进小鼠体内转化GRP为SFN;在缓解小鼠结肠炎方面,200 mg/kg BSE和不同活菌数长双歧杆菌CCFM1206组合均能改善小鼠结肠炎表观病症、降低结肠炎症反应和氧化应激水平、促进紧密连接蛋白的转录和表达、上调Nrf2信号通路和抑制NF-κB信号通路,从而缓解结肠炎,且补充109 CFU剂量以上的长双歧杆菌CCFM1206在激活Nrf2和抑制NF-κB信号通路方面效果更佳。
综上所述,可在摄入200 mg/kg BSE的同时,补充长双歧杆菌CCFM1206,促进体内GRP转化为SFN,实现肠内SFN水平有效调控,增强膳食补充GRP的健康益处。因人体对GRP的代谢能力在个体间存在显著差异,补充剂量可根据人群差异而定,若人体肠道菌群将GRP转化为SFN的能力相对较强,可适当减少长双歧杆菌补充量;若人体肠道对GRP的代谢能力相对较弱,则可补充109 CFU剂量以上长双歧杆菌CCFM1206以促进GRP代谢。
[1] SUBEDI L, LEE J H, YUMNAM S, et al.Anti-inflammatory effect of sulforaphane on LPS-activated microglia potentially through JNK/AP-1/NF-κB inhibition and Nrf2/HO-1 activation[J].Cells, 2019, 8(2):194.
[2] QIN W S, DENG Y H, CUI F C.Sulforaphane protects against acrolein-induced oxidative stress and inflammatory responses:Modulation of Nrf-2 and COX-2 expression[J].Archives of Medical Science:AMS, 2016, 12(4):871-880.
[3] YE J H, HUANG L Y, TEREFE N S, et al.Fermentation-based biotransformation of glucosinolates, phenolics and sugars in retorted broccoli puree by lactic acid bacteria[J].Food Chemistry, 2019, 286:616-623.
[4] COCETTA V, CATANZARO D, BORGONETTI V, et al.A fixed combination of probiotics and herbal extracts attenuates intestinal barrier dysfunction from inflammatory stress in an in vitro model using Caco-2 cells[J].Recent Patents on Food, Nutrition and Agriculture, 2019, 10(1):62-69.
[5] HUBBARD T D, MURRAY I A, NICHOLS R G, et al.Dietary broccoli impacts microbial community structure and attenuates chemically induced colitis in mice in an Ah receptor dependent manner[J].Journal of Functional Foods, 2017, 37:685-698.
[6] ZHANG T, HOLMAN J, MCKINSTRY D, et al.A steamed broccoli sprout diet preparation that reduces colitis via the gut microbiota[J].The Journal of Nutritional Biochemistry, 2023, 112:109215.
[7] WU J Y, GUO W L, CUI S M, et al.Broccoli seed extract rich in polysaccharides and glucoraphanin ameliorates DSS-induced colitis via intestinal barrier protection and gut microbiota modulation in mice[J].Journal of the Science of Food and Agriculture, 2023, 103(4):1749-1760.
[8] WU J Y, CUI S M, TANG X, et al.Bifidobacterium longum CCFM1206 promotes the biotransformation of glucoraphanin to sulforaphane that contributes to amelioration of dextran-sulfate-sodium-induced colitis in mice[J].Journal of Agricultural and Food Chemistry, 2023, 71(2):1100-1112.
[9] REJCHRT S, KVETINA J, KUNES M, et al.Tu1632 The probiotic Lactobacillus casei Dn 114001 significantly influenced absorption and metabolism of 5-aminosalicylic acid in experimental porcine inflammatory bowel disease induced by dextran sulfate sodium[J].Gastroenterology, 2013, 144(5):S810.
[10] LIU Y W, ONG W K, SU Y W, et al.Anti-inflammatory effects of Lactobacillus brevis K65 on RAW 264.7 cells and in mice with dextran sulphate sodium-induced ulcerative colitis[J].Beneficial Microbes, 2016, 7(3):387-396.
[11] LEE I A, BAE E A, LEE J H, et al.Bifidobacterium longum HY8004 attenuates TNBS-induced colitis by inhibiting lipid peroxidation in mice[J].Inflammation Research, 2010, 59(5):359-368.
[12] CHEN Y, JIN Y, STANTON C, et al.Dose-response efficacy and mechanisms of orally administered CLA-producing Bifidobacterium breve CCFM683 on DSS-induced colitis in mice[J].Journal of Functional Foods, 2020, 75:104245.
[13] MA C M, YANG D X, WANG B W, et al.Gasdermin D in macrophages restrains colitis by controlling cGAS-mediated inflammation[J].Science Advances, 2020, 6(21):eaaz6717.
[14] NAKAMURA A, KURIHARA S, TAKAHASHI D, et al.Symbiotic polyamine metabolism regulates epithelial proliferation and macrophage differentiation in the colon[J].Nature Communications, 2021, 12(1):2105.
[15] GUO W L, MAO B Y, CUI S M, et al.Protective effects of a novel probiotic Bifidobacterium pseudolongum on the intestinal barrier of colitis mice via modulating the Pparγ/STAT3 pathway and intestinal microbiota[J].Foods, 2022, 11(11):1551.
[16] WU J Y, CUI S M, LIU J S, et al.The recent advances of glucosinolates and their metabolites:Metabolism, physiological functions and potential application strategies[J].Critical Reviews in Food Science and Nutrition, 2023, 63(20):4217-4234.
[17] CRAMER J M, TERAN-GARCIA M, JEFFERY E H.Enhancing sulforaphane absorption and excretion in healthy men through the combined consumption of fresh broccoli sprouts and a glucoraphanin-rich powder[J].The British Journal of Nutrition, 2012, 107(9):1333-1338.
[18] NEURATH M F.Cytokines in inflammatory bowel disease[J].Nature Reviews Immunology, 2014, 14(5):329-342.
[19] BHATTACHARYYA A, CHATTOPADHYAY R, MITRA S,et al.Oxidative stress:An essential factor in the pathogenesis of gastrointestinal mucosal diseases[J].Physiological Reviews, 2014, 94(2):329-354.
[20] HWANG J, JIN J, JEON S, et al.SOD1 suppresses pro-inflammatory immune responses by protecting against oxidative stress in colitis[J].Redox Biology, 2020, 37:101760.
[21] CUI L, GUAN X N, DING W B, et al.Scutellaria baicalensis Georgi polysaccharide ameliorates DSS induced ulcerative colitis by improving intestinal barrier function and modulating gut microbiota[J].International Journal of Biological Macromolecules, 2021, 166:1035-1045.
[22] LEE J S, SURH Y J.Nrf2 as a novel molecular target for chemoprevention[J].Cancer Letters, 2005, 224(2):171-184.
[23] WU S, ZHOU Y, YANG G X, et al.Sulforaphane-cysteine induces apoptosis by sustained activation of ERK1/2 and caspase 3 in human glioblastoma U373MG and U87MG cells[J].Oncology Reports, 2017, 37(5):2829-2838.
[24] KOBAYASHI E H, SUZUKI T, FUNAYAMA R, et al.Nrf2 suppresses macrophage inflammatory response by blocking proinflammatory cytokine transcription[J].Nature Communications, 2016, 7(1):11624.