胶原蛋白是人体内含量最多,分布最广的功能性蛋白之一,约占据人体总蛋白的1/3左右,主要存在于哺乳动物的皮肤、骨骼、肌肉、血管、肌腱等组织,是动物结缔组织和细胞外基质的重要组成成分[1-2]。胶原蛋白由3条长度相同的左旋多脯氨酸α-螺旋肽链组成,以相错一个残基的方式围绕中心轴拧成右手3股螺旋结构[3]。胶原蛋白稳定的3股螺旋结构赋予其出色的生物力学性能和生物相容性,因此广泛应用于生物医学、组织工程、食品工业、化妆品美容等众多领域。目前获取胶原蛋白的途径主要包括传统动物组织提取、化学合成、动植物生产和微生物重组表达。传统动物组织提取是最常见的方法,但是可能存在免疫原性和潜在病原体感染的风险。化学合成虽然能够精确设计和合成胶原多肽,但合成工艺复杂,成本较高,且三螺旋肽的长度远不及天然胶原。动植物生产和微生物重组表达都是通过基因工程技术将胶原蛋白基因导入宿主细胞中进行表达,其中微生物重组表达具有更高的生产效率和更低的生产成本,尤其适用于大规模工业生产。近年来,合成生物学的进步提供了高度可定制的工具,同时高效的微生物表达系统显著提高了蛋白的生产效率,微生物表达重组胶原蛋白具有广泛的应用前景。
目前表达重组胶原蛋白常用的微生物表达系统包括大肠杆菌(Escherichia coli)和毕赤酵母(Pichia pastoris)表达系统。在大肠杆菌中表达来源于化脓性链球菌(Streptococcus pyogenes)的胶原蛋白Scl2,摇瓶水平产量达300 mg/L,发酵罐水平产量高达19 g/L,且在缺乏脯氨酸羟化酶修饰的情况下仍能形成稳定的三股螺旋结构[4-5]。分别通过响应面优化、培养基成分和分批发酵条件的优化等策略,类人源Ⅲ型胶原蛋白在大肠杆菌和毕赤酵母表达系统的产量分别达到9.68 g/L[6]和4.71 g/L[7];截取人源I型胶原亲水性片段合成的重组胶原蛋白在毕赤酵母中的发酵罐水平产量高达4.5 g/L[8]。然而,大肠杆菌表达系统在表达外源蛋白时多为胞内表达,同时产生的大量内源蛋白和内毒素都会为下游纯化带来一定的挑战。毕赤酵母表达系统存在操作复杂、表达周期长等问题。相对而言,谷氨酸棒杆菌(Corynebacterium glutamicum)作为符合食品安全标准的宿主,因其在分泌表达和纯化等方面的显著优势而受到越来越多的关注。在细胞工程领域,基因表达的调节对于代谢工程至关重要[9]。其中启动子与基因的表达及其调控密切相关。大肠杆菌诱导型启动子如tac,lacUV5,trc等已经广泛用于谷氨酸棒杆菌中的基因表达,而通过定点诱变技术扩展Ptac的-10区得到的启动子tacM具有更强的活性[10]。同时近年来挖掘谷氨酸棒杆菌的天然内源型启动子和构建高强度的组成型合成启动子受到广泛的研究。其中,基于谷氨酸棒杆菌ATCC 13032的RNA-Seq数据和荧光强度分析;从90个突变菌株中获得了16个高强度的天然PUTR和最强内源型启动子PNCgl1676[11]。而通过传统合成启动子文库和统计模型分析相结合的策略,合成启动子P69的强度比甚至比Ptac高93%[12]。此外,核糖体结合位点(ribosomal binding site,RBS)和间隔序列(aligned spacing,AS)也对mRNA的翻译水平产生重要影响。在谷氨酸棒杆菌中启动子ahp和不同的RBS组合使用呈现出不同能力的蛋白表达水平[13]。通过对谷氨酸脱羧酶(glutamate decarboxylase,GAD)编码基因前的RBS序列进行优化并在此基础上改变RBS序列后的间隔序列,显著提高了GAD酶活性及γ-氨基丁酸(γ-aminobutyric acid,GABA)产量[14]。另外,通过构建RBS文库并组合不同强度的RBS共表达基因aroG、aroB、aroD、aroE,降低了多次转化的复杂性,减少了表达系统的负担并最终提高了莽草酸的产量[15]。因此,通过不同强度的RBS串联基因表达盒同样有助于提高蛋白的整体表达效率。
为了实现带有三螺旋结构胶原蛋白的分泌表达,实验室前期选用来自化脓性链球菌类胶原蛋白Scl2的胶原片段B序列,经信号肽筛选和发酵条件的优化,使得重组胶原蛋白V-B的表达量提升至67.3 mg/L[16],但表达量依旧处于较低水平。因此本研究以V-B作为模式蛋白,通过启动子筛选,RBS、AS优化和多基因表达盒的串联组合策略的综合应用,旨在提高重组胶原蛋白在谷氨酸棒杆菌中表达的水平。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
E.coli JM109、E.coli BL21、C.glutamicum ATCC13032及大肠杆菌-谷氨酸棒杆菌穿梭表达质粒tac-V-B均为本实验室保藏。实验中构建重组质粒所用的引物由苏州金唯智生物科技有限公司合成。
1.1.2 主要试剂
DL 10 000 DNA marker、Blunting Kination Ligation (BKL) Kit、Premixed Protein Marker (Broad),TaKaRa公司;2×Phanta Max Master Mix、ClonExpress Ⅱ One Step Cloning Kit,Ultra GelRed (10 000×),南京诺唯赞生物科技股份有限公司;Ezup柱式游离DNA抽提试剂盒、氯霉素及异丙基-β-D硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG),生工生物(上海)股份有限公司;SDS-PAGE试剂盒、BCA蛋白浓度测定试剂盒(增强型),上海碧云天生物技术股份有限公司;GeneJET凝胶回收试剂盒,Thermo Fisher Scientific-CN;其余试剂无特殊说明,均为国产分析纯。
1.2 实验方法
1.2.1 启动子的选择及重组菌株的构建
在本研究中,所选择的外源诱导型和组成型启动子通过直接设计引物,经过PCR扩增得到带有不同启动子序列的重组质粒,获得的产物进行磷酸化连接后,转化至E.coli JM109,为验证所得的阳性转化子,进行了测序验证。内源启动子的获取是通过使用试剂盒提取C.glutamicum ATCC13032的基因组,随后根据启动子和载体序列,设计表1所示引物。扩增得到的序列与载体pXMJ19通过同源重组连接,同样转化至E.coli JM109并进行测序验证,由此构建带有不同启动子序列的pXMJ19重组质粒。
表1 启动子改造使用的引物
Table 1 Primers used for promoter modification

引物名称引物序列(5′-3′)大小/bptacM-FATGGTACCACACGATGATTAATTGTCAACAGCTCACAGCTCATTTCAGAATATTTGCC58tacM-RTGTGGAATTGTGAGCGGATAACAATTCCCAATTGAAAGGAGTCGACATGAAGCTGT56P7-FACAGAACCATTATAACACAGATTCAAATTAATGTCAACAGCTCATTTCAGAATATTTG58P7-RGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGAATTAATTAGGAGGTATAC57H36-FAATATTCCCCCGTTTAGGGCACCAGATAGAGGTACCCAGCTTTTGCAGCTCATTTCAG58H36-RAACGGGCCCAGGGTGGTCGCACCTTGGTTGGTAGGAGTAGCATCGTCGACATGAAGCT58H10-FATACGCCGCCGGCTTAGAGCCGACCGGTAAGGGTTGAGCCAGCTCATTTCAGAATATT58H10-RGGTAAGCTCTGTTATGTATAGTCCGAGCACGGCGAAAGGGTCGACATGAAGCTGTCAC58NCgl1676-FTGAAATGAGCTGATGCGACAGTACTTTTCATTAAGC36NCgl1676-RCTTCATGTCGACCATGTCCATAGTCCTAACCAATCA36NCgl0226-FTGAAATGAGCTGTGGATCTGTATTTGACGTGGTT34NCgl0226-RCTTCATGTCGACGTGGTGCTCATCTCCTACTT32sod-FTGAAATGAGCTGTAGCTGCCAATTATTCCGGG32sod-RCTTCATGTCGACGGGTAAAAAATCCTTTCGTAGGT35tac-R0-FAAAGGAGTCGACATGAAGCTT21tac-R0-RAATTAATTCTGTTTCCTGTGTGAAATTG28P7-R0-FAGTCGACATGAAGCTGTCAC20P7-R0-RCCTTTAATTAATTCTGTTTCCTGTGTG27pXMJ19-FCAGCTCATTTCAGAATATTTGCCAG25pXMJ19-RGTCGACATGAAGCTTTCACAC21
1.2.2 不同启动子重组菌株的摇瓶发酵
将经过测序验证的重组质粒通过电击转化引入C.glutamicum ATCC13032感受态细胞,涂布于含15 μg/mL氯霉素的LBHIS培养皿上培养36 h,通过抗性筛选得到阳性转化子,并将其命名为Promoter-V-B。同时以tac-V-B作为对照菌株,挑取单菌落至种子培养基BHI,于30 ℃,200 r/min条件下过夜培养11 h,转接至发酵培养基[17],在实验室前期发酵优化的基础上进行摇瓶发酵[16]。
1.2.3 不同启动子重组菌株发酵时长的优化
利用带有不同启动子的重组菌株Promoter-V-B进行摇瓶发酵,在整个发酵过程中,每隔12 h取样测定OD600值,同时在发酵的24、36、48、60、72 h分别取样,以探究各启动子在不同发酵时长下对V-B表达水平的影响。
1.2.4 诱导型启动子RBS和AS序列的优化设计
本实验以AAAGGA作为RBS序列的种子区域,并以tacR0-V-B和tacM-V-B作为RBS和AS优化载体,利用在线服务器RBS Calculator Version 2.1(https://salislab.net/software/predict_rbs_library_calculator),设计突变文库,选择5个不同强度的RBS序列,设计表2所示引物分别合成重组质粒,并构建包含10个不同RBS序列的工程菌。
表2 RBS、AS改造使用的引物
Table 2 Primers used for RBS and AS modification

引物名称引物序列(5′-3′)大小/bptac-R1-FAAAGGAGGTTTTTTATGAAGCTTTCACACCGCATCGCAG39tac-R1-RTTCATAAAAAACCTCCTTTAATTAATTCTGTTTCCTGTGTGAAATTGTTATCCG54tac-R2-FAAAGGAGGTATTTGTATGAAGCTTTCACACCGCATCGCAG40tac-R2-RTCATACAAATACCTCCTTTAATTAATTCTGTTTCCTGTGTGAAATTGTTATCC53tac-R3-FAAAGGAGGTATATATGAAGCTTTCACACCGCATCGCAG38tac-R3-RCTTCATATATACCTCCTTTAATTAATTCTGTTTCCTGTGTGAAATTGTTATCCGC55tac-R4-FAAAGGAGGTATAATGAAGCTTTCACACCGCATCGCAG37tac-R4-RGCTTCATTATACCTCCTTTAATTAATTCTGTTTCCTGTGTGAAATTGTTATC53tac-R5-FAAAGGAGATATTTAATGAAGCTTTCACACCGCATCGCA39tac-R5-RTTCATTAAATATCTCCTTTAATTAATTCTGTTTCCTGTGTGAAATTGTTAT51tacM-R1-FTTGAAAGGAGGTCTTTTATGAAGCTGTCACACCGCATCGC40tacM-R1-RCATAAAAGACCTCCTTTCAATTGGGAATTGTTATCCGCTC40tacM-R2-FATTGAAAGGAGGTCTTAATGAAGCTGTCACACCGCATCGC40tacM-R2-RCATTAAGACCTCCTTTCAATTGGGAATTGTTATCCGCTC39tacM-R3-FATTGAAAGGAGGTTTTAATGAAGCTGTCACACCGCATCGC40tacM-R3-RCATTAAAACCTCCTTTCAATTGGGAATTGTTATCCGCTC39tacM-R4-FATTGAAAGGAGGTCTAATGAAGCTGTCACACCGCATCGC39tacM-R4-RCATTAGACCTCCTTTCAATTGGGAATTGTTATCCGCTC38tacM-R5-FATTGAAAGGAGGAGATATTATGAAGCTGTCACACCGCATCGC42tacM-R5-RCATAATATCTCCTCCTTTCAATTGGGAATTGTTATCCGCTC41
1.2.5 不同RBS序列重组菌株的摇瓶发酵
通过电击转化和抗性筛选得到的阳性转化子命名为tac-Rs-V-B和tacM-Rs-V-B。与对照菌株tac-R0-V-B和tacM-V-B一同进行摇瓶发酵。在发酵过程中,每隔8 h取样测定OD600值,并在最优发酵时长进行采样,以研究不同的RBS序列对V-B表达量的影响。
1.2.6 胶原蛋白V-B的纯化
在最优发酵时长下,以4 ℃、11 000 r/min离心30 min,取发酵上清液,经0.45 μm水系滤膜过滤。然后用His TrapTM HP 5 mL亲和纯化。具体步骤如下:首先,用15个柱体积的上样缓冲液(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、10 mmol/L iminazole、pH 7.4)平衡。然后,以3 mL/min的流速进样,待进样结束后,使用上样缓冲液平衡。接着,用10%洗脱缓冲液(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、500 mmol/L iminazole、pH 7.4)除去杂蛋白。最后,通过梯度洗脱获得目的蛋白,并通过SDS-PAGE检验纯化情况。
1.2.7 胶原蛋白V-B的定量分析
本研究通过对发酵上清液进行SDS-PAGE,通过BCA蛋白含量测定法对纯化后的胶原蛋白产量进行准确定量。
1.2.8 胰蛋白酶酶切
使用胰蛋白酶对纯化后的胶原蛋白V-B进行酶切,经SDS-PAGE验证后进行真空冷冻干燥。
1.2.9 MALDI-TOF质谱法检测
将冻干后的胶原蛋白样品溶于超纯制成1 mg/mL的溶液,利用AB Sciex4800质谱仪在线性模式下进行分子质量鉴定。
1.2.10 圆二色谱检测
将冻干后的胶原蛋白样品溶于pH 7.4的10 mmol/L的PB缓冲液,配成1 mg/mL的溶液。于4 ℃平衡24 h以上,使用圆二色谱对胶原蛋白进行二级结构表征和熔解温度(melting temperature,Tm)的测定。在4 ℃以下扫描190~260 nm范围内样品的全波长,设置步长为1 nm,平均扫描时间2 ns,根据全波长的特征吸收峰确定蛋白的二级结构。设置波长为225 nm,温度10~70 ℃,升温速率为1 ℃/min,每个温度下平衡5 s。记录样品吸光值得到热变曲线,并通过拟合热变曲线的一阶导数得到Tm。
2 结果与分析
2.1 不同类型启动子重组菌株的构建与表达
为了研究不同启动子对重组胶原蛋白表达量的影响,以确定最优启动子。本研究筛选了谷氨酸棒杆菌中部分强启动子,这些启动子包括外源诱导型启动子tacM和P7,组成型启动子H36和H10,以及内源启动子NCgl1676、NCgl0226和sod。通过同源重组将其引入信号肽PorB前端,构建相应的重组菌株,进行摇瓶发酵,对照菌株为携带Ptac的tac-V-B[16]。每8 h取样测定OD600值并绘制了生长曲线,如图1-a所示,各重组菌株在前32 h生长迅速,在32~48 h菌体总数趋于稳定,并先后达到峰值,随后进入衰亡期。取48 h发酵上清液进行SDS-PAGE。如图1-b所示,与引入tac启动子的对照菌株相比,tacM、H36、H10和NCgl1676启动子介导的蛋白表达量均高于对照菌株,尤其是诱导型启动子tacM和内源启动子NCgl1676表达效果最佳。

a-不同重组菌株的生长曲线; b-不同重组菌株发酵上清液的SDS-PAGE图
图1 不同启动子重组菌株的表达
Fig.1 Expression of strains with different promoters
根据蛋白条带结果,观察到诱导型启动子tac、tacM和P7在介导胶原蛋白V-B时表达水平有明显的差异,进一步分析可能原因是它们的RBS序列不同,作为控制翻译起始速率的关键元件,RBS影响核糖体的结合和启动子复合物的形成,从而对蛋白表达产生影响[18]。鉴于后续实验将对RBS序列进行改造,本研究将Ptac和P7的RBS序列改为与PtacM相同的AAAGGA序列,构建了重组菌株并命名为tac-R0-V-B和P7-R0-V-B。
2.2 各重组菌株不同发酵时长对蛋白表达的影响
启动子的特性(如启动效率、启动子结构、调控元件的种类和数量等)直接影响基因的转录速率和调控模式[19],从而导致蛋白质的表达水平和持续时长不同。为了研究不同发酵时长对各启动子介导V-B表达量的影响,本研究对部分表达水平较高的重组菌株进行了发酵时长的优化,分别在发酵24、36、48、60、72 h取发酵上清液进行SDS-PAGE分析,如图2-a~图2-e所示,通过蛋白条带分析获得了各启动子的最优发酵时长。在这些启动子中,由IPTG诱导的启动子tac-R0、tacM、P7-R0介导的重组胶原蛋白V-B的表达量在发酵的36~48 h达到最高值,后续随着发酵时间的延长,蛋白表达量略有降低。这可能与诱导信号的持续性以及菌株的生长状态有关。随着发酵时间的延长,细胞内的环境会发生变化,同时诱导剂浓度也可能下降,这些原因都可能导致诱导信号的减弱。此外,在发酵的48 h后,菌体逐渐进入衰亡期,菌体总数下降,导致蛋白的合成速率开始小于降解速率,蛋白表达量降低。而组成型启动子H36和NCgl1676介导的蛋白表达量则随着发酵时间的延长而提高,这可能时由于组成型启动子不受外部信号或调控的影响,一直处于活跃状态并持续地驱动基因的表达。尽管在发酵中后期菌体逐渐衰亡,但启动子的持续作用依旧使得重组胶原蛋白的表达量缓慢提升。

a~e-重组菌株在不同发酵时间下的上清液SDS-PAGE图(分别对应引入启动子tac-R0、tacM、P7-R0、H36、NCg1676); f-不同重组菌株在最优发酵条件下的上清液SDS-PAGE图;g-纯化后SDS-PAGE图;h-纯化后V-B的产量
图2 不同启动子重组菌株发酵时长的优化
Fig.2 Optimization of fermentation duration for strains with different promoters
为了确定谷氨酸棒杆菌重组胶原蛋白表达系统中的最优启动子,本研究在各启动子重组菌株的最优发酵时长下进行SDS-PAGE分析(图2-f)。同时为了准确量化V-B产量,对各重组菌株的发酵上清液进行了纯化(图2-g)并测定V-B产量(图2-h)。结果表明,由tac-R0介导的V-B产量最高,最高可达244 mg/L,其次是tacM启动子,介导V-B产量达143 mg/L。研究结果显示,诱导型启动子相对于组成型启动子在表达水平上具有优势,这与先前的研究结果一致。然而,本研究观察到部分启动子在表达V-B的能力与先前文献报道的启动子强度存在一些差异。有报道将Ptac的-10区进行改造设计而得到的PtacM在表达cat时有更高的产量[10],但在本研究中,当RBS序列相同的情况下,Ptac的摇瓶表达水平却高于PtacM,这与先前的研究结果不同。
综合来看,诱导型启动子和组成型启动子在表达蛋白时各有优劣,前者一旦被激活,能迅速启动基因的转录,启动效率和表达量相对较高,但随着时间的推移,其活性可能降低。而后者作为长时效性启动子,可以支持较长时间的、稳定的基因表达,但是表达量,尤其是时空表达量相对较低。有报道在研究不同类型启动子对gadB2表达的影响时发现,组成型启动子的表达量普遍低于诱导型启动子tacM,但转录水平大多会随着时间的延长而提高,因此在发酵后期的表达量会稳定提升[20]。
2.3 RBS和AS改造突变株的构建和摇瓶发酵
RBS的强弱直接影响核糖体与mRNA结合的效率,从而影响蛋白的翻译水平。在先前的实验中,将tac和P7启动子的RBS序列优化为AAAGGA后,目的蛋白表达量明显提高。因此为了进一步提高谷氨酸棒杆菌中重组胶原蛋白V-B的表达水平,本研究对最优启动子tac-R0和tacM的RBS区域(包括AS)进行改造。利用RBS Library Calculator v2.1[21],结合前期实验和文献综述的结果,设计一个包含AAAGGAN(6-9)的突变文库。随后,从中选择预测翻译速率较高或适中的RBS序列(表3),并确保了序列之间存在明显的差异性。构建不同RBS序列的工程菌,分别命名为tac-Rx-V-B和tacM-Rx-V-B。
对工程菌进行了摇瓶发酵,并绘制生长曲线。如图3-a和图3-b所示,经RBS改造后,菌株的生长曲线没有明显变化。在最优发酵时长48 h下,取样进行SDS-PAGE分析(图3-c、图3-d),结果表明,不同RBS和AS的菌株V-B的产量存在显著差异。tac-Rx-V-B的菌株表达量均有不同程度的提升。而PtacM经过RBS序列改造后,仅tacM-R5-V-B表达量有所提升,其余菌株的表达量都有明显下降。
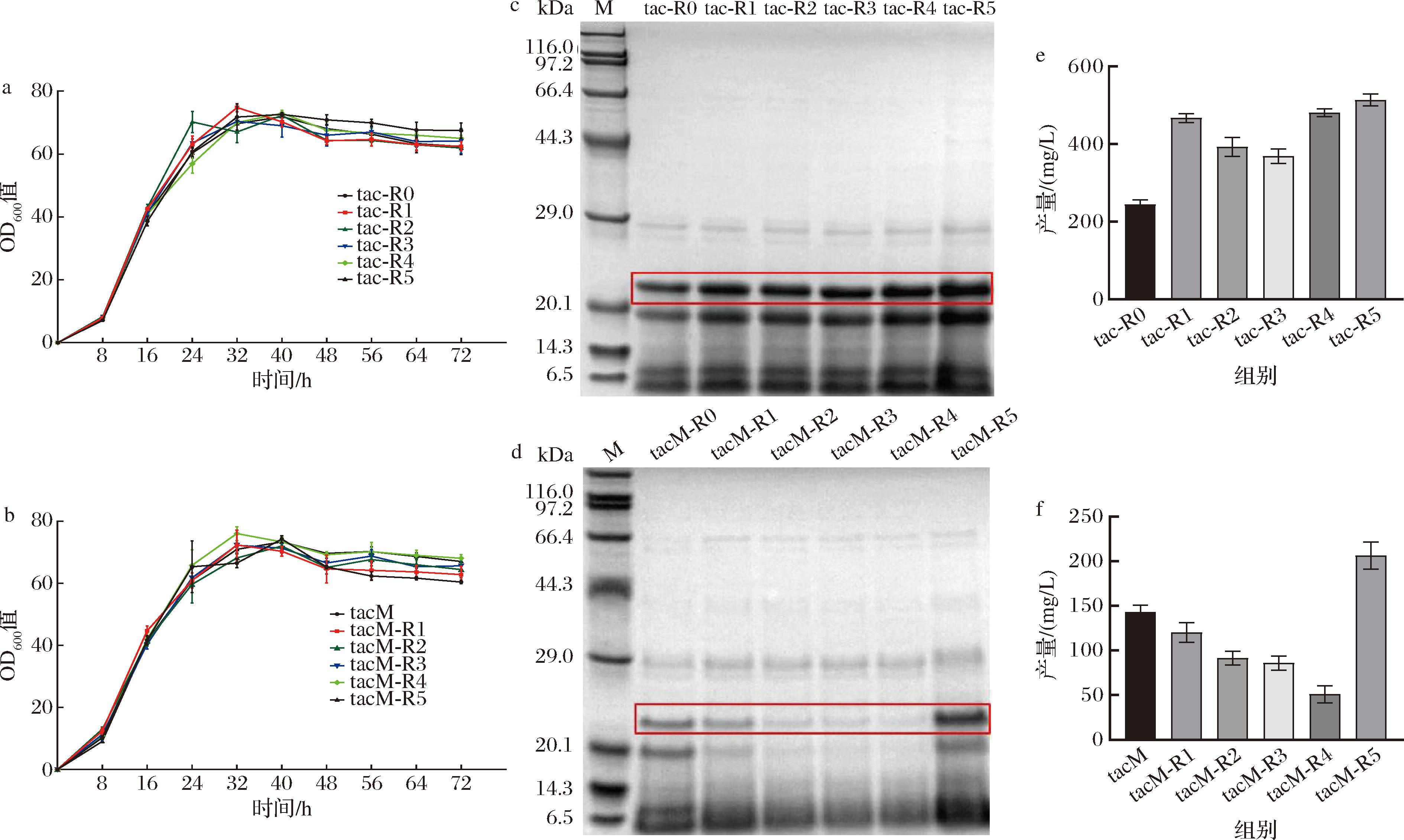
a、b-Ptac-R0和PtacM经RBS改造后重组菌株生长曲线;c、d-Ptac-R0和PtacM经RBS改造后 重组菌株发酵上清液的SDS-PAGE图;e、f-RBS改造后重组菌株纯化后V-B的产量
图3 不同RBS重组菌株的表达
Fig.3 Expression of strains with different RBS
对发酵上清液进行纯化并测定V-B的产量(图3-e、图3-f),结果显示,在构建的不同RBS序列菌株中,启动子tac-R0和RBS序列AAAGGAGATATTTA组合的tac-R5-V-B菌株表达量最高,达到514 mg/L,相较于优化前提高了约6倍。而启动子tacM仅和RBS序列AAAGGAGGAGATATT组合的tacM-R5-V-B菌株表达量有所提高,达到206.3 mg/L。同时,重组菌株的蛋白表达量与RBS Calculator预测的翻译起始速率不完全呈正相关。这与此前文献报道的结果一致,相对较低的翻译起始速率可能更有利于目的基因的表达,而过高的翻译起始速率会导致翻译过程中核糖体之间的碰撞概率提高,降低其与mRNA结合的稳定性,最终导致表达水平的降低[22]。此外,预测算法仅基于特定的假设和模型有关,而假设和模型存在一定的局限性,无法考虑到所有可能影响翻译起始速率的因素[23]。RBS Calculator的翻译起始速率是根据总吉布斯自由能(ΔGtotal)进行量化,其自由能模型考虑到了启动子强度、RBS序列、mRNA的二级结构、起始密码子和tRNA的匹配程度等多种因素。然而,蛋白质的特殊结构、折叠以及修饰等因素都可能导致对翻译速率不准确的预测,尤其是胶原蛋白的三螺旋结构可能涉及复杂的折叠动力学。因此,在优化RBS序列时,综合考虑实际实验结果和预测软件的数据,更加准确地选择和设计RBS序列,是确保目标蛋白高效表达的关键因素。
表3 RBS序列和翻译起始速率
Table 3 RBS sequences and translation initiation rat

名称RBS序列(5′-3′,包含AS)翻译起始速率tac-R0AAAGGAGTCGAC447.97tac-R1AAAGGAGGTTTTTT173 628.44tac-R2AAAGGAGGTATTTGT143 466.07tac-R3AAAGGAGGTATAT128 897.99tac-R4AAAGGAGGTATA61 399.62tac-R5AAAGGAGATATTTA20 436.32tacMAAAGGAGTCGAC4 033.44tacM-R1AAAGGAGGTCTTTT28 243.15tacM-R2AAAGGAGGTCTTA23 614.39tacM-R3AAAGGAGGTTTTA23 073.37tacM-R4AAAGGAGGTCTA10 599.30tacM-R5AAAGGAGGAGATATT10 575.00
2.4 多基因表达盒的串联组合
为了进一步提高蛋白表达量,构建了谷氨酸棒杆菌重组胶原蛋白表达体系的多基因表达盒。在Ptac-R5后面插入了多个相同的目的基因表达单元,该策略可以增加目的基因在宿主细胞中的拷贝数。同时,通过前顺反子的表达,促进核糖体在后顺反子的聚集,最终提高目标产物的表达量。因此,设计了两种不同的重组菌株,分别串联了2个和4个目的基因,并命名为tac-2B和tac-4B。其中tac-2B和tac-4B每个目的基因单元前的RBS(包括AS)均为本研究前期筛选的最优RBS序列AAAGGAGATATTTA。在最优发酵时长下进行SDS-PAGE分析,如图4所示,串联表达后,重组胶原蛋白V-B的表达量有所提升,纯化后重组菌株tac-2B和tac-4B的平均蛋白产量达到620、697 mg/L,相较于串联之前分别提高了106、193 mg/L。然而,随着串联基因的增加,蛋白产量总体的提升幅度有限,并没有呈倍数增长。可能是由于一个启动子同时带动后面多个基因同时表达时,基因的位置越靠后,表达量逐渐减弱。有研究报道,通过4个基因的串联表达生产Hyp,发现远离启动子的基因蛋白表达弱于靠近启动子的基因[24]。并且随着基因数量的增加,可能会遇到调控和代谢负担的问题,从而影响整体代谢平衡,也可能导致蛋白质在细胞内的不正确折叠或修饰。
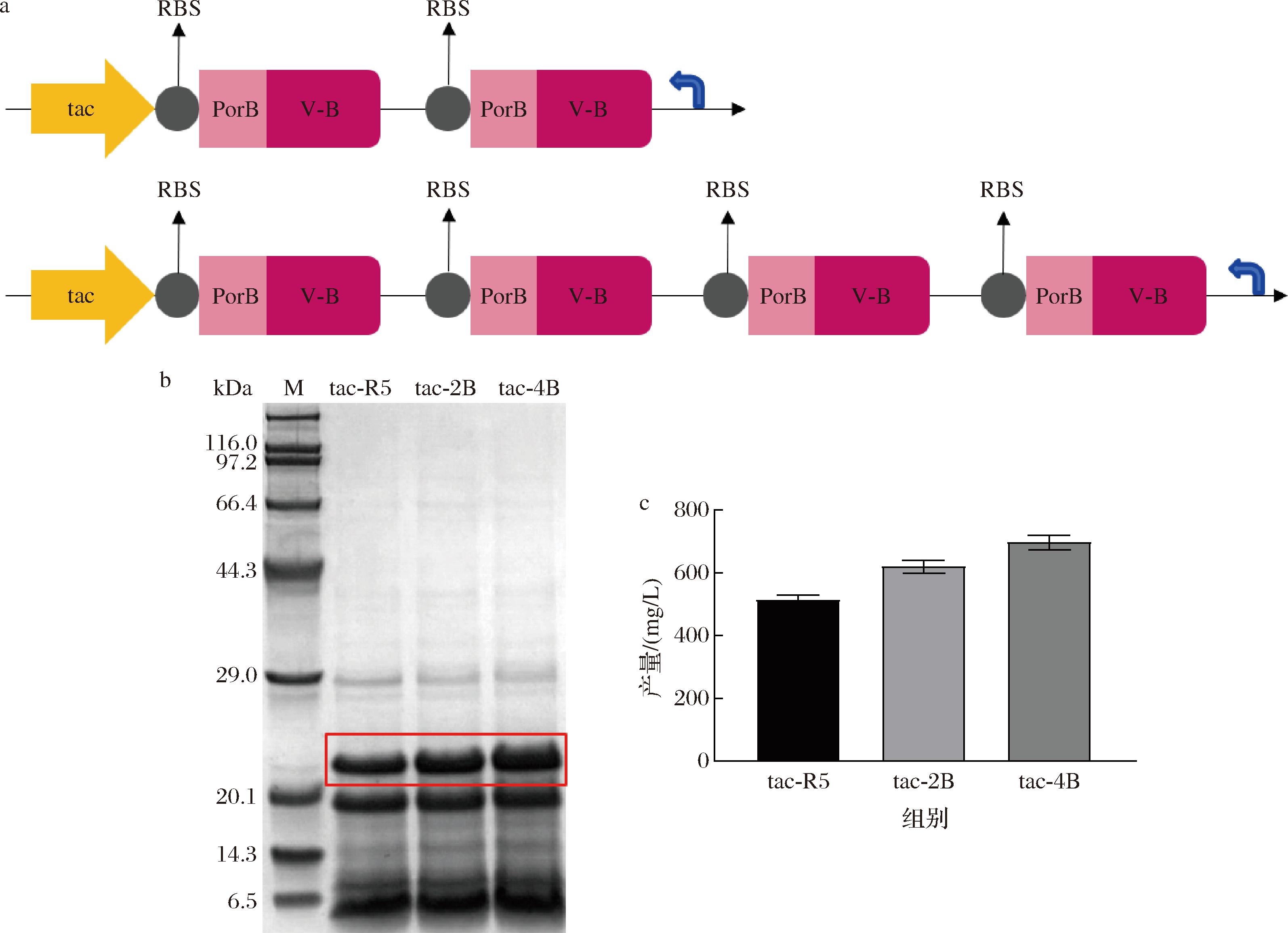
a-多基因表达盒策略图;b-多基因串联重组菌株发酵上清液的SDS-PAGE图;c-基因串联重组菌株纯化后V-B的产量
图4 多基因串联重组菌株的表达
Fig.4 Expression of multigene tandem strains
2.5 重组胶原蛋白V-B的表征
为了验证表达元件的优化是否影响了重组胶原蛋白的正确折叠和表达,本研究利用胰蛋白酶对纯化后的V-B进行了酶切消化,并通过SDS-PAGE验证其纯度。酶切前V-B的理论分子质量为17.8 kDa,其中携带6×His标签的球状结构域V的理论分子质量9.89 kDa。由图5-a可以看出,酶切后有一条分子质量约为12 kDa的单一条带,是胶原域B理论分子质量的1.5倍,可能原因是胶原蛋白分子中大量的脯氨酸导致其在基质辅助激光解析电离-飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry ,MALDI-TOF)上的迁移速率变缓。通过MALDI-TOF对其分子量进行鉴定,质谱结果如图5-b所示,切除折叠域V-domain后的胶原域B实际分子质量为7 949.87 g/mol,其理论分子质量为7 949.52 g/mol,确定酶切后的蛋白为目的蛋白。利用圆二色光谱仪验证胶原域B的二级结构,结果如图5-c所示,胶原域B表现为典型的3股螺旋结构,在220 nm处出现特征性正吸收峰,表明胶原域B正确折叠形成了3股螺旋结构。之后扫描胶原蛋白溶液在220 nm下从4~80 ℃的热变曲线,如图5-d所示,拟合后得到胶原蛋白Tm值为26.35 ℃,与文献报道相近[25]。证明表达元件的优化没有影响重组胶原蛋白的正确折叠。
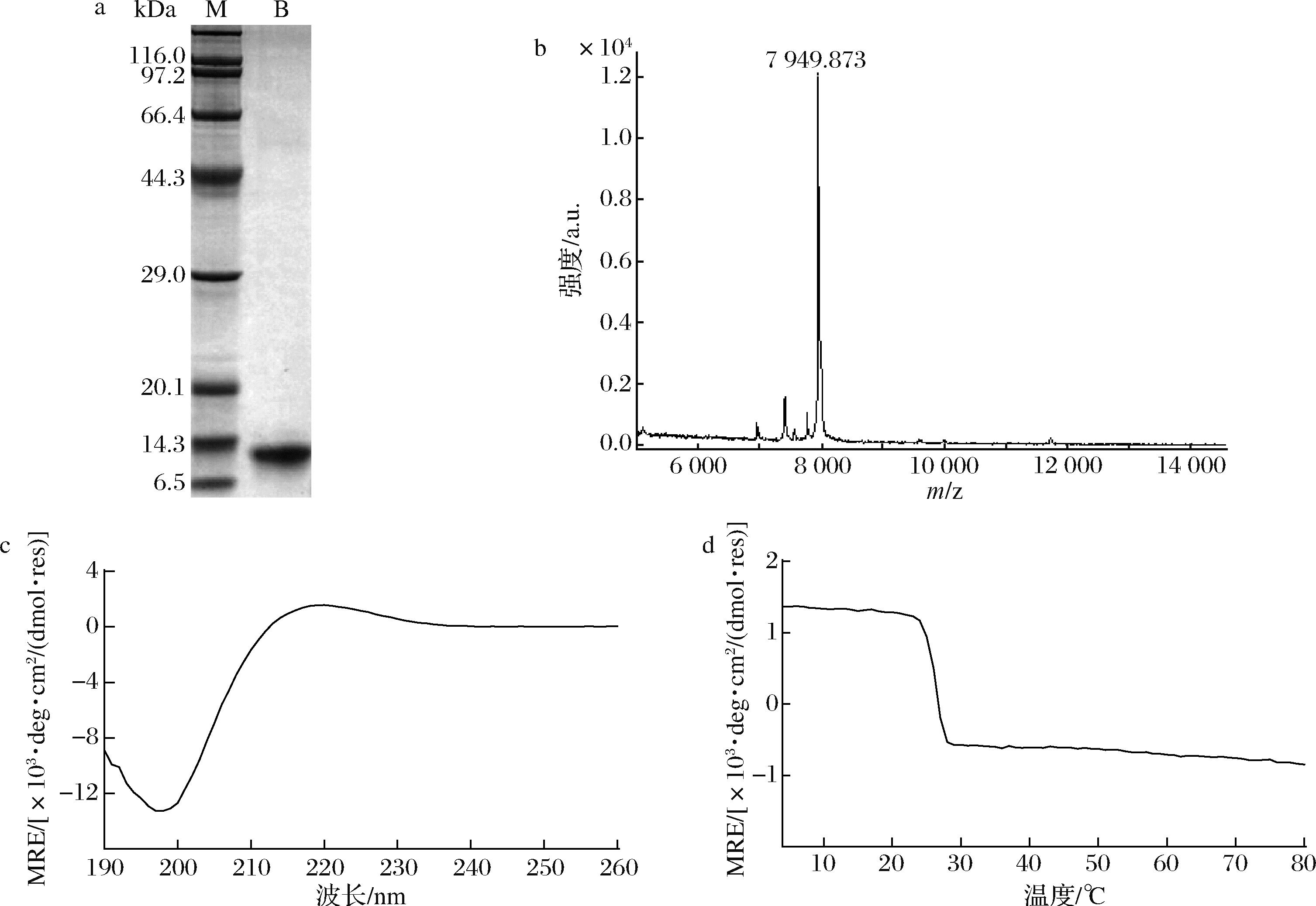
a-V-B酶切后SDS-PAGE图;b-酶切后V-B的质谱鉴定;c-在4 ℃下的CD光谱;d-在220 nm处测定的热熔曲线
图5 V-B酶切后表征
Fig.5 Characterization after V-B digestion
注:MRE为摩尔残留椭圆度(molar residue ellipticity)。
3 结论与讨论
本研究旨在通过表达元件的优化促进重组胶原蛋白在谷氨酸棒杆菌中的表达。通过不同类型启动子的筛选和发酵时长的优化,结果显示外源诱导型启动子tac-R0介导胶原蛋白的产量最高,其次是外源诱导型启动子tacM和内源启动子NCgl1676。随后,利用RBS Library Calculator对核糖体结合位点和间隔序列的翻译起始效率进行预测,通过筛选获得工程菌tac-R5-V-B,表达量提高到514 mg/L。此外,通过多基因表达盒的串联组合,最终4个目的基因串联后表达量提升至697 mg/L。本研究通过对表达元件的优化,使得重组胶原蛋白在谷氨酸棒杆菌中的表达水平提高了8.4倍,并且通过圆二色谱验证了重组胶原蛋白的三螺旋结构,为谷氨酸棒杆菌的改造提供一定的参考,同时也胶原蛋白的重组表达提供了基础。
表达元件的优化是提高外源蛋白表达量的常用策略,本研究选取了8个不同类型的启动子用于胶原蛋白的表达,研究结果表明,通过合成启动子文库筛选出的强组成型启动子H36和H10,以及谷氨酸棒杆菌内源启动子NCgl1676和NCgl0226介导胶原蛋白的表达水平均不如预期,而外源诱导型启动子则表现出较高的表达水平且时空产率更高。在核糖体结合位点和间隔序列改造方面,虽然通过筛选提高了蛋白的表达量,但是预测的翻译起始速率与蛋白表达水平没有正相关关系,且对于不同启动子的影响差异也较大,后续可以计算预测作为辅助,对RBS核心区域进行改造和筛选,以期寻找更优的组合。此外,在胞外上清有一个分子质量低于目的条带的杂蛋白,经蛋白质鉴定,为目的蛋白的降解条带,后续通过宿主改造等方法有望消除蛋白质降解,进一步提高产量。
[1] KADLER K E, BALDOCK C, BELLA J, et al.Collagens at a glance[J].Journal of Cell Science, 2007, 120(Pt12):1955-1958.
[2] SHOULDERS M D, RAINES R T.Collagen structure and stability[J].Annual Review of Biochemistry, 2009, 78:929-958.
[3] BRODSKY B, RAMSHAW J A M.The collagen triple-helix structure[J].Matrix Biology, 1997, 15(8-9):545-554.
[4] YU Z X, BRODSKY B, INOUYE M.Dissecting a bacterial collagen domain from Streptococcus pyogenes sequence and length dependent variations in triple helix stability and folding[J].The Journal of Biological Chemistry, 2011, 286(21):18960-18968.
[5] PENG Y Y, HOWELL L, STOICHEVSKA V, et al.Towards scalable production of a collagen-like protein from Streptococcus pyogenes for biomedical applications[J].Microbial Cell Factories, 2012, 11:146.
[6] ZHANG C, FAN D D, SHANG L A, et al.Optimization of fermentation process for human-like collagen production of recombinant Escherichia coli using response surface methodology[J].Chinese Journal of Chemical Engineering, 2010, 18(1):137-142.
[7] 李伟娜, 尚子方, 段志广, 等.毕赤酵母高密度发酵产Ⅲ型类人胶原蛋白及其胃粘膜修复功能[J].生物工程学报, 2017, 33(4):672-682.
LI W N, SHANG Z F, DUAN Z G, et al.Production of gastric-mucosa protective collagen Ⅲ by Pichia pastoris[J].Chinese Journal of Biotechnology, 2017, 33(4):672-682.
[8] 侯增淼, 李晓颖, 李敏, 等.重组人源性胶原蛋白的制备及表征[J].生物工程学报, 2019, 35(2):319-326.
HOU Z M, LI X Y, LI M, et al.Preparation and characterization of recombinant human-source collagen[J].Chinese Journal of Biotechnology, 2019, 35(2):319-326.
[9] 刘洋, 牟庆璇, 石雅南, 等.微生物细胞工厂的代谢调控[J].生物工程学报, 2021, 37(5):1541-1563.
LIU Y, MU Q X, SHI Y N, et al.Metabolic regulation in constructing microbial cell factories[J].Chinese Journal of Biotechnology, 2021, 37(5):1541-1563.
[10] XU D Q, TAN Y Z, SHI F, et al.An improved shuttle vector constructed for metabolic engineering research in Corynebacterium glutamicum[J].Plasmid, 2010, 64(2):85-91.
[11] LI N, ZENG W Z, XU S, et al.Obtaining a series of native gradient promoter-5′-UTR sequences in Corynebacterium glutamicum ATCC 13032[J].Microbial Cell Factories, 2020, 19(1):120.
[12] ZHANG S H, LIU D Y, MAO Z T, et al.Model-based reconstruction of synthetic promoter library in Corynebacterium glutamicum[J].Biotechnology Letters, 2018, 40(5):819-827.
[13] ZHANG W, ZHAO Z H, YANG Y K, et al.Construction of an expression vector that uses the aph promoter for protein expression in Corynebacterium glutamicum[J].Plasmid, 2017, 94:1-6.
[14] SHI F, LUAN M Y, LI Y F.Ribosomal binding site sequences and promoters for expressing glutamate decarboxylase and producing γ-aminobutyrate in Corynebacterium glutamicum[J].AMB Express, 2018, 8(1):61.
[15] ZHANG B, ZHOU N, LIU Y M, et al.Ribosome binding site libraries and pathway modules for shikimic acid synthesis with Corynebacterium glutamicum[J].Microbial Cell Factories, 2015, 14:71.
[16] 齐静静, 范炳森, 张萌, 等.信号肽及发酵条件优化促进胶原蛋白在谷氨酸棒杆菌中分泌表达[J].食品与发酵工业, 2022, 48(15):9-17.
QI J J, FAN B S, ZHANG M, et al.Optimization of signal peptide and fermentation conditions to promote collagen secretion in Corynebacterium glutamicum[J].Food and Fermentation Industries, 2022, 48(15):9-17.
[17] 胡立涛. 代谢工程改造谷氨酸棒杆菌合成透明质酸[D].无锡:江南大学,2020.
HU L T.Metabolic engineering of Corynebacterium glutamicum for production of hyaluronic acid [D].Wuxi:Jiangnan University, 2020.
[18] KUDLA G, MURRAY A W, TOLLERVEY D, et al.Coding-sequence determinants of gene expression in Escherichia coli[J].Science, 2009, 324(5924):255-258.
[19] AYOUBI T A, VAN DE VEN W J.Regulation of gene expression by alternative promoters[J].FASEB Journal, 1996, 10(4):453-460.
[20] 栾明月. 利用RBS序列和启动子策略高效表达谷氨酸脱羧酶[D].无锡:江南大学,2018.
LUAN M Y.Efficient expression of glutamic acid decarboxylase using RBS sequence and promoter strategy[D].Wuxi:Jiangnan University, 2018.
[21] CETNAR D P, SALIS H M.Systematic Quantification of Sequence and Structural Determinants Controlling mRNA stability in Bacterial Operons[J].ACS Synthetic Biology, 2021, 10(2):318-332.
[22] 韩徐悦. Bacillus subtilis漆酶的高效表达与热稳定性改造[D].无锡:江南大学,2022.
HAN X Y.Efficient expression and stabilization of Bacillus subtilis laccase [D].Wuxi:Jiangnan University, 2022.
[23] REEVE B, HARGEST T, GILBERT C, et al.Predicting translation initiation rates for designing synthetic biology[J].Frontiers in Bioengineering and Biotechnology, 2014, 2:1.
[24] 盛花开, 衣玉兰, 李志敏, 等.重组大肠杆菌多基因串联表达合成反式-4-羟基-L-脯氨酸[J].生物技术, 2016, 26(1):81-86.
SHENG H K, YI Y L, LI Z M, et al.Co-expression of multiple genes for the synthesis of trans-4-hydroxy- L- proline in Escherichia coli[J].Biotechnology, 2016, 26(1):81-86.
[25] 侯亚茹, 张萌, 许菲.引入非天然氨基酸胶原蛋白表达及交联成键的优化[J].生物工程学报, 2021, 37(9):3231-3241.
HOU Y R, ZHANG M, XU F.Optimization of unnatural amino acid incorporation in collagen and the cross-linking through thioether bond[J].Chinese Journal of Biotechnology, 2021, 37(9):3231-3241.