木聚糖酶(β-1,4-xylanase,EC 3.2.1.8)是能够以内切方式将木聚糖降解成低聚木糖及少量木糖的酶,其在低聚木糖生产、果汁澄清、延缓面包衰老等食品领域都有广泛的应用前景[1-2]。烘焙面粉中有1.5%~2.5%为非淀粉多糖,其最重要的成分是阿拉伯木聚糖[3]。阿拉伯木聚糖中有70%~75%的水不溶性阿拉伯木聚糖[4],其在面包的制作过程中会出现面包的延展性和弹性以及口感变差等不良影响[5]。木聚糖酶能够催化水解阿拉伯木聚糖的 (1→4)-β-D-糖苷键,使其变成低分子水溶性的阿拉伯木聚糖,从而有效改善面团芯的结构[6-9]。
来自厌氧嗜热微生物Caldicellulosiruptor owensensis的木聚糖酶表现出优异的热稳定性[10],但在大肠杆菌在中表达量不高。本研究拟通过融合Sumo标签提高该木聚糖酶在大肠杆菌中的表达量,并对融合木聚糖酶SumoXyn的酶学性质进行初步研究,同时将该酶用于面包烘焙,探究其对全麦面包特性的影响,旨在为面包烘焙提供一种良好的候选酶,丰富我国面粉改良酶制剂资源。
1 材料与方法
1.1 材料与试剂
根据NCBI数据库Caldicellulosiruptor owensensis木聚糖酶的氨基酸序列(WP_013411146.1),按照大肠杆菌密码子偏爱性优化合成,并构建了重组质粒pET28a-sumo-xyn、转化至表达菌株E.coli BL21 (DE3)中,由本实验室保存。
新良全麦面包粉,新良粮油加工有限责任公司;安琪高活性酵母,湖北安琪酵母股份有限公司;Bradford蛋白定量检测试剂盒,上海生工生物有限公司;BeyoGoldTM His-tag 纯化试剂盒,碧云天生物公司;榉木木聚糖、福林酚,上海源叶生物科技有限公司;其他化学试剂无特殊说明均为国产分析纯。
1.2 仪器与设备
PerkinElmer EnSight多功能酶标仪,美国PerkinElmer;湘仪GL-21M高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;SCIENTZ-207A超高压均质机,宁波新芝生物科技股份有限公司;GenoSens 1860 凝胶成像分析系统,上海勤翔科学仪器有限公司;NanoDSF 蛋白质稳定性分析系统,德国Nano Temper;SMS质构仪,厦门超技仪器设备有限公司;东陵家用面包机DL-TM018,广东东菱电器有限公司。
1.3 实验方法
1.3.1 融合木聚糖酶SumoXyn的表达、纯化及浓度测定
从甘油管中划线培养含重组质粒pET28a-sumo-xyn的E.coli BL21 (DE3),挑选单菌落接种至5 mL含50 μg/mL 卡那霉素的LB液体培养基中,置于转速为200 r/min的37 ℃振荡培养箱中培养过夜。然后转接至500 mL卡那霉素抗性LB液体培养基中,置于37 ℃ 振荡培养至OD600值为0.6~0.8,加入IPTG至终浓度为0.1 mmol/L,22 ℃ 诱导培养12 h后,8 000 r/min 离心10 min收集菌体,然后加入200 mL PBS缓冲液(pH 7.4)洗涤菌体后,再次加入50 mL PBS缓冲液(pH 7.4)悬浮菌体制备菌悬液。倒入超高压均质机中,在压力为100 MPa、温度为4 ℃时破胞,直至菌液澄清。破胞液转入离心管中,配平后置于高速冷冻离心机12 000 r/min离心30 min,上清液即为粗酶液。留取少量样品进行SDS-PAGE分析,另一部分置于75 ℃水浴锅中加热30 min,加热结束后再置于高速离心机中12 000 r/min离心30 min,所得上清液即为后续实验所用酶液。取样进行SDS-PAGE分析,并根据Bradford蛋白定量检测试剂盒说明书测定蛋白浓度。
1.3.2 SumoXyn的Tm值分析
热变性中点温度(mecting temperature,Tm)值是蛋白质溶液在加热过程中变性一半时所对应的温度,可以表征蛋白质的热稳定性。微量差示扫描荧光(nano differential scanning fluorimeter,Nano DSF)是一种可在天然状态下检测蛋白质热变性和化学变性的技术。它是通过检测蛋白质芳香族氨基酸残基在蛋白升温过程中的固有荧光微小变化来研究蛋白质的稳定性,不受任何缓冲液限制,且可检测浓度范围非常广(5~250 mg/mL)[11]。取加热后的SumoXyn进行热变性实验,并通过微量差示扫描荧光(Nano DSF)分析,设置实验参数为:温度提升范围为30~110 ℃,温度提升速率为2.5 ℃/min。
1.3.3 SumoXyn的酶学性质研究
采用3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)比色法测定还原糖含量。取10 μL酶液至1.5 mL离心管中,再加入90 μL最适pH缓冲液配制的10 mg/mL木聚糖底物,置于最适温度下反应10 min,然后加入100 μL DNS终止反应,沸水浴5 min后加蒸馏水至1 mL,12 000 r/min离心3 min除去不溶的底物,再取200 μL上清液至96孔板中,酶标仪测定A540读数,以木糖为标准,计算还原糖含量。1个木聚糖酶活力单位定义为:在上述实验条件下,每分钟产生1 μmol还原糖所需要的酶量定义为1个酶活力单位[12]。
研究SumoXyn的酶学性质,包括最适反应pH、pH稳定性、最适反应温度、热稳定性、动力学参数测定以及金属离子的影响分析,具体方法参考文献[13]。
1.3.3.1 最适反应pH和pH稳定性
以0.2 mol/L Na2HPO4-0.1 mol/L柠檬酸缓冲液配制pH 2.0~8.0的底物、50 mmol/L Gly-NaOH缓冲液配制pH 8.5~10.5的底物,按照木聚糖酶活性测定方法测定粗酶在不同pH缓冲液中的酶活性,最高酶活性对应的pH值即为最适反应pH。为测定SumoXyn的pH稳定性,将SumoXyn与不同pH值缓冲液混合后于4 ℃放置24 h,然后再以最适pH缓冲液配制的底物测定残余活性。
1.3.3.2 最适反应温度和热稳定性
以最适反应pH缓冲液配制浓度底物,按照酶活性测定方法将酶与底物混合后分别测定SumoXyn在30~100 ℃下的酶活性,最高酶活性对应的温度即为最适反应温度。将SumoXyn置于70~100 ℃各处理30 min后,再按照酶活性测定方法,加入底物在最适温度下测定残余酶活性。
1.3.3.3 动力学分析
一定浓度的木聚糖酶10 μL与90 μL最适pH 缓冲液配制不同浓度的木聚糖底物(0.5~15 mg/mL),在最适温度下反应5 min后测定酶活性。应用 GraphPad Prism 9.5 软件,根据 Michaelis-Menten 方程通过非线性回归拟合计算Km和Vmax,催化常数Kcat按照公式(1)计算获得。
(1)
式中:[E]为酶浓度。
1.3.3.4 金属离子和部分化合物影响
根据酶活性测定标准方法,测定终浓度为5 mmol/L金属离子、EDTA和SDS对木聚糖酶的影响。反应体系中不添加金属离子和其他化合物的样品作为对照,以对照酶活性为100%,测定相对酶活性。
1.3.4 SumoXyn对面包品质的影响
1.3.4.1 全麦面团制作
酵母3 g,白砂糖10 g,水100 g,将三者混合,置于30 ℃水浴锅中活化10 min,将活化后的酵母倒入200 g面粉中,加入18 g黄油,与纯化后的木聚糖酶SumoXyn混合(3、6、9 mg),以不加酶的为对照组,并编号,揉面30 min。
1.3.4.2 面包比容
参考GB/T 20981—2007《面包》测定面包比容。面包工艺完成后,将面包冷却2 h,记录面包质量m及体积V。将待测面包样品放入一定容积的容器中,接着加入小颗粒的小米,通过直尺量取容器高度、宽度和长度,然后取出面包。将小米倒入量筒中进行体积测量,通过容器体积减去填充剂体积,就能得到面包的体积。
1.3.4.3 面包质构特性
参考吉梦莹[14]的方法,对全麦面包的质构特性进行测试。首先将面包切成2 cm厚的面包片,然后使用TA-XT质构仪的P/36探头进行测试。测试时,前置速度、测试速度和后置速度分别设置为1、1、5 mm/s,面包压缩比设置为50 %,2次下压间隔时间设置为10 s。
2 结果与分析
2.1 SDS-PAGE分析木聚糖酶的表达和纯度
SDS-PAGE分析Caldicellulosiruptor owensensis木聚糖酶在大肠杆菌中的可溶性表达情况,结果见图1-A(泳道1)所示,IPTG诱导后的破胞上清液样品在 55 kDa附近有明显的条带,与带Sumo标签的融合木聚糖酶SumoXyn理论大小(约为55 kDa)相符,且该条带在细胞破碎上清液中占比较高,说明Caldicellulosiruptor owensensis木聚糖酶融合Sumo标签后在大肠杆菌中可溶性表达良好,且表达量较高。与融合His标签的Caldicellulosiruptor owensensis木聚糖酶CoxynA在大肠杆菌中的表达情况相比[10],SumoXyn可溶性表达更好,说明Sumo标签有助于提高外源蛋白在大肠杆菌中的表达量。将破胞上清液75 ℃水浴锅中加热30 min后取样进行电泳分析,发现加热后的样品条带较单一,说明加热能除去绝大部分杂蛋白(图1-A,泳道2)。利用Bradford蛋白定量检测试剂盒测定加热后的蛋白浓度,计算纯化后的融合木聚糖酶SumoXyn为0.94 mg/mL。以甘蔗渣木聚糖酶为底物测定破胞液加热前后的酶活性,与加热前的粗酶液相比,加热后的酶液活性比加热前高出约25%(图1-B),说明75 ℃水浴加热30 min能激活融合木聚糖酶SumoXyn活性。
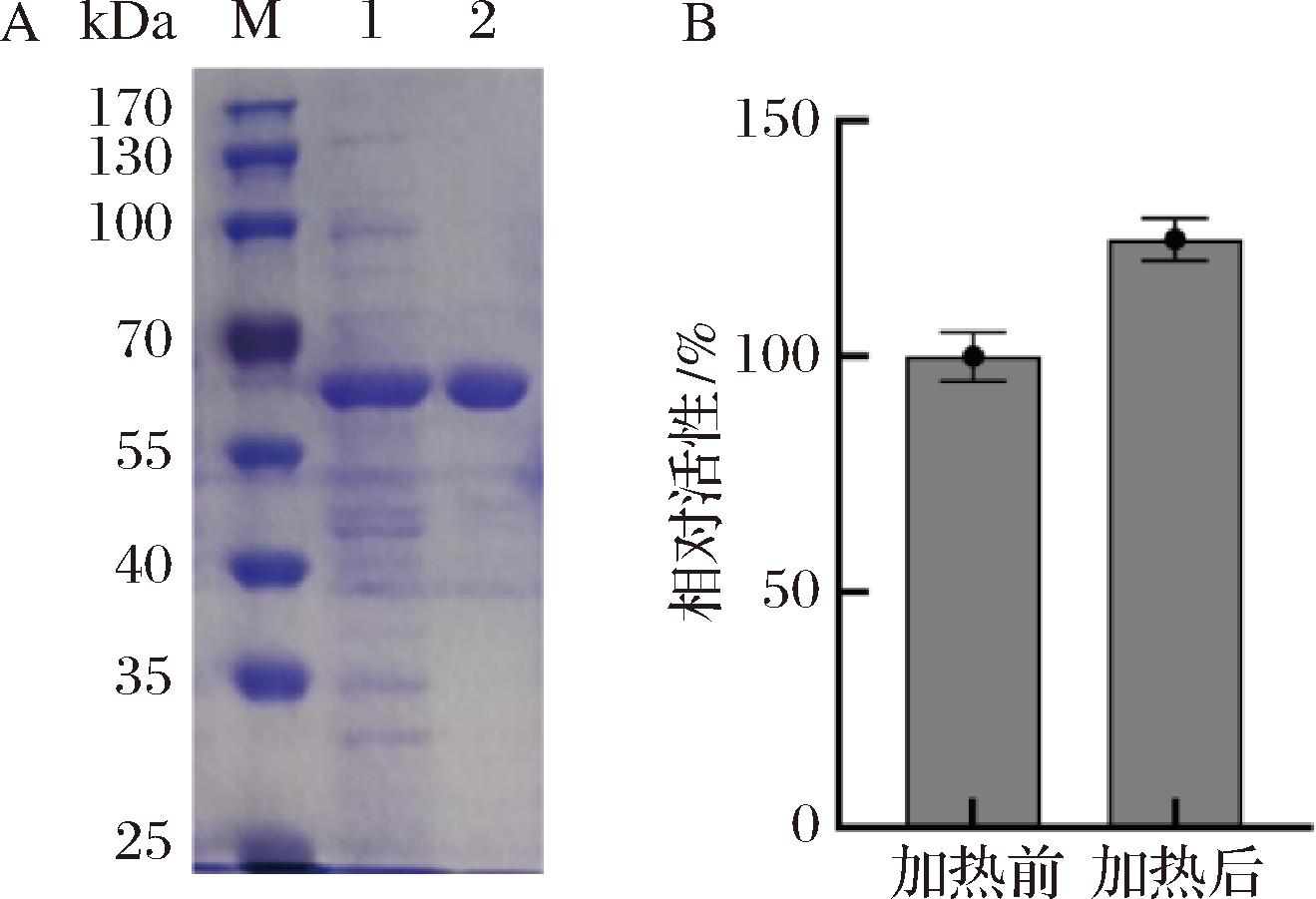
A-破胞液加热前后SDS-PAGE分析(M-蛋白质marker; 1-IPTG诱导的含重组质粒的DE3破胞上清液; 2-纯化后的蛋白样品);B-破胞液加热前后活性分析
图1 破胞液加热前后SDS-PAGE分析及活性分析
Fig.1 SDS-PAGE analysis and activity analysis of cell lysate before and after heated
2.2 Nano DSF测定Tm
采用Nano DSF技术研究纯化后的SumoXyn的形成聚集的起始温度和熔化温度(Tm),结果如图2所示,在pH7.4的磷酸盐缓冲液中测定SumoXyn的形成聚集的起始温度为78.2 ℃,Tm值为83.5 ℃。Nano DSF技术是利用芳香氨基酸残基(主要是色氨酸)的固有荧光强度比(350 nm∶330 nm)的变化来跟踪蛋白质的折叠状态,从而测定蛋白质温度的参数Tm值[15]。Nano DFS扫描后观察到的单一拐点和Tm值进一步验证了SumoXyn蛋白样品的纯度,因为混合样品会产生线性F350/330信号和多个Tm值。
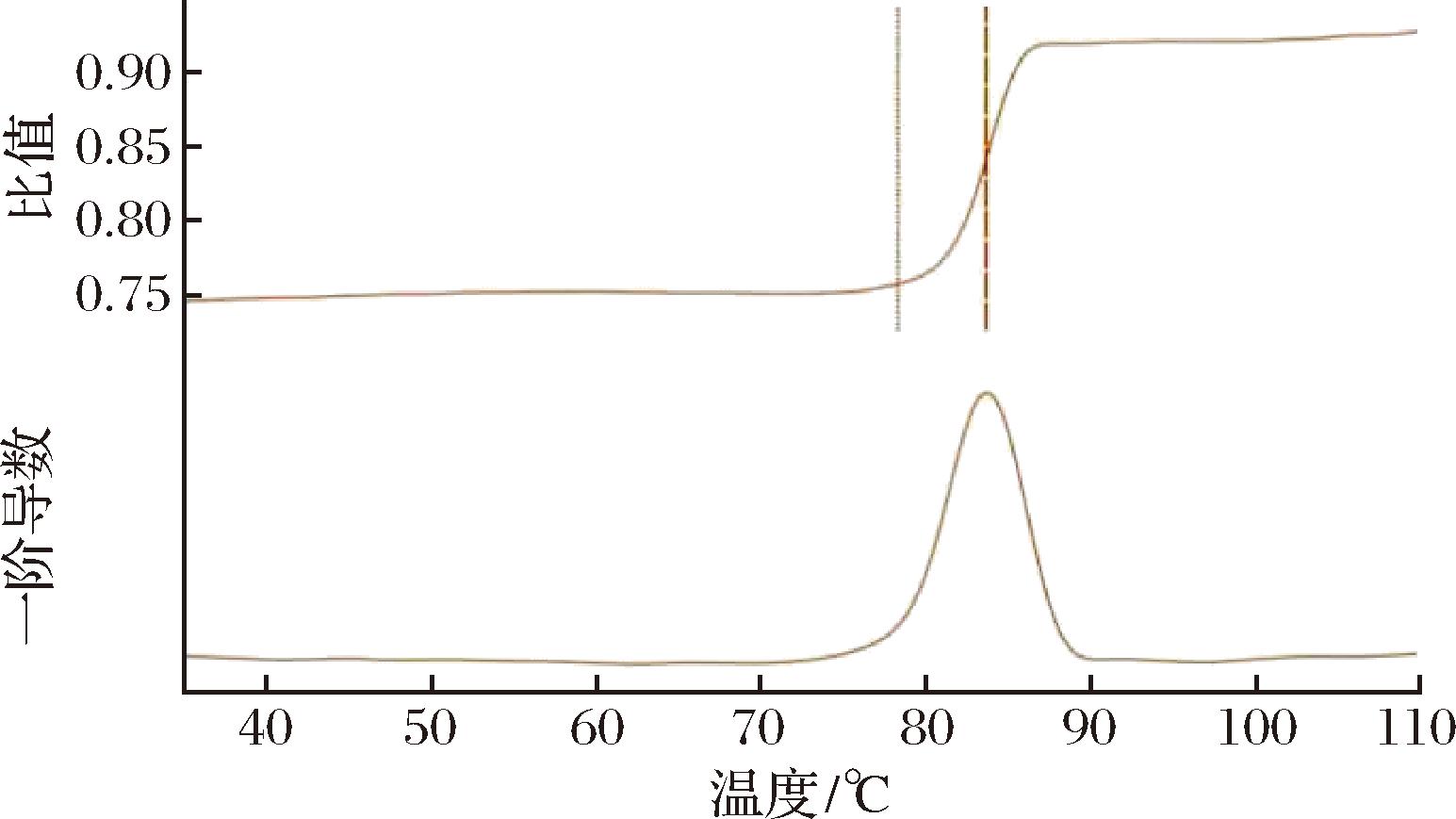
图2 Nano DSF分析SumoXyn的Tm值
Fig.2 Tm of SumoXyn analyzed by Nano DSF
2.3 融合木聚糖酶SumoXyn酶学性质
2.3.1 最适反应pH和pH稳定性
测定融合木聚糖酶SumoXyn在不同pH缓冲液中的酶活,结果如图3-A所示,SumoXyn在Gly-NaOH缓冲液中pH 9.0时活性最高,但在pH 5.5~10有超过60%以上的活性。将SumoXyn与pH 3~10.5的缓冲液混合置于4 ℃放置24 h,按照标准方法测定处理后的酶活,由图3-B可知,当pH≤3或>10.5时的缓冲液处理木聚糖酶时,SumoXyn活性几乎丧失;但pH 4.0~10的缓冲液处理过夜后SumoXyn的残余酶活性仍在80%以上,说明SumoXyn在pH 4.0~10有较好的稳定性。CoxynA的最适pH值为7,在pH≤5或pH≥10时几乎没有活性,在不同缓冲液中处理后,在pH 5~10的缓冲液中残余活性>70%[10]。与CoxynA相比,SumoXyn最适反应pH发生改变,且在pH 4~5和pH 10的缓冲液中更稳定,推测是融合的Sumo标签有助于提高木聚糖酶在偏酸和偏碱性缓冲液的稳定性。
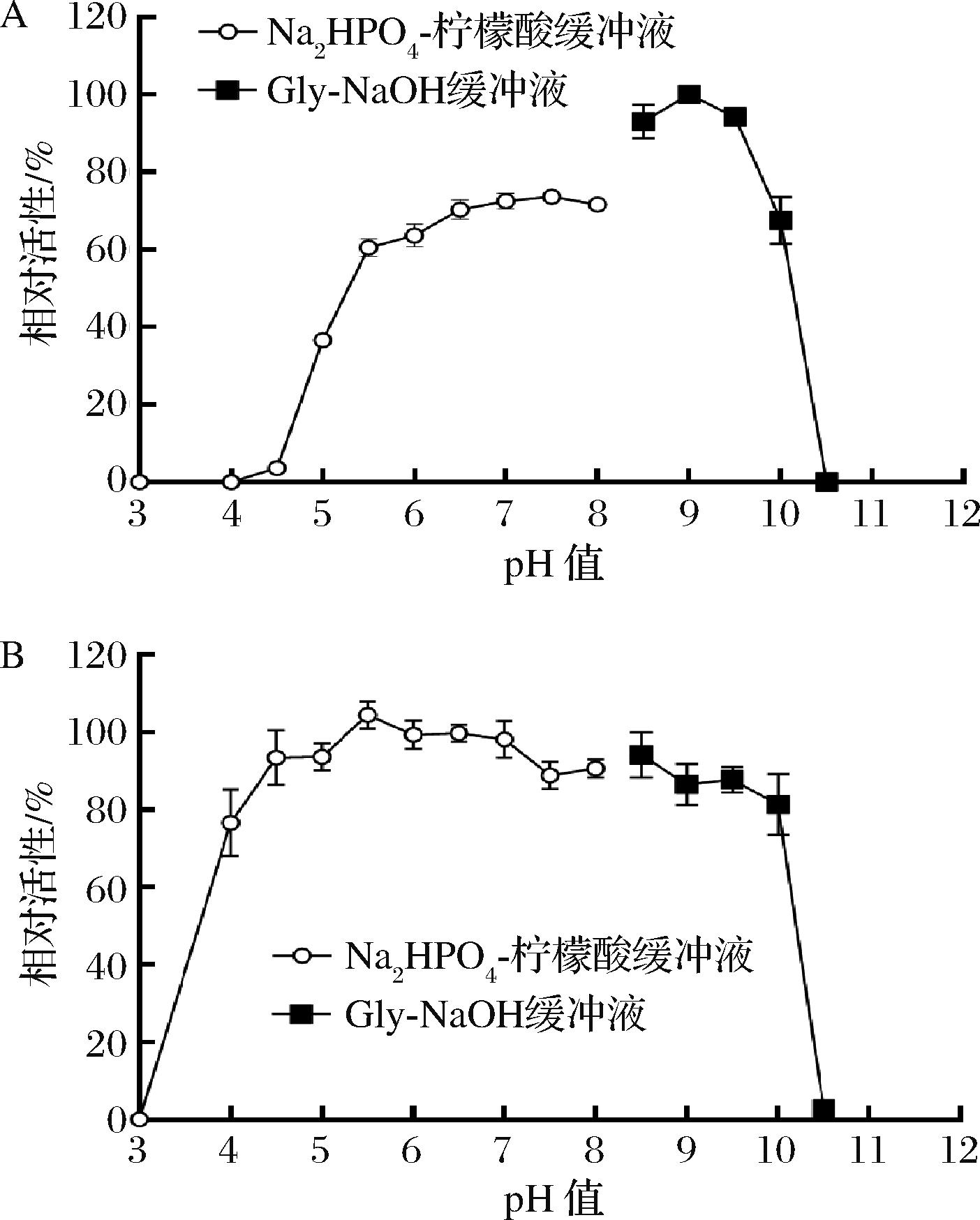
图3 SumoXyn的最适反应pH及pH稳定性
Fig.3 Optimum pH and pH stability of SumoXyn
2.3.2 最适反应温度及热稳定性
在最适pH缓冲液中测定SumoXyn在不同温度下的活性,发现该酶在80 ℃时酶活性最高,在60~95 ℃时仍有超过60%以上的酶活性,甚至在100 ℃仍有50%的酶活性(图4-A)。目前一般把最适反应温度在70 ℃以上的木聚糖酶,称为嗜热木聚糖酶[16],SumoXyn的最适反应温度为80 ℃,说明该酶为嗜热木聚糖酶。经75 ℃加热30 min后的SumoXyn再置于70~100 ℃分别放置0.5 h,测定不同温度处理后的残余活性,发现70~75 ℃处理0.5 h后仍有75%的残余活性,但超过80 ℃处理0.5 h后,SumoXyn的活性几乎丧失。与已报到的大部分木聚糖酶相比,SumoXyn具有较好的热稳定性。目前已有多种微生物被报道产嗜热木聚糖酶,如Thermotoga、Geobacillus和Caldicellulosiruptor属微生物是嗜热木聚糖酶的重要来源,Thermotoga thermarum DSM 5069、Geobacillus thermoleovorans和C.lactoaceticus第10家族木聚糖酶最适反应温度均为80 ℃;来自Caldicellulosiruptor bescii的第10家族木聚糖酶最适反应温度是70 ℃。LIU等[10]研究C.owensensis的(CoXynA)的最适温度是90 ℃,且在80 ℃保温1 h后仍有50%的残余活性。
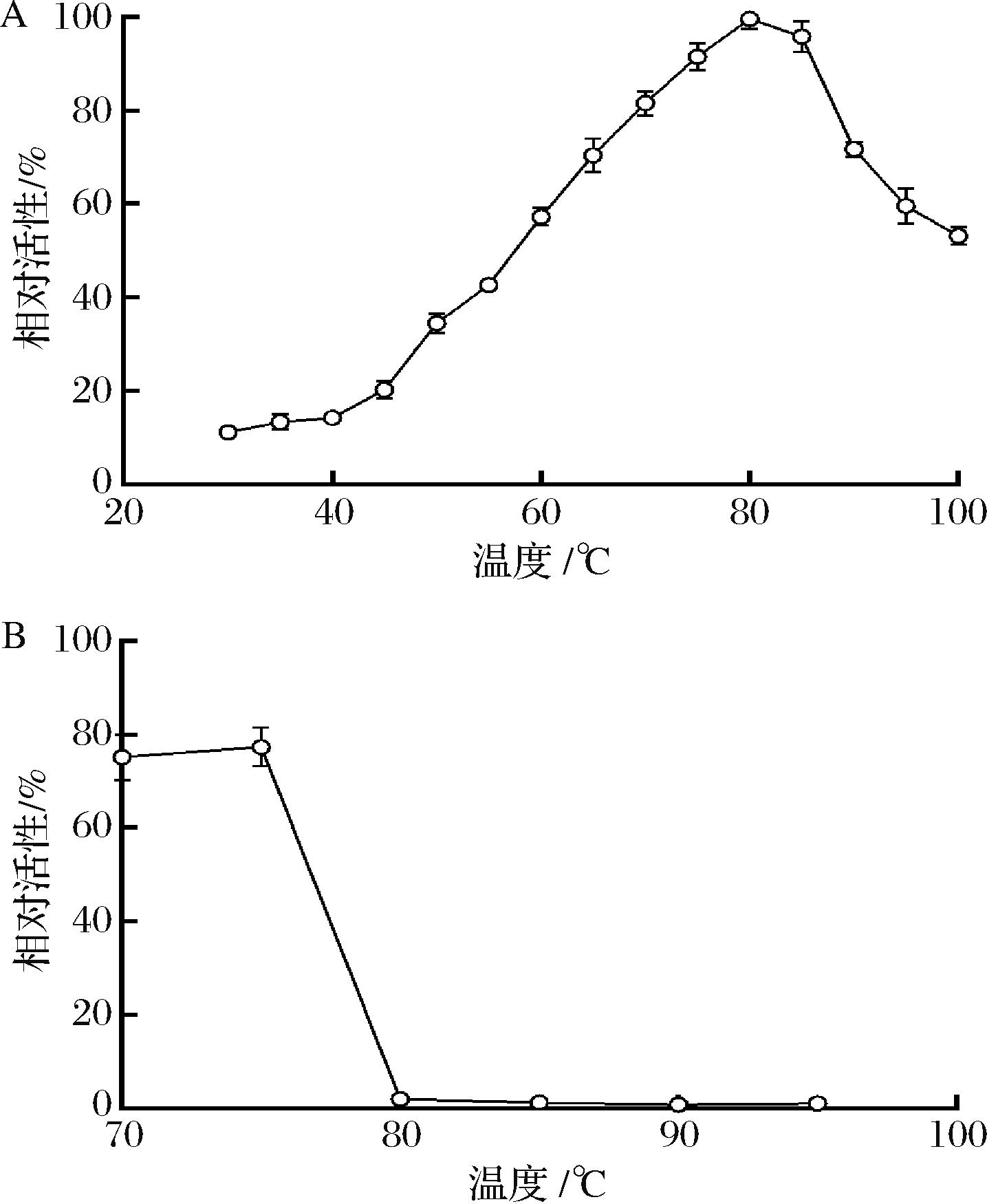
A-最适反应温度;B-不同温度下的稳定性
图4 SumoXyn的最适反应温度及不同温度下的稳定性
Fig.4 Optimum temperature and stability at different temperatures of SumoXyn
2.3.3 木聚糖酶的动力学参数测
当以榉木木聚糖为底物时,测定木聚糖酶SumoXyn的动力学参数如表1所示。SumoXyn的Km值为2.26 mg/mL,Kcat为214.68 s-1,Kcat/Km为94.95 mL/(s·mg)。与 MI等[17]报道的活性有所不同,MI等人以榉木木聚糖为底物测定 Caldicellulosiruptor kronotskyensis的木聚糖酶Km值为(0.62±0.33) mg/mL, vmax为(341.46±47.1) μmol/(min·mg),Kcat为(227±31.3) s-1。本研究中的重组SumoXyn Km大于MI的报道,但是Kcat与其相似。
表1 SumoXyn动力学参数测定
Table 1 The kinetic parameters of SumoXyn

参数SumoXynVmax/[μmoL/(min·mg)]2 354.52±106.73Km/(mg/mL)2.26±0.33Kcat/s-1214.68±9.73Kcat/Km/[mL/(s·mg)]94.95±13.82
2.3.4 各金属离子和化合物对木聚糖酶的影响
测定不同金属离子、EDTA以及SDS对SumoXyn的酶活影响,结果如图5所示,Co2+,Fe2+,Zn2+对其有明显的促进作用,反应体系中分别添加5 mmol/L的Co2+,Fe2+和Zn2+,酶活性提高了30%~45%;Mn2+有20%左右的促进作用,Na+、K+对酶活性几乎没有影响,但是Cu2+、Fe3+、Ca2+、Mg2+对其有轻微的抑制作用,而Ni+几乎抑制了45%的酶活性。5 mmol/L的EDTA也能明显抑制酶活,说明该酶为金属离子依赖型酶。该酶不能耐受SDS,5 mmol/L的SDS几乎完全抑制其活性。
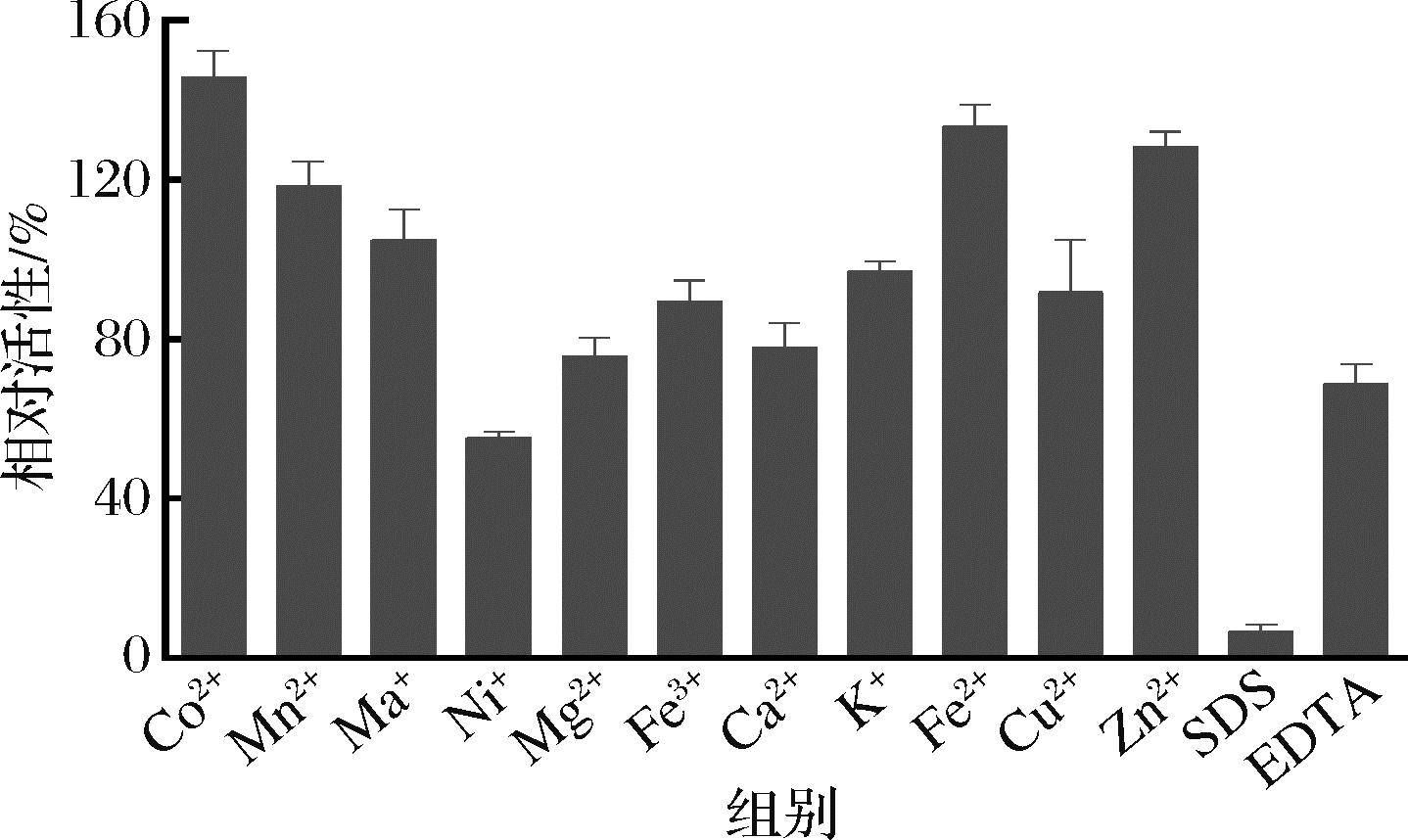
图5 金属离子和一些化合物对木聚糖酶的影响
Fig.5 Effects of metal ions and some compounds on xylanase
2.4 木聚糖酶对面包品质的影响
为了评估SumoXyn在面包烘焙中的应用,将纯化的SumoXyn添加至面团中进行面包烘焙,不同加酶量对面包的影响见表2。与未加酶的对照相比,添加了木聚糖酶的面包比容显著增加,而面包的硬度和咀嚼性显著降低,弹性增加。当200 g全麦面粉添加9 mg SumoXyn时,比容增加了约51.78%,硬度和咀嚼性分别下降了约43.96%和41.87%,而弹性增加了5.17%。
表2 不同添加量SumoXyn对面包质构特性影响
Table 2 Effect of SumoXyn on texture characteristics of bread
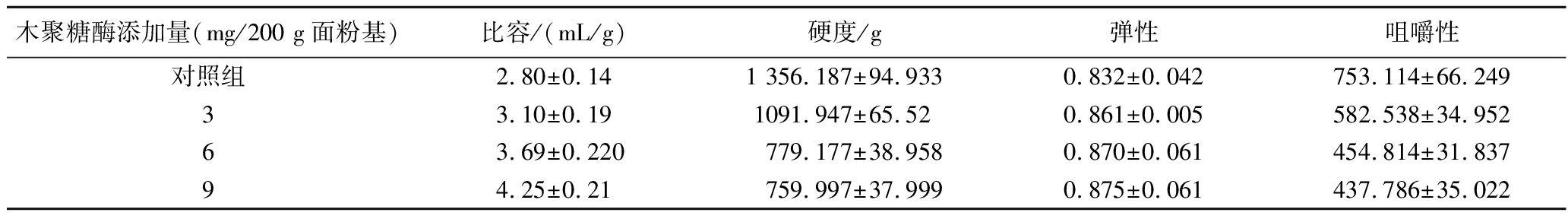
木聚糖酶添加量(mg/200 g面粉基)比容/(mL/g)硬度/g弹性咀嚼性对照组2.80±0.141 356.187±94.9330.832±0.042753.114±66.24933.10±0.191091.947±65.520.861±0.005582.538±34.95263.69±0.220779.177±38.9580.870±0.061454.814±31.83794.25±0.21759.997±37.9990.875±0.061437.786±35.022
在全麦面粉中添加木聚糖酶,木聚糖酶能降解水不溶阿拉伯木聚糖生成水溶性的木聚糖,一方面增加的可溶的低聚木糖可作为酵母的碳源,促进酵母发酵产气;另一方面水溶性木聚糖增加,改善了面筋网络结构,有利于面筋网络结构的扩展和形成,从而增加面团的持气能力,最终增大面包体积,提高面包的比容。而且水溶性木聚糖的增加使面团变得柔软,自由水含量增加[18],有研究表明,全麦面包的品质与比容和弹性成正相关,硬度与咀嚼性与品质成负相关,较低的硬度和咀嚼性有助于提高面包的口感[19]。结果表明,SumoXyn的添加能明显改善全麦面包的品质,SumoXyn有望成为良好的面包改良剂。
3 结论
以E.coli为宿主,融合Sumo标签重组表达嗜热微生物Caldicellulosiruptor owensensis的木聚糖酶SumoXyn,发现Sumo标签有助于提高Caldicellulosiruptor owensensis木聚糖酶在E.coli的可溶性表达。诱导表达后的细胞破碎液经75 ℃加热30 min可以除去绝大部分杂蛋白,且对融合木聚糖酶SumoXyn有25%的激活作用。这种方法不仅大大减少了纯化蛋白的繁琐的步骤,降低蛋白纯化成本,还能激活酶的活性。Nano DSF测定SumoXyn的Tm值为83.5 ℃,在pH 9.0和80 ℃时活性最高。首次尝试将该酶应用到全麦面包的烘焙中,发现该酶能显著提高全麦面包的比容和弹性,降低面包的硬度和咀嚼性。综上所述,该酶由于其较好的pH稳定性和耐热性,因此在面包烘焙工业中具有良好的应用前景。后续还可以将该木聚糖酶应用到其他食品的制作过程中,如粗粮饼干,粗粮馒头的生产,更好地满足人们对粗粮的需求。
[1] BEG Q K, KAPOOR M, MAHAJAN L, et al.Microbial xylanases and their industrial applications:A review[J].Applied Microbiology and Biotechnology,2001,56(3-4):326-338.
[2] MIAO H B, MA Y, ZHE Y Y, et al.Improving the thermostability of a fungal GH11 xylanase via fusion of a submodule (C2) from hyperthermophilic CBM9_1-2[J].International Journal of Molecular Sciences, 2021, 23(1):463.
[3] COURTIN C M, DELCOUR J A.Arabinoxylans and endoxylanases in wheat flour bread-making[J].Journal of Cereal Science, 2002, 35(3):225-243.
[4] 周素梅, 向波, 王璋, 等.小麦面粉中阿拉伯木聚糖研究进展[J].粮油食品科技, 2001,9 (2):20-22.
ZHOU S M, XIANG B, WANG Z.Research advance of arabinoxylans in wheat flour[J].Science and Technology of Cereals,Oils and Foods, 2001,9 (2):20-22.
[5] 陆云军, 陆利霞, 姚丽丽, 等.酶制剂对全麦面包品质作用分析[J].食品工业科技, 2021, 42 (1):363-367; 372.
LU Y J,LU L X, YAO L L, et al.Analysis on the effect of enzymes on the quality of whole wheat bread[J].Science and Technology of Food Industry, 2021, 42 (1):363-367; 372.
[6] 康志敏, 张康逸, 高玲玲, 等.不同酵母在青麦馒头面团中的发酵特性及品质对比分析[J].食品与发酵工业, 2019, 45(7):173-179.
KANG Z M, ZHANG K Y, GAO L L, et al.Fermentation characteristics of different yeasts in green wheat flour dough and qualities of the bread[J].Food and Fermentation Industries, 2019, 45(7):173-179.
[7] 安兆鹏, 王然, 赵文哲, 等.小麦麸皮对面团及面筋蛋白特性的影响[J].食品研究与开发, 2018, 39(9):11-17.
AN Z P, WANG R, ZHAO W Z, et al.Effects of wheat bran on dough and gluten characteristics[J].Food Research and Development, 2018, 39(9):11-17.
[8] 李秀婷, 李里特, 江正强, 等.耐热木聚糖酶对面包老化作用探讨[J].食品与发酵工业, 2006, 32(1):23-27.
LI X T, LI LT, JIANG Z Q, et al.Effect of a Thermostable Xylanase on Bread-staling[J].Food and Fermentation Industries,2006, 32(1):23-27.
[9] 田天娥, 张雄, 孙伟媛, 等.木聚糖酶在烘焙中的应用[J].粮食加工, 2021, 46(5):26-27.
TIAN T E, ZHANG X, SUN W Y, et al.Application of xylanase in baking[J].Grain Processing, 2021, 46(5):26-27.
[10] LIU X, LIU T F, ZHANG Y B, et al.Structural insights into the thermophilic adaption mechanism of endo-1,4-β-xylanase from Caldicellulosiruptor owensensis[J].Journal of Agricultural &Food Chemistry, 2018, 66(1):187-193.
[11] 郭莎, 贾哲, 贺鹏飞, 等.纳米级差示扫描荧光法在阿达木单抗热分析中的应用[J].药物分析杂志, 2023, 43(1):153-161.
GUO S, JIA Z, HE P F, et al.Application of nano-differential scanning fluorescence inthermal analysis of adalimumab[J].Chinese Journal of Pharmaceutical Analysis, 2023, 43(1):153-161.
[12] 李婵娟, 石慧, 王曼玥, 等.嗜热脂肪芽孢杆菌木聚糖酶A的 H297F 定点突变、表达及酶学性质变化[J].食品与发酵工业, 2018, 44(3):41-46.
LI C J, SHI H, WANG M Y, et al.Site-directed mutagenesis,expression and enzymatic properties of H297F in xylanase XynA of Geobacillus stearothermophilus[J].Food and Fermentation Industries, 2018, 44(3):41-46.
[13] LI C J, KUMAR A, LUO X, et al.Highly alkali-stable and cellulase-free xylanases from Fusarium sp.21 and their application in clarification of orange juice[J].International Journal of Biological Macromolecules, 2020, 155:572-580.
[14] 吉梦莹.添加挤压膨化燕麦粉对小麦面团性质及面包品质的影响[D].杨凌:西北农林科技大学,2017.
JI M Y. Effect of adding extruded oat flours on wheat-oat-dough properties and bread qualities[D]. Yangling: Northwest A &F University, 2017.
[15] 张伦, 罗坚, 周月芳, 等.差示扫描荧光法快速筛选高浓度人免疫球蛋白液体制剂处方[J].中国生物制品学杂志, 2016, 29(9):973-977;983.
ZHANG L, LUO J, ZHOU Y F, et al.Rapid screening of high concentration human immunoglobulin liquid formulations by differential scanning fluorimetry[J].Chinese Journal of Biologicals, 2016, 29(9):973-977;983.
[16] VERMA D. Extremophilic prokaryotic endoxylanases: Diversity, applicability, and molecular insights[J]. Frontiers in Microbiology, 2021, 12:728475.
[17] QIAO W B, TANG S G, MI S F, et al. Biochemical characterization of a novel thermostable GH11 xylanase with CBM6 domain from Caldicellulosiruptor kronotskyensis[J]. Journal of Molecular Catalysis B: Enzymatic, 2014, 107:8-16.
[18] 孟祥平, 栾广忠, 孙华幸, 等.木聚糖酶对米糠面团特性及面包烘焙品质的影响[J].食品与发酵工业, 2020, 46(16):190-195.
MENG X P, LUAN G Z, SUN H X, et al.Effects of xylanase on properties of dough and baking qualities of bread enriched with rice bran[J].Food and Fermentation Industries, 2020, 46(16):190-195.
[19] 张亚萍, 赵风光, 刘纯, 等.镰刀菌Fo47来源木聚糖酶的异源表达,酶学性质及其对全麦面包品质的影响[J].食品研究与开发, 2022, 43(11):35-41.
ZHANG Y P, ZHAO F G, LIU C, et al.Xylanase from fusarium oxysporum Fo47:Expression,characterization and application in whole-wheat bread making[J].Food Research and Development, 2022, 43(11):35-41.