开菲尔是一种传统的发酵乳饮料,具有轻微的酸味,碳酸气味和良好的香气,是通过微生物的代谢作用发酵而产生,它的起源可以追溯到巴尔干半岛、东欧和高加索地区,由于其有益健康的特性,它的消费者已遍布世界其他地区[1]。开菲尔中微生物具有产生有机酸,抗生素和多种香气的能力,对人体健康和营养具有重要意义,开菲尔制品可减轻乳糖不耐受症、胃肠道疾病和高血压等[2-4]。开菲尔主要以乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、醋酸杆菌属(Acetobacter)和明串珠菌属(Leuconostoc)以及哈萨克斯坦酵母(Kazachstania)、克鲁维酵母(Kluyveromyces)、诺莫夫氏酵母(Naumovozyma)和啤酒酵母菌属(Saccharomyces)为主[5-6]。
苯并芘[benzo(a)pyrene,B(a)P]是由5个苯环组成的高分子量多环芳烃,是世界卫生组织确定的三大致癌物质之一,也是具有三致(致癌性、致畸性和致突变性)作用的有害化合物[7]。食物中的苯并(a)芘来源主要有2个来源:a)空气中有含大量苯并(a)芘的灰尘和颗粒被农作物吸收后转移到人赖以生存的终产品中[8-9];b)食物经烘烤、烟熏、油炸等加热过程中产生和积累的苯并(a)芘。一般去除苯并(a)芘的有效策略之一是使用微生物降解,这一策略是基于利用苯并(a)芘作为微生物的碳源来激发潜在的降解能力,从而导致部分或完全去除苯并(a)芘,与物理和化学方法相比,微生物降解具有降解彻底、成本较低、不会产生二次污染等多种优势[9-11]。本课题组在前期研究中,通过不同发酵时间开菲尔高通量测序,确定了开菲尔中微生物降解苯并(a)芘过程中的核心功能微生物为乳杆菌属(Lactobacillus)、链球菌属(Streptococcus)、芽胞杆菌属(Bacillus)、乳球菌属(Lactococcus)、奈瑟氏菌属(Neisseria)等[12]。
本文以不同发酵时间段开菲尔微生物资源作为研究材料,在苯并(a)芘胁迫条件下通过富集驯化分离筛选出苯并(a)芘降解菌,对其进行形态学观察及分子生物学鉴定;通过单因素实验分析降解菌株M72-4降解苯并(a)芘的效果,初步确定其降解最优范围。再采用Box-Behnken实验设计和响应曲面法优化降解条件,为进一步研究食源性苯并(a)芘降解微生物资源奠定了基础。
1 材料与方法
1.1 样品采集
开菲尔粒:2020年8月采集新疆克孜勒苏柯尔克孜自治州阿克陶县地区牧民家庭手工制作的开菲尔乳酪,采集后装入灭菌自封袋中冷冻保藏运送至实验室-80 ℃冰箱保存备用。
1.2 培养基和试剂
试剂:苯并(a)芘(分析纯,≥99%),上海麦克林生化科技有限公司;二氯甲烷、丙酮(均为色谱纯,≥99.9%),北京鼎国昌盛生物技术有限责任公司;甲醇(色谱纯,≥99.9%),美国Thermo Fisher Scientific公司。
富集培养基(g/L):NH4NO31.00,MgSO4·7H2O 0.20,KH2PO4 0.50,K2HPO4 1.50,NaCl 0.50,(NH4)2SO4 0.50,苯并(a)芘储备液20.00 mg/L,121 ℃灭菌30 min。
基础无机盐培养基(g/L):NH4NO3 1.00,MgSO4·7H2O 0.20,KH2PO4 0.50,K2HPO4 1.50,NaCl 0.50,(NH4)2SO4 0.50,苯并(a)芘储备液(20.00、40.00、60.00、80.00 mg/L),121 ℃灭菌30 min。
MC液体培养基(g/L):蛋白胨5.00,牛肉浸粉3.00,酵母浸粉3.00,C6H12O6·H2O 20.00,碳酸钙10.00,pH 6.00,121 ℃灭菌20 min。
MRS液体培养基:蛋白胨10.00 g/L,吐温80 1.00 mL/L,柠檬酸氢二铵2.00 g/L,乙酸钠5.00 g/L,K2HPO4 2.00 g/L,MgSO4·7H2O 0.50 g,MnSO4·5H2O 0.25 g,酵母膏5.00 g,牛肉膏10.00 g,C6H12O6·H2O 20.0 g,pH 6.00,121 ℃灭菌20 min。
YGC液体培养基:酵母浸粉5.00 g,C6H12O6·H2O 20.00 g,氯霉素0.10 g,pH 6,121 ℃灭菌15 min。
固体培养基:上述培养基中添加15.00~20.00 g/L琼脂粉。
1.3 仪器与设备
MLS-3750高压蒸汽灭菌锅,上海天辰;U3000高效液相色谱仪,赛默飞世尔科技;TS-111B SHAKER摇床培养箱、HZQ-X300恒温培养箱,上海天呈实验仪器制造有限公司。
1.4 菌株的分离筛选
1.4.1 开菲尔活化与开菲尔粒的制备
制备流程如下:
开菲尔乳酪→碾碎→过40目筛→温水30 ℃泡洗3次→按质量比1∶5加入30 ℃水打浆→均质→按1∶10比例接种在25 ℃已灭菌牛乳中→25 ℃培养24 h→过滤获得开菲尔粒→重复上述活化培养次数3~5次→过滤获得发酵用开菲尔粒[7]
1.4.2 发酵开菲尔样品
将活化完成的10.00 g开菲尔粒(接种量在14%)加入到200.00 mL在实验室已灭菌的牛乳中,充分摇匀混合后,放在28 ℃的恒温培养箱中发酵。
1.4.3 苯并(a)芘溶液的配制
将苯并(a)芘固体溶于丙酮中配制为1.00 mg/L的苯并(a)芘贮备液,然后用无菌水稀释苯并(a)芘溶液至质量浓度为100.00 μg/mL的工作液。
1.4.4 苯并(a)芘标准曲线的制作
称取一定量的苯并(a)芘,用色谱级丙酮作为溶剂配制成质量浓度为1.00 mg/mL储备液,逐级稀释配制质量浓度为0.00、10.00、20.00、40.00、60.00、80.00、100.00 mg/L的标准液,进行液相色谱分析,测定峰面积,根据峰面积与浓度的对应关系制作标准曲线。
1.4.5 苯并(a)芘耐受菌的富集驯化培养
开菲尔从发酵12 h起每隔12 h取样至发酵72 h,每个时间段同时取5个平行样,各取5.00 mL于离心管中,每个试管中加入5.00 mL磷酸盐缓冲溶液,混合均匀,5 000 r/min离心10 min。分别将上清液加入至含有20.00 mg/L苯并(a)芘的基础无机盐培养基中,37 ℃,120 r/min,摇床振荡培养72 h,作为培养物的第1代。取10.00 ml出现混浊的第1代菌株培养液转入90.00 mL新的含有20.00 mg/L苯并(a)芘的基础无机盐培养基中,按照以上方法培养72 h,为第2代培养物,重复以上操作富集培养5代苯并(a)芘降解菌。
1.4.6 苯并(a)芘耐受菌的分离纯化
将富集培养后的第5代菌液采用10倍稀释法稀释至体积分数为10-1~10-7的菌悬液,涂布在含有20.00 mg/L苯并(a)芘的基础无机盐固体培养基平板上,置37 ℃恒温培养箱中恒温培养12~72 h。待菌落长好后,分别挑取不同形态的单菌落重新接种至100.00 mL含苯并(a)芘20.00 mg/L的基础无机盐培养基中培养12~72 h来验证其是否具备降解能力,发酵过程设置3个生物学重复,每个重复设置3个平行。取降解率高的菌株接种于选择性固体培养基上划线纯化,得到纯培养,备用。
1.4.7 苯并(a)芘的提取
取待测样品1.00 mL,加入等体积的色谱级二氯甲烷萃取苯并(a)芘,漩涡混合30 s,充分混匀,40 ℃下超声提取10 min,12 000 r/min条件下离心8 min,移取下层有机相。在上层培养液中加入等体积的二氯甲烷再进一步萃取,合并有机相,过孔径为0.45 μm的有机相滤膜过滤,HPLC检测。
1.4.8 苯并(a)芘降解率的测定
高效液相色谱条件:色谱柱为C18 Diamosil TM (250 mm×4.60 mm,粒径5.00 μm);流动相为纯甲醇,流速1.00 mL/min,柱温39 ℃,检测波长254 nm,进样量20.00 μL,保留时间10 min。
苯并(a)芘降解率计算方法见公式(1):
苯并(a)芘降解率![]()
(1)
式中:A为空白样品中苯并(a)芘的含量;B为待测样品中苯并(a)芘的含量。
1.4.9 菌株鉴定
将菌接在选择性培养基上划线培养至对数生长期后,观察菌落形态特征,挑取少量菌体涂于载玻片在显微镜下观察菌体的形态特征并进行革兰氏染色。采用16S rRNA通用引物27 F(5′-AGAGTTTGATCCTGGCTCAG-3′),1492 R(5′-GGTTACCTTGTTACGACTT-3′)进行扩增。将PCR产物送至上海生工公司完成测序。测序数据在NCBI网站上进行同源性比较,并提交至NCBI获得菌株序列GenBank登录号,下载同源性高的序列用MEGA11.0软件构建系统发育树。
1.5 单因素试验
以降解率及OD600值为评价指标,考察较苯并(a)芘初始质量浓度(20.00、40.00、60.00、80.00 mg/L)、培养温度(27、32、37、42 ℃)、培养基pH(3.00、4.00、5.00、6.00、7.00、8.00、9.00、10.00)、培养时间(0、12、24、36、48、60、72 h)对菌株降解苯并(a)芘能力及菌株OD600值的影响。
1.6 响应面优化实验
在单因素试验基础上,利用Box-Behnken设计原理,考察4因素之间的交互作用并得到目标菌株降解苯并芘的最优条件,把苯并(a)芘降解能力作为响应值,设计4因素3水平的试验,见表1。
表1 Box-Behnken设计的因素与水平
Table 1 Factors and levels of Box-Behnken design
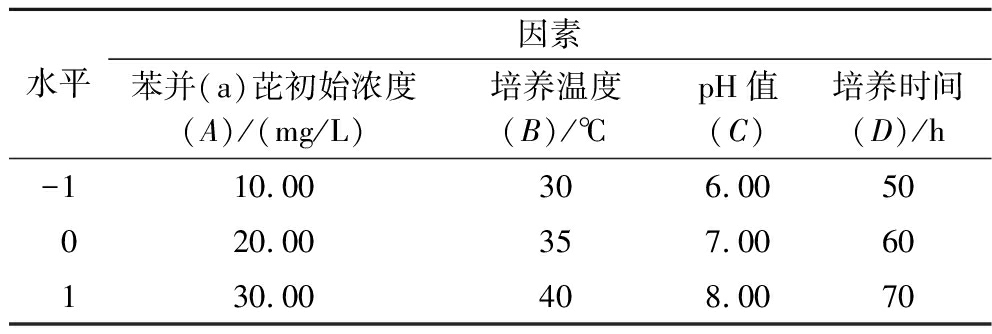
水平因素苯并(a)芘初始浓度(A)/(mg/L)培养温度(B)/℃pH值(C)培养时间(D)/h-110.00306.0050020.00357.0060130.00408.0070
1.7 数据分析
数据用Excel进行初步统计和归纳整理、利用SPSS 26.0进行单因素方差分析(ANOVA),分析数据之间的显著性差异(P<0.05),最后用Origin 2021进行绘图。条件优化利用Design Expert 8.0.6软件处理,由模型方程决定系数R2和方差分析判断,统计显著性及回归系数,显著性通过F值进行测试,P值分别为0.05和0.01两个不同的水平。
2 结果与分析
2.1 开菲尔粒及开菲尔发酵乳
采集于新疆克孜勒苏柯尔克孜自治州阿克陶县地区牧民家庭手工制作的开菲尔乳酪经反复活化五代后过滤获得发酵用开菲尔粒(图1-a)。将活化完成的开菲尔粒以14%的接种量加入到200.00 mL已灭菌的牛乳中,充分摇匀混合后,放在28 ℃的恒温培养箱中发酵获得开菲尔发酵乳(图1-b)。

a-开菲尔粒;b-开菲尔发酵乳
图1 开菲尔粒及开菲尔发酵乳
Fig.1 Kefir grains and Kefir
2.2 苯并(a)芘标准曲线
以苯并(α)芘质量浓度为横坐标,峰面积为纵坐标,得到标准曲线(附图1,https://doi.org/10.13995/j.cnki.11-1802/ts.036763,下同),回归方程为y=0.443 5x+0.409 5,其相关系数R2=0.999 1,说明本实验中苯并(α)芘质量浓度为0.00~100.00 mg/L,具有良好的线性关系及较高的灵敏度。
2.3 苯并(a)芘耐受菌株的分离纯化
处于不同发酵时间段的开菲尔中微生物作为微生物来源,经过反复富集驯化培养,进行涂布划线纯化后,分别从添加20.00 mg/L苯并(a)芘的选择性培养基(MC、MRS、YGC)中分离培养,获得了3株细菌,一株酵母菌(附图2)。

图2 苯并(a)芘初始浓度对菌株降解能力的影响
Fig.2 Effect of initial concentration of benzo (a) pyrene on degradation ability of strain
注:各柱形上不同大写字母表示同一苯并(a)芘初始质量浓度不同降解菌的 降解能力之间显著差异(P<0.05);不同小写字母表示同一降解菌株 在不同质量浓度苯并(a)芘胁迫下降解能力之间显著差异(P<0.05)。
2.4 苯并(a)芘耐受菌株菌株的降解率
这4株菌株在不同苯并(a)芘初始质量浓度下的降解能力如图2所示。其中菌株M72-4在不同质量浓度苯并(a)芘下的降解能力分别为33.74%、28.9%、15.05%和12.36%;苯并(a)芘质量浓度为20.00~40.00 mg/L时菌株M72-4与其他菌株之间的降解能力呈显著差异(P<0.05)。菌株M72-4对不同质量浓度苯并(a)芘的降解能力均大于其他菌株,因此作为后续研究的目标菌株对降解条件进行优化。
2.5 可降解苯并(a)芘菌株的鉴定
菌体M72-4在MC固体培养基上生长48~72 h后,形成圆形单菌落,菌落呈乳白色不透明,菌落表面粗糙,边缘不规则(图3-a)。经革兰氏染色后,菌体呈紫蓝色、细胞呈短杆状(图3-b)。生化鉴定结果显示,该菌株可以发酵蔗糖和葡萄糖,而无法发酵甘露醇和乳糖。根据分子生物学鉴定结果构建的系统发育树(图3-c),发现M72-4菌株与Bacillus velezensis(贝莱斯芽孢杆菌)同源性达到100%。经形态学和16S rRNA基因序列与系统发育树构建,可以确定M72-4菌株属于芽孢杆菌属。由于目前课题组仅对菌株M72-4进行了后续的研究获得了相应的研究结果,其他3株降解菌仍在研究中,因此本文将针对该菌株进行降解条件的优化研究过程进行论述。
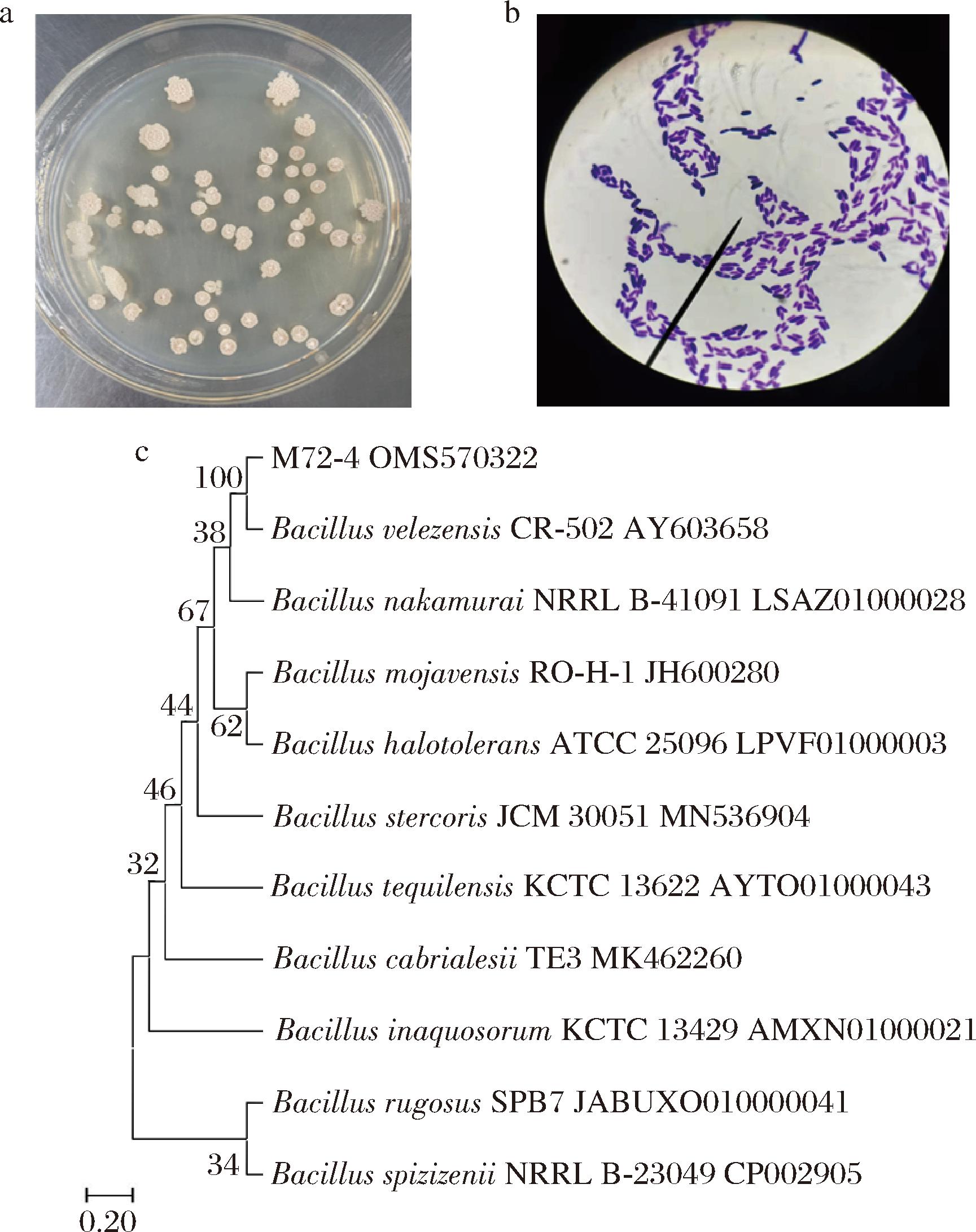
a-菌落形态;b-革兰氏染色镜检结果(放大倍数 10×100); c-系统进化树
图3 菌株M72-4形态学结果和系统进化树
Fig.3 Morphological results and phylogenetic tree of the strain M72-4
2.6 菌株M72-4苯并(a)芘降解条件的单因素优化
单因素优化结果如图4所示,苯并(a)芘降解率及菌株OD600值随苯并(a)芘初始质量浓度的增加呈下降趋势。在初始质量浓度为20.00 mg/L时,芽孢杆菌M72-4菌株菌种OD600值及降解率最高,分别为0.674和44.42%。苯并(a)芘质量浓度为80.00 mg/L时,菌株降解率及OD600值明显下降。因此,菌株M72.4降解苯并(a)芘的最佳质量浓度为20.00 mg/L(图4-a);随着培养时间的延长,降解率显示先增后减的趋势,60 h达到峰值49.65%。菌株OD600值随着培养时间的延长,显示缓慢下降趋势,由此可见菌株在苯并(a)芘胁迫下,显示趋于适应胁迫环境的趋势。因此,菌株M72-4降解苯并(a)芘的最佳时间为60 h(图4-b);温度是微生物生长的重要影响因素,随着培养温度升高,降解率呈现先升后降的变化趋势;在37 ℃时降解率最高,为46.12%,温度对苯并(a)芘降解率影响较大。菌体的OD600值与降解率趋势相一致,在37 ℃时最高,为0.65。因此,37 ℃是菌株M72-4降解苯并(a)芘的最适温度(图4-c);当初始pH值为5.00~7.00时,降解体系中表现出对苯并(a)芘有较好的降解能力,且pH值为7.0时,苯并(a)芘的降解率达45.47%,此时对苯并(a)芘的降解能力达到最强,菌体OD600值也达到最大,为0.672。因此,菌株M72-4 降解苯并(a)芘的最佳pH值为7.0(图4-d)。

a-苯并(a)芘质量浓度;b-培养时间;c-培养温度;d-pH
图4 Bacillus velezensis M72-4降解苯并(a)芘的单因素优化结果
Fig.4 Single-factor optimization results of degradation of benzo (a) pyrene by Bacillus velezensis M72-4
注:图中大小写字母分别表示降解率和OD600值组间存在显著性差异(P<0. 05)。
2.7 响应面试验结果
2.7.1 回归模型与方差分析
本研究评价了Bacillus velezensis M72-4降解苯并(a)芘的主要作用因素和不同变量之间的相互作用。因此,研究了4个自变量[初始苯并(a)芘浓度、温度、pH和时间]在3个水平上对苯并(a)芘的降解率(因变量)的影响。实验按照Box-Behnken设计进行。实际的苯并(a)芘降解率见表2。
表2 Box-Behnken试验设计方案及响应值
Table 2 Program of Box-Behnken experimental design and response value
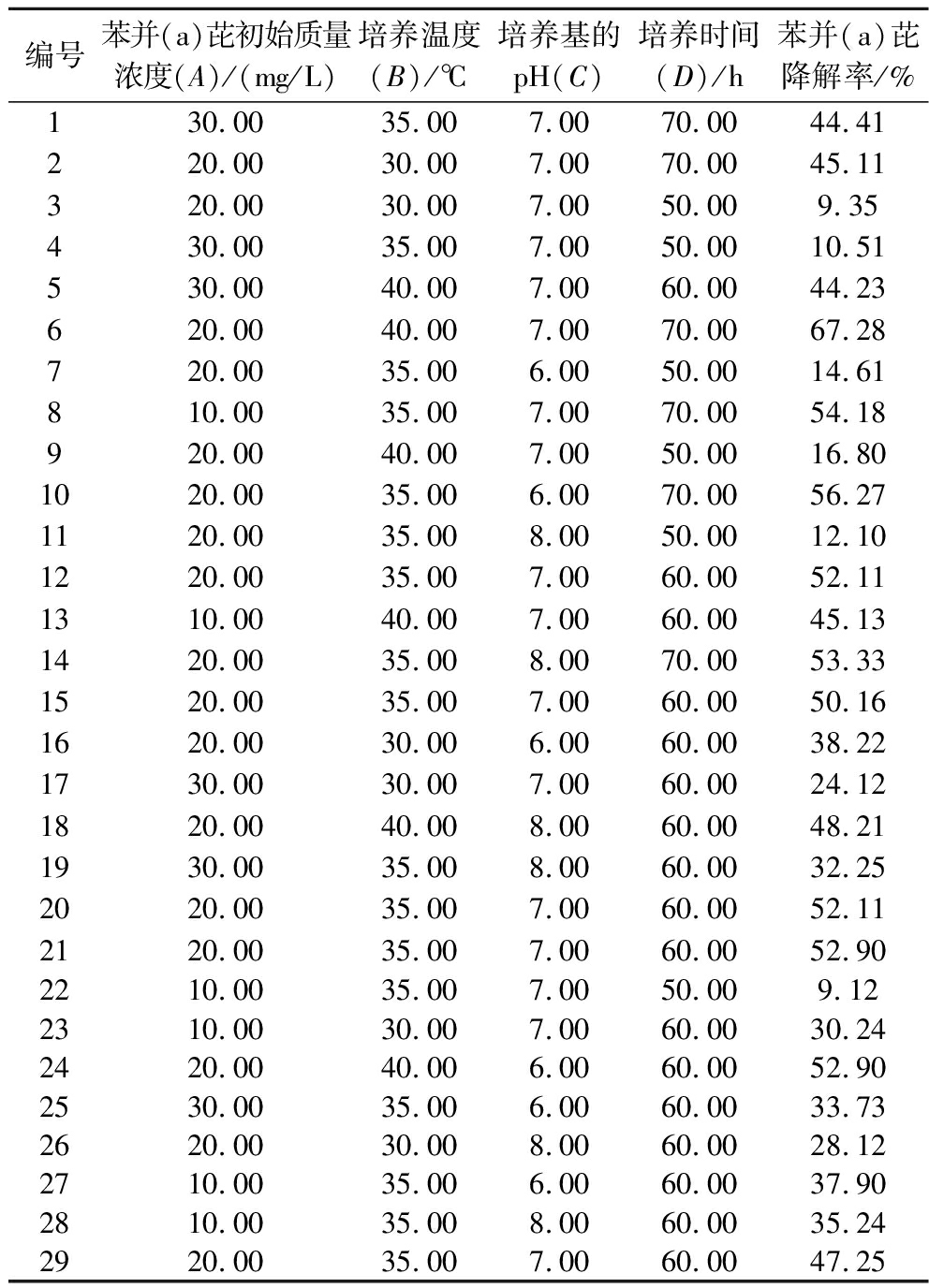
编号苯并(a)芘初始质量浓度(A)/(mg/L)培养温度(B)/℃培养基的pH(C)培养时间(D)/h苯并(a)芘降解率/%130.0035.007.0070.0044.41220.0030.007.0070.0045.11320.0030.007.0050.009.35430.0035.007.0050.0010.51530.0040.007.0060.0044.23620.0040.007.0070.0067.28720.0035.006.0050.0014.61810.0035.007.0070.0054.18920.0040.007.0050.0016.801020.0035.006.0070.0056.271120.0035.008.0050.0012.101220.0035.007.0060.0052.111310.0040.007.0060.0045.131420.0035.008.0070.0053.331520.0035.007.0060.0050.161620.0030.006.0060.0038.221730.0030.007.0060.0024.121820.0040.008.0060.0048.211930.0035.008.0060.0032.252020.0035.007.0060.0052.112120.0035.007.0060.0052.902210.0035.007.0050.009.122310.0030.007.0060.0030.242420.0040.006.0060.0052.902530.0035.006.0060.0033.732620.0030.008.0060.0028.122710.0035.006.0060.0037.902810.0035.008.0060.0035.242920.0035.007.0060.0047.25
选择二次模型作为最佳匹配模型,由于R2(0.985 8)和调整后R2(0.992 9)值较高,可以得出实验结果与模型预测的数据吻合较好的结论。利用残差的正态性图来评估数据的正态性,残差呈正态分布,没有明显的偏差。此外,实际水平与预测水平的曲线表明,预测值和实验值之间具有高度的相似性(附图3)。利用Dsign-Expert软件方差分析,通过比较各因素值,各影响因子的显著性进行排序,结果为:D(培养时间)>B(培养温度)>A(苯并(a)芘初始质量浓度)>C(培养基pH)。
2.7.2 苯并(a)芘降解率响应面图分析
经过对该模型的评估和回归公式的确定,利用Design-Expert软件制作响应面图。苯并(a)芘初始质量浓度(A)、温度(B)、pH(C)和时间(D)对苯并(a)芘降解率的单一影响(附图4)。结果显示通过适当延长培养时间和培养温度可以提高苯并(a)芘降解率。
各因素交互作用对苯并(a)芘降解率影响的响应面图见图5。图5-a和图5-b分别显示了苯并(a)芘初始质量浓度和时间的联合效应的三维表面图和等高线图,苯并(a)芘的初始质量浓度的增加对苯并(a)芘降解率呈现先增加后减少的趋势。时间的延长幅度较苯并(a)芘初始质量浓度陡峭,时间对菌株降解苯并(a)芘的影响更为显著。根据时间和温度组合效果的3D表面和等高线图(图5-c和图5-d),可知在温度为30 ℃时,当培养时间从50 h延长到70 h时,苯并(a)芘的降解率从9.12%增加到67.28%。等高线图中明确得出,两因素互相作用,时间的上升的幅度比温度的影响较为陡峭,时间对菌株降解苯并(a)芘的影响更大于温度的影响。苯并(a)芘的降解率随温度的升高,缓慢上升,温度的变化加速苯并(a)芘的降解,最高温度40 ℃时苯并(a)芘降解率达到最高值为67.28%。

a、c-苯并(a)芘初始质量浓度和时间、温度和时间的响应面图;b、d-苯并(a)芘初始质量浓度和时间、温度和时间的等高线图
图5 交互作用对苯并(a)芘降解率的影响
Fig.5 Effect of interaction on the degradation rate of benzo (a) pyrene
2.7.3 菌株降解苯并(a)芘工艺优化及验证
对预测的结果进行可实验性求证,根据已知的回归方程,只需要进行分析其最优的方案,结果显示最优的降解条件是初始质量浓度精确到18.37 mg/L,温度控制在40 ℃、培养基的pH值调到6.92,共培养70 h,降解率达到最高,为68.01%。根据优化后的降解条件,在实际实验操作过程中,真实初始质量浓度为18.00 mg/L、温度控制在40 ℃、pH值调到6.90、持续培养70 h,测定降解液中苯并(a)芘的残留量。确定符合实际的条件后,按照降解条件,进行3次平行试验,统计数据、获得Bacillus velezensis M72-4在最优条件时,最终降解率为65.78%。与模型预测值接近,说明响应面优化的降解条件是有效的。
3 讨论
近年来,随着人类健康问题受到普遍关注,人们越来越重视食品中有毒物质的预防和控制措施研究。食品中有毒物质的可食用微生物降解作用及机理成为研究热点及趋势[13-18]。贺新丽等[19]研究了乳酸菌在模拟淀粉条件下去除苯并(a)芘的作用,结果证实,乳酸菌菌株可以从淀粉类食品中去除苯并(a)芘。BARTKIENE等[20]通过研究乳酸菌菌株从冷熏猪肉香肠中去除苯并(a)芘,结果显示,3株乳酸菌菌株(清酒乳杆菌KTU05-6、戊糖片球菌KTU05-9和乳酸片球菌KTU05-7)在熏制前后均能显著去除香肠中的苯并(a)芘。SULTANA等[21]从发酵食品中分离益生菌测试其降解或解毒多环芳烃的能力,从26种与苯并(a)芘共培养的发酵食品混合物中分离出5种形态不同的益生菌,这些结果表明了发酵食品微生物在生物降解和清除人体有毒多环芳烃方面具有潜在能力。YOUSEFI等[22]研究了不同乳酸菌菌株从受污染的磷酸盐缓冲生理盐水中去除四种多环芳烃的方法,结果表明,供试菌株均能去除多环芳烃,去除率与培养基的pH、菌株的类型、多环芳烃的浓度显著相关。本课题组前期研究了开菲尔中微生物对苯并(a)芘的非靶向代谢组学分析,已经获得了苯并(a)芘微生物降解的特异性中间代谢物邻苯二甲酸、原儿茶酸、苯乙酸、邻苯二甲酸二异丙酯和苯酚等[23]。结合本研究中得到的高效降解苯并(a)芘数据,研究团队认为新疆传统发酵乳开菲尔中对苯并(a)芘降解能够起到作用的微生物分类为降解菌和耐受菌,降解菌很有可能具有代谢苯并(a)芘的关键性基因,并能够产生苯并(a)芘降解的第一步生化反应的关键性酶;耐受菌则有可能具有对苯并(a)芘降解中间代谢产物的作用能力,很可能会与降解菌产生“协同代谢”现象,开菲尔中菌群的协同作用将为进一步研究其在苯并(a)芘胁迫条件下的代谢途径及关键基因奠定基础。
4 结论
本研究从不同发酵时间段的开菲尔微生物中以苯并(a)芘为碳源富集驯化后的降解菌群中分离纯化出4株苯并(α)芘耐受菌,并根据其降解率最终筛选出1株菌株,命名为M72-4,经过对其形态特征分析,16S rRNA测序分析以及发育树分析鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)的同源菌。以苯并(a)芘降解率和菌株OD600值为指标,通过单因素试验确定影响因素范围,利用响应面试验得到最佳培养条件为:初始质量浓度精确到18.37 mg/L,温度控制在40 ℃、培养基的pH调到6.92,培养70 h,降解率为68.01%。实验室反复验证结果与模型预测值相接近,确定符合实际的条件后,按照降解条件,进行3次平行试验,最终降解率为65.78%。新疆地方传统发酵乳制品开菲尔可为食源性苯并(a)芘降解提供可食用菌株资源,为进一步研究新疆传统发酵食品微生物的应用价值提供参考。
[1] VARDJAN T, MOHAR LORBEG P, ![]() A.Stability of prevailing lactobacilli and yeasts in kefir grains and kefir beverages during ten weeks of propagation[J].International Journal of Dairy Technology, 2018, 71(S1):51-60.
A.Stability of prevailing lactobacilli and yeasts in kefir grains and kefir beverages during ten weeks of propagation[J].International Journal of Dairy Technology, 2018, 71(S1):51-60.
[2] AZIZI N F, KUMAR M R, YEAP S K, et al.Kefir and its biological activities[J].Foods, 2021, 10(6):1210.
[3] ROSA D D, DIAS M M S, ![]()
 M, et al.Milk kefir:Nutritional, microbiological and health benefits[J].Nutrition Research Reviews, 2017, 30(1):82-96.
M, et al.Milk kefir:Nutritional, microbiological and health benefits[J].Nutrition Research Reviews, 2017, 30(1):82-96.
[4] ERDOGAN F S, OZARSLAN S, GUZAL S Z B, et al.The effect of kefir produced from natural kefir grains on the intestinal microbial populations and antioxidant capacities of Balb/c mice[J].Food Research International, 2019, 115:408-413.
[5] NALBANTOGLU U, CAKAR A, DOGAN H, et al.Metagenomic analysis of the microbial community in kefir grains[J].Food Microbiology, 2014, 41:42-51.
[6] MARSH A J, O’SULLIVAN O, HILL C, et al.Sequencing-based analysis of the bacterial and fungal composition of kefir grains and milks from multiple sources[J].PLoS One, 2013, 8(7):e69371.
[7] 马龙, 邢军, 李安, 等.开菲尔不同发酵时期微生物群落结构的变化[J].现代食品科技, 2019, 35(8):27-34;26.
MA L, XING J, LI A, et al.Evolution of microbial community structure in different fermentation periods in kefir[J].Modern Food Science and Technology, 2019, 35(8):27-34;26.
[8] BAKIRCIOGLU D, TOPRAKSEVER N, YURTSEVER S,et al.Investigation of macro, micro and toxic element concentrations of milk and fermented milks products by using an inductively coupled plasma optical emission spectrometer, to improve food safety in Turkey[J].Microchemical Journal, 2018, 136:133-138.
[9] 王欣, 周智慧, 赵晓联.苯并[α]芘危害性及其检测技术[J].粮食与油脂, 2011,24(3):48-49.
WANG X, ZHOU Z H, ZHAO X L.The harm and its detection techniques of benzopyrene[J].Cereals and Oils, 2011,24(3):48-49.
[10] HU G F, CAI K Z, LI Y Z, et al.Significant inhibition of garlic essential oil on benzo [a] pyrene formation in charcoal-grilled pork sausages relates to sulfide compounds[J].Food Research International, 2021, 141:110127
[11] 冯亚净, 王瑞鑫, 李书国.食品中苯并芘的来源及减控方法的研究[J].粮食与油脂, 2017, 30(2):72-75.
FENG Y J, WANG R X, LI S G, Review on the sources and reducing strategies of benzo(a)pyrene in foods[J].Cereals and Oils, 2017, 30(2):72-75.
[12] DAS D N, BHUTIA S K.Inevitable dietary exposure of benzo [a] pyrene:Carcinogenic risk assessment an emerging issues and concerns[J].Current Opinion in Food Science, 2018, 24:16-25.
[13] NACHVAK S M, SOLEIMANI D, GHOLIZADEH S, et al.A delicious food, but contaminated with harmful compounds:A literature review[J].Journal of Isfahan Medical School, 2021, 39(626):376-383.
[14] 李安. 新疆传统发酵剂开菲尔粒中微生物对苯并芘的降解研究[D].乌鲁木齐:新疆师范大学, 2021.
LI A.Degradation of benzo (a) pyrene by Kefer microorganism from Xinjiang[D].Urumqi:Xinjiang Normal University, 2021.
[15] SHOUKAT S.Potential anti-carcinogenic effect of probiotic and lactic acid bacteria in detoxification of benzo(a)pyrene:A review[J].Trends in Food Science &Technology, 2020, 99:450-459.
[16] MANDAL S K, DAS N.Biodegradation of perylene and benzo[ghi] perylene (5-6 rings) using yeast consortium:Kinetic study, enzyme analysis and degradation pathway[J].Journal of Environmental Biology, 2018, 39(1):5-15.
[17] OSTREM LOSS E M, YU J H.Bioremediation and microbial metabolism of benzo(a)pyrene[J].Molecular Microbiology, 2018, 109(4):433-444.
[18] SHOUKAT S, ASLAM M Z, REHMAN A, et al.Screening of Bifidobacterium strains to bind with benzo(a)pyrene under food stress factors and the mechanism of the process[J].Journal of Food Processing and Preservation, 2019, 43(7):100-109.
[19] 贺新丽, 赵丽丽, 张柏林, 等.模拟淀粉条件下乳杆菌吸附苯并(a)芘的能力[J].微生物学报, 2016, 56(5):814-823.
HE X L, ZHAO L L, ZHANG B L, et al.Removal of benzo(a)pyrene by Lactobacillus strains under simulated starch conditions[J].Acta Microbiologica Sinica, 2016, 56(5):814-823.
[20] BARTKIENE E, BARTKEVICS V, MOZURIENE E, et al.The impact of lactic acid bacteria with antimicrobial properties on biodegradation of polycyclic aromatic hydrocarbons and biogenic amines in cold smoked pork sausages[J].Food Control, 2017, 71:285-292.
[21] SULTANA O F, LEE S, SEO H, et al. Biodegradation and removal of PAHs by Bacillus velezensis isolated from fermented food[J]. Journal of Microbiology and Biotechnology, 2021, 31(7):999-1010.
[22] YOUSEFI M, SHARIATIFAR N, TAJABADI EBRAHIMI M, et al.In vitro removal of polycyclic aromatic hydrocarbons by lactic acid bacteria[J].Journal of Applied Microbiology, 2019, 126 (3):954-964.
[23] 古丽加马力·艾萨, 邢军, 李安, 等.开菲尔粒中微生物对苯并(a)芘的非靶向代谢组学分析[J].生物技术通报, 2022, 38(5):123-135.
AISA G, XING J, LI A, et al.Non-targeted metabolomics analysis of benzo(α)pyrene by microorganisms in kefir grains[J].Biotechnology Bulletin, 2022, 38 (5):123-135.