草莓果酒是以草莓为原料,经接种酵母菌、发酵、过滤、陈酿、调配等工艺酿制而成,其保留了部分草莓水果风味并具有一定的保健作用[1-2],深受广大消费者的喜爱。草莓果酒的研发与生产加工为解决我国草莓鲜果过剩、深加工不足难题提供了新策略。然而,由于缺乏专用酵母,草莓果酒的风味寡淡且同质化严重[3],使其在果酒市场上缺乏竞争力。
在果酒的生产过程中,一般会使用商用酿酒酵母进行纯种发酵,这种方式可以有效抑制杂菌生长,而且商用酿酒酵母一般能够耐高酒精度和渗透压、耐高温、竞争营养物的能力强[4],使果酒的品质有保障,但是采用纯种酵母发酵不能很好地体现果酒风味的复杂性和典型性。近年来,许多研究学者通过增加非酿酒酵母,与酿酒酵母混合发酵的方式增强了葡萄酒[5]、苹果酒[6]、猕猴桃酒[7]、蓝莓果酒[8]等果酒的香气多样性和浓郁度,并改善了口感。研究报道非酿酒酵母能够分泌多种酶[9],如β-葡聚糖酶、β-葡糖苷酶、木聚糖酶、酯酶等,促进水解芳香化合物前体,合成酯类、醇类、萜烯类等风味物质,并降低酒精度,释放甘露糖蛋白或多糖,增加甘油含量,有助于调节果酒的花香与果味香气、品种香气、酸度等,改善感官品质,提高果酒的综合质量[10-11]。然而,非酿酒酵母常常会受到酒精、二氧化硫、酿酒酵母等因素的胁迫,导致其生长缓慢甚至停滞,因此多采用非酿酒酵母与酿酒酵母顺序接种发酵的方式来提高果酒的品质[12-13]。
非酿酒酵母的种类繁多,不同属种的非酿酒酵母发酵特性及对果酒风味的具体贡献也不同。其中德尔布有孢圆酵母(Torulaspora delbrueckii, Td)是最早被商业化且应用、研究最多的非酿酒酵母菌种之一。Td的发酵能力较强,纯种发酵可获得7.40%~9.38%(体积分数)酒精度[14]的酒。相比于酿酒酵母,Td能够产生更多的果味、甜味脂肪酸乙酯,如丙酸乙酯、辛酸乙酯、癸酸乙酯及萜烯和硫醇,产生较少的高级醇、挥发酸和乙醛等刺激性不良风味物质[15],对酒精饮料风味有积极的贡献,被广泛用于酿酒业。有研究报道,Td与酿酒酵母共发酵可提高草莓酒挥发性成分的浓度和气味活度值(odorant activity value, OAV),增加果酒风味体系的丰度,为草莓果酒的风味调控和品质提升提供了新的技术方案[16]。目前,不同种类非酿酒酵母与酿酒酵母混菌发酵在果酒领域得到了广泛研究,但同一非酿酒酵母与不同酿酒酵母混合共发酵对果酒品质影响的研究相对较少。
本研究以草莓为原料,选用非酿酒酵母Td,分别与4种酿酒酵母ICV D254(D254)、Lalvin K1(K1)、F15和安琪酵母RW(Aq)进行顺序混合发酵。对不同混菌模式草莓果酒的理化性质、色度、挥发性香气物质进行比较分析,并结合消费者嗜好性评价,筛选出有利于草莓酒增香的酵母组合,为高品质草莓果酒加工提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
草莓(红颜品种),安徽省合肥市长丰县,挑选成熟、无病害的果实用于发酵。
酵母菌株:德尔布有孢圆酵母(Torulaspora delbrueckii, Td)、酵母F15,法国LAFFORT公司;酿酒酵母ICV D254(D254)、Lalvin K1(K1),法国LALLEMAND公司;安琪酵母RW(Aq),安琪酵母有限公司。酵母均为活性干酵母,加入量为0.2 g/kg。
1.1.2 主要试剂
焦亚硫酸钾(食品级),意大利Enartis公司;4-甲基-2-戊醇(色谱级),梯希爱(上海)化成工业发展有限公司;葡萄糖、五水硫酸铜、酒石酸钾钠、次甲基蓝、盐酸、酚酞、亚铁氰化钾、氢氧化钠等,均为AR级。
1.2 仪器与设备
PAL-1手持糖度计,日本爱宕公司;CR-400/410型色彩色差仪,日本美能达公司;S220-K pH计,梅特勒-托利多仪器有限公司;Agilent 7890A-5975C气质联用仪,美国Agilent公司;57329-U SPME萃取头,上海安谱实验科技股份有限公司。
1.3 实验方法
1.3.1 实验处理
酵母活化:将称量好的酵母加入10倍体积的蒸馏水,在37 ℃恒温水浴锅中活化30 min。
实验设计:采用顺序接种方式,先接种非酿酒酵母(Td),在24 h后以1∶1的接种比例再分别接种酿酒酵母(D254、F15、K1、Aq),分别简称为:Td+D254、Td+F15、Td+K1、Td+Aq。每个处理酿制3罐,每罐2 L。
草莓果酒发酵工艺流程为:
草莓称重→解冻(室温解冻3 h)→清洗破碎酶解(添加焦亚硫酸钾0.06 g/kg,果胶酶0.05 g/kg酶解2 h)→调糖(用白砂糖将糖度调至22 °Brix)→接种不同处理组酵母→主发酵(22 ℃下进行发酵直至结束)→过滤(采用80目滤网过滤)→陈酿(16 ℃下恒温箱内3个月)→澄清→成品酒
1.3.2 实验处理理化指标测定
酒精度、还原糖、游离SO2、总SO2测定方法参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》;总酸测定方法参照GB/T 15038—2006《采用酸碱滴定法测定》,以柠檬酸计;可溶性固形物:采用PAL-1手持糖度计测定;pH测定S220-K型pH计测定;色差值测定参考时宽芹[17]的方法,用CR-400/410 色彩色差仪测定草莓酒的L*,a*,b*值,饱和度和色调的计算如公式(1)和公式(2)所示:
饱和度![]()
(1)
色调![]()
(2)
1.3.3 挥发性香气成分测定
参考时宽芹[17]的方法并略作修改,采用顶空固相微萃取-气相色谱-质谱联用(headspace solid-phase microextraction-gas chromatograph-mass spectrometer, HS-SPME-GC-MS)技术进行测定。取8 mL酒样于40 mL顶空瓶中,再加入3 g NaCl和20 μL内标溶液(1 g/L 4-甲基-2-戊醇的乙醇溶液),在磁力搅拌器40 ℃下平衡10 min。将老化后的SPME萃取针插入顶空瓶中萃取45 min。取出SPME萃取针于GC前进样口解析10 min。
色谱条件:毛细管柱为HP-5 MS(30 m×0.25 mm×0.25 μm膜厚)。载气为氦气(纯度为99.99%),恒定流速1 mL/min,进样口温度230 ℃,不分流进样模式。柱箱升温程序:起始温度50 ℃,保持1 min,以3 ℃/min的速率升到200 ℃,不保持,再以8 ℃/min升到220 ℃,保持3 min。
质谱条件:电子轰击能量为70 eV。电离模式为EI;四级杆温度150 ℃,离子源温度230 ℃;质量扫描范围为20~450 m/z。
定性:利用AMDIS(auto-mated mass spectral deconvolution and identification system)计算挥发性化合物的保留指数(retention index, RI),结合NIST11数据库对挥发性成分进行初步鉴定,再结合相关文献进行图谱解析完成挥发物的最终定性。
定量:以4-甲基-2-戊醇为内标采用内标法按公式(3)对鉴定出的挥发性化合物进行半定量:
(3)
式中:C,分析物的相对质量浓度,μg/L;Ac,分析物峰面积;Ais,内标峰面积;Cis,内标物的质量浓度,μg/L。
1.3.4 挥发性成分香气相对活度值(relative odor activity value, ROAV)计算
待确定每个挥发性成分相对含量后,通过化合物嗅觉阈值汇编和文献检索每个挥发性成分的香气阈值,ROAV的计算如公式(4)所示:
(4)
式中:Ci,某一化合物的质量浓度,μg/L;Ti,某一化合物气味阈值,μg/L。
1.3.5 感官分析
草莓酒感官品质由85名食品专业学生及教师(33名男性,52名女性,年龄在22~40岁)采用9点喜好度方法评价。实验在安徽农业大学茶与食品科技学院食品感官审评室进行。采用感官测试软件App sense 5.0收集数据。评价前草莓酒酒样贮存于(18±2) ℃,评价时先于醒酒器中醒酒30 min,然后分装在125 mL专业果酒评酒杯中,每杯约20 mL,样品采用3位数随机编码进行标识,按照随机顺序将样品呈送给评价员。要求评价员对面前的标有编号的4个样品依次进行嗅闻,从9个语义词中选出最能体现自己对草莓酒喜好程度的描述,即9(极喜欢)、8(很喜欢)、7(喜欢)、6(有点喜欢)、5(谈不上喜不喜欢)、4(有点不喜欢)、3(不喜欢)、2(很不喜欢)、1(极不喜欢),然后根据嗅闻到的香气特征,写下每种草莓酒的感官香气描述词。
1.4 数据统计与分析
理化指标、挥发性香气成分均进行3次平行检测,结果以平均值±标准偏差形式呈现。理化指标、感官喜好性试验数据均用Excel 2021进行记录与处理,使用SPSS statistics 26进行单因素方差分析(one-way ANOVA)和邓肯多重比较分析检验(Duncan’s multiple range tests),P<0.05代表差异显著。在线网站Bioinformatics &Evolutionary Genomics(http://bioinformatics.psb.ugent.be/webtools/Venn/)绘制维恩图,通过Origin 2018b和Graphpad Pism 9.5绘制柱状图。
2 结果与分析
2.1 基本理化指标
经过3个月的陈酿期,草莓果酒的基本理化指标如表1所示。混菌发酵的草莓果酒酒精度为9.11%vol~10.51%vol,其中Td+K1组显著高于其他组。这与时宽芹[17]报道酿酒酵母(Aq)纯种发酵的草莓酒酒精度为9.91%vol的结果类似,说明非酿酒酵母Td的添加并未显著降低酒精的产量。可溶性固形物为5.80~6.23 °Brix,最低的是Td+F15组,其余3组差异不显著。除了Td+D254组,其他处理组还原糖含量均小于4.00 g/L,且各组间差异不显著,表明均能完全发酵。果酒在长时间的贮藏过程中,其pH值可能会影响酒体的色泽。各处理组的pH值为3.46~3.56,其中Td+F15组的pH值最高,但与其他组相比差异较小(约0.1)。
表1 不同酵母组合发酵草莓酒的基本理化指标
Table 1 Basic physicochemical indexes of strawberry wine fermented with different yeast combinations
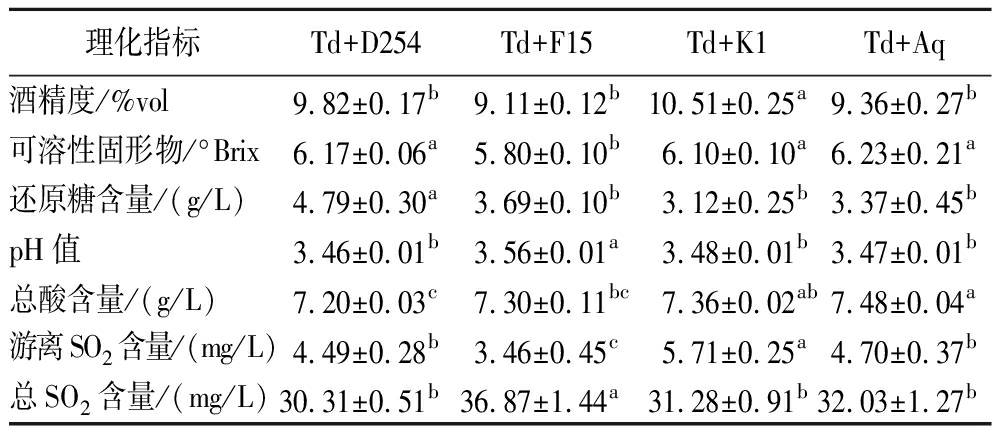
理化指标Td+D254Td+F15Td+K1Td+Aq酒精度/%vol9.82±0.17b9.11±0.12b10.51±0.25a9.36±0.27b可溶性固形物/°Brix6.17±0.06a5.80±0.10b6.10±0.10a6.23±0.21a还原糖含量/(g/L)4.79±0.30a3.69±0.10b3.12±0.25b3.37±0.45bpH值3.46±0.01b3.56±0.01a3.48±0.01b3.47±0.01b总酸含量/(g/L)7.20±0.03c7.30±0.11bc7.36±0.02ab7.48±0.04a游离SO2含量/(mg/L)4.49±0.28b3.46±0.45c5.71±0.25a4.70±0.37b总SO2含量/(mg/L)30.31±0.51b36.87±1.44a31.28±0.91b32.03±1.27b
注:同一行不同字母表示样品之间具有显著性差异(P<0.05)(下同)。
果酒中含有适量的酸有利于提高果酒口感的丰富性,还能起到稳定酒体,抑制杂菌的作用[18],总酸含量的微小差异可能会对口感产生较大影响。本研究中各组总酸介于7.20~7.48 g/L,其中Td+D254组总酸含量最低。SO2在果酒中起到杀菌、保持酸度和抗氧化的作用[19],根据存在方式分为游离SO2和结合SO2,果酒中主要是游离SO2发挥作用,但残留的SO2含量过高会使果酒硫味过重,而且危害人体健康。本研究所有处理组的SO2含量符合NY/T 1508—2017《绿色食品 果酒》标准要求(总SO2<250 mg/L)。
2.2 色度值
颜色是果酒品质的重要参数之一,通常发酵过程中花青素与其他黄酮类物质发生反应,生成更稳定的吡喃花青素,这些物质由于极性降低溶解性变差[20],导致果酒的颜色密度和红色度降低,同时增加黄色度。另外由于酵母细胞壁吸收花青素,也会影响酒体的色度[21]。本研究所有处理组的草莓酒酒体呈现澄清透明的淡红色(表2)。从表2可以看出,4个处理组的L*值差异不大;Td+Aq组a*值显著高于其他组,说明酒体颜色偏红程度最高。Td+D254组与Td+Aq组的b*值显著高于其他2组。C*值和h值分别反映果酒酒体颜色的饱和度和色调。综合来看,各处理组之间的色调相似,Td+Aq组与Td+D254组的颜色饱和度相对较高。
表2 不同酵母组合发酵草莓酒的色度值
Table 2 The color values of strawberry wine fermented with different yeast combinations
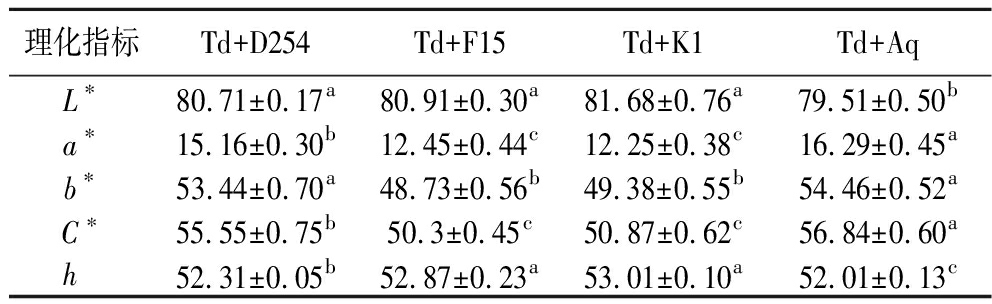
理化指标Td+D254Td+F15Td+K1Td+AqL∗80.71±0.17a80.91±0.30a81.68±0.76a79.51±0.50ba∗15.16±0.30b12.45±0.44c12.25±0.38c16.29±0.45ab∗53.44±0.70a48.73±0.56b49.38±0.55b54.46±0.52aC∗55.55±0.75b50.3±0.45c50.87±0.62c56.84±0.60ah 52.31±0.05b52.87±0.23a53.01±0.10a52.01±0.13c
2.3 挥发性香气成分分析
2.3.1 挥发性香气成分初步分析
香气成分对果酒的感官特征和综合品质起着十分重要的作用。本研究采用HS-SPME-GC-MS方法,在4种混菌模式下草莓酒中共检测到67种化合物(附表1, https://doi.org/10.13995/j.cnki.11-1802/ts.0368,下同),包括17种酯类、14种醇类、10种酸类、8种萜烯类、7种酮类、6种醛类及5种其他物质。不同混菌模式草莓果酒中挥发性香气物质的组成和含量存在显著差异。从种类上来看,Td+D254组中检测到最多种类的挥发性物质(共48种),尤其是萜烯类化合物较多(图1-A)。一般萜烯类化合物具有独特的香气和味道,可为果酒增添复杂的风味和层次感。酯类化合物主要包括乙酯和乙酸酯类,是果酒中的重要香气化合物,这些物质可以增加果酒的口感和丰富度[17]。Td+F15组的草莓果酒中酯类化合物种类多于其他组。而Td+K1组和Td+Aq组的化合物数量相对较少,分别为38种和40种。
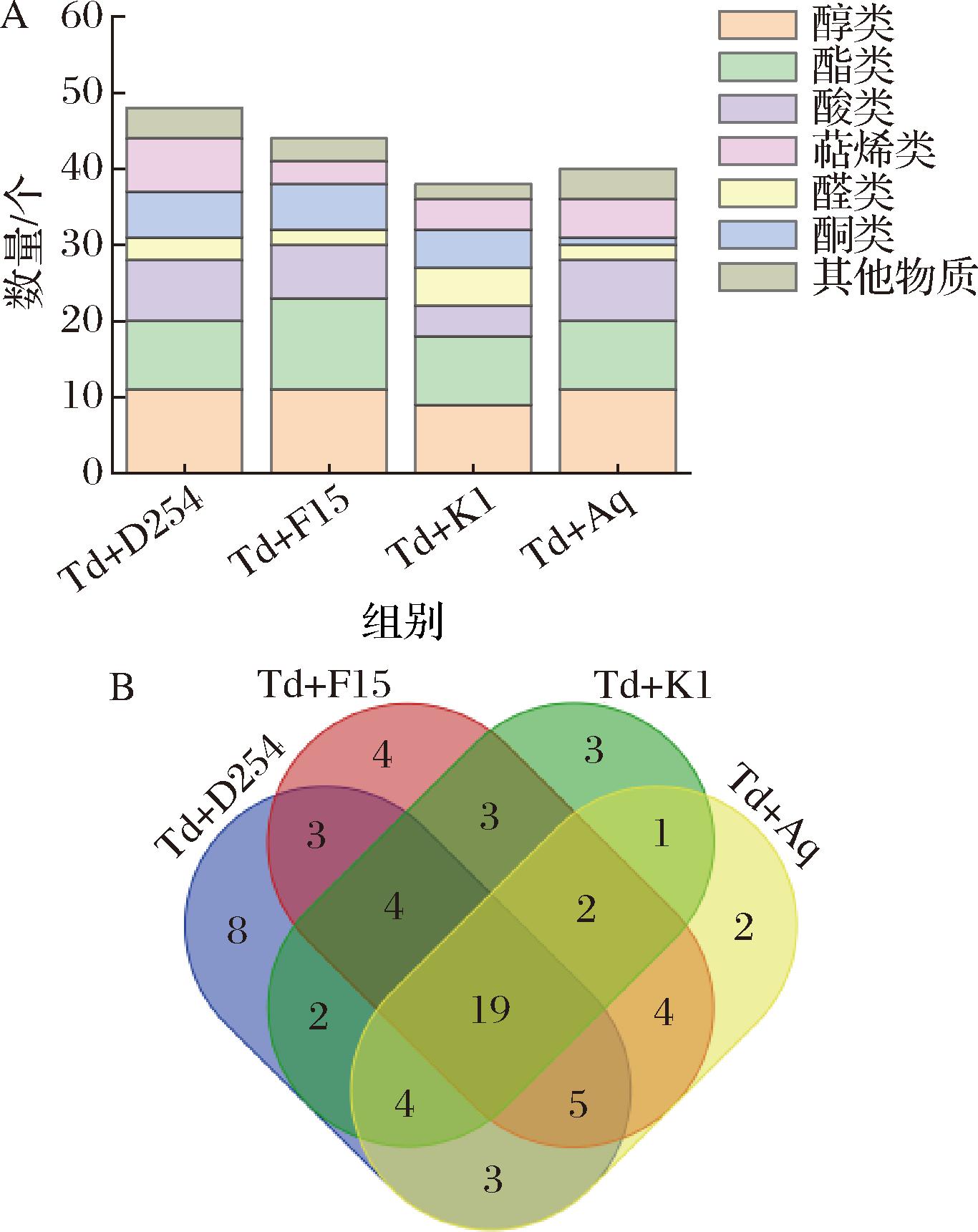
A-挥发性化合物种类数量;B-韦恩图
图1 不同酵母组合发酵草莓酒的挥发性化合物种类 数量及韦恩图
Fig.1 Number of volatile compounds in fermented strawberry wine with different yeast combinations and Venny diagram
进一步通过韦恩图分析不同混菌模式发酵草莓酒中挥发性物质种类的差异(图1-B),结果表明4种酒样中共有19种化合物,主要是高级醇类(如正己醇、正庚醇、苯乙醇、1-壬醇、1-辛醇和3-苯丙醇等),和挥发性脂肪酸类(如己酸、壬酸、正癸酸等),说明这些化合物对草莓酒共同的香气和风味具有重要贡献。另外不同组别之间也有少数几种共有的化合物,同时还分别产生了独特的化合物。其中,Td+D254组独有8种物质,包括月桂酸、2-癸酮、1-辛烯、葫芦烯等,这些物质对果酒的品质有积极地作用。如月桂酸可以提高果酒的口感和丰富性,让果酒更加柔和和饱满[22];2-癸酮具有水果香气和甜味,同时还具有抗氧化和抗菌作用,有助于保持果酒的新鲜度和稳定性。
从香气物质含量上来看,Td+D254组草莓酒中醇类、酸类化合物含量显著高于其他组;Td+K1组中醛类、酮类物质含量显著高于其他组,而萜烯类物质显著低于其他组(图2)。高级醇是果酒中重要的香气成分,由糖的分解代谢、氨基酸的脱氨作用和α-酮酸的脱羧作用产生,酵母类型、水果品种和发酵条件等严重影响着高级醇的产量[23]。适量的高级醇可以赋予酒体醇香并增强其协调性,如苯乙醇有玫瑰般芳香气味,衬托酯香;异戊醇具有麦芽和酒精的气味,增强酒香[24]。本研究共检测到14种醇类化合物,包括正己醇正庚醇、1-辛醇、1-壬醇、苯乙醇等,且醇类物质含量最高,均在20 000 μg/L以上。其中Td+D254组的正丙醇、正庚醇、苯乙醇含量等显著高于其他处理组。
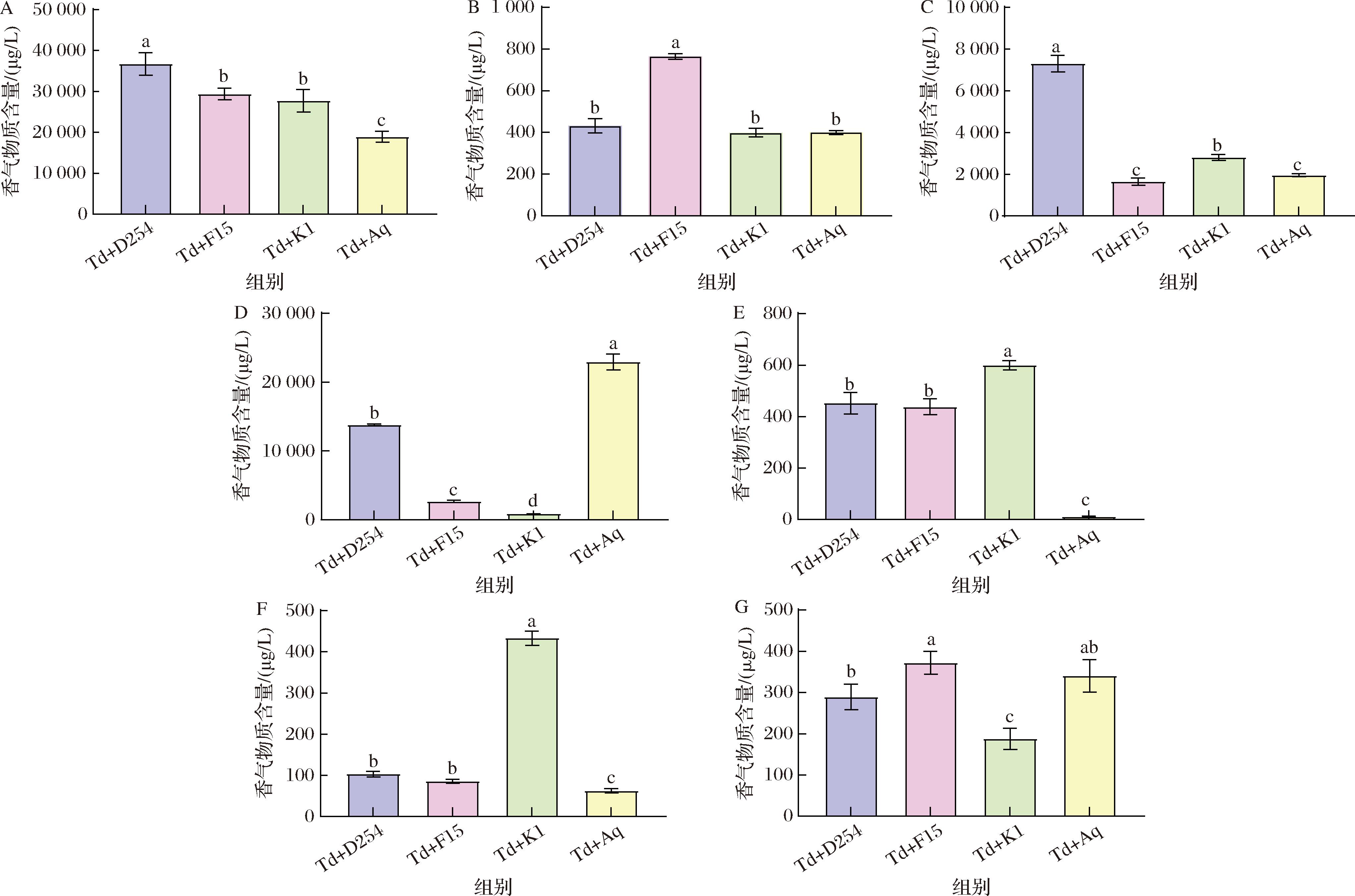
A-醇类;B-酯类;C-酸类;D-萜烯类;E-酮类;F-醛类;G-其他物质
图2 不同酵母组合发酵草莓酒中挥发性化合物含量
Fig.2 Volatile compounds in strawberry wine fermented with different yeast combinations
注:不同小写字母表示差异显著(P<0.05)(下同)。
除了醇类化合物,酯类化合物对果酒的水果香和花香具有重要贡献,通常混合发酵会增加整体酯类的种类和含量,这是由于在长期的发酵过程中醇类发生酯化,转化为酯类物质,这种转化使得酯类不断积累,极大地促进了发酵产生的果酒香气[10]。本研究共检测出17种酯类化合物,包括乙酸丙酯、乙酸异丁酯、己酸异戊酯、水杨酸甲酯等,含量为398.95~764.45 μg/L,其中Td+F15组中酯类化合物种类最多(12种),并且在含量上也具有明显的优势(图2-B)。17种酯类化合物中,水杨酸甲酯是主要的活性化合物,它被报道为蓝莓果实的特征性香气[25],可能为果酒提供鲜果果香。
酸类物质是果酒中香气复杂性和平衡味觉的主要挥发性物质,可以带来清爽的口感,但浓度过高时易引起不良的风味[15]。本研究中共检测出10种挥发性酸类物质,包括乙酸、丁酸、己酸、辛酸等。Td+D254处理组的酸类物质总量显著高于其他3个处理组。萜烯类化合物是一类具有较强香气和生理活性的烃类化合物,对果酒的香气具有积极作用[26]。在混菌发酵草莓酒中共检测到8种,包括苯乙烯、柠檬烯和香叶醇等。Td+D254组萜烯类化合物数量最多,Td+Aq处理组中萜烯类物质含量最高,尤其是苯乙烯、柠檬烯含量显著高于其他处理组。
除了主要的高级醇类、酯类和挥发性脂肪酸类化合物外,一些醛、酮类化合物对果酒的香气也会产生一定的影响。醛类物质多具有脂肪、青气和化学物质的刺激性,酮类物质与酒的香型密切相关,Td+K1组中醛类和酮类物质含量较多。
2.3.2 主要呈香物质主成分分析
ROAV表示挥发性香气物质的相对浓度与该化合物呈香阈值的比值,该值越大表示某物质对香气的贡献程度越大[27]。一般认为OAV>1的化合物对果酒的香气贡献较为显著,而OAV>0.1的化合物可能表现出协同作用,有助于形成果酒的风味[28]。主成分分析(principal component analysis, PCA)可以将多维数据降维成二维图形,同时展示不同变量之间的相关性[16]。对ROAV>0.1的19种香气活性化合物进行PCA分析,结果见图3。PCA解释了累计贡献率的71.8%,PC1与PC2分别占总差异的41.6%和30.2%。非酿酒酵母Td与不同酿酒酵母混合发酵,可以产生独特的气味活性化合物,从而使草莓果酒产生不同的风味特征。Td+Aq处理组与苯乙烯、1-壬醇、香叶醇及1-辛醇等4种香气化合物聚集在第一象限,果香与花香突出。苯乙烯具有最高的气味贡献度,具有花香和糖果甜香,赋予草莓酒浓郁的甜香。除了苯乙烯,萜烯类物质如香叶醇的贡献也较大,赋予果酒百香果、桃子、玫瑰香气等果香和花香。Td+F15组单独位于第一主成分的负向端,油酸乙酯、水杨酸甲酯和苯乙醛等含量丰富。Td+K1和Td+D254均位于第四象限,说明这2种混菌模式下产生的挥发性活性化合物比较相似,而且与辛酸、壬醛、S-(-)-2-甲基-1-丁醇等密切相关,这些化合物往往给果酒带来果味、清爽风味[29]。
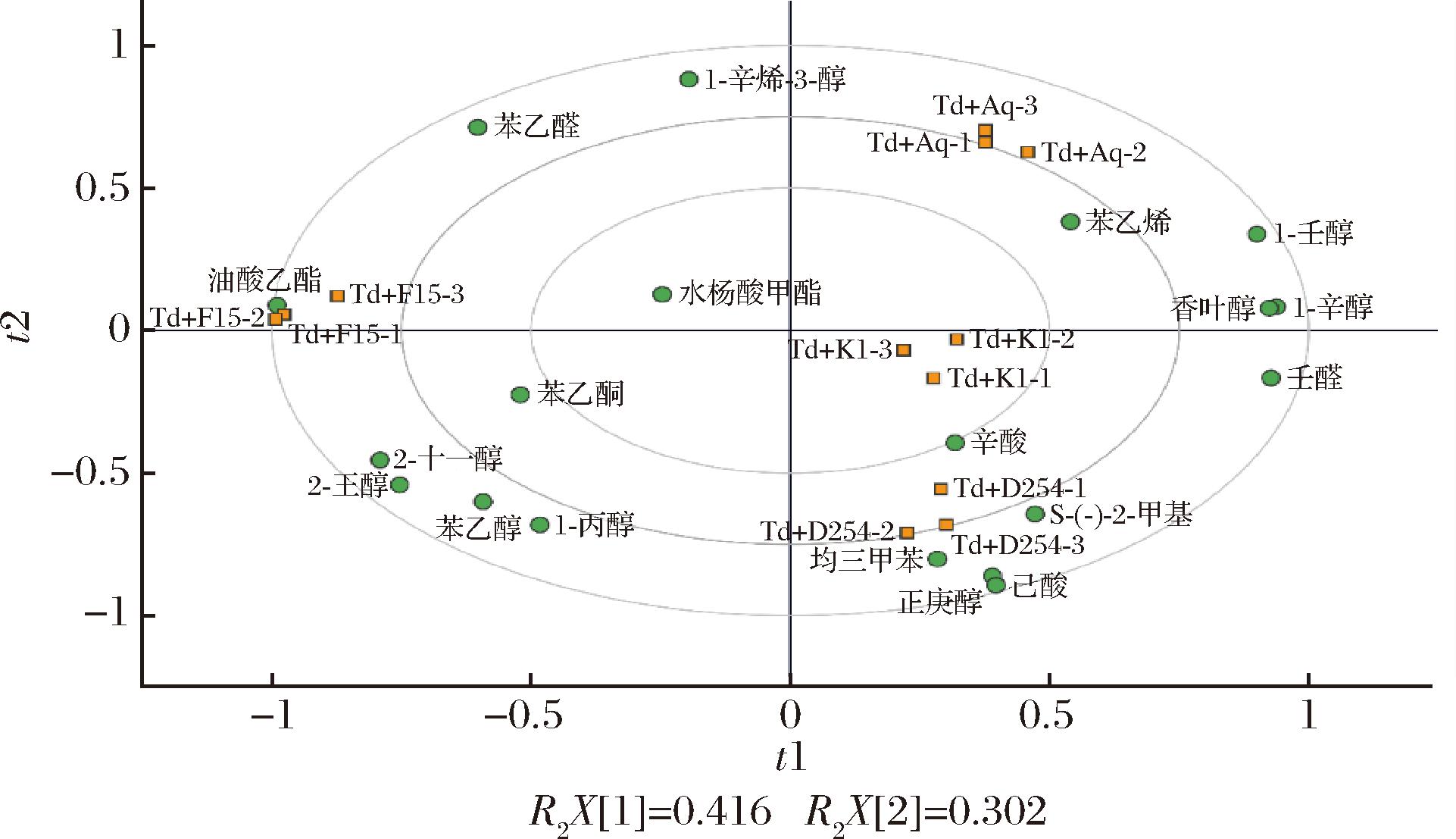
图3 不同酵母组合发酵草莓酒中活性香气化合物主成分分析
Fig.3 Principal components analysis for aroma-active compounds variables in strawberry wines fermented by different yeast combinations
2.4 喜好度评价
感官评价可以直接衡量草莓酒的香气品质,反映消费者的喜好程度。根据香气描述词的频次百分比,可以看出“醇香”、“甜香”“果香”、“酸气”、“草莓”是消费者使用较多的描述词(图4-A),为草莓酒的主要风味特征。消费者普遍认为混菌发酵草莓酒的香气是令人舒适的,具有一定的层次感,平均喜好度都超过5.5(图4-B)。消费者对Td+D254处理组的喜好度最高,因为大多数消费者认为这款酒具有较强的果香、青爽气,并且具有一定的花香;其次是Td+F15处理组,此款酒消费者感受到较强的草莓香与甜香;Td+K1处理组的喜好度最低,可能是因为醇香过于浓郁,刺鼻不适。
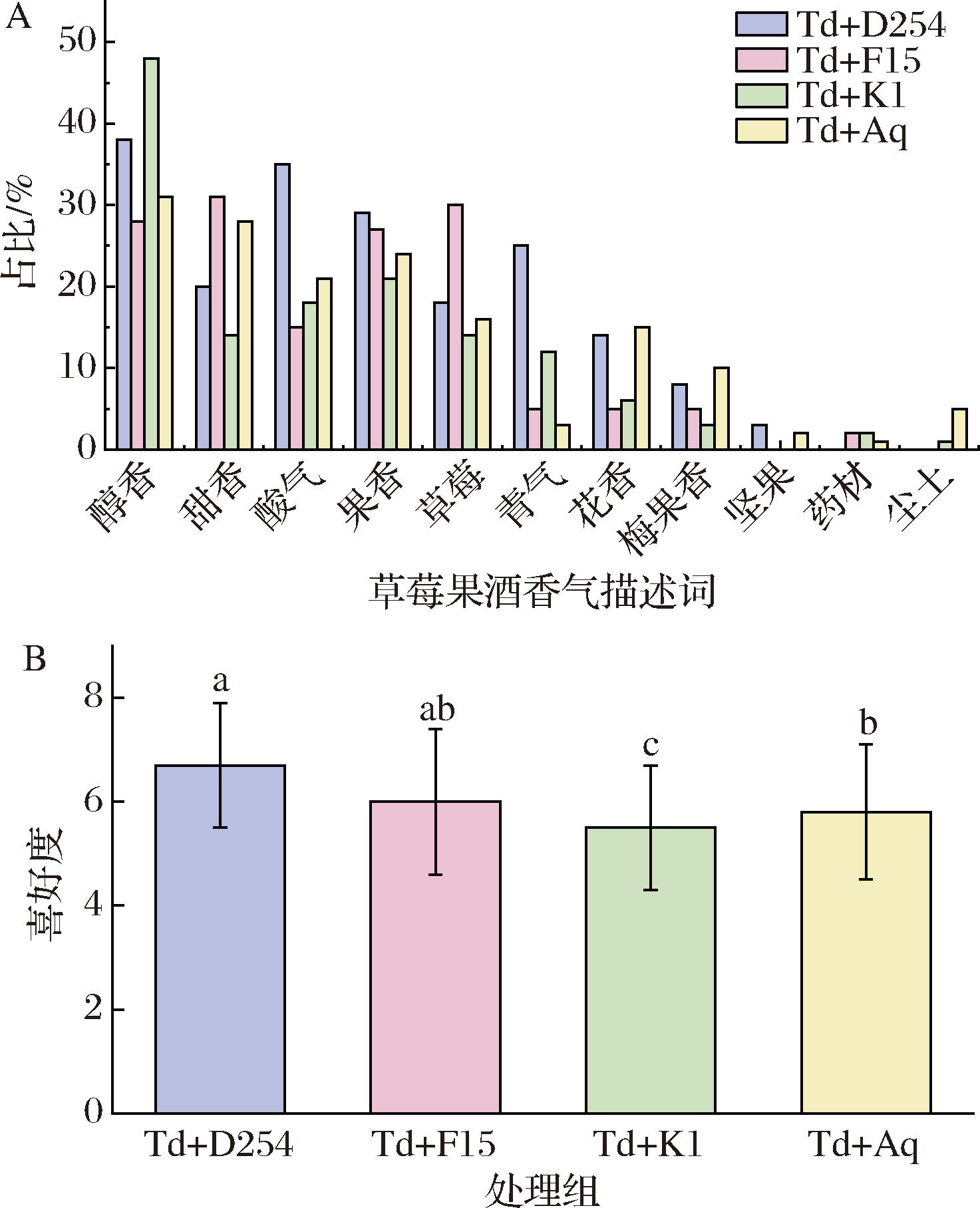
A-出现频率;B-喜好度测试结果
图4 不同酵母组合发酵草莓酒香气描述词的出现频率和 喜好度测试结果
Fig.4 The frequency of aroma descriptors and overall liking test of fermented strawberry wines with different yeast combinations
3 结论
研究分析了非酿酒酵母Td与不同种商业酿酒酵母顺序接种混合发酵对草莓果酒理化特性与挥发性香气的影响。结果表明,不同混菌模式下草莓果酒的色度及挥发性香气物质有显著性差异。Td与Aq、D254顺序接种发酵使草莓果酒获得更高的红度和饱和度。在香气成分方面,通过GC-MS共检测到67种挥发性物质,主要是酯类、醇类和酸类;通过韦恩图分析,发现4种酒样中共有香气组分19种,其中Td+D254组产生的香气化合物最多,共48种。主要呈香物质为(ROAV>0.1)苯乙烯、苯乙醛、正庚醇、壬醛、辛酸、水杨酸甲酯等对草莓酒具有较高的气味贡献度。主成分分析表明,Td+K1组和Td+D254组2种混菌模式下产生的挥发性活性化合物相似,而且与辛酸、壬醛、S-(-)-2-甲基-1-丁醇等密切相关。Td+Aq组果酒与苯乙烯、香叶醇及1-辛醇等活性香气化合物密切相关,这些物质提升了草莓酒的果香与甜香风味;消费者喜好度检验结果表明,Td+D254组草莓酒具有较强的果香、青爽味与花香,获得最高的喜好度为6.7±1.2。综上,将非酿酒酵母Td与酿酒酵母Aq顺序组合发酵具有为草莓果酒提高香气品质的应用潜力,但其增加草莓果酒香气成分的机理仍需进一步研究。
[1]  LVAREZ-FERN
LVAREZ-FERN NDEZ M A, CEREZO A B, CA
NDEZ M A, CEREZO A B, CA ETE-RODR
ETE-RODR GUEZ, A M, et al.Composition of nonanthocyanin polyphenols in alcoholic-fermented strawberry products using LC-MS (QTRAP), high-resolution MS (UHPLC-Orbitrap-MS), LC-DAD, and antioxidant activity[J].Journal of Agricultural and Food Chemistry, 2015, 63(7):2041-2051.
GUEZ, A M, et al.Composition of nonanthocyanin polyphenols in alcoholic-fermented strawberry products using LC-MS (QTRAP), high-resolution MS (UHPLC-Orbitrap-MS), LC-DAD, and antioxidant activity[J].Journal of Agricultural and Food Chemistry, 2015, 63(7):2041-2051.
[2] SONG Y Y, ZHANG Y J, LIU N, et al.Volatile compounds in wild strawberry and their odorants of wild strawberry wines:Effects of different stages of fermentation[J].International Journal of Food Properties.2017, 20(sup1):S399-S415.
[3] TONDINI F, LANG T, CHEN L, et al.Linking gene expression and oenological traits:Comparison between Torulaspora delbrueckii and Saccharomyces cerevisiae strains[J].International Journal of Food Microbiology, 2019, 294:42-49.
[4] 刘沛通, 丁子元, 于庆泉, 等.优良本土酿酒酵母的酿造特性研究[J].中国食品学报, 2023, 23(1):204-215.
LIU P T, DING Z Y, YU Q Q, et al.Studies on oenological characteristics of high-quality Chinese indigenous Saccharomyces cerevisiae strains[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(1):204-215.
[5] DUARTE F L, EGIPTO R, BALEIRAS-COUTO M M.Mixed fermentation with Metschnikowia pulcherrima using different grape varieties[J].Fermentation, 2019, 5(3):59.
[6] WEI J P, ZHANG Y X, WANG Y W, et al.Assessment of chemical composition and sensorial properties of ciders fermented with different non-Saccharomyces yeasts in pure and mixed fermentations[J].International Journal of Food Microbiology, 2020, 318:108471.
[7] LIU J, LIU M, YE P, et al.Characterization of major properties and aroma profile of kiwi wine co-cultured by Saccharomyces yeast (S.cerevisiae, S.bayanus, S.uvarum) and T.delbrueckii[J].European Food Research and Technology,2020, 246(4):807-820.
[8] 徐青柳. 非酿酒酵母菌株筛选及其与酿酒酵母混合发酵对蓝莓酒品质的影响[D].雅安:四川农业大学, 2021.
XU Q L.Screening of non-Saccharomyces cerevisiae strains and the effect of mixed fermentation with Saccharomyces cerevisiae on blueberry wine quality[D].Ya′an:Sichuan Agricultural University, 2021.
[9] 任学梅, 姚红红, 严幻汝, 等.高产糖苷酶非酿酒酵母菌株筛选、鉴定及其发酵过程中酶活性变化[J].食品科学, 2022, 43(20):198-206.
REN X M, YAO H H, YAN H R, et al.Screening and identi cation of non-Saccharomyces yeast strains with high glycosidase production and changes in enzyme activities during their fermentation[J].Food Science, 2022, 43(20):198-206.
cation of non-Saccharomyces yeast strains with high glycosidase production and changes in enzyme activities during their fermentation[J].Food Science, 2022, 43(20):198-206.
[10] ZHANG P Z, ZHANG R G, SIRISENA S, et al.Beta-glucosidase activity of wine yeasts and its impacts on wine volatiles and phenolics:A mini-review[J].Food Microbiology, 2021, 100:103859.
[11] 战吉宬, 曹梦竹, 游义琳, 等.非酿酒酵母在葡萄酒酿造中的应用[J].中国农业科学, 2020, 53(19):4057-4069.
ZHAN J C, CAO M Z, YOU Y L, et al.Research advance on the application of non-Saccharomyces in winemaking[J].Scientia Agricultura Sinica, 2020, 53(19):4057-4069.
[12] LI S Q, BI P F, SUN N, et al.Effect of sequential fermentation with four non-Saccharomyces and Saccharomyces cerevisiae on nutritional characteristics and flavor profiles of kiwi wines[J].Journal of Food Composition and Analysis, 2022, 109:104480.
[13] OLIVEIRA I, FERREIRA V.Modulating fermentative, varietal and aging aromas of wine using non-Saccharomyces yeasts in a sequential inoculation approach[J].Microorganisms, 2019, 7(6):164.
[14] BENITO S.The impact of Torulaspora delbrueckii yeast in winemaking[J].Applied Microbiology &Biotechnology, 2018, 102(7):3081-3094.
[15] WANG Y, QI X Y, FU Y, et al.Effects of Torulaspora delbrueckii co-fermented with Saccharomyces cerevisiae on physicochemical and aromatic profiles of blueberry fermented beverage[J].Food Chemistry.2023, 409:135284.
[16] YANG W, LIU S X, MARSOL-VALL A, et al.Chemical composition, sensory profile and antioxidant capacity of low-alcohol strawberry beverages fermented with Saccharomyces cerevisiae and Torulaspora delbrueckii[J].LWT, 2021, 149:111910.
[17] 时宽芹. 草莓品种对其发酵酒理化性质与感官品质的影响研究[D].合肥:安徽农业大学, 2020.
SHI K Q.Effects of strawberry breeds on the physicochemical properties and sensory quality of wine[D].Hefei:Anhui Agricultural University, 2020.
[18] 屈嫒, 满都拉, 孙子羽, 等.不同酵母菌株发酵蓝莓酒有机酸的动态变化研究[J].食品研究与开发, 2020, 41(8):199-204. QU A, MAN D L, SUN Z Y, et al.Dynamic changes of organic acids in blueberry wine fermented by different yeast strains[J].Food Research and Development, 2020, 41(8):199-204.
[19] 荆红彭, 刘明, 陈晓明, 等.二氧化硫对蓝莓酒发酵动力学及品质变化的影响[J].食品与发酵工业, 2021, 47(21):73-78. JING H P, LIU M, CHEN X M, et al.Effect of sulfur dioxide on fermentation kinetics and quality of blueberry wine[J].Food and Fermentation Industries, 2021, 47(21):73-78.
[20] BENITO S, MORATA A, PALOMERO F, et al.Formation of vinylphenolic pyranoanthocyanins by Saccharomyces cerevisiae and Pichia guillermondii in red wines produced following different fermentation strategies[J].Food Chemistry, 2011, 124(1):15-23.
[21] ![]() J T, BUTINAR L, ALBREHT A, et al.The impact of Saccharomyces and non-Saccharomyces yeasts on wine colour:A laboratory study of vinylphenolic pyranoanthocyanin formation and anthocyanin cell wall adsorption[J].LWT, 2020, 123:109072.
J T, BUTINAR L, ALBREHT A, et al.The impact of Saccharomyces and non-Saccharomyces yeasts on wine colour:A laboratory study of vinylphenolic pyranoanthocyanin formation and anthocyanin cell wall adsorption[J].LWT, 2020, 123:109072.
[22] 李涛, 李昀哲, 冯翰杰, 等.不同发酵工艺对石榴酒香气质量的影响[J].食品与发酵工业, 2023, 49(8):137-147.
LI T, LI Y Z, FENG H J, et al.Effect of different fermentation processes on aroma quality of pomegranate wine[J].Food and Fermentation Industries, 2023, 49(8):137-147.
[23] JIANG Y, LUO T, TANG Y, et al.Isolation of a novel characterized Issatchenkia terricola from red raspberry fruits on the degradation of citric acid and enrichment of flavonoid and volatile profiles in fermented red raspberry juice[J].Food Science and Human Wellness, 2022, 11(4):1018-1027.
[24] ZHANG B Q, LIU H, XUE J, et al.Use of Torulaspora delbrueckii and Hanseniaspora vineae co-fermentation with Saccharomyces cerevisiae to improve aroma profiles and safety quality of Petit Manseng wines[J].LWT, 2022, 161:113360.
[25] 陈昌琳, 孙小钦, 钟程操, 等.四川地区不同蓝莓品种的品质评价及香气成分分析[J].食品与发酵工业, 2022, 48(19):264-271.
CHEN C L, SUN X Q, ZHONG C C, et al.Quality evaluation and aroma components analysis of different blueberry cultivars in Sichuan[J].Food and Fermentation Industries, 2022, 48(19):264-271.
[26] LIU F T, LI S J, GAO J H, et al.Changes of terpenoids and other volatiles during alcoholic fermentation of blueberry wines made from two southern highbush cultivars[J].LWT, 2019, 109:233-240.
[27] XIAO Z B, LIU J H, CHEN F, et al.Comparison of aroma-active volatiles and their sensory characteristics of mangosteen wines prepared by Saccharomyces cerevisiae with GC-olfactometry and principal component analysis[J].Natural Product Research, 2015, 29(7):656-662.
[28] SUN N, GAO Z Y, LI S Q, et al.Assessment of chemical constitution and aroma properties of kiwi wines obtained from pure and mixed fermentation with Wickerhamomyces anomalus and Saccharomyces cerevisiae[J].Journal of the Science of Food and Agriculture, 2022, 102(1):175-184.
[29] 王娟, 孙瑞, 王桂霞, 等.8个草莓品种(系)果实特征香气成分比较分析[J].果树学报, 2018, 35(8):967-976.
WANG J, SUN R, WANG G X, et al.A comparative analysis on fruit characteristic aroma compounds in eight strawberry varieties (strains)[J].Journal of Fruit Science, 2018, 35(8):967-976.