大黄鱼(Larimichthys crocea),属硬骨鱼纲,又名黄瓜鱼[1]。鱼卵作为大黄鱼加工过程中的主要副产物之一,含有丰富的蛋白质及脂质。LIANG等[2]通过分析大黄鱼鱼卵的脂质组成及含量发现其富含磷脂,且脂肪酸组成分析表明鱼卵中的磷脂包含丰富的n-3多不饱和脂肪酸(n-3 polyunsaturated fatty acid, n-3 PUFAs),尤其是二十碳五烯酸(eicosapentaenoic acid, EPA)和二十二碳六烯酸(docosahexaenoic acid, DHA)。课题组前期研究发现,大黄鱼鱼卵磷脂(large yellow croaker roe phospholipids, LYCRPLs)能够改善由高脂饮食引起的大鼠脂质代谢紊乱[3];HUANG等[4]对比了鱼卵磷脂与传统磷脂的乳化稳定性,表明鱼卵磷脂具有更优的乳化活性;ZHANG等[5]考察了鱼卵磷脂的热稳定性,为鱼卵磷脂作为具有抗氧化活性的新型食品添加剂奠定了理论基础。此外,陈文娟等[6]发现鱼卵磷脂具有清除羟自由基的能力,效果与维生素C接近。
因鱼油中脂肪酸含有多个不饱和双键导致其极不稳定,易发生氧化。鱼油氧化进程中涉及多不饱和脂肪酸长链分解,导致营养损失和产生不良气味,摄入后对人体不利,严重限制了其高值化利用[7]。通过喷雾干燥对鱼油进行微胶囊化是防止脂质氧化及减少其不良气味的一种策略。微胶囊的囊壁一般为天然或合成的高分子物质,大豆分离蛋白(soy protein isolate, SPI)具有乳化性、保水性等诸多功能特性,但是单独使用不利于微胶囊的稳定性。麦芽糊精(maltodextrin, MD)黏度高,包封脂质时稳定性强,但缺乏微胶囊化所需的界面性能,通常与蛋白质或胶质材料混配[8]。由于单一壁材包埋微胶囊存在缺陷,因此在实际操作生产中常使用2种及以上材料作复合壁材[9]。使用具有优异性能的壁材和芯材能够封装大部分油脂并且使核心材料实现高保留,因此采用喷雾干燥对鱼油进行微胶囊化具有可行性[10]。
实验以大黄鱼鱼卵磷脂-鱼油作为芯材,大豆分离蛋白/麦芽糊精作为复合壁材,采用喷雾干燥制备大黄鱼鱼卵磷脂-鱼油微胶囊,比较了贮藏过程中鱼油和大黄鱼鱼卵磷脂-鱼油微胶囊的挥发性成分及稳定性的变化,旨在为开发鱼油微胶囊产品提供理论依据。
1 材料与方法
1.1 材料与试剂
大黄鱼鱼卵磷脂,参照许艳萍等[11]的提取方法制备;鱼油,福建海富特生物科技股份有限公司;大豆分离蛋白,河南万邦化工科技有限公司;麦芽糊精,河南华瑞生物科技;正己烷(色谱纯),德国默克公司;石油醚、95%乙醇、可溶性淀粉、硫代硫酸钠、三氯甲烷、冰乙酸、碘化钾,均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
FB-110Q型超高压纳米均质机,上海励途机械设备工程有限公司;HN-3K型手持均质机,上海汗诺仪器有限公司;YC-500型实验室喷雾干燥机,上海雅程仪器设备有限公司;STA449C-6-G型同步热分析仪,德国耐驰仪器制造有限公司;TQ8050型气相色谱质谱联用仪,日本岛津科学器械有限公司。
1.3 实验方法
1.3.1 大黄鱼鱼卵磷脂-鱼油微胶囊的制备
通过前期实验,取质量比为1∶2的大豆分离蛋白和麦芽糊精复配溶解于蒸馏水作为复合壁材,初步均质后加入0.4%(质量分数)大黄鱼鱼卵磷脂-鱼油作为芯材,芯壁比为1∶1.6 (体积比)。通过高压均质得到均匀的乳液,采用喷雾干燥法制备微胶囊。喷雾干燥条件:进样流速4 r/min,进风温度160 ℃,出风温度保持在100~110 ℃。
1.3.2 挥发性成分分析
固相微萃取条件:取鱼油及大黄鱼鱼卵磷脂-鱼油微胶囊样品各2 g,置于20 mL顶空瓶中密封。60 ℃水浴10 min,在样品瓶顶空处放置充分老化的萃取纤维头吸附30 min,随后将萃取纤维头插入GC-MS进样口进行解析。
GC-MS条件:色谱柱为HP-5MS柱(30 m×0.25 mm, 0.25 μm);载气为氦气,进量1.3 mL/min;进样口温度250 ℃;气相色谱烘箱50 ℃保持2 min;升温程序:初始温度4 ℃/min升至160 ℃/min,再以20 ℃/min升至280 ℃/min,保持2 min。MS条件:EI离子源,离子源温度200 ℃,电子能量70 eV,质量范围35~550 AMU/s,GC-MS接口温度280 ℃。
定性与定量分析:通过计算机检索与NIST 14标准质谱图进行对照分析,结合保留指数(retention index,RI)对往返匹配度大于800的挥发性化合物进行定性。采用峰面积归一化法进行定量。
1.3.3 关键挥发性物质分析
针对鱼油及大黄鱼鱼卵磷脂-鱼油微胶囊中RI>800的挥发性物质进行相对气味活度值(relative odor activity value,ROAV)分析,参照刘登勇等[12]提出的方法计算样品中关键挥发性物质的ROAV;定义对样品总体风味贡献最大组分ROAVstan=100,定义ROAV≥1的挥发性物质为关键风味物质;当0.1≤ROAV<1时,该物质对总体风味起修饰作用。ROAV越大说明对整体风味贡献越大,本研究仅选取ROAV≥1的挥发性风味物质进行分析。计算如公式(1)所示:
(1)
式中:Cstan,对样品风味贡献最大组分的相对百分含量,%;Tstan,对样品风味贡献最大组分的感官阈值,μg/kg;C,样品各组分相对百分含量,%;T,样品各组分对应的感官阈值,μg/kg。
1.3.4 大黄鱼鱼卵磷脂-鱼油微胶囊氧化稳定性分析
参照GB 5009.227—2023《食品安全国家标准 食品中过氧化值的测定》滴定法,将鱼油及磷脂-鱼油微胶囊样品置于(60±5) ℃恒温干燥箱中贮藏,每2 d测定样品过氧化值(peroxidation value,POV),连续测定10 d。各组样品平行测定3次,结果以平均值±标准差表示。
1.3.5 大黄鱼鱼卵磷脂-鱼油微胶囊热稳定性分析
通过同步热分析仪对鱼油及磷脂-鱼油微胶囊的热稳定性进行分析。仪器操作条件:气氛为氮气,流量为20 mL/min,升温速度为10 ℃/min。
1.4 数据处理
采用Excel软件进行数据录入;SPSS 20.0软件进行实验数据分析;Origin 9.1软件进行作图。
2 结果与分析
2.1 大黄鱼鱼卵磷脂-鱼油微胶囊挥发性物质结果与分析
采用顶空固相微萃取结合GC-MS技术分析鉴定鱼油及磷脂-鱼油微胶囊中的挥发性物质,结果如表1和表2所示。鱼油样品中检出46种挥发性物质,包括醇类4种、酮类6种、醛类14种、烷烃类4种、烯烃类3种、酯类10种、酸类4种、其他类1种。磷脂-鱼油微胶囊样品中检出70种挥发性物质,包括醇类10种、酮类10种、醛类16种、烷烃类8种、烯烃类4种、酯类14种、酸类5种、其他类3种。挥发性物质对风味的贡献是由其在风味体系中的浓度和感觉阈值共同决定的,贮藏过程中n-3、n-6和n-9族PUFAs的氧化分解与水产品腥味的形成密切相关[13],结合表1和表2可以发现贮藏前后的鱼油和磷脂-鱼油微胶囊样品产生的挥发性风味物质存在一定差异。
表1 鱼油及大黄鱼鱼卵磷脂-鱼油微胶囊的挥发性成分分析结果
Table 1 Analysis results of volatile substances of fish oil and large yellow croaker roe phospholipids-fish oil microcapsules
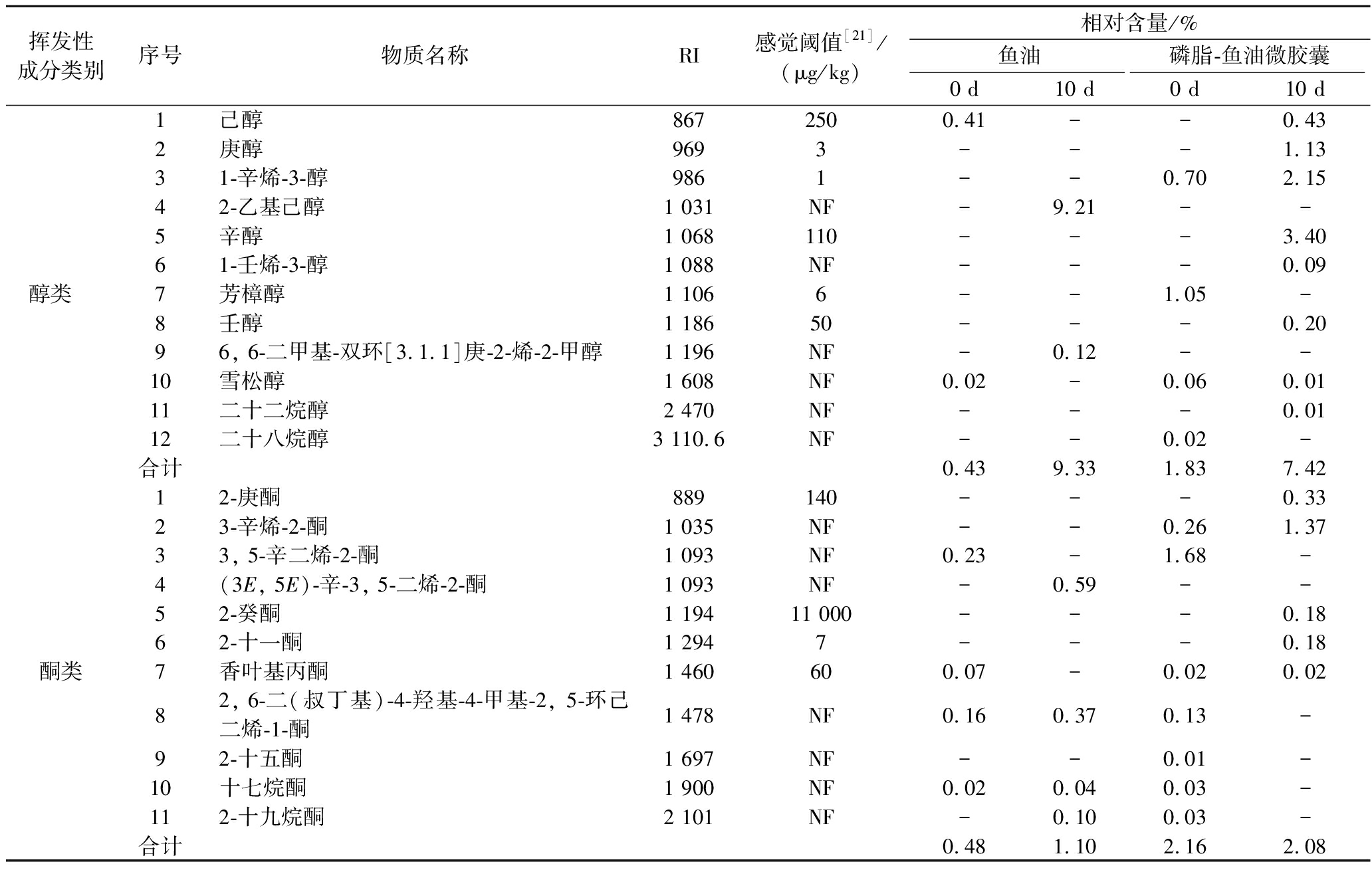
挥发性成分类别序号物质名称RI感觉阈值[21]/(μg/kg)相对含量/%鱼油磷脂-鱼油微胶囊0 d10 d0 d10 d醇类 1己醇8672500.41--0.432庚醇9693---1.1331-辛烯-3-醇9861--0.702.1542-乙基己醇1 031NF-9.21--5辛醇1 068110---3.4061-壬烯-3-醇1 088NF---0.097芳樟醇1 1066--1.05-8壬醇1 18650---0.2096, 6-二甲基-双环[3.1.1]庚-2-烯-2-甲醇1 196NF-0.12--10雪松醇1 608NF0.02-0.060.0111二十二烷醇2 470NF---0.0112二十八烷醇3 110.6NF--0.02-合计0.439.331.837.42酮类12-庚酮889140---0.3323-辛烯-2-酮1 035NF--0.261.3733, 5-辛二烯-2-酮1 093NF0.23-1.68-4(3E, 5E)-辛-3, 5-二烯-2-酮1 093NF-0.59--52-癸酮1 19411 000---0.1862-十一酮1 2947---0.187香叶基丙酮1 460600.07-0.020.0282, 6-二(叔丁基)-4-羟基-4-甲基-2, 5-环己二烯-1-酮1 478NF0.160.370.13-92-十五酮1 697NF--0.01-10十七烷酮1 900NF0.020.040.03-112-十九烷酮2 101NF-0.100.03-合计0.481.102.162.08
续表1
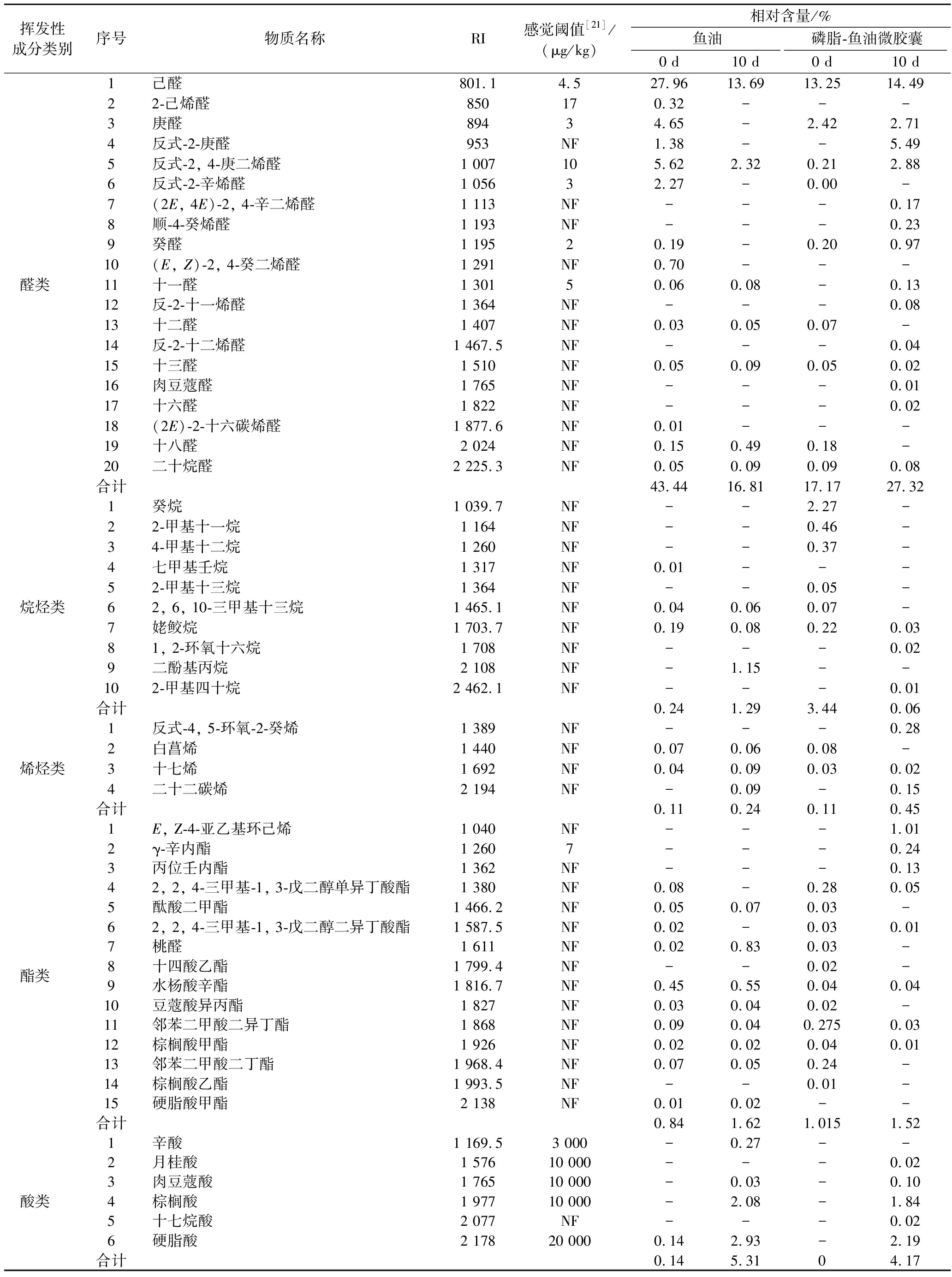
挥发性成分类别序号物质名称RI感觉阈值[21]/(μg/kg)相对含量/%鱼油磷脂-鱼油微胶囊0 d10 d0 d10 d醛类 1己醛801.14.527.9613.6913.2514.4922-己烯醛850170.32---3庚醛89434.65-2.422.714反式-2-庚醛953NF1.38--5.495反式-2, 4-庚二烯醛1 007105.622.320.212.886反式-2-辛烯醛1 05632.27-0.00-7(2E, 4E)-2, 4-辛二烯醛1 113NF---0.178顺-4-癸烯醛1 193NF---0.239癸醛1 19520.19-0.200.9710(E, Z)-2, 4-癸二烯醛1 291NF0.70---11十一醛1 30150.060.08-0.1312反-2-十一烯醛1 364NF---0.0813十二醛1 407NF0.030.050.07-14反-2-十二烯醛1 467.5NF---0.0415十三醛1 510NF0.050.090.050.0216肉豆蔻醛1 765NF---0.0117十六醛1 822NF---0.0218(2E)-2-十六碳烯醛1 877.6NF0.01---19十八醛2 024NF0.150.490.18-20二十烷醛2 225.3NF0.050.090.090.08合计43.4416.8117.1727.32烷烃类1癸烷1 039.7NF--2.27-22-甲基十一烷1 164NF--0.46-34-甲基十二烷1 260NF--0.37-4七甲基壬烷1 317NF0.01---52-甲基十三烷1 364NF--0.05-62, 6, 10-三甲基十三烷1 465.1NF0.040.060.07-7姥鲛烷1 703.7NF0.190.080.220.0381, 2-环氧十六烷1 708NF---0.029二酚基丙烷2 108NF-1.15--102-甲基四十烷2 462.1NF---0.01合计0.241.293.440.06烯烃类1反式-4, 5-环氧-2-癸烯1 389NF---0.282白菖烯1 440NF0.070.060.08-3十七烯1 692NF0.040.090.030.024二十二碳烯2 194NF-0.09-0.15合计0.110.240.110.45酯类 1E, Z-4-亚乙基环己烯1 040NF---1.012γ-辛内酯1 2607---0.243丙位壬内酯1 362NF---0.1342, 2, 4-三甲基-1, 3-戊二醇单异丁酸酯1 380NF0.08-0.280.055酞酸二甲酯1 466.2NF0.050.070.03-62, 2, 4-三甲基-1, 3-戊二醇二异丁酸酯1 587.5NF0.02-0.030.017桃醛1 611NF0.020.830.03-8十四酸乙酯1 799.4NF--0.02-9水杨酸辛酯1 816.7NF0.450.550.040.0410豆蔻酸异丙酯1 827NF0.030.040.02-11邻苯二甲酸二异丁酯1 868NF0.090.040.2750.0312棕榈酸甲酯1 926NF0.020.020.040.0113邻苯二甲酸二丁酯1 968.4NF0.070.050.24-14棕榈酸乙酯1 993.5NF--0.01-15硬脂酸甲酯2 138NF0.010.02--合计0.841.621.0151.52酸类 1辛酸1 169.53 000-0.27--2月桂酸1 57610 000---0.023肉豆蔻酸1 76510 000-0.03-0.104棕榈酸1 97710 000-2.08-1.845十七烷酸2 077NF---0.026硬脂酸2 17820 0000.142.93-2.19合计0.145.3104.17
续表1
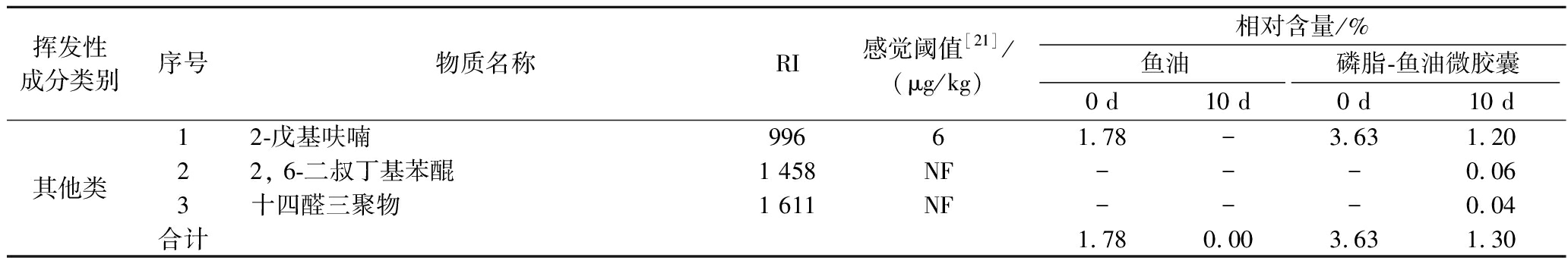
挥发性成分类别序号物质名称RI感觉阈值[21]/(μg/kg)相对含量/%鱼油磷脂-鱼油微胶囊0 d10 d0 d10 d其他类12-戊基呋喃99661.78-3.631.2022, 6-二叔丁基苯醌1 458NF---0.063十四醛三聚物1 611NF---0.04合计1.780.003.631.30
注:-表示未检出;NF表示未查阅到相应化合物的感觉阈值(下同)。
表2 鱼油及大黄鱼鱼卵磷脂-鱼油微胶囊挥发性 成分的相对含量
Table 2 Relative content of volatile substances of fish oil and large yellow croaker roe phospholipids-fish oil microcapsules
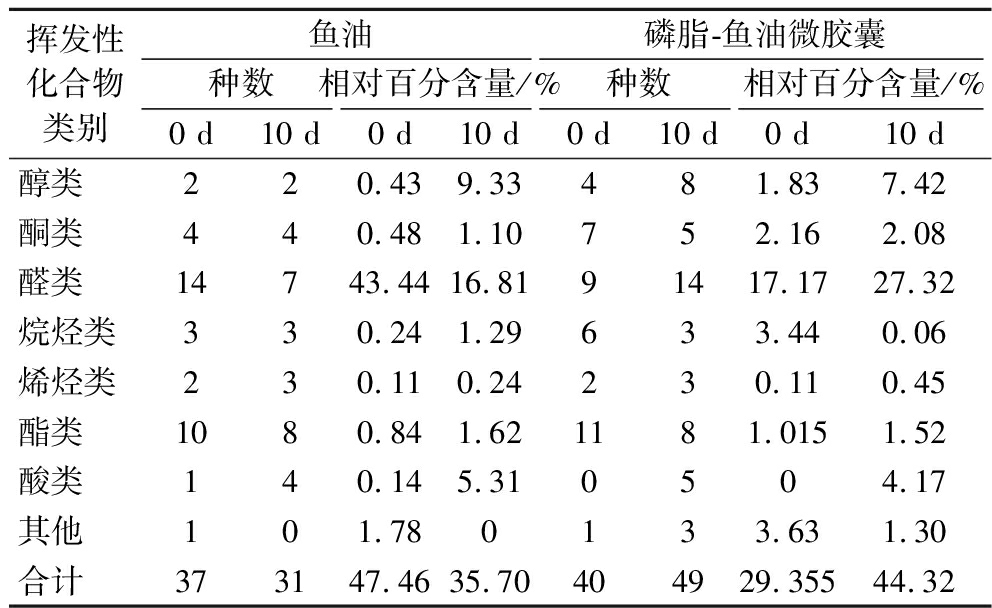
挥发性化合物类别鱼油磷脂-鱼油微胶囊种数相对百分含量/%种数相对百分含量/%0 d10 d0 d10 d0 d10 d0 d10 d醇类220.439.33481.837.42酮类440.481.10752.162.08醛类14743.4416.8191417.1727.32烷烃类330.241.29633.440.06烯烃类230.110.24230.110.45酯类1080.841.621181.0151.52酸类140.145.310504.17其他101.780133.631.30合计373147.4635.70404929.35544.32
醇类化合物主要是氨基酸降解或脂肪氧化的产物,具有特殊的芳香气味。样品中检出的代表性醇类物质是1-辛烯-3-醇,它被描述为n-3 PUFAs最具特征的氧化标志物之一,这与崔婷婷等[14]的研究结果具有一致性。贮藏期间,鱼油及磷脂-鱼油微胶囊中含有多种PUFAs氧化降解产生的不饱和醇,容易影响鱼油制品的风味[15]。但醇类物质阈值普遍较高,除非以高相对含量或不饱和态呈现,否则对鱼油的风味贡献较小。样品中检出的不饱和醇类物质相对含量较低,因此对磷脂-鱼油微胶囊的特征风味无明显影响。
醛类化合物多由脂肪氧化或降解产生,多数醛类具有低风味阈值和特征性脂肪气味。醛类物质是鱼腥味的重要来源之一[16],也是鱼油和磷脂-鱼油微胶囊样品中分离鉴定出的种类最丰富、含量最高的挥发性成分。样品贮藏前后分别检出己醛、庚醛等醛类物质,据报道[17],己醛、庚醛、反式-2, 4-庚二烯醛、(E, Z)-2, 4-癸二烯醛等挥发性风味物质是水产品中典型的腥味物质。鱼油制品的感官特性既能反映其整体品质,还能表征鱼油本身的氧化程度,从表2可以观察到,磷脂-鱼油微胶囊中醛类化合物的相对含量(17.17%)显著低于鱼油中的相对含量(43.44%)。己醛作为鱼油中的关键腥味物质,其相对含量差异最为显著,表明壁材包埋性能良好,微胶囊化一定程度上能够延缓鱼油氧化,掩蔽鱼油的不良气味。
酮类化合物对风味的贡献低于醛类化合物,主要呈脂肪味和焦燃味,对腥味物质起增强作用。从表1中发现,磷脂-鱼油微胶囊的酮类物质种类及相对含量比鱼油高,可能是由于喷雾干燥过程中温度高且进料缓慢,鱼油微胶囊化的过程中多不饱和脂肪酸易发生热降解产生酮类物质。该结果与彭茜等[18]研究结果相似。样品中酮类物质相对含量低,因此对微胶囊整体风味影响不大。
烃类物质阈值较高,各种烷烃(C6~C19)存在于甲壳类和鱼类的挥发物中,大多数学者认为烷烃对风味的贡献可以忽略[19]。烯烃化合物在特定条件下可生成醛酮类物质,可能是腥味产生的潜在因素,但因其阈值较高而对整体风味的贡献较小。酯类、酸类挥发性物质在样品中检出相对含量较低,因此不考虑它们对整体风味的影响。此外,磷脂-鱼油微胶囊中还检出部分杂环化合物,其中呋喃是一类重要的风味化合物,感官阈值较低,具有肉香味,对肉制品的特征风味有很大的影响[20],例如2-戊基呋喃是亚油酸氧化产物,阈值为6 μg/kg,可能对鱼油风味起到辅助作用。
综上所述,磷脂-鱼油微胶囊中挥发性成分相对含量显著低于鱼油,尤其是醛类物质丰度明显降低,说明将大黄鱼鱼卵磷脂-鱼油制成微胶囊能明显减少脂肪氧化产物,延缓鱼油脂肪氧化速度。微胶囊复合囊壁包埋性能良好,减少脂肪氧化异味的产生,保证了产品质量。
2.2 大黄鱼鱼卵磷脂-鱼油微胶囊贮藏过程中关键风味成分分析
鱼油及磷脂-鱼油微胶囊风味间的差异主要来自羰基化合物的定性定量差异[22]。表3展现了构成鱼油的主体风味的8种关键风味物质以及影响磷脂-鱼油微胶囊主体风味的15种关键风味物质。结果表明醛类、醇类、酮类和呋喃类是构成鱼油及磷脂-鱼油微胶囊风味的关键挥发性成分种类,而烃类、酯类和酸类对整体风味贡献较小,这与前文挥发性成分的分析结果一致。磷脂-鱼油微胶囊中产生的1-辛烯-3-醇、芳樟醇属于不饱和醇类,对风味起关键性作用。1-辛烯-3-醇具有蘑菇味、青草味、油腻气息,是水产品中的关键风味物质。芳樟醇通常用于调配茶叶、奶油等食用香精,可能对鱼油产品起到一定增香效果。醛类物质风味贡献程度从大到小依次是己醛、庚醛、反式-2-辛烯醛、反式-2, 4-庚二烯醛和癸醛,这与ZHAO等[23]在微胶囊贮藏期间鉴定出的关键醛类物质结果相符。另外,2-戊基呋喃具有豆香、果香、蔬菜香韵,在磷脂-鱼油微胶囊中的ROAV较高,对鱼油的风味具有一定贡献。由表3可知,磷脂-鱼油微胶囊中醛类物质的ROAV整体低于鱼油中醛类物质的ROAV,说明磷脂-鱼油微胶囊具有良好的包埋效果,可以降低鱼油中的不良气味。通过10 d的加速贮藏后,磷脂-鱼油微胶囊中各主要风味物质的ROAV均上升,推测可能是由于大黄鱼鱼卵磷脂本身具有一定的油脂气息,随着时间的延长,磷脂-鱼油微胶囊囊壁发生破裂,微胶囊内部游离的PUFAs发生降解,挥发性风味成分逸出,磷脂-鱼油微胶囊中腥味物质相对含量升高。
表3 鱼油及大黄鱼鱼卵磷脂-鱼油微胶囊贮藏前后关键 挥发性风味成分的相对气味活度值
Table 3 Relative odor activity values of key volatile flavor substances before and after fish oil and large yellow croaker roe phospholipids-fish oil microcapsules storage
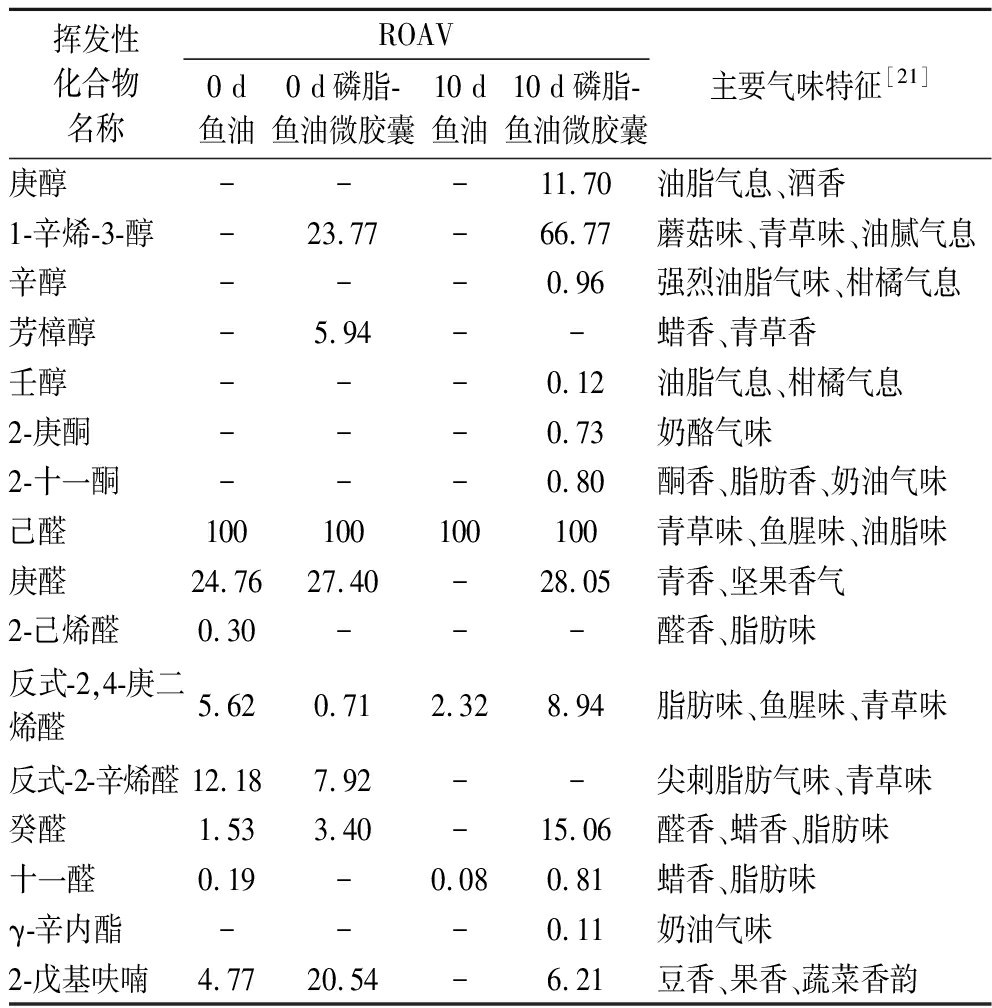
挥发性化合物名称ROAV0 d鱼油0 d磷脂-鱼油微胶囊10 d鱼油10 d磷脂-鱼油微胶囊主要气味特征[21]庚醇---11.70油脂气息、酒香1-辛烯-3-醇-23.77-66.77蘑菇味、青草味、油腻气息辛醇---0.96强烈油脂气味、柑橘气息芳樟醇-5.94--蜡香、青草香壬醇---0.12油脂气息、柑橘气息2-庚酮---0.73奶酪气味2-十一酮---0.80酮香、脂肪香、奶油气味己醛100100100100青草味、鱼腥味、油脂味庚醛24.7627.40-28.05青香、坚果香气2-己烯醛0.30---醛香、脂肪味反式-2,4-庚二烯醛5.620.712.328.94脂肪味、鱼腥味、青草味反式-2-辛烯醛12.187.92--尖刺脂肪气味、青草味癸醛1.533.40-15.06醛香、蜡香、脂肪味十一醛0.19-0.080.81蜡香、脂肪味γ-辛内酯---0.11奶油气味2-戊基呋喃4.7720.54-6.21豆香、果香、蔬菜香韵
2.3 大黄鱼鱼卵磷脂-鱼油微胶囊氧化稳定性分析
POV是衡量油脂氧化程度的指标,常作为判断油脂贮藏稳定性的重要依据之一[24]。图1是加速贮藏实验中磷脂-鱼油微胶囊POV的变化情况。结果显示,随着贮藏时间的延长,鱼油和磷脂-鱼油微胶囊都发生了不同程度的氧化,磷脂-鱼油微胶囊组的氧化速度显著低于鱼油组。磷脂-鱼油微胶囊的初始POV低于鱼油初始POV,说明大黄鱼鱼卵磷脂作为抗氧化剂添加到鱼油中,一定程度上抑制了鱼油氧化。贮藏0~2 d时,由于微胶囊表面油脂氧化作用[25],两者的POV呈现相似的增长趋势。贮藏2~8 d 时,磷脂-鱼油微胶囊组的POV增长速率显著低于鱼油组,说明微胶囊化能够有效包埋大黄鱼鱼卵磷脂-鱼油,致密的囊壁一定程度上减少了外界不良因素对囊芯的影响,从而延缓鱼油的氧化进程[26];贮藏8~10 d时,持续的高温处理使得微胶囊的囊壁破裂,大黄鱼鱼卵磷脂-鱼油释放并发生氧化分解,磷脂-鱼油微胶囊的过氧化值明显上升。
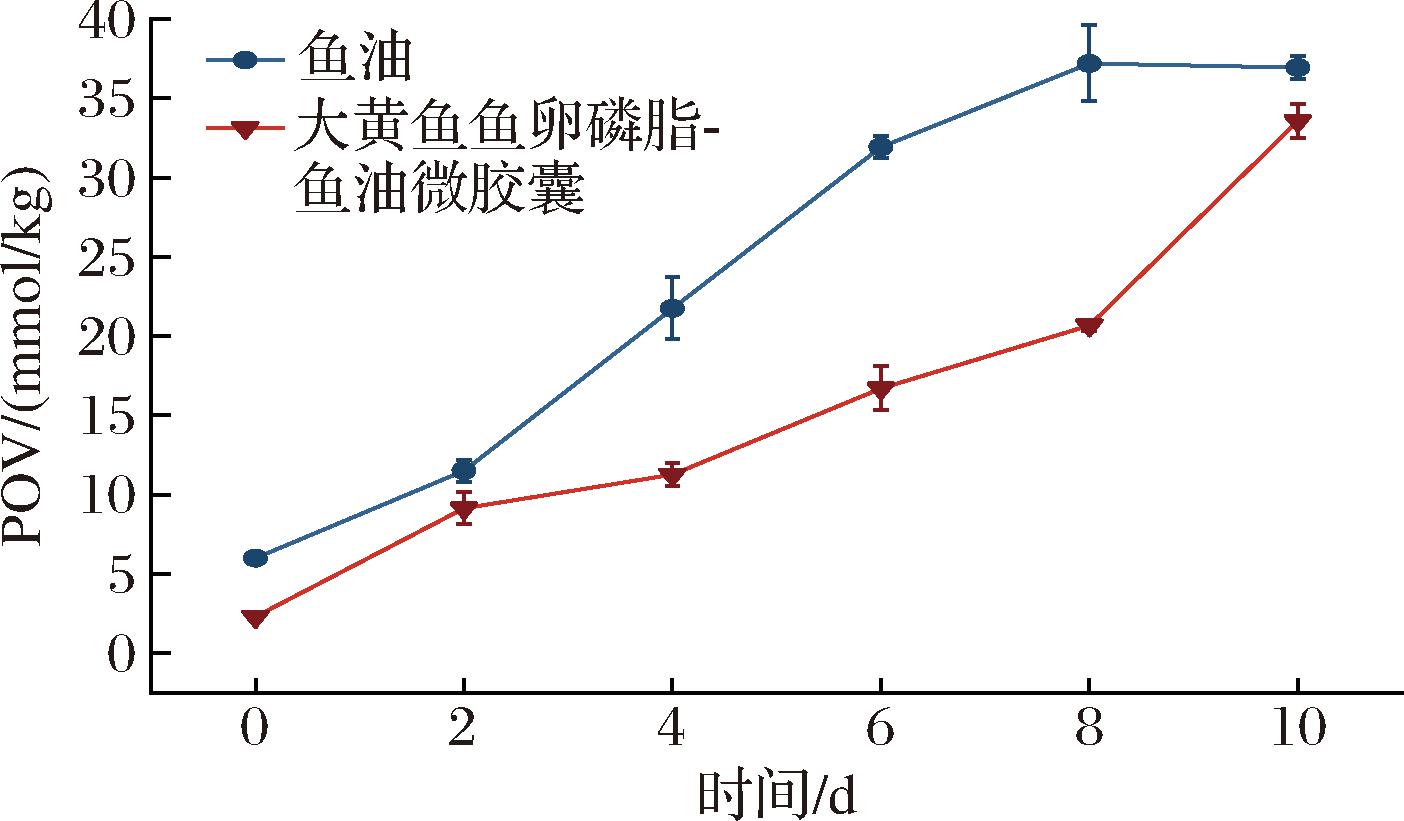
图1 贮藏期间鱼油及大黄鱼鱼卵磷脂-鱼油微胶囊 过氧化值的变化
Fig.1 Peroxide value changes of fish oil and large yellow croaker roe phospholipids-fish oil microcapsules during storage
2.4 大黄鱼鱼卵磷脂-鱼油微胶囊热稳定性分析
通过热重分析(differential thermal gravity-thermogravimetry, DTG-TG)评价了磷脂-鱼油微胶囊的热稳定性,TG和DTG曲线见图2。比较大豆分离蛋白、麦芽糊精、鱼油及磷脂-鱼油微胶囊的TG曲线可知,磷脂-鱼油微胶囊有4个失重阶段,10~200 ℃为起始分解温度阶段,质量变化主要由样品中自由水汽化引起[27],图2-a的第1个质量损失在200 ℃左右发生,由于磷脂-鱼油微胶囊的水分含量很低,因此在这个阶段质量损失不显著(<10%)。微胶囊在10~200 ℃阶段质量损失较少,可能是由于复合壁材大豆分离蛋白和麦芽糊精二者发生聚合,不易造成热分解,对微胶囊芯材起到了保护作用。200~250 ℃主要是结合水、大豆分离蛋白和麦芽糊精中挥发性分解物的损失。250~330 ℃的质量损失主要是大豆分离蛋白和麦芽糊精的热降解,此温度条件下大豆分离蛋白开始变性,麦芽糊精开始糊化;在300 ℃左右观察到磷脂-鱼油微胶囊第2次显著的质量损失,该结果与图2-b DTG曲线呈现的峰值显示一致。330~500 ℃条件下复合壁材被分解导致大部分芯材释放,鱼油微胶囊中脂肪酸发生降解和断裂,与鱼油曲线相对应。结合DTG-TG曲线可知,磷脂-鱼油微胶囊质量损失程度显著低于鱼油,壁材对大黄鱼鱼卵磷脂-鱼油形成保护作用,抑制了鱼油氧化,从而提高其稳定性。结果表明磷脂-鱼油微胶囊具有良好的热稳定性,在食品加工领域中存在优势。
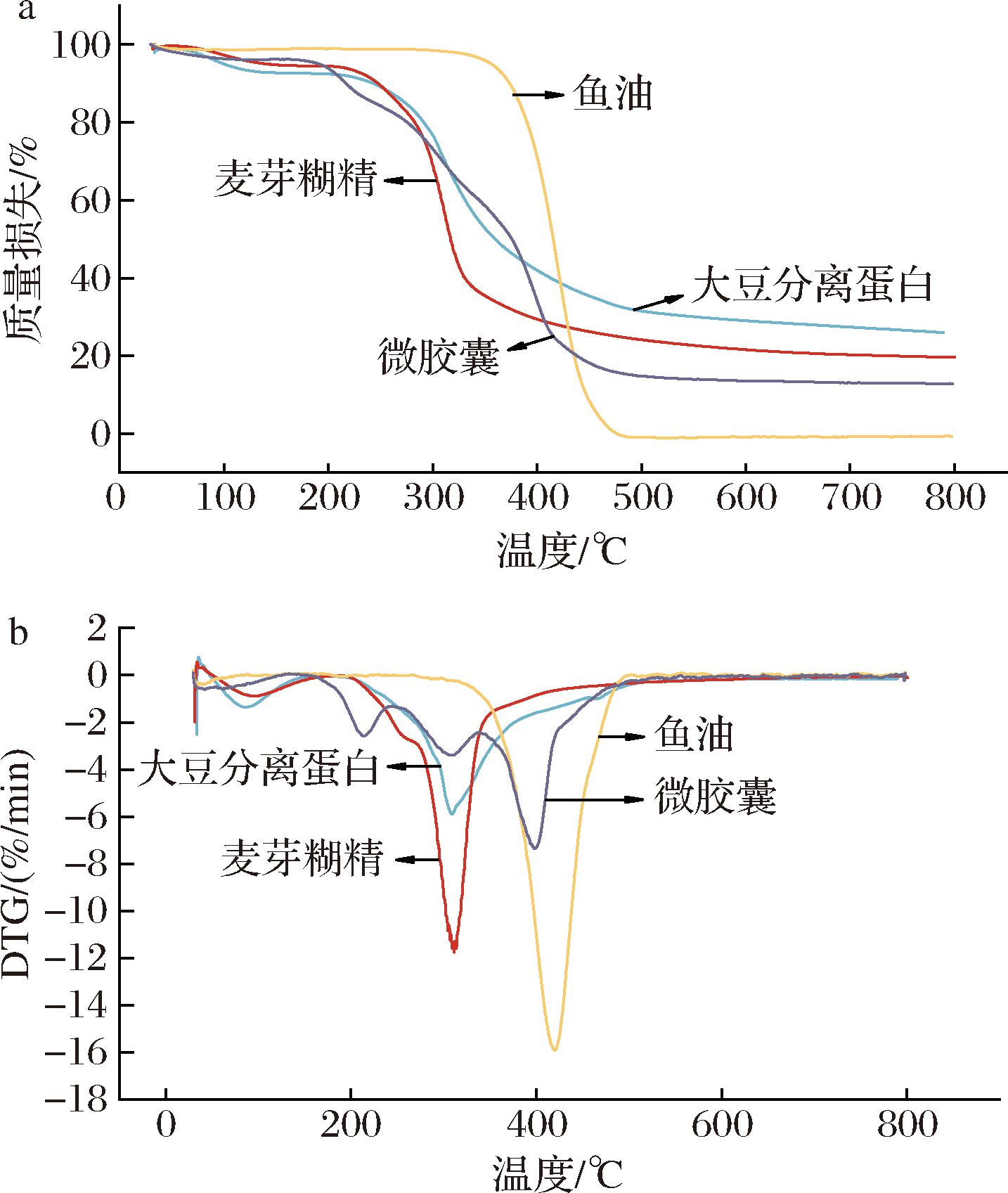
a-TG图谱;b-DTG图谱
图2 大豆分离蛋白、麦芽糊精、鱼油、大黄鱼鱼卵 磷脂-鱼油微胶囊热重分析结果
Fig.2 TG-DTG spectra of soy protein isolate, maltodextrin, fish oli, and large yellow croaker roe phospholipids-fish oil microcapsules
3 结论
本文以大黄鱼鱼卵磷脂-鱼油作为芯材,大豆分离蛋白/麦芽糊精作为复合壁材,利用喷雾干燥技术制备成微胶囊。对比分析了鱼油及大黄鱼鱼卵磷脂-鱼油微胶囊贮藏过程中挥发性成分的差异,发现醛类、醇类、酮类、呋喃类是磷脂-鱼油微胶囊中的关键风味构成。醛类物质是鱼腥味的重要来源,鱼油经微胶囊包埋后,醛类物质相对含量由43.44%下降至17.17%,磷脂-鱼油微胶囊挥发性化合物变化较为稳定,相对含量显著低于鱼油。过氧化值的分析结果表明,贮藏期间磷脂-鱼油微胶囊组的过氧化值增长速率显著低于鱼油组,说明磷脂-鱼油微胶囊的氧化稳定性优于鱼油。热稳定性结果显示,磷脂-鱼油微胶囊质量损失相对缓慢,展现出更好的热稳定性。后续研究考虑深入探究大黄鱼鱼卵磷脂在鱼油微胶囊中的抗氧化机制,进一步提高微胶囊的贮藏稳定性,进而助力微胶囊型鱼油产业的发展。
[1] 吴燕燕, 陶文斌, 李来好, 等.宁德地区养殖大黄鱼形态组织结构与品质特性[J].水产学报, 2019, 43(6):1472-1482.
WU Y Y, TAO W B, LI L H, et al.Morphological structure and quality characteristics of cultured Larimichthys crocea in Ningde[J].Journal of Fisheries of China, 2019, 43(6):1472-1482.
[2] LIANG P, LI R F, SUN H, et al.Phospholipids composition and molecular species of large yellow croaker (Pseudosciaena crocea) roe[J].Food Chemistry, 2018, 245:806-811.
[3] LU X D, ZHONG R B, HU L, et al.DHA-enriched phospholipids from large yellow croaker roe regulate lipid metabolic disorders and gut microbiota imbalance in SD rats with a high-fat diet[J].Food &Function, 2021, 12(11): 4825-4841.
[4] HUANG L Y, LU X D, ZHANG L Y, et al.Insight into the emulsifying properties of DHA-enriched phospholipids from large yellow croaker (Larimichthys crocea) roe[J].LWT, 2021, 150:111984.
[5] ZHANG H D, ZHANG L Y, YANG X Y, et al.Oxidative stability of marine phospholipids derived from large yellow croaker roe[J].Food Research International, 2022, 160:111743.
[6] 陈文娟, 陈丽娇, 曾稍俏.大黄鱼鱼卵磷脂的自由基清除及抗氧化活性[J].江苏农业科学, 2014, 42(1):247-250.
CHEN W J, CHEN L J, ZENG S Q.Free radical scavenging and antioxidant activity of lecithin from Pseudosciaena crocea[J].Jiangsu Agricultural Sciences, 2014, 42(1):247-250.
[7] 彭地纬, 杨必能, 黄祯, 等.饲用鱼油的氧化稳定性研究[J].现代畜牧兽医, 2022(10):19-23.
PENG D W, YANG B N, HUANG Z, et al.Study on oxidation stability of feed fish oil for feeding[J].Modern Journal of Animal Husbandry and Veterinary Medicine, 2022(10):19-23.
[8] GUO B Z, ZHU C Y, HUANG Z H, et al.Microcapsules with slow-release characteristics prepared by soluble small molecular starch fractions through the spray drying method[J].International Journal of Biological Macromolecules, 2022, 200:34-41.
[9] CHEW S C, TAN C P, NYAM K L.Microencapsulation of refined kenaf (Hibiscus cannabinus L.) seed oil by spray drying using β-cyclodextrin/gum arabic/sodium caseinate[J].Journal of Food Engineering, 2018, 237:78-85.
[10] JAFARI S M, ASSADPOOR E, HE Y H, et al.Encapsulation efficiency of food flavours and oils during spray drying[J].Drying Technology, 2008, 26(7):816-835.
[11] 许艳萍, 梁鹏, 陈丽娇, 等.大黄鱼鱼卵(籽)磷脂提取工艺及其脂肪酸组成分析[J].中国食品学报, 2017, 17(9):74-81.
XU Y P, LIANG P, CHEN L J, et al.Extraction process of phospholipids from eggs of large yellow croaker and analysis of fatty acids composition[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(9):74-81.
[12] 刘登勇, 周光宏, 徐幸莲.确定食品关键风味化合物的一种新方法:“ROAV” 法[J].食品科学, 2008, 29(7):370-374.
LIU D Y, ZHOU G H, XU X L.“ROAV” method:A new method for determining key odor compounds of Rugao ham[J].Food Science, 2008, 29(7):370-374.
[13] RINC N-CERVERA M
N-CERVERA M  , GONZ
, GONZ LEZ-BARRIGA V, VALENZUELA R, et al.Profile and distribution of fatty acids in edible parts of commonly consumed marine fishes in Chile[J].Food Chemistry, 2019, 274:123-129.
LEZ-BARRIGA V, VALENZUELA R, et al.Profile and distribution of fatty acids in edible parts of commonly consumed marine fishes in Chile[J].Food Chemistry, 2019, 274:123-129.
[14] 崔婷婷, 贾爱荣, 白新峰, 等.不同制备方式的鱼油微胶囊挥发性成分及贮藏稳定性的比较[J].现代食品科技, 2020, 36(11):236-243.
CUI T T, JIA A R, BAI X F, et al.Volatile components and storage stability of fish oil microcapsules prepared by different methods[J].Modern Food Science and Technology, 2020, 36(11):236-243.
[15] 李冲冲, 李子豪, 柳余莉, 等.鱼粉加工副产物中鱼油的精炼及其脂肪酸组成分析[J].食品科学, 2015, 36(20):190-193.
LI C C, LI Z H, LIU Y L, et al.Refinement of fish oil from byproducts of fish meal processing and its fatty acid composition analysis[J].Food Science, 2015, 36(20):190-193.
[16] ZHANG Q, QIN W, LIN D R, et al.The changes in the volatile aldehydes formed during the deep-fat frying process[J].Journal of Food Science and Technology, 2015, 52(12):7 683-7 696.
[17] ZHAO T F, SHENG B L, YING X G, et al.Role of lipid deterioration on the quality of aquatic products during low-temperature storage:A lipidomics-based study using large yellow croaker (Larimichthys crocea)[J].International Journal of Food Science &Technology, 2022, 57(2):1026-1039.
[18] 彭茜, 戴志远, 宋恭帅, 等.壳聚糖微胶囊对鱼油品质的影响[J].中国食品学报, 2020, 20(5):222-230.
PENG X, DAI Z Y, SONG G S, et al.Effect of chitosan microcapsules on the quality of fish oil[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(5):222-230.
[19] JOSEPHSON D B, LINDSAY R C, STUIBER D A.Enzymic hydroperoxide initiated effects in fresh fish[J].Journal of Food Science, 1987, 52(3):596-600.
[20] 刘源, 周光宏, 徐幸莲, 等.南京盐水鸭挥发性风味化合物的研究[J].食品科学, 2006, 27(1):166-171.
LIU Y, ZHOU G H, XU X L, et al.Study on volatile flavor compounds of Nanjing water boiled salted duck[J].Food Science, 2006, 27(1):166-171.
[21] 孙宝国, 陈海涛.食用调香术[M].3版:北京:化学工业出版社, 2016.
SUN B G, CHEN H T, The Technology of Food Flavoring[M].3rd Edition. Beijing: Chemical Industry Press, 2016.
[22] GAO P, JIANG Q X, XU Y S, et al.Esterase activities of autochthonous starter cultures to increase volatile flavour compounds in Chinese traditional fermented fish (Suan Yu)[J].International Journal of Food Properties, 2017, 20(sup1):S663-S672.
[23] ZHAO T F, BENJAKUL S, SANMARTIN C, et al.Changes of volatile flavor compounds in large yellow croaker (Larimichthys crocea) during storage, as evaluated by headspace gas chromatography-ion mobility spectrometry and principal component analysis[J].Foods, 2021, 10(12):2917.
[24] 钟榕斌, 曾巧玲, 杨伟, 等.大黄鱼鱼卵磷脂抗油茶籽油氧化作用的研究[J].食品安全质量检测学报, 2021, 12(21):8328-8333. ZHONG R B, ZENG Q L, YANG W, et al.Study on antioxidant effect of phospholipids from large yellow croaker roe on camellia oil[J].Journal of Food Safety &Quality, 2021, 12(21):8328-8333.
[25] MIYASHITA K, UEMURA M, HOSOKAWA M.Effective prevention of oxidative deterioration of fish oil:Focus on flavor deterioration[J].Annual Review of Food Science and Technology, 2018, 9:209-226.
[26] SELIM K A, ALHARTHI S S, ABU EL-HASSAN A M, et al.The effect of wall material type on the encapsulation efficiency and oxidative stability of fish oils[J].Molecules, 2021, 26(20):6109.
[27] EINHORN-STOLL U, KUNZEK H.Thermoanalytical characterisation of processing-dependent structural changes and state transitions of citrus pectin[J].Food Hydrocolloids, 2009, 23(1):40-52.