百香果为西番莲科(Passifloraceae)西番莲属(Passiflora Linn.)多年生常绿藤本植物,是热带、亚热带地区特有的水果[1-2],在我国广西、海南、广东、台湾、福建等地均有种植。近年来,百香果被作为致富果大力推广,以广西、福建扩种态势最为迅猛,现已成为当地农民增收的主要途径和区域经济的支柱产业且发展较为迅猛[3-5]。百香果香气浓郁,因富含草莓、芒果、苹果、番石榴、香蕉、菠萝等多种水果香气,而被誉为“果汁之王”和“香料水果”[6]。果实香气不仅能反映不同果实的风味特点及其成熟程度,更是评价果实商品质量的重要指标。近年国内外对百香果香气物质组成、香气物质合成途径等方面进行报道,取得了不少的成果。MACORIS等[7]在百香果果肉中分离检测到77种化合物,其中以丁酸甲酯、乙酸丁酯、己醛、丁酸丁酯、反式-3-己烯乙酸酯、顺式-3-己烯-1-醇、己酸丁酯、丁酸己酯等酯类为香气的主要挥发性化合物。PORTO-FIGUEIRA等[8]分析了9种百香果的挥发性成分,发现酯类为主要挥发性化合物,品种间的挥发性图谱存在差异。潘葳等[9]鉴定出5种百香果果汁中共含有68种香气成分,酯类含量最高,其次为醇类、酮类、萜烯类、烷类、醚类和杂环类;而香气物质含量较高的是丁酸乙酯、己酸乙酯、丁酸己酯等。LI等[10]基于转录组分析对百香果果实成熟过程中香气形成的机理进行了研究,分析了148个香气物质和相关差异表达基因,指出百香果香气形成相关的代谢途径主要包括脂肪酸代谢和氨基酸代谢,通过关键基因进行功能验证,脂氧合酶(lipoxygenase,LOX)表达与百香果直链酯类香气形成呈正相关。目前有关百香果采后风味物质的研究主要集中在香气成分测定及特征香气分析,而对百香果香气合成前体物质相关研究鲜有报道。百香果香气合成前体物质研究不仅可以揭示百香果果实香气形成机理,而且对改善百香果香味品质并指导其保鲜具有积极意义。
香气物质的形成主要是在果实发育的后期,是以脂肪酸、氨基酸和单糖作为香气的前体物质,在相关酶的催化作用下形成[11]。果实中存在多种风味物质合成途径,根据前体物质的不同可分为:脂肪酸代谢途径、氨基酸代谢途径和单糖代谢途径等[12-13]。脂肪酸代谢途径主要合成直链脂肪族醇、酸、酮和酯类物质,脂肪酸是合成大多数直链酯类物质的前体物质;其中LOX途径是较为重要的脂肪酸代谢途径,不饱和脂肪酸亚油酸、亚麻酸和油酸等是LOX途径最主要的前体物质[14-15]。氨基酸代谢途径主要合成支链脂肪族醇、酸、酮和酯类物质,丙氨酸、半胱氨酸、缬氨酸、蛋氨酸、异亮氨酸和亮氨酸等氨基酸是该途径的前体物质[16-17]。糖组分是构成果实味感的组成成分,也是风味物质代谢合成醇类、酸类、酯类等的前体物质。本研究主要对百香果贮藏过程中香气合成的前体物质:脂肪酸、氨基酸和糖组分进行研究,并通过相关性分析,以期揭示百香果脂肪酸、氨基酸和糖组分等前体物质在贮藏过程的变化规律,为百香果果实香气物质代谢机制的调控提供参考依据。
1 材料与方法
1.1 材料与试剂
百香果(Passiflora caerulea L.):品种为‘台农1号’,2018年8月采自广西省南宁市邕宁区,7~8成熟(花后55~60 d),采收后立刻运回实验室。焦性没食子酸、盐酸、乙醚、石油醚、氢氧化钠、甲醇、正庚烷、氯化钠、异硫氰酸苯酯、醋酸钠、异硫氰酸苯酯、三乙胺、乙腈、正己烷,均为分析纯,国药集团化学试剂有限公司;蔗糖、果糖、葡萄糖、14种氨基酸标准品,Sigma(中国)公司;亚麻酸甲酯、亚油酸甲酯、油酸甲酯,均纯度>99%、色谱级,沈阳鼎国生物技术有限公司;水为去离子水或二次蒸馏水。
1.2 仪器与设备
组织粉碎机、旋转蒸发仪、PGL精密天平,深圳市怡华新电子有限公司;AA-S2电热恒温水浴锅,江苏省金坛市医疗仪器厂;Agilent 1260 Infinity高效液相色谱仪、Agilent 7890A-5975C 气相色谱-质谱联用仪,美国Agilent公司;BIC-300 工人气候箱,上海博讯实业有限公司医疗设备厂;固相微萃取装置手柄、固定搭载装置、双极性50/30 μm二乙烯基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)萃取头,美国Supelco公司;D-37520型高速冷冻离心机,德国赛默飞世尔有限公司;离子PTP-IV-30型实验室超纯水机,广州品业仪器设备有限公司。
1.3 实验方法
1.3.1 样品杀菌处理
挑选无机械伤、果形端正、无病虫斑、大小一致及成熟度均匀的果实。杀菌处理参考杨雪莲等[18]方法,稍有改动:用含量为500 mg/kg的次氯酸钠溶液浸泡果实1 min,取出晾干,备用。在常温(25±1) ℃、低温(6±1) ℃贮藏温度且相对湿度均为80%条件下进行贮藏实验,每2 d取1次样。去籽取果囊果汁、匀浆、过滤,经充分混匀后,样品贮存于-80 ℃中待测,每个样品3组平行。
1.3.2 指标测定
1.3.2.1 亚油酸、亚麻酸、油酸含量测定
参考国标GB/T 5009.168—2016 《食品安全国家标准 食品中脂肪酸的测定》。
1.3.2.2 氨基酸测定
样品处理:称取2.0 g果肉样品于20 mL水解管中,加入16 mL 6 mol/L盐酸溶液,真空脱气30 min,充氮封管;在110 ℃条件下水解22 h,冷却,定容至50 mL。取1 mL水解液于小瓶中在真空状态下脱酸抽干,重复抽干3次备用。加入1 mL 0.02 mol/L盐酸溶液充分溶解。取500 μL上述溶液,加入250 μL 1 mol/L三乙胺乙腈溶液混匀,再加入25 μL 0.1 mol/L异硫氰酸苯酯乙腈溶液混匀,室温静置1 h后加2 mL正己烷,剧烈振摇后静置10 min,取下层溶液用0.22 μm的微孔水相滤膜过滤后上机分析[19]。
色谱条件:流动相A:V(0.1 mol/L醋酸钠溶液)∶V(乙腈)=93∶7,流动相B:V(乙腈)∶V(水)=80∶20;色谱柱:填充剂为十八烷基硅烷键合硅胶(4.6 mm×250 mm,5 μm)。流速1.0 mL/min,进样量10 μL,波长254 nm,柱温40 ℃。
1.3.2.3 糖组分测定
样品处理:准确称取2.00 g样品,用30 mL 80%乙醇溶解后,在40 ℃下超声浸提40 min,12 000 r/min离心、过滤,滤渣加入5 mL 80%乙醇再提取,合并上清液,于90 ℃下水浴蒸干,用超纯水多次洗涤合并定容至50 mL容量瓶中,用一次性注射器抽取提取样液,用0.45 μm的微孔水系滤膜针头过滤注入样品瓶中待上机分析[20]。
色谱条件:色谱柱为Sugar-Pak TM1色谱柱(300 mm×6 mm,5 mm,7 μm),流动相为超纯水,流速0.6 mL/min,柱温80 ℃,进样量为10 μL。
1.3.2.4 香气成分测定
参考辛明等[21]的方法测定。取搅匀的百香果汁5 g于20 mL萃取瓶中,将萃取头插入样品瓶顶空部分,于40 ℃吸附30 min,吸附后的萃取头取出,插入GC-MS进样口。GC-MS分析条件:DB-WAX MS毛细管柱(30 m×0.25 mm×0.25 μm),He 流量 1 mL/min,不分流进样,进样口温度250 ℃;升温程序为40 ℃保持3 min,然后以8 ℃/min线性升温至90 ℃,10 ℃/min线性升温至230 ℃,在此温度下保持7 min;离子化方式为电子轰击电离(EI),离子源温度230 ℃,电子能量80 eV,接口温度280 ℃;全扫描方式,扫描质量范围 35~350 U;对照NIST 2014谱库进行数据分析,采用峰面积归一法确定相对含量。
1.4 数据分析
指标测定数据为3次以上重复实验的平均值±标准差;使用SPSS 19.0软件进行统计分析,利用邓肯多重比较法(Duncan)对数据间进行差异显著性分析,P<0.05表示差异显著;利用Origin 8.2进行作图。
2 结果与分析
2.1 不同温度贮藏过程中百香果亚麻酸、亚油酸、油酸含量分析
脂肪酸是大多数直链酯类、醛类和醇类香气成分的前体,在香气物质合成过程中参与的脂肪酸主要有不饱和脂肪酸亚麻酸、亚油酸和油酸[22-24]。由图1可知,不同贮藏温度下百香果亚麻酸含量整体呈先上升后下降的趋势,在采后0~6 d,常温与低温条件下的亚麻酸含量均变化不大,二者间无显著性差异(P>0.05),常温组在第10天达到最高值72.77 μg/g,低温组在第14天达到最高值64.84 μg/g。由图2可知,在采后2~6 d,常温组亚油酸含量显著高于低温组(P<0.05),且均在第8天出现峰值,分别为487.14、448.66 μg/g。由图3可知,不同贮藏温度下百香果油酸含量整体呈先上升后下降的趋势,在采后2~8 d,常温组油酸含量显著高于低温组(P<0.05);常温组油酸含量在第8天达到最高值111.56 μg/g,低温组在第10天达到最高值103.12 μg/g。说明低温条件对亚麻酸、亚油酸、油酸含量均具有一定的抑制作用。
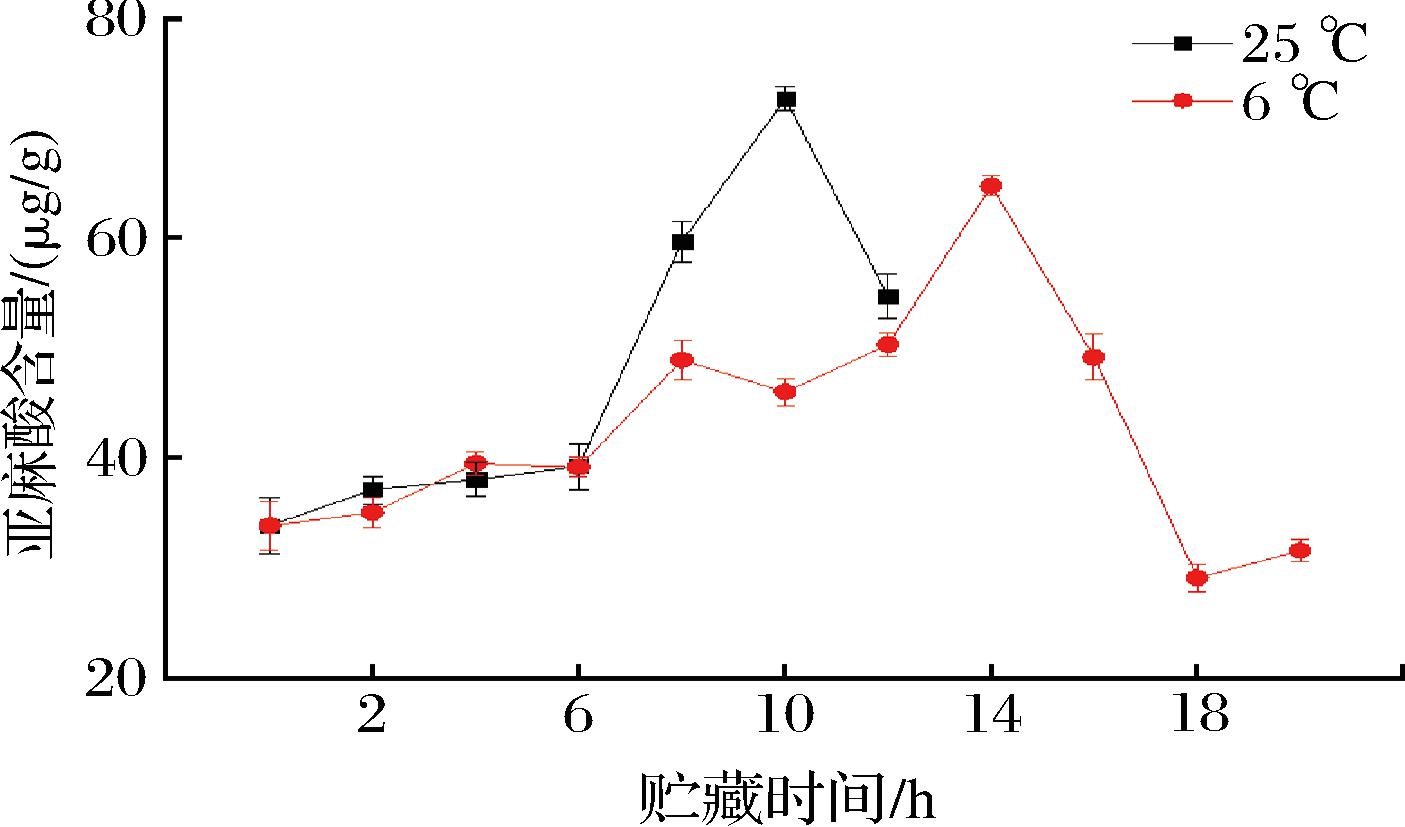
图1 不同贮藏温度下百香果亚麻酸含量的变化
Fig.1 Changes of linolenic acid content of passion fruit under different storage temperatures
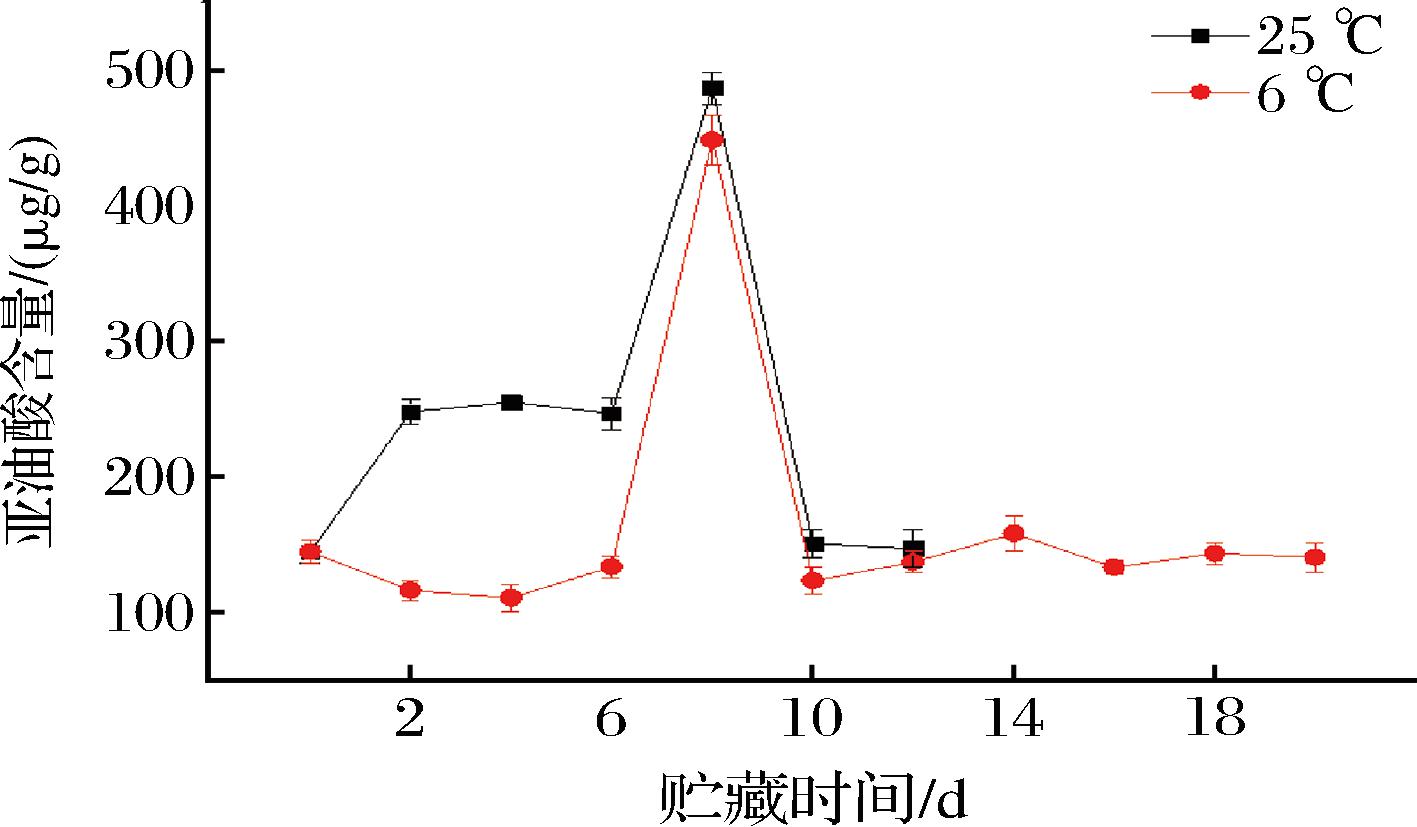
图2 不同贮藏温度下百香果亚油酸含量的变化
Fig.2 Changes of linoleic acid content of passion fruit under different storage temperatures
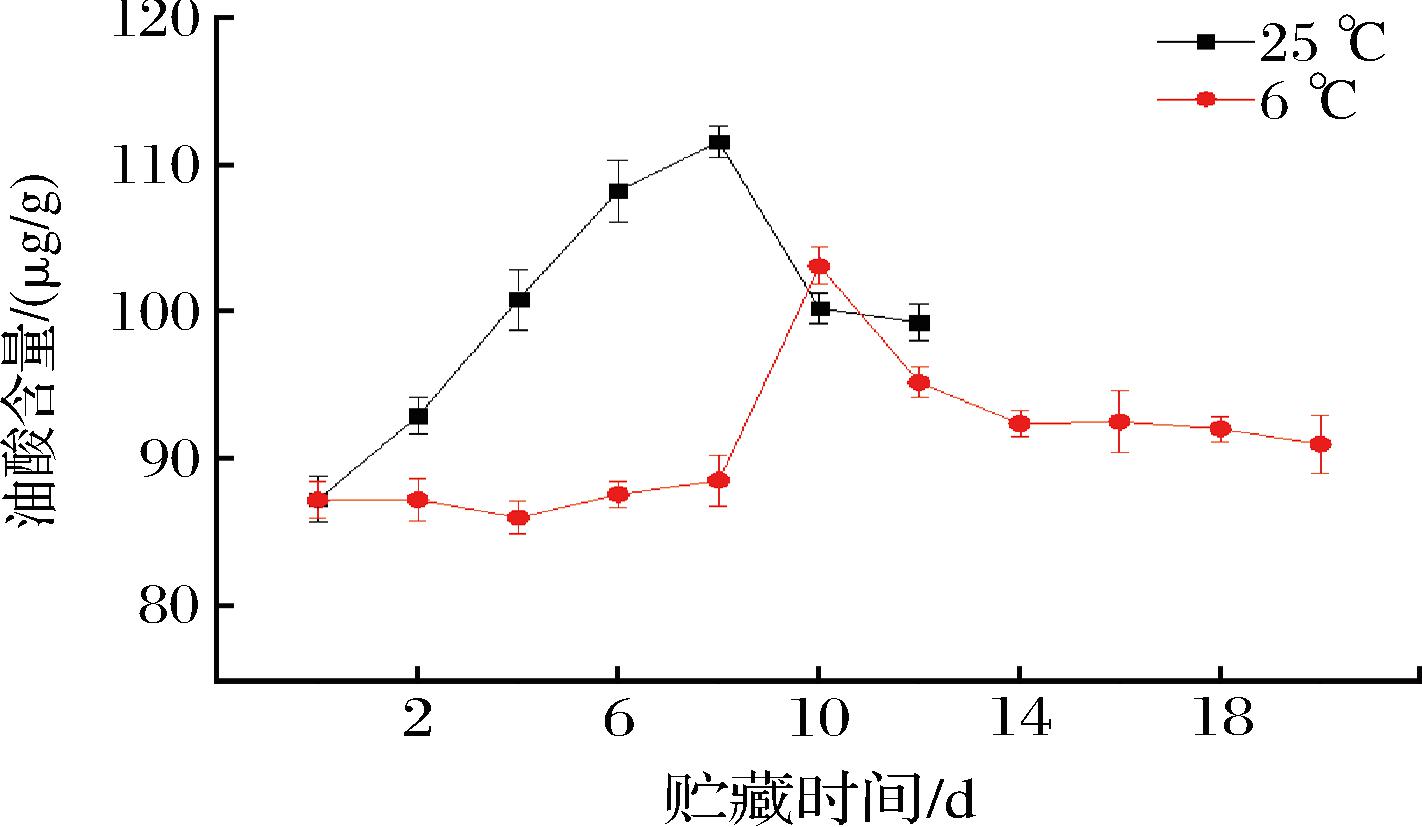
图3 不同贮藏温度下百香果油酸含量的变化
Fig.3 Changes of oleic acid content of passion fruit under different storage temperatures
2.2 不同温度贮藏过程中百香果氨基酸含量分析
氨基酸是支链脂肪族类和酯类物质合成的前体物质。在香气物质合成过程中参与的氨基酸主要有缬氨酸、亮氨酸、异亮氨酸、丙氨酸和苯丙氨酸等[12]。由表1可知,含量较高的氨基酸是脯氨酸(25 ℃:111.23~277.40 mg/100 g,6 ℃:111.23~271.85 mg/100 g)、苯丙氨酸(25 ℃:126.62~186.97 mg/100 g,6 ℃:126.62~211.67 mg/100 g)、亮氨酸(25 ℃:59.15~95.80 mg/100 g,6 ℃:58.43~114.81 mg/100 g)、色氨酸(25 ℃:67.29~82.28 mg/100 g,6 ℃:54.41~103.59 mg/100 g),其次是酪氨酸、异亮氨酸、赖氨酸等。不同温度贮藏条件下,脯氨酸、异亮氨酸含量差异较大,低温组含量比常温组大幅降低;而含量差异最小的是酪氨酸。在低温条件下赖氨酸、组氨酸、脯氨酸、甲硫氨酸、异亮氨酸、酪氨酸、苯丙氨酸、缬氨酸含量的最大峰值分别延迟了2、6、8、2、6、8、8、2 d,说明低温条件对以上氨基酸含量有一定的抑制作用。
表1 不同贮藏温度下百香果氨基酸含量的变化 单位:mg/100 g
Table 1 Changes of amino acids of passion fruit under different storage temperatures
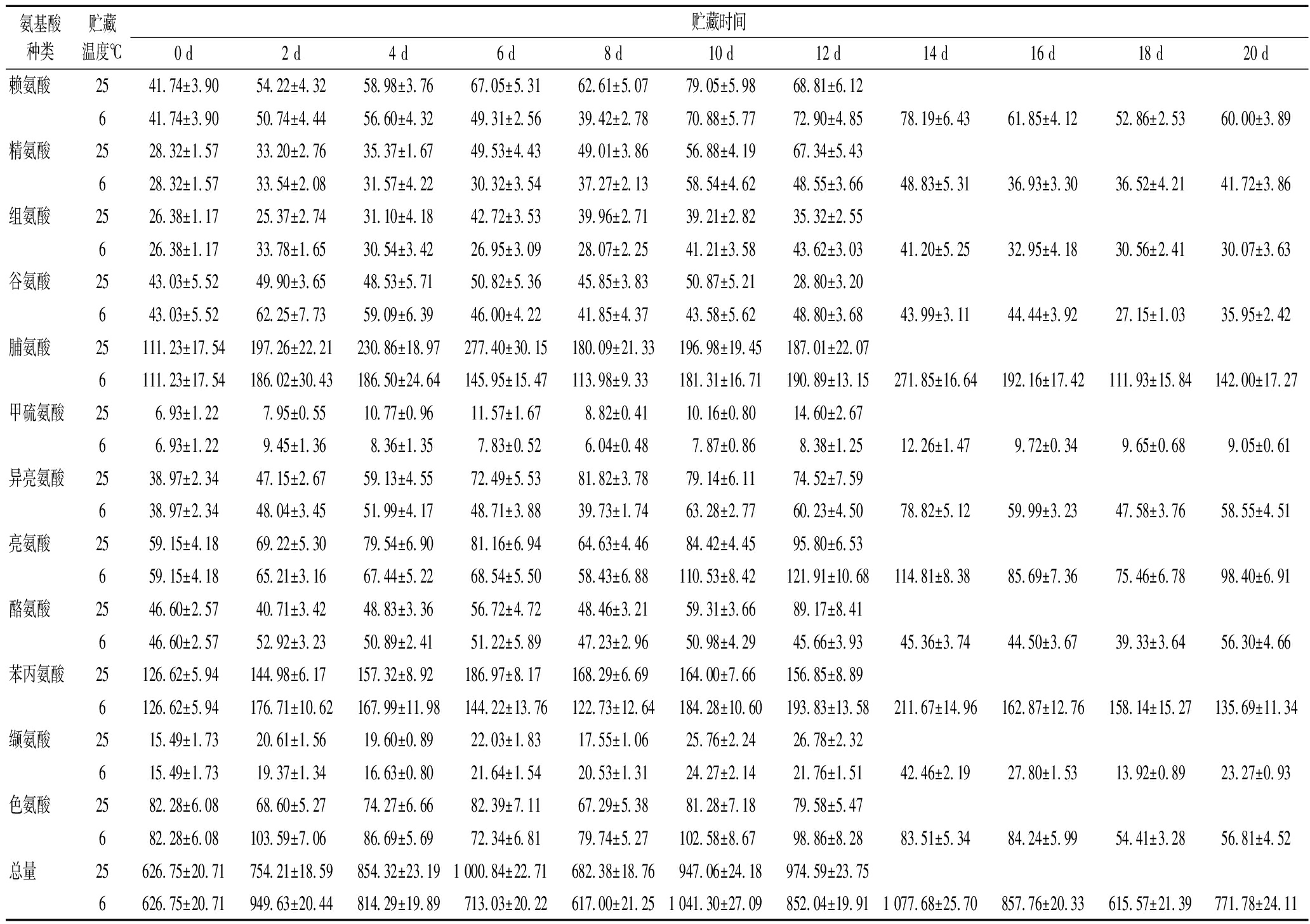
氨基酸种类贮藏温度℃贮藏时间0 d2 d4 d6 d8 d10 d12 d14 d16 d18 d20 d赖氨酸2541.74±3.9054.22±4.3258.98±3.7667.05±5.3162.61±5.0779.05±5.9868.81±6.12641.74±3.9050.74±4.4456.60±4.3249.31±2.5639.42±2.7870.88±5.7772.90±4.8578.19±6.4361.85±4.1252.86±2.5360.00±3.89精氨酸2528.32±1.5733.20±2.7635.37±1.6749.53±4.4349.01±3.8656.88±4.1967.34±5.43628.32±1.5733.54±2.0831.57±4.2230.32±3.5437.27±2.1358.54±4.6248.55±3.6648.83±5.3136.93±3.3036.52±4.2141.72±3.86组氨酸2526.38±1.1725.37±2.7431.10±4.1842.72±3.5339.96±2.7139.21±2.8235.32±2.55626.38±1.1733.78±1.6530.54±3.4226.95±3.0928.07±2.2541.21±3.5843.62±3.0341.20±5.2532.95±4.1830.56±2.4130.07±3.63谷氨酸2543.03±5.5249.90±3.6548.53±5.7150.82±5.3645.85±3.8350.87±5.2128.80±3.20643.03±5.5262.25±7.7359.09±6.3946.00±4.2241.85±4.3743.58±5.6248.80±3.6843.99±3.1144.44±3.9227.15±1.0335.95±2.42脯氨酸25111.23±17.54197.26±22.21230.86±18.97277.40±30.15180.09±21.33196.98±19.45187.01±22.076111.23±17.54186.02±30.43186.50±24.64145.95±15.47113.98±9.33181.31±16.71190.89±13.15271.85±16.64192.16±17.42111.93±15.84142.00±17.27甲硫氨酸256.93±1.227.95±0.5510.77±0.9611.57±1.678.82±0.4110.16±0.8014.60±2.6766.93±1.229.45±1.368.36±1.357.83±0.526.04±0.487.87±0.868.38±1.2512.26±1.479.72±0.349.65±0.689.05±0.61异亮氨酸2538.97±2.3447.15±2.6759.13±4.5572.49±5.5381.82±3.7879.14±6.1174.52±7.59638.97±2.3448.04±3.4551.99±4.1748.71±3.8839.73±1.7463.28±2.7760.23±4.5078.82±5.1259.99±3.2347.58±3.7658.55±4.51亮氨酸2559.15±4.1869.22±5.3079.54±6.9081.16±6.9464.63±4.4684.42±4.4595.80±6.53659.15±4.1865.21±3.1667.44±5.2268.54±5.5058.43±6.88110.53±8.42121.91±10.68114.81±8.3885.69±7.3675.46±6.7898.40±6.91酪氨酸2546.60±2.5740.71±3.4248.83±3.3656.72±4.7248.46±3.2159.31±3.6689.17±8.41646.60±2.5752.92±3.2350.89±2.4151.22±5.8947.23±2.9650.98±4.2945.66±3.9345.36±3.7444.50±3.6739.33±3.6456.30±4.66苯丙氨酸25126.62±5.94144.98±6.17157.32±8.92186.97±8.17168.29±6.69164.00±7.66156.85±8.896126.62±5.94176.71±10.62167.99±11.98144.22±13.76122.73±12.64184.28±10.60193.83±13.58211.67±14.96162.87±12.76158.14±15.27135.69±11.34缬氨酸2515.49±1.7320.61±1.5619.60±0.8922.03±1.8317.55±1.0625.76±2.2426.78±2.32615.49±1.7319.37±1.3416.63±0.8021.64±1.5420.53±1.3124.27±2.1421.76±1.5142.46±2.1927.80±1.5313.92±0.8923.27±0.93色氨酸2582.28±6.0868.60±5.2774.27±6.6682.39±7.1167.29±5.3881.28±7.1879.58±5.47682.28±6.08103.59±7.0686.69±5.6972.34±6.8179.74±5.27102.58±8.6798.86±8.2883.51±5.3484.24±5.9954.41±3.2856.81±4.52总量25626.75±20.71754.21±18.59854.32±23.191 000.84±22.71682.38±18.76947.06±24.18974.59±23.756626.75±20.71949.63±20.44814.29±19.89713.03±20.22617.00±21.251 041.30±27.09852.04±19.911 077.68±25.70857.76±20.33615.57±21.39771.78±24.11
2.3 不同温度贮藏过程中百香果葡萄糖、果糖、蔗糖含量分析
糖组分不仅是构成果实味感的成分,而且是许多香气成分酯、醇、醛、酸等的前体物质。由图4、图5可知,不同贮藏温度下百香果葡萄糖、果糖含量整体呈先上升后下降的趋势,整个贮藏期常温组葡萄糖、果糖含量均高于低温组。常温组葡萄糖、果糖含量均在第8天达到最高值,分别为91.31、89.55 mg/g;低温组葡萄糖含量在第14天达到最高值72.34 mg/g,果糖含量在第12天达到最高值74.62 mg/g。由图6可知,常温组蔗糖含量在贮藏期间呈快速下降趋势,由74.36 mg/g(第0天)将至19.92 mg/g(第12天),降幅为73.21%;低温组较好地维持了蔗糖含量,由74.36 mg/g(第0天)将至67.89 mg/g(第20天),降幅为8.70%。说明低温条件对葡萄糖、果糖含量均具有一定的抑制作用,且能较好地维持蔗糖含量。
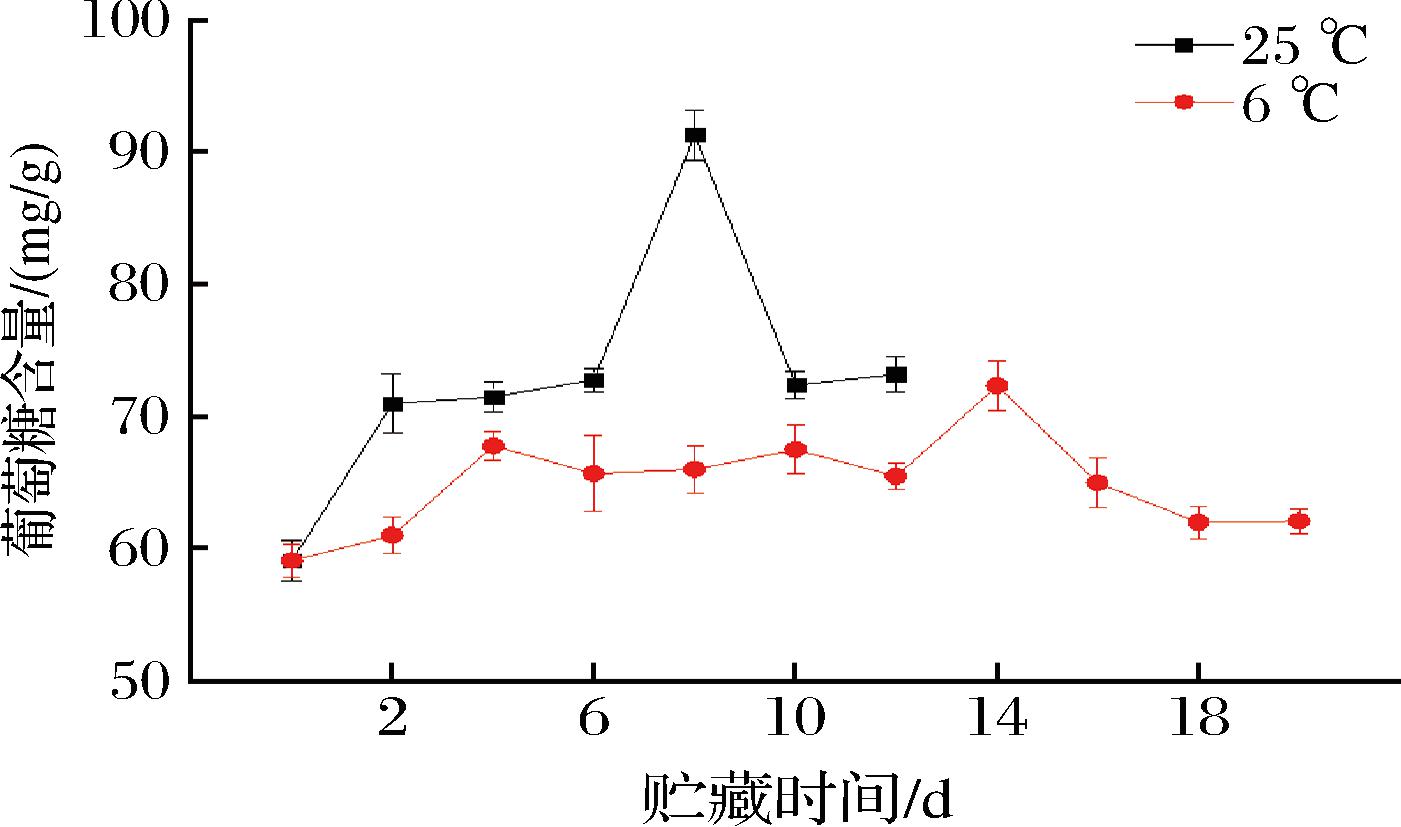
图4 不同贮藏温度下百香果葡萄糖含量的变化
Fig.4 Changes of glucose content of passion fruit under different storage temperatures
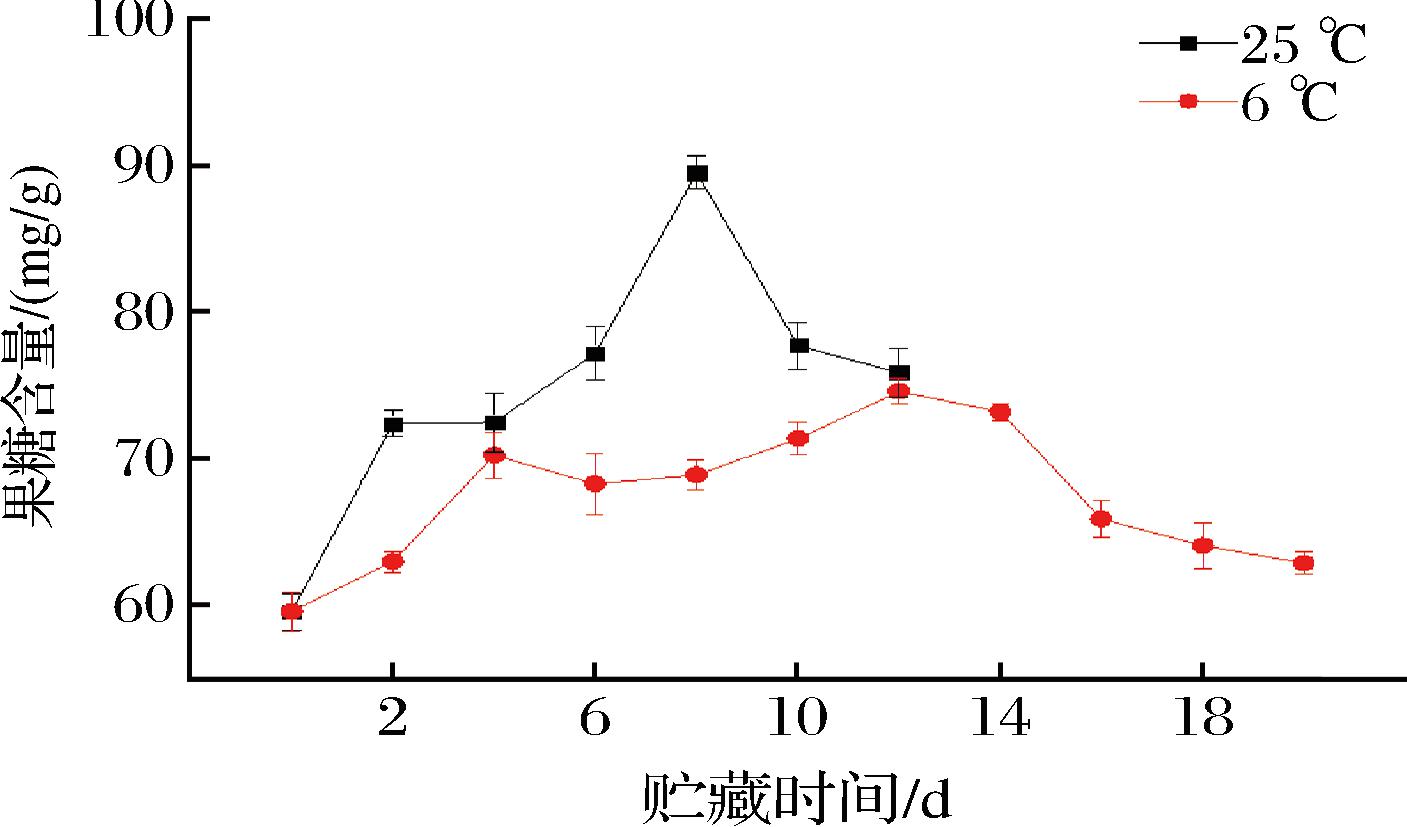
图5 不同贮藏温度下百香果果糖含量的变化
Fig.5 Changes of fructose content of passion fruit under different storage temperatures
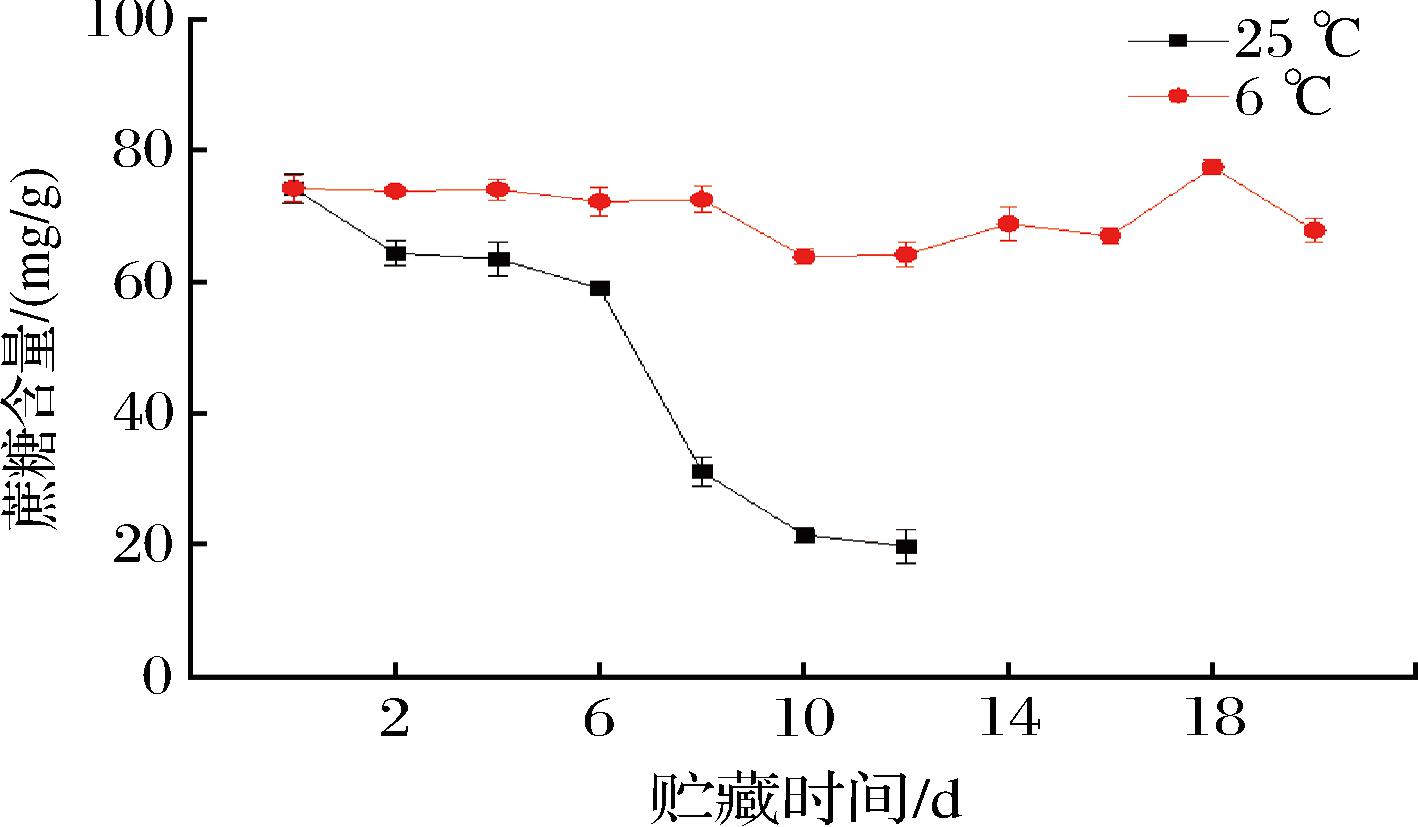
图6 不同贮藏温度下百香果蔗糖含量的变化
Fig.6 Changes of sucrose content of passion fruit under different storage temperatures
2.4 不同温度贮藏过程中百香果香气成分分析
不同温度贮藏过程中百香果香气成分如图7所示,百香果香气成分主要包括酯类、醇类、酮类、醛类、烯类、烷类、酸类,其相对含量在不同温度贮藏过程中均有明显变化。酯类是百香果的主要香气成分,其相对含量最高(25 ℃:40.00%~60.32%,6 ℃:54.62%~69.27%),常温组呈先上升后下降的趋势,贮藏第4天出现峰值(60.32%)、第12天下降为40.00%;低温组整体呈上升趋势,稍有上下波动,相对含量在贮藏期维持在较高水平(54.62%~69.27%),在20 d达到峰值,表明低温条件可以维持较高含量的酯类物质。醇类在百香果总香气物质中占比仅次于酯类,常温组醇类物质相对含量在贮藏后期逐渐增加,第12天时达最高值24.74%,低温组醇类物质相对含量呈先上升后下降趋势,在第8天达最高值16.11%。另外,酮类(25 ℃:7.31%~14.47%,6 ℃:6.78%~14.47%)、醛类(25 ℃:0%~1.17%,6 ℃:0.18%~1.34%)、烯类(25 ℃:1.82%~5.85%,6 ℃:1.03%~5.85%)、烷类(25 ℃:0.08%~4.98%,6 ℃:0.44%~5.06%)、酸类(25 ℃:0%~2.69%,6 ℃:0%~3.26%)成分相对含量较少。
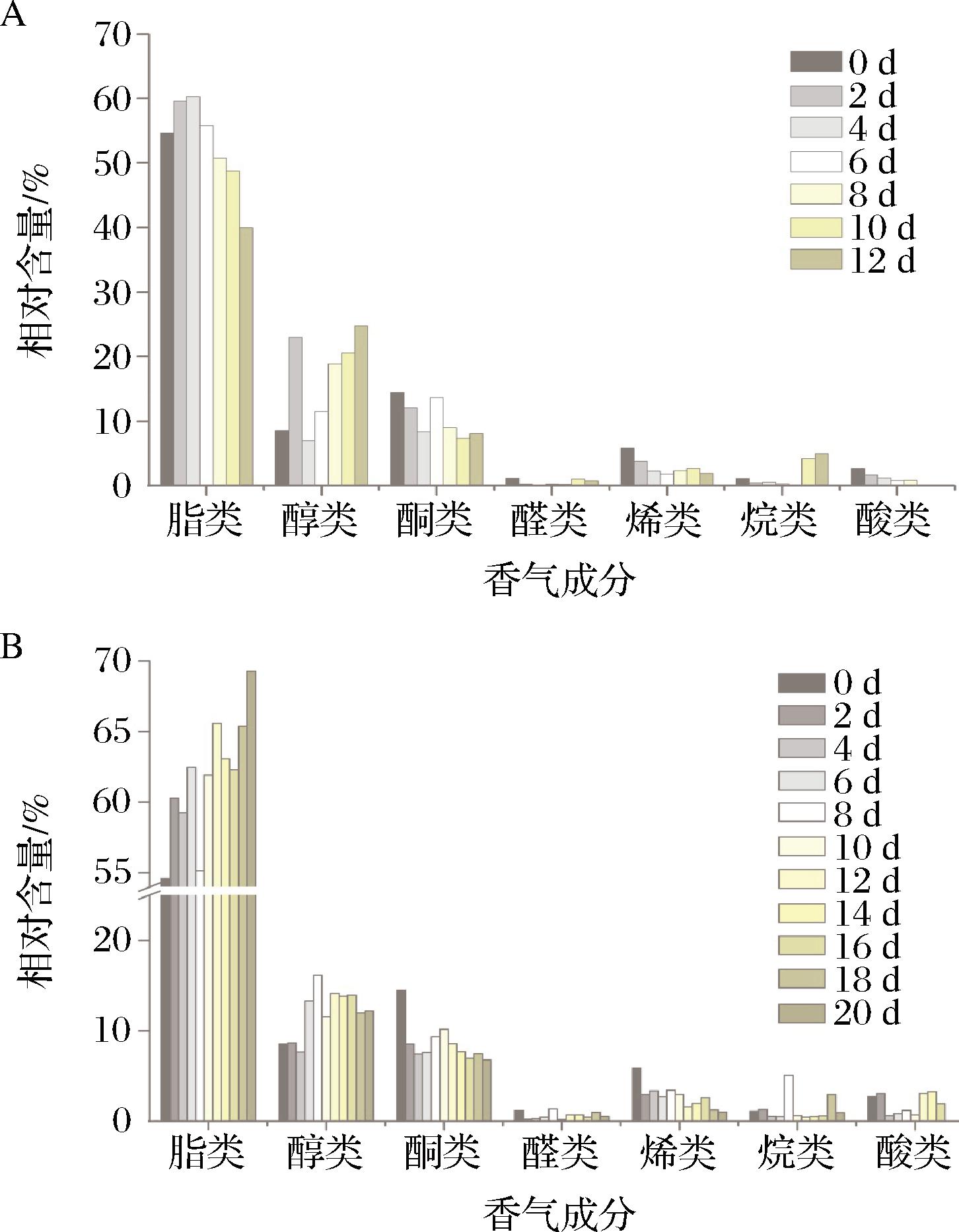
A-25 ℃;B-6 ℃
图7 不同贮藏温度下百香果香气成分的变化
Fig.7 Changes of aroma compounde of passion fruit under different storage temperatures
2.5 百香果香气合成前体物质与香气成分相关性分析
百香果香气合成前体物质与香气成分相关性分析分析结果见表2。常温贮藏条件下,酯类物质相对含量与谷氨酸含量呈极显著正相关(P<0.01),与油酸、蔗糖、缬氨酸含量呈显著正相关(P<0.05),与精氨酸含量呈极显著负相关(P<0.01);醇类物质相对含量与亚油酸、亮氨酸含量呈极显著正相关(P<0.01),与缬氨酸含量呈显著正相关(P<0.05);酮类相对含量与蔗糖含量呈显著正相关(P<0.05),与亚麻酸含量呈显著负相关(P<0.05);醛类相对含量与脯氨酸含量呈显著负相关(P<0.05);烯类相对含量与油酸、果糖含量呈显著负相关(P<0.05);烷类与缬氨酸含量呈极显著正相关(P<0.01),与酪氨酸含量呈显著正相关(P<0.05);酸类物质相对含量与赖氨酸、异亮氨酸呈极显著负相关(P<0.01),与亚麻酸、精氨酸、缬氨酸含量呈显著负相关(P<0.05)。
表2 香气合成前体物质与其香气成分相关性分析
Table 2 Correlation analysis on aroma synthetic precursors and aroma components

名称25 ℃贮藏6 ℃贮藏酯类醇类酮类醛类烯类烷类酸类酯类醇类酮类醛类烯类烷类酸类亚麻酸-0.6610.573-0.764∗0.294-0.4280.620-0.774∗-0.0700.551-0.1320.006-0.103-0.1300.519亚油酸0.2070.970∗∗-0.114-0.671-0.307-0.615-0.016-0.4660.672∗0.1160.674∗0.1530.868∗∗-0.071油酸0.734∗0.079-0.368-0.556-0.826∗-0.165-0.6220.690∗0.312-0.011-0.234-0.344-0.205-0.072葡萄糖-0.2210.382-0.495-0.533-0.640-0.151-0.5120.0870.395-0.390-0.226-0.272-0.1840.087果糖-0.2920.446-0.549-0.481-0.762∗-0.014-0.06840.1680.445-0.323-0.201-0.345-0.1780.158蔗糖0.842∗-0.6970.774∗-0.2180.579-0.7250.8760.664∗-0.4120.1190.3570.3050.451-0.192赖氨酸-0.4590.380-0.6400.121-0.6670.646-0.901∗∗-0.3950.074-0.414-0.603∗-0.600-0.5890.255精氨酸-0.908∗∗0.598-0.5590.179-0.6300.653-0.836∗0.2860.371-0.022-0.018-0.3950.233-0.091组氨酸-0.7130.113-0.1660.260-0.5340.561-0.6380.1510.3650.080-0.097-0.205-0.0920.228谷氨酸0.884∗∗-0.588-0.568-0.0840.565-0.6310.696-0.478-0.3890.227-0.3420.519-0.3090.457脯氨酸0.417-0.189-0.066-0.766∗-0.705-0.379-0.3520.182-0.008-0.312-0.620∗-0.231-0.5600.539甲硫氨酸-0.4760.084-0.2760.026-0.5190.562-0.5090.5270.0180.266-0.257-0.480-0.210-0.207异亮氨酸-0.5430.222-0.5210.111-0.7420.639-0.888∗∗0.643∗0.269-0.397-0.470-0.611∗-0.4470.064亮氨酸-0.3560.889∗∗-0.2450.217-0.2710.650-0.3660.745∗∗0.388-0.263-0.177-0.677∗-0.3350.132酪氨酸-0.7870.187-0.2210.508-0.1890.772∗-0.406-0.081-0.4380.215-0.0850.2720.041-0.347苯丙氨酸-0.285-0.0410.1390.107-0.2750.400-0.2410.419-0.170-0.401-0.635∗-0.431-0.4970.292缬氨酸0.790∗0.788∗-0.5160.316-0.4330.888∗∗-0.741∗0.2380.317-0.382-0.299-0.279-0.4210.402色氨酸0.159-0.5220.5950.6070.7020.0740.587-0.744∗∗-0.1590.500-0.0600.698∗0.0580.432
低温贮藏条件下,酯类物质相对含量与亮氨酸含量呈极显著正相关(P<0.01),与油酸、蔗糖、异亮氨酸含量呈显著正相关(P<0.05),与色氨酸含量呈极显著负相关(P<0.01);醇类物质相对含量与亚油酸含量呈显著正相关(P<0.05);醛类物质相对含量与亚油酸含量呈显著正相关(P<0.05);与赖氨酸、脯氨酸、苯丙氨酸含量呈显著负相关(P<0.05);烯类物质相对含量与色氨酸含量呈显著正相关(P<0.05);与异亮氨酸、亮氨酸含量呈显著负相关(P<0.05);烷类物质相对含量与亚油酸含量呈极显著正相关(P<0.01)。
3 讨论
水果香气物质的代谢途径非常复杂,参与代谢的前体物质也比较复杂。植物中酯、醇、醛、酸类等香气成分的生物合成前体主要是脂肪酸、氨基酸、单糖等。在以脂肪酸为前体物质合成的代谢途径中,百香果中的油酸、亚油酸、亚麻酸含量在贮藏过程中均呈现先升高后降低的趋势。百香果刚贮藏时香气较淡,适度贮藏后熟后,逐渐变得香气诱人且最宜食,脂肪酸作为直链酯类物质合成的前体物质,酯类物质又是百香果香气的主要组成部分,脂肪酸的变化趋势与香气的变化一致。且低温条件下均出现了亚麻酸、油酸及酯类物质峰值的延迟,说明低温抑制了亚麻酸、油酸的合成,进而也显著抑制了百香果香气物质的形成,亚油酸与醇类、油酸与酯类呈显著正相关也进一步验证了该结论,表明脂肪酸尤其是亚油酸、油酸作为香气合成的前体物质作用显著。不少研究报道证实了低温可以降低果实中不饱和脂肪酸的含量,枇杷、猕猴桃等果实置于低温环境下不饱和脂肪酸含量显著降低[25-26]。谭卓[27]的研究同样表明了油酸、亚油酸和亚麻酸的含量受到低温的影响,总酯含量与亚油酸、亚麻酸、油酸含量显著正相关,这与本文的实验结果一致。
在以氨基酸为前体物质合成的代谢途径中,氨基酸通过转氨作用形成支链酮酸,之后经脱梭或脱氢,形成支链醇和酰基CoA,进而形成支链酯类物质。张丽萍[11]在研究冷藏对南果梨香气物质代谢的影响时,发现参与南果梨香气合成的氨基酸有6种:丙氨酸、半胱氨酸、缬氨酸、蛋氨酸、异亮氨酸和亮氨酸。而本研究中,通过氨基酸与酯类香气的相关性分析发现与百香果酯类香气有显著正相关性的氨基酸有谷氨酸、异亮氨酸、亮氨酸和缬氨酸,与张丽萍[11]的研究在异亮氨酸、亮氨酸、缬氨酸3种氨基酸上结论一致,但在丙氨酸、半胱氨酸、蛋氨酸、谷氨酸这4种氨基酸上有所差异,其原因可能是南果梨与百香果的香气成分有差异,因此与香气合成的氨基酸种类也会有所差别。
在以糖组分为前体物质合成的代谢途径中,糖组分为香气的形成提供了底物,使果实形成醇类、醛类、酯类香气物质。很多学者都研究了低温贮藏条件下水果糖组分的变化,邵青旭[28]研究低温贮藏对薄皮甜瓜风味品质的影响时发现,低温贮藏条件下薄皮甜瓜的葡萄糖、蔗糖含量均显著低于室温组。本研究中,果糖、葡萄糖含量低温组均低于常温组;蔗糖含量低温组高于常温组,这与邵青旭[28]的研究结果一致,低温贮藏后果实糖组分含量的变化与蔗糖代谢途径中的蔗糖合成酶、蔗糖磷酸合成酶等酶活力有关[29-30]。张丽萍[11]也探讨了糖组分与南果梨果实香气成分的关系,结果表明南果梨果实在含糖量较高时,酶活力较高,此时果实香气成分变化显著、香气浓郁,说明糖对于南果梨香气成分有一定的贡献。本研究中由糖组分与香气物质的相关性分析得到,常温贮藏条件下酯类、酮类物质相对含量与蔗糖含量呈显著正相关(P<0.05),低温贮藏条件下酯类物质相对含量与蔗糖含量呈显著正相关(P<0.05),也进一步证明了糖组分作为百香果果实香气物质合成的前体物质,为香气的形成提供了底物。
百香果香气成分的代谢途径及参与代谢的酶非常复杂,今后应对百香果香气的形成与代谢途径及相关酶生理功能进行重点研究,并通过对香气物质合成关键酶基因克隆与表达分析,在分子水平上调控香气物质的合成,从而系统解析百香果香气形成机理。
4 结论
研究表明,在以脂肪酸为前体物质合成的代谢途径中,不同贮藏温度条件下,百香果亚麻酸、亚油酸、油酸含量整体呈先上升后下降的趋势,其低温组含量低于常温组,低温组亚麻酸、油酸的峰值较常温组分别延迟4、2 d,说明低温条件对亚麻酸、油酸含量具有一定的抑制作用。
在以氨基酸为前体物质合成的代谢途径中,低温组赖氨酸、组氨酸、脯氨酸、甲硫氨酸、异亮氨酸、酪氨酸、苯丙氨酸、缬氨酸含量的最大峰值较常温组分别延迟2、6、8、2、6、8、8、2 d,说明低温条件对以上氨基酸含量有一定的抑制作用。
在以糖组分为前体物质合成的代谢途径中,不同贮藏温度条件下,百香果葡萄糖、果糖含量整体呈先上升后下降的趋势,其低温组含量低于常温组,低温组葡萄糖、果糖的峰值较常温组分别延迟6、4 d,说明低温条件对葡萄糖、果糖含量具有一定的抑制作用。常温组蔗糖含量在贮藏期间呈快速下降趋势(0~14 d降幅为73.21%),而低温组较好地维持了蔗糖含量(0~20 d降幅为8.70%)。
百香果的香气物质以酯类为主,常温组酯类物质相对含量在第4天出现峰值(60.32%)、第12天下降为40.00%;低温组第20天出现峰值(69.27%)、整个贮藏期内保持在54.62%~69.27%,表明低温贮藏可以维持较高的酯类物质相对含量。
百香果香气合成前体物质与其香气成分的相关性分析显示,亚油酸、油酸、蔗糖、谷氨酸、异亮氨酸、亮氨酸、酪氨酸、缬氨酸、色氨酸对香气成分有显著的正相关,且主要是与酯类、醇类香气物质关系较强。
[1] WYCKHUYS K A G, KORYTKOWSKI C, MARTINEZ J, et al. Species composition and seasonal occurrence of Diptera associated with passionfruit crops in Colombia[J]. Crop Protection, 2012, 32:90-98.
[2] JIMÉNEZ A M, SIERRA C A, RODR GUEZ-PULIDO F J, et al. Physicochemical characterisation of gulupa (Passiflora edulis Sims. fo edulis) fruit from Colombia during the ripening[J]. Food Research International, 2011, 44(7):1912-1918.
GUEZ-PULIDO F J, et al. Physicochemical characterisation of gulupa (Passiflora edulis Sims. fo edulis) fruit from Colombia during the ripening[J]. Food Research International, 2011, 44(7):1912-1918.
[3] 崔忠吉. 广西百香果种植现状及存在问题[J]. 农家参谋, 2018(19):108; 94.
CUI Z J. Current situation and existing problems of passion fruit planting in Guangxi[J]. The Farmers Consultant, 2018(19):108; 94.
[4] 谢林婧, 林碧英, 郑诚乐. 福建百香果产业历史、现状及发展若干思考[J]. 福建热作科技, 2017, 42(4):57-59.
XIE L J, LIN B Y, ZHENG C L. Some thoughts on the history, present situation and development of passion fruit industry in Fujian[J]. Fujian Science &Technology of Tropical Crops, 2017, 42(4):57-59.
[5] 陈美花, 熊拯, 庞庭才. 气调包装对百香果贮藏品质的影响[J]. 食品科学, 2016, 37(20):287-292.
CHEN M H, XIONG Z, PANG T C. Effects of modified atmosphere packaging on quality of passion fruit during storage[J]. Food Science, 2016, 37(20):287-292.
[6] 张佳艳, 任仙娥. 西番莲果汁的研究进展[J]. 食品研究与开发, 2016, 37(11):219-224.
ZHANG J Y, REN X E. Progress in research on passion fruit juice[J]. Food Research and Development, 2016, 37(11):219-224.
[7] MACORIS M S, JANZANTTI N S, DOS SANTOS GARRUTI D, et al. Volatile compounds from organic and conventional passion fruit (Passiflora edulis F. Flavicarpa) pulp[J]. Ciência e Tecnologia De Alimentos, 2011, 31(2):430-435.
[8] PORTO-FIGUEIRA P, FREITAS A, CRUZ C J, et al. Profiling of passion fruit volatiles: An effective tool to discriminate between species and varieties[J]. Food Research International, 2015, 77:408-418.
[9] 潘葳, 刘文静, 韦航, 等. 不同品种百香果果汁营养与香气成分的比较[J]. 食品科学, 2019, 40(22):277-286.
PAN W, LIU W J, WEI H, et al. Comparative analysis of nutritional and aroma components in passion fruit juices from five cultivars[J]. Food Science, 2019, 40(22):277-286.
[10] LI C B, XIN M, LI L, et al. Characterization of the aromatic profile of purple passion fruit (Passiflora edulis Sims) during ripening by HS-SPME-GC/MS and RNA sequencing[J]. Food Chemistry, 2021, 355:129685.
[11] 张丽萍. 冷藏及1-MCP处理对南果梨挥发性香气物质代谢的影响及其调控[D]. 沈阳: 沈阳农业大学, 2013.
ZHANG L P. Effects of refrigeration and 1-methylcyclopropene on the metabolic of volatile aroma in Nanguo pear and control[D]. Shenyang: Shenyang Agricultural University, 2013.
[12] EL HADI M A M, ZHANG F J, WU F F, et al. Advances in fruit aroma volatile research[J]. Molecules, 2013, 18(7):8200-8229.
[13] 程焕, 陈健乐, 周晓舟, 等. 水果香气物质分析及合成途径研究进展[J]. 中国食品学报, 2016, 16(1):211-218.
CHENG H, CHEN J L, ZHOU X Z, et al. Advances in identification and biosynthetic pathwayof key aroma in fruits[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(1):211-218.
[14] 陈晶, 李正国. 脂氧合酶在果实成熟衰老中的作用[J]. 广州食品工业科技, 2002, 18(1):50-53.
CHEN J, LI Z G. The roles of lipoxygenase in ripening and senescence of fruits in plants[J]. Guangzhou Food Science and Technology, 2002, 18(1):50-53.
[15] HATANAKA A. The biogeneration of green odour by green leaves[J]. Phytochemistry, 1993, 34(5):1201-1218.
[16] ROWAN D D, LANE H P, ALLEN J M, et al. Biosynthesis of 2-methylbutyl, 2-methyl-2-butenyl, and 2-methylbutanoate esters in red delicious and granny Smith apples using deuterium-labeled substrates[J]. Journal of Agricultural and Food Chemistry, 1996, 44(10):3276-3285.
[17] 把灵珍, 王波, 雷春妮, 等. “中国苦水玫瑰” 氨基酸含量及其代谢香气组分与种植区域的相关性[J]. 食品科学, 2023, 44(8):277-283.
BA L Z, WANG B, LEI C N, et al. Correlation analysis of amino acids and amino acid-derived aroma compounds of Chinese kushui rose petals with planting locations[J]. Food Science, 2023, 44(8):277-283.
[18] 杨雪莲, 李涵, 李斌奇, 等. 水杨酸处理对采后百香果品质的影响[J]. 食品与发酵工业, 2021, 47(17):206-212.
YANG X L, LI H, LI B Q, et al. Effect of salicylic acid treatment on quality of postharvest passion fruit[J]. Food and Fermentation Industries, 2021, 47(17):206-212.
[19] 张楠, 谢宇, 唐小雪, 等. 不同形状猴头菇营养成分的比较分析[J]. 核农学报, 2018, 32(10):1992-2001.
ZHANG N, XIE Y, TANG X X, et al. Comparative analysis of nutritional components in different shapes of mushroom from Hericium erinaceus[J]. Journal of Nuclear Agricultural Sciences, 2018, 32(10):1992-2001.
[20] 李昌宝, 孙健, 李丽, 等. 贮藏温度对香蕉糖酸组分的影响[J]. 食品工业科技, 2017, 38(7):305-310.
LI C B, SUN J, LI L, et al. Effect of storing temperatures on the sugar and acid compositions in banana fruits[J]. Science and Technology of Food Industry, 2017, 38(7):305-310.
[21] 辛明, 李昌宝, 孙宇, 等. 百香果贮藏过程中香气成分及其相关酶活性的变化特征[J]. 热带作物学报, 2021, 42(5):1472-1484. XIN M, LI C B, SUN Y, et al. Variation characteristics of aroma components and related enzyme activities during storage of passion fruit(Passiflora caerulea L.)[J]. Chinese Journal of Tropical Crops, 2021, 42(5):1472-1484.
[22] KIM J Y, OK E, KIM Y J, et al. Oxidation of fatty acid may be enhanced by a combination of pomegranate fruit phytochemicals and acetic acid in HepG2 cells[J]. Nutrition Research and Practice, 2013, 7(3):153-159.
[23] CONTRERAS C, TJELLSTRÖM H, BEAUDRY R M. Relationships between free and esterified fatty acids and LOX-derived volatiles during ripening in apple[J]. Postharvest Biology and Technology, 2016, 112:105-113.
[24] WYLLIE S G, FELLMAN J K. Formation of volatile branched chain esters in bananas (Musa sapientum L.)[J]. Journal of Agricultural and Food Chemistry, 2000, 48(8):3493-3496.
[25] CAO S F, YANG Z F, CAI Y T, et al. Fatty acid composition and antioxidant system in relation to susceptibility of loquat fruit to chilling injury[J]. Food Chemistry, 2011, 127(4):1777-1783.
[26] 杨青珍. 猕猴桃果实采后冷害发生生理机制及调控作用[D]. 杨凌: 西北农林科技大学, 2013.
YANG Q Z. Physiological mechanism and regulation of chilling injury in postharvest kiwifruit[D]. Yangling: Northwest A &F University, 2013.
[27] 谭卓. 基于脂肪酸代谢的冷藏南果梨香气变淡机理及调控研究[D]. 沈阳: 沈阳农业大学, 2018.
TAN Z. Study on the mechanism and regulation of aroma weakening of refrigerated ‘Nanguo’ pears based on fatty acid metabolism[D]. Shenyang: Shenyang Agricultural University, 2018.
[28] 邵青旭. 低温贮藏对薄皮甜瓜风味品质的影响[D]. 沈阳: 沈阳农业大学, 2019.
SHAO Q X. Effects of low temperature storage on the flavor qualities of oriental melon[D]. Shenyang: Shenyang Agricultural University, 2019.
[29] ITAI A, HATANAKA R, IRIE H, et al. Effects of storage temperature on fruit quality and expression of sucrose phosphate synthase and acid invertase genes in Japanese pear[J]. The Horticulture Journal, 2015, 84(3):227-232.
[30] PALMA F, CARVAJAL F, LLUCH C, et al. Changes in carbohydrate content in zucchini fruit (Cucurbita pepo L.) under low temperature stress[J]. Plant Science, 2014, 217:78-86.