脂溶性营养物质具有抗氧化、抗高血压、提高免疫力等有利人体健康的生物学活性,通常溶解在脂肪中,进而被人体摄入、消化、吸收[1]。异硫氰酸苄酯(benzyl isothiocyanate, BITC)是主要存在于十字花科植物中的一类天然脂溶性活性成分,具有抗癌、抗菌、抗氧化等作用[2]。然而BITC易降解、水溶性差、生物利用度低、不易被人体吸收,不能发挥其功能特性,使其在食品行业的应用受到限制[3]。近年来有关BITC乳液的研究仅见水包油纳米乳液[4-5],选用Pickering乳液系统实现对BITC的递送,是一种成本较低、能够减缓BITC降解、增强稳定性的方法,目前还鲜有报道。
由固体颗粒代替表面活性剂稳定的乳液统称为Pickering乳液[6]。Pickering乳液跟传统乳液相比具有成本低、生物相容性好、安全性高等优势,已经被广泛应用于食品体系中[7]。近年来常用于稳定Pickering乳液的食品级固体颗粒有壳聚糖、玉米醇溶蛋白、大豆分离蛋白等[8-9]。随着乳液在食品工业中应用的不断发展,食品级Pickering乳液的研制与开发已成为研究的热点。
木犀草素(luteolin, LUT)是一种广泛分布于各种植物中的天然多酚类成分,具有消炎、保肝、抗癌等多种生理活性,但LUT中酚羟基的存在及分子间作用力导致其亲脂性、亲水性较差,这极大限制了其在食品中的实际应用和发展[10]。将LUT制备成乳液可改善其双亲特性,进而提高生物利用度。目前常见采用反溶剂沉淀法将多酚类化合物以低溶解性颗粒形式分散在Pickering乳液中,紧密吸附在油水界面,从而使乳液体系稳定[11-12]。
油的类型在决定乳液的稳定能力方面发挥了重要作用。MA等[13]研究5种油相所制备的姜黄素乳液,发现中链甘油三酯作为油相时姜黄素含量最高,乳液最为稳定;SHI等[14]研究通过超声乳化法制备4种含不同油相的亚麻籽分离蛋白乳液的稳定性,结果表明亚麻籽油乳液储存稳定性最佳。目前,油的类型对LUT稳定的Pickering乳液体系的影响尚未见报道。本研究选择碳链长度和不饱和双键数量不同的油为代表来制备油相。其中玉米油(corn oil, CO)主要成分为亚油酸,亚麻籽油(linseed oil, LO)主要成分是α-亚麻酸,南极磷虾油(Antarctic krill oil, AKO)主要成分为EPA和DHA[15-17],旨在明确不同种类油与Pickering乳液稳态化之间的关联性。
本实验利用反溶剂沉淀法制备LUT悬浮液,用其构筑了不同油相负载BITC的LUT Pickering乳液,以流变特性、光稳定性、粒径、电位、微观结构、抗氧化特性和BITC保留率为指标,考察不同碳链长度和不饱和双键数量的油相对LUT Pickering乳液稳定性的影响。本研究为扩大LUT的应用范围及提高脂溶性活性物质在Pickering乳液中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
CO,山东西王食品有限公司;LO、LUT、2-硫代巴比妥酸、0.1 mol/L硫代硫酸钠溶液,上海麦克林生物有限公司;AKO,辽渔南极磷虾科技发展有限公司;BITC,美国SIGMA公司;乙酸、无水乙醇,天津市富宇精细化加工有限公司;正己烷、甲醇、乙腈均为色谱纯,美国SIGMA公司。
1.2 仪器与设备
LC-RE-52A旋转蒸发仪,青岛明博科学仪器有限公司;T25高速分散机,德国IKA公司;UV-2100B紫外可见分光光度计,上海元析仪器有限公司;PandaPLUS+2000高压均质机,意大利GEA Niro公司;UV-B紫外灯照射仪,铂金埃尔默仪器有限公司;Zeta sizer 3000HSA激光粒度仪,英国MALVERN仪器公司;TA-DHR2流变仪,美国TA公司;LC-20AD岛津液相色谱,日本SHIMADZU公司;SU8010冷场扫描电镜,日本HITACHI公司。
1.3 实验方法
1.3.1 LUT悬浮液的制备
参考WANG等[18]的方法并适当修改,将0.216 g LUT完全溶解于54 mL无水乙醇中,缓慢注入6倍体积的去离子水于2 000 r/min搅拌的LUT-乙醇溶液中,搅拌1 h,在旋转蒸发仪中以45 ℃、50 r/min条件将其中乙醇完全挥发,获得淡黄色半透明的LUT悬浮液。
1.3.2 LUT Pickering乳液的制备
将BITC分别溶于CO、LO和AKO中,在2 000 r/min 转速搅拌25 min,以获得含有BITC的油相(5 mg/mL)。将LUT悬浮液和不同油相按体积比9∶1混合,在10 000 r/min条件下高速分散2 min得到LUT粗乳液。将粗乳液在500 bar下高压均质循环3 次得到LUT Pickering乳液。
1.3.3 LUT Pickering乳液的流变特性分析
参考PI等[19]的方法并适当修改,分别吸取1.5 mL新制备的乳液滴于测量平台,两板间隙1 mm,使两板间均匀覆盖乳液且无气泡,测试温度为25 ℃,剪切速率为0.1~100 rad/s。测定不同油相的Pickering乳液表观黏度的变化曲线。
1.3.4 LUT Pickering乳液不同光照条件下的稳定性测定
根据WANG等[18]的方法将新鲜制备的3种不同油相Pickering乳液分别加入透明样品瓶中,放置在避光、自然光和紫外线(20 W)照射的条件下2 h,测定乳液的浊度。将不同乳液样品用去离子水稀释20倍,在500 nm波长下检测吸光度,浊度的计算方法如公式(1)所示:
浊度![]()
(1)
式中:Ab,新鲜配制稀释乳液介质的吸光度值;Ac,不同光照条件操作后稀释乳液介质的吸光度;A2,实验操作前稀释介质的吸光度;A1,不同光照条件操作后稀释介质的吸光度。
1.3.5 LUT Pickering乳液的粒径和电位测定
参照ZHANG等[20]的方法并略做修改,将新鲜制备的Pickering乳液在4 ℃条件下贮存14 d,在第0、1、4、7、14天测定Pickering乳液的平均粒径和Zeta电位,并观察外观形态变化。所有样品测试前先用去离子水稀释100倍,测试温度为25 ℃,水相折射率为1.33,每个样品平行测定3次,取平均值。
1.3.6 LUT Pickering乳液的微观形态观察
参考TANG等[21]的方法并适当修改,通过冷场扫描电子显微镜(cryo-scanning electron microscopy, cryo-SEM)观察不同油相制备的新鲜Pickering乳液的微观结构。样品滴入样品盘后,放入液氮快速冷冻至-180 ℃。将冷冻样品在真空条件下转移至制备室升华以去除水分。对样品喷金处理后,在2 kV的加速电压下获得样品的cryo-SEM图像。
1.3.7 LUT Pickering乳液的油脂氧化测定
将新鲜制备的Pickering乳液置于37 ℃环境中贮藏14 d,并在第0、1、4、7、10、12、14天分别取不同油相的乳液测定其初级氧化产物和次级氧化产物。
1.3.7.1 初级氧化产物含量的测定
参照GB/T 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》中滴定法进行测定。
1.3.7.2 次级氧化产物含量的测定
参照吴梓宣[22]的方法并稍加修改,0.5 mL样品中加入2.5 mL TBARS溶液(0.375% 2-硫代巴比妥酸,15% 三氯乙酸,0.25 mol/L盐酸),将得到的混合物在沸水浴中加热20 min,待溶液变为粉红色后,用流水冷却10 min,以8 000 r/min 离心15 min。取离心后上清液,在532 nm处测量吸光度。计算如公式(2)所示:
TBARS=A532×2.77
(2)
式中:TBARS,硫代巴比妥酸值,mg/kg;A532,样品在532 nm处的吸光度;2.77,换算系数。
1.3.8 LUT Pickering乳液中BITC的保留率测定
将新鲜制备的Pickering乳液置于37 ℃环境中贮藏14 d,根据ZHANG等[20]的方法并稍加修改。将1 mL正己烷与1 mL乳液样品充分震荡后吸除上层,向剩余溶液中加入1 mL甲醇和1 mL正己烷,提取上清液用于BITC包埋率的分析。采用高效液相色谱法测定,选用依利特Hypersil 100-5 ODS液相色谱柱(250×4.6 mm,5 μm),超纯水为流动相A,乙腈为流动相B。流动相设置为:30% A相和70% B相,流速为0.8 mL/min,上样时间15 min,上样量为10 μL。采用光电二极管阵列检测器在246 nm波长下对BITC进行定量分析。
1.4 统计分析
所有实验均至少做3次平行并取平均值,实验数据以平均值±标准差表示。采用SPSS 19.0软件对以上各指标进行ANOVA差异显著性分析和显著性检验方法(Duncan)多重比较,P<0.05表示具有显著性差异。
2 结果与分析
2.1 LUT Pickering乳液的流变特性分析
乳液的黏度是乳液物性学基本性质之一[23]。根据Stoke定律,乳液黏度越大,液滴的上浮速率减缓,乳液维持稳定性能力越强[24]。由图1可知,随着剪切速率的增加,3种乳液的表观剪切黏度均下降,当剪切速率增加到20 s-1时,表观黏度趋于零并基本保持不变,发生非牛顿流体剪切稀化现象[25]。乳液在剪切过程中油滴相互分离是发生剪切稀化的主要原因。其中由碳链长度最长、不饱和度最高的AKO为油相制备的乳液具有最大的黏度值,这可能是因为其相互交联形成的网状结构阻碍液滴分子的移动,这在一定程度上增加了乳液的黏度值,进而改善乳液的稳定性[23]。CO和LO碳链长度相同但不饱和双键含量不同,以不饱和双键含量较高的LO为油相制备的乳液液滴间相互作用力较小,导致液滴彼此间距离略大,发生的挤压较小,进而表观黏度较小。
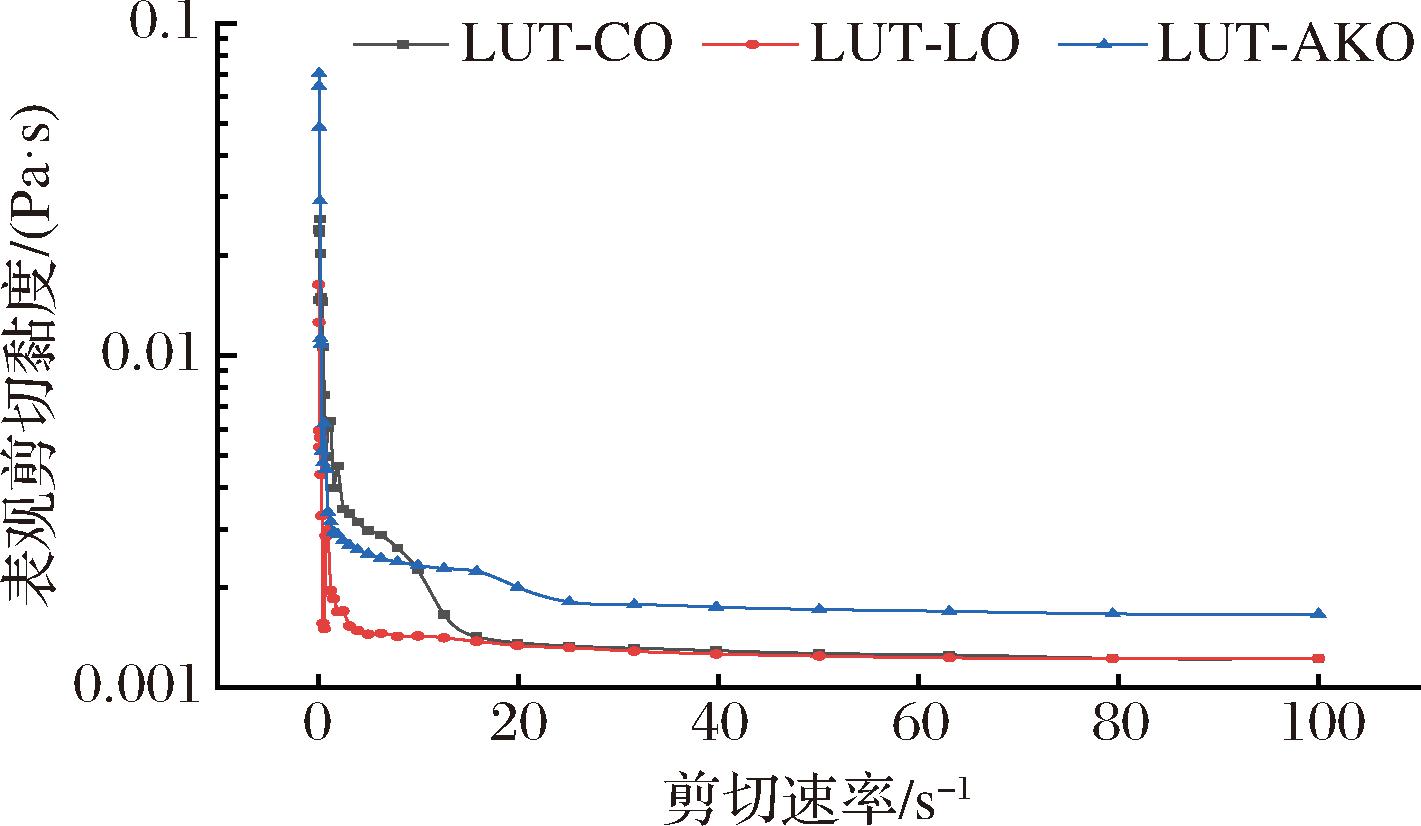
图1 不同油相的LUT Pickering乳液流变特性变化曲线
Fig.1 Rheological characteristics of LUT Pickering emulsions with different oil phases
2.2 LUT Pickering乳液不同光照条件下的稳定性
乳液浊度能反映乳液的乳化程度,是一种体现乳化层稳定性的检测方法[26]。由图2可知,在相同的光照条件下放置2 h,3种不同油相制成的乳液浊度无显著性差异(P>0.05);在不同光照条件下放置2 h,相同油相制成的乳液的浊度同样无显著性差异(P>0.05),所有乳液的外观基本无明显变化,未出现分层、破乳等不良现象。以上结果表明,短时间光照对碳链长度和不饱和双键数量不同的油相制备的LUT Pickering乳液稳定性不会产生大幅不良影响,这对Pickering乳液贮藏和运输有一定实用意义。

a-浊度变化;b-外观观察
图2 不同光照条件下Pickering乳液的浊度变化和外观观察
Fig.2 Turbidity changes of Pickering emulsions under different light conditions and appearance observation
注:图2-b中1、2、3分别为LUT-CO、LUT-LO、LUT-AKO Pickering乳液; 不同大写字母表示相同光照条件不同油相差异性显著,不同小写字母 表示不同光照条件同一油相差异性显著(P<0.05)。
2.3 LUT Pickering乳液的粒径和电位测定
平均粒径是衡量Pickering乳液稳定性的关键指标之一。通常情况下,乳液液滴的平均粒径越小,乳液越倾向于稳定[27]。由图3-a可知,3种不同油相制备的乳液在贮藏期间未出现分层、漏油、乳析等不良现象。如图3-b所示,随着贮藏时间的延长,LUT-CO、LUT-LO、LUT-AKO Pickering乳液的平均粒径逐渐增加,这是因为乳液中液滴相互碰撞的概率变大,使液滴间发生了一定程度的聚集[28]。在同一贮藏时间的条件下,3种乳液的粒径之间存在显著性差异(P<0.05)。TEO等[29]研究表明油相的脂肪酸碳链长度对乳液粒径有显著影响,短链脂肪酸通常会使乳液形成更大的囊泡,导致乳液的粒径更大。
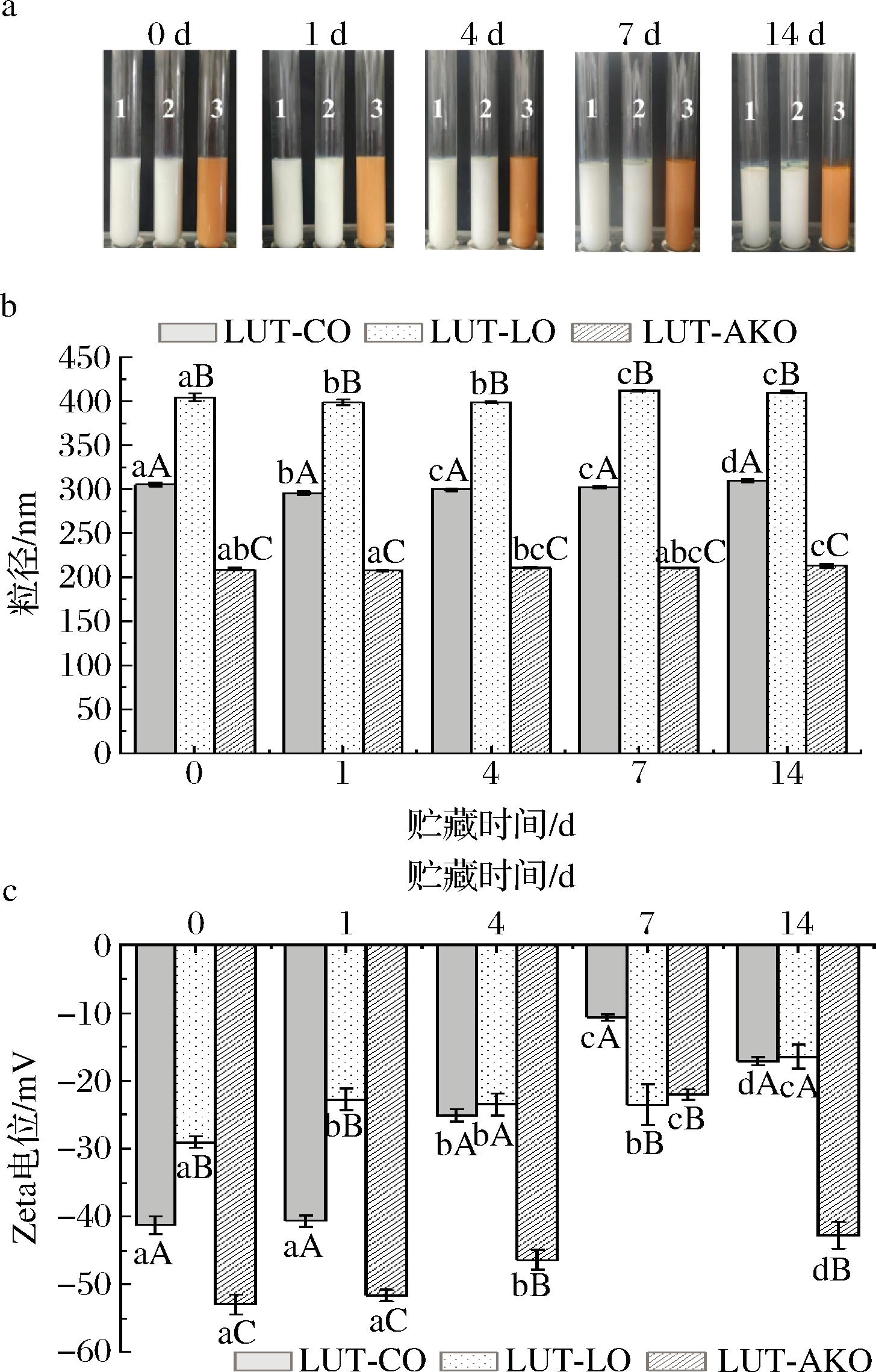
a-外观;b-粒径;c-电位
图3 贮藏期间不同油相Pickering乳液的外观、粒径和电位
Fig.3 Appearance, particle sizes, and Zeta potential of Pickering emulsions with different oil phases during storage
注:图3-a中1、2、3分别为LUT-CO、LUT-LO、LUT-AKO Pickering乳液; 不同大写字母表示同一贮藏时间不同油相差异性显著,不同小写字母 表示不同贮藏时间同一油相差异性显著(P<0.05)。
Zeta电位也是常用于表征乳液稳定性的重要指标之一,乳液电位的绝对值越大,说明乳液中颗粒之间存在的排斥力越大,能够更好的抑制乳液液滴间的聚集,使乳液具有更好的稳定性[30]。由图3-c可知,3种乳液均带负电,随着贮藏时间的延长,LUT-CO、LUT-LO和LUT-AKO Pickering乳液的Zeta电位绝对值分别从(41.27±1.25)、(29.03±0.86)、(52.90±1.45) mV(0 d)显著下降至(17.10±0.61)、(16.40±1.78)、(42.73±1.96) mV(14 d)(P<0.05)。贮藏14 d时,LUT-AKO Pickering乳液的Zeta电位绝对值最大,即该乳液颗粒间排斥作用最大,为乳液油水界面提供更强的相互作用,从而抑制液滴聚集[31],这与平均粒径的结果相对应。以上结果表明,LUT-AKO Pickering乳液在贮藏14 d内具有最佳的稳定性。
2.4 LUT Pickering乳液的微观形态观察
通过cryo-SEM观察了3种Pickering乳液的微观结构。如图4所示,不同油相制备的乳液微观结构有明显区别,碳链长度最长的LUT-AKO Pickering乳液比LUT-CO、LUT-LO Pickering乳液空间结构分布更为均匀,颗粒尺寸更小,且形成更为稳定的网状结构,LUT-CO、LUT-LO Pickering乳液多为不规则颗粒体的聚合结构,碳链长度相当、不饱和双键含量较少的LUT-CO Pickering乳液比LUT-LO Pickering乳液颗粒尺寸小。该结果与乳液表观黏度(图1)和粒径(图2-b)结果相符。刘芸杭[32]研究发现,在含油量相同的条件下,不同比例混合油(长链甘油三酯和中链甘油三酯)制备自乳化乳液的液滴随着长链甘油三酯比例增加而明显变小且分布均匀,此结果与本研究一致。

a-LUT-CO;b-LUT-LO;c-LUT-AKO
图4 不同油相的LUT Pickering乳液冷场扫描电镜图
Fig.4 cryo-SEM images of LUT Pickering emulsions with different oil phases
2.5 LUT Pickering乳液的油脂氧化测定
乳液中油脂酸败是影响乳液品质的重要因素。初级氧化产物反映油脂和脂肪酸的氧化程度,其含量用过氧化值(peroxide value,POV)表示[33]。由图5-a可知,贮藏14 d后,LUT-AKO Pickering乳液的POV显著增加(P<0.05),而LUT-CO和LUT-LO Pickering乳液的POV无显著性变化(P>0.05)。LUT在油脂初级氧化阶段发挥其抗氧化作用,抑制不饱和双键含量较少的玉米油和亚麻籽油的氧化,从而抑制氢过氧化物生成,两者相互作用进而使POV无显著性变化[26]。在乳液贮藏7 d后,3种Pickering乳液的POV大小为LUT-AKO>LUT-LO>LUT-CO。当碳链中存在碳碳双键时,连接双键的碳原子容易受自由基攻击而氧化,不饱和双键含量越多被氧化的概率越大[23]。
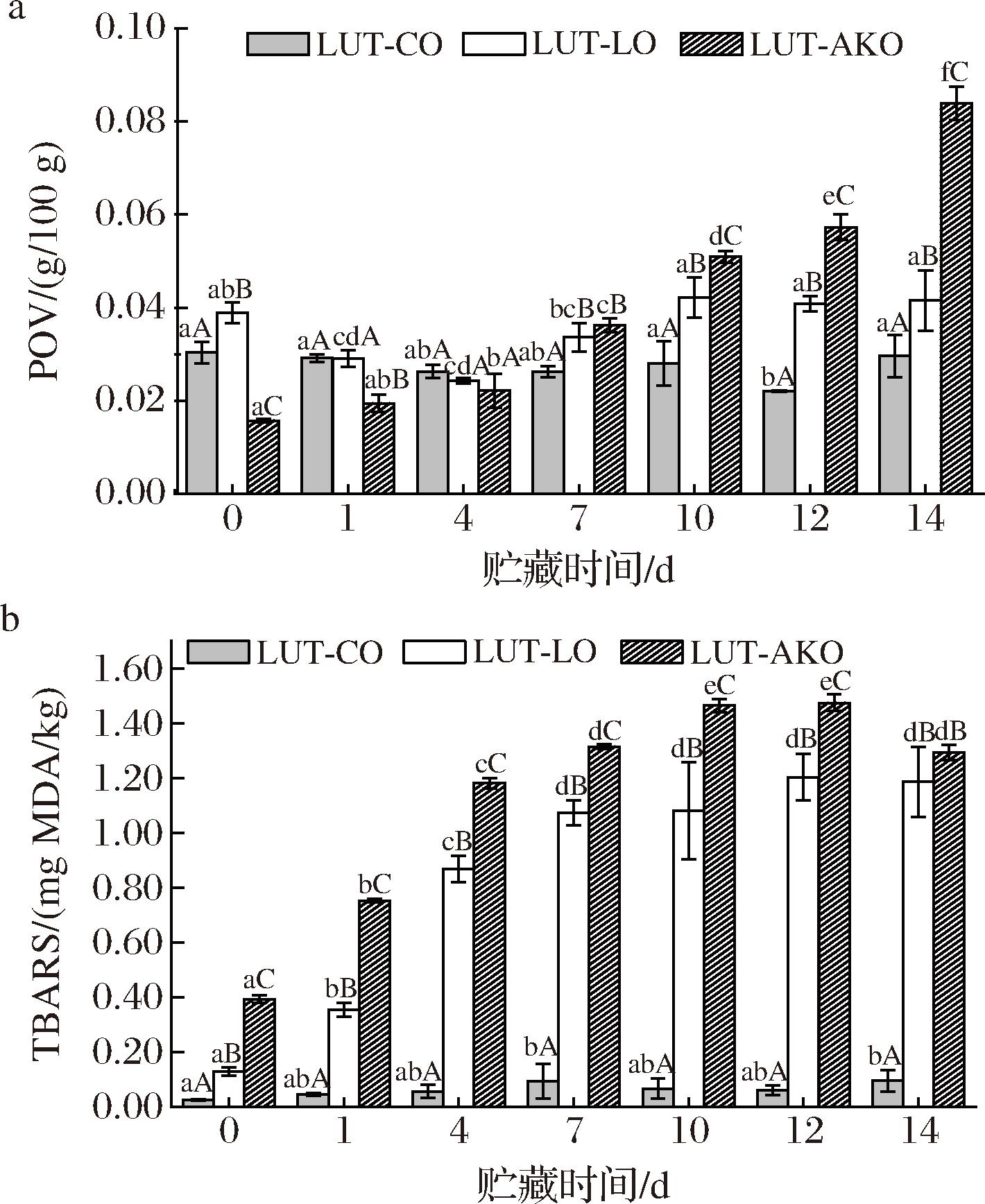
a-过氧化值;b-硫代巴比妥酸值
图5 不同油相Pickering乳液在贮藏期间的过氧化值和 硫代巴比妥酸值
Fig.5 POV and TBARS values of Pickering emulsions with different oil phases during storage
注:不同大写字母表示同一贮藏时间不同油相差异性显著, 不同小写字母表示不同贮藏时间同一油相差异性显著(P<0.05)。
TBARS是用于反映脂肪初级氧化产物进一步形成以丙二醛为代表的次级氧化产物的程度[34]。如图5-b所示,贮藏14 d后,3种乳液的TBARS值均发生显著性增加(P<0.05)。LUT-CO与LUT-LO Pickering乳液的TBARS值在贮藏前7 d明显升高,进入贮藏中后期则逐渐趋于稳定。LUT-AKO Pickering乳液的TBARS值呈现先升高后下降的趋势。这可能是因为AKO中的脂肪先被氧化,产生了次级氧化产物丙二醛导致TBARS的增加,其值显著升高至最高点后丙二醛降解,生成有机酸或醇类进而TBARS值下降[35]。以上结果说明制备LUT Pickering乳液的油相中碳链长度越长、双键个数越多其氧化稳定性越弱,更容易发生氧化反应。该结果与朱波等[36]探究山茶油、葵花籽油、亚麻籽油制备的水包油乳液氧化稳定性一致。
2.6 LUT Pickering乳液中BITC的保留率测定
在乳液包埋活性物质的研究中,保留率是衡量其研究效果的重要指标[37]。如图6所示,在贮藏期间LUT-AKO Pickering乳液BITC保留率一直显著高于另外两种乳液(P<0.05),随着贮藏时间的延长,LUT-CO、LUT-LO和LUT-AKO Pickering乳液BITC保留率分别从(52.09±2.06)%、(56.46±2.23)%、(71.57±2.29)%(0 d)下降到(44.75±3.39)%、(50.03±3.53)%、(65.25±1.45)%(14 d)(P<0.05)。推测该现象发生主要是因为BITC在不同油相中溶解性不同,碳链长度越长、不饱和双键含量越高则BITC溶解性越高。该结果与姜卉[38]研究一致,即长链甘油三酯跟中链甘油三酯相比制备的乳液能更好的溶解BITC。
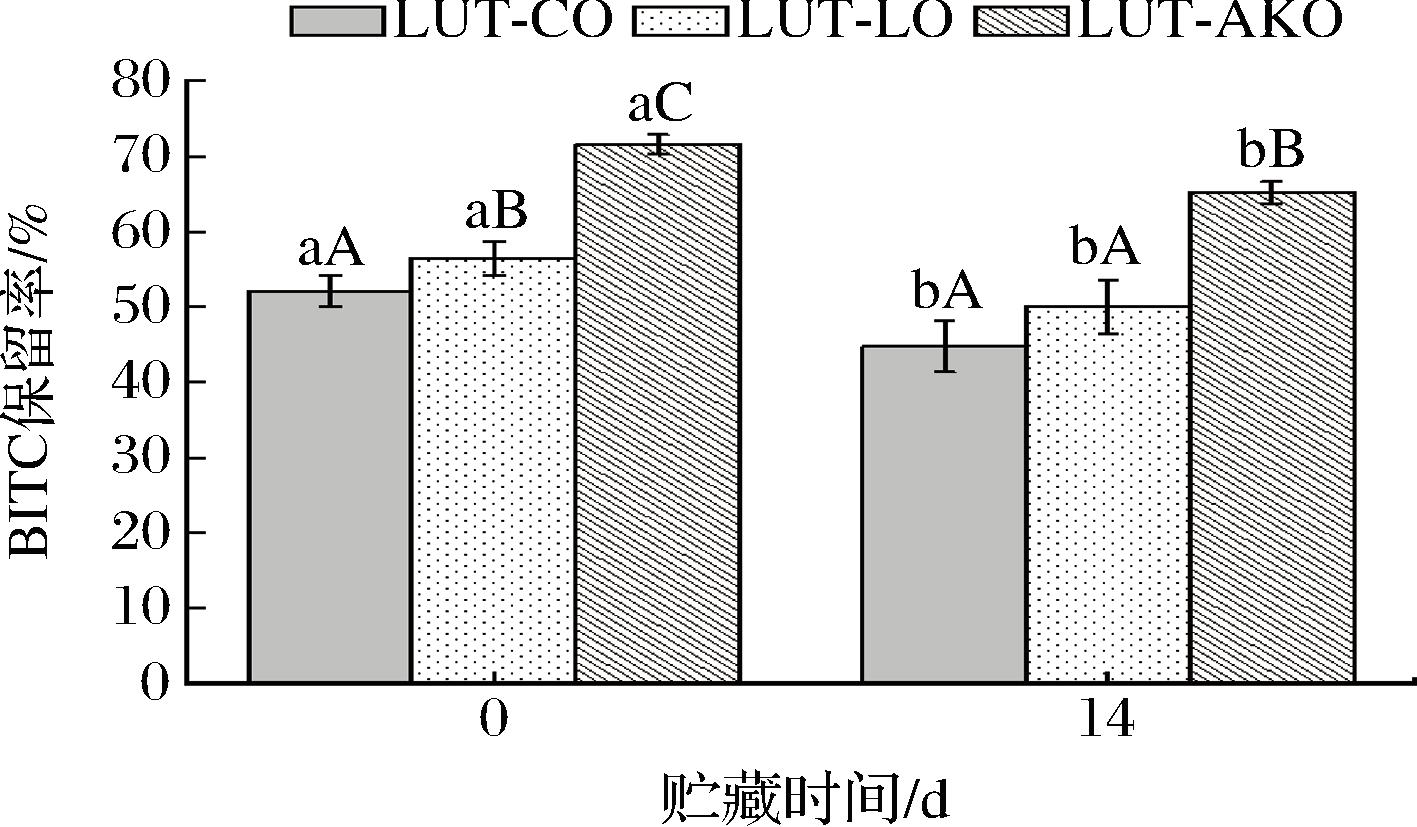
图6 贮藏期间不同油相Pickering乳液的BITC保留率
Fig.6 BITC retention rates of Pickering emulsions with different oil phases during storage
注:不同大写字母表示同一贮藏时间不同油相差异性显著, 不同小写字母表示不同贮藏时间同一油相差异性显著(P<0.05)。
3 结论
本实验以LUT为乳化剂,研究碳链长度和不饱和双键含量不同的CO、LO、AKO对包埋BITC的LUT Pickering乳液稳态化的影响。结果表明,短时间光照对3种Pickering乳液稳定性无影响;LUT-AKO Pickering乳液具有更高的表观黏度和电位绝对值、更小的平均粒径,微观形貌为更均匀的网状结构,虽然LUT-AKO Pickering乳液的氧化稳定性略差,但贮藏14 d后其BITC保留率最高。与LUT-LO Pickering乳液相比,LUT-CO Pickering乳液在表观黏度、抗氧化能力、粒径及微观结构上均表现更佳,更为稳定。本研究对不同链长和不饱和双键含量的油相包埋BITC构筑Pickering乳液的稳态化差异进行初步探索,为后续复合纳米粒子乳液或多层乳液的制备提供了理论研究基础。
[1] 王笑涵, 姜卉, 吴海涛, 等.大黄鱼卵分离蛋白乳液的构筑及其体外消化规律[J].食品科学, 2020, 41(18):8-13.
WANG X H, JIANG H, WU H T, et al.Construction and in vitro digestion properties of Pseudosciaena crocea roe protein isolate-stabilized emulsion[J].Food Science, 2020, 41(18):8-13.
[2] KHAMIS I, HEIKKILA J J.Effect of isothiocyanates, BITC and PEITC, on stress protein accumulation, protein aggregation and aggresome-like structure formation in Xenopus A6 kidney epithelial cells[J].Comparative Biochemistry and Physiology Part C: Toxicology &Pharmacology, 2018, 204:1-13.
[3] ROUSSEAU D.Fat crystals and emulsion stability—A review[J].Food Research International, 2000, 33(1):3-14.
[4] LIU Z Y, LIN S Y, LIU W W, et al.Construction of benzyl isothiocyanate-loaded fish skin gelatin-luteolin compound emulsion delivery system, and its digestion and absorption characteristics[J].Journal of the Science of Food and Agriculture, 2023, 103(4):1864-1873.
[5] TIAN T, TONG X H, YUAN Y, et al.Preparation of benzyl isothiocyanate nanoemulsions by different emulsifiers:Stability and bioavailability[J].Process Biochemistry, 2021, 111:128-138.
[6] LI F F, LI X H, HUANG K L, et al.Preparation and characterization of Pickering emulsion stabilized by hordein-chitosan complex particles[J].Journal of Food Engineering, 2021, 292:110275.
[7] 冯鑫, 马良, 戴宏杰, 等.食品级Pickering乳液的稳定性及β-胡萝卜素的装载研究[J].食品与发酵工业, 2021, 47(6):18-25.
FENG X, MA L, DAI H J, et al.The study on stability of food grade Pickering emulsion and the loading of β-carotene[J].Food and Fermentation Industries, 2021, 47(6):18-25.
[8] SHARKAWY A, BARREIRO M F, RODRIGUES A E.Chitosan-based Pickering emulsions and their applications:A review[J].Carbohydrate Polymers, 2020, 250:116885.
[9] SOUZA E M C, FERREIRA M R A, SOARES L A L.Pickering emulsions stabilized by zein particles and their complexes and possibilities of use in the food industry:A review[J].Food Hydrocolloids, 2022, 131(17):107781.
[10] 康芷若. 木犀草素纳米复合物的制备及药理学评价[D].沈阳:沈阳农业大学, 2022.
KANG Z R.Preparation and pharmacological evaluation of luteolin nanocomplexes[D].Shenyang:Shenyang Agricultural University, 2022.
[11] 葛思彤, 李琦, 贾睿, 等.基于玉米醇溶蛋白/没食子酸复合纳米颗粒提升玉米油Pickering乳液的氧化稳定性[J].食品科学, 2022, 43(20):78-85.
GE S T, LI Q, JIA R, et al.Zein/gallic acid composite nanoparticles to improve the oxidation stability of corn oil Pickering emulsion[J].Food Science, 2022, 43(20):78-85.
[12] SUN Y W, CHAI X H, HAN W J, et al.Pickering emulsions stabilized by hemp protein nanoparticles:Tuning the emulsion characteristics by adjusting anti-solvent precipitation[J].Food Hydrocolloids, 2023, 138:108434.
[13] MA P H, ZENG Q H, TAI K D, et al.Preparation of curcumin-loaded emulsion using high pressure homogenization:Impact of oil phase and concentration on physicochemical stability[J].LWT-Food Science and Technology, 2017, 84:34-46.
[14] SHI J Y, XIAO J X, LIU L, et al.Ultrasonic assisted oil-in-water emulsions stabilized by flaxseed protein isolate:Influence of different oils[J].Journal of Dispersion Science and Technology, 2022, 43(12):1789-1800.
[15] 霍超, 纳文娟, 徐桂花.玉米油的主要功效成分及开发应用前景[J].中国食物与营养, 2008, 14(10):37-38.
HUO C, NA W J, XU G H. Health function of corn oil and its utilization[J].Food and Nutrition in China, 2008, 14(10):37-38.
[16] 廖振林,李倩滢, 陈俊杰, 等.亚麻籽油组分的功能活性研究进展[J].现代食品科技, 2021, 37(11):379-389;337.
LIAO Z L, LI Q Y, CHEN J J, et al.Research progress on the functional activity of flaxseed oil components[J].Modern Food Science and Technology, 2021, 37(11):379-389;337.
[17] 田晓清, 杨桥, 邵盛男, 等.南极磷虾脂溶性成分的研究进展[J].海洋渔业, 2011, 33(4):462-466.
TIAN X Q, YANG Q, SHAO S N, et al.The research progress of ester-soluble constituents of Antarctic Krill [J].Marine Fisheries, 2011, 33(4):462-466.
[18] WANG L, LU S M, DENG Y P, et al.Pickering emulsions stabilized by luteolin micro-nano particles to improve the oxidative stability of pine nut oil[J].Journal of the Science of Food and Agriculture, 2021, 101(4):1314-1322.
[19] PI G L, LI Y M, BAO M T, et al.Novel and environmentally friendly oil spill dispersant based on the synergy of biopolymer xanthan gum and silica nanoparticles[J].ACS Sustainable Chemistry and Engineering, 2016, 4(6):3095-3102.
[20] ZHANG X Y, LIU Z Y, WANG A L, et al.Influence of fish skin gelatin-sodium alginate complex stabilized emulsion on benzyl isothiocyanate stability and digestibility in vitro and in vivo[J].Journal of the Science of Food and Agriculture, 2022, 102(13):5680-5689.
[21] TANG Y, WANG X H, YU J H, et al.Fish skin gelatin-based emulsion as a delivery system to protect lipophilic bioactive compounds during in vitro and in vivo digestion:The case of benzyl isothiocyanate[J].LWT-Food Science and Technology, 2020, 134(2):110145.
[22] 吴梓宣. 黄渤海主要扇贝暂养净化及贮藏过程中脂质变化及控制[D].大连:大连工业大学, 2019.
WU Z X.Study on changes of lipids and their control in major scallops from the yellow sea and the bohai sea during aquaculture purification and storage[D].Dalian:Dalian Polytechnic University, 2019.
[23] 付冬文. Pickering型和传统剂型DHA藻油乳液体系的构建及产品开发[D].南昌:南昌大学, 2020.
FU D W.Construction of Pickering and traditional DHA algal oil emulsion systems and its product development[D].Nanchang:Nanchang University, 2020.
[24] WANG W N, WANG R Y, YAO J, et al.Effect of ultrasonic power on the emulsion stability of rice bran protein-chlorogenic acid emulsion[J].Ultrasonics Sonochemistry, 2022, 84:105959.
[25] TAHERIAN A R, FUSTIER P, BRITTEN M, et al.Rheology and stability of beverage emulsions in the presence and absence of weighting agents:A review[J].Food Biophysics, 2008, 3(3):279-286.
[26] 王璐. 花生果实荚壳中木犀草素的提取纯化、纳米粒制备及其稳定Pickering乳液的设计与研究[D].哈尔滨:东北林业大学, 2020.
WANG L.Extraction and purification of luteolin from peanut shell, preparation of nanoparticles and design and study of stable Pickering emulsion[D].Harbin:Northeast Forestry University, 2020.
[27] ZOU H N, ZHAO N, SUN S, et al.High-intensity ultrasonication treatment improved physicochemical and functional properties of mussel sarcoplasmic proteins and enhanced the stability of oil-in-water emulsion[J].Colloids and Surfaces A Physicochemical and Engineering Aspects, 2020, 589:124463.
[28] PERIASAMY V S, ATHINARAYANAN J, ALSHATWI A A.Anticancer activity of an ultrasonic nanoemulsion formulation of Nigella sativa L.essential oil on human breast cancer cells[J].Ultrasonics Sonochemistry, 2016, 31:449-455.
[29] TEO Y Y, MISRAN M, LOW K H, et al.Effect of unsaturation on the stability of C18 polyunsaturated fatty acids vesicles suspension in aqueous solution[J].Bulletin of the Korean Chemical Society, 2011, 32(1):59-64.
[30] 张翔宇, 王瑷琳, 刘祉妤, 等.鱼皮明胶-海藻酸钠相互作用及其规律[J].食品与发酵工业, 2022, 48(7):160-165.
ZHANG X Y, WANG A L, LIU Z Y, et al.Interaction and rule between sodium alginate and fish skin gelatin[J].Food and Fermentation Industries, 2022, 48(7):160-165.
[31] 徐明进, 李明远, 彭勃, 等.Zeta电位和界面膜强度对水包油乳状液稳定性影响[J].应用化学, 2007, 24(6):623-627.
XU M J, LI M Y, PENG B, et al.Effects of strength of interfacial film and zeta potential on oil-inwater emulsion stability[J].Chinese Journal of Applied Chemistry, 2007, 24(6):623-627.
[32] 刘芸杭. 南极磷虾油分级提取及南极磷虾油含量对乳液制备的影响 [D].大连:大连工业大学, 2021.
LIU Y H.Fractional extraction of Antarctic krill oil and the effect of Antarctic krill oil content on emulsion preparation [D].Dalian:Dalian Polytechnic University, 2021.
[33] WU T, MAO L C.Influences of hot air drying and microwave drying on nutritional and odorous properties of grass carp (Ctenopharyngodon idellus) fillets[J].Food Chemistry, 2008, 110(3):647-653.
[34] 汤丽霞, 沈恂.生物系统中脂质过氧化检测方法的评述[J].生物化学与生物物理进展, 1995, 22(2):108-112.
TANG L X, SHEN X.A review of the method in measuring lipid peroxidation in biological systems[J].Progress in Biochemistry and Biophysics, 1995, 22(2):108-112.
[35] 袁玥, 许兆滨, 杨宪时, 等.温度对南极磷虾粉贮藏性的影响[J].食品工业科技, 2015, 36(3):327-330.
YUAN Y, XU Z B, YANG X S, et al.Effect of temperature on the storage properties of Antarctic krill meal[J].Science and Technology of Food Industry, 2015, 36(3):327-330.
[36] 朱波, 蒋将, 李进伟, 等.三种不同脂肪酸组成的油脂乳化液的理化性质研究[J].食品工业科技, 2013, 34(14):103-107;112.
ZHU B, JIANG J, LI J W, et al.Physicochemical properties of three different oil in water emulsions[J].Science and Technology of Food Industry, 2013, 34(14):103-107;112.
[37] KIM Y J, KIM B K, LEE M H, et al.Improving curcumin retention in oil-in-water emulsions coated by chitosan and their disperse stability exposed to thermal treatments[J].Journal of Food Engineering, 2022, 319:110918.
[38] 姜卉. 大黄鱼卵分离蛋白乳液输送系统的构筑及吸收利用率的研究 [D].大连:大连工业大学, 2019.
JIANG H.Construction and bioaccessibility of Pseudosciaena crocea roe protein isolate emulsion delivery system [D].Dalian:Dalian Polytechnic University, 2019.