瓦尼桑黄(Sanghuangporus vaninii)的子实体是目前在中、日、韩等国销售和应用范围最广的桑黄产品[1]。Hispidin是桑黄中经典的酚类成分之一,分子式为C13H10O5[2],是Hypholomine B、Inoscavin A和Phelligridimer A等其他桑黄酚类化合物的前体[3]。Hispidin和Hypholomine B不仅具有良好的药理活性和较低的毒性,为高开发价值的天然产物和新的先导化合物[4-6],而且Hypholomine B在瓦尼桑黄子实体的指纹图谱中出峰稳定、峰面积较大和分离度好,也是评价瓦尼桑黄药材质量的参照之一[7]。
Hispidin可在桑黄中以苯丙氨酸和酪氨酸为底物进行合成,合成过程中有如苯丙氨酸解氨酶、酪氨酸解氨酶、肉桂酸-3-羟化酶、肉桂酸-4-羟化酶和4-香豆酸:辅酶A连接酶[苯丙氨酸解氨酶(phenylalanine ammonia lyase, PAL)、酪氨酸解氨酶(tyrosine ammonia lyase, TAL)、肉桂酸-3-羟化酶(cinnamate-3-hydroxylase, C3H)、肉桂酸-4-羟化酶(cinnamate-4-hydroxylase, C4H)、4-香豆酸:辅酶A连接酶(4-coumarate-CoA ligase, 4CL)]的参与[8]。乙烯利是一种植物生长调节剂,分子式为C2H6ClO3P,在植物中不仅能促进PAL、C4H和4CL等酶活力[9],而且可以增加酚类化合物的生成累积[10]。目前对瓦尼桑黄的发酵研究主要集中于优化培养基组成和发酵条件,以总酚、总多糖和总三萜为评价依据,但对特定化合物的讨论较少。此外,关于乙烯利对微生物中酚类化合物的影响也鲜见报道。
本研究旨在促进瓦尼桑黄合成Hispidin和Hypholomine B等酚类化合物,以提高瓦尼桑黄产品的药用价值、保健功能和市场竞争力。创新性地向液体培养基中添加能在植物中促进PAL、C4H和4CL等酶活力的乙烯利,对瓦尼桑黄进行液体发酵研究。以Hispidin和Hypholomine B的体外活性研究为依据[11-12],评价了其子实体提取物与发酵提取物对DPPH自由基清除能力、ABTS阳离子自由基清除能力和α-葡萄糖苷酶抑制能力。
1 材料与方法
1.1 材料与试剂
瓦尼桑黄子实体,森源生态科技公司;马铃薯葡萄糖琼脂培养基(PDA),海博生物公司;乙烯利、α-葡萄糖苷酶,源叶公司;葡萄糖,科密欧公司;酵母浸粉,奥博星生物公司;Hispidin、其他试剂,麦克林公司。
瓦尼桑黄菌株QJF-8,由三峡大学生物与制药学院刘呈雄副教授鉴定为瓦尼桑黄,保藏编号为CGMCC No.40120,于天然产物研究与利用湖北省重点实验室保藏。
1.2 发酵方法
1.2.1 液体发酵
母种菌种在PDA上培养2代后保存于5 ℃,取Φ=5 mm处在指数生长期的菌丝接种于新的PDA平板上,于28 ℃活化14 d后即得接种培养基。液体发酵的培养基组成为:葡萄糖(20.0 g/L)、酵母浸粉(5.0 g/L)、MgSO4(0.5 g/L)、(NH4)2SO4(0.2 g/L)、CaCl2(0.1 g/L)、KH2PO4(1.0 g/L)和维生素B1(0.01 g/L),于121 ℃高压蒸汽灭菌锅中灭菌20 min,灭菌后pH=5.5。
在装液量为25/50 mL的三角烧瓶中,接种2枚Φ=5 mm带有指数生长期菌丝的接种培养基块,于28 ℃、140 rpm的摇床中共发酵21 d,从第6天开始每3 d随机取样提取检测,以研究生物量累积(菌丝体干重)与Hispidin和Hypholomine B产生的关系,确定发酵时间。
1.2.2 添加乙烯利发酵
将乙烯利溶解于无菌水中,于紫外灯下放置40 min。用移液枪吹打均匀后,于发酵的第0天时加入,使其在培养基中的终浓度分别为0.2、0.4、2、10、20 mmol/L[13],并用1 mol/L的Na2CO3溶液调节pH至添加前水平,共发酵15 d,以研究不同乙烯利的终浓度对瓦尼桑黄合成Hispidin和Hypholomine B的影响。
在0、3、6、9、12 d时,向培养基中加入乙烯利,使其在培养基中的终浓度为2 mmol/L,并调节pH至添加前水平,共发酵15 d,以研究不同乙烯利的添加时间点对瓦尼桑黄合成Hispidin和Hypholomine B的影响。
1.3 发酵液和子实体的提取
1.3.1 发酵液的提取
向发酵后的三角烧瓶中加入适量乙醇,使乙醇终浓度为50%(体积分数)。用研磨器将菌丝体打散,于50 ℃下超声(功率360 W,频率 40 kHz)45 min后过滤。将菌丝体和滤液分别置于50 ℃下干燥,称取前者的菌丝体干重,即得生物量。向后者滤液加入适量甲醇后过滤,滤液于50 ℃下干燥,制得发酵提取物。
1.3.2 子实体的提取
取瓦尼桑黄子实体粉末,按料液比1∶100(g∶mL)加入50%乙醇溶液于50 ℃下超声45 min后过滤。将滤液置于50 ℃下干燥,向干燥的滤液中加入适量甲醇后过滤。后者滤液于50 ℃下干燥后,制得子实体提取物。
1.4 酚类化合物的检测
1.4.1 检测液的配制
取发酵提取物以色谱甲醇为溶剂溶解,制得检测液。将Hispidin对照品以色谱甲醇为溶剂配制成质量浓度为20、40、100、200、400 μg/mL的系列浓度。
在高效液相色谱(HPLC)系统中,以0.1%甲酸-水溶液为流动相A,以0.1%甲酸-乙腈溶液为流动相B,进行梯度洗脱:0~5 min,20% B;5~45 min,20%~40% B,于353 nm下比较出峰情况。结合超高效液相色谱-串联二级质谱辅助检测。
1.4.2 总酚含量的测定
将40 mg/mL溶剂为二甲基亚砜的各提取物母液,用水稀释为100 μg/mL的样品液。向25 mL的棕色容量瓶中,分别加入1 mL样品液以及质量浓度为25、50、100、150、200 μg/mL的没食子酸溶液。分别加入1 mL磷钼钨酸溶液和11 mL水后用290 g/L的Na2CO3溶液将所有容量瓶稀释至标线处,静置1 h,在760 nm处测定吸光度(OD)值。
1.5 体外活性实验
1.5.1 DPPH自由基清除率
10 mg的DPPH溶于100 mL无水乙醇后,于5 ℃下避光保存。用水将阳性对照L-抗坏血酸和各提取物母液配制成质量浓度为25、50、100、250、500 μg/mL的样品溶液,于5 ℃中避光保存。
以50 μL样品溶液和150 μL DPPH溶液为样品组;50 μL样品溶液和150 μL无水乙醇为样品空白组;50 μL水和150 μL DPPH溶液为对照组;50 μL水和150 μL无水乙醇为对照空白组,在37 ℃下避光反应20 min后,于517 nm下测定OD值。
DPPH自由基清除率计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
1.5.2 ABTS阳离子自由基清除率
用水配制7 mmol/L的ABTS和2.5 mmol/L的过硫酸钾混合溶液,避光反应12 h,用无水乙醇稀释20倍,于5 ℃中避光保存。用水将阳性对照L-抗坏血酸和各提取物母液配制成质量浓度为25、50、100、250、500 μg/mL的样品溶液,于5 ℃下避光保存。
以50 μL样品溶液和150 μL ABTS溶液为样品组;50 μL样品溶液和150 μL无水乙醇为样品空白组;50 μL水和150 μL ABTS溶液为对照组;50 μL水和150 μL无水乙醇为对照空白组,在37 ℃下避光反应20 min后,于734 nm下测定OD值。
ABTS阳离子自由基清除率计算如公式(2)所示:
ABTS阳离子自由基清除率/%=
(2)
1.5.3 α-葡萄糖苷酶抑制率
用pH=7.0的磷酸盐缓冲液(PBS)将阳性对照阿卡波糖和各提取物母液配制成质量浓度为25、50、100、250、500 μg/mL的样品溶液,于5 ℃下避光保存。
以50 μL样品溶液和50 μL α-葡萄糖苷酶溶液(酶活力为0.1 U)为样品组;50 μL样品溶液和50 μL PBS为样品空白组;50 μL PBS和50 μL酶溶液为对照组;100 μL PBS为对照空白组,于37 ℃下避光反应20 min后,皆加入50 μL 4-硝基苯-α-D-吡喃半乳糖苷溶液(5 mmol/L),继续在37 ℃下避光反应15 min。以100 μL的Na2CO3溶液(0.1 mol/L)停止反应,并在405 nm处测定OD值。
α-葡萄糖苷酶抑制率计算如公式(3)所示:
α-葡萄糖苷酶抑制率![]()
(3)
2 结果与分析
2.1 Hispidin和Hypholomine B的鉴定和检测
Hispidin(100 μg/mL)、液体发酵组和乙烯利发酵组的HPLC图谱如图1所示。结合UPLC-MS/MS分析,图1中峰1的保留时间为11.934 min,[M+H]+为247.061 2 m/z,高分辨质谱结果拟合的分子式为C13H10O5,UVmax(374 nm)和减质子计算的二级质谱的碎片离子(247.060 6)与文献中[M-H]-模式下的Hispidin信息一致[14-15],将该化合物鉴定为Hispidin。峰2的保留时间为22.941 min,[M+H]+为491.095 4 m/z,高分辨质谱结果拟合的分子式为C26H18O10,UVmax(379 nm)和减质子计算的二级质谱的碎片离子(405.094 2、337.072 9、285.044 9和243.054 3)与文献中[M-H]-模式下的Hypholomine B信息一致[14-15],将该化合物鉴定为Hypholomine B。Hispidin的峰面积与浓度标准曲线为:y=0.010 3x-1.221 6,R2=0.999 5。Hispidin和Hypholomine B的相对含量以HPLC图谱中的峰面积表示。
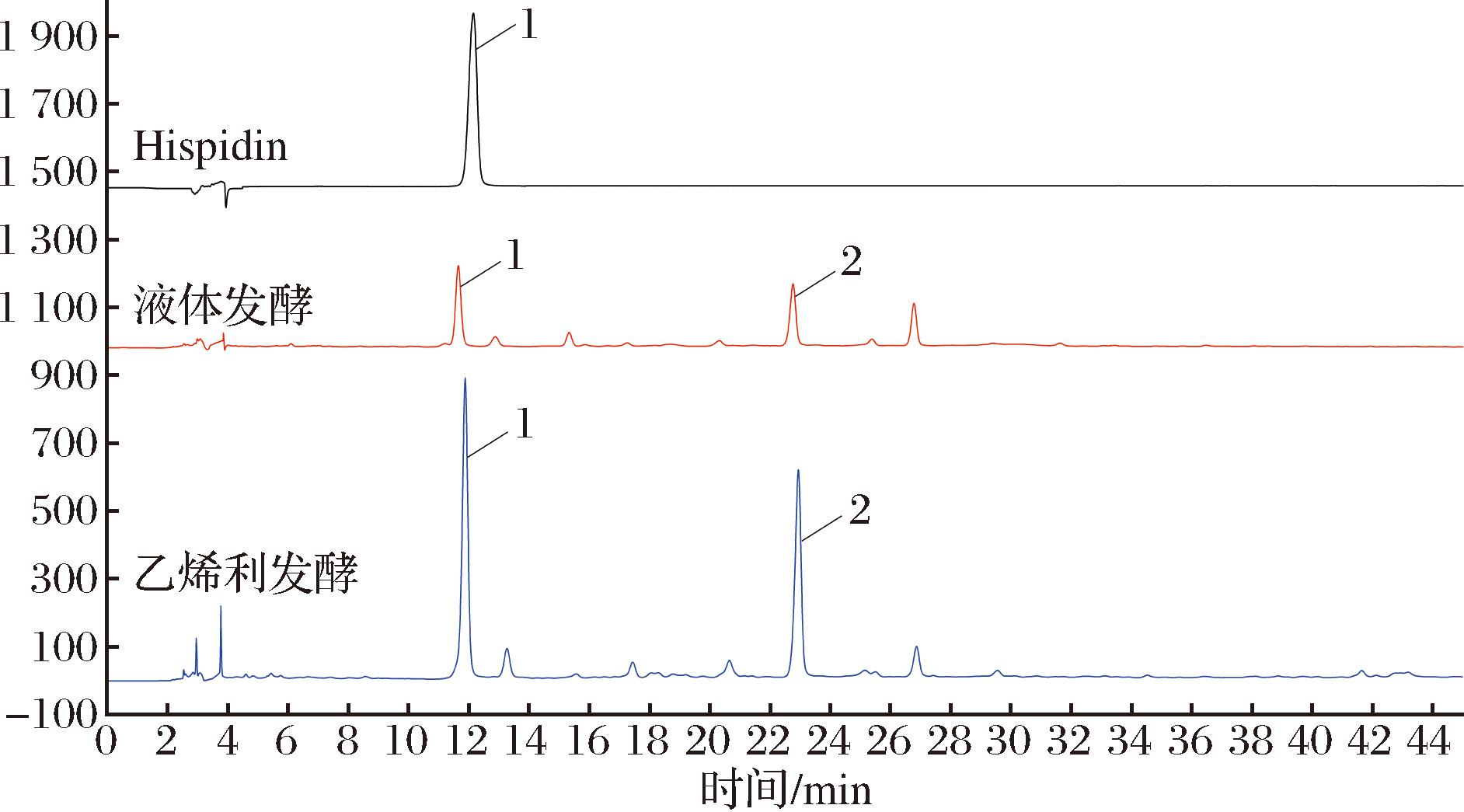
1-Hispidin;2-Hypholomine B
图1 Hispidin、液体发酵组和乙烯利发酵组的HPLC图
Fig.1 HPLC profiles of Hispidin, liquid fermentation group, and ethephon fermentation group
2.2 液体发酵
如图2所示,生物量在液体发酵过程中逐渐增加,可分为快速累积时期和次级代谢时期。在发酵的前12 d为快速累积时期,次级代谢时期的生物量累积缓慢,在此期间的生物量最高可在21 d时达到(141.62±9.42) mg。
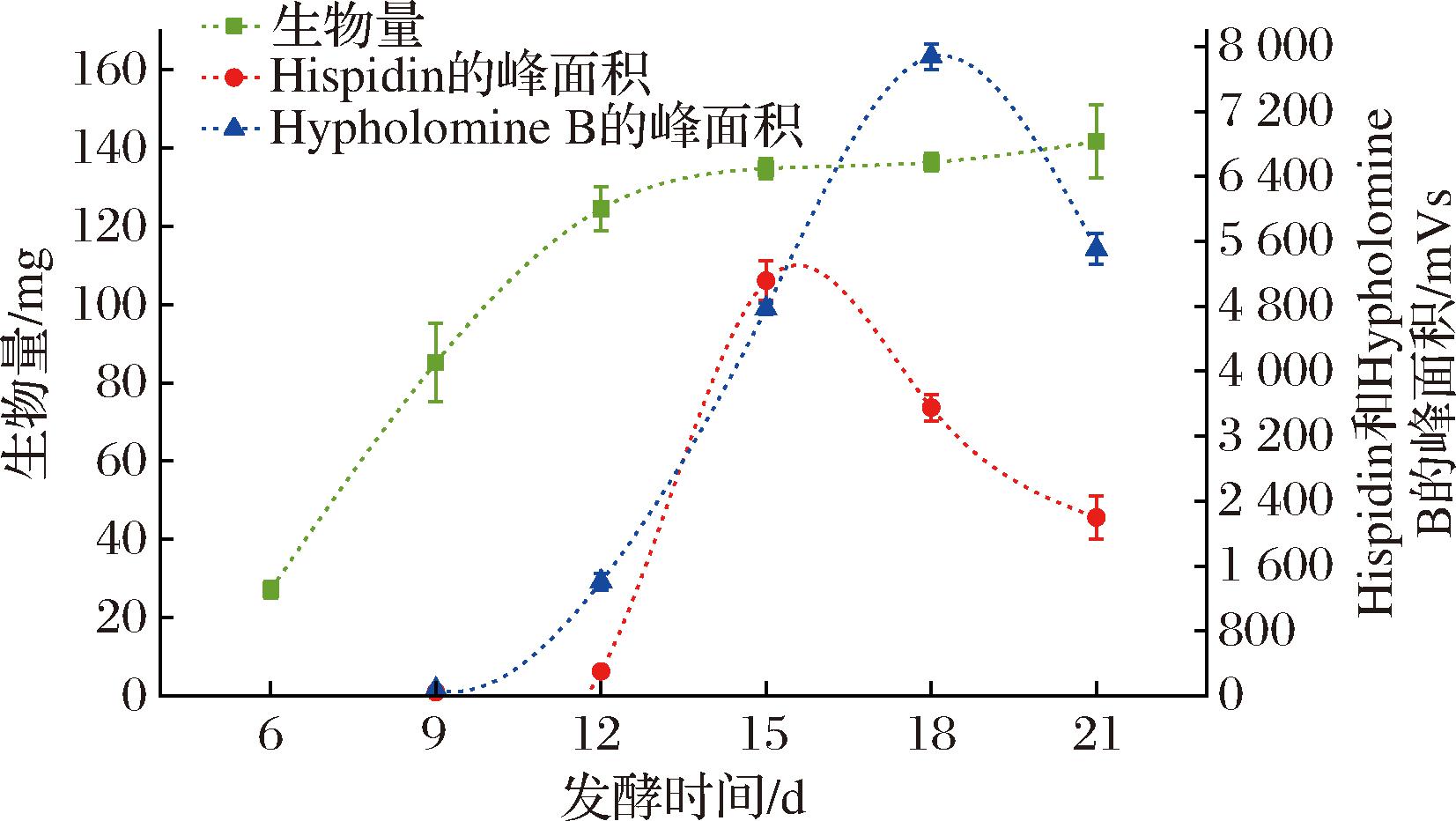
图2 发酵时间、生物量和Hispidin/Hypholomine B平均 相对含量的趋势
Fig.2 Trend of fermentation time, biomass, and average relative contents of Hispidin/Hypholomine B
Hispidin和Hypholomine B均于发酵9 d时被首次检测到。Hispidin的相对含量呈先增加后减少的趋势,于发酵15 d时达到最大,通过标准曲线计算后其平均含量为(7.64±0.29) μg/mg(Hispidin/生物量),Hypholomine B的相对含量也呈先增加后减少的趋势,其平均相对含量于发酵18 d时达到最大。
Hispidin和Hypholomine B的变化趋势表明,Hispidin开始合成于生物量快速累积时期,并在次级代谢时期大量合成后转向次级代谢而被消耗,以合成Hypholomine B等酚类化合物。在本研究中,于15 d结束发酵可检测到相对含量较大的Hispidin和Hypholomine B。
2.3 添加乙烯利发酵
2.3.1 乙烯利的终浓度
如图3所示,与液体发酵组相比,0.2 mmol/L组和0.4 mmol/L组的生物量累积上升(P<0.05)。2 mmol/L组和10 mmol/L组的生物量累积不变(P>0.05),而20 mmol/L组的生物量累积下降(P<0.05)。Hispidin和Hypholomine B的相对含量随乙烯利的终浓度增加呈先上升后下降的趋势,在2 mmol/L组中极显著增加(P<0.001),Hispidin和Hypholomine B的相对含量最高,Hispidin的平均含量是(18.79±1.14) μg/mg,为液体发酵组(6.27±0.32) μg/mg的3.00倍,Hypholomine B的平均相对含量为液体发酵组的2.55倍。在本研究中,乙烯利的最佳终浓度为2 mmol/L。
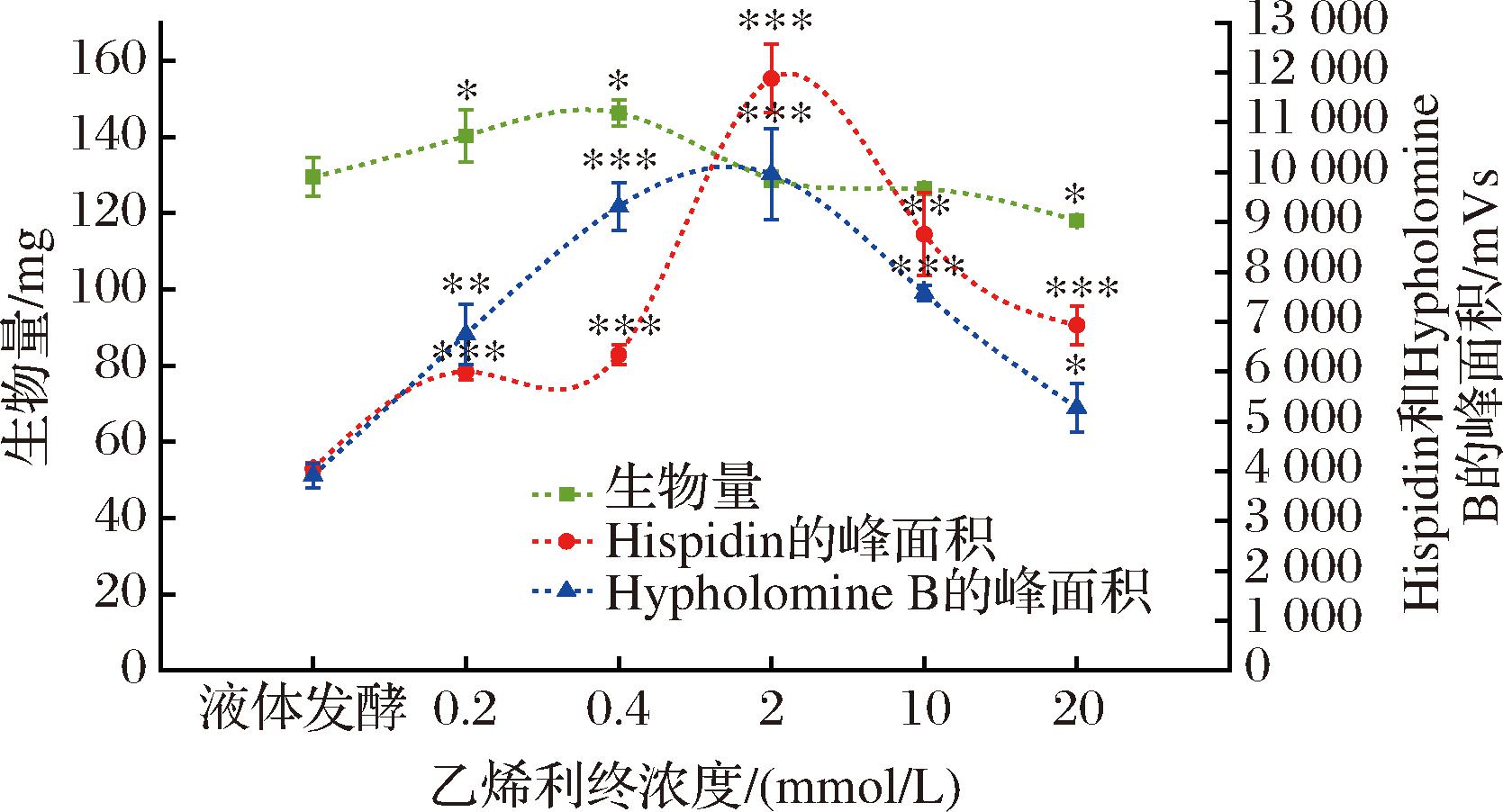
图3 乙烯利的终浓度、生物量和Hispidin/Hypholomine B 平均相对含量的趋势
Fig.3 Trend of ethephon final concentrations, biomass, and average relative contents of Hispidin/Hypholomine B
注:“*”为与液体发酵组相比P<0.05;“**”为与液体发酵组相比 P<0.01;“***”为与液体发酵组相比P<0.001(下同)。
2.3.2 乙烯利的添加时间点
如图4所示,与液体发酵组相比,各组的生物量累积不变(P>0.05)。Hispidin的相对含量在0 d组中极显著增加(P<0.001),相对含量最高,平均含量是(22.48±0.34) μg/mg,为液体发酵组(7.10±0.42) μg/mg的3.17倍。但在3 d组中骤减至(7.56±0.29) μg/mg,而后又随加入时间点的后移而增加。Hypholomine B的相对含量也在0 d组中极显著增加(P<0.001),相对含量最高,其平均相对含量为液体发酵组的2.35倍,变化趋势为随加入时间点的后移而下降。在本研究中,乙烯利的最佳添加时间点为0 d。
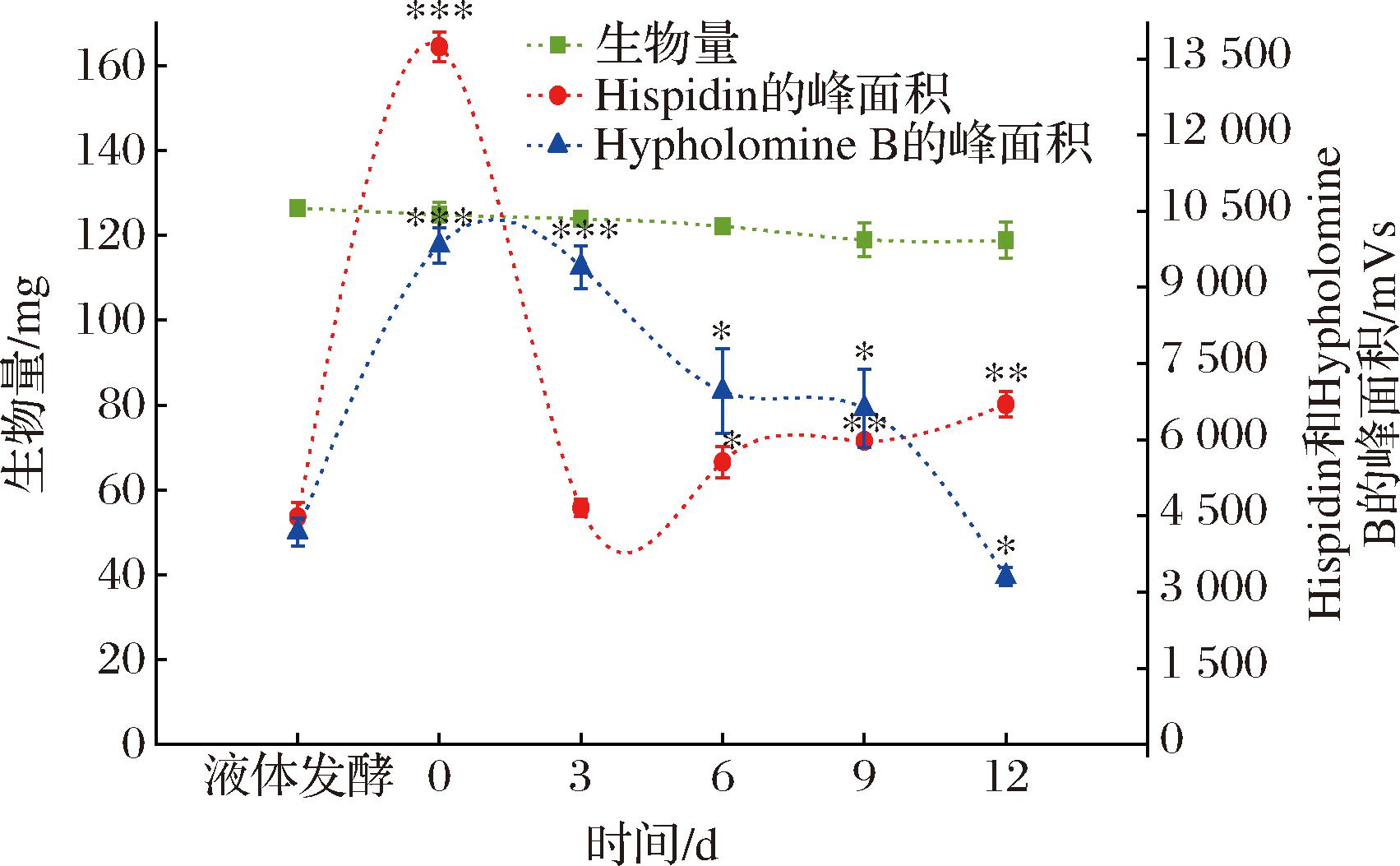
图4 乙烯利的添加时间点、生物量和Hispidin/Hypholomine B 平均相对含量的趋势
Fig.4 Trend of time points for ethephon addition, biomass, and average relative contents of Hispidin/Hypholomine B
2.4 酚类化合物的检测
2.4.1 总酚的含量测定
没食子酸的标准曲线为:y=21.863 0x-2.605 1,R2=0.998 9。乙烯利发酵组、液体发酵组和子实体组的提取物中总酚含量分别为:(3.76±0.11)%、(1.96±0.12)%和(0.77±0.04)%。
2.4.2 酚类化合物及其含量变化
乙烯利发酵组和液体发酵组的UPLC-MS/MS总离子流图如图5所示。酚类化合物根据拟合的分子式与文献对比确定[16],化合物的相对含量变化倍数关系根据总离子流图中乙烯利发酵组的峰面积/液体发酵组的峰面积确定。如表1所示,乙烯利不仅能促进瓦尼桑黄合成Hispidin和Hypholomine B,而且提高了其他酚类化合物的生成累积。
表1 酚类化合物及其相对含量变化
Table 1 Phenolic compounds and their relative content changes

峰编号分子式名称乙烯利发酵组的峰面积液体发酵组的峰面积相对含量变化1C17H16O108-hydroxyl-5-O-β-D-glucopyranosylpsoralen1 880 6891 836 4711.022C23H20O6甲基桑黄黄酮A20 978 4309 442 4752.223C15H12O6北美圣草素3 776 2725 859 6850.644C22H18O6桑黄黄酮A3 659 0094 365 8000.845C16H12O6山柰素5 391 3832 554 9112.116C16H14O6橙皮素7 730 1614 018 2861.927C22H16O9Phellibaumin D4 500 4091 322 8043.408C13H10O5Hispidin8 148 9151 959 7944.169C23H18O8Inonotusin B1 727 331718 7752.4010C25H20O9Interfungin A8 131 0354 748 8361.7111C27H22O11Baumin12 693 7884 514 3222.8112C26H18O10Hypholomine B1 515 0471 457 0441.0413C16H16O6Inonophenol C1 072 103653 8831.6414C16H14O5樱花亭2 211 1682 480 9240.8915C27H20O103,3′-methylene-bis[6-(3,4-dihydroxystyryl)-4-hydroxy-2H-pyran-2-one]1 551 288863 1311.8016C15H12O5柚皮素30 634 63620 511 8601.49
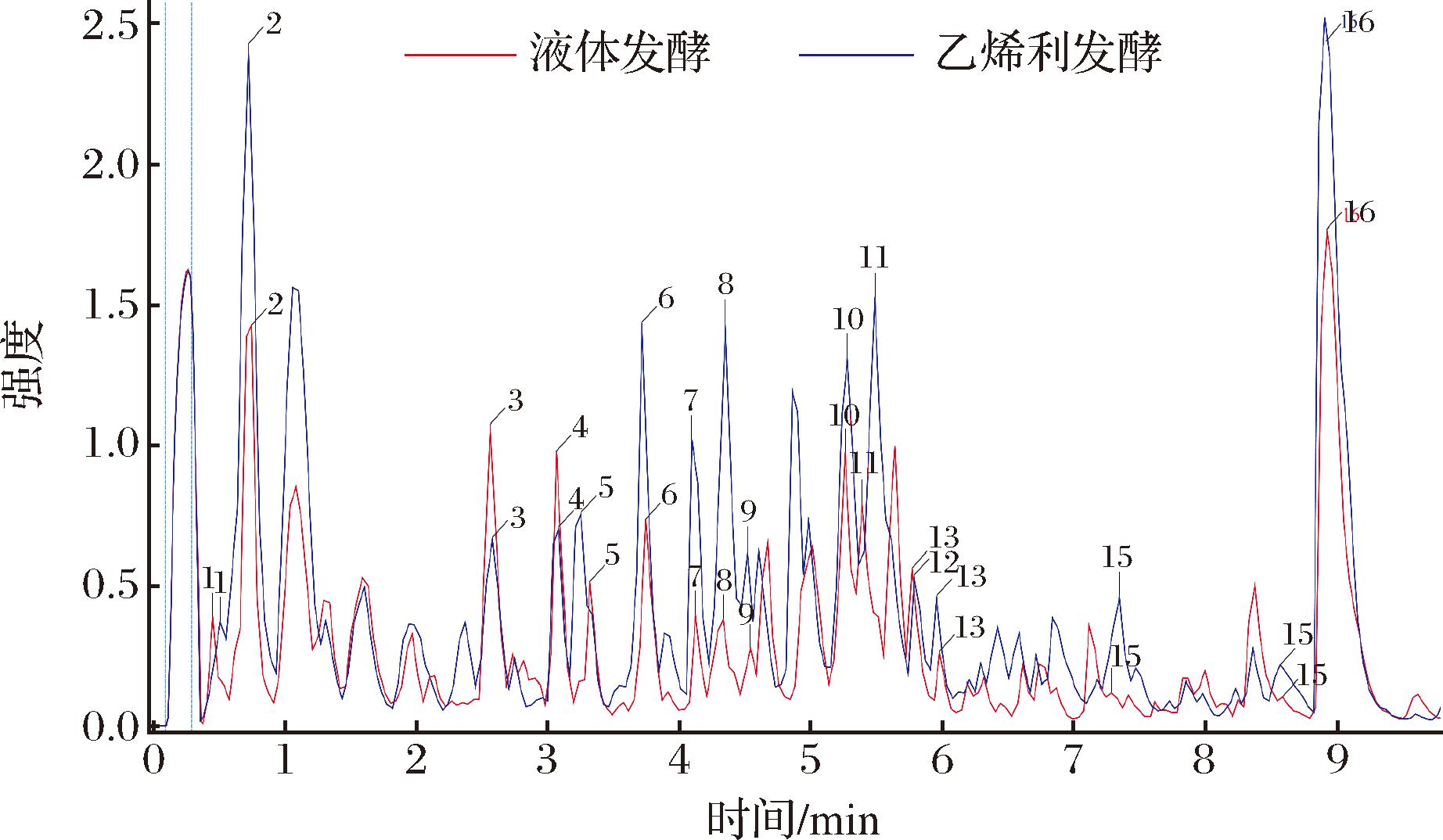
图5 液体发酵组和乙烯利发酵组的UPLC-MS/MS总离子流图
Fig.5 UPLC-MS ion chromatograms of liquid fermentation group and ethephon fermentation group
2.5 体外活性评价
2.5.1 DPPH自由基清除率
根据浓度与清除率的对数关系计算,L-抗坏血酸组、子实体组、液体发酵组和乙烯利发酵组的提取物对DPPH自由基清除率的半抑制浓度(IC50)分别为:78.08、218.10、170.61、150.00 μg/mL。
2.5.2 ABTS阳离子自由基清除率
根据浓度与清除率的对数关系计算,L-抗坏血酸组、子实体组、液体发酵组和乙烯利发酵组的提取物对ABTS阳离子自由基清除率的IC50分别为:38.19、130.51、115.36、106.46 μg/mL。
2.5.3 α-葡萄糖苷酶抑制率
根据浓度与抑制率的对数关系计算,子实体组、液体发酵组和乙烯利发酵组的提取物对α-葡萄糖苷酶抑制率的IC50分别为:56.83、35.48、16.08 μg/mL。阿卡波糖组在所有浓度下的抑制率均为100%。
3 结论
在液体培养基中添加乙烯利可以促进瓦尼桑黄合成Hispidin和Hypholomine B等酚类化合物,且不影响生物量。培养基中乙烯利的终浓度为2 mmol/L,添加时间点为0 d,添加后用1 mol/L的Na2CO3将pH调节至添加前水平,发酵15 d。该方法发酵的Hispidin平均含量按标准曲线计算后,分别为液体发酵组的3.00倍和3.17倍,Hypholomine B的平均相对含量按HPLC图谱的峰面积计算后,分别为液体发酵组的2.55倍和2.35倍。此外,乙烯利的添加还提高了其他酚类化合物的生成累积,乙烯利发酵组、液体发酵组和子实体组的提取物中总酚含量分别为:(3.76±0.11)%、(1.96±0.12)%和(0.77±0.04)%。
各提取物对DPPH自由基清除率、ABTS阳离子自由基清除率和α-葡萄糖苷酶抑制率的IC50由小到大排序均为:乙烯利发酵组、液体发酵组和子实体组。表明乙烯利发酵组的DPPH自由基清除能力、ABTS阳离子自由基清除能力和α-葡萄糖苷酶抑制能力皆优于液体发酵组和子实体组。
本研究提供了一种促进液体发酵的瓦尼桑黄合成Hispidin和Hypholomine B等酚类化合物的创新方法,不仅为提高瓦尼桑黄产品的药用价值、保健功能和市场竞争力提供了新的见解,而且为乙烯利在瓦尼桑黄发酵工业中的应用提供了理论依据。
[1] 吴声华, 黄冠中, 陈愉萍, 等.桑黄的分类及开发前景[J].菌物研究, 2016,14(4):187-200;185.
WU S H, HUANG G Z, CHEN Y P, et al.Taxonomy and development prospects of Sanghuang (Sanghuangporus sanghuang)[J].Journal of Fungal Research, 2016,14(4):187-200;185.
[2] EDWARDS R L, LEWIS D G, WILSON D V.983.Constituents of the higher fungi.Part I.Hispidin, a new 4-hydroxy-6-styryl-2-pyrone from polyporus hispidus(Bull.) Fr.[J].Journal of the Chemical Society (Resumed), 1961:4995.
[3] WANG Y, WANG S J, MO S Y, et al.Phelligridimer A, a highly oxygenated and unsaturated 26-membered macrocyclic metabolite with antioxidant activity from the fungus Phellinus igniarius[J].Organic Letters, 2005,7(21):4733-4736.
[4] LI T J, LIN T W, LU T Y, et al.Phellinus linteus mycelia extract in COVID-19 prevention and identification of its key metabolic compounds profiling using UPLC-QTOF-MS/MS spectrometry[J].Fitoterapia, 2023,171:105695.
[5] SERSEG T, BENAROUS K, YOUSFI M.Hispidin and lepidine E:Two natural compounds and folic acid as potential inhibitors of 2019-novel coronavirus main protease (2019-nCoVMpro), molecular docking and SAR study[J].Current Computer-Aided Drug Design, 2021,17(3): 469-479.
[6] HUO J, SUN Y X, ZHONG S Q, et al.Safety evaluation of aqueous extracts of Sanghuangporus vaninii fruiting body in Sprague-Dawley rats[J].Food Science &Nutrition, 2020,8(9):5107-5113.
[7] 钟石, 曹英龙, 王文琼, 等.人工栽培桑黄HPLC指纹图谱及主成分含量测定[J].浙江农业学报, 2023,35(3):658-665.
ZHONG S, CAO Y L, WANG W Q, et al.HPLC fingerprint of cultivated Sanghuangporus and content determination of main component[J].Acta Agriculturae Zhejiangensis, 2023,35(3):658-665.
[8] WANG Z X, FENG X L, LIU C W, et al.Diverse metabolites and pharmacological effects from the basidiomycetes Inonotus hispidus[J].Antibiotics (Basel), 2022,11(8):1097.
[9] YIN Y Q, LIU C, YANG Z F, et al.Ethephon promotes isoflavone accumulation in germinating soybeans by its acceleration of isoflavone biosynthetic pathway[J].Plant Physiology and Biochemistry, 2023,201:107805.
[10] ZHANG L H, LI S F, LIU X H, et al.Effects of ethephon on physicochemical and quality properties of kiwifruit during ripening[J].Postharvest Biology and Technology, 2012,65:69-75.
[11] PARK I H, CHUNG S K, LEE K B, et al.An antioxidant hispidin from the mycelial cultures of Phellinus linteus[J].Archives of Pharmacal Research, 2004,27(6):615-618.
[12] ZHENG M Y, WANG L, SUN Y Q, et al.Hypoglycemic effect of the Phellinus baumii extract with α-glucosidase-inhibited activity and its modulation to gut microbiota in diabetic patients[J].Biomedicine &Pharmacotherapy, 2023,158:114130.
[13] 刘金福, 李晓雁, 孟蕊.苦荞发芽过程中促进黄酮合成的因素初探[J].食品工业科技, 2006,27(10):106-108.
LIU J F, LI X Y, MENG R.Study on factors capable of stimulating synthesis of flavonoids in tartary buckwheat during germinating period[J].Science and Technology of Food Industry, 2006,27(10):106-108.
[14] ZHANG Y Y, LV G Y, SONG T T, et al.Recovery of the phenolic compounds from artificial cultivated Sanghuangporus vaninii using a green method and biological properties of phenolic extract in vitro[J].International Journal of Food Science &Technology, 2023,58(7):3969-3981.
[15] GORNOSTAI T G, BOROVSKII G G, KASHCHENKO N I, et al.Phenolic compounds of Inonotus rheades (Agaricomycetes) mycelium:RP-UPLC-DAD-ESI/MS profile and effect of light wavelength on styrylpyrone content[J].International Journal of Medicinal Mushrooms, 2018,20(7):637-645.
[16] 彭睿, 徐睿鹏, 辛芮, 等.桑黄中的酚类化合物研究进展[J].中草药, 2023,54(9):2978-2992.
PENG R, XU R P, XIN R P, et al.Research progress on phenol compounds in Sanghuang[J].Chinese Traditional and Herbal Drugs, 2023,54(9):2978-2992.